
 , 吕贝1, 孔玲1, 陈欣虹1, 朱素娟2
, 吕贝1, 孔玲1, 陈欣虹1, 朱素娟2
1 扬州大学 医学院 生物化学教研室,江苏 扬州 225001
2 扬州大学 生技学院 生物化学教研室,江苏 扬州 225009
网络出版时间:2016-01-06
基金项目:国家自然科学基金 (Nos. 81100862, 8167050872, 2015CXJ070) 资助。
摘要: 构建人NOVA1基因的真核表达载体pCMV-Myc-NOVA1,转染PC12细胞后筛选最佳转染条件,进而结合细胞免疫组织化学研究NOVA1蛋白在PC12细胞中的表达分布,并探究其抗低氧活性。根据NCBI数据库NOVA1基因序列设计上下游引物,以pCR4-TOPO-NOVA1载体为模板采用聚合酶链式反应扩增获得NOVA1基因的全长cDNA编码序列,限制性内切酶SalⅠ和XhoⅠ双酶切后插入pCMV-Myc真核表达载体,酶切及直接测序验证后采用脂质体转染法转染入PC12细胞,针对转染比例和转染时间进行优化,进而采用实时定量PCR和Western blotting检测NOVA1蛋白的表达,最后采用细胞免疫组织化学检测NOVA1蛋白在PC12细胞中的表达定位及其抗低氧活性。通过酶切和直接测序验证,成功构建了真核表达载体pCMV-Myc-NOVA1;质粒和Lipo2000最佳转染比例为1:2.5,最佳转染时间为72 h;最佳转染条件下NOVA1基因和蛋白的表达水平显著增加,转染pCMV-Myc-NOVA1质粒后,NOVA1蛋白主要分布于细胞核和细胞质;过表达NOVA1的PC12细胞增殖活性明显增加。本文采用分子克隆的方法成功构建了NOVA1基因的真核表达载体,通过条件优化实现了高效表达并测定过表达NOVA1蛋白具有明显的抗低氧活性,不仅为深入揭示NOVA1蛋白的作用机理提供了重要参考,而且为NOVA1蛋白潜在的药物开发提供了重要技术支撑。
关键词: 人源NOVA1蛋白 真核表达载体 转染 分布 抗低氧
Eukaryotic expression of human NOVA1 protein and identification of its anti-hypoxia activity
Li Hualing1

 , Lü Bei1, Kong Ling1, Chen Xinhong1, Zhu Sujuan2
, Lü Bei1, Kong Ling1, Chen Xinhong1, Zhu Sujuan2
1 Department of Biochemistry, Medical College of Yangzhou University, Yangzhou 225001, Jiangsu, China;
2 Department of Biochemistry, Life Science College of Yangzhou University, Yangzhou 225009, Jiangsu, China
Received: July 28, 2015; Accepted: October 22, 2015
Supported by:National Natural Science Foundation of China (Nos. 81100862, 8167050872, 2015CXJ070).
Corresponding authors:E-mail: hlli@yzu.edu.cn
Sujuan Zhu. Tel: +86-514-87979022
Abstract: The aim of this study was to construct the eukaryotic expression vector of pCMV-Myc-NOVA1 based on NOVA1 gene, and to screen the optimum expression condition after transfecting to PC12 cells, and further to explore the distribution of NOVA1 protein in PC12 cells using cell immunohistochemistry, and to identifyits anti-hypoxia activity. According to the NOVA1 gene sequence of NCBI database, we designed the upstream and downstream primers, and performed polymerase chain reaction (PCR) to amplify the full length cDNA coding sequence using pCR4-TOPO-NOVA1 as a template. The products were digested by restriction endonuclease SalⅠand XhoⅠ, and conjugated to the eukaryotic expression vector ofpCMV-Myc followed by validating by digestion and direct sequencing. Subsequently, the validated pCMV-Myc-NOVA1 was transfected to PC12 cells followed by optimizing of transfection ratio and transfection time, and identified by qPCR, Western blotting and cell immunohistochemistry respectively. After validation by digestion and direct sequencing, the eukaryotic expression vector of pCMV-Myc-NOVA1 was correctly constructed. The optimum transfection ratio of plasmid to Lipo 2000 was 1:2.5, and the optimum transfection time was 72 h. At the optimum transfection condition, the expression level of NOVA1 mRNA and protein significantly increased, and after transfection of pCMV-Myc-NOVA1, NOVA1 protein mainly distributed in cell nucleus and cytoplasm. After 6 h hypoxia, the cell proliferation activity was significantly increased compared to that of the control and pCMV-Myc group. Our findings provided a reference for exploring the mechanism of NOVA1, and also a technical support for potential drug development of NOVA1.
Key words: human NOVA1 protein eukaryotic expression vector transfection distribution anti-hypoxia
NOVA蛋白家族是一类仅表达于中枢神经系统的RNA结合蛋白[1-2],作为神经副肿瘤性眼阵挛共济失调症 (Paraneoplastic opsoclonus myoclonus ataxia,POMA) 的抗原而被最早发现,是第一个被确认的哺乳动物神经特异性的剪接因子[3-4]。NOVA蛋白是序列特异性的RNA结合蛋白,通过其KH结构域与靶基因mRNA前体中的YCAY基序结合,调控可变剪接过 程[5-6]。目前已发现的NOVA家族成员主要包括NOVA1和NOVA2,NOVA1蛋白主要定位于间脑、脑干、脊髓腹侧的运动神经元,NOVA2蛋白主要定位于大脑皮质、海马和脊髓背侧神经元[7]。
NOVA1蛋白于1993年被Darnell等发现,因其与hnRNP K、MER1等蛋白均有KH结构域,故而最初就被推测具有调控可变剪接的作用,且NOVA1在进化上非常保守,人类、大鼠、小鼠的NOVA1氨基酸序列的同源性达99%,如此强的保守性表明NOVA1功能的重要性[8]。如今,通过生物化学、交联与免疫共沉淀、微阵芯片及生物信息学分析,证明NOVA调控神经元转录产物的可变剪接,而且神经元转录产物编码与神经的刺激及抑制有关的突触蛋白,这表明NOVA作为一种调控蛋白,它处于复杂的等级体系网络的顶端[9]。目前通过多种技术方法的综合运用,对NOVA靶基因的研究取得很大的进展,同时也对NOVA的功能有了更深刻的认识,但是NOVA与其他疾病的关系涉及较少,因此进一步研究NOVA与疾病的相关性变得尤为迫切。基于此,我们采用PCR扩增获得了NOVA1基因的cDNA编码序列,通过分子克隆技术成功构建了真核表达载体pCMV-Myc-NOVA1,通过转染条件优化获得了高效表达NOVA1蛋白的细胞株,且发现NOVA1蛋白主要表达于细胞质和细胞核,并具有明显的抗低氧活性,为进一步研究NOVA1对神经细胞的调控,特别是低氧条件下的调控奠定了重要基础。
1 材料与方法1.1 材料pCR4-TOPO-NOVA1和pCMV-Myc载体均购自湖南长沙赢润生物技术公司;大肠杆菌DH5α感受态细胞和cDNA反转录试剂盒购自天根生化科技有限公司;PC12细胞由南京师范大学郭志刚教授惠赠;质粒小提试剂盒购自美国Qiagen公司;凝胶回收试剂盒购自日本OMEGA公司;限制性核酸内切酶SalⅠ和XhoⅠ、T4 DNA连接酶、DL 2000 DNA marker均购自TaKaRa公司;阳离子脂质体Lipofectamine-2000购自美国Invitrogen公司;RNAiso Plus试剂和SYBR? Premix Ex TaqTM染料法荧光定量试剂盒购自TaKaRa公司;兔抗大鼠NOVA1多克隆抗体购自美国Sigma公司;多聚赖氨酸、SABC免疫组化染色试剂盒、DAB显色试剂盒、辣根酶标记山羊抗兔IgG均购自北京中杉金桥生物技术有限公司。
1.2 方法1.2.1 引物设计根据GenBank数据库NOVA1 (NM_002515.2) 基因全长编码序列,利用Primer Premer 5.0软件进行引物对设计 (表 1),引物序列由北京英骏公司合成,-20 ℃冰箱保存备用。
表1 NOVA1 基因编码区扩增引物序列Table1 Primers sequence for NOVA1 geneencoding region amplication
| Primer name | Primer sequence (5'–3') | ||
| NOVA1 | Forward | TACGTCGACTATGATGGCG | |
| GCAGCTCCC | |||
| Reverse | TCCCTCGAGTCAACCCACT | ||
| TTCTGAGG | |||
| The underline indicates the SalⅠ and XhoⅠ site. | |||
表选项
1.2.2 NOVA1基因PCR扩增以pCR4-TOPO-NOVA1载体为模板,按照如下加样量进行加样:2 μL 10×PCR 缓冲液; 2 μL dNTPs;2 μL DNA;各1 μL上下游引物;0.3 μL Ex Taq,ddH2O定容至20 μL,样品混匀后按照如下PCR程序进行扩增:94 ℃ 5 min;94 ℃ 45 s,56 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR扩增产物采用1%琼脂糖凝胶电泳分离,按照凝胶回收试剂盒所述步骤进行纯化回收,回收产物-20 ℃冰箱保存备用。
1.2.3 pCMV-Myc-NOVA1真核表达载体的构建及鉴定将上述回收的PCR扩增产物和pCMV-Myc载体采用限制性内切酶SalⅠ和XhoⅠ于37 ℃水浴锅酶切2 h,1%琼脂糖凝胶电泳分离后按照凝胶回收试剂盒所述步骤进行纯化回收,回收产物采用T4 DNA连接酶于16 ℃连接过夜。次日,全部转化入大肠杆菌DH5α感受态细胞,涂布棒涂板后37 ℃恒温箱孵育过夜待长出克隆。挑取单克隆摇菌并提取质粒后进行限制性内切酶SalⅠ和XhoⅠ双酶切,阳性克隆放大培养后直接送英骏公司测序。
1.2.4 PC12细胞培养及转染将液氮中冻存的PC12细胞复苏,采用含100 mL/L马血清、50 mL/L胎牛血清的DMEM培养液稀释后,于37 ℃、5% CO2培养箱培养至对数生长期,消化后按照3×105细胞/孔的比例加入六孔,37 ℃、5% CO2培养箱培养过夜,使细胞融合度达80%?90%。按照Lipofectamine-2000说明书所述步骤,将空载体pCMV-Myc和pCMV-Myc-NOVA1转染入PC12细胞,设置为转染组作为空白对照,并于转染后24 h、48 h、72 h和96 h收集细胞进行总RNA和总蛋白提取。
同时,为了获得质粒与脂质体的最佳转染比例,针对pCMV-Myc-NOVA1质粒和脂质体设置3个比例,分别为1∶2、1∶2.5和1∶3,于转染后的72 h收集细胞进行总RNA和总蛋白提取。
1.2.5 细胞总RNA提取及反转录将上述收集的PC12细胞采用PBS洗两遍,加入500 μL RNAiso Plus试剂,反复吹打裂解细胞,然后将裂解液移入离心管;室温静置5 min,4 ℃、12 000×g离心10 min;吸取上清注入一新的离心管;每个离心管加入100 μL氯仿,剧烈振荡15 s,然后静置3 min使其分层;4℃、12 000×g离心15 min,小心吸取上层水相至一新的离心管,注意不要吸到中间白色蛋白层;每管加入250 μL异丙醇,颠倒混匀,-20 ℃放置1?2 h;4 ℃条件下离心 (12 000×g,20 min),吸弃上清;每管加1 mL 75%乙醇 (用DEPC水配制),盖紧盖子,将沉淀弹起,4 ℃、7 500×g离心5 min,离心后吸弃上清;再同样轻速离心一次,吸弃上清,静置5?10 min,使残余液体挥发,注意不能时间过长或加热;每管加入 20 μL DEPC水,使用紫外分光光度仪测定RNA纯度和浓度;RNA合格后用作反转录模板,按照FastQuant cDNA第一链合成试剂盒说明书所述步骤进行反转录,反转录体系为:2 μL 10×Fast RT缓冲液;1 μL RT 酶混合液;2 μL引物混合液,ddH2O定容至10 μL,反转录程序为:42 ℃ 15 min→95 ℃ 3 min。
1.2.6 实时定量PCR检测根据GenBank数据库NOVA1 (Accession No. NM 002515.2)和GAPDH (Accesion No. NM 017008.4)基因序列,利用Primer Premer 5.0软件软件进行引物对设计 (表 1)。应用ABI 7500荧光定量PCR仪进行荧光定量分析,参照SYBR? Premix Ex TaqTM说明书提供的反应体系及条件进行实时定量PCR检测,反应体系为:12.5 μL SYBR? Premix Ex TaqTM;0.5 μL PCR 正向引物 (10 μmol/L);0.5 μL PCR 反向引物 (10 μmol/L);0.5 μL ROX Reference DyeⅡ (50×);2 μL cDNA,ddH2O定容至25 μL,PCR反应程序为:95 ℃ 30 s→95 ℃ 5 s;60 ℃ 30 s;40个循环。实验结束后针对Ct值采用2-△△Ct公式进行相对定量。
1.2.7 细胞总蛋白提取将上述收集的PC12细胞采用PBS洗两遍,加入适量的细胞裂解液,然后放在冰上裂解 30 min;采用细胞刮将细胞碎片刮至一边,并转移至一预冷的EP管,12 000×g离心15 min;将上清转移至另一EP管,采用BCA蛋白定量检测试剂盒进行定量检测。
1.2.8 免疫印记检测将上述定量的35 μg总蛋白采用12%的SDS- PAGE进行分离,电泳结束后按照说明书所述步骤转印到PVDF膜;转膜结束后,将PVDF膜正面朝上放入5%脱脂牛奶封闭液,摇床上封闭至少30 min;封闭结束后,将PVDF膜正面朝上放入一抗工作液,包括兔抗大鼠NOVA1多克隆抗体 (1∶500稀释) 和小鼠抗大鼠GAPDH单克隆抗体 (1∶2 000稀释),4 ℃冰箱孵育过夜。次日,采用TBST室温漂洗膜3次 (10 min/次);采用辣根酶标记山羊抗兔IgG (1∶5 000稀释) 和山羊抗鼠IgG (1∶5 000稀释) 室温孵育45 min,TBST洗3次 (10 min/次),采用ECL化学发光液进行蛋白条带显影,采集图片后利用Image J软件进行积分光密度分析,以目的条带和内参条带的积分光密度比值作为蛋白强度指标。
1.2.9 免疫组化按照2×105/mL的接种密度将PC12细胞悬液滴在六孔板中多聚赖氨酸包被的盖玻片上,细胞培养箱培养15?30 min,再加入适量培养基继续培养过夜。然后将六孔板置于冰上,吸弃培养液,PBS洗5 min×3次,吸弃残留PBS,空气干燥,当细胞表面微潮湿时加入4%多聚甲醛,固定30 min;固定结束后,吸弃4%多聚甲醛,ddH2O洗5 min×1次,PBS洗5 min×1次;加入3% H2O2 (现用现配),室温孵育30 min以灭活内源性过氧化氢酶,然后PBS洗5 min×3次;加入0.3% TritonX-100,通透细胞30 min,然后PBS洗5 min×3次;5% BSA室温封闭20 min,然后倾去,勿洗;将玻片用镊子小心取出,放在湿盒内,滴加兔抗大鼠Nova1多克隆抗体 (1∶100稀释),4 ℃孵育过夜;将湿盒取出,室温平衡60 min,PBS洗5 min×3次;滴加生物素化山羊抗兔IgG,37 ℃孵育20 min,PBS洗5 min×3次;滴加SABC试剂,37 ℃孵育20 min,PBS洗5 min×4次;DAB室温显色,ddH2O洗2?3次终止显色;依次在75%、85%、95%、100%酒精中脱水,最后经二甲苯透明;中性树胶封片,光学显微镜下观察拍照,采用Image Pro Plus软件进行统计分析。
1.2.10 PC12细胞缺氧模型的建立PC12细胞消化后,按照1×104细胞/孔的比例接种于96孔板,置于37 ℃,5% CO2细胞培养箱中培养24 h;将细胞放入缺氧小室中,通入95% N2,5% CO2混合气体1?2 min后关紧出气口,继续通4 min后关紧进气口;缺氧小室移入37 ℃、5% CO2细胞培养箱,分别缺氧0 h、2 h、4 h、6 h和8 h。收集细胞后采用MTT检测细胞增殖活性。
1.2.11 MTT检测向上述处理后单细胞加入MTT溶液(5 mg/mL),20 μL/孔,继续孵育4 h,终止培养,吸弃上清。每孔加入150 μL DMSO振荡5 min,使结晶充分溶解。选择490 nm波长,酶联免疫检测仪测定各孔OD值 (空白对照为不加细胞只加培养液,空白孔调零)。记录结果:试验结果以细胞存活率表示,细胞存活率= (试验组光吸收值/对照组光吸收值) ×100%。
1.2.12 统计学处理实验结果以均数±标准差 (x±s) 表示,用SPSS 19.0 for windows统计软件进行分析,两样本釆用t检验,釆用One way-ANOVA test进行方差分析,P<0.05为差异有显著性,即有统计学意义。
2 结果与分析2.1 pCMV-Myc-NOVA1真核表达载体的构建及鉴定设计的引物序列如表 1所示。如图 1A所示,可见1 500 bp有特异的核酸条带,与预期NOVA1基因的编码序列大小一致;双酶切后pCMV-Myc载体和NOVA1基因均出现了特异性条带,条带大小分别为3 800 bp和1 500 bp,与预期基本一致 (图 1B);构建完成的质粒经双酶切后出现了明显的两条带,条带大小分别为 1 500 bp和3 800 bp (图 1C),说明目的基因NOVA1正确插入载体。
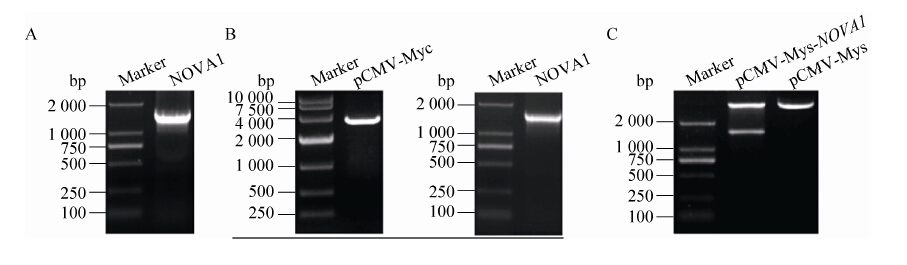 |
| 图1 pCMV-Myc-NOVA1 真核表达载体的构建及鉴定 Figure1 Construction and identification of eukaryotic expression vector pCMV-Myc-NOVA1. |
| 图选项 |
2.2 pCMV-Myc-NOVA1质粒的最佳转染时间设计合成的定量PCR扩增引物如下表 2所示。如图 2A所示,与pCMV-Myc-NOVA1质粒转染24 h相比,转染48 h、72 h和96 h NOVA1 mRNA表达水品显著增加,转染48 h到达峰值 (**P<0.01);随着转染时间的增加,NOVA1蛋白的表达水平明显增加,转染72 h到达峰值 (图 2B,**P<0.01)。
表2 实时定量PCR鉴定引物序列Table2 Primers sequence of qRT-PCR identification
| Primer name | Primer sequence (5'-3') | ||
| NOVA1 | Forward | GGTCTCAGCCAAGCAGCAGCAA | |
| Reverse | TTGCAGCAGTAGCAGCAGCCAG | ||
| GAPDH | Forward | TGGATCTGACATGCCGCCTGGA | |
| Reverse | AGGTCCACCACCCTGTTGCTGT | ||
表选项
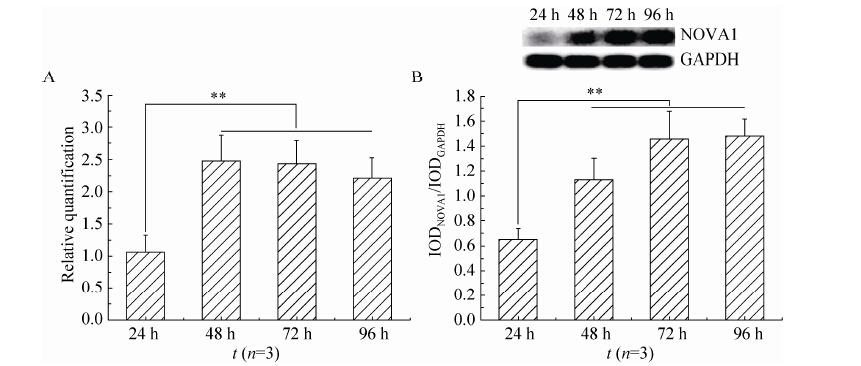 |
| 图2 实时定量PCR 和Western blotting 检测不同转染时间NOVA1 mRNA 和蛋白的表达变化 Figure2 qPCR and Western blotting assay of the change of NOVA1 mRNA and protein at different transfection time. |
| 图选项 |
2.3 pCMV-Myc-NOVA1质粒与Lipofecamine 2000最佳转染比例如图 3A所示,随着pCMV-Myc-NOVA1质粒与Lipofecamine 2000转染比例的降低,NOVA1 mRNA的表达水平先增加后降低,二者的比例为1∶2.5时,NOVA1 mRNA的表达水平最高,且存在显著性差异 (**P<0.01,与1∶2相比)。同样地,NOVA1蛋白的表达水平随着二者转染比例的降低而增加,1∶2.5时达到最大值,且存在显著性差异 (**P<0.01,与1∶2相比)。
 |
| 图3 实时定量PCR 和Western blotting 检测不同转染比例NOVA1 mRNA 和蛋白的表达变化 Figure3 qPCR and Western blotting assay of the change of NOVA1 mRNA and protein at different transfection ratio. |
| 图选项 |
2.4 NOVA1 mRNA和蛋白的表达水平显著增加根据上述优化的最佳转染时间 (72 h) 和最佳转染比例 (1∶2.5),采用实时定量PCR和Western blotting分别检测了NOVA1 mRNA和蛋白的表达变化。实时定量PCR结果显示,与Control和pCMV-Myc组相比,转染pCMV-Myc-NOVA1质粒组NOVA1 mRNA的表达水平明显增加,且存在显著性差异 (图 4A,**P<0.01)。同样地,转染pCMV-Myc-NOVA1质粒后,NOVA1蛋白表达水平也明显增加,二者存在显著性差异 (图 4B,**P<0.01)。
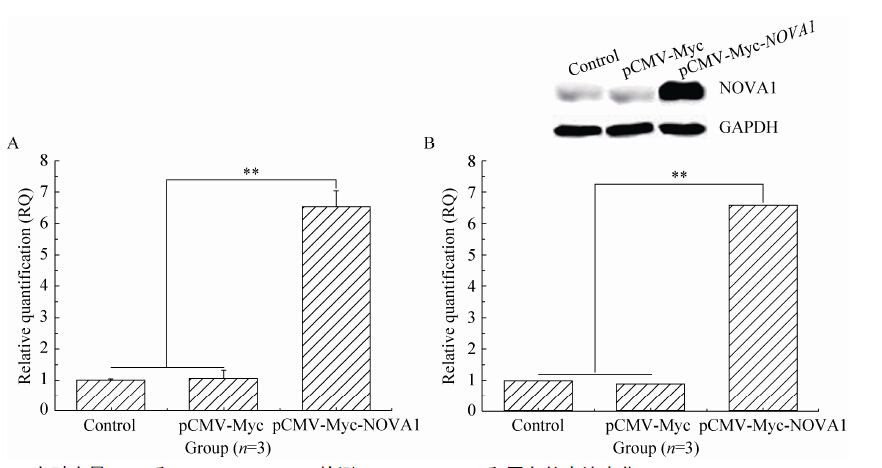 |
| 图4 实时定量PCR 和Western blotting 检测NOVA1 mRNA 和蛋白的表达变化 Figure4 qPCR and Western blotting assay of the change of NOVA1 mRNA and protein. |
| 图选项 |
2.5 转染pCMV-Myc-NOVA1质粒后NOVA1蛋白高效表达于细胞质和细胞核如图 5所示,Control和pCMV-Myc组,NOVA1蛋白主要表达分布于细胞核,且表达水平较低。转染pCMV-Myc-NOVA1组,NOVA1蛋白主要表达分布于细胞核和细胞质,且表达水平显著增加。
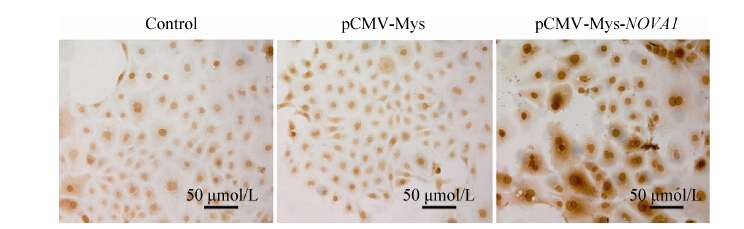 |
| 图5 细胞免疫组化检测NOVA1 蛋白亚细胞定位 Figure5 Cell immunohistochemistry detection subcellular localization of NOVA1 protein. |
| 图选项 |
2.6 过表达NOVA1蛋白可显著增加PC12细胞的增殖活性如图 6所示,与Control和pCMV-Myc组相比,转染pCMV-Myc-NOVA1质粒的PC12细胞增殖活性随着时间的延长明显增加,二者相比具有显著性差异 (*P<0.05;**P<0.01).
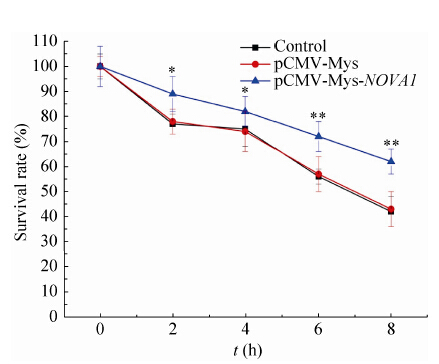 |
| 图6 MTT 检测细胞增值活性 Figure6 Cell proliferation activity assay by MTT (n=3). |
| 图选项 |
3 讨论在真核生物中,生物体需要很多不同的蛋白质以保证生命活动的进行,从有限的基因产生多种多样的蛋白质的一种关键机制是pre-mRNA的可变剪接,至少75%的蛋白质是经可变剪接产生的,不论是普遍表达还是组织特异性的RNA结合蛋白,可变剪接过程对其都是非常重要的,尤其是像大脑这样复杂的系统。许多研究发现在脑中确实存在着最大量的组织特异性剪接现象,如NOVA蛋白家族参与的可变剪接等[8]。
NOVA家族是一类特异性表达于脑组织的剪接因子,包括NOVA1和NOVA2两个成员,其中,NOVA1于1993年被Darnell等发现,时隔5年,他们通过抗血清试验再次发现家族另一成员——NOVA2[7]。在大鼠脑中,NOVA1的表达几乎遍布整个脑区,有试验表明NOVA1对于运动神经元的发展与存活是至关重要的[10]。实验室前期研究表明NOVA1可能调节神经元的应激反应,且NOVA1与脑血管疾病的治疗过程中常发生的脑缺血再灌注损伤后的修复作用之间可能存在一定关系[11],因此,为了深入揭示NOVA1的神经细胞保护功能,我们构建了其真核表达载体并实现了高效表达,以期为其新功能的开发提供重要技术参考。
基因重组及质粒转染是一种研究特定基因的有效的分子生物学技术,通过质粒转染、过表达及免疫荧光成像等技术,在研究基因表达、蛋白质在细胞内定位和信号转导等方面起着重要的作用[12-13]。因此,我们选取了能携带目的基因靶向性高效表达,并且容易操作的真核表达载体pCMV-Myc作为NOVA1基因的载体。基因转染的方法包括病毒转染法及非病毒转染法。其中,病毒转染法风险大,且病毒的免疫原性高、容量小、制备困难、成本较高[14-15]。脂质体转染是目前细胞转染最为普遍的方法之一。虽然脂质体的转染效率低于病毒载体,但它安全性较高、能够多次转染且操作简单、无免疫原性、不仅能感染分裂中的细胞,还能感染不分裂细胞、能携带不同大小的外源基因。因此,脂质体有望成为基因治疗中的基因转染载体[16-17]。脂质体介导基因转染的效率与细胞的状态、脂质体的结构、质粒的浓度、DNA和脂质体的比例及转染时间以及靶细胞的选择性作用有关[18]。大鼠肾上腺嗜铬瘤细胞 (PC12细胞) 是由大鼠肾上腺嗜铬细胞瘤分离并建立的细胞系[19-20],它具有神经细胞的特性,可稳定传代,因而很多研究人员将其作为体外研究神经系统疾病的理想细胞模型。因此,本研究将构建并验证成功的重组质粒pCMV-Myc-NOVA1,利用脂质体转染法转染入PC12细胞,采用实时定量PCR和Western blotting检测其表达效果,筛选最佳作用时间和最佳转染比例,进而确定其细胞表达分布。
通过研究发现,NOVA1 mRNA和蛋白的表达水平明显增加,且最佳转染时间为转染后 72 h,最佳转染比例为1∶2.5。同时,过表达NOVA1蛋白不仅高效表达于细胞质,而且高效表达于细胞核,且过表达NOVA1蛋白的细胞增殖活性明显增加。因此,本研究一方面为NOVA1蛋白的表达提供了重要技术支撑,另一方面为其新功能的开发提供了重要参考,具有一定的应用价值。
参考文献
| [1] | Buckanovich RJ, Yang YY, Darnell RB. The onconeural antigen Nova-1 is a neuron-specific RNA-binding protein, the activity of which is inhibited by paraneoplastic antibodies.J Neurosci, 1996, 16(3): 1114–1122(in Chinese). |
| [2] | Yang RB, Mark MR, Gray A, et al. Toll-like receptor-2 mediates lipopolysaccharide-induced cellular signaling.Nature, 1998, 395(6699): 284–288(in Chinese). |
| [3] | Yang YYL, Yin GL, Darnell RB. The neuronal RNA-binding protein Nova-2 is implicated as the autoantigen targeted in POMA patients with dementia.Proc Natl Acad Sci USA, 1998, 95(22): 13254–13259(in Chinese). |
| [4] | Buckanovich RJ, Posner JB, Darnell RB. Nova, the paraneoplastic Ri antigen, is homologous to an RNA-binding protein and is specifically expressed in the developing motor system.Neuron, 1993, 11(4): 657–672(in Chinese). |
| [5] | Buckanovich RJ, Darnell RB. The neuronal RNA binding protein Nova-1 recognizes specific RNA targets in vitro and in vivo.Mol Cell Biol, 1997, 17(6): 3194–3201(in Chinese). |
| [6] | Ashburner M, Ball CA, Blake JA, et al. Gene ontology: tool for the unification of biology.Nat Genet, 2000, 25(1): 25–29(in Chinese). |
| [7] | Fletcher CF, Okano HJ, Gilbert DJ, et al. Mouse chromosomal locations of nine genes encoding homologs of human paraneoplastic neurologic disorder antigens.Genomics, 1997, 45(2): 313–319(in Chinese). |
| [8] | Han L, Li ZF, Ren CH, et al. NOVA, a nervous system specific splicing factor: research progress.Bull Acad Milit Med Sci, 2008, 32(6): 571–574(in Chinese). 韩冷, 李稚锋, 任长虹, 等. 神经系统特异性剪接因子NOVA研究进展.军事医学科学院院刊,2008,32(6):571–574. |
| [9] | Ule J, Ule A, Spencer J, et al. Nova regulates brain-specific splicing to shape the synapse.Nat Genet, 2005, 37(8): 844–852(in Chinese). |
| [10] | Jensen KB, Dredge BK, Stefani G, et al. Nova-1 regulates neuron-specific alternative splicing and is essential for neuronal viability.Neuron, 2000, 25(2): 359–371(in Chinese). |
| [11] | Li HL, Sun CQ, Wang Y, et al. Dynamic expression pattern of neuro-oncological ventral antigen 1 (Nova1) in the rat brain after focal cerebral ischemia/reperfusion insults.J Histochem Cytochem, 2013, 61(1): 45–54(in Chinese). |
| [12] | Li WS. The construction of eukaryotic expression vector of human Dickkopf-1 and the initial study in SHG44[D]. Suzhou: Soochow University, 2009 (in Chinese). 李文帅. Dickkopf-1 的真核表达载体构建及其对 SHG44 的作用[D]. 苏州: 苏州大学, 2009. |
| [13] | Liu YP. Experimental study on construction of eukaryotic expression vectors of NOV gene and its effect on neural-oriented differentiation of dermal multipotent stem cells in rats[D]. Chongqing: Third Military Medical University of Chinese P.L.A, 2008 (in Chinese). 刘雁平. NOV 基因真核表达载体的构建及其在大鼠真皮多能干细胞成神经分化中的作用研究[D]. 重庆: 中国人民解放军第三军医大学,2008. |
| [14] | Zhang SB, Xu YM, Wang B, et al. Cationic compounds used in lipoplexes and polyplexes for gene delivery. J Contr Rel, 2004, 100(2): 165-180. |
| [15] | Nicolazzi C, Garinot M, Mignet N, et al. Cationic lipids for transfection.Curr Med Chem, 2003, 10(14): 1263–1277(in Chinese). |
| [16] | Zandi E, Chen Y, Karin M. Direct phosphorylation of IκB by IKKα and IKKβ: discrimination between free and NF-κB-bound substrate.Science, 1998, 281(5381): 1360–1363(in Chinese). |
| [17] | May MJ, D'Acquisto F, Madge LA, et al. Selective inhibition of NF-κB activation by a peptide that blocks the interaction of NEMO with the IκB kinase complex.Science, 2000, 289(5484): 1550–1554(in Chinese). |
| [18] | Kim YJ, Kim TW, Chung H, et al. The effects of serum on the stability and the transfection activity of the cationic lipid emulsion with various oils.Int J Pharm, 2003, 252(1/2): 241–252(in Chinese). |
| [19] | Greene LA, Tischler AS. Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor.Proc Natl Acad Sci USA, 1976: 2424–2428(in Chinese). |
| [20] | Rudy B, Kirschenbaum B, Greene LA. Nerve growth factor-induced increase in saxitoxin binding to rat PC12 pheochromocytoma cells.J Neurosci, 1982: 1405–1411(in Chinese). |
