

1 河南大学 生命科学学院,河南 开封 475004
2 河南大学 生物工程研究所,河南 开封 475004
网络出版时间:2015-09-17
基金项目:转基因重大专项 (No. 2011zx08008-002),国家自然科学基金 (No. 31271597) 资助。
摘要: 绒山羊 (Cashmere goat) 是一类以生产山羊绒为主的山羊品种,因其绒毛纤细有光泽、轻盈、保暖而备受青睐。绒山羊角蛋白关联蛋白 (Keratin associated protein,KAP) 和骨形态发生蛋白 (Bone morphogenetic protein,BMP) 在羊绒纤维毛囊细胞的增殖和分化过程中起重要作用。为了提高山羊绒的产量和品质,对包含kap6.3,kap8.1和bmp4基因的细菌人工染色体 (Bacterial artificial chromosome,BAC) 进行研究。首先采用同源重组的方法对BAC进行修饰,其次将哺乳动物密码子优化过的Tol2转座子加入BAC中,最后采用Amaxa nucleofector核转染技术将修饰过的BAC转入绒山羊成纤维细胞。结果表明成功构建了含有目的基因的BAC-Tol2载体。载体上包含UBC启动元件的egfp标记基因和真核筛选抗性neo基因,并且载体的两端加有loxp元件,为转染细胞后标记和抗性基因的去除作准备。载体转染细胞效率达到1%?6%,最高可达10%。成功获得了外源整合kap6.3、kap8.1和bmp4基因的细胞株,为以后克隆绒山羊作准备。研究表明,在BAC的修饰中应用Tol2转座子系统增加了电转染后的整合率,提高了BAC无错重组的效率和精确性。
关键词: 绒山羊 细菌人工染色体 (BAC) Tol2转座子 电转染
Cashmere goat bacterial artificial chromosome recombination and cell transfection system
Tian Huang1,2, Zhongyang Cao1,2, Yaohui Yang1,2, Gengsheng Cao1,2


1 School of Life Science, Henan University, Kaifeng 475004, Henan, China;
2 Institute of Bioengineering, Henan University, Kaifeng 475004, Henan, China
Received: June 24, 2015; Accepted: August 31, 2015
Supported by:Transgenic Major Projects (No. 2011zx08008-002), National Natural Science Foundation of China (No. 31271597).
Corresponding authors:Gengsheng Cao. Tel: +86-371-23858418; E-mail: gscao@henu.edu.cn
Abstract: The Cashmere goat is mainly used to produce cashmere, which is very popular for its delicate fiber, luscious softness and natural excellent warm property. Keratin associated protein (KAP) and bone morphogenetic protein (BMP) of the Cashmere goat play an important role in the proliferation and development of cashmere fiber follicle cells. Bacterial artificial chromosome containing kap6.3, kap8.1 and bmp4 genes were used to increase the production and quality of cashmere. First, we constructed bacterial artificial chromosomes by homology recombination. Then Tol2 transposon was inserted into bacterial artificial chromosomes that were then transfected into Cashmere goat fibroblasts by amaxa nucleofector technology according to the manufacture’s instructions. We successfully constructed the BAC-Tol2 vectors containing target genes. Each vector contained egfp report gene with UBC promoter, Neomycin resistant gene for cell screening and two loxp elements for resistance removing after transfected into cells. The bacterial artificial chromosome-Tol2 vectors showed a high efficiency of transfection that can reach 1% to 6% with a highest efficiency of 10%. We also obtained Cashmere goat fibroblasts integrated exogenous genes (kap6.3, kap8.1 and bmp4) preparing for the clone of Cashmere goat in the future. Our research demonstrates that the insertion of Tol2 transposons into bacterial artificial chromosomes improves the transfection efficiency and accuracy of bacterial artificial chromosome error-free recombination.
Key words: Cashmere goat bacterial artificial chromosome Tol2 transposon, electric transfection
绒山羊的羊绒具有纤细、柔软、保暖等多种优良性状,所以用途广泛并具有较高的经济价值,但其产量一直不高。角蛋白(Keratin)及其关联蛋白(KAPs)是羊绒的主要结构蛋白,它们决定了绒毛的基本特性[1]。KAPs蛋白根据氨基酸的组成可进一步分为高硫氨酸KAP、超高硫氨酸KAP和高甘氨酸-酪氨酸KAP。高甘氨酸-酪氨酸(HGT)KAP是由kap6-8基因家族编码[2, 3, 4],它们都位于绒山羊的1号染色体上[5]。Jin等研究表明高甘氨酸-酪氨酸KAP与羊毛的特性有很大的关系[6, 7, 8]。Parsons等发现kap6和kap8这两个基因位点与羊毛的产量和纤维直径具有直接的相关性[9]。同时Zhao等也证明了kap8.1基因与羊绒细度具有重要的相关性[10]。在不同地区和不同的品系中,绒山羊羊绒的特质有着显著的变化,这是由于角蛋白基因表达水平不同造成的[11]。因此从分子水平研究KAPs的基因是用来控制羊绒纤维细度和提高质量的一个重要手段。毛囊是毛纤维的“发源地”,它的性状和组织结构决定着毛纤维的品质和产量。骨形态发生蛋白 (BMPs) 是转化生长因子 (TGF-β) 超家族成员之一[12],是毛囊发育所涉及的重要信号分子。其中bmp4基因在绒山羊皮肤次级毛囊休止期高表达,而在兴盛期低表达,因此它是调节山羊绒周期性生长的重要因子[13]。
细菌人工染色体 (BAC) 可以容纳较大的克隆片段,包括基因上下游的调控元件,这样可以有效地防止位置效应。但是插入片段过大时不易操作,而且拷贝数较低。Tol2转座子作为基因转移的载体,可以携带长达11 kb的DNA片段,而且不会降低转座效率[14]。目前Tol2转座系统已用于将外源DNA导入斑马鱼的生殖细胞中[15, 16],以及用显微注射的方法将含有Tol2转座子的供体质粒和转座酶mRNA共注射入爪蟾的二细胞胚胎中[17]。此外也有研究表明在人和小鼠体细胞中,经过哺乳动物密码子优化的Tol2转座子的转座效率要比SB (Sleeping beauty) 转座子高[18]。为了改善羊绒的品质并提高绒山羊的产绒量,我们对包含绒山羊品种优良基因的BAC进行修饰,使用Tol2转座系统增加目的基因的整合率和整合的精确性,并采用电转染方法提高转染效率,为克隆绒山羊做准备。
1 材料与方法1.1 菌种、载体和细胞 菌株:大肠杆菌Escherichia coli DH5α及TOP10为本实验室保存。
质粒载体:pGEM-3zf、pGEM-7zf、pABRG由本实验室构建。Tol2转座质粒 (含有末端反向重复序列L200、R150和原核抗性筛选基因Amp+)、pcDNA3.1-TP是由生工生物工程 (上海) 股份有限公司在pcDNA的基础上合成的含有Tol2转座酶编码基因的质粒。pMD-19T载体购自TaKaRa公司。
BAC:169D05、706H15、572K17由内蒙古农业大学提供;绒山羊成纤维细胞第二代:由内蒙古农业大学国家动物转基因技术研究中心提供。
1.2 主要试剂 实验所用限制性内切酶购自TaKaRa公司。KOD-Plus DNA聚合酶购自TOYOBO公司。质粒小提试剂盒购自OMEGA公司。去内毒素质粒大提试剂盒购自北京康为世纪公司。BAC磁珠小提试剂盒购自河南惠尔纳米科技有限公司。BAC去内毒素大提试剂盒NucleoBond BAC100购自MACHEREY-NAGEL公司。Amaxa@ Nucleofector Ⅱ Kit for Primary Mammalian Fibroblasts电转染试剂盒购自Thermo公司。DMEM/F12培养基为Gibco进口分装。标准胎牛血清为Hyclone进口分装。引物使用Primer 6.0软件设计,基因测序及引物合成由北京金唯智生物技术公司完成。本实验所用引物见表 1。
表1 引物序列Table1 Sequence of primer
| Primer name | Primer sequence (5′?3′) | Length (bp) |
| KAP8.1-F | ATACTGAGGAAATTCATTCCCTGC | 199 |
| KAP8.1-R | GCCCCAGAGCCGTTGTAG | |
| KAP6.3-F | GCTCAAGTGACACCTATACTCTCC | 306 |
| KAP6.3-R | CAGAACTGGAAAATTGGAGGGT | |
| BMP4-F | GCGAGCCATGCTAGTTTGATACC | 314 |
| BMP4-R | GTGGAAGCTCCTCACGGTGTTG | |
| EGFP -F | ATGGTGAGCAAGGGCGAG | 751 |
| EGFP-R | TTACTTGTACAGCTCGTCCATGC | |
| Homology-F1 | ACATGTCGTCGTAACCTGTAGAACGGAGTAACCTCGGTGTGCGGTTGTATCCCTGCTCGAGCCGGGCCCAAGTG | 1 516 |
| Homology-R1 | TTAACGTGCCGGCACGGCCTGGGTAACCAGGTATTTTGTCCACATAACCGATTATGATCCTCTAGATCAGATCT | |
| Tol2-F | TCTGGCTAGAATCTTACTTGAG | 591 |
| Tol2-R | GACTTCCATTGTTCATTCCAC | |
| pBAC-EGFP-F | TTCCGTTCTTCTTCGTCATA | 529 |
| pBAC-EGFP-R | ATGTCCTTCTGCTGATACTG |
表选项
1.3 方法1.3.1 构建LoxP-EGFP-Neo 载体 首先对pPB-UBC-EGFP质粒进行XhoⅠ和SalⅠ双酶切得到带有egfp基因及真核表达调控元件的完整片段:UBC-EGFP-polyA,与XhoⅠ (XhoⅠ和SalⅠ是同尾酶) 单酶切的PGL3-contro载体连接,构建新的PGL3-EGFP质粒。然后用Bgl Ⅱ和KpnⅠ双酶切PGL3-EGFP质粒,得到带有Bgl Ⅱ和KpnⅠ酶切位点的UBC-EGFP-ployA片段,并连接到被Bgl Ⅱ和KpnⅠ双酶切的7zf-mcs载体上 (这个载体是由Promega公司的原载体进行多克隆位点改造后的载体),构建新的载体7zf-EGFP。最后再使用Bgl Ⅱ和NotⅠ双酶切7zf-EGFP载体,得到带有Bgl Ⅱ和NotⅠ粘性末端的UBC-EGFP-ployA片段,与被BamHⅠ (BamHⅠ和Bgl Ⅱ是同尾酶) 和NotⅠ双酶切的LoxP-Neo的骨架载体连接,构建新的LoxP-EGFP-Neo载体 (图 1),并进行PCR鉴定和XhoⅠ酶切鉴定。
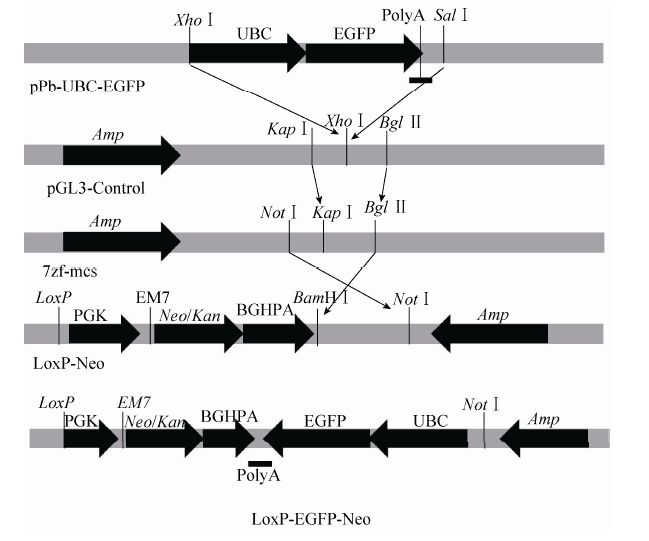 |
| 图1 LoxP-EGFP-Neo载体构建流程图 Figure1 Construction of LoxP-EGFP-Neo vector. |
| 图选项 |
1.3.2 BAC 克隆的鉴定与第一次重组 BAC的载体骨架为pCC1BAC,在Hind Ⅲ克隆位点处携带有目的基因的基因组。3个绒山羊的BAC克隆分别为169D05、706H15、572K17,对应的基因分别为kap6.3、kap8.1、bmp4,其基因序列经过PCR扩增并测序比对后确定为绒山羊基因。我们以含有Tol2转座子的质粒为模板,设计同源臂引物Homo-F1和Homo-R1,并进行PCR扩增转座子的L200-Amp+-R150片段,使用电转染方法将其转到带有pABRG质粒的BAC感受态细胞中,在BAC骨架pCC1BAC上插入L200-Amp+-R150,构建pCC1BAC-Tol2载体 (图 2)。分别使用Homo-F1、Homo-R1引物和Tol2-F1、Tol2-R1引物进行PCR鉴定 (引物位置如图 2所示)。
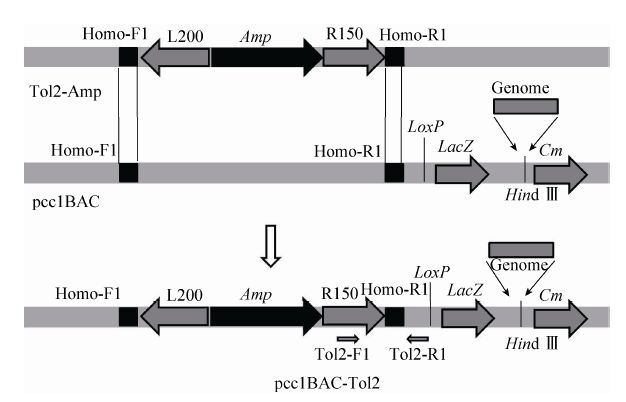 |
| 图2 pCC1BAC-Tol2载体构建流程图 Figure2 Construction of pCC1BAC-Tol2 vector. |
| 图选项 |
1.3.3 1.3.3 BAC 第二次重组 分别在LoxP-EGFP-Neo载体的上下游设计同源引物Homo-R2和 Homo-F2并进行PCR扩增,将得到的片段通过电转染转到含有pCC1BAC-Tol2载体的感受态细胞中,得到重组质粒pCC1BAC-Tol2-EGFP,分别是含有kap6.3、kap8.1和bmp4 基因的载体169D05-Tol2- EGFP、706H15-Tol2-EGFP、572K17-Tol2-EGFP (图 3)。为了验证Tol2转座子的转座效率,我们使用相同的方法构建了不含Tol2转座子的质粒即pCC1BAC-EGFP载体 (图 4)。载体构建完成后使用PCR和测序进行鉴定。
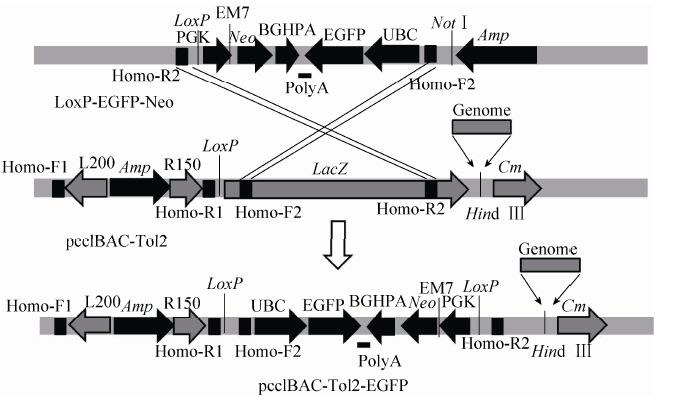 |
| 图3 pCC1BAC-Tol2-EGFP 载体构建流程 Figure3 Construction of pCC1BAC-Tol2-EGFP vectors. |
| 图选项 |
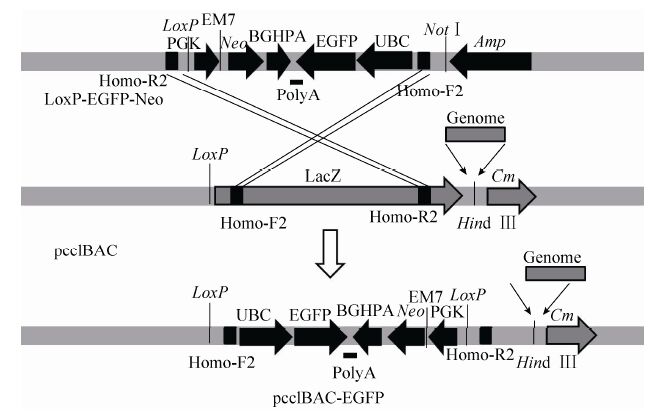 |
| 图4 无 Tol2转座子 pCC1BAC-EGFP载体构建流程图 Figure4 Construction of pCC1BAC-EGFP vector less Tol2 transposon. |
| 图选项 |
1.3.4 细胞转染与筛选 重组完成后的BAC用MACHEREY-NAGEL试剂盒提取后测定浓度备用。因为电转染使用的是绒山羊的成纤维细胞,所以其传代次数不能太多,我们在转染前两天对细胞进行复苏,传代一次进行电转染,以防止对后续的克隆动物实验产生影响。选取细胞融合为70%?80%,细胞数目为0.5×106?1×106时进行转染。转染时同时加入pcDNA3.1-TP质粒。在细胞转染24 h后更换新鲜培养基观测荧光信号。细胞生长到一定时候加入400 μg/mL新霉素进行筛选。待克隆岛孤立出现后停止加药继续培养,等到克隆点长到一定大小的时候进行单克隆挑取。根据加入新霉素筛选后荧光细胞数和转染前细胞数计算转染效率。
1.3.5 标记基因的去除与重组效率鉴定 本实验构建载体时在遗传标记基因 (egfp) 和抗性基因(neo) 的两端插入了两个方向相同的loxP位点,在挑取单克隆后利用电转染的方法转染含有Cre酶编码基因的质粒(转染约400 ng),利用Cre-LoxP系统去除遗传标记基因 (egfp) 和抗性基因 (neo)。经过Cre-LoxP系统处理后的细胞在6孔板上培养后用胰酶消化,收集细胞提取基因组并做PCR鉴定重组效率。
2 结果与分析2.1 载体鉴定2.1.1 UBC-EGFP-ployA 载体鉴定 载体构建完成后进行了PCR鉴定、酶切鉴定和测序鉴定。首先挑取单克隆进行菌体PCR扩增egfp基因,扩增片段大小为751 bp (图 5A),测序证明结果正确。然后取阳性克隆1提质粒并用Xho Ⅰ进行酶切,酶切后片段大小分别为 2 930 bp和4 390 bp (图 5B)。结果表明PCR和酶切结果正确,载体构建成功。
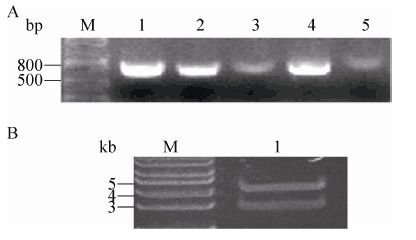 |
| 图5 LoxP-EGFP-Neo载体 PCR和酶切鉴定 Figure5 Identification of LoxP-EGFP-Neo vector. |
| 图选项 |
2.1.2 pCC1BAC-Tol2 载体鉴定 首先我们使用同源臂引物Homo-F1、Homo-R1进行菌体PCR扩增Tol2转座子。如图 6所示,扩增产物片段大小为1 516 bp。其中2、3、26号的菌体PCR结果条带较弱,其余全部为阳性。然后我们使用Tol2-F1、Tol2-R1作为引物对阳性克隆进行PCR验证重组是否成功,如图 7所示,PCR片段大小为591 bp,与预期结果一致。同时我们对PCR产物进行测序,测序结果与载体序列一致,结果表明第一次重组成功。
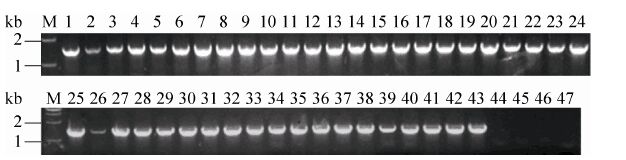 |
| 图6 pCC1BAC-Tol2 载体Tol2 转座子菌体PCR 鉴定 Figure6 PCR amplification of Tol2 transposon in pCC1BAC-Tol2 vector. |
| 图选项 |
 |
| 图7 pCC1BAC-Tol2载体菌体PCR鉴定 Figure7 PCR amplification of pCC1BAC-Tol2 vectors using Tol2F1 and Tol2R1 primers. |
| 图选项 |
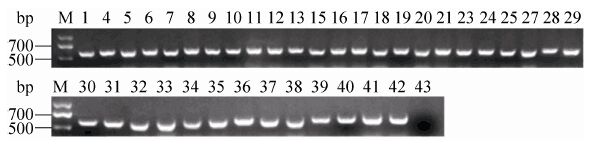
2.1.3 pCC1BAC-Tol2-EGFP 载体鉴定 第二次重组之后,我们首先使用Tol2-F1、Tol2-R1引物来鉴定第一次重组后的效果是否存在。如图 8所示,扩增产物片段大小为591 bp,除了8号和12号之外其余均为阳性克隆。
 |
| 图8 第二次重组跨Tol2转座子和BAC骨架的菌体PCR鉴定 Figure8 PCR amplification of the second recombination products using Tol2-F1 and Tol2-R1 primers. |
| 图选项 |
然后我们在第一次鉴定的基础上选取阳性克隆菌落为模板,分别在BAC骨架和UBC启动子上设计上下游引物pBAC-EGFP-F和pBAC-EGFP-R,进行进一步的PCR鉴定和测序。如图 9所示,扩增产物片段大小为529 bp,除9号外其他均是阳性克隆。然后对PCR产物进行测序,结果与同源重组后的序列基本相同,这表明第二次重组成功。
 |
| 图9 pCC1BAC-Tol2-EGFP载体菌体PCR鉴定 Figure9 PCR amplification of thepCC1BAC-Tol2-EGFP vectors using pBAC-EGFP-F and pBAC-EGFP-R primers. |
| 图选项 |
2.1.4 无Tol2 转座子的pCC1BAC-EGFP 载体(阴性对照) 鉴定 对于不含Tol2转座子的BAC重组质粒,
利用引物pBAC-EGFP-F、pBAC-EGFP-R进行PCR鉴定。如图 10所示,片段大小为529 bp。对其中的阳性克隆进行测序,结果与载体序列一致。
 |
| 图10 菌体PCR鉴定无Tol2转座子的pCC1BAC-EGFP载体 Figure10 PCR amplification of pCC1BAC-EGFP vector less Tol2 transposon. |
| 图选项 |
2.2 绒山羊成纤维细胞的转染、筛选与鉴定2.2.1 细胞转染与筛选 电转染后在倒置荧光显微镜下观察细胞,都出现荧光,但荧光出现的时间不同。转染706H15-Tol2 -EGFP质粒的细胞在转染48 h后即出现荧光,转染572K17-Tol2-EGFP和169D05-Tol2-EGFP质粒的细胞荧光出现的较晚,但荧光细胞数目较多 (图 11)。然后我们使用400 μg/mL的新霉素进行抗性筛选,并挑取单克隆继续培养 (图 12A-C)。经过计算,不同批次转染效率达到1%?6%,最高可达10%。单克隆培养一段时间后,我们利用电转染的方法将包含Cre酶基因的质粒转入细胞,然后在倒
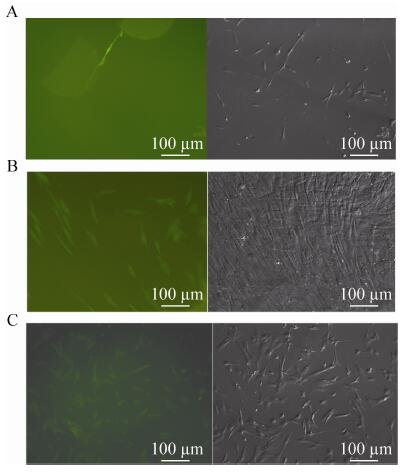 |
| 图11 细胞转染后荧光检测 Figure11 Detection of cell fluorescence after transfected with 706H15-Tol2-EGFP (kap8.1 gene) |
| 图选项 |
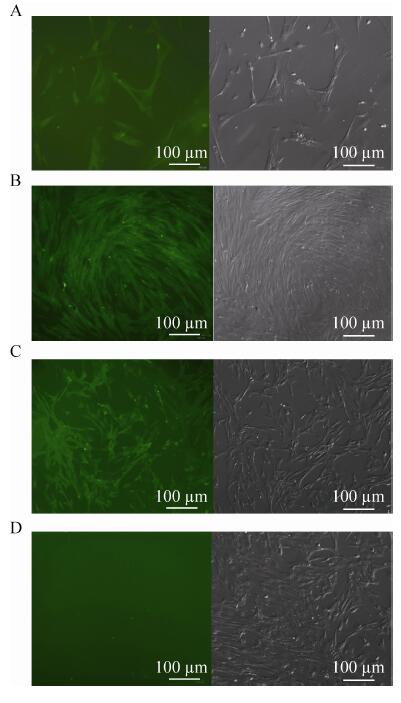 |
| 图12 新霉素抗性筛选后细胞荧光检测 Figure12 Detection of cell fluorescence after screened with neomycin. |
| 图选项 |
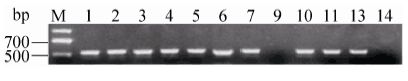
2.2.2 阳性细胞克隆鉴定 我们把经过Cre-LoxP系统处理后的细胞收集后提取基因组做PCR鉴定。首先对目的基因作鉴定,分别是kap8.1、kap6.3和bmp4基因。如图 13A所示,目的基因kap8.1扩增产物是199 bp。图 13B中目的基因kap6.3扩增产物为314 bp,bmp4扩增产物为306 bp。
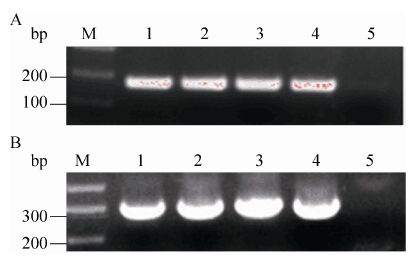 |
| 图13 目的基因鉴定 Figure13 Identification of target genes by genomic PCR. |
| 图选项 |
在转染时,我们把表达转座酶 (TP蛋白) 的质粒pcDNA3.1-TP同时转入细胞,表达的TP蛋白和转入的BAC质粒相互作用,将Tol2转座子左右两端的L200和R150序列与BAC携带的目的基因融合并整合到基因组上,因此中间的原核抗性基因amp+被删除,所以我们使用同源臂引物Homo-F1/ R1对细胞基因组进行PCR鉴定。如图 14所示,如果TP蛋白没有发挥作用,扩增产物应为1 576 bp。
 |
| 图14 细胞基因组amp+基因鉴定 Figure14 Identification of amp+ geneby genomic PCR. |
| 图选项 |
3 讨论 在BAC的重组过程中我们选用了2012年Bird等提出的一种新的重组体系即pABRG,它只包括依赖阿拉伯糖诱导的Red β和鼠李糖诱导的Red γ两种蛋白,可以有效地减少BAC质粒内部的重组,保证了BAC质粒的完整性,同时在定向位点诱变效率上比其他方法如pkD46、sw102等高出一个数量级[19]。但是这种重组体系需要两种不同的糖来进行诱导,对糖的加入时间和加入量都需要有严格的要求,并且加入前后温度变化也都需要严格的控制,这提高了制备电转感受态细胞的难度。到目前为止PiggyBac (PB) 转座子已经广泛地应用于哺乳动物细胞,但是其转座效率较低[20, 21]。睡美人 (SB) 转座子在介导转基因时,基因转移效率会随转座酶的过量表达而降低[22]。Tol2转座子目前在哺乳动物中应用得较少,但是在小鼠和人的体细胞中,Tol2转座子的转座效率比睡美人 (SB) 转座子高[18]。我们首次在绒山羊成纤维细胞中应用Tol2转座子,并且取得了成功。
细胞转染方法包括脂质体转染、病毒介导的转染、显微注射和电转染等,但是很少有报道使用电转染方法来转染BAC,因为电转染BAC的效率很低,当BAC达到200 kb时其电转染的效率不到1%,所以一般对BAC的转染都是应用显微注射的方法[23, 24]。但是显微注射对设备和技术的要求很高,一般实验室很难达到要求,而且一次处理细胞数量不能太多。我们通过在BAC中应用Tol2转座子系统,增加了电转染后的整合率,提高了转染效率。
本文成功地构建了含有目的基因的BAC-Tol2-EGFP载体,载体上包含Tol2转座子,提高了目的基因的整合效率,同时载体上携带有UBC启动子的egfp标记基因和真核抗性筛选基因neo,并且载体的两端分别加入loxp元件,使得细胞转染后可以将标记和抗性基因去除。转染效率最高可达10%。此外我们也获得了整合有山羊绒角蛋白关联蛋白 (kap8.1、kap6.3) 和骨形态发生蛋白相关基因和 (bmp4) 的绒山羊成纤维细胞株,为绒山羊的克隆奠定基础。
参考文献
| [1] | Yin J, Li JQ, Zhang YJ, et al. Sequence analysis and expression of a type I hair keratin gene in goat skin.Acta Veterinar Zootech Sin, 2006, 37(1): 18–22(in Chinese). 尹俊, 李金泉, 张燕军, 等. 一个山羊Ⅰ型毛角蛋白基因的序列及其在皮肤中的表达.畜牧兽医学报,2006,37(1):18–22. |
| [2] | Rogers MA, Langbein L, Winter H, et al. Characterization of a first domain of human high glycine-tyrosine and high sulfur keratin-associated protein (KAP) genes on chromosome 21q22.J Biol Chem, 2002, 277(50): 48993(in Chinese). |
| [3] | Yin J, Hu TM, Li JQ, et al. Cloning and analysis of six full-length cDNA similar to sheep KAP6-1 from cashmere goat.Acta Genet Sin, 2004, 31(5): 502–507(in Chinese). 尹俊, 扈廷茂, 李金泉, 等. 与绵羊KAP6-1 相似的6 个绒山羊全长cDNA 的克隆与序列分析.遗传学报,2004,31(5):502–507. |
| [4] | Langbein L, Rogers MA, Winter H, et al. The catalog of human hair keratins. II. Expression of the six type II members in the hair follicle and the combined catalog of human type I and II keratins. J Biol Chem, 2001, 276(37): 35123-35132. |
| [5] | Liu GF, Tian KC, Zhang EP, et al. Candidate gene analysis of high quality merino sheep.Hereditas, 2007, 29(1): 70–74(in Chinese). 刘桂芬, 田可川, 张恩平, 等. 优质细毛羊羊毛细度的候选基因分析.遗传,2007,29(1):70–74. |
| [6] | Jin M, Wang L, Li S, et al. Characterization and expression analysis of KAP7.1, KAP8.2 gene in Liaoning new-breeding cashmere goat hair follicle. Mol Biol Rep, 2010, 38(5): 3023–3028(in Chinese). |
| [7] | Gong H, Zhou H, Hickford JGH. Diversity of the glycine/tyrosine-rich keratin-associated protein 6 gene (KAP6) family in sheep.Mol Biol Rep, 2010, 38(1): 31(in Chinese). |
| [8] | Matsunaga R, Abe R, Ishii D, et al. Bidirectional binding property of high glycine-tyrosine keratin-associated protein contributes to the mechanical strength and shape of hair.J Struct Biol, 2013, 183(3): 484(in Chinese). |
| [9] | Parsons YM, Cooper DW, Piper LR. Evidence of linkage between high-glycine-tyrosine keratin gene loci and wool fibre diameter in a Merino half-sib family.Anim Genet, 1994, 25(2): 105–108(in Chinese). |
| [10] | Zhao M, Chen H, Wang X, et al. aPCR-SSCP and DNA sequencing detecting two silent SNPs at KAP8.1 gene in the cashmere goat. Mol Biol Rep, 2009, 36(6): 1387–1391(in Chinese). |
| [11] | Plowman JE, Bryson WG, Jordan TW. Application of proteomics for determining protein markers for wool quality traits.Electrophoresis, 2000, 21(9): 1899–1906(in Chinese). |
| [12] | Wozney JM, Rosen V, Celeste AJ, et al. Novel regulators of bone formation: molecular clones and activities.Science, 1988, 242(4885): 1528–1534(in Chinese). |
| [13] | Hu XZ, Wang YJ. Research progress on the periodic development and molecular regulation ofhair follicles in cashmere goats.Acta Ecolog Anim Domast, 2012, 33(3): 1–6(in Chinese). 胡秀芝, 王永军. 绒山羊毛囊的周期性发育及其分子调控研究进展.家畜生态学报,2012,33(3):1–6. |
| [14] | Urasaki A, Morvan G, Kawakami K. Functional dissection of the Tol2 transposable element identified the minimal cis-sequence and a highly repetitive sequence in the subterminal region essential for transposition.Genetics, 2006, 174(2): 639–649(in Chinese). |
| [15] | Kawakami K, Takeda H, Kawakami N, et al. A transposon-mediated gene trap approach identifies developmentally regulated genes in zebrafish.Dev Cell, 2004, 7(1): 133–144(in Chinese). |
| [16] | Kawakami K, Shima A, Kawakami N. Identification of a functional transposase of the Tol2 element, an Ac-like element from the Japanese medaka fish, and its transposition in the zebrafish germ lineage.Proc Natl Acad Sci USA, 2000, 97(21): 11403–11408(in Chinese). |
| [17] | Kawakami K, Imanaka K, Itoh M, et al. Excision of the Tol2 transposable element of the medaka fish Oryzias latipes in Xenopus laevis and Xenopus tropicalis.Gene, 2004, 338(1): 93–98(in Chinese). |
| [18] | Wu SC, Meir YJ, Coates CJ, et al. piggyBac is a flexible and highly active transposon as compared to Sleeping Beauty, Tol2, and Mos1 in mammalian cells.Proc Natl Acad Sci USA, 2006, 103(41): 15008–15013(in Chinese). |
| [19] | Bird AW, Erler A, Fu J, et al. High-efficiency counterselection recombineering for site-directed mutagenesis in bacterial artificial chromosomes.Nat Methods, 2012, 9(1): 103–109(in Chinese). |
| [20] | Nakazawa Y, Huye LE, Dotti G, et al. Optimization of the PiggyBac transposon system for the sustained genetic modification of human T-lymphocytes.J immunother, 2009, 32(8): 826–836(in Chinese). |
| [21] | Yusa K, Rad R, Takeda J, et al. Generation of transgene-free induced pluripotent mouse stem cells by the piggyBac transposon.Nat Methods, 2009, 6(5): 363–369(in Chinese). |
| [22] | Geurts AM, Yang Y, Clark KJ, et al. Gene transfer into genomes of human cells by the sleeping beauty transposon system.Mol Ther, 2003, 8(1): 108–117(in Chinese). |
| [23] | Suster ML, Abe G, Schouw A, et al. Transposon-mediated BAC transgenesis in zebrafish.Nat Protoc, 2011, 6(12): 1998–2021(in Chinese). |
| [24] | Suster ML, Sumiyama K, Kawakami K. Transposon-mediated BAC transgenesis in zebrafish and mice.BMC Genomics, 2009: 477(in Chinese). |
