

1 厦门大学附属第一医院杏林分院 肺科实验室,福建 厦门 361022
2 厦门大学 生命科学学院 国家传染病诊断试剂与疫苗工程技术研究中心,福建 厦门 361102
Development, identification and application of 33 monoclonal antibodies against cardiac troponin T
Yuehong Hu1, Zimin Chen2, Yuxiang Chen1, Yinghui Yang1, Shuying Wei2, Liuwei Song2, Guoliang Zhou2, Shengxiang Ge2


1 Laboratory of Lung, Xinglin Branch of the First Affiliated Hospital of Xiamen University, Xiamen 361022, Fujian, China
2 National Institute of Diagnostics and Vaccine Development in Infectious Diseases, School of Life Sciences, Xiamen University, Xiamen 361102, Fujian, China
Received: March 29, 2016; Accepted: May 16, 2016
Supported by:Xiamen Science and Technology Program (No. 3502Z20126007)
Corresponding authors:Shengxiang Ge. Tel/Fax: +86-592-6536555; E-mail: sxge@xmu.edu.cn
Abstract: The aim of this study is to prepare and characterize cardiac troponin T (cTnT) monoclonal antibodies (mAb), and further develop a chemiluminescence quantitative detection assay for cTnT. BALB/c mice were immunized with recombinant cTnT antigen, and specific mAbs were prepared using conventional hybridoma technique and screened by indirect ELISA method. To identify the epitopes, several cTnT peptide fragments were synthesized or expressed by genetic engineering. A double antibody sandwich ELISA method was used to screen the mAb pairs for cTnT detection, and the automatic chemiluminescence detection assay for cTnT was developed. In total 220 clinical specimens were used for system comparison between our assay and Roche cTnT assay; further performance characteristics was evaluated by testing 238 clinical samples and 784 physical examination samples. We successfully screened 33 strains of hybridoms against cTnT, and the mAbs' epitopes were identified. Mab E16H8 and C8G11 with a detection limit of 10 pg/mL cTnT antigen were selected to develop the full automatic chemiluminescence quantitative assay. The correlation coefficient of our reagent with Roche's was 0.959 9, with a coincidence rate of 95%. The assay presented a sensitivity of 97.5%, and a specificity of 99.15% in detection of clinical samples. The cTnT concentration was less than 0.080 6 ng/mL in 99% of general population, which agrees with the definition of WHO on patients with acute myocardial infarction (AMI). In summary, we developed monoclonal antibodies against predominant epitopes for diagnostics of cTnT, and an automatic tubular chemiluminescence quantitative detection assay was further developed, which presents a high coincidence rate with Roche's.
Key words: cardiac troponin T acute myocardial infarction (AMI) monoclonal antibodies chemiluminescence
心血管疾病是我国最常见的疾病之一,死亡率很高[1]。随着基础医学临床医学和检验医学的不断发展,陆续有许多心脏标志物先后应用于临床,在心脏疾病的诊断危险性评估疗效观察预后估计等方面起了重要作用。目前,临床应用的心脏标志物按功能可大致分为3类:一是主要反映心脏组织损伤的标志物;二是了解心脏功能及预测冠状动脉粥样硬化标志物;三是作为心血管炎性疾病的标志物[2-7]。因此检测心脏标志物对指导心脏病人的治疗、监测血栓病人的溶栓疗效、判断愈后都有着重要的意义[8]。
心肌肌钙蛋白T (cTnT)是心肌损伤(如心肌梗死)的特异性和高敏感性的标志物,由于分子量小(37 000 Da),所以发病后血中浓度迅速升高。心肌肌钙蛋白T (cTnT)是能预测急性冠状动脉综合症短期、中期甚至长期结局的一1种独立的预后诊断标志物。低浓度的肌钙蛋白T是心血管事件(包括初发和再发的心房颤动)的独立预测指标[9]。血中cTnT浓度增高也可见于其他疾病,如心肌炎、心脏挫伤、肺栓塞和药物引起的心脏毒作用[10-13]。本研究目的就是特异性单抗的原料制备以及基于全自动管式化学发光免疫检测试剂的建立。
1 材料与方法1.1 试剂心肌肌钙蛋白T抗原购买于International laboratory USA (产品货号:CMT866525A);cTnI抗原(购买于International Laboratory USA货号CM583262);Human troponic C (TnC)购买于HyTest (货号:8T57)。小鼠骨髓瘤细胞株SP2/0为本公司保存。BALB/c小鼠为上海斯莱克动物中心提供。PEG1500﹑次黄嘌呤﹑胸腺嘧啶﹑氨基喋呤﹑DMSO﹑HRP、磁微粒Dynabeads M-270购自美国Life technologies公司。吖啶酯等购自Sigma公司。RPMI 1640基础培养基购自Gibco公司。胎牛血清购自PAA公司。羊抗鼠标记辣根过氧化酶、IgM﹑IgG1﹑IgG2a﹑IgG2b﹑IgG3为Serotec公司产品。
1.2 样本1.2.1 临床样本选取2013年11月-2013年12月福建医科大学附属协和医院及厦门大学附属中山医院收集的临床样本,来源于门诊住院病人,其中确诊AMI的118例,排除AMI的120例(AMI的诊断标准参照全国中西医结合防治冠心病、心绞痛、心律失常研究座谈会修订的诊断标准和WHO缺血性心脏病诊断标准)其次还选择了厦门大学附属中山医院收集有Roche罗氏E170检测背景的标本220份。
1.2.2 体检样本均来自体检中心健康体检者。
1.2.3 样本采集所有检测对象均为肝素抗凝的血浆。
1.3 仪器Caris200为厦门优迈科医学仪器有限公司的产品。
1.4 多抗、单抗制备选择6只雌性BALB/c小鼠用外购的cTnT抗原乳化完全弗氏佐剂(CFA) (Sigma, St. Louis,MO)皮下免疫50 μg/只、免疫总体积是500 μL,两周后使用同样的抗原乳化不完全弗氏佐剂(IFA) (Sigma,St. Louis,MO)进行皮下免疫,剂量、免疫体积同初次免疫,间隔2周继续免疫加强2针。最后利用相同的抗原PBS稀释至1 mg/mL脾脏免疫100 μL,采集眼球血清监测血清效价3 d后开展细胞融合。细胞融合、克隆化、腹水制备以及纯化均按照常规方法进行[14]。其中融合、克隆化的筛选模式是利用间接法筛选检测,利用外购抗原300 ng/孔包被于聚苯乙烯微孔板上,包被缓冲液是碳酸缓冲液,而后加入细胞上清反应,最后利用羊抗鼠标记的辣根过氧化物酶二抗捕获反应。选择1只3月龄新西兰兔利用外购的cTnT抗原免疫制备多抗(剂量是200 μg/只;皮下免疫;免疫体积1 mL),免疫周期3周一次,免疫3针后处死采集血清[15]。
1.5 抗原制备以及鉴定利用PTO-T7载体(本实验室构建)构建cTnT全长以及不同区段的克隆,在cTnT全长以及不同区段N端再引入6个His的标签,并在大肠杆菌中获得表达,命名为r-cTnT、B6-71-285、B6-71-130、B6-101-160、B6-131-190、和B6-161-220。经过金属螯合层析获得纯化抗原。利用兔多抗血清评价制备的抗原:利用获得不同的截断抗原包被,而后加入兔多抗血清评价。
1.6 单抗特征分析1)?mAb滴度测定:杂交瘤细胞培养上清及mAb滴度的测定采用间接ELISA法,包被的抗原为外购的cTnT抗原。2)?mAb的亚型鉴定:采用间接ELISA法分析。将抗体稀释至1 μg/mL加入预先包被外购的cTnT抗原的微孔板中反应其中抗原的包被量是300 ng/孔,所用酶标二抗为商品化购买的IgM、IgG1、IgG2a、IgG2b和IgG3的酶标二抗,根据说明书进行使用。3)?mAb识别表位的分析:将不同表达的区段分别进行分别包被后,用间接ELISA法测定各株mAb与之的反应性,从而分析各株mAb的识别表位[16]。
1.7 酶联免疫吸附试验平台检测系统的建立1)?单抗之间阻断试验验证:利用r-cTnT包被评价32株单抗之间的相互阻断关系,并初步分类。用间接阻断ELISA分析mAb间与cTnT抗原反应的相互阻断情况,以便为双抗体夹心检测cTnT抗原选择配伍mAb提供参考。mAb辣根过氧化物酶(HRP)的标记采用改良过碘酸钠法[17]。将各株单抗分别加入预先包被r-cTnT抗原的微孔板中37 ℃反应30 min,对照孔加PBS,而后利用PBST洗板后,正交加入各合适稀释度的单抗标记的酶液37 ℃反应30 min,PBST洗板后并显色读值。最后依据各阻断孔OD450值与相应对照孔的OD450值之差与对照孔OD450值的百分比值作为某mAb对相应HRP-mAb的阻断值,大于50%认为有阻断效果,小于50%认为无阻断效果[18]。2)?采用方正滴定法[18]筛选配对单抗,以灵敏度高、本底低、线性范围广为选择标准,最终确定E16H8为包被单抗,C8G11为酶标单抗初步建立酶免试剂。
1.8 磁微粒包被单克隆抗体取1 mg磁微粒用200 μL EDC溶液(10 mg EDC溶于1 mL去离子水)活化,然后加入10 μg单克隆抗体并置于旋转混匀仪上孵育偶联2 h,孵育后洗液洗涤3次后用1 mL甘氨酸溶液(pH 7.4)进行封闭,完成封闭后保存在含酪蛋白的PBS缓冲液中[19]。
1.9 吖啶酯标记单克隆抗体取100 μg单克隆抗体稀释到合适浓度后加入15 μL吖啶酯(溶于甲基甲酰胺中),混匀,室温避光反应30 min;加入1 mL赖氨酸溶液(pH 8.0)封闭;最后透析到PBS缓冲液中,用含酪蛋白的PBS缓冲液稀释后使用[19]。
1.10 心肌肌钙蛋白T定量测定试剂盒的配制以及免疫分析方法将包被好的磁微粒及标记好的吖啶酯按照一定的稀释比例进行稀释,稀释后进行罐装、组装及贴签,即为心肌肌钙蛋白T定量测定试剂盒。
取50 μL标记了单抗的磁珠缓冲液加入U型微孔板中并加入50 μL待检测样品,贴上封板膜后放置于37 ℃恒温箱内孵育。15 min后将微孔板至于置于磁力板架上,将磁珠完全被吸附后,PBST清洗3遍,吸干残余洗涤液,加入吖啶酯标记的抗体缓冲液50 μL,37 ℃恒温箱孵育10 min,PBST清洗3遍,将每孔磁珠转移至发光管中,加入激发液A100 μL,上机检测时加入激发液B100 μL,检测发光值[20]。
1.11 参考品的配制cTnT抗原用基质血(购买于Trina公司)稀释后用Roche罗氏E170试剂定量, 而后将定量的抗原用基质血稀释成L系列参考品,-20 ℃保存备用。
1.12 分析灵敏度的确定用试剂检测L系列参考品(L1-L8,浓度分别为0.01、0.1、0.4、1、2、5、10、25 ng/mL),用GraphPad Prism进行四参数拟合试剂剂量反应曲线。然后重复测定基质血清20次,计算其平均发光值、标准差,得出M+2SD,然后将M+2SD的RLU值代入试剂盒剂量反应曲线方程中,求出对应的浓度值,即为其分析灵敏度。
1.13 统计学处理分析灵敏度的结果采用GraphPad Prism5分析;与对照试剂相关性分析采用GraphPad Prism5;Bland-Altman分析采用SPSS18.0统计软件进行处理;本试剂的Kappa值采用SPSS18.0统计软件计算。
2 结果与分析2.1 重组抗原的制备以及鉴定利用PTO-T7载体表达N端带有6个His标签的cTnT区段抗原。由于cTnT N端1--71 aa是不稳定的易变区,而且发生急性心肌梗死时产生的cTnT为cTnT-ND,此时外周血中cTnT-ND含量上升,通过试剂检出的cTnT大部分为cTnT-ND[21],因此从71 aa开始进行不同截短抗原表达利用亲和层析纯化截短抗原(图 1)利用购买的cTnT抗原免疫获得的兔多抗血清评价,均显示具有抗原性。
 |
| 图 1 纯化cTnT截短抗原图 Figure 1 SDS-PAGE analysis of truncated cTnT antigen. |
| 图选项 |
2.2 cTnT单克隆抗体的制备与鉴定利用常规单抗制备筛选技术,开展了4个融合获得了33株抗-cTnT单抗。
2.2.1 cTnT单抗表位鉴定将这些单抗分别与上述制备的全长抗原以及截短抗原、合成肽(120-150 aa)进行反应,结果见图 2。发现大多数单抗的识别表位都是位于71-101 aa或者120-160 aa。评价这些单抗与cTnI抗原的反应性,结果显示其与cTnI抗原无交叉反应。
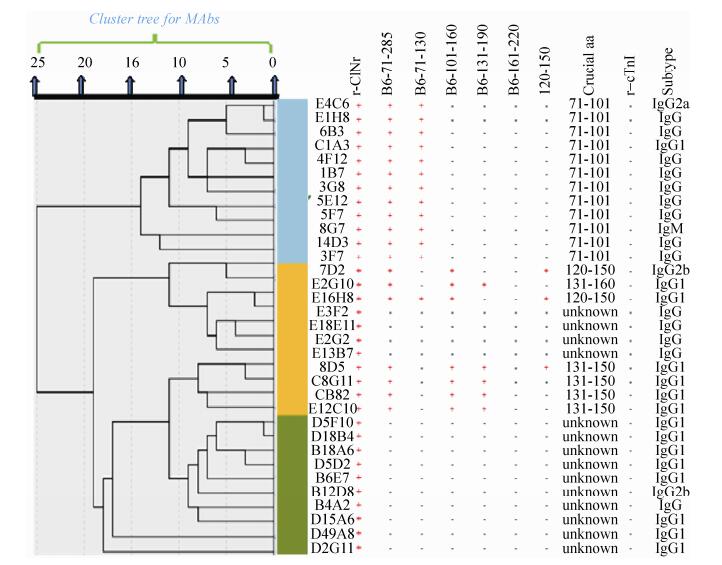 |
| 图 2 单抗的阻断试验及性质鉴定图谱 Figure 2 Blocking test and characterization of monoclonal antibodies. |
| 图选项 |
2.2.2 单抗相互阻断实验通过间接阻断ELISA方法获得不同单抗之间的相互阻断情况的数据(图 2),利用组间连接聚类方法进行系统聚类分析[22],结果可以将上述制备的33株单抗分为3类,其中1B7/3G8/ 5E12/5F7/8G7/14D3/3F7分为一类,主要是识别71-101 aa的偏线性表位单抗,这一类单抗基本识别表位一致;第二类单抗是7D2/E2G10/ E16H8/E3F2/E18E11/E2G2/E13B7/8D5/C8G11/C8B2/E12C10,主要是识别120-160 aa的偏线性表位单抗以及对这些表位都不反应的单抗,但是可能也存在偏构象单抗类似120-160 aa表位的单抗;第三类单抗是完全偏构象型单抗对现有区段抗原都不反应。
2.2.3 单抗配对筛选将获得的33株单抗分别标记HRP,使用定量的抗原以及一份高浓度血清作为样品进行单抗与酶标记单抗的正交配对检测,根据检测灵敏度以及特异性筛选到4个配对:D2G11-4F12-HRP;E4G6-B12D8-HRP;E16H8-C8G11-HRP;E4G6-8D5-HRP。这4个配对又进行灵敏度的平行比较以及选择3份阳性样本和山羊血清、人血清白蛋白进行配对的特异性评价,结果见图 3。从结果显示E16H8-C8G11对抗原检测的灵敏度最优,对样本检测较好且无非特异性反应,因此最终选择该配对用于cTnT管式化学发光试剂的研制。最后还选用E16H8-C8G11配对评价cTnI以及TnC的交叉反应情况,结果显示对二者无交叉。
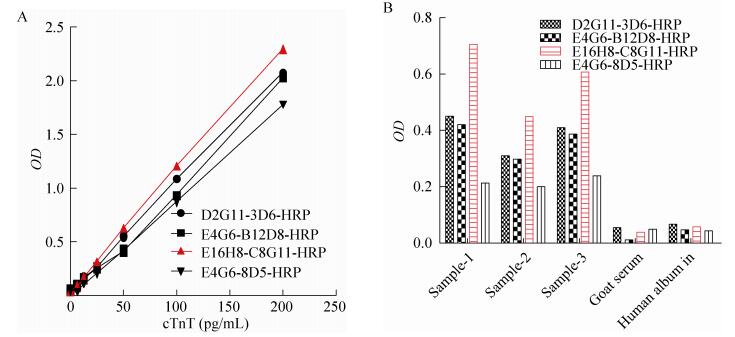 |
| 图 3 比较不同抗体配对检测(A) cTnT抗原和(B)样本 Figure 3 Comparison of different pairs of antibodies in detection of cTnT antigen (A) and samples (B). |
| 图选项 |
2.3 cTnT管式化学发光平台检测系统的建立及应用2.3.1 试剂分析灵敏度以L系列参考品建立四参数拟合试剂剂量反应曲线,通过重复测定基质血清得出所建立化学发光试剂的分析灵敏度为0.009 2 ng/mL (图 4)。
 |
| 图 4 试剂分析灵敏度结果 Figure 4 The analytical sensitivity of the assay. |
| 图选项 |
2.3.2 试剂与同类产品的比较检测有对比试剂Roche E170检测背景的标本220份,根据定量结果,以<0.1 ng/mL为正常参考值,将220份标本的结果判定为正常或异常,考核其判定符合率。本研发试剂与Roche试剂的结果总体符合率为95.00%,表明本试剂有良好检测性能,对临床cTnT的异常与否判定准确,结果如图 5、6和表 1所示。
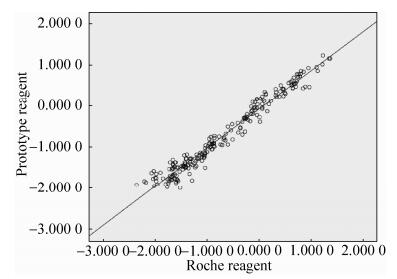 |
| 图 5 相关性分析散点图 Figure 5 Scatter plots of correlation analysis. |
| 图选项 |
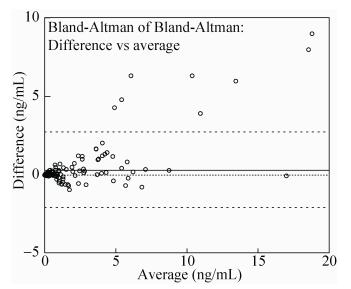 |
| 图 6 两试剂检测结果Bland-Altman图 Figure 6 Bland-Altman analysis of the two assays. |
| 图选项 |
表 1 与Roche检测结果的符合率Table 1 Coincidence rate with the Roche kit
| Detection results of Roche reagent | ||||
| Positive (≥0.1 ng/mL) | Negative ( < 0.1 ng/mL) | Total | ||
| Detection results of this reagent | Positive (≥0.1 ng/mL) | ?99 | ??1 | 100 |
| Negative ( < 0.1 ng/mL) | ?10 | 110 | 120 | |
| Total | 109 | 111 | 220 | |
表选项
检测有罗氏E170检测背景的标本220份,将定量结果与罗氏的定量结果进行相关性比较。对其进行线性回归,考察其定量相关性程度。本试剂与罗氏的定量值经过直线回归后,得到的直线斜率为1.065、截距-0.078 26,相关系数r达到0.959 9,表明两试剂有良好的相关性。其中漏检的10份标本主要都是灰区的标本。
2.3.3 临床样本检测检测临床样本238例,其中正常人样本120例,AMI病人118例。试剂灵敏度为97.5%,特异性为99.15%,总符合率为98.32%,Kappa值为0.966 (P < 0.001),一致性为最强。见表 2。
表 2 试剂检测结果与临床样本背景的比较Table 2 Comparison of test results with clinical samples
| AMI (case) | Normal (case) | Total | ||
| Test result | Abnormal (case) | 117 | ??1 | 118 |
| Normal (case) | ??3 | 117 | 120 | |
| Total (case) | 120 | 118 | 238 |
表选项
2.3.4 体检人群样本检测检测784例排除了近期有服用处方及自服药、血压异常及有心脑血管相关疾病的体检人群样本。结果显示95%体检人群的cTnT浓度小于0.016 3 ng/mL,99%体检人群的cTnT浓度小于0.080 6 ng/mL,符合WHO[23]对急性心肌梗死的定义标准。
3 讨论心肌肌钙蛋白(Cardiac troponin,cTn)是由3种亚基组成:心肌肌钙蛋白T (cTnT)、心肌肌钙蛋白I (cTnI)和肌钙蛋白C (TnC)。所以在检测的过程中要求较高的特异性,根据这个要求心肌肌钙蛋白T定量测定试剂盒(化学发光微粒子免疫检测法)中使用的是能与cTnT特异性反应的一对单克隆抗体。本研究主要目的是建立高特异性以及高灵敏度的化学发光微粒子免疫检测试剂,为此我们首先需要获得高特异性以及高灵敏度的心肌肌钙蛋白T的单克隆抗体。我们利用大肠杆菌表达的cTnT免疫筛选获得大量的单抗,并对单抗的进行大致的表位分析以及特异性分析,结果显色大多数单抗的识别表位都是在71-130 aa与120-160 aa之间,而且对cTnI等都无交叉。没有鉴定出表位的几个单抗,有可能是1-71 aa的单抗,也有可能是构象表位的单抗。本研究制备的心肌肌钙蛋白T的特异性单抗为建立心肌肌钙蛋白T定量测定试剂盒解决了关键原料的来源,促进国产化定量试剂研发的速度。
我们利用心肌肌钙蛋白T的特异性单抗E16H8以及C8G11建立定量检测试剂。通过试剂性能验证,表明心肌肌钙蛋白T定量测定试剂盒能达到Roche罗氏试剂的水平,与Roche[L3]罗氏试剂的结果总体符合率为95.00%,与罗氏的定量值经过直线回归后,得到的直线斜率为1.065、,截距为-0.078 26,相关系数r达到0.959 9。
对心肌损伤的诊断在诸多诊断急性心肌梗死(AMI)的临床生化指标中,CK-MB (血清心肌酶)曾一度被认为是诊断AMI的“金标准”,已广泛应用多年。随着对心肌肌钙蛋白(cTn)深入研究,无论是对心肌的特异性还是诊断敏感性,CK-MB的作用受到越来越多人的质疑。cTn被认为是目前最好的确定标志物,正逐步取代CK-MB成为AMI的诊断“金标准”。检测238例临床样本,灵敏度为97.5%,特异性为99.15%,其中有4例不符的样本都是在临界值附近属于灰区样本。
目前除了罗氏有成熟的化学发光检测试剂外,其他公司大部分都是有cTnI检测试剂而较少有cTnT检测试剂,价格昂贵。虽然国内已有一些公司已经研发出一些利用荧光免疫层析法和胶体金免疫层析法的检测试剂,但是在灵敏度还未能达到要求,而化学发光免疫分析它具有更高的灵敏度、更宽的线性范围、更好的重复性及更容易实现高通量的检测[24-25]。故研究国产心肌肌钙蛋白T定量发光检测试剂盒已经迫在眉睫。
总之,本研究建立的心肌肌钙蛋白T的全自动管式化学发光免疫检测试剂是一种准确、可靠、可定量、高通量的检测方法,有利于国内各级医院以及临床单位广泛开展cTnT指标检测,有利于提高我国对急性心肌梗死(AMI)病人进行早期诊断和治疗,降低病人的死亡风险。
参考文献
| [1] | World Health Organization. Report of the Joint International Society and Federation of Cardiology/World Health Organization Task Force on Standardization of Clinical Nomenclature. Nomenclature and criteria for diagnosis of ischemic heart disease.Circulation, 1979, 59: 607–609.DOI: 10.1161/01.CIR.59.3.607 |
| [2] | Thygesen K, Alpert JS. White HD on behalf of the joint ESC/ACCF/AHA/WHF task force for redefinition of myocardial infarction.JACC, 2007, 50: 2173–2195.DOI: 10.1016/j.jacc.2007.09.011 |
| [3] | Huang JF, Zhang XF, Chen PJ. Values of D-dimer, cTnT and myocardial enzymogram detections in the diagnosis of acute myocardial infarction.Int J Lab Med, 2015, 36(10): 1325–1326, 1329.(in Chinese). 黄建锋, 张小锋, 陈丕绩. D-二聚体、cTnT及心肌酶谱检测在急性心肌梗死诊断中的价值.国际检验医学杂志, 2015, 36(10): 1325-1326, 1329. |
| [4] | Hu XB, Xiang XJ, Guo XC, et al. Significance investigation of high-sensitivity cardiac troponin T for viral myocarditis in children.Labor Med, 2014, 29(4): 307–311.(in Chinese). 胡孝彬, 向小节, 郭晓聪, 等. 高敏肌钙蛋白T对儿童病毒性心肌炎诊断价值探讨.检验医学, 2014, 29(4): 307-311. |
| [5] | Lin HM, Sun QK, Hu LY. Clinical significance of NT-proBNP, cTnT, hs-CRP mesurements in patients with chronic heart failure.Int J Lab Med, 2013, 34(15): 1965–1966.(in Chinese). 林慧铭, 孙全昆, 胡礼仪. 慢性心衰患者血NT-proBNP、cTnT、hs-CRP检测的临床意义.国际检验医学杂志, 2013, 34(15): 1965-1966. |
| [6] | Kitamura M, Hata N, Takayama T, et al. High-sensitivity cardiac troponin T for earlier diagnosis of acute myocardial infarction in patients with initially negative troponin T test-comparison between cardiac markers.J Cardiol, 2013, 62(6): 336–342.DOI: 10.1016/j.jjcc.2013.06.005 |
| [7] | Roberts A. Biomarkers: hs-cTnT measurement to rule out MI.Nat Rev Cardiol, 2014, 11: 311. |
| [8] | Heeschen C, Hamm CW, Goldmann BU, et al. for PRISM study investigators. Troponin concentrations for stratification of patients with acute coronary syndromes in relation to therapeutic efficacy of tirofiban.Lancet, 1999, 354: 1757–1762.DOI: 10.1016/S0140-6736(99)10285-X |
| [9] | Masson S, Pirelli S, Pulitano G, et al. Circulating markers of myocyte injury predict first recurrence of atrial fibrillation.New Orleans: AHA, 2008, 11: 8–12. |
| [10] | Lauer B, Niederau C, Kühl U, et al. Cardiac troponin T in patients with clinically suspected myocarditis.JACC, 1997, 30(5): 1354–1359.DOI: 10.1016/S0735-1097(97)00317-3 |
| [11] | Swaanenburg JCJM, Klaase JM, DeJongste MJL, et al. Troponin I, troponin T, CKMB-activity and CKMB-mass as markers for the detection of myocardial contusion in patients who experienced blunt trauma.Clin Chim Acta, 1998, 272(2): 171–181.DOI: 10.1016/S0009-8981(98)00014-X |
| [12] | Giannitsis E, Müller-Bardorff M, Kurowski V, et al. Independent prognostic value of cardiac troponin T in patients with confirmed pulmonary embolism.Circulation, 2000, 102(2): 211–217.DOI: 10.1161/01.CIR.102.2.211 |
| [13] | Herman EH, Lipshultz SE, Rifai N, et al. Use of cardiac troponin T levels as an indicator of doxorubicin-induced cardiotoxicity.Cancer Res, 1998, 58(2): 195–197. |
| [14] | Harlow E, Lane D. Monoclonal antibodies//Harlow E, Lane D, Eds. Antibodies: A Laboratory Mannual. New York: Cold Spring Harbor Laboratory Press, 1998: 139-312. |
| [15] | Liu PG, Li GQ, Chen YX, et al. Chemiluminescent immunoassay for high-sensitivity C-reactive protein.Chin J Biotech, 2010, 26(8): 1150–1156.(in Chinese). 刘平果, 李国强, 陈毅歆, 等. 一种定量检测人血清高敏C反应蛋白的化学发光免疫方法.生物工程学报, 2010, 26(8): 1150-1156. |
| [16] | Liu YN, Li XY, Li ZH, et al. Preparation and identification of monoclonal antibodies against infectious bursal disease virus (IBDV) VP4.Chin J Biotech, 2014, 30(11): 1660–1668.(in Chinese). 柳亚楠, 李夏莹, 李忠华, 等. 传染性法氏囊病病毒VP4蛋白单克隆抗体的制备及鉴定.生物工程学报, 2014, 30(11): 1660-1668. |
| [17] | Tijssen P, Kurstak E. Highly efficient and simple methods for the preparation of peroxidase and active peroxidase-antibody conjugates for enzyme immunoassays.Anal Biochem, 1984, 136(2): 451–457.DOI: 10.1016/0003-2697(84)90243-4 |
| [18] | Guo YL, Chen YX, Huang DD, et al. Preparation and selection of the monoclonal antibody used for kits to detect the p24 antigen of HIV-1.Chin J Zoon, 2007, 23(6): 527–531.(in Chinese). 郭永利, 陈毅歆, 黄德党, 等. 适于HIV-1 p24抗原检测试剂的单抗制备与筛选.中国人兽共患病学报, 2007, 23(6): 527-531. |
| [19] | Chen LY, Lin HJ, Weng ZX, et al. Development of detection kit for T cell infected with Mycobacterium tuberculosis based on full-automatic chemiluminescence immune analyzer.J Mol Diagn Ther, 2015, 7(5): 296–301.(in Chinese). 陈鹭颖, 林海军, 翁祖星, 等. 基于全自动管式化学发光免疫检测系统的人结核感染T细胞检测方法的建立.分子诊断与治疗杂志, 2015, 7(5): 296-301. |
| [20] | Qi JL, Shao J, Peng K, et al. Preparation of monoclonal antibodies against neutrophil gelatinase-associated lipocalin (NGAL) and development of an antibody-based chemiluminescence immune quantification assay.Chin J Biochem Drugs, 2015, 35(4): 5–9.(in Chinese). 齐家龙, 劭佳, 彭宽, 等. 中性粒细胞明胶酶相关脂质运载蛋白的单克隆抗体制备及化学发光免疫定量检测试剂研究.中国生化药物杂志, 2015, 35(4): 5-9. |
| [21] | Feng HZ, Biesiadecki BJ, Yu ZB, et al. Restricted N-terminal truncation of cardiac troponin T: a novel mechanism for functional adaptation to energetic crisis.J Physiol, 2008, 586(14): 3537–3550.DOI: 10.1113/jphysiol.2008.153577 |
| [22] | Huang CH, Yuan Q, Chen PJ, et al. Influence of mutations in hepatitis B virus surface protein on viral antigenicity and phenotype in occult HBV strains from blood donors.J Hepatol, 2012, 57(4): 720–729.DOI: 10.1016/j.jhep.2012.05.009 |
| [23] | Müller-Bardorff M, Hallermayer K, Schr der A, et al. Improved troponin T ELISA specific for cardiac troponin T isoform: assay development and analytical validation.Clin Chem, 1997, 43(3): 458–466. |
| [24] | Gámiz-Gracia L, Garc??a-Campa?a AM, Soto-Chinchilla JJ, et al. Analysis of pesticides by chemiluminescence detection in the liquid phase.TrAC Trends Analyt Chem, 2005, 24(11): 927–942.DOI: 10.1016/j.trac.2005.05.009 |
| [25] | Arakawa H, Maeda M, Tsuji A. Enzyme immunoassay of cortisol by chemiluminescence reaction of luminol-peroxidase.Bunseki Kagaku, 1977, 26(5): 322–327.DOI: 10.2116/bunsekikagaku.26.322 |
