王丹丹, 殷志秋, 孙丽, 刘鑫蓓, 刘佳凝, 庞诗琪, 解志红


山东农业大学资源与环境学院, 山东 泰安 271000
收稿日期:2021-03-20;修回日期:2021-05-11;网络出版日期:2021-10-12
基金项目:国家自然科学基金(31570063,31870020);NSFC-山东省联合基金重点支持项目(U1806206);山东农业大学引进人才科研启动基金(010/72091)
*通信作者:解志红, E-mail: zhihongxie211@163.com.
摘要:[目的] 长期连作障碍严重降低花生生产的产量及品质,根际促生菌可有效降解土壤中自毒化感物质、抑制植物病原菌生长及促进植物生长,从而有效缓解连作障碍问题。筛选优化具有缓解花生连作障碍能力的多功能根际益生微生物,验证其益生作用能力,为根际促生菌株在连作障碍中的应用提供理论依据及技术支持。[方法] 采集连作12年地块花生根际土壤,利用以酚酸为唯一碳源的筛选培养基获得具有酚酸自毒化感物质降解及利用能力的根际促生菌,通过16S rRNA基因测序进行系统发育分析,确定根际促生菌菌株的分类地位,并验证其对植物病原菌生长抑制能力及解磷、解钾、产植物激素吲哚乙酸能力。[结果] 从连作12年的花生发病土壤中获得7株可高效降解酚酸类自毒物质且降解底物多样的根际微生物菌株,经16S rRNA测序比对分别为克雷伯氏菌B02 (Klebsiella sp.B02)、克雷伯氏菌B07 (Klebsiella sp.B07)、克雷伯氏菌B15 (Klebsiella sp.B15)、芽孢杆菌B28 (Bacillus sp.B28)、不动杆菌P09 (Acinetobacter sp.P09)、布鲁氏杆菌VA05 (Brucella sp.VA05)、芽孢杆菌CA04 (Bacillus sp.CA04)。促生实验表明,7株高效降解菌株均可以合成吲哚乙酸,3株具有固氮能力,4株菌具有解有机磷及无机磷的能力,2株菌具有解钾的能力。拮抗实验表明,2株菌可以抑制多种植物病原菌的生长,均为芽孢杆菌属。选取Bacillus sp.B28初步验证对花生种子萌发及幼苗生长的影响,结果表明根际促生菌可显著缓解酚酸对花生种子发芽的抑制,并明显促进花生幼苗的生长。[结论] 获得多株具有降解酚酸类自毒化感物质、抑制植物病原菌生长及促进植物生长的多功能花生根际促生菌,更好地为根际促生菌在连作障碍治理中的有效应用提供菌株及技术支持。
关键词:花生连作障碍根际促生菌功能鉴定
Isolation and identification of peanut plant-growth promoting rhizobacteria with the potential to alleviate continuous cropping obstacle
Dandan Wang, Zhiqiu Yin, Li Sun, Xinbei Liu, Jianing Liu, Shiqi Pang, Zhihong Xie


College of Resources and Environment, Shandong Agricultural University, Tai'an 271000, Shandong Province, China
Received: 20 March 2021; Revised: 11 May 2021; Published online: 12 October 2021
*Corresponding author: Zhihong Xie, E-mail: zhihongxie211@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (31570063, 31870020), by the NSFC-Shandong Joint Fund Key Projects (U1806206) and by the Scientific Research Foundation of Shandong Agricultural University (010/72091)
Abstract: [Objective] Continuous cropping obstacle reduced the production and quality of agricultural products, and application of rhizosphere beneficial microbes with the function of degrading autotoxic substances, inhibiting the growth of plant pathogen and promoting plant growth was an important strategy for suppression of continuous cropping obstacle. Screening and revealing the function of peanut plant-growth promoting rhizobacteria with the potential to alleviate soil degeneration caused by continuous cropping obstacle, would provide scientific evidence for the application in agricultural produce. [Methods] Screening high-efficiency plant growth-promoting rhizobacteria with function of degrading autotoxic substances, inhibiting the growth of plant pathogen and promoting plant growth from 12-year peanut filed with continuous cropping obstacle, and the phylogenetic analysis was performed by 16S rRNA gene sequencing to determine the taxonomic status. [Results] 7 plant growth-promoting rhizobacteria with high-efficiency in degrading autotoxic substances were isolated from the rhizosphere from 12-year continuous cropping peanut soil, and according to phylogenetic analysis, identified as Klebsiellasp. B02, Klebsiella sp. B07, Klebsiella sp. B15, Bacillus sp. B28, Acinetobacter sp. P09, Brucella sp. VA05 and Bacillus sp. CA04. The result of growth-promoting experiments indicated that 7 strains showed the ability of IAA-producing, 3 strains showed the ability of nitrogen-fixing, 4 strains showed the ability of phosphate solubilization, 2 strains showed the activity of potassium solubilizing. The result of antagonistic activity showed that 2 strains could against to plant pathogen, and belong to the specie of Bacillus genus. Bacillus sp. B28 was selected for peanut pot experiment, the results showed that strain Bacillus sp. B28 can significantly alleviate the inhibition of phenolic acid on peanut seed germination and promote the growth of peanut seedling. [Conclusion] This research screened plant growth-promoting rhizobacteria with high-efficiency in alleviate continuous cropping obstacles, provided strains and scientific evidence for the application in agricultural produce.
Keywords: peanutcontinuous cropping obstacleplant growth-promoting rhizobacteriafunction research
花生是我国主要油料经济作物,伴随现代农业技术发展与革新,经济作物的种植模式开始向规模化及集约化发展,花生产业的种植面积及单位产量也在持续增长,但同时也带来了连作障碍,花生连作障碍已成为制约花生产业可持续发展的重要影响因子[1-2]。
连作障碍导致当季作物损失巨大,严重的几乎绝产,同时还降低了农产品的质量与安全性,如何实现安全有效地缓解连作障碍是目前亟需解决的问题。传统治理措施包括选用改善栽培制度、土壤熏蒸或者增施消石灰,这些措施使连作障碍暂时得以缓解,但是对于高度规模化和集约化的生产模式并不能彻底解决连作问题,甚至会带来环境污染和食品安全问题[3]。根际区域微生物数量种类丰富且功能多样[4-5],而根际促生菌(plant growth promoting rhizobacteria,PGPR)是指附着于植物根际土壤颗粒中,与植物根系相互影响、相互作用、相互促进,对植物健康生长发挥着重要作用的一类根际微生物,有望成为一种健康有效治理连作障碍的措施[6-8]。
连作障碍是植物与土壤两个系统中多个因素相互作用的结果,其主要是由于土壤自毒化感物质积累、土壤微生物区系失衡及土壤理化性质恶化引起的[9-10]。酚酸类化感物质是广泛存在于植物中的一类重要的次生代谢产物,常被认为是根系分泌物中主要的自毒化感物质,对植物种子发芽、生长都有抑制作用,还能造成作物幼苗根系细胞膜受到损伤,影响作物健康生长。近年来,科研人员利用以酚酸类物质作为唯一碳源的培养基,已从自然环境中获得多种具有酚酸降解功能的细菌,在缓解连作障碍中具有较好的实际应用价值[11-12]。植物土传病害也是导致连作障碍出现影响农业生产的主要因素之一,传统对其防治主要以化学防治为主,施用化学农药虽有一定效果,但价格昂贵且长期使用会增加病原菌的抗性并造成环境的污染。根际促生菌在生长代谢过程中可产生多种具有抑菌活性的活性物质,这些物质可以有效地抑制甚至可以杀死植物病原菌,且对环境无害,因此利用微生物及其所产生的抗菌物质进行植物病害生物防治具有很大的应用价值和潜力[13-14]。连作障碍还会导致土壤理化性质恶化,不利于作物对养分的利用,而根际促生菌通过多种促生机制促进植物生长。根际促生菌首先可以通过固氮、解磷及解钾等作用提高土壤中养分的含量及利用率,为植物提供更多可利用的营养元素;其次可以通过产生植物类激素促进植物生长[14]。
施用根际促生菌是治理连作障碍的重要方向,而寻找有效的可以使用的多功能根际促生菌为最重要的部分,本研究从12年花生连作障碍根际土壤中运用选择培养基筛选有酚酸自毒化感物质降解功能的菌株,并测定了菌株对植物病原菌生长抑制、解磷、解钾及产IAA (吲哚乙酸,indole-3-acetic acid)的能力。本研究结果将为开发缓解连作障碍菌剂提供菌种资源,并为根际促生菌治理连作障碍机理研究奠定前期基础。
1 材料和方法 1.1 材料
1.1.1 供试土壤: 样品于2020年5月取自青岛市12年连续花生种植地块,将花生整株采集,去除根周围的大块附着土,收集根系1 cm内的根际土4 ℃保存。
1.1.2 培养基、主要试剂和仪器: LB培养基(g/L):Tryptone 10,Yeast extract 5,NaCl 10,pH 7.0。PDA培养基(g/L):马铃薯200,葡萄糖20,pH 7.0。NA培养基(g/L):蛋白胨10,牛肉膏3,氯化钠5,pH 7.0。无机盐培养基(g/L):KH2PO4 2,(NH4)2SO4 2,Na2HPO4 1.3,葡萄糖1,NaCl 5,pH 7.0。Ashby无氮固体培养基(g/L):甘露醇10.0,KH2PO4 0.2,MgSO4 0.2,NaCl 0.2,CaSO4 0.1,CaCO3 5.0,pH 7.0。卵黄固体培养基(g/L):葡萄糖10.0,(NH4)2SO4 0.5,NaCl 0.3,KCl 0.3,FeSO4·7H2O 0.03,MnSO4·4H2O 0.03,蛋黄卵磷脂0.2,CaCO3 5,Yeast extract 0.4,pH 7.0。无机磷固体培养基(g/L):Ca3(PO4)2 5,(NH4)2SO4 0.5,NaCl 0.3,KCl 0.3,FeSO4·7H2O 0.003,MnSO4·4H2O 0.003,MgSO4·7H2O 0.3,葡萄糖10,pH 7.0。缺钾固体培养基(g/L):蔗糖5,Na2HPO4 2,MgSO4·7H2O 0.005,FeCl3 0.005,CaCO3 0.1,钾长石粉1,pH 7.0。
Salkowski比色液(0.5 mol/L FeCl3与35%高氯酸1:5混匀)、16S扩增引物购自TaKaRa生物技术有限公司(大连)、高保真聚合酶Primers STAR HS DNA polymerase购自TaKaRa生物技术有限公司(大连)、基因组提取试剂盒购自Axygen生物技术有限公司(杭州)。
PCR仪购于赛默飞世尔科技(ThermoFisher),凝胶成像系统购于北京君意东方电泳设备有限公司,酶标仪购于美国伯腾仪器有限公司(BioTek);超净工作台购于苏州安泰空气技术有限公司;微生物培养箱购于上海龙跃仪器设备有限公司;摇床购于上海一恒科学仪器有限公司。
1.2 酚酸自毒物质降解菌的筛选 降解花生自毒物质微生物的分离主要包括富集、选择培养、纯化和驯化4个部分。
1.2.1 富集: 从连作12年的花生耕地中选取长势较好的花生植株,采集根际土壤,按1%将土壤接种于l000 mg/L苯甲酸的无机盐培养基中,35 ℃摇床180 r/min,使能够降解苯甲酸的菌株得到富集。同理富集可降解对羟基苯甲酸、水杨酸、肉桂酸、香草酸和香豆酸的微生物。
1.2.2 选择培养: 土壤悬液在摇床中培养10 d后稀释涂布,共设置10-1、10-2、10-3、10-4、10-5、10-6六个浓度梯度,涂布于LB培养基上,35 ℃培养。
1.2.3 纯化: 采用平板划线法,用接种环挑取单菌落并在LB固体培养基上画线培养,待菌落长成后观察其特征包括菌落的大小、颜色、透明度、粘度、形状、菌落边缘(光滑、锯齿状、波浪状、纤维状等)、表面光滑程度(光滑、粗糙、皱纹、同心环、辐射状)、隆起(凸、凹、平)、基质是否产生水溶性色素、荧光的有无等,若培养特征完全一致则为同一种菌,如否则需多次划线反复纯化。
1.2.4 驯化: 为获得高效降解菌株,在分离纯化之后对其进行驯化,按相同方法配无机盐培养基,将筛选得到的菌株再接回至无机盐培养基上,将酚酸自毒物质的浓度提高至5 g/L,部分能适应或者产生变异的微生物留下来,成为优势菌群。
1.3 降解菌的鉴定 采取提基因组DNA的方式扩增16S rRNA序列片段,扩增引物为:27F:AGAGTTTGATCMT GGCTCAG;1429R:TACGGYTACCTTGTTACGA CTT。
扩增结束后电泳检测PCR产物片段的长度和亮度,验证合格的送至测序公司测序,测序获得的16S rRNA序列片段在EZBioCloud网站上进行序列同源性比对分析。
1.4 自毒物质降解率测定 降解率测定分别以6种自毒物质为唯一碳源,将-80 ℃甘油管保存的根际促生菌菌种在LB固体培养基平板上划线活化,置于35 ℃培养箱培养12 h。挑取LB固体培养基平板上的单菌落接种于3 mL液体LB试管,35 ℃、170 r/min振荡培养12 h作为种子液。将种子液以1%的接种量转接至LB液体培养基中,35 ℃、180 r/min振荡培养至OD600为0.5,取1 mL OD600为0.5的菌液加入到49 mL无机盐培养液中(对照加入1 mL无菌水),培养液中以对应的自毒物质为唯一碳源,浓度为5 g/L,35 ℃摇床培养72 h,8000 r/min离心10 min,采用紫外可见分光光度法,取上清液测定对应自毒物质的最大吸收峰波长的吸光度值计算降解率(公式1)。
各物质的最大吸收波长分别为苯甲酸230 nm、对羟基苯甲酸246 nm、水杨酸298 nm、肉桂酸269 nm、香草酸250 nm、香豆酸268 nm。
 | 公式(1) |
解磷能力测定包含有机磷解磷能力及无机磷解磷能力测定:有机磷解磷能力测定采用卵黄固体培养基,无机磷解磷能力测定采用无机磷固体培养基,将目标根际促生菌接种于卵黄固体培养基/无机磷固体培养基上,35 ℃培养3 d,观察是否有溶磷圈出现。
解钾能力测定采用缺钾固体培养基,将目标根际促生菌接种于缺钾固体培养基上,35 ℃培养7 d,观察是否有溶钾圈出现。
IAA合生能力测定采用Salkowski法,将目标根际促生菌接种于含L-色氨酸(200 mg/L)的液体LB培养基中,35 ℃、170 r/min摇床培养4 d,菌液于4 ℃、8000 r/min条件下离心10 min,取上清液于酶标板中,加入等体积Salkowski比色液,黑暗条件下静置反应30 min后,迅速于530 nm下测定吸光度。
1.6 植物病原菌生长抑制实验 对真菌病原菌的生长抑制实验在PDA平板上进行,首先将病原菌接种到PDA培养基上,放置于30 ℃,待菌丝长直径约1 cm后,在距离菌丝边缘3 cm处接种目标根际促生菌,再将平板置于30 ℃培养箱中,直至病原菌菌丝长满整个平板。
对细菌病原菌的生长抑制实验在NA平板上进行,半固体培养基按1%的接种量加入细菌植物病原菌菌液(OD600=0.5),混合均匀后倒入无菌培养皿,培养基凝固接种根际促生菌,30 ℃培养3 d。
观察拮抗圈的大小,以此来检测目标根际促生菌对植物病原菌的生长抑制活性。
1.7 种子发芽实验 根际促生菌缓解酚酸抑制作物种子发芽实验,选取花生为实验对象,花生浸泡于70%酒精10 min后用无菌水清洗3遍完成消毒。设置3组实验:CK为空白对照,消毒后的花生种子置于含无菌水的培养皿中;处理T1为消毒后的种子置于含1 g/L的酚酸溶液中;T2处理在T1处理的基础上加入筛选到的酚酸降解细菌(细菌在OD600为0.5时离心收集菌体,菌体用无菌水清洗3次后重悬,接种量为1%)。每个处理10粒种子,设置3次重复,培养4 d。
 |
1.9 数据处理及分析 利用Microsoft Excel和Origin 9.1软件进行数据分析及图表制作。
2 结果和分析 2.1 酚酸高效降解菌的筛选 通过高浓度酚酸自毒物质驯化后,共计分离得到131株菌株,通过对酚酸降解菌自毒物质降解率测定,有51株根际促生菌对各自酚酸自毒物质降解率高于50%。利用底物广谱实验探究所筛降解率高的51株根际促生菌对于其他自毒物质的降解效果,实验结果如图 1所示,表明有14株菌对6种酚酸都有降解能力(B01、B02、B03、B07、B15、B28、P04、P09、P15、SA06、VA05、VA12、CA01、CA04),其中7株B02、B07、B15、B28、P09、VA05、CA04对苯甲酸、对羟基苯甲酸、水杨酸、肉桂酸、香草酸、香豆酸降解效率均超过50%。
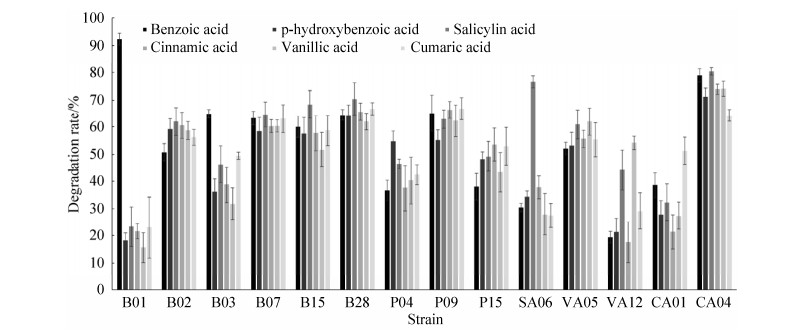 |
| 图 1 14株根际促生菌对6种酚酸降解率 Figure 1 The degradation rates of six phenolic acids by 14 plant growth-promoting rhizobacteria. |
| 图选项 |
2.2 酚酸高效降解菌的鉴定 对分离筛选得到的7株高效降解菌株的16S rRNA基因序列通过NCBI数据库完成分子生物学鉴定,其结果如表 1所示。从表 1中的结果可以看到,7株高效降解菌株与其相似菌的相似度均超过99%,分别为:克雷伯氏菌B02 (Klebsiella sp. B02)、克雷伯氏菌B07 (Klebsiella sp. B07)、克雷伯氏菌B15 (Klebsiella sp. B15)、芽孢杆菌B28 (Bacillus sp. B28)、不动杆菌P09 (Acinetobacter sp. P09)、布鲁氏杆菌VA05 (Brucella sp. VA05)、芽孢杆菌CA04 (Bacillus sp. CA04)。
表 1. 菌株的分类 Table 1. Classification of strains
| Strains | Top-hit taxon | Top-hit strain | Accession No. of similar strains | Similarity/% | Completeness/% |
| B02 | Klebsiella variicola | SB5531 (T) | CAAHGN010000012 | 99.93 | 96.5 |
| B07 | Klebsiella variicola | SB5531 (T) | CAAHGN010000012 | 99.93 | 96.6 |
| B15 | Klebsiella variicola | SB5531 (T) | CAAHGN010000012 | 99.86 | 95.8 |
| B28 | Bacillus halotolerans | ATCC 25096 (T) | LPVF01000003 | 99.93 | 94.6 |
| P09 | Acinetobacter pittii | CIP 70.29 (T) | APQP01000001 | 99.79 | 95.9 |
| VA05 | Brucella intermedia | LMG 3301 (T) | ACQA01000003 | 100.00 | 97.5 |
| CA04 | Bacillus halotolerans | ATCC 25096 (T) | LPVF01000003 | 99.44 | 97.1 |
表选项
2.3 根际促生菌促生特性 定殖在根际的微生物通常会发挥其促进植物生长的特性,如调节植物激素水平、固氮、解磷、解钾等,为了进一步探究所筛选菌株的促生特性,对7株高效降解菌株各项促生能力进行检测,结果如表 2所示。
表 2. 促生活性检测 Table 2. Promoting growth feature test
| Strains | IAA production/(mg/L) | Nitrogen fixation | Phosphorus solution | Potassium solution |
| Klebsiella sp. B02 | 9.56±0.08 | + | + | ? |
| Klebsiella sp. B07 | 8.33±0.15 | + | + | + |
| Klebsiella sp. B15 | 9.21±0.08 | + | + | + |
| Bacillus sp. B28 | 9.58±0.08 | ? | ? | ? |
| Acinetobacter sp. P09 | 6.66±0.07 | ? | + | ? |
| Brucella sp. VA05 | 7.82±0.15 | ? | + | ? |
| Bacillus sp. CA04 | 8.64±0.21 | ? | ? | ? |
| +: strain has the related capacity; ?: strain does not have the related capacity. | ||||
表选项
定量检测植物根际促生菌的产IAA能力,7株高效降解菌株均可以合成植物激素IAA,其中菌株Bacillus sp. B28在相同条件下分泌的IAA最多,达到9.58 mg/L;其次为Klebsiella sp. B02,分泌量为9.56 mg/L;7株高效降解菌中IAA分泌最少的为Acinetobacter sp. P09,但也达到了6.66 mg/L。
定性检测7株高效降解菌固氮、解磷及解钾的能力,其中Klebsiella sp. B02、Klebsiella sp. B07、Klebsiella sp. B15可在Ashby无氮固体培养基正常生产,证明这3株根际促生菌具有固氮能力;有4株菌表现出解有机磷及无机磷的能力,分别为Klebsiella sp. B02、Klebsiella sp. B07、Klebsiella sp. B15及Acinetobacter sp. P09;有2株菌表现出解钾的能力,为Klebsiella sp. B07、Klebsiella sp. B15。
2.4 根际促生菌抑制植物病原菌生长特性 选取4株植物病原真菌及1株植物病原细菌进行拮抗实验,结果如表 3所示。Bacillus sp. B28及Bacillus sp. CA04对5种常见的植物病原菌生长都有抑制能力,包括黄曲霉菌(Aspergillus flavus)、疫霉菌(Phytophthora capsici)、灰霉菌(Botrytis cinerea)、尖孢镰刀菌(Fusariu moxysporum)及劳尔氏菌(Ralstonia solanacearum),Klebsiella sp. B07仅对黄曲霉菌表现出了较弱的抑制效果,其余4株根际促生菌Klebsiella sp. B02、Klebsiella sp. B15、Acinetobacter sp. P09及Brucella sp. VA05没有拮抗植物病原菌能力。
表 3. 植物病原菌生长抑制实验 Table 3. Antagonistic assay against plant pathogens
| Strains | Aspergillus flavus | Phytophthora capsici | Botrytis cinerea | Fusariu moxysporum | Ralstonia solanacearum |
| Klebsiella sp. B02 | ? | ? | ? | ? | ? |
| Klebsiella sp. B07 | W | ? | ? | W | ? |
| Klebsiella sp. B15 | ? | ? | ? | ? | ? |
| Bacillus sp. B28 | ++ | + | ++ | ++ | + |
| Acinetobacter sp. P09 | ? | ? | ? | ? | ? |
| Brucella sp. VA05 | ? | ? | ? | ? | ? |
| Bacillus sp. CA04 | ++ | + | ++ | ++ | ++ |
| ++: strong inhibition (the radius > 2 mm); +: inhibition (the radius between 0.5 mm and 2 mm); W: week inhibition (the radius < 0.5 mm); ?: no inhibition. | |||||
表选项
2.5 Bacillus sp. B28对花生种子萌发及幼苗生长的影响 高效降解菌Bacillus sp. B28对6种常见酚酸类自毒化感物质降解率均超过50%,另外Bacillus sp. B28的IAA合成能力最强,且对多种植物病原菌都有很强的拮抗能力,因此选取B28验证其缓解酚酸(苯甲酸)抑制花生种子萌发及促进花生幼苗生长的能力。
2.5.1 Bacillus sp. B28缓解酚酸对花生种子萌发的抑制: 经过不同处理后花生种子萌发的能力如图 2所示,各处理在第2天开始种子发芽,空白对照发芽率达80%,苯甲酸处理实验组T1的种子发芽率仅为10%,而添加B28可显著缓解酚酸对花生种子萌发的副作用,实验组T2的发芽率恢复至56.7%,随着种植时间延长,T2的发芽率逐渐升高,在处理第4天与空白对照恢复一致。本实验结果表明苯甲酸显著抑制花生种子的萌发,而根际促生菌Bacillus sp. B28可有效缓解苯甲酸对种子萌发的影响。
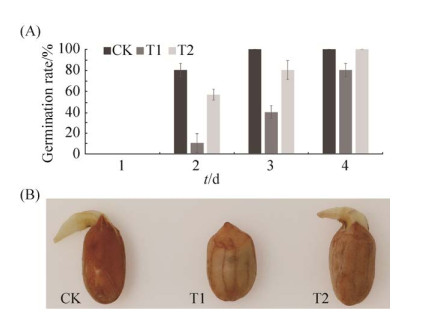 |
| 图 2 Bacillus sp. B28缓解苯甲酸对花生种子萌发的抑制 Figure 2 Bacillus sp. B28 relieves the inhibition of benzoic acid on peanut seed germination. A: the indexes of peanut seed germination under different treatment; B: the difference of peanut seed germination (seeds of the second day). |
| 图选项 |
2.5.2 Bacillus sp. B28促进花生幼苗生长: 幼苗盆栽实验结果如表 4所示,花生植株生长的对比如图 3所示,盆栽基质中添加根际促生菌B28对花生的鲜重、干重、株高、根长影响显著,花生鲜重增加30.85%,干重增加57.60%,地上部分苗高增加12.55%,地下部分根长增加37.48%。室内盆栽试验测定菌株对植物生长作用影响表明,Bacillus sp. B28对花生有明显的促进生长作用。
表 4. Bacillus sp. B28对花生生物量的影响 Table 4. The effects of Bacillus sp. B28 on peanut growth
| Strains | Fresh weight/g | Dry weight/g | Shoot length/cm | Root length/cm |
| CK | 5.646±0.349 b | 0.566±0.059 b | 18.80±0.689 b | 10.78±0.626 b |
| Bacillus sp. B28 | 7.388±0.521 a | 0.892±0.039 a | 21.16±0.321 a | 14.82±0.455 a |
| a, b: significant difference at P < 0.05 level. | ||||
表选项
 |
| 图 3 Bacillus sp. B28花生盆栽促生实验 Figure 3 The peanut pot experiment of Bacillus sp. B28. |
| 图选项 |
3 讨论和结论 根际微生物被看作植物的第二基因组,对植物的生长和健康发挥着重要作用[4]。根际促生菌可通过以下几个方面缓解连作障碍,保护作物健康生长:(1) 降解自毒化感物质。在连作障碍土壤中酚酸类自毒化感物质往往是几种甚至是十几种共同存在的[15],花生连作障碍土壤中常见的有对羟基苯甲酸、香草酸、香豆酸、苯甲酸、肉桂酸、邻苯二甲酸、阿魏酸等[11, 16-17],其降解是多种微生物及多种降解途径共同发挥作用,因此筛选高效且降解底物多样的根际促生菌,是利用生物方法治理作物连作障碍的关键[18-19]。(2) 拮抗植物病原菌。根际环境微生物数量众多,微生物之间竞争异常激烈,根际促生菌基因组中相对大比例的基因用来编码合成脂肽和聚酮等活性物质以拮抗各种真菌和细菌,增强其竞争优势[20-21],这些物质可以抑制甚至杀死植物病原菌,从而有效抑制连作障碍中土传病害的发生[22]。(3) 促进作物生长。根际促生菌一方面可以提高土壤中可利用养分的含量,另一方面可以通过产生植物类激素促进植物生长,如合成植物激素IAA[23]。
根际促生菌可通过多种途径缓解花生连作障碍,对作物健康生长息息相关[24-26],因此,筛选获得高效的多功能根际促生菌具有重要意义,但是根际促生菌在实际应用过程中仍存在着有效菌株在土壤中存活期短、效果不稳定、作用效果单一等问题,制约着根际促生菌在连作障碍治理中的应用,因此筛选效果稳定的微生物菌群是生物方法治理成功的关键。目前,利用以酚酸类自毒化感物质为唯一碳源的筛选培养基从自然环境中已获得多种具有酚酸降解功能的根际促生菌,包括芽孢杆菌属(Bacillus sp.)、固氮菌属(Azotobacter sp.)、假单胞菌属(Pseudomonas sp.)、葡萄球菌属(Staphylococcus sp.)、不动杆菌属(Acinetobacter sp.)、微小杆菌属(Exiguobacterium sp.)等[12, 27-28],颜艳伟等也对连作花生根际土壤中优势微生物菌群进行了系统的分离鉴定,为根际促生菌分离提供了参考依据[29]。这些根际微生物不仅可降解酚酸类自毒化感物质且降解底物多样,在缓解连作障碍中具有较好的实际应用价值,但是对于其他益生功能如对植物病原菌拮抗能力及促生能力报道较少,没有挖掘根际促生菌的多功能性。
本研究从连作12年花生根际土壤中筛选根际促生菌,可适应连作障碍土壤极端环境,提高外源菌剂的存活率从而发挥作用。通过降解率及底物多样性实验,获得7株高效降解菌株,其中2株为革兰氏阳性菌,芽孢杆菌B28及芽孢杆菌CA04;5株为革兰氏阴性菌,克雷伯氏菌B02、克雷伯氏菌B07、克雷伯氏菌B15、不动杆菌P09及布鲁氏杆菌VA05。促生实验表明,7株菌株均有合成IAA的能力,但对于解磷、解钾及固氮,5株革兰氏阴性菌表现出了一定的能力,而2株革兰氏阳性菌均没有解磷、解钾及固氮能力。拮抗实验表明,2株革兰氏阳性菌对常见的植物病原菌均表现出了较强的生长抑制活性,而5株革兰氏阴性菌对植物病原菌基本没有拮抗能力。
本研究对根际促生菌自毒化感物质降解、植物病原菌生长抑制及促进花生生长特性只进行了基础实验及分析,作用机理仍需进一步研究。通过高效降解菌拮抗及促生实验发现,不同种属功能差异较明显,没有任何单一根际促生菌能包含所有期望的益生功能,因此,在筛选根际促生菌时,应包含多个种属,防止获得的菌株功能单一,限制其应用范围。也可将多个具有自毒化感物质降解、抑制植物病原菌生长及促生能力的根际促生菌配制高效多功能复合菌剂,从而提高根际促生菌对连作障碍的综合治理效果。
References
| [1] | Wan SB, Zhang JL. Discussion on new ways to reduce cost and increase efficiency of peanut industry in China. Chinese Journal of Oil Crop Sciences, 2019, 41(5): 657-662. (in Chinese) 万书波, 张佳蕾. 中国花生产业降本增效新途径探讨. 中国油料作物学报, 2019, 41(5): 657-662. |
| [2] | Tang CH, Guo F, Zhang JL, Yang S, Meng JJ, Geng Y, Wang JG, Li XG, Wan SB. Research progress on mechanism of peanut continuous cropping obstacle and its mitigation countermeasures. Journal of Peanut Science, 2019, 48(1): 66-70. (in Chinese) 唐朝辉, 郭峰, 张佳蕾, 杨莎, 孟静静, 耿耘, 王建国, 李新国, 万书波. 花生连作障碍发生机理及其缓解对策研究进展. 花生学报, 2019, 48(1): 66-70. |
| [3] | Chen T, Lin S, Wu LK, Lin WX, Sampietro DA. Soil sickness: current status and future perspectives. Allelopathy, 2015, 36(2): 167-195. |
| [4] | Berendsen RL, Pieterse CMJ, Bakker PAHM. The rhizosphere microbiome and plant health. Trends in Plant Science, 2012, 17(8): 478-486. DOI:10.1016/j.tplants.2012.04.001 |
| [5] | Sasse J, Martinoia E, Northen T. Feed your friends: do plant exudates shape the root microbiome?, 2018, 23(1): 25-41. Trends in Plant Science, 2018, 23(1): 25-41. DOI:10.1016/j.tplants.2017.09.003 |
| [6] | Zhou WJ, Lv DG, Qin SJ. Research progress in interaction between plant and rhizosphere microorganism. Journal of Jilin Agricultural University, 2016, 38(3): 253-260. (in Chinese) 周文杰, 吕德国, 秦嗣军. 植物与根际微生物相互作用关系研究进展. 吉林农业大学学报, 2016, 38(3): 253-260. |
| [7] | Backer R, Rokem JS, Ilangumaran G, Lamont J, Praslickova D, Ricci E, Subramanian S, Smith DL. Plant growth-promoting rhizobacteria: context, mechanisms of action, and roadmap to commercialization of biostimulants for sustainable agriculture. Frontiers in Plant Science, 2018, 9: 1473. DOI:10.3389/fpls.2018.01473 |
| [8] | Tao CY, Li R, Xiong W, Shen ZZ, Liu SS, Wang BB, Ruan YZ, Geisen S, Shen QR, Kowalchuk GA. Bio-organic fertilizers stimulate indigenous soil Pseudomonas populations to enhance plant disease suppression. Microbiome, 2020, 8(1): 1-14. DOI:10.1186/s40168-019-0777-4 |
| [9] | Li TL, Yang LJ. Overcoming continuous cropping obstacles—the difficult problem. Scientia Agricultura Sinica, 2016, 49(5): 916-918. (in Chinese) 李天来, 杨丽娟. 作物连作障碍的克服——难解的问题. 中国农业科学, 2016, 49(5): 916-918. |
| [10] | Schandry N, de Becker C. Allelopathic plants: models for studying plant-interkingdom interactions. Trends in Plant Science, 2020, 25(2): 176-185. DOI:10.1016/j.tplants.2019.11.004 |
| [11] | Zhang CY, Yu CY, Gao JS. Isolation and identification of a phenolic acids-degrading bacterium from peanut soil. Journal of Anhui Agricultural Sciences, 2020, 48(5): 93-95, 99. (in Chinese) 张春杨, 于春雨, 高金山. 花生土壤酚酸降解菌的分离和鉴定. 安徽农业科学, 2020, 48(5): 93-95, 99. DOI:10.3969/j.issn.0517-6611.2020.05.025 |
| [12] | Wang Y, Zhang W, Zhang Z, Wang W, Xu S, He X. Isolation, identification and characterization of phenolic acid-degrading bacteria from soil. Journal of Applied Microbiology, 2021, 131(1): 208-220. DOI:10.1111/jam.14956 |
| [13] | Niu B, Wang WX, Yuan ZB, Sederoff RR, Sederoff H, Chiang VL, Borriss R. Microbial interactions within multiple-strain biological control agents impact soil-borne plant disease. Frontiers in Microbiology, 2020, 11: 585404. DOI:10.3389/fmicb.2020.585404 |
| [14] | Oleńska E, Ma?ek W, Wójcik M, Swiecicka I, Thijs S, Vangronsveld J. Beneficial features of plant growth-promoting rhizobacteria for improving plant growth and health in challenging conditions: a methodical review. Science of the Total Environment, 2020, 743: 140682. DOI:10.1016/j.scitotenv.2020.140682 |
| [15] | Li ZH, Wang Q, Ruan X, Pan CD, Jiang DA. Phenolics and plant allelopathy. Molecules: Basel, Switzerland, 2010, 15(12): 8933-8952. DOI:10.3390/molecules15128933 |
| [16] | Li PD, Wang XX, Li YL, Wang HW, Liang FY, Dai CC. The contents of phenolic acids in continuous cropping peanut and their allelopathy. Acta Ecologica Sinica, 2010, 30(8): 2128-2134. (in Chinese) 李培栋, 王兴祥, 李奕林, 王宏伟, 梁飞燕, 戴传超. 连作花生土壤中酚酸类物质的检测及其对花生的化感作用. 生态学报, 2010, 30(8): 2128-2134. |
| [17] | Liu P, Zhao HJ, Tang ZH, Zhang YF, Lin HT, Shen YW, Wang JT, Wan SB. Effects of continuous cropping on root exudates of different resistance peanut (Arachis hypogaea L.) varieties and allelochemicals content in soil. Chinese Journal of Oil Crop Sciences, 2015, 37(4): 467-474. (in Chinese) 刘苹, 赵海军, 唐朝辉, 张玉凤, 林海涛, 沈玉文, 王江涛, 万书波. 连作对不同抗性花生品种根系分泌物和土壤中化感物质含量的影响. 中国油料作物学报, 2015, 37(4): 467-474. |
| [18] | Monisha TR, Ismailsab M, Masarbo R, Nayak AS, Karegoudar TB. Degradation of cinnamic acid by a newly isolated bacterium Stenotrophomonas sp. TRMK2. 3 Biotech, 2018, 8(8): 1-8. |
| [19] | Xiang W, Wei XL, Tang H, Li LB, Huang RS. Complete genome sequence and biodegradation characteristics of benzoic acid-degrading bacterium Pseudomonas sp. SCB32. BioMed Research International, 2020, 2020: 1-12. |
| [20] | Shi SJ, Nuccio EE, Shi ZJ, He ZL, Zhou JZ, Firestone MK. The interconnected rhizosphere: High network complexity dominates rhizosphere assemblages. Ecology Letters, 2016, 19(8): 926-936. DOI:10.1111/ele.12630 |
| [21] | Wang DD, Xu ZH, Zhang GS, Xia LM, Dong XY, Li Q, Liles MR, Shao JH, Shen QR, Zhang RF. A genomic island in a plant beneficial rhizobacterium encodes novel antimicrobial fatty acids and a self-protection shield to enhance its competition. Environmental Microbiology, 2019, 21(9): 3455-3471. DOI:10.1111/1462-2920.14683 |
| [22] | Dror B, Wang ZQ, Brady SF, Jurkevitch E, Cytryn E. Elucidating the diversity and potential function of nonribosomal peptide and polyketide biosynthetic gene clusters in the root microbiome. bioRxiv, 2020. DOI:10.1101/2020.06.07.138487 |
| [23] | Ryu MH, Zhang J, Toth T, Khokhani D, Geddes BA, Mus F, Garcia-Costas A, Peters JW, Poole PS, Ané JM, Voigt CA. Control of nitrogen fixation in bacteria that associate with cereals. Nature Microbiology, 2020, 5(2): 314-330. DOI:10.1038/s41564-019-0631-2 |
| [24] | Liu Y, Liu LD, Zhang LL, Wu Y, Wang GW, Wang Q, Jiang Y. Screening, identification of multifunctional peanut root-promoting rhizobacteria and its promoting effects on peanuts (Arachis hypogaea L.). Biotechnology Bulletin, 2017, 33(10): 125-134. (in Chinese) 刘晔, 刘晓丹, 张林利, 吴越, 王国文, 汪强, 姜瑛. 花生根际多功能高效促生菌的筛选鉴定及其效应研究. 生物技术通报, 2017, 33(10): 125-134. |
| [25] | Yu RQ, Kurt Z, He F, Spain JC. Biodegradation of the allelopathic chemical pterostilbene by a Sphingobium sp. strain from the peanut rhizosphere. Applied and Environmental Microbiology, 2019, 85(5): e02154-18. |
| [26] | Syed S, Tollamadugu NVKVP, Lian B. Aspergillus and Fusarium control in the early stages of Arachis hypogaea (groundnut crop) by plant growth-promoting rhizobacteria (PGPR) consortium. Microbiological Research, 2020, 240: 126562. DOI:10.1016/j.micres.2020.126562 |
| [27] | Khalid M, Hassani D, Bilal M, Asad F, Huang DF. Influence of bio-fertilizer containing beneficial fungi and rhizospheric bacteria on health promoting compounds and antioxidant activity of Spinacia oleracea L. Botanical Studies, 2017, 58(1): 35. DOI:10.1186/s40529-017-0189-3 |
| [28] | Wu FH, An YQ, An YR, Wang XJ, Cheng ZY, Zhang Y, Hou XW, Chen CX, Wang L, Bai JG. Acinetobacter calcoaceticus CSY-P13 mitigates stress of ferulic and p-hydroxybenzoic acids in cucumber by affecting antioxidant enzyme activity and soil bacterial community. Frontiers in Microbiology, 2018, 9: 1262. DOI:10.3389/fmicb.2018.01262 |
| [29] | Yan YW, Zhang H, Liu L, Xian HQ, Cui DJ. Isolation and identification of dominant microorganisms in rhizosphere of continuous cropping with peanut. Acta Microbiologica Sinica, 2011, 51(6): 835-842. (in Chinese) 颜艳伟, 张红, 刘露, 咸洪泉, 崔德杰. 连作花生田根际土壤优势微生物的分离和鉴定. 微生物学报, 2011, 51(6): 835-842. |
