金辉1,4, 杨晓燕1, 柳皓月1, 赵玉卉2, 郑伟丽2, 程济南3, 闵灯1, 许欣欣1, 秦波1


1. 中国科学院兰州化学物理研究所, 中国科学院西北特色植物资源化学重点实验室/甘肃省天然药物重点 实验室, 甘肃 兰州 730000;
2. 甘肃省科学院生物研究所, 甘肃 兰州 730000;
3. 兰州大学草地农业科技学院, 甘肃 兰州 730000;
4. 烟台中科先进材料与绿色化工产业技术研究院, 山东 烟台 264006
收稿日期:2021-02-01;修回日期:2021-05-13;网络出版日期:2021-08-16
基金项目:国家自然科学基金(31772668);中国科学院战略性先导科技专项A类(XDA26020201);烟台中科先进材料与绿色化工产业技术研究院科技创新项目(AMGCE013)
*通信作者:秦波, Tel: +86-931-4968371;Fax: +86-931-4968019;E-mail: bqin@licp.cas.cn.
摘要:[目的] 探究青藏高原不同地区高寒草原紫花针茅根际和体内真菌群落的组成、多样性等特征,及与土壤环境因子(理化性质和酶活性)间的相互关系。[方法] 从青藏高原不同地区采集紫花针茅样品,应用土壤化学方法分析根际土壤理化性质和酶活性,并采用Illumina Miseq高通量测序技术,解析根际土壤和体内真菌群落组成和丰度、Alpha多样性和菌群结构,同时分析了紫花针茅根际真菌种群多样性与土壤环境因子的相关性,厘清了影响紫花针茅根际真菌区系的土壤环境因素。[结果] 三个采样地的根际土壤呈中性偏碱,土壤理化性质和酶活性变化各异。高通量测序共得到314801条有效序列和4491个OTUs;XZ样地的紫花针茅真菌多样性和丰富度相对偏低,GS样地最高。在门分类水平上,子囊菌门Ascomycota和担子菌门Basidiomycota是主要内生真菌类群,占总菌群的88.28%。不同采样地区紫花针茅体内真菌群落结构存在明显差异,而根际土壤真菌群落结构差异不大。相关性分析表明,紫花针茅真菌多样性与土壤pH、有效钾、铁、钙、镁、多酚氧化酶、过氧化物酶和脱氢酶呈显著(P < 0.05)或极显著(P < 0.01)正相关,而与海拔、土壤酸性磷酸酶呈极显著负相关。RDA分析发现,紫花针茅根际土壤真菌不同,影响的土壤环境因子也不同。[结论] 青藏高原高寒草地紫花针茅根际和体内栖息着丰富的真菌群落,其组成和多样性受多种土壤环境因子影响,且影响不同真菌群落的主要土壤环境因子也不同。本研究对于有益微生物资源的开发、利用及保护具有重要意义,并为紫花针茅草原保育和合理开发利用提供科学依据。
关键词:紫花针茅真菌群落结构土壤环境因子高通量测序青藏高原
The structure of rhizosphere soil and endophytic fungal communities associated with Stipa purpurea and their correlation with soil environmental factors
Hui Jin1,4, Xiaoyan Yang1, Haoyue Liu1, Yuhui Zhao2, Weili Zheng2, Jinan Cheng3, Deng Min1, Xinxin Xu1, Bo Qin1


1. CAS Key Laboratory of Chemistry of Northwestern Plant Resources and Key Laboratory for Natural Medicine of Gansu Province, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences(CAS), Lanzhou 730000, Gansu Province, China;
2. Institute of Biology, Gansu Academy of Sciences, Lanzhou 730000, Gansu Province, China;
3. State Key Laboratory of Grassland Agro-Ecosystems, College of Pastoral Agricultural Science and Technology, Lanzhou University, Lanzhou 730000, Gansu Province, China;
4. Yantai Zhongke Research Institute of Advanced Materials and Green Chemical Engineering, Yantai 264006, Shandong Province, China
Received: 1 February 2021; Revised: 13 May 2021; Published online: 16 August 2021
*Corresponding author: Bo Qin, Tel: +86-931-4968371; Fax: +86-931-4968019; E-mail: bqin@licp.cas.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31772668), by the Chinese Academy of Sciences Strategic Priority Science and Technology Special Program Class A (XDA26020201) and by the Science and Technology Innovation Project of Yantai Zhongke Advanced Materials and Green Chemical Industry Technology Research Institute (AMGCE013)
Abstract: [Objective] The aim of this study is to explore the fungal community structures associated with rhizosphere soil, root and leaf of Stipa purpurea, and the relationship between rhizosphere soil fungal community structure and soil environmental factors. [Methods] We collected soil and plant samples from three different sites which located in the Qinghai-Tibetan Plateau. Soil physiochemical properties and enzymatic activities were detected by using the methods of soil chemistry, and rhizospheric and endophytic fungal community structures were analysed by Illumina Miseq high throughput sequencing technology. Based on this, we resolved the composition and richness, Alpha diversity and the characteristics of fungal community structures. Meanwhile, we also analyzed the correlation between the diversity of rhizosphere fungi and the soil environmental factors, and clarified the soil environmental factors which effected the rhizosphere mycobiota structure of Stipa purpurea. [Results] The results showed that rhizosphere soil pH were neutral or leaning alkalinity of three sampling sites, soil physiochemical properties and enzymatic activities changed differently in different sites. We obtained a total of 314801 effective sequences and 4611 OTUs by high throughput sequencing, the diversity and richness of fungal communities were the highest in GanSu site, and the lowest in XiZang site. The fungal communities' dominant phyla of all samples were Ascomycota and Basidiomycota, accounting for 88.28% of the total. The endophytic fungal communities had significant variations in different sampling sites, while rhizosphere soil fungal communities had no obvious differences in three sites. Correlation analysis showed that the diversity of fungal community was significant positive correlated with soil pH, the contents of available K, Fe, Ca, Mg, and soil peroxidase, soil polyphenol oxidase, soil dehydrogenase, while significant negative correlated with altitude and soil acid phosphatase. Redundancy analysis indicated that different fungal communities corresponding different impact environmental factors. [Conclusion] A wide variety of fungal communities are associated with the roots, leaves and rhizosphere soil of S. purpurea. The fungal assemblages are influenced by multiple soil environmental factors, and different fungal communities have different influencing factors. This study was significant to the exploitation of the beneficial microbial resource, and also providing a theoretical basis for the conservation and reasonable development these natural grasslands.
Keywords: Stipa purpureafungal communitysoil chemical and physical propertieshigh-throughput sequencingQinghai-Tibetan Plateau
真菌是生态系统中生物多样性的重要组成部分,在生物量、养分循环能力和多样性方面比其他微生物类群更具优势。研究不同生态环境下真菌群落结构、物种多样性和生态功能成为菌物学和生态学研究领域的主题之一,而其中植物根际和内生真菌(endophytic fungi)无疑是该领域的研究热点[1]。根际土壤真菌以植物分泌物及土壤中的有机物为生存的物质基础,参与土壤养分和能量的循环与流动,调节土壤养分释放和肥力的形成,是生态系统中物质和能量流动的主要驱动力[2]。植物内生真菌是指在其生活史的特定阶段或全部阶段寄生在植物组织内,而不对植物产生有害症状的真菌,包括其生活史中的特定阶段生活在植物表面的内生真菌和潜伏性病原菌[3]。内生真菌长期生活在植物体内的特殊环境中,并与宿主协同进化,一方面内生真菌可从宿主中吸收营养供自身生长需要,另一方面内生真菌在宿主的生长发育和系统演化过程中起着重要作用。内生真菌分布于植物组织内,可获得足够的碳源、氮源,受到植物组织的良好保护,比暴露于恶劣环境的附生菌和腐生菌具有更稳定的生存环境,更易于发挥作用[4]。研究表明,多数内生真菌能增强宿主植物抵抗昆虫、家畜、野鸟等的釆食,增强宿主植物对病害、干旱等生物及非生物胁迫的抵抗能力,在农牧业上受到广泛重视[5]。
大量研究表明,植物不同组织器官栖息的内生真菌对植物生长发育的贡献能力存在一定差异,这种差异性的存在为筛选功能性菌株提供了理论指导[6-7]。植物根系和叶片组织是受其生境内生物和非生物因子胁迫影响最大的器官,定殖于根系和叶片的内生真菌在植物防御外界不利因子胁迫,保护植物本身组织免受伤害方面发挥了重要作用。根据文献资料分析,内生真菌对植物各组织器官的生理生态效应的影响能力最大的是植物根系组织,其次是叶片组织[8]。与叶片相比,植物根系内生真菌的侵染程度更强,而叶片内生真菌则以局部侵染为主。因此,有必要同时对植物根系和叶片组织内生真菌物种组成、多样性、分布格局以及生态功能等进行系统研究。目前有关禾本科植物根际和内生真菌的研究主要集中于栽培禾草,对于天然禾草的研究还比较少,相对而言,天然禾草与真菌群落的关系更为复杂多变[9-10]。
紫花针茅(Stipa purpurea)隶属于禾本科(Gramineae)针茅属的多年生旱生草本植物,是青藏高原、帕米尔高原和中亚高山地区的特有植物,主要分布于我国的甘肃、青海、新疆、四川和西藏等地[11]。紫花针茅是高寒草地的建群种,对高原环境的低温、干旱、强紫外线及贫瘠土壤等胁迫条件具有极强的适应性,在高寒草地中分布面积极广,是最具代表性的植物类群。紫花针茅作为高寒草地的建群种和优势种群,对天然草原的毒杂草有更强的抵抗力,而且茎叶适口性好,富含蛋白质和脂肪,营养价值高,牲畜喜食,是高寒草地最主要的优质牧草之一,为畜牧业的发展提供了重要的物质基础。另外,紫花针茅具有耐寒、耐旱、耐践踏和抗风沙等特性,在生态防护方面起着不可或缺的作用[12]。鉴于紫花针茅天然拥有的这些优良基因资源,使得紫花针茅群落自然演替或人工种植成为治理高寒草地生态系统退化的途径之一[13]。
近年来,紫花针茅的研究工作主要集中在遗传多样性[14]、草地退化的影响[15-17]、群落分类[18]、放牧效应[19]、环境响应[12, 20]等方面。针对紫花针茅草原的土壤与内生菌研究也备受关注,王军等[21]基于磷酸脂肪酸(PLFA)方法测定了短期增温对紫花针茅草原土壤微生物生物量的影响,发现增温对土壤真菌类群生物量和群落结构没有显著影响;路等学等[22]采用构建克隆基因文库(ITS library construction)的方法对青海地区的紫花针茅根际和根内真菌群落结构进行了研究;鲍根生等[23]对青藏高原紫花针茅内生真菌进行分离培养(culture method)与系统进化研究,表明紫花针茅内生真菌与宿主间没有严格的特异性。然而,已有的报道大部分关注点在局部地区的紫花针茅种群,并且所用的研究方法只能分离到易培养的常见内生真菌类群,而难培养和不可培养真菌也是植物根际和内生真菌种群的重要组成部分。鉴于此,本研究从大尺度下的青藏高原不同地区高寒草地的紫花针茅种群入手,采用土壤化学方法明确根际土壤基本理化性质与土壤酶活性等土壤系统特性;利用灵敏度较高的分子检测——高通量测序法(high throughput sequencing)分析根际土壤、体内真菌群落组成、多样性等特征;并应用相关性分析法,解析紫花针茅根际土壤真菌群落与土壤环境因子的相关性。本研究对有益微生物资源的开发利用以及种质资源保护具有重要意义,并可为紫花针茅草原的生态恢复和保育提供理论依据。
1 材料和方法 1.1 研究样地概况 本实验选取青藏高原北缘的甘肃省肃南县康乐草原(样地编号为GS)、青海省祁连县祁连草原(样地编号为QH)和西藏自治州墨竹工卡县甲玛乡草地(样地编号为XZ)等3个研究样地(表 1)。康乐草原位于祁连山东北缘,年平均气温4 ℃左右,年平均降水量253 mm,蒸发量1828 mm,年平均无霜期127 d,平均日照数2665 h。土壤以山地黑钙土、草甸土等为主,主要植被以旱生莎草科和禾本科植物组成,如西北针茅(S. krylovii)、紫花针茅(S. purpurea)、赖草(Leymus secalinus)、冷蒿(Artemisia frigida)、多茎委陵菜(Potentilla multicaulis)等[24]。祁连县草原是青藏高原地区优良牧草生产适宜的生态地区,位于青海省东北部,年平均气温1.0 ℃,年降水量为420 mm左右,全年无绝对无霜期。土壤类型为亚高山草甸土,植物主要为紫花针茅(S. purpurea)、矮蒿草(Kobresia humilis)、赖草(L. secalinus)和披碱草(Elymus dahuricus)等[25]。墨竹工卡县甲玛乡草地位于藏北高原,年平均气温4.9 ℃,年均降水量522 mm,年均蒸发量2018 mm,年均无霜期约100 d,年日照时数为3012 h。土壤类型主要为高山草甸土和草原土,主要植被为紫花针茅(S. purpurea)、早熟禾(Poa annua)、羊茅(Festuca ovina)、矮蒿草(K. humilis)、线叶蒿草(K. capillifolia)、珠芽蓼(Polygonum viviparum)等[26]。
表 1. 三个采样地详细信息及根际土壤环境因子特征 Table 1. Details of the three study sites and the summary of rhizosphere soil environmental parameters
| Sample plot | GS | QH | XZ |
| Alt (m a.s.l.) | 2815 | 3289 | 3785 |
| Lat | N 38°49′29″ | N 37°58′29″ | N 29°46′12″ |
| Long | E 99°54′44″ | E 100°52′1″ | E 91°39′36″ |
| pH | 7.76±0.18a | 7.63±0.05a | 7.43±0.06a |
| TN/(g/kg) | 3.37±0.06a | 3.72±0.02a | 1.84±0.03b |
| TC/(g/kg) | 43.27±0.53a | 48.85±0.31a | 22.63±0.24b |
| OC/(g/kg) | 23.92±0.32a | 26.71±0.28a | 11.78±0.17b |
| C/N ratio | 12.74±0.30a | 13.22±0.17a | 12.56±0.14a |
| AP/(g/kg) | 0.71±0.04a | 0.51±0.03b | 0.58±0.03a |
| AK/(g/kg) | 16.89±0.71a | 14.27±1.09b | 13.65±0.41b |
| Fe/(g/kg) | 36.09±0.48a | 28.97±0.81b | 25.81±1.08c |
| Ca/(g/kg) | 18.89±0.71a | 3.88±0.42b | 1.60±0.15c |
| Mg/(g/kg) | 13.81±0.88a | 7.34±0.74b | 3.52±0.39c |
| Mo/(mg/kg) | 0.12±0.02b | 0.10±0.01b | 0.30±0.08a |
| POD/(mg/d/g) | 93.79±0.66a | 78.75±0.63b | 64.55±0.31c |
| SC/(mg/d/g) | 62.97±0.70a | 59.45±0.28b | 61.34±1.66b |
| UE/(μg/d/g) | 846.43±3.17b | 1073.28±3.61a | 602.94±1.85c |
| ACP/(μmol/d/g) | 19.00±0.56b | 22.41±1.05a | 21.35±0.96b |
| AKP/(μmol/d/g) | 21.88±0.59a | 22.45±1.31a | 21.95±1.61a |
| PPO/(mg/d/g) | 36.96±1.27a | 34.43±1.27b | 30.82±0.74c |
| DHA/(μg/d/g) | 245.82±4.10a | 132.70±0.43b | 34.48±0.02c |
| The different lowercase letters indicate that the difference is significant at the 0.05 level. n=3. The same below. Alt: altitude; a.s.l.: above sea level; Lat: Latitude; Long: Longitude; TN: total nitrogen; TC: total organic carbon; OC: organic carbon; C/N ratio: carbon/nitrogen ratio; AP: available phosphorus; AK: available potassium; POD: soil peroxidase; SC: soil sucrase; UE: soil urease; ACP: soil acid phosphatase; AKP: soil alkaline phosphatase; PPO: soil polyphenol oxidase; DHA: soil dehydrogenase. | |||
表选项
1.2 样地设置及样品采集 2016年6月至7月,分别在3个研究样地布置样方,每个样地设置3个大样方(25 m×25 m),每个大样方各设置3个小样方(50 cm×50 cm)[27]。在每个小样方采用5点法,随机选择5株健康紫花针茅,完整挖取植株。采用“抖落法”收集根际土壤,即用力抖动紫花针茅根部,去除多余的土壤和腐解物等杂质,仍粘在根部的即为根际土壤,用无菌小毛刷扫落根际土壤,收集到灭菌采样袋中。用无菌剪刀从完整植株分别剪取5段长度约3 cm的健康无病斑的根和叶段,分别装入采样袋,并做好标记。将每个大样方内取得的15份根际、根和叶段分别混匀为1份样品,共获得根际土壤(rhizosphere soil,rs)、根(root,r)和叶(leaf,l)样品各9份。将每份根际土壤样品再分成2小份,1份用于土壤理化性质和酶活性分析,另1份保存在–80 ℃超低温冰箱中,用于根际土壤真菌总DNA提取。将紫花针茅的根和叶样品用流动的自来水冲洗之后,分别置于75%的乙醇中浸泡1 min,转入2%次氯酸钠溶液中处理8 min,最后用无菌水清洗5次,每次约1 min,取最后一次的冲洗液涂布于NA (营养琼脂)固体培养基上,于28 ℃培养3 d,检测表面灭菌效果,将表面消毒的根和茎样品用无菌滤纸吸干表层水分后待用。
1.3 根际土壤理化性质与酶活性分析 采用常规分析方法测定根际土壤理化性质[28]。土壤pH值采用酸度计测定,以去除CO2的纯水为浸提剂,水土比为2.5:1;土壤全氮采用半微量凯氏定氮法测定,全碳采用干烧法,通过元素分析仪(Vario EL/micro cube,Elementar,Hanau,Germany)测定,有机碳采用重铬酸钾-硫酸溶液氧化法测定;土壤有效磷采用NaHCO3浸提-钼锑抗比色法测定,有效钾采用NH4OAc浸提-火焰光度法测定;土壤微量元素(Fe、Ca、Mg、Mo)含量采用HF-HClO4-HNO3消煮,用电感耦合等离子体发射光谱法(ICP-OES)测定。土壤酶活性测定参照《土壤酶及其研究法》[29],脲酶活性采用苯酚钠-次氯酸钠比色法,酸性和碱性磷酸酶活性采用磷酸苯二钠比色法,蔗糖酶活性采用3, 5-二硝基水杨酸比色法,多酚氧化酶活性采用没食子素比色法测定,过氧化物酶活性采用邻苯三酚比色法测定,脱氢酶活性采用三苯基四氮唑氯化物(TTC)比色法测定。
1.4 基因组DNA提取、扩增、高通量测序 在无菌超净工作台中,分别准确称取1.0 g不同采样地区的表面灭菌的紫花针茅根和茎样品,无菌剪刀剪成约1 cm的组织块,置于灭菌研钵中,加入液氮,研磨成粉末状,将粉末转移至1.5 mL的无菌离心管中,同样准确称取1.0 g根际土壤样品于1.5 mL的无菌离心管中,用于总DNA提取。使用土壤微生物DNA提取试剂盒(ZR Soil Microbe DNA KitTM,Zymo Research,Orange,CA,USA)提取DNA,操作步骤参考产品说明书。提取到的DNA用1.0%的琼脂糖凝胶电泳检测纯度和浓度。PCR扩增采用引物ITS1F/ITS2R (ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′,ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′),PCR反应体系为25 μL,包括DNA模板1.5 μL,引物各1.0 μL,10×PCR Buffer 2.5 μL,Taq酶0.2 μL (Promega, Madison, WI, USA),dNTPs 2.5 μL,ddH2O 16.3 μL。PCR扩增条件:95 ℃ 1 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 45 s,30个循环;72 ℃ 10 min。
高通量测序委托上海生工生物工程技术服务有限公司完成,所用平台为高通量二代测序仪(Illumina,HiSeq 2500)。将测序得到的数据进行质控和过滤,具体步骤如下:截去样品数据的Barcode序列和PCR扩增引物序列,使用FLASH (v 1.2.7)对每个样品的reads进行拼接,得到原始Tags数据;应用Qiime (v 1.7.0)的Tags质量控制流程,将原始Tags数据过滤处理得到高质量的Tags数据;得到的Tags序列于数据库(Unite Database,http://unite.ut.ee/)进行比对,采用UCHIME (v 4.2)检测并去除嵌合体序列,最终得到有效数据。应用Uparse软件(v 7.0.1001)对所有样品的有效数据序列在97%的相似度下进行OTUs (Operational Taxonomic Units)聚类,采用Qiime中的Blast方法与Unite真菌数据库(Release 7.2,http://unite.ut.ee/index.php)进行物种注释分析,获得每个OTU的分类学信息。
1.5 数据分析 对各样品中的数据进行均一化处理,使用R软件(v 2.15.3)绘制稀释曲线,检验测序数量的合理性;在数据序列OTU聚类分析的基础上,利用Mothur (version v.1.30)软件计算样品Alpha多样性指数,其中Coverage指数衡量测序深度,Chao1和ACE指数反映群落丰富度,Simpson和Shannon指数反映微生物多样性。根据样品数据分类分析的结果,构建紫花针茅各样品真菌类群的分布柱形图,比较不同样品间的菌群组成差异。应用Sigmaplot 12.0软件对数据进行One-Way ANOVA差异显著性检验,以及Pearson相关性分析检验。基于bray curtis算法使用QIIME软件,对样品进行非度量多维标定法(NMDS)分析,并采用CANOCO 4.5软件对紫花针茅真菌群落与土壤环境因子间的相互关系进行冗余分析(redundancy analysis,RDA),以期反映土壤理化性质、土壤酶活性与紫花针茅根际真菌群落的相互关系。
2 结果和分析 2.1 紫花针茅根际土壤基本理化性质与酶活性分析 对3个采样地紫花针茅根际土壤基本理化性质的11项指标进行了检测,结果表明:3个采样地的土壤pH呈中性偏碱,土壤的总N、总C、有机C含量和C: N均为QH样地高于GS和XZ样地,XZ样地最低;土壤有效K、Fe、Ca和Mg含量均为GS样点最高,XZ样地最低;土壤速效磷含量GS样地偏高,QH样地最低,而Mo含量XZ样地最高,QH样地偏低(表 1)。
对紫花针茅根际土壤7个酶活性指标的检测结果显示:土壤多酚氧化酶(PPO)、过氧化物酶(POD)和脱氢酶(DHA)的活性,GS样地高于QH和XZ样地;土壤脲酶活性,QH样地高于GS和XZ样地,XZ样地上述4种酶的活性最低。土壤酸性和碱性磷酸酶活性QH样地高于XZ和GS样地,蔗糖酶活性GS样地最高,QH样地最低,XZ样地上述3种酶活性居中(表 1)。
2.2 紫花针茅根际和体内真菌高通量测序结果及多样性分析 以最后一次冲洗紫花针茅根部和叶片的无菌水涂布平板培养基,7 d后观察平板表面未出现任何菌落,表明实验样品表面灭菌效果彻底,研究结果可信。稀疏度曲线可反映样本的物种多样性和丰富度随测序量的变化情况,本研究中随样品测序数量的增加,27个样品的OTU稀疏曲线逐渐趋于平缓,而且各样品测序覆盖度均在99.50%以上,表明本实验测序的数据量能较全面地反映测序样品的真菌群落组成(图 1,表 2)。
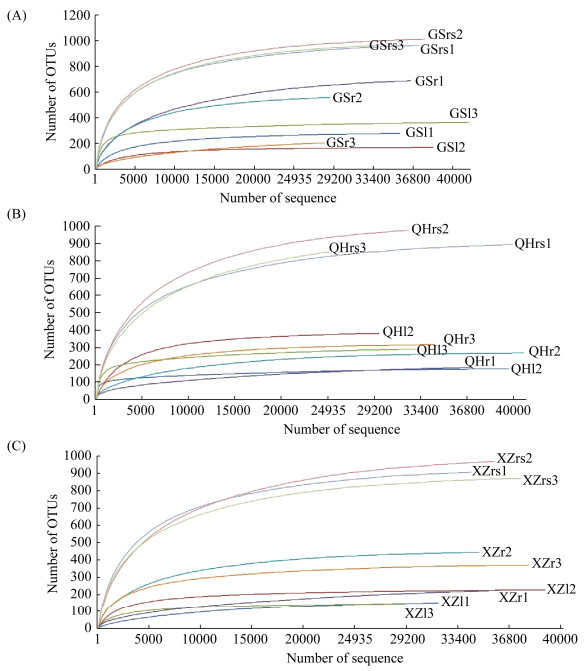 |
| 图 1 紫花针茅根际土壤和体内真菌的OTUs稀释曲线 Figure 1 Fungal OTUs rarefaction curves of rhizosphere soil, root and leaf associated with S. purpurea. a: GS site; b: QH site; c: XZ site. |
| 图选项 |
表 2. 紫花针茅根际土壤和体内真菌群落多样性指数分析 Table 2. Diversity index of fungal community associated with S. purpurea
| Sample | Effective tags | OTUs | ACE | Chao1 | Shannon index | Simpson index | Coverage/% |
| GSrs | 36048 | 979 | 1042.86±20.20a | 1044.41±20.07a | 4.91±0.31a | 0.04±0.00a | 99.67 |
| GSr | 31303 | 482 | 546.03±8.65b | 534.61±4.05b | 2.89±0.13b | 0.18±0.01a | 99.71 |
| GSl | 38524 | 269 | 307.21±3.02c | 292.20±11.63c | 2.04±0.19c | 0.50±0.03a | 99.92 |
| QHrs | 32368 | 907 | 999.77±5.25a | 990.23±15.63a | 4.33±0.06a | 0.06±0.01b | 99.50 |
| QHr | 37318 | 256 | 307.33±9.44b | 283.96±3.11c | 2.51±0.35c | 0.21±0.02a | 99.88 |
| QHl | 34007 | 283 | 314.86±5.50b | 310.01±17.32b | 3.35±0.43b | 0.15±0.02a | 99.89 |
| XZrs | 35743 | 915 | 980.17±8.61a | 979.88±24.39a | 4.32±0.27a | 0.07±0.01a | 99.66 |
| XZr | 36214 | 346 | 424.40±4.89b | 401.22±3.48b | 2.92±0.16b | 0.12±0.03a | 99.83 |
| XZl | 33276 | 174 | 189.30±4.43c | 186.40±3.52c | 1.57±0.26c | 0.43±0.02a | 99.93 |
| a, b, c: the significant difference indicates the comparison of different sampling parts in the same place. | |||||||
表选项
27个样品测序共获得317707条原始序列,剔除不合格的序列之后,共得到314801条有效序列,以≥97%的相似性聚类得到4491个OTUs,其中,GS样地1927个,QH样地1256个,XZ样地1308个。GS和XZ两个样地的真菌OTU数量均为根际土壤 > 根 > 叶,而QH样地为根际土壤 > 叶 > 根(表 2)。由韦恩图可知,GS样地不同采样部位共有的OTUs为173个,其中根际土壤、根和叶中所特有的OTUs数目分别为1137、553和243个;QH样地中,根际土壤、根和叶所特有的OTUs数目分别为1249、205和338个,3个部位共有的OTUs为130个;XZ样地不同采样部位共有的OTUs为125个,根际土壤、根和叶3个部位所特有的OTUs数目分别为1242、396和200个(图 2)。
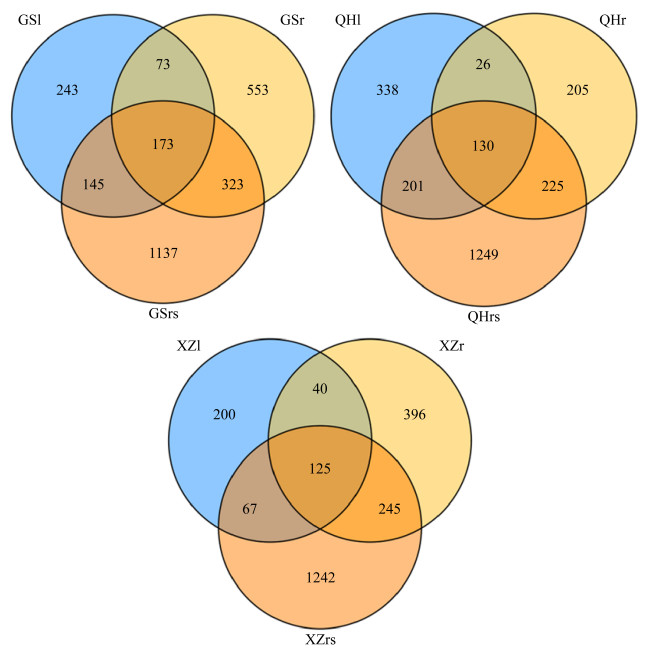 |
| 图 2 紫花针茅不同采样地区真菌群落OTUs分布韦恩图 Figure 2 Venn diagram of fungal OTUs detected in different sampling sites of S. purpurea. |
| 图选项 |
对不同样品的Alpha多样性指数分析表明:GS和XZ样地的真菌群落多样性和丰富度均表现为根际土壤最高,叶最低,QH样地则为根际土壤最高,根最低。不同样地之间比较发现,GS样地紫花针茅不同部位的真菌群落多样性均高于其他2个样地,QH样地紫花针茅根际土壤和叶中的真菌群落多样性大于XZ样地,而根中的小于XZ样地。反映根际和内生真菌丰富度的ACE和Chao1指数分别在189.30–1042.86和186.40–1044.41之间。反映菌群多样性的Shannon指数在1.57–4.91之间,其中,GS样地紫花针茅根际土壤真菌多样性最丰富,Shannon指数和Chao1指数分别为4.91和1044.41。与之相反,XZ样地叶部内生真菌多样性最低,Shannon指数、Chao1指数分别为1.57和186.40。反应根际土壤真菌优势度的Simpson指数在0.04–0.50之间,GS样地的叶部内生真菌优势度最高,根际土壤真菌群落的优势度最低,3个样地紫花针茅体内真菌群落的优势度明显高于根际土壤(表 2)。
2.3 紫花针茅真菌群落分布特征 27个样品中共检测到了5个门的真菌,其中子囊菌门Ascomycota和担子菌门Basidiomycota是主要的真菌类群,分别占总序列数的75.52%和12.76%。在纲水平上(图 3-A),共注释到了27类真菌,其中粪壳菌纲Sordariomycetes、座囊菌纲Dothideomycetes、伞菌纲Agaricomycetes、Archaeorhizomycetes及散囊菌纲Eurotiomycetes为主要菌群,相对丰度之和超过73%。
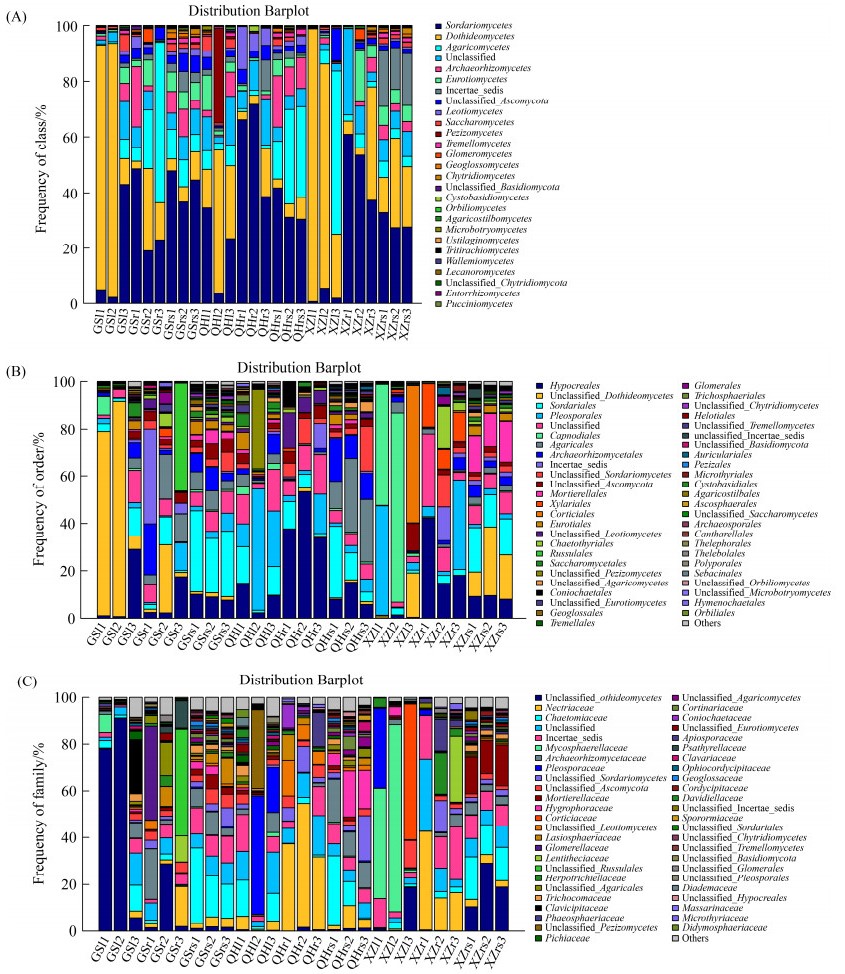 |
| 图 3 不同采样地区紫花针茅根际和体内真菌的群落组成 Figure 3 Fungal community composition in rhizosphere soil, root and leaf of S. purpurea in different sampling sites. A: class level; B: order level; C: family level. |
| 图选项 |
在目水平上,27个样品共注释到了99个真菌目,肉座菌目Hypocreales、座囊菌纲Unclassified_Dothideomycetes、粪壳菌目Sordariales、腔菌目Pleosporales、煤炱目Capnodiales、伞菌目Agaricales和古根菌目Archaeorhizomycetales为主要的优势真菌目(图 3-B)。在GS样地的紫花针茅样品中,肉座菌目Hypocreales在叶、根和根际土壤中均占优势地位,座囊菌纲Unclassified_Dothideomycetes在叶和根中出现比例较大,而粪壳菌目Sordariales在叶和根际土壤中较多;伞菌目Agaricales和古根菌目Archaeorhizomycetales在GS样地的地下部位(根和根际土壤)中占优势地位,而红菇目Russulales仅在根部样品中占优势地位。在QH地区紫花针茅样品中,粪壳菌目Sordariales和肉座菌目Hypocreales在叶、根和根际都处于优势地位,腔菌目Pleosporales在叶和根中所占比例较高,粪壳菌纲Unclassified_Sordariomycetes在根和根际属于优势类群;而盘菌纲Unclassified_Pezizomycetes仅在叶中占优势,Unclassified_Leotiomycetes仅在根中占优势,伞菌目Agaricales和古根菌目Archaeorhizomycetales仅在根际土壤中占优势。分布在XZ的紫花针茅样品中,煤炱目Capnodiales和伏革菌目Corticiales是叶中特有的优势菌群,炭角菌目Xylariales和刺盾炱目Chaetothyriales是根中特有的优势菌群,被孢霉目Mortierellales和粪壳菌目Sordariales是根际土壤特有的优势菌群;而座囊菌纲Unclassified_Dothideomycetes在叶和根际中所占比例较大,腔菌目Pleosporales在叶和根中处于优势地位,肉座菌目Hypocreales在根和根际中为优势类群。
在科水平上,27个样品共注释到了217个真菌类群(图 3-C),丛赤壳科Nectriaceae、毛壳菌科Chaetomiaceae、座囊菌纲Unclassified_ Dothideomycetes、Incertae_sedis、球腔菌科Mycosphaerellaceae、Archaeorhizomycetaceae和腔孢菌科Pleosporaceae为主要的优势类群,占总序列数目的57%以上,但同一采样地区的紫花针茅不同部位之间真菌群落组成存在显著差异。GS地区紫花针茅叶部内生真菌有108科,根部有115科,根际土壤有161科。其中座囊菌纲Unclassified_Dothideomycetes为叶和根中的优势科,毛壳菌科Chaetomiaceae为叶和根际中的优势科,Archaeorhizomycetaceae为根和根际土壤中的优势科。麦角菌科Clavicipitaceae是叶中特有的优势科,unclassified_Russulales、小丛壳科Glomerellaceae、丛赤壳科Nectriaceae和unclassified_Agaricales为根中特有的优势科,Incertae_sedis、毛球壳科Lasiosphaeriaceae和unclassified_Ascomycota是根际土壤特有的优势科。采自QH地区的紫花针茅叶部内生真菌有105科,根部有89科,根际土壤有162科。其中腔孢菌科Pleosporaceae和盘菌纲Unclassified_ Pezizomycetes是叶中特有的优势类群,unclassified_Leotiomycetes和Phaeosphaeriaceae是根中特有的优势类群,蜡伞科Hygrophoraceae和Archaeorhizomycetaceae是根际土壤特有的优势类群。毛壳菌科Chaetomiaceae是叶和根际中共有的优势类群,丛赤壳科Nectriaceae和粪壳菌纲Unclassified_Sordariomycetes是根和根际中共有的优势类群,而Incertae_sedis在叶、根和根际中均属优势类群。XZ地区紫花针茅叶部内生真菌有77科,根部有101科,根际土壤有148科。其中Incertae_sedis在叶、根和根际中均居于优势类群,座囊菌纲Unclassified_Dothideomycetes是叶和根际的共有优势科。球腔菌科Mycosphaerellaceae、伏革菌科Corticiaceae和腔孢菌科Pleosporaceae是叶中特有的优势科,丛赤壳科Nectriaceae、Lentitheciaceae、Herpotrichiellaceae和粪壳菌纲Unclassified_Sordariomycetes是根中特有的优势科,被孢霉科Mortierellllaceae和毛壳菌科Chaetomiaceae是根际中特有的优势科。
2.4 紫花针茅真菌群落组成及丰度分析 热图分析发现,内生真菌群落不仅在不同采样地区之间存在明显差异,在同一采样地区的不同部位的分布也存在差异(图 4)。在GS采集的紫花针茅样品中,座囊菌纲Unclassified_Dothideomycetes在叶和根部样品中相对富集,Mycothermus在叶部和根际样品中相对富集,unclassified_ Archaeorhizomycetaceae在根部和根际样品中相对富集,Neotyphodium仅在叶部样品中相对富集,刺盘孢属Colletotrichum、红菇unclassified_ Russulales、丛赤壳科unclassified_Nectriaceae和伞菌unclassified_Agaricales等仅在根部样品中相对富集,unclassified_Incertae_sedis等仅在根际土壤样品中相对富集。在QH采集的紫花针茅样品中,粪壳菌纲Unclassified_Sordariomycetes在根部和根际样品中相对富集,腔孢菌科unclassified_Pleosporaceae、Mycothermus、盘菌纲Unclassified_Pezizomycetes、unclassified_Incertae_ sedis等仅在叶部样品中相对富集,丛赤壳科unclassified_Nectriaceae、unclassified_Leotiomycetes、unclassified_Phaeosphaeriaceae等仅在根部样品中相对富集,Mycothermus、unclassified_ Archaeorhizomycetaceae、湿伞属Hygrocyb等仅在根际土壤样品中相对富集。在XZ采集的紫花针茅样品中,座囊菌纲Unclassified_ Dothideomycetes在叶部和根际样品中相对富集,球腔菌属Mycosphaerella、Limonomyces、腔孢菌科unclassified_Pleosporaceae等仅在叶部样品中相对富集,丛赤壳科unclassified_Nectriaceae、微座孢属Microdochium、Darksidea、unclassified_ Herpotrichiellaceae、粪壳菌纲Unclassified_ Sordariomycetes等仅在根部样品中相对富集,被孢霉科unclassified_Mortierellaceae、Mycothermus、unclassified_Incertae_sedis等仅在根际土壤样品中相对富集。
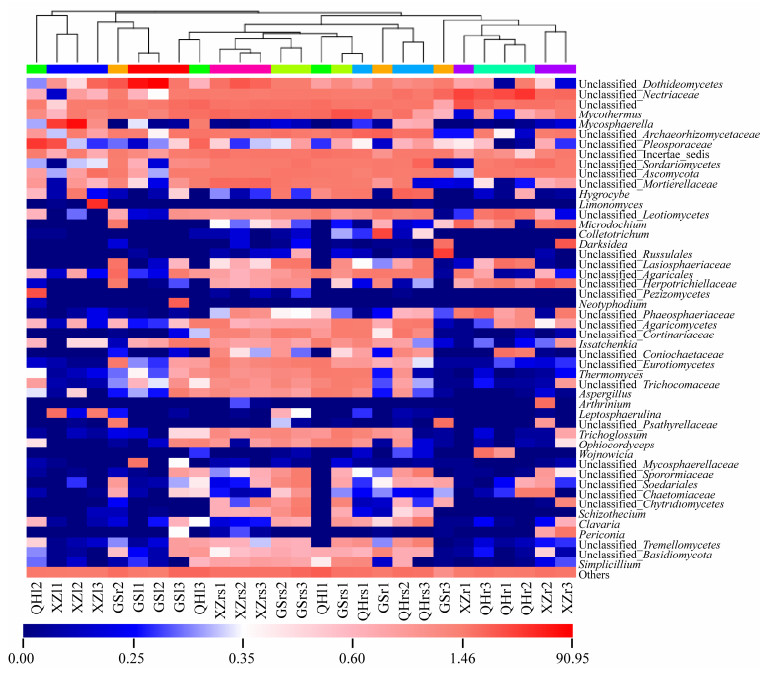 |
| 图 4 不同采样地区紫花针茅根际和体内真菌属水平的相对丰度热图 Figure 4 Heatmap of the relative abundance of fungal community in rhizosphere soil, root and leaf of S. purpurea in different sampling sites. |
| 图选项 |
为了进一步分析同一地区不同采样部位以及不同采样地区紫花针茅根际和内生真菌群落组成的差异,进行了韦恩分析和NMDS分析。GS采集的紫花针茅样品中,有11属为根际、根部和叶部样品共有属,包括Mycothermus、unclassified_Archaeorhizomycetaceae、被孢霉科unclassified_Mortierellaceae等。叶部样品有5个属(曲霉属Aspergillus、白僵菌属Beauveria、酵母属Issatchenkia、伞菌unclassified_Agaricomycetes、unclassified_Phaeosphaeriaceae)为特有属;根部样品中,刺盘孢属Colletotrichum、Darksidea、微座孢属Microdochium、伞菌unclassified_Agaricales、球囊霉目unclassified_Glomerales、unclassified_ Herpotrichiellaceae、鬼伞科unclassified_ Psathyrellaceae、和红菇unclassified_Russulales 8个属为特有属;根际土壤样品中,湿伞属Hygrocybe、冬虫夏草属Ophiocordyceps、Schizothecium、壶菌纲unclassified_Chytridiomycetes、unclassified_Sordariales 5个属为特有属。在QH采集的紫花针茅样品中,有8个属为叶部、根部和根际土壤共有属,包括Mycothermus、unclassified_Archaeorhizomycetaceae、丛赤壳科unclassified_Nectriaceae和粪壳菌纲Unclassified_Sordariomycetes等。叶部样品有10个属(曲霉属Aspergillus、Comoclathris、酵母属Issatchenkia、冬虫夏草属Ophiocordyceps、Pseudopithomyces、unclassified_Davidiellaceae、unclassified_Eurotiomycetes、盘菌纲Unclassified_ Pezizomycetes、unclassified_Pleosporaceae和unclassified_Pleosporales)为特有属;根部样品中,微座孢属Microdochium、木霉属Trichoderma、毛壳菌科unclassified_Chaetomiaceae、unclassified_ Coniochaetaceae、unclassified_Cystobasidiaceae、unclassified_Herpotrichiellaceae、unclassified_ Massarinaceae、unclassified_Phaeosphaeriaceae和Wojnowicia 9个属为特有属;在根际土壤样品中,有Clavaria、Floccularia、丝膜菌科unclassified_Cortinariaceae、荚胞腔菌科unclassified_Sporormiaceae、银耳纲unclassified_ Tremellomycetes、和湿伞属Hygrocybe 6个属为特有属。在XZ采集的紫花针茅样品中,Mycothermus、unclassified_Archaeorhizomycetaceae、丛赤壳科unclassified_Nectriaceae和粪壳菌纲Unclassified_Sordariomycetes等8个属为特有属。叶部样品中,枝孢属Cladosporium、Comoclathris、湿伞属Hygrocybe、小光壳属Leptosphaerulina、Limonomyces、球腔菌属Mycosphaerella和unclassified_Thelebolales 7个属为特有属;根部样品中,节菱孢属Arthrinium、离蠕孢属Bipolaris、Darksidea、微座孢属Microdochium、Oliveonia、Paramicrothyrium、Periconia、毛壳菌科unclassified_Chaetomiaceae、球囊霉科unclassified_Glomeraceae、unclassified_Glomerales、unclassified_Herpotrichiellaceae 11个属为特有属;在根际土壤样品中曲霉属Aspergillus、白僵菌属Beauveria、嗜热真菌属Thermomyces、毛舌菌属Trichoglossum、丝膜菌科unclassified_ Cortinariaceae、unclassified_Eurotiomycetes、unclassified_Leotiomycetes和发菌科unclassified_ Trichocomaceae 8个属为特有属。NMDS进一步分析发现27个样品按照采样部位分成了3组,分别是叶部样品、根部样品和根际土壤样品,说明虽然采样地区不同,但是同一部位的紫花针茅真菌群落结构相似;紫花针茅内生真菌(叶部和根部)样品分布相对分散,相距较远,表明不同采样地区内生真菌群落组成存在明显差异,而不同地区紫花针茅根际土壤样品分布集中,表明紫花针茅根际土壤真菌群落结构受采样地区的影响较小,样品间的差异不大(图 5)。
 |
| 图 5 不同采样地区紫花针茅根际和体内真菌群落NMDS分析 Figure 5 NMDS analysis of fungal community in rhizosphere soil, root and leaf of S. purpurea in different sampling sites. Ovals drawn with solid line represent the associations of root samples, short dash line represent the associations of leaf samples, and long dash line represent the associations of rhizosphere soil samples. |
| 图选项 |
2.5 紫花针茅根际土壤真菌群落结构与土壤环境因子相关性分析 通过Pearson相关性分析得出,土壤理化性质参数中,pH、AK、Fe、Ca和Mg与真菌多样性指数ACE、Chao 1和Shannon指数呈显著(P < 0.05)或极显著(P < 0.01)正相关,而与Simpson指数呈显著或者极显著负相关;海拔与ACE、Chao 1和Shannon指数呈极显著负相关,而与Simpson指数呈极显著正相关,说明土壤的这些理化性质对根际真菌群落分布和多样性有重要影响。AP与ACE和Chao 1指数呈显著正相关,而与Shannon和Simpson指数相关性不显著,Mo只与ACE指数呈显著负相关,与其他多样性指数相关性不显著,说明AP和Mo对根际土壤真菌群落分布起重要作用(表 3)。土壤酶参数中,多酚氧化酶(PPO)、过氧化物酶(POD)和脱氢酶(DHA)与真菌多样性指数ACE、Chao 1和Shannon指数呈显著(P < 0.05)或极显著(P < 0.01)正相关,而与Simpson指数呈显著或者极显著负相关;土壤酸性磷酸酶(ACP)与ACE、Chao 1和Shannon指数呈极显著负相关,而与Simpson指数呈极显著正相关,说明土壤的这些酶是根际真菌群落分布和多样性的关键酶。土壤蔗糖酶只与Shannon指数呈显著正相关,与其他多样性指数相关性不显著,说明其对真菌群落多样性有一定的影响。除此以外,其他土壤理化性质和酶与根际土壤真菌群落分布和多样性的相关性不显著(表 3)。
表 3. 紫花针茅根际土壤真菌群落多样性指数与土壤理化性质和酶活性的Pearson相关性分析 Table 3. Pearson correlations between rhizosphere soil fungal communities of S. purpurea and soil environmental factors
| Index | ACE | Chao 1 | Shannon index | Simpson index |
| Altitude | –0.919*** | –0.826*** | –0.739** | 0.784** |
| pH | 0.705* | 0.667* | 0.709** | –0.589* |
| TN | 0.572 | 0.424 | 0.157 | –0.357 |
| TC | 0.527 | 0.363 | 0.164 | –0.349 |
| OC | 0.517 | 0.374 | 0.174 | –0.316 |
| C/N | –0.183 | –0.298 | 0.171 | –0.031 |
| AK | 0.854*** | 0.858*** | 0.864*** | –0.867*** |
| AP | 0.606* | 0.738* | 0.510 | –0.324 |
| Fe | 0.925*** | 0.848*** | 0.874*** | –0.848*** |
| Ca | 0.921*** | 0.882*** | 0.856*** | –0.818** |
| Mg | 0.897*** | 0.849*** | 0.773** | –0.757** |
| Mo | –0.601* | –0.570 | –0.200 | 0.371 |
| PPO | 0.903*** | 0.858*** | 0.634* | –0.625* |
| POD | 0.928*** | 0.848*** | 0.758** | –0.795** |
| UE | 0.303 | 0.149 | 0.036 | –0.219 |
| DHA | 0.933*** | 0.846*** | 0.769** | –0.799** |
| SC | 0.520 | 0.522 | 0.636* | –0.407 |
| ACP | –0.673* | –0.618* | –0.852*** | 0.664* |
| AKP | –0.096 | 0.074 | –0.031 | –0.130 |
| The signifcant differences (*: P≤0.05; **:P≤0.01;***: P≤0.001) are highlighted in bold. The different lowercase letters indicate that the difference is significant at the 0.05 level. TN: total nitrogen; TC: total organic carbon; OC: organic carbon; C/N ratio: carbon/nitrogen ratio; AP: available phosphorus; AK: aavailable potassium; POD: soil peroxidase; SC: soil sucrase; UE: soil urease; ACP: soil acid phosphatase; AkP: soil alkaline phosphatase; PPO: soil polyphenol oxidase; DHA: soil dehydrogenase. | ||||
表选项
通过RDA分析真菌群落与土壤理化性质和酶活性之间的相互关系(图 6)。结果表明,第一、二排序轴累计解释率分别为74.5%和24.8%,累计解释率达到99.3%,说明第一、二排序轴能较好地反映出真菌群落与土壤特性之间的相互关系。球囊菌门(Glomeromycota)与海拔和Mo箭头方向一致呈正相关,与土壤蔗糖酶(SC)、AP、Ca和Fe方向相反呈负相关;接合菌门(Zygomycota)与海拔和Mo箭头方向一致呈正相关,而与大部分土壤理化性质和酶活性参数的方向相反呈负相关;子囊菌门(Ascomycota)和壶菌门(Chytridiomycota)与土壤蔗糖酶、AP、Ca和Fe方向相同呈正相关,与土壤酸性磷酸酶(ACP)和碱性磷酸酶(AKP)方向相反呈负相关;担子菌门(Basidiomycota)的箭头方向与土壤脲酶(UE)、多酚氧化酶(PPO)、脱氢酶(DHA)和过氧化物酶(POD),以及TN、TC、OC、AK、pH和Mg的方向一致呈正相关,与海拔和Mo的箭头方向相反呈负相关(图 6)。
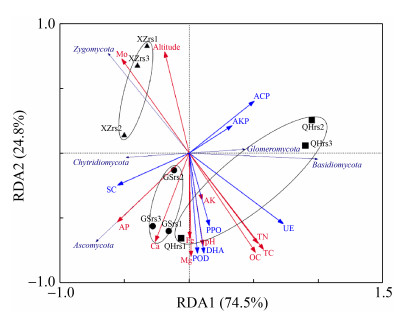 |
| 图 6 不同采样地区紫花针茅根际土壤真菌门水平相对丰度与土壤环境因子冗余分析 Figure 6 RDA analysis ordination biplot showing relationships between fungal communities and soil enzyme activities, and environmental variables. Ovals represent the associations of different samples in different sampling sites. The black arrows, red arrows and blue arrows indicate fungal community, soil physiochemical properties, and soil enzymes, respectively. The abbreviations of the variables in this figure were showed in Table 1. |
| 图选项 |
3 讨论 紫花针茅是青藏高原高寒草地中面积最大、最重要的草原优势植物类群,对青藏高原景观、生态系统多样性和自然环境稳定性的保护与维持起着重要作用,并且也是草地畜牧业发展的关键物质基础[16, 23]。近年来,随着国内外****对草原禾草研究的日益关注[4-5],针对高寒草原紫花针茅根际和体内微生物群落的研究也备受注目[21-23, 30]。
本文研究发现,子囊菌门Ascomycota和担子菌门Basidiomycota是紫花针茅根际和体内的优势真菌类群。根际土壤的真菌群落多样性和丰富度大于根部内生真菌,叶部内生真菌的多样性和丰富度最小。同样地,杨晓燕等[30]采用传统的分离培养方法,从青海湖地区的紫花针茅根部和叶部分离得到33种内生真菌,子囊菌门的真菌占绝对的优势地位,并且根内真菌群落的多样性和丰富度大于叶内真菌群落。李海云[27]等研究发现,子囊菌门和担子菌门是不同退化草地土壤真菌的优势类群,原因可能是高寒草甸土壤木质素含量相对较高,从而促使子囊菌门和担子菌门真菌成为高寒草甸的优势真菌类群[31]。上述结果与本研究得到的结果一致。路等学等[22]采用构建真菌ITS rRNA基因文库的方法,分析青海湖地区高寒草原紫花针茅根际土壤和根部内生真菌群落,结果表明:担子菌门和子囊菌门是紫花针茅的优势类群,根际土壤中子囊菌门真菌占主导地位,而根内担子菌门真菌数量最多,根部内生真菌的多样性和丰富度大于根际土壤。这些结果与本文研究不一致,主要的原因可能有以下两点:首先是研究技术手段的不同,高通量测序技术应用于植物根际和体内微生物研究,有效避免了传统微生物研究方法的弊端,是精细化研究微生物的有效方法[27, 32]。而传统的微生物研究方法,比如分离培养、构建克隆文库等,受到各种因素的制约,通常会导致过低估计微生物的群落组成和多样性[21-22, 30]。其次是采样地点不同,本文采集了青藏高原北缘的3个不同海拔高寒草原分布的紫花针茅种群样品,而路等学等[22]只采集了青海省青海湖地区高寒草原的样品,无论从取样代表性和结果覆盖度等方面,本研究都更能真实反映野外的实地状况。
本研究的α-多样性指数分析显示,根际土壤真菌多样性的所有指数显著高于叶片和根部,表明根际真菌的多样性和丰富度均显著高于内生真菌。而根部和叶片相比,GS和XZ样地根部真菌群落的OTUs、Chao、ACE、Shannon等参数均高于叶片,而QH样地的情况相反。根际土壤作为植物体内和体外环境的联系纽带,是植物与外界环境互作的微环境场所,植物根系与根系、根系与昆虫、根系与微生物之间的互作均在根际土壤进行[33],这些复杂的相互作用塑造了根际土壤微生物的多样性。与根际环境相比,植物根部和叶片的内部环境相对稳定单一,导致内生的微生物种群也相对单一。总之,根际土壤真菌群落多样化和内生真菌群落的相对单一化均是植物和微生物对各自环境及功能相适应的结果[34]。
肉座菌目Hypocreales、粪壳菌目Sordariales、腔菌目Pleosporales是紫花针茅根内、叶内和根际土壤共有的优势真菌类群。已有的研究表明,这3类真菌广泛分布于种子植物的根际土壤和体内[35],是子囊菌门中重要的代表性类群,也是农林草业生态系统中重要的组成部分。这些真菌类群物种资源丰富、全型特征多样,其中包含许多具有重要经济价值和生态功能的种类[36]。然而,综合本研究的热图、韦恩图和NMDS分析显示,紫花针茅根际和内生真菌不仅在不同采样地区之间存在一定差异,在同一采样地区的不同部位的分布也存在差异,优势种群也有所不同,表现出一定的地区和组织特异性。由此表明,植物的不同组织可主动选择一些特异性的真菌定殖,真菌群落结构的差异可能不仅由植物单独塑造,不同微生物间的相互作用也是重要影响因素,是外部环境和宿主两者共同作用导致的这种差异结果[37]。紫花针茅是青藏高原的特有优势植物类群,其根际和内生真菌具有一定的地域性,这些菌群与宿主植物之间建立了相对平衡稳定的关系,因此内生真菌群落受宿主影响要大于外界环境的影响。另外,紫花针茅根际土壤真菌群落除了受不同土壤类型本身的影响外,还受到由于海拔高度不同造成的气候因素、植被类型等的综合影响,环境的特化性低于根茎,从而对真菌群落的选择性也较低[38-39],这就很好地解释了本研究中,不同采样地区紫花针茅根际土壤真菌群落结构受采样地区影响小,而根茎内生真菌群落结构受采样地区影响大的原因。另外,在紫花针茅的根际和内生真菌中也有一些作为植物病原菌的真菌广泛存在,紫花针茅与这些病原菌之间的联系,以及病原菌的角色转换关系等有待进一步研究。
土壤pH、有机质、TN、AP、AK及主要微量元素,属于土壤微生态环境的基本组分,能直观反映土壤肥力状况,并对植物和微生物的生长产生重要影响。本研究的相关性分析显示,紫花针茅根际土壤真菌多样性指数和土壤理化性质中的pH、AP、AK、Fe、Ca和Mg呈显著正相关。有研究显示,高寒草甸土壤有机质、氮量、有效磷和有效镁的含量随海拔呈现先升高后降低,然后再升高的趋势,含量最低点在海拔3200–3400 m[40],本研究采样点海拔在2800–3800 m,相对海拔较低的GS采样点紫花针茅根际土壤真菌多样性大于海拔较高的QH和XZ采样点,本文根际土壤真菌多样性变化与该研究中高寒草甸土壤理化因子的海拔变化一致。有些真菌具有溶解无机或有机磷的能力,也有些可产生植酸酶,提高土壤中有效磷的含量[41],这也解释了本研究中土壤有效磷含量与真菌多样性呈正相关的结果。已有报道证实,在有效微量元素含量相对较低的贫瘠土壤中,植物根际和内生真菌能活化微量元素,促进宿主对微量元素的吸收[42],这也是本研究中真菌多样性与主要微量元素呈显著相关性的原因。李海云等[27]研究退化高寒草地土壤真菌群落发现,接合菌门Zygomycota、球囊菌门Glomeromycota和壶菌门Chytridiomycota真菌对环境的适应能力强,能够在盐碱地及贫瘠环境中生存;而担子菌门Basidiomycota和子囊菌门Ascomycota真菌菌群的环境适应能力差,适合在土壤肥力好、养分充足的土壤中生存。这一结果与本研究中子囊菌门Ascomycota和担子菌门Basidiomycota真菌与大部分土壤营养元素呈正相关,而接合菌门Zygomycota和球囊菌门Glomeromycota真菌与营养元素呈负相关的结果相似。
土壤酶调控土壤微生物对有机质的分解转化与养分循环,多数由微生物分泌,土壤微生物和土壤酶共同参与土壤的生物生化过程[43],土壤酶活性不仅能指示土壤养分的状态,还能反映其生化反应过程的方向和强度[44]。本研究中,土壤酶活性与真菌多样性的相关性分析结果表明,真菌多样性与土壤多酚氧化酶(PPO)、过氧化物酶(POD)和脱氢酶(DHA)呈显著或极显著的正相关,而与酸性磷酸酶(ACP)呈极显著的负相关。可能的原因在于:土壤多酚氧化酶(PPO)、过氧化物酶(POD)和脱氢酶(DHA)都属于氧化还原酶类,能直接氧化苯环、大分子类物质,影响土壤有机质的积累和代谢过程,而土壤的氧化酶多由真菌分泌合成,土壤真菌是土壤酶活性的重要来源,与土壤有机质输入组分密切相关,所以真菌的多样性对土壤氧化还原酶类有一定的促进作用[45-46]。另一方面,紫花针茅分布的西北高寒草原常年低温大风,生境中磷元素相对匮乏,此时微生物会通过酸性磷酸酶作用释放有效磷,促进土壤中的磷元素循环,从而满足植物和微生物生长的需求[45]。本研究中海拔较低的GS采样地根际土壤磷含量明显高于海拔较高的QH和XZ采样地,GS采样地的紫花针茅真菌释放的有效磷相对较少,因此酸性磷酸酶(ACP)活性低,而随着土壤磷含量的降低,QH和XZ采样地的紫花针茅真菌释放的有效磷含量增加,酸性磷酸酶(ACP)活性也随之增加,这可能是本研究中紫花针茅根际土壤真菌多样性与酸性磷酸酶(ACP)呈负相关的原因所在。西北高寒草原生态系统复杂,紫花针茅根际和体内真菌与根际微环境的相互影响有待进一步研究。
4 结论 青藏高原紫花针茅根际土壤pH呈中性偏碱,QH样地土壤的总氮、总碳、有机碳含量和碳氮比最高,XZ样地最低;GS样地的土壤有效钾、铁、钙和镁含量最高,XZ样地最低。GS样地的土壤多酚氧化酶、过氧化物酶和脱氢酶的活性最高,QH样地的土壤最高脲酶活性,XZ样地上述4种酶的活性最低,土壤酸性和碱性磷酸酶活性QH样地最高,XZ样地最低,土壤蔗糖酶活性GS样地最高,QH样地最低。GS和XZ样地的真菌群落多样性和丰富度均表现为根际土壤最高,叶最低,QH样地则为根际土壤最高,根最低。不同样地之间比较发现,GS样地紫花针茅不同部位的真菌群落多样性均高于其他2个样地,QH样地紫花针茅根际土壤和叶中的真菌群落多样性大于XZ样地,而根中的小于XZ样地。子囊菌门Ascomycota和担子菌门Basidiomycota是紫花针茅根际和体内主要内生真菌类群,不同采样地区紫花针茅内生真菌群落组成存在明显差异,而根际土壤真菌群落结构受采样地区的影响较小,样品间的差异不大。相关性检验发现,紫花针茅真菌多样性与土壤pH、有效钾、铁、钙、镁、多酚氧化酶、过氧化物酶和脱氢酶呈显著(P < 0.05)或极显著(P < 0.01)正相关,而与海拔、土壤酸性磷酸酶(ACP)呈极显著负相关。总之,土壤生态环境因子是青藏高原高寒草原紫花针茅根际真菌群落组成和多样性的主要驱动因素。
References
| [1] | Jiang J, Song MH. Review of the roles of plants and soil microorganisms in regulating ecosystem nutrient cycling. Chinese Journal of Plant Ecology, 2010, 34(8): 979-988. (in Chinese) 蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用. 植物生态学报, 2010, 34(8): 979-988. DOI:10.3773/j.issn.1005-264x.2010.08.011 |
| [2] | Hadar Y, Papadopoulou KK. Suppressive composts: microbial ecology links between abiotic environments and healthy plants. Annual Review of Phytopathology, 2012, 50(1): 133-153. DOI:10.1146/annurev-phyto-081211-172914 |
| [3] | Hyde KD, Soytong K. The fungal endophyte dilemma. Fungal Diversity, 2008, 33(1): 163-173. |
| [4] | Wang ZW, Ji YL, Chen YG, Kang Y. Endophytic fungi resources and species diversity in grass family. Acta Ecologica Sinica, 2010, 30(17): 4771-4781. (in Chinese) 王志伟, 纪燕玲, 陈永敢, 亢燕. 禾本科植物内生真菌资源及其物种多样性. 生态学报, 2010, 30(17): 4771-4781. |
| [5] | Cheplick GP, Faeth SH. Introduction: the grass-endophyte symbiosis. Ecology and Evolution of the Grass-Endophyte Symbiosis. Oxford: Oxford University Press, 2009: 3-17. |
| [6] | Kusari P, Kusari S, Spiteller M, Kayser O. Endophytic fungi harbored in Cannabis sativa L.: diversity and potential as biocontrol agents against host plant-specific phytopathogens. Fungal Diversity, 2013, 60(1): 137-151. DOI:10.1007/s13225-012-0216-3 |
| [7] | Kaul S, Gupta S, Ahmed M, Dhar MK. Endophytic fungi from medicinal plants: a treasure hunt for bioactive metabolites. Phytochemistry Reviews, 2012, 11(4): 487-505. DOI:10.1007/s11101-012-9260-6 |
| [8] | Yuan ZL, Zhang CL, Lin FC. Recent advances on physiological and molecular basis of fungal endophyte-plant interactions. Acta Ecologica Sinica, 2008, 28(9): 4430-4439. (in Chinese) 袁志林, 章初龙, 林福呈. 植物与内生真菌互作的生理与分子机制研究进展. 生态学报, 2008, 28(9): 4430-4439. DOI:10.3321/j.issn:1000-0933.2008.09.043 |
| [9] | Tian P, Zhang GM, Nan ZB. Advances in research on grass endophytes in agricultural systems and applications in forage breeding. Acta Prataculturae Sinica, 2016, 25(12): 206-220. (in Chinese) 田沛, 张光明, 南志标. 禾草内生真菌研究及应用进展. 草业学报, 2016, 25(12): 206-220. DOI:10.11686/cyxb2016049 |
| [10] | Liu H, Chen T, Xia C. On the response of plant-soil feedback to grass endophytes. Pratacultural Science, 2020, 37(1): 65-74. (in Chinese) 刘欢, 陈焘, 夏超. 植物-土壤反馈对禾草内生真菌响应. 草业科学, 2020, 37(1): 65-74. |
| [11] | Wu ZY. Chinese vegetation. Beijing: Science Press, 1980. (in Chinese) 吴征镒, 中国植被编辑委员会. 中国植被. 北京: 科学出版社, 1980. |
| [12] | Yue PP, Sun J, Lu XF, Ye RR, Zhou YB, Yang SB, Peng M. Quantitative classification and ordination of Stipa purpurea Steppe community in Qinghai plateau. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(5): 1047-1054. (in Chinese) 岳鹏鹏, 孙菁, 卢学峰, 叶润蓉, 周玉碧, 杨仕兵, 彭敏. 青海高原紫花针茅草原群落数量分类与排序. 西北植物学报, 2014, 34(5): 1047-1054. |
| [13] | Li X, Yin X, Yang SH, Yang YQ, Hu XY, Yang YP. Effects of temperatures on seed germination characteristics of alpine plant Stipa purpurea (Poaceae). Plant Diversity and Resources, 2014, 36(6): 698-706. (in Chinese) 李雄, 尹欣, 杨时海, 杨云强, 胡向阳, 杨永平. 温度对高山植物紫花针茅种子萌发特性的影响. 植物分类与资源学报, 2014, 36(6): 698-706. |
| [14] | Liu WS, Dong M, Song ZP, Wei W. Genetic diversity pattern of Stipa purpurea populations in the hinterland of Qinghai-Tibet Plateau. Annals of Applied Biology, 2009, 154(1): 57-65. DOI:10.1111/j.1744-7348.2008.00274.x |
| [15] | Zhou HK, Zhao XQ, Wen J, Chen Z, Yao BQ, Yang YW, Xu WX, Duan JC. The characteristics of soil and vegetation of degenerated alpine steppe in the Yellow River Source Region. Acta Prataculturae Sinica, 2012, 21(5): 1-11. (in Chinese) 周华坤, 赵新全, 温军, 陈哲, 姚步青, 杨元武, 徐维新, 段吉闯. 黄河源区高寒草原的植被退化与土壤退化特征. 草业学报, 2012, 21(5): 1-11. |
| [16] | Yang J, An SZ, Dong YQ, Ayimin B, Zhang JJ. Effects of degradation degree on modules growth and biomass allocation of Stipa purpurea population at flowering stage. Chinese Journal of Grassland, 2018, 40(4): 75-81. (in Chinese) 杨娇, 安沙舟, 董乙强, 阿依敏·波拉提, 张晶晶. 退化程度对紫花针茅花期种群构件生长及生物量分配的影响. 中国草地学报, 2018, 40(4): 75-81. |
| [17] | Li XE, Meng FD, Jiang LL, Zhang LR, Jia SG, Wang SP, Cui X, Lü WW. Small-scale spatial patterns of Kobresia humilis and Stipa purpurea in typical plant communities from east to west across the northern Tibetan Plateau. Chinese Journal of Ecology, 2019, 38(9): 2577-2584. (in Chinese) 李新娥, 孟凡栋, 姜丽丽, 张立荣, 贾书刚, 汪诗平, 崔霞, 吕汪汪. 藏北高原自东向西样带典型植物群落中矮嵩草与紫花针茅小尺度空间格局变化. 生态学杂志, 2019, 38(9): 2577-2584. |
| [18] | Yang YQ, Li X, Kong XX, Ma L, Hu XY, Yang YP. Transcriptome analysis reveals diversified adaptation of Stipa purpurea along a drought gradient on the Tibetan Plateau. Functional & Integrative Genomics, 2015, 15(3): 295-307. |
| [19] | Hong JT, Wu JB, Wang XD. Effects of grazing and fencing on Stipa purpurea community biomass allocation and carbon, nitrogen and phosphorus pools on the northern Tibet Plateau alpine. Pratacultural Science, 2015, 32(11): 1878-1886. (in Chinese) 洪江涛, 吴建波, 王小丹. 放牧和围封对藏北高寒草原紫花针茅群落生物量分配及碳、氮、磷储量的影响. 草业科学, 2015, 32(11): 1878-1886. DOI:10.11829/j.issn.1001-0629.2015-0076 |
| [20] | Li X, Yang SH, Yang YQ, Yin X, Sun XD, Yang YP. Comparative physiological and molecular analyses of intraspecific differences of Stipa purpurea (Poaceae) response to drought. Plant Diversity and Resources, 2015, 37(4): 439-452. (in Chinese) 李雄, 杨时海, 杨云强, 尹欣, 孙旭东, 杨永平. 不同居群紫花针茅响应干旱胁迫的生理和分子差异分析(英文). 植物分类与资源学报, 2015, 37(4): 439-452. |
| [21] | Wang J, Wang GQ, Li F, Peng YF, Yang GB, Yu JC, Zhou GY, Yang YH. Effects of short-term experimental warming on soil microbes in a typical alpine steppe. Chinese Journal of Plant Ecology, 2018, 42(1): 116-125. (in Chinese) 王军, 王冠钦, 李飞, 彭云峰, 杨贵彪, 郁建春, 周国英, 杨元合. 短期增温对紫花针茅草原土壤微生物群落的影响. 植物生态学报, 2018, 42(1): 116-125. |
| [22] | Lu DX, Jin H, Yang XY, Zhang DH, Yan ZQ, Li XZ, Zhao YH, Han RB, Qin B. Characterization of rhizosphere and endophytic fungal communities from roots of Stipa purpurea in alpine steppe around Qinghai Lake. Canadian Journal of Microbiology, 2016, 62(8): 643-656. DOI:10.1139/cjm-2015-0857 |
| [23] | Bao GS, Li CJ. Isolation and identification of endophytes infecting Stipapurpurea, a dominant grass in meadows of the Qinghai-Tibet Plateau. Acta Prataculturae Sinica, 2016, 25(3): 32-42. (in Chinese) 鲍根生, 李春杰. 青藏高原高寒草地优势禾草-紫花针茅内生真菌分离和鉴定. 草业学报, 2016, 25(3): 32-42. |
| [24] | Gu ZL. The poisonous and harm plants and control effect of Su'Nan County. Journal of Animal Science and Veterinary Medicine, 2019, 38(5): 58-60. (in Chinese) 顾自林. 肃南县天然草原毒害草种类及防治效果. 畜牧兽医杂志, 2019, 38(5): 58-60. |
| [25] | Li S, Jiang ZH, Zhang DG, Nie ZN, Chen JG, Hu XZ, Chen L, Yuan ZR, Ren L. Distribution characteristics of soil organic carbon in northern slope of alpine meadow steppe in Qilian mountains in Qilian County, Qinghai Province. Pratacultural Science, 2016, 33(8): 1469-1475. (in Chinese) 李硕, 姜哲浩, 张德罡, 聂中南, 陈建纲, 胡新振, 陈璐, 袁子茹, 任灵. 青海省祁连县高寒草甸草原土壤有机碳分布特征. 草业科学, 2016, 33(8): 1469-1475. |
| [26] | Sun GM, Da W, Zhang Q, Luo S, Jiang H, Cidanyangji. Investigation on health system of natural meadow in Sibu village in Mozhugongka county, Tibet Autonomous Region. Hubei Journal of Animal and Veterinary Sciences, 2019, 40(7): 9-12. (in Chinese) 孙光明, 达娃央拉, 张强, 洛桑顿珠, 姜辉, 次旦央吉. 西藏墨竹工卡县斯布村天然草地健康体系调查研究. 湖北畜牧兽医, 2019, 40(7): 9-12. DOI:10.3969/j.issn.1007-273X.2019.07.004 |
| [27] | Li HY, Yao Y, Gao YM, Zhang JG, Ma YC, Lu XW, Yang XL, Zhang HR, Xia DH. Relationship between soil fungal community and soil environmental faxtors in degraded alpine grassland. Acta Microbiologica Sinica, 2019, 59(4): 678-688. (in Chinese) 李海云, 姚拓, 高亚敏, 张建贵, 马亚春, 路晓雯, 杨晓蕾, 张慧荣, 夏东慧. 退化高寒草地土壤真菌群落与土壤环境因子间相互关系. 微生物学报, 2019, 59(4): 678-688. |
| [28] | Bao SD. Soil and Agricultural Chemistry Analysis. Beijing: Chinese Agriculture Press, 2000. (in Chinese) 鲍士旦. 土壤农化分析. 第3版. 北京: 中国农业出版社, 2000. |
| [29] | Guan SY. Soil Enzymes and Their Research Methods. China Agriculture Press, 1986. (in Chinese) 关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986. |
| [30] | Yang XY, Jin H, Xu LH, Cui HY, Xin AY, Liu HY, Qin B. Diversity and functions of endophytic fungi associated with roots and leaves of Stipa purpurea in an alpine steppe at Qinghai-Tibet plateau. Journal of Microbiology and Biotechnology, 2020, 30(7): 1027-1036. DOI:10.4014/jmb.2002.02056 |
| [31] | Xia F, Chen X, Guo MY, Bai XH, Liu Y, Shen GR, Li YL, Lin J, Zhou XW. High-throughput sequencing-based analysis of endogenetic fungal communities inhabiting the Chinese Cordyceps reveals unexpectedly high fungal diversity. Scientific Reports, 2016, 6: 33437. DOI:10.1038/srep33437 |
| [32] | van der Wal A, van Veen JA, Smant W, Boschker HTS, Bloem J, Kardol P, van der Putten WH, de Boer W. Fungal biomass development in a chronosequence of land abandonment. Soil Biology and Biochemistry, 2006, 38(1): 51-60. DOI:10.1016/j.soilbio.2005.04.017 |
| [33] | Yu L, Nicolaisen M, Larsen J, Ravnskov S. Molecular characterization of root-associated fungal communities in relation to health status of Pisum sativum using barcoded pyrosequencing. Plant and Soil, 2012, 357(1/2): 395-405. |
| [34] | Fu J, Liu YF, Mei M, Huang YH. Comparing analysis of diversity of Chinese leek rhizospheritic and endophytic fungal communities. Acta Agriculturae Boreali-Sinica, 2018, 33(S1): 246-252. (in Chinese) 付静, 刘堰凤, 梅眉, 黄永红. 韭菜根际真菌和内生真菌种群多样性分析. 华北农学报, 2018, 33(S1): 246-252. DOI:10.7668/hbnxb.2018.S1.039 |
| [35] | Zhu GS, Guiyang, Huang YH, Liu ZY. The endophytic fungus resources of spermatophyte in China and their coevolution. Journal of Fungal Research, 2005, 3(2): 6-13. (in Chinese) 朱国胜, 桂阳, 黄永会, 刘作易. 中国种子植物内生真菌资源及菌植协同进化. 菌物研究, 2005, 3(2): 6-13. DOI:10.3969/j.issn.1672-3538.2005.02.002 |
| [36] | Li WY, Li X, Xie KZ, Deng WQ, Zhuang WY. Systematics and species diversity of botryosphaeriaceous fungi. Biodiversity Science, 2017, 25(8): 874-885. (in Chinese) 李文英, 李夏, 解开治, 邓旺秋, 庄文颖. 葡萄座腔菌科真菌的系统学和多样性探讨. 生物多样性, 2017, 25(8): 874-885. |
| [37] | Zhu LJ, Wei ZM, Yang TX, Zhao XY, Dang QL, Chen XM, Wu JQ, Zhao Y. Core microorganisms promote the transformation of DOM fractions with different molecular weights to improve the stability during composting. Bioresource Technology, 2020, 299: 122575. DOI:10.1016/j.biortech.2019.122575 |
| [38] | Tedersoo L, Bahram M, P?lme S, K?ljalg U, Yorou NS, Wijesundera R, Ruiz LV, Vasco-Palacios AM, Thu PQ, Suija A, Smith ME, Sharp C, Saluveer E, Saitta A, Rosas M, Riit T, Ratkowsky D, Pritsch K, P?ldmaa K, Piepenbring M, Phosri C, Peterson M, Parts K, P?rtel K, Otsing E, Nouhra E, Njouonkou AL, Nilsson RH, Morgado LN, Mayor J, May TW, Majuakim L, Lodge DJ, Lee SS, Larsson KH, Kohout P, Hosaka K, Hiiesalu I, Henkel TW, Harend H, Guo LD, Greslebin A, Grelet G, Geml J, Gates G, Dunstan W, Dunk C, Drenkhan R, Dearnaley J, de Kesel A, Dang T, Chen X, Buegger F, Brearley FQ, Bonito G, Anslan S, Abell S, Abarenkov K. Global diversity and geography of soil fungi. Science, 2014, 346(6213): 1256688. DOI:10.1126/science.1256688 |
| [39] | Edwards J, Johnson C, Santos-Medellín C, Lurie E, Podishetty NK, Bhatnagar S, Eisen JA, Sundaresan V. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of National Academy of the Sciences of the United States of America, 2015, 112(8): E911-E920. DOI:10.1073/pnas.1414592112 |
| [40] | Wang RY, Liu SS, Wang CZ, Guo YX, Yan XB. Analysis on soil physicochemical indices at different altitudes in alpine rangeland. Acta Agrestia Sinica, 2009, 17(5): 621-628. (in Chinese) 王瑞永, 刘莎莎, 王成章, 郭玉霞, 严学兵. 不同海拔高度高寒草地土壤理化指标分析. 草地学报, 2009, 17(5): 621-628. |
| [41] | Zhu L, Huang J, Chen TY, Zhou YB. Root-associated and endophytic fungal community diversity in Xanthoceras sorbifolia bunge plantation. Journal of Northeast Forestry University, 2015, 43(5): 105-111. (in Chinese) 朱琳, 黄建, 陈天阳, 周永斌. 文冠果人工林根际土壤真菌和根系内生真菌群落多样性. 东北林业大学学报, 2015, 43(5): 105-111. |
| [42] | He XL, Ma L, Meng JJ, Wang P. Effects of AM fungi on the growth and nutrients of Salvia miltiorrhiza Bge. under different soil water and fertilizer conditions. Acta Ecologica Sinica, 2012, 32(18): 5721-5728. (in Chinese) 贺学礼, 马丽, 孟静静, 王平. 不同水肥条件下AM真菌对丹参幼苗生长和营养成分的影响. 生态学报, 2012, 32(18): 5721-5728. |
| [43] | Liu ST, Tian CL, Cao WM, Zheng BB, Li PC, Dong HL. Characteristics analysis of rhizosphere microorganisms and enzyme activities of cotton based on different soil textures. Journal of Agricultural Science and Technology, 2020, 22(2): 73-79. (in Chinese) 刘松涛, 田春丽, 曹雯梅, 郑贝贝, 李鹏程, 董合林. 基于不同土壤质地棉花根际微生物和酶活性特征分析. 中国农业科技导报, 2020, 22(2): 73-79. |
| [44] | Li HY, Zhang JG, Yao T, Yang XM, Gao YM, Li CN, Li Q, Feng Y. Soil nutrients, enzyme activities and ecological stoichiometric characteristics in degraded alpine grasslands. Journal of Soil and Water Conservation, 2018, 32(5): 287-295. (in Chinese) 李海云, 张建贵, 姚拓, 杨晓玫, 高亚敏, 李昌宁, 李琦, 冯影. 退化高寒草地土壤养分、酶活性及生态化学计量特征. 水土保持学报, 2018, 32(5): 287-295. |
| [45] | Gu XN, He HS, Tao Y, Jin YH, Zhang XY, Xu ZW, Wang YT, Song XX. Soil microbial community structure, enzyme activities, and their influencing factors along different altitudes of Changbai Mountain. Acta Ecologica Sinica, 2017, 37(24): 8374-8384. (in Chinese) 谷晓楠, 贺红士, 陶岩, 靳英华, 张心昱, 徐志伟, 王钰婷, 宋祥霞. 长白山土壤微生物群落结构及酶活性随海拔的分布特征与影响因子. 生态学报, 2017, 37(24): 8374-8384. |
| [46] | Chu HL, Li S, Tang M. Soil enzyme activity and fungal community diversity in rhizosphere of Pinus tabulaeformis carr. growing on loess plateau-a case study of Huanglongshan forest farm. Acta Pedologica Sinica, 2015, 52(1): 154-161. (in Chinese) 褚洪龙, 李莎, 唐明. 黄土高原油松根际土壤酶活性及真菌群落多样性研究——以黄龙山林场为例. 土壤学报, 2015, 52(1): 154-161. |
