张珂飞, 钟永嘉

 , 孙丽莉, 廖红
, 孙丽莉, 廖红 福建农林大学根系生物学研究中心/资源与环境学院, 福建 福州 350002
收稿日期:2020-08-30;修回日期:2020-10-19;网络出版日期:2020-10-22
基金项目:中国科学院战略性先导科技专项(XDB15030202)
*通信作者:钟永嘉, Tel: +86-591-88260952;E-mail: Yongjiazhong@fafu.edu.cn.
摘要:伯克霍尔德氏菌属是一类革兰氏阴性细菌,其具有广泛的地理及生态位分布。近年来,随着对植物相关的伯克霍尔德氏菌的研究增加,越来越多的证据表明,伯克霍尔德氏菌是一类重要的植物相关的有益微生物。伯克霍尔德氏菌能够通过生物固氮、解磷作用,促进植物对氮、磷的吸收;还能够产生吲哚乙酸等植物激素、分泌抗菌物质抑制病原菌的生长,因此,伯克霍尔德氏菌在促进植物生长和维持植物健康方面具有较大的应用潜力。本文对近些年来关于植物有益的伯克霍尔德氏菌的研究进展进行了综述,并讨论了其在农业上的应用前景。
关键词:伯克霍尔德氏菌促生固氮解磷抗菌
Plant–associated beneficial Burkholderia
Kefei Zhang, Yongjia Zhong

 , Lili Sun, Hong Liao
, Lili Sun, Hong Liao Fujian Agriculture and Forestry University, Root Biology Center/College of Resources and Environment, Fuzhou 350002, Fujian Province, China
Received: 30 August 2020; Revised: 19 October 2020; Published online: 22 October 2020
*Corresponding author: Yongjia Zhong, Tel: +86-591-88260952; E-mail: Yongjiazhong@fafu.edu.cn.
Foundation item: Supported by the Strategic Priority Research Program of the Chinese Academy of Sciences (XDB15030202)
Abstract: Burkholderia spp. is a class of Gram-negative bacteria with a wide geographical and niche distribution. In recent years, with the increasing research on plant associated Burkholderia, more and more evidences suggest that Burkholderia is an important plant-associated beneficial microorganism. Burkholderia could promote plant growth through biological nitrogen fixation, phosphorus solubilizing, to increase nitrogen and phosphorus absorption, production of phytohormones like IAA and antifungal metabolites to inhibit the growth of phytopathogenic microorganisms. All of these make Burkholderia with great application potential in promoting plant growth and health. This article reviews the research progresses of the plant-associated beneficial Burkholderia and discusses its application prospects in agriculture.
Keywords: Burkholderiaplant growth promotionnitrogen fixationphosphate solubilizationantifungal activity
伯克霍尔德氏菌(Burkholderia)是以美国植物病理学家沃尔特·伯克霍尔德的名字命名的。1942年,沃尔特发现的第一个“伯克霍尔德氏菌”葱生植物单胞菌(Phytomonas alliicola)为洋葱的病原体,能够引起洋葱球茎的腐烂[1]。1992年,Yabuuchi等首次提出伯克霍尔德氏菌属,并将几个最初被归类为假单胞菌属(Pseudomonas)和杆菌属(Bacilli)的物种归入该伯克霍尔德氏菌属[2]。伯克霍尔德氏菌属是一类分布广泛、功能多样的细菌,其分类复杂,成员占据了包括土壤、水、植物和动物在内的各种生态位[3]。由于其临床的重要性,先前的研究大都集中在致病菌上。近年来,随着与植物相关的伯克霍尔德氏菌被不断的发现且大多对植物的生长有益[4-5]。由此,伯克霍尔德氏菌属被分为两类:一类是人体、动物和植物中的病原体;另一类为非致病性物种。
对植物有益的伯克霍尔德氏菌是一类重要的植物根际促生菌(PGPR: plant growth promoting rhizobacteria),普遍存在于红壤中,经常在植物根系中被发现。据报道,伯克霍尔德氏菌能够在至少30种植物的根系大量定殖[3-4, 6],具有多种促生功能(表 1)。作为植物促生菌的伯克霍尔德氏菌至少具有如下功能之一:(1) 生物固氮:将大气中的氮气转化为氨,促进氮循环,增加农业生态系统的氮输入,提高植物对氮的吸收利用[7-8];(2) 解磷:通过分泌有机酸或酸性磷酸酶等,将土壤中难溶性磷转化为可供植物直接吸收利用的可溶性磷,促进植物对土壤磷的利用[9-10];(3) 促生:产生植物激素生长素刺激植物根系生长和分泌铁载体利于植物对微量元素的获取[6];(4) 抗菌:抑制植物病原菌生长,被用作生物防治剂[11]。此外,部分菌株能够降解环境中的污染物,如甲苯等土壤污染物,因此可以联合植物进行土壤修复[4, 12]
表 1. 植物相关的有益伯克霍尔德氏菌的主要特征 Table 1. Main characteristics of the plant-associated beneficial (PBE) Burkholderia group
| Species | nif | nod | Phosphate solubilization | ACC deaminase | IAA | Antifungal activity | References |
| B. anthina | + | - | - | - | - | - | [17] |
| B. ambifaria | + | - | - | + | + | + | [18-19] |
| B. acidipaludis | + | - | - | - | - | - | [20] |
| B. australis | + | - | - | - | - | - | [15] |
| B. bannensis | + | - | - | - | - | - | [20] |
| B. caribensis | + | - | + | + | + | - | [21-22] |
| B. cepacia | - | - | + | + | - | + | [10, 13, 23-25] |
| B. caledonica | - | - | - | + | - | - | [26] |
| B. fungorum | - | - | + | + | - | - | [14, 26] |
| B. heleia | + | - | - | - | - | - | [20] |
| B. kururiensis | + | - | - | + | + | - | [27-28] |
| P. mimosarum | + | + | - | - | - | - | [29-30] |
| P. nodosa | + | + | - | - | - | - | [30-31] |
| P. phymatum | + | + | - | + | - | - | [30, 32-33] |
| B. phytofirmans | - | - | - | + | + | - | [9, 34] |
| B. phyrrocinia | - | - | + | - | - | + | [35] |
| B. silvatlantica | + | - | - | + | - | - | [36] |
| B. tropica | + | - | + | + | + | - | [21, 37] |
| B. tuberum | + | + | - | + | - | - | [38-40] |
| B. unamae | + | - | + | + | + | - | [4, 9, 26, 41] |
| B. vietnamiensis | + | - | - | - | - | - | [42-43] |
| *ACC: aminocyclopropane-1-carboxylate; IAA: indole-3-acetic acid; B.: Burkholderia; P.: Paraburkholderia. | |||||||
表选项
目前,大量文献报道伯克霍尔德氏菌属对植物特别是对农作物具有促生作用。例如:天然存在于玉米根际的洋葱伯克霍尔德氏菌(Burkholderia cepacia),能够有效促进玉米生长[13];Burkholderia fungorum在营养不良的氧化土中,显著促进菜豆生长[14];在甘蔗根部定殖的部分伯克霍尔德氏菌株,可以通过生物固氮作用在低氮条件下促进甘蔗的生长[15];接种伯克霍尔德氏菌,有效地提高了水稻对磷的吸收,进而促进水稻生长和提高籽粒产量[16]。由此可见,伯克霍尔德氏菌在促进农作物生长方面具有很大的研究价值和应用潜力。
1 伯克霍尔德氏菌的功能研究 植物相关的伯克霍尔德氏菌具有多种有益于植物的功能,例如在植物表面和根际的定殖、固氮、解磷、降低植物乙烯的水平、产生生长素、保护植物免受生物胁迫以及降解污染物等的功能(图 1)。因此,对伯克霍尔德氏菌的开发与应用,为作物生产提供了新的策略,同时也为现代农业“减肥增效”开辟了新途径。
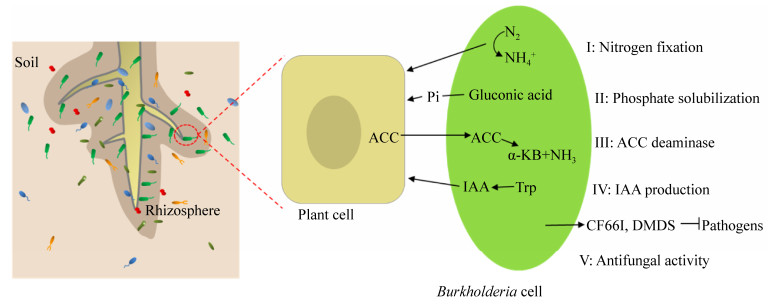 |
| 图 1 伯克霍尔德氏菌的功能研究 Figure 1 Functional studies of Burkholderia. |
| 图选项 |
1.1 植物组织定殖能力 植物有益菌能够在植物组织和根系表面有效定殖对于促进植物的生长很重要[44]。因此在探究植物根际促生菌促生功能的同时,应明确其在植物组织内的定殖能力与定殖方式。通过电镜观察接种过B. kururiensis的水稻植株的根部发现,细菌首先附着在根毛区的表皮细胞上,在根毛基部进行繁殖并完成侵染,最后通过内皮层进行内生定殖然后进入木质部[28]。此外,固氮伯克霍尔德氏菌与甘蔗相互作用的分子机制的研究结果显示,伯克霍尔德氏菌首先在甘蔗根部表面形成了一层生物膜,通过抑制植物的免疫反应在根部定殖。甘蔗通过扩大根部通气组织来应对生物膜引起的氧气限制,并为细菌提供光合产物;与此同时,伯克霍尔德氏菌会向甘蔗提供生长所需的氮源[45]。伯克霍尔德氏菌通过不同的方式有效地在植物组织内完成内生定殖,这为后期同植物相互作用奠定了基础。
1.2 固氮能力及与豆科植物共生结瘤 自然生长的植物的氮素来源主要有:土壤中的有机物降解、大气氮沉降以及生物固氮。其中生物固氮提供了绝大部分的氮素来源[46]。生物固氮是指在土壤中固氮微生物的作用下将大气中的氮气还原成氨的过程。植物可以通过与固氮微生物相互作用来获取自身所需的氮源。固氮菌利用固氮酶基因(nif)来进行固氮反应,在伯克霍尔德氏菌属的一些菌株中已经证实了nifHDK基因簇的存在[7]。1995年,Gillis等从水稻的根系中分离得到的越南伯克霍尔德氏菌(B. vietnamiensis),通过研究发现其具有固氮作用,这是第一个被发现具有固氮功能的伯克霍尔德氏菌[42]。Santos等通过分析田间玉米、高粱和咖啡等根系微生物,发现在所有固氮微生物中,伯克霍尔德氏菌最为丰富。由此表明,伯克霍尔德氏菌属可能是一个富含固氮功能的菌属[7]。并且在墨西哥本地玉米相关的内生固氮伯克霍尔德氏菌属的研究中发现,这些菌株与其寄主的共生关系在大刍草驯化为玉米的过程中持续存在[47]。除此之外,伯克霍尔德氏菌作为甘蔗固氮菌的研究报道也有很多,Perin等从巴西不同地区、多个甘蔗品种根部分离提取到的固氮微生物,通过DNA-DNA同源性分析、16S rRNA序列相似性比对,最终确定其为B. silvatlantica,这些伯克霍尔德氏菌可以通过生物固氮帮助甘蔗获取更多的氮源[36]。另外具有固氮功能的伯克霍尔德氏菌(B. australis),也可以在甘蔗根部大量定殖,并且在低氮条件下促进甘蔗的生长[15]。最近,Malviya等通过对转录组的数据分析发现,与对照组相比,接种固氮伯克霍尔德氏菌MYSP113的甘蔗根中,碳水化合物代谢的多个代谢途径受到调控。另外,接种处理的甘蔗根部的过氧化物酶和超氧歧化酶活性也显著提高[17]。有关伯克霍尔德氏菌固氮功能的研究,为实现低投入且长期可持续的农业生产中氮肥的高效利用,提供了可行性的替代方案。
普遍认为,豆科植物并非只和α-变形菌门中的根瘤菌科成员结瘤,也可以与β-变形菌门的成员结瘤。伯克霍尔德氏菌属(在分类学上属于β-变形菌门)与豆科根瘤菌属的大多数菌株在系统进化学上有亲缘关系,但直到2001年才首次发现其与豆科植物可以形成共生关系[40]。之后,Chen等发现台湾当地入侵性的含羞草植株主要利用伯克霍尔德氏菌属作为根瘤共生菌[48]。B. phymatum是一种有效的含羞草共生固氮菌,该菌株的乙炔还原活性较强,且寄主范围广泛,可以与多种含羞草共生[32]。除了与豆科植物含羞草形成共生结瘤外,B. tuberum还可以与蝶形豆科植物共生[38]。最新的研究表明,伯克霍尔德氏菌、副伯克霍尔德氏菌(Paraburkholderia)是委内瑞拉部分地区大豆根部主要的根瘤菌,其中副伯克霍尔德氏菌属中的VTr53菌株表现出高结瘤性、高固氮能力以及耐酸耐Al3+等特性[49]。对这类伯克霍尔德氏菌的开发和利用,为促进酸性土壤条件下大豆的生长以及产量的提升,提供了新的策略。
1.3 解磷促生功能 土壤中的磷含量十分丰富,但是由于磷元素自身化学性质的原因,土壤中可供植物利用的可溶性磷含量远低于植物生长发育所需要的磷浓度[50]。为了适应土壤中有效磷含量低的环境因素,植物在生长的过程中进化出了复杂的调控机制,包括局部磷信号和系统磷信号(或者长距离磷信号),来维持细胞内磷的平衡[51]。此外,土壤中的解磷细菌能够通过分泌有机酸或酸性磷酸酶等,将难被植物直接吸收利用的磷转化为可溶性磷,从而提高土壤中磷的可利用性[52]。目前,已经证实了一些伯克霍尔德氏菌具有解磷功能。
白羽扇豆在低磷胁迫下形成的排根,富集了大量的解磷伯克霍尔德氏菌(占所有分离菌株的58%);并且随着排根的生长,伯克霍尔德氏菌的富集程度也显著增加。这些分离自白羽扇豆根部的伯克霍尔德氏菌通过溶解难溶性的无机磷,促进植株在低磷环境下的生长[53]。洋葱伯克霍尔德氏菌(B. cepacia) SAOCV2作为接种剂,可以提高菜豆对土壤中磷的吸收,相比于未接种的对照组,接种该菌株后的菜豆植株的磷含量提高了44%[10]。解磷伯克霍尔德氏菌还可以促进豇豆的结瘤、根茎生物量、籽粒产量以及对土壤中磷氮的吸收[54]。
伯克霍尔德氏菌对难溶性无机磷酸盐的溶解主要是通过产生葡萄糖酸来实现的。葡萄糖酸具有螯合性,可以与Ca2+离子形成不溶性复合物,进而将磷酸盐从磷酸三钙中释放出来供植物吸收利用[23]。Song等发现,当3%的葡萄糖作为碳源时,洋葱伯克霍尔德氏菌(B. cepacia) DA23具有明显的溶解矿物质磷酸盐能力,并且磷酸盐的溶解与菌株引起的pH值降低有关[24]。从四川当地的玉米根际中分离到的1株洋葱伯克霍尔德氏菌(B. cepacia) SCAUK0330具有较强的解磷能力,该菌株可以从不溶性磷酸三钙中溶解出大量的磷酸盐。从该菌株上扩增了功能性的磷酸盐溶解基因gabY,将其连接到载体质粒上,构建出了表达质粒Pym359并转入大肠杆菌中。在含有磷酸三钙的平板上可以观察到,携带有质粒Pym359的大肠杆菌菌落周围有明显的磷酸盐溶解区,这说明该菌株溶解难溶性无机磷酸盐的能力部分归因于gabY基因的表达[55]。尽管目前相关的研究不断增加,但伯克霍尔德氏菌解磷功能的遗传背景和机理尚未完全解答,对此还需深入探究。
1.4 ACC脱氨酶活性和IAA的产生 通过ACC脱氨酶的作用降低植物的乙烯水平是植物促生菌促进植物生长的主要机制之一。处于胁迫条件下的植株,根际和种子中能够富集可以产生ACC脱氨酶的细菌,帮助植物应对逆境[56]。ACC是植物合成乙烯的前体之一,ACC脱氨酶可以将其降解为氨和α-丁酮酸,从而降低植物的乙烯水平,进而促进植物生长[57-58]。ACC脱氨酶相关编码基因acdS在伯克霍尔德氏菌属的多个物种中被发现。缺失abcS基因的突变体菌株B. phytofirmans失去了ACC脱氨酶活性,同时也失去了促进油菜幼苗根系伸长的能力[34]。从洋葱根茎中分离到的伯克霍尔德氏菌(PsJNT)表现出较高的ACC脱氨酶活性,该菌株可以降低正在生长或者受到胁迫的植物的乙烯水平,促进植物的生长[59]。此外,番茄根际的B. unamae被证实可以通过ACC脱氨酶的作用促进番茄的生长[41]。豆科植物根瘤中的共生菌B. phymatum和B. tuberum则可以通过ACC脱氨酶活性增加豌豆根部的结瘤数[33]。这有助于提高豌豆对氮的吸收利用。
植物生长素可以通过控制根系的生长和发育来促进植物的生长。吲哚乙酸(IAA)是最常见的天然存在的生长素,其在多种土壤和根际细菌中存在,并且在植物与微生物的互作中起着一定的作用。伯克霍尔德氏菌中的B. kururiensis、B. phytofirmans、B. unamae已经被报道可以通过产生IAA来促进植株的生长[9, 34]。用含有生长素响应报告基因(DR5-GUS)的转基因水稻接种B. kururiensis,并对菌株分泌IAA的情况进行了测定,结果表明该菌株产生的生长素对植物的生长具有促进作用,并且可以提高水稻籽粒产量[28]。在与植物的互作中B. phytofirmans不仅可以产生IAA,还可以降解可能抑制植物生长的过量的外源IAA[60]。因此,利用此类微生物作为接种剂可以有效改善植物的生长状态。
1.5 植物病原菌抑制能力 伯克霍尔德氏菌属中的部分菌株可以产生具有抗菌活性的化合物,有效抑制土壤中部分病原菌的生长,从而达到生物防治的效果[11]。从巴西当地甘蔗的根和茎中分离到的许多伯克霍尔德氏菌都能产生抗真菌代谢物吡咯硝基苷[61]。洋葱伯克霍尔德氏菌(B. cepacia) MCI7能够拮抗并抑制玉米土壤中的主要真菌病原体,如镰刀菌属真菌(Fusarium verticillioides)缓解玉米的染病状况[25]。B. ambifaria通过释放可扩散的抑菌化合物,来抑制土壤中多种病原真菌菌丝的生长。该菌株作为种子包裹剂可以显著抑制病原菌(Pythium ultimum)对黄瓜和大豆的感染,维持黄瓜和大豆的健康[18]。此外,洋葱伯克霍尔德氏菌(B. cepacia)产生的抗真菌化合物CF66I对多种病原真菌的生长有抑制作用[62]。低剂量的CF66I主要通过引起真菌菌丝肿胀,导致几丁质沉积异常,改变真菌细胞壁结构等来抑制病原菌的生长,当CFF6I的剂量达到120 μg/mL时主要作用于细胞膜来杀死病菌[63]。
Sandania等研究了伯克霍尔德氏菌对辣椒病原菌(Colletotrichum truncatum)的拮抗作用,菌株在体外对病原菌芽孢萌发的抑制作用接近100%。通过显微观察受到拮抗作用的真菌菌丝发现,菌丝出现了增厚、肿胀和畸形等多种变形。体内实验表明,经过伯克霍尔德氏菌接种处理的辣椒种子,被病原菌定殖感染的几率显著降低(P < 0.05)。并且在种子出苗后,幼苗存活率和植株活力均显著高于未处理对照组。此外,伯克霍尔德氏菌对红辣椒果实着色期炭疽病的防治效果为100%[64]。国内的****研究发现吡咯伯克霍尔德氏菌(B. pyrrocinia) WY6-5可以产生二甲基二硫(DMDS: dimethyl disulfide)这一具有挥发性的物质,二甲基二硫具有高效广谱的抑菌作用,以及潜在的促进植物生长的活性,为抑菌性生物肥料的制备,提供潜在的生物活性材料[35]。
基于伯克霍尔德氏菌的抗菌作用,近些年该菌株还被用于草莓、樱桃、苹果、梨和桃等多种水果的采后保鲜。草莓采前喷施洋葱伯克霍尔德氏菌菌悬液后,菌株可以有效地在果实表面定殖,进而抑制果实表面病原菌的生长,从而降低果实腐烂,提升草莓品质,延缓果实硬度、可溶性固形物、可滴定酸,一定程度上可以保持草莓果实的亮度[65]。伯克霍尔德氏菌作为水果保鲜剂,可以提高水果的储存能力,减少水果采收后不必要的损失,为水果运输及销售提供保障,增加果农们的经济收益。
1.6 生物修复功能研究 近年来,根际有害化合物的微生物降解被认为是净化土壤的替代策略。伯克霍尔德氏菌属中的许多成员在环境污染物的降解过程中发挥着重要的作用[12]。这些伯克霍尔德氏菌能够有效地降解土壤中的甲苯等芳香族污染物以及三氯乙烯等氯化溶剂。通过对菌株B. vietnamiensis (ENV435)进行田间接种试验,发现其能使含沙层中的氯化溶剂含量降低70%[66]。B. phenoliruptrix (AC1100)能够去除严重污染的土壤中的大部分2, 4, 5-三氯苯氧乙酸污染物,也能降解其他卤代酚类化合物,包括2, 4, 5-三氯苯酚、2, 4, 5, 6-四氯苯酚和五氯苯酚,帮助缓解土壤污染状况[67]。
探究番茄根系富集的固氮伯克霍尔德氏菌,在以一些常见的挥发性污染化合物作为唯一碳源情况下的生长能力,发现与番茄植株相关的B. unamae菌株能在以苯和苯酚作为唯一碳源的情况下生长。通过PCR扩增苯酚加单氧酶基因并进行测序分析,进一步证实了菌株在苯酚上的生长能力,表明该菌株具有用于普通土壤污染物根际修复的潜力[9]。此外,有研究发现从废水中分离得到的B. zhejiangensis能够有效地降解甲基对硫磷这一农药污染物[68]。利用伯克霍尔德氏菌作为生物修复剂,有助于维持耕地健康,提高农产品的品质。
1.7 植物有益伯克霍尔德氏菌的功能基因研究及遗传改良 随着测序技术的不断完善,对植物有益伯克霍尔德氏菌菌株的分离和全基因组测序有助于深入发掘这些菌株的益生功能及其分子机制。此外,通过对植物有益伯克霍尔德氏菌的遗传改良,将有助于对其进一步开发和利用。Song等发现伯克霍尔德氏菌(JP2-270)能有效抑制植物病原真菌立枯丝核菌(Rhizoctonia solani)的菌丝生长。随后对JP2-270进行了全基因组测序,并利用pRL1063a构建了伯克霍尔德氏菌(JP2-270) Tn5突变体库,经过筛选获得了拮抗活性降低的突变株,通过分析发现编码lysR型转录调控因子的基因bysR对JP2-270的生防活性起重要作用。因此,bysR可能是基因工程挖掘伯克霍尔德氏菌生防潜力的潜在靶点[69]。基于前期已发表的全基因组测序数据,使用IslandViewer4预测了B. cenocepacia与磷酸盐有关的基因,如编码高亲和力无机磷酸盐转运蛋白的pstSCAB基因,以及参与吡咯喹啉醌生物合成的pqqABCDE基因簇,这些数据有助于更好地理解伯克霍尔德氏菌解磷功能的遗传基础[70]。利用转座子载体pUTkm1克隆了枯草芽孢杆菌中能够抑制病原真菌的几丁质酶基因,并将其稳定整合到B. vietnamiensis (P418)的染色体上。重组菌株不仅保留了野生型菌株的体外生长速率、固氮、解磷和溶钾等特性,还检测到几丁质酶的活性[71]。因此通过基因改良进一步开发功能性伯克霍尔德氏菌将有助于扩展其应用范围。
2 伯克霍尔德氏菌在农业上的应用潜力 微生物菌剂是化学肥料的最佳替代品,是一种生态友好的肥料。伯克霍尔德氏菌属具有广泛的地理分布和寄主多样性,菌株可以在植物根际自由生活,也可以以附生或共生的形式生活[3]。许多植物相关的伯克霍尔德氏菌可以固氮、解磷、促生和抑菌等,具有农业生物技术应用潜力[72]。
目前,关于伯克霍尔德氏菌作为接种剂促进农作物尤其是粮食作物水稻生长的报道较多。越南伯克霍尔德氏菌(B. vietnamiensis) TVV75作为固氮菌对提高东南亚水稻产量具有显著效果[43]。在探究酸性硫酸盐土壤中潜在的解磷细菌的试验中,研究人员共筛选到了21株解磷细菌,其中编号为PSB7和PSB21的伯克霍尔德氏菌表现出良好的溶解无机磷酸盐的能力,具有促进水稻生长的作用[73]。Stephen等的研究表明,在温室条件下,通过接种葡萄糖酸杆菌(Gluconacetobacter) MTCC8368和伯克霍尔德氏菌MTCC8369,能够提高水稻对磷的吸收,促进水稻生长[16]。在水稻苗期通过采用浸根和喷施两种方式接种伯克霍尔德氏菌(BRRh-4),均能显著促进其生长并且提高籽粒产量。盆栽试验表明,接种过伯克霍尔德氏菌的水稻后期,只需要施加氮磷钾推荐施肥量的50%,即可获得与完全施肥的未接种组相同甚至更高的产量[74]。此外,接种B. tropica或B. unamae菌株能够促进玉米生长,与未接种对照相比,接种处理可以增加30%的干重[21]。在田间接种乙炔还原活力较强的越南伯克霍尔德氏菌(B. vietnamiensis) MG43,可以使微繁殖甘蔗生物量增加20%[75]。另外在甘蔗根部及叶片中定殖的B. anthina可以调节植物的代谢活动,触发植物根部和地上部几丁质酶、纤维素、吲哚乙酸和脱落酸的生成,促进植物健康,可以提高甘蔗幼苗的鲜重、干重、株高和叶绿素含量[76]。
伯克霍尔德氏菌还可以有效地促进蔬菜作物如:番茄、黄瓜等的生长。在番茄根尖、根毛、侧根生长点以及气孔中定殖的B. tropica可以促进番茄的生长,增加果实挂果数以及果实的重量[77]。同时有研究发现吡咯伯克霍尔德氏菌(B. pyrrocinia) JK-SH007所产生的嗜铁素对黄瓜幼苗的生长具有促进作用[78]。籽粒苋是一种新兴的粮、饲、菜兼用型作物,其种子富含优质蛋白且脂肪含量丰富,但是其生产受到许多农业因素的限制。通过接种B. ambifaria或B. caribensis可以提高籽粒苋对氮的吸收,增加根部和地上部的氮含量,促进其生长并提高籽粒产量[19]。
植物有益的伯克霍尔德氏菌对粮食作物、经济作物和蔬菜作物等农作物的生长都有一定的促进作用,但目前伯克霍尔德氏菌作为农业接种剂、菌肥等真正具有应用价值的商品、产品却很少,这主要是由于伯克霍尔德氏菌属中包含部分人类病原菌,因此通过进一步完善植物有益伯克霍尔德氏菌的归类,使其与人类病原伯克霍尔德氏菌之间建立明确的区分,推进伯克霍尔德氏菌成为农药化肥的合适替代品,从而扩大伯克霍尔德氏菌在农业生产中的应用,实现优质高效生态农业生产。
3 小结和展望 农业上化肥的过量施用导致了土壤的退化,空气和水质的污染,严重威胁到环境的可持续性[79]。因此,迫切需要加快对有效、可持续和绿色作物生产系统的开发。植物根际促生菌是一组能够对植物生长和发育产生有益影响而不会对宿主或环境造成破坏的微生物[80]。这些微生物依靠不同的机制来促进植物的生长,例如生物固氮、植物激素的产生、磷酸盐利用率的提高和植物病原体的生物防治等[34, 81-82]。因此,将植物根际促生菌作为生物接种剂,可以大大减少化肥农药的使用,这是一种生态友好的农业生产方式。植物根际促生菌包括多个细菌属,例如固氮弧菌属(Azoarcus)、固氮螺菌属(Azospirillum)、伯克霍尔德氏菌属(Burkholderia)、欧文氏菌属(Erwinia)和芽孢杆菌属(Bacillus)等[83]。
在过去的几年中,人们对伯克霍尔德氏菌属的关注越来越多。伯克霍尔德氏菌属菌株的特点是功能多样,在环境中普遍存在且具有多样性。许多伯克霍尔德氏菌具备固氮、溶解无机磷酸盐、产生植物激素以及生物防控等能力,因此在植物促生方面表现良好,可以有效地促进经济作物甘蔗、粮食作物(水稻,玉米,大豆)、蔬菜作物番茄黄瓜等的生长,提高作物产量。
然而目前伯克霍尔德氏菌的研究存在一些不足,首先是尚不了解植物与伯克霍尔德氏菌互作的分子机制。例如:解磷伯克霍尔德氏菌与植物的互作是否受植物磷信号的调控?尽管在模式植物拟南芥中已经证明了植物的磷信号网络可以调控拟南芥根系微生物的组成[84]。而且关于植物磷信号通路的研究也已经较为清楚,但是磷信号是否调控了植物与解磷伯克霍尔德氏菌的互作,仍未有报道[85-86]。而这些磷信号通路的遗传材料,是深入研究植物与解磷伯克霍尔德氏菌互作分子机制的首选。其次是伯克霍尔德氏菌在农业生产上的实际推广较少,目前仍停留在实验室研究阶段,并且先前的研究并未探明植物是如何招募伯克霍尔德氏菌,以及菌株促进植物生长的分子机制的研究也较少,因此未来应进一步揭示伯克霍尔德氏菌与植物的互作机制,从分子水平上解析伯克霍尔德氏菌参与作物养分高效的机理,从而推动其在改善土壤健康、减肥增效的绿色生态农业中的应用。
References
| [1] | Burkholder WH. Three bacterial plant pathogens: Phytomonas caryophylli sp.n., Phytomonas alliicola sp.n., and Phytomonas manihotis (Arthaud-Berthet et Bondar) Viégas. Phytopathology, 1942, 32(2): 141-149. |
| [2] | Yabuuchi E, Kosako Y, Oyaizu H, Yano I, Hotta H, Hashimoto Y, Ezaki T, Arakawa M. Proposal of Burkholderia gen. nov. and transfer of seven species of the genus Pseudomonas homology group Ⅱ to the new genus, with the type species Burkholderia cepacia (Palleroni and Holmes 1981) comb. nov. Microbiology and Immunology, 1992, 36(12): 1251-1275. DOI:10.1111/j.1348-0421.1992.tb02129.x |
| [3] | Coenye T, Vandamme P. Diversity and significance of Burkholderia species occupying diverse ecological niches. Environmental Microbiology, 2003, 5(9): 719-729. DOI:10.1046/j.1462-2920.2003.00471.x |
| [4] | Suárez-Moreno ZR, Caballero-Mellado J, Coutinho BG, Mendonca-Previato L, James EK, Venturi V. Common features of environmental and potentially beneficial plant-associated Burkholderia. Microbial Ecology, 2012, 63(2): 249-266. DOI:10.1007/s00248-011-9929-1 |
| [5] | Angus AA, Agapakis CM, Fong S, Yerrapragada S, Santos PEDL, Yang P, Song NN, Kano S, Caballero-Mellado J, De Faria SM, Dakora FD, Weinstock G, Hirsch AM. Plant-associated symbiotic Burkholderia species lack hallmark strategies required in mammalian pathogenesis. PLoS ONE, 2014, 9(1): e83779. DOI:10.1371/journal.pone.0083779 |
| [6] | Compant S, Nowak J, Coenye T, Clement C, Barka EA. Diversity and occurrence of Burkholderia spp. in the natural environment. FEMS Microbiology Reviews, 2008, 32(4): 607-626. DOI:10.1111/j.1574-6976.2008.00113.x |
| [7] | Santos PEDL, Bustillos-Cristales R, Caballero-Mellado J. Burkholderia, a genus rich in plant-associated nitrogen fixers with wide environmental and geographic distribution. Applied and Environmental Microbiology, 2001, 67(6): 2790-2798. DOI:10.1128/AEM.67.6.2790-2798.2001 |
| [8] | Martinez-Aguilar L, Diaz R, Pena-Cabriales JJ, Santos PEDL, Dunn MF, Caballero-Mellado J. Multichromosomal genome structure and confirmation of diazotrophy in novel plant-associated Burkholderia species. Applied and Environmental Microbiology, 2008, 74(14): 4574-4579. DOI:10.1128/AEM.00201-08 |
| [9] | Caballero-Mellado J, Onofre-Lemus J, Santos PEDL, Martinez-Aguilar L. The tomato rhizosphere, an environment rich in nitrogen-fixing Burkholderia species with capabilities of interest for agriculture and bioremediation. Applied and Environmental Microbiology, 2007, 73(16): 5308-5319. DOI:10.1128/AEM.00324-07 |
| [10] | Peix A, Mateos PF, Rodriguez-Barrueco C, Martinez-Molina E, Velazquez E. Growth promotion of common bean (Phaseolus vulgaris L.) by a strain of Burkholderia cepacia under growth chamber conditions. Soil Biology and Biochemistry, 2001, 33(14): 1927-1935. DOI:10.1016/S0038-0717(01)00119-5 |
| [11] | Santos AV, Dillon RJ, Dillon VM, Reynolds SE, Samuels RI. Ocurrence of the antibiotic producing bacterium Burkholderia sp. in colonies of the leaf-cutting ant Atta sexdens rubropilosa. FEMS Microbiology Letters, 2004, 239(2): 319-323. DOI:10.1016/j.femsle.2004.09.005 |
| [12] | Zhang H, Hanada S, Shigematsu T, Shibuya K, Kamagata Y, Kanagawa T, Kurane R. Burkholderia kururiensis sp. nov., a trichloroethylene (TCE)-degrading bacterium isolated from an aquifer polluted with TCE. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(2): 743-749. DOI:10.1099/00207713-50-2-743 |
| [13] | Bevivino A, Sarrocco S, Dalmastri C, Tabacchioni S, Cantale C, Chiarini L. Characterization of a free-living maize-rhizosphere population of Burkholderia cepacia: effect of seed treatment on disease suppression and growth promotion of maize. FEMS Microbiology Ecology, 1998, 27(3): 225-237. DOI:10.1111/j.1574-6941.1998.tb00539.x |
| [14] | De Oliveira-Longatti SM, De Sousa PM, Marra LM, Ferreira PAA, De Souza Moreira FM. Burkholderia fungorum promotes common bean growth in a dystrophic oxisol. Annals of Microbiology, 2015, 65: 1825-1832. DOI:10.1007/s13213-014-1020-y |
| [15] | Paungfoo-Lonhienne C, Lonhienne TGA, Yeoh YK, Webb RI, Lakshmanan P, Chan CX, Lim PE, Ragan MA, Schmidt S, Hugenholtz P. A new species of Burkholderia isolated from sugarcane roots promotes plant growth. Microbial Biotechnology, 2014, 7(2): 142-154. DOI:10.1111/1751-7915.12105 |
| [16] | Stephen J, Shabanamol S, Rishad KS, Jisha MS. Growth enhancement of rice (Oryza sativa) by phosphate solubilizing Gluconacetobacter sp. (MTCC 8368) and Burkholderia sp. (MTCC 8369) under greenhouse conditions. Biotechnology, 2015, 5(5): 831-837. |
| [17] | Malviya MK, Li CN, Solanki MK, Singh RK, Htun R, Singh P, Verma KK, Yang LT, Li YR. Comparative analysis of sugarcane root transcriptome in response to the plant growth-promoting Burkholderia anthina MYSP113. PLoS ONE, 2020, 15(4): e0231206. DOI:10.1371/journal.pone.0231206 |
| [18] | Li W, Roberts DP, Dery PD, Meyer SLF, Lohrke S, Lumsden RD, Hebbar KP. Broad spectrum anti-biotic activity and disease suppression by the potential biocontrol agent Burkholderia ambifaria BC-F. Crop Protection, 2002, 21(2): 129-135. DOI:10.1016/S0261-2194(01)00074-6 |
| [19] | Parra-Cota FI, Pena-Cabriales JJ, De Los Santos-Villalobos S, Martinez-Gallardo NA, Delano-Frier JP. Burkholderia ambifaria and B. caribensis promote growth and increase yield in grain amaranth (Amaranthus cruentus and A. hypochondriacus) by improving plant nitrogen uptake. PLoS ONE, 2014, 9(2): e88094. DOI:10.1371/journal.pone.0088094 |
| [20] | Aizawa T, Ve NB, Nakajima M, Sunairi M. Burkholderia heleia sp. nov., a nitrogen-fixing bacterium isolated from an aquatic plant, Eleocharis dulcis, that grows in highly acidic swamps in actual acid sulfate soil areas of Vietnam. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(5): 1152-1157. DOI:10.1099/ijs.0.015198-0 |
| [21] | Castro-González R, Martínez-Aguilar L, Ramírez-Trujillo A, Santos PDEL, Caballero-Mellado J. High diversity of culturable Burkholderia species associated with sugarcane. Plant and Soil, 2011, 345(1): 155-169. DOI:10.1007%2Fs11104-011-0768-0 |
| [22] | Achouak W, Christen R, Barakat M, Martel MH, Heulin T. Burkholderia caribensis sp. nov., an exopolysaccharide-producing bacterium isolated from vertisol microaggregates in Martinique. International Journal of Systematic Bacteriology, 1999, 49(2): 787-794. |
| [23] | Lin TF, Huang HI, Shen FT, Young CC. The protons of gluconic acid are the major factor responsible for the dissolution of tricalcium phosphate by Burkholderia cepacia CC-A174. Bioresource Technology, 2006, 97(7): 957-960. DOI:10.1016/j.biortech.2005.02.017 |
| [24] | Song OR, Lee SJ, Lee YS, Lee SC, Kim KK, Choi YL. Solubilization of insoluble inorganic phosphate by Burkholderia cepacia DA23 isolated from cultivated soil. Brazilian Journal of Microbiology, 2008, 39(1): 151-156. DOI:10.1590/S1517-83822008000100030 |
| [25] | Bevivino A, Dalmastri C, Tabacchioni S, Chiarini L. Efficacy of Burkholderia cepacia MCI 7 in disease suppression and growth promotion of maize. Biology and Fertility of Soils, 2000, 31(3): 225-231. DOI:10.1007/s003740050649 |
| [26] | Coenye T, Laevens S, Willems A, Ohlén M, Hannant W, Govan JRW, Gillis M, Falsen E, Vandamme P. Burkholderia fungorum sp. nov. and Burkholderia caledonica sp. nov., two new species isolated from the environment, animals and human clinical samples. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(3): 1099-1107. DOI:10.1099/00207713-51-3-1099 |
| [27] | Anandham R, Gandhi PI, Kwon SW, Sa TM, Kim YK, Jee HJ. Mixotrophic metabolism in Burkholderia kururiensis subsp. thiooxydans subsp. nov., a facultative chemolithoautotrophic thiosulfate oxidizing bacterium isolated from rhizosphere soil and proposal for classification of the type strain of Burkholderia kururiensis as Burkholderia kururiensis subsp. kururiensis subsp. nov. Archives of Microbiology, 2009, 191(12): 885-894. DOI:10.1007/s00203-009-0517-4 |
| [28] | Mattos KA, Pádua VLM, Romeiro A, Hallack LF, Neves BC, Ulisses TMU, Barros CF, Todeschini AR, Previato JO, Mendon?a-Previato L. Endophytic colonization of rice (Oryza sativa L.) by the diazotrophic bacterium Burkholderia kururiensis and its ability to enhance plant growth. Anais da Academia Brasileira de Ciências, 2008, 80(3): 477-493. DOI:10.1590/S0001-37652008000300009 |
| [29] | Chen WM, James EK, Coenye T, Chou JH, Barrios E, De Faria SM, Elliott GN, Sheu SY, Sprent JI, Vandamme P. Burkholderia mimosarum sp. nov., isolated from root nodules of Mimosa spp. from Taiwan and South America. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(8): 1847-1851. DOI:10.1099/ijs.0.64325-0 |
| [30] | Sawana A, Adeolu M, Gupta RS. Molecular signatures and phylogenomic analysis of the genus Burkholderia: proposal for division of this genus into the emended genus Burkholderia containing pathogenic organisms and a new genus Paraburkholderia gen. nov. harboring environmental species. Frontiers in Genetics, 2014, 5: 429. |
| [31] | Chen WM, De Faria SM, James EK, Elliott GN, Lin KY, Chou JH, Sheu SY, Cnockaert M, Sprent JI, Vandamme P. Burkholderia nodosa sp. nov., isolated from root nodules of the woody Brazilian legumes Mimosa bimucronata and Mimosa scabrella. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(5): 1055-1059. DOI:10.1099/ijs.0.64873-0 |
| [32] | Elliott GN, Chen WM, Chou JH, Wang HC, Sheu SY, Perin L, Reis VM, Moulin L, Simon MF, Bontemps C, Sutherland JM, Bessi R, De Faria SM, Trinick MJ, Prescott AR, Sprent JI, James EK. Burkholderia phymatum is a highly effective nitrogen-fixing symbiont of Mimosa spp. and fixes nitrogen ex planta. New Phytologist, 2007, 173(1): 168-180. DOI:10.1111/j.1469-8137.2006.01894.x |
| [33] | Ma W, Guinel FC, Glick BR. Rhizobium leguminosarum biovar viciae 1-aminocyclopropane-1-carboxylate deaminase promotes nodulation of pea plants. Applied and Environmental Microbiology, 2003, 69(8): 4396-4402. DOI:10.1128/AEM.69.8.4396-4402.2003 |
| [34] | Sun YL, Cheng ZY, Glick BR. The presence of a 1-aminocyclopropane-1-carboxylate (ACC) deaminase deletion mutation alters the physiology of the endophytic plant growth-promoting bacterium Burkholderia phytofirmans PsJN. FEMS Microbiology Letters, 2009, 296(1): 131-136. DOI:10.1111/j.1574-6968.2009.01625.x |
| [35] | Gong AD, Zhu ZY, Lu YN, Wan HY, Wu NN, Cheelo D, Gong SJ, Wen ST, Hou X. Functional analysis of Burkholderia pyrrocinia WY6-5 on phosphate solubilizing, antifungal and growth-promoting activity of maize. Scientia Agricultura Sinica, 2019, 52(9): 1574-1586. (in Chinese) 宫安东, 朱梓钰, 路亚南, 万海燕, 吴楠楠, Cheelo D, 龚双军, 文淑婷, 侯晓. 吡咯伯克霍尔德菌WY6-5的溶磷、抑菌与促玉米生长作用研究. 中国农业科学, 2019, 52(9): 1574-1586. |
| [36] | Perin L, Martínez-Aguilar L, Paredes-Valdez G, Baldani JI, Santos PEDL, Reis VM, Caballero-Mellado J. Burkholderia silvatlantica sp. nov., a diazotrophic bacterium associated with sugar cane and maize. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(8): 1931-1937. DOI:10.1099/ijs.0.64362-0 |
| [37] | Reis VM, Santos PEDL, Tenorio-Salgado S, Vogel J, Stoffels M, Guyon S, Mavingui P, Baldani VLD, Schmid M, Baldani JI, Balandreau J, Hartmann A, Caballero-Mellado J. Burkholderia tropica sp. nov., a novel nitrogen-fixing, plant-associated bacterium.. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(6): 2155-2162. DOI:10.1099/ijs.0.02879-0 |
| [38] | Elliott GN, Chen WM, Bontemps C, Chou JH, Young JPW, Sprent JI, James EK. Nodulation of Cyclopia spp. (Leguminosae, Papilionoideae) by Burkholderia tuberum. Annals of Botany, 2007, 100(7): 1403-1411. DOI:10.1093/aob/mcm227 |
| [39] | Vandamme P, Goris J, Chen WM, De Vos P, Willems A. Burkholderia tuberum sp. nov. and Burkholderia phymatum sp. nov., nodulate the roots of tropical legumes. Systematic and Applied Microbiology, 2002, 25(4): 507-512. DOI:10.1078/07232020260517634 |
| [40] | Moulin L, Munive A, Dreyfus B, Boivin-Masson C. Nodulation of legumes by members of the β-subclass of Proteobacteria. Nature, 2001, 411(6840): 948-950. DOI:10.1038/35082070 |
| [41] | Onofre-Lemus J, Herna?Ndez-Lucas I, Girard L, Caballero-Mellado J. ACC (1-aminocyclopropane-1-carboxylate) deaminase activity, a widespread trait in Burkholderia species, and its growth-promoting effect on tomato plants. Applied and Environmental Microbiology, 2009, 75(20): 6581-6590. DOI:10.1128/AEM.01240-09 |
| [42] | Gillis M, Van Van T, Bardin R, Goor M, Hebbar P, Willems A, Segers P, Kersters K, Heulin T, Fernandez MP. Polyphasic taxonomy in the genus Burkholderia leading to an emended description of the genus and proposition of Burkholderia vietnamiensis sp. nov. for N2-fixing isolates from rice in Vietnam. International Journal of Systematic and Evolutionary Microbiology, 1995, 45(2): 274-289. |
| [43] | Van VT, Berger O, Kê SN, Balandreau J, Heulin T. Repeated beneficial effects of rice inoculation with a strain of Burkholderia vietnamiensis on early and late yield components in low fertility sulphate acid soils of Vietnam. Plant and Soil, 2000, 218(1): 273-284. |
| [44] | Mannaa M, Park I, Seo YS. Genomic features and insights into the taxonomy, virulence, and benevolence of plant-associated Burkholderia species. International Journal of Molecular Sciences, 2018, 20(1): 121. DOI:10.3390/ijms20010121 |
| [45] | Paungfoo-Lonhienne C, Lonhienne TGA, Yeoh YK, Donose BC, Webb RI, Parsons J, Liao W, Sagulenko E, Lakshmanan P, Hugenholtz P, Schmidt S, Ragan MA. Crosstalk between sugarcane and a plant-growth promoting Burkholderia species. Scientific Reports, 2016, 6(1): 37389. DOI:10.1038/srep37389 |
| [46] | Galloway JN, Townsend AR, Erisman JW, Bekunda M, Cai ZC, Freney JR, Martinelli LA, Seitzinger SP, Sutton MA. Transformation of the nitrogen cycle: recent trends, questions, and potential solutions. Science, 2008, 320(5878): 889-892. DOI:10.1126/science.1136674 |
| [47] | Estrada P, Mavingui P, Cournoyer B, Fontaine F, Balandreau J, Caballero-Mellado J. A N2-fixing endophytic Burkholderia sp. associated with maize plants cultivated in Mexico. Canadian Journal of Microbiology, 2002, 48(4): 285-294. DOI:10.1139/w02-023 |
| [48] | Chen WM, James EK, Chou JH, Sheu SY, Yang SZ, Sprent JI. β-rhizobia from Mimosa pigra, a newly discovered invasive plant in Taiwan. New Phytologist, 2005, 168(3): 661-675. DOI:10.1111/j.1469-8137.2005.01533.x |
| [49] | Ramírez MDA, Espa?a M, Aguirre C, Kojima K, Ohkama-Ohtsu N, Sekimoto H, Yokoyama T. Burkholderia and Paraburkholderia are predominant soybean rhizobial genera in venezuelan soils in different climatic and topographical regions. Microbes and Environments, 2019, 34(1): 43-58. DOI:10.1264/jsme2.ME18076 |
| [50] | Vance CP, Uhde-Stone C, Ailan DL. Phosphorus acquisition and use: critical adaptations by plants for securing a nonrenewable resource. New Phytologist, 2003, 157(3): 423-447. DOI:10.1046/j.1469-8137.2003.00695.x |
| [51] | Zhang ZL, Liao H, Lucas WJ. Molecular mechanisms underlying phosphate sensing, signaling, and adaptation in plants. Journal of Integrative Plant Biology, 2014, 56(3): 192-220. DOI:10.1111/jipb.12163 |
| [52] | Tripura C, Sashidhar B, Podile AR. Ethyl methanesulfonate mutagenesis-enhanced mineral phosphate solubilization by groundnut-associated Serratia marcescens GPS-5. Current Microbiology, 2007, 54(2): 79-84. DOI:10.1007/s00284-005-0334-1 |
| [53] | Weisskopf L, Heller S, Eberl L. Burkholderia species are major inhabitants of white lupin cluster roots. Applied and Environmental Microbiology, 2011, 77(21): 7715-7720. DOI:10.1128/AEM.05845-11 |
| [54] | Linu MS, Stephen J, Jisha MS. Phosphate solubilizing Gluconacetobacter sp., Burkholderia sp. and their potential interaction with cowpea (Vigna unguiculata (L.) Walp.).. International Journal of Agricultural Research, 2009, 4(2): 79-87. DOI:10.3923/ijar.2009.79.87 |
| [55] | Zhao K, Penttinen P, Zhang XP, Ao XL, Liu MK, Yu XM, Chen Q. Maize rhizosphere in Sichuan, China, hosts plant growth promoting Burkholderia cepacia with phosphate solubilizing and antifungal abilities. Microbiological Research, 2014, 169(1): 76-82. DOI:10.1016/j.micres.2013.07.003 |
| [56] | Nascimento FX, Rossi MJ, Glick BR. Ethylene and 1-aminocyclopropane-1-carboxylate (ACC) in plant-bacterial interactions. Front in Plant Science, 2018, 9: 114. DOI:10.3389/fpls.2018.00114 |
| [57] | Glick BR. The enhancement of plant growth by free-living bacteria. Canadian Journal of Microbiology, 1995, 41(2): 109-117. DOI:10.1139/m95-015 |
| [58] | Glick BR, Cheng ZY, Czarny J, Duan J. Promotion of plant growth by ACC deaminase-producing soil bacteria. European Journal of Plant Pathology, 2007, 119(3): 239-339. |
| [59] | Sessitsch A, Coenye T, Sturz AV, Vandamme P, Barka EA, Salles JF, Van Elsas JD, Faure D, Reiter B, Glick BR, Wang-Pruski G, Nowak J. Burkholderia phytofirmans sp. nov., a novel plant-associated bacterium with plant-beneficial properties. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(3): 1187-1192. DOI:10.1099/ijs.0.63149-0 |
| [60] | Zú?iga A, Poupin MJ, Donoso R, Ledger T, Guiliani N, Gutiérrez RA, González B. Quorum sensing and indole-3-acetic acid degradation play a role in colonization and plant growth promotion of Arabidopsis thaliana by Burkholderia phytofirmans PsJN. Molecular Plant-Microbe Interactions, 2013, 26(5): 546-553. DOI:10.1094/MPMI-10-12-0241-R |
| [61] | Mendes R, Pizzirani-Kleiner AA, Araujo WL, Raaijmakers JMR. Diversity of cultivated endophytic bacteria from sugarcane: genetic and biochemical characterization of Burkholderia cepacia complex isolates. Applied and Environmental Microbiology, 2007, 73(22): 7259-7267. DOI:10.1128/AEM.01222-07 |
| [62] | Li X, Quan CS, Fan SD. Antifungal activity of a novel compound from Burkholderia cepacia against plant pathogenic fungi. Letters in Applied Microbiology, 2007, 45(5): 508-514. DOI:10.1111/j.1472-765X.2007.02221.x |
| [63] | Li X, Quan CS, Yu HY, Wang JH, Fan SD. Assessment of antifungal effects of a novel compound from Burkholderia cepacia against Fusarium solani by fluorescent staining. World Journal of Microbiology and Biotechnology, 2009, 25(1): 151-154. DOI:10.1007/s11274-008-9861-9 |
| [64] | Sandani HBP, Ranathunge NP, Lakshman PLN, Weerakoon WMW. Biocontrol potential of five Burkholderia and Pseudomonas strains against Colletotrichum truncatum infecting chilli pepper. Biocontrol Science and Technology, 2019, 29(8): 727-745. DOI:10.1080/09583157.2019.1597331 |
| [65] | Shi JF, Sun CQ, Zhang JT. Effects of preharvest spraying of Burkholderia contaminans on postharvest decay and quality of strawberry. Journal of Plant Protection, 2018, 45(2): 382-388. (in Chinese) 施俊凤, 孙常青, 张婧婷. 采前喷施洋葱伯克霍尔德菌Burkholderia contaminans对草莓采后腐烂和品质的影响. 植物保护学报, 2018, 45(2): 382-388. |
| [66] | Steffan RJ, Sperry KL, Walsh MT, Vainberg S, Condee CW. Field-scale evaluation of in situ bioaugmentation for remediation of chlorinated solvents in groundwater. Environmental Science & Technology, 1999, 33(16): 2771-2781. |
| [67] | Coenye T, Henry D, Speert DP, Vandamme P. Burkholderia phenoliruptrix sp. nov., to accommodate the 2, 4, 5-trichlorophenoxyacetic acid and halophenol-degrading strain AC1100. Systematic and Applied Microbiology, 2004, 27(6): 623-627. DOI:10.1078/0723202042369992 |
| [68] | Lu P, Zheng LQ, Sun JJ, Liu HM, Li SP, Hong Q, Li WJ. Burkholderia zhejiangensis sp. nov., a methyl-parathion-degrading bacterium isolated from a wastewater-treatment system. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(6): 1337-1341. |
| [69] | Song DW, Chen GQ, Liu SH, Khaskheli MA, Wu LJ. Complete genome sequence of Burkholderia sp. JP2-270, a rhizosphere isolate of rice with antifungal activity against Rhizoctonia solani. Microbial Pathogenesis, 2019, 127: 1-6. DOI:10.1016/j.micpath.2018.11.024 |
| [70] | You M, Fang SM, Macdonald J, Xu JP, Yuan ZC. Isolation and characterization of Burkholderia cenocepacia CR318, a phosphate solubilizing bacterium promoting corn growth. Microbiological Research, 2020, 233: 126395. DOI:10.1016/j.micres.2019.126395 |
| [71] | Zhang XJ, Huang YJ, Harvey PR, Ren Y, Zhang GZ, Zhou HZ, Yang HT. Enhancing plant disease suppression by Burkholderia vietnamiensis through chromosomal integration of Bacillus subtilis chitinase gene chi113. Biotechnology Letters, 2012, 34(2): 287-293. DOI:10.1007/s10529-011-0760-z |
| [72] | Angus AA, Lee A, Lum MR, Shehayeb M, Hessabi R, Fujishige NA, Yerrapragada S, Kano S, Song NN, Yang P, De Los Santos PE, De Faria SM, Dakora FD, Weinstock G, Hirsch AM. Nodulation and effective nitrogen fixation of Macroptilium atropurpureum (siratro) by Burkholderia tuberum, a nodulating and plant growth promoting beta-proteobacterium, are influenced by environmental factors. Plant and Soil, 2013, 369(1/2): 543-562. |
| [73] | Panhwar QA, Naher UA, Jusop S, Othman R, Latif MA, Ismail MR. Biochemical and molecular characterization of potential phosphate-solubilizing bacteria in acid sulfate soils and their beneficial effects on rice growth. PLoS ONE, 2014, 9(10): e97241. DOI:10.1371/journal.pone.0097241 |
| [74] | Khan MMA, Haque E, Paul NC, Khaleque MA, Al-Garni SMS, Rahman M, Islam MT. Enhancement of growth and grain yield of rice in nutrient deficient soils by rice probiotic bacteria. Rice Science, 2017, 24(5): 264-273. DOI:10.1016/j.rsci.2017.02.002 |
| [75] | Govindarajan M, Balandreau J, Muthukumarasamy R, Revathi G, Lakshminarasimhan C. Improved yield of micropropagated sugarcane following inoculation by endophytic Burkholderia vietnamiensis. Plant and Soil, 2006, 280(1/2): 239-252. |
| [76] | Malviya MK, Solanki MK, Li CN, Htun R, Singh RK, Singh P, Yang LT, Li YR. Beneficial linkages of endophytic Burkholderia anthina MYSP113 towards sugarcane growth promotion. Sugar Tech, 2019, 21(5): 737-748. DOI:10.1007/s12355-019-00703-2 |
| [77] | Bernabeu PR, Pistorio M, Torres-Tejerizo G, Santos PEFL, Galar ML, Boiardi JL, Luna MF. Colonization and plant growth-promotion of tomato by Burkholderia tropica. Scientia Horticulturae, 2015, 191: 113-120. DOI:10.1016/j.scienta.2015.05.014 |
| [78] | Min LJ, Guo L, Ye JR. Mechanism of Burkholderia pyrrocinia JK-SH007 growth-promoting to plant via siderophore-mediation. Journal of Nanjing Forestry University (Natural Sciences Edition), 2019, 43(6): 165-172. (in Chinese) 闵莉静, 郭璐, 叶建仁. 基于嗜铁素介导的吡咯伯克霍尔德氏菌JK-SH007促生作用机制研究. 南京林业大学学报(自然科学版), 2019, 43(6): 165-172. |
| [79] | Tilman D, Reich PB, Knops J, Wedin D, Mielke T, Lehman C. Diversity and productivity in a long-term grassland experiment. Science, 2001, 294(5543): 843-845. DOI:10.1126/science.1060391 |
| [80] | Glick BR. Plant growth-promoting bacteria: mechanisms and applications. Scientifica, 2012, 2012: 963401. |
| [81] | Sarkar A, Islam T, Biswas GC, Alam S, Hossain M, Talukder NM. Screening for phosphate solubilizing bacteria inhabiting the rhizoplane of rice grown in acidic soil in Bangladesh. Acta Microbiologica et Immunologica Hungarica, 2012, 59(2): 199-213. DOI:10.1556/amicr.59.2012.2.5 |
| [82] | Islam S, Akanda AM, Prova A, Islam MT, Hossain MM. Isolation and identification of plant growth promoting rhizobacteria from cucumber rhizosphere and their effect on plant growth promotion and disease suppression. Frontiers in Microbiology, 2015, 6: 1360. |
| [83] | Hillel D. Encyclopedia of soils in the environment. Amsterdam: Elsevier/Academic Press, 2005. |
| [84] | Castrillo G, Teixeira PJPL, Paredes SH, Law TF, De Lorenzo L, Feltcher ME, Finkel OM, Breakfield NW, Mieczkowski P, Jones CD, Paz-Ares J, Dangl JL. Root microbiota drive direct integration of phosphate stress and immunity. Nature, 2017, 543(7646): 513-518. DOI:10.1038/nature21417 |
| [85] | Lv QD, Zhong YJ, Wang YG, Wang ZY, Zhang L, Shi J, Wu ZC, Liu Y, Mao CZ, Yi KK, Wu P. SPX4 negatively regulates phosphate signaling and homeostasis through its interaction with PHR2 in rice. The Plant Cell, 2014, 26(4): 1586-1597. DOI:10.1105/tpc.114.123208 |
| [86] | Zhong YJ, Wang YG, Guo JF, Zhu XL, Shi J, He QJ, Liu Y, Wu YR, Zhang L, Lv QD, Mao CZ. Rice SPX6 negatively regulates the phosphate starvation response through suppression of the transcription factor PHR2. New Phytologist, 2018, 219(1): 135-148. DOI:10.1111/nph.15155 |
