宋吴涛, 刘喜朋

 , 缪晓玲
, 缪晓玲

上海交通大学生命科学技术学院, 微生物代谢国家重点实验室, 上海 200240
收稿日期:2021-03-17;修回日期:2021-05-14;网络出版日期:2021-05-17
基金项目:国家重点研发计划(2018YFC0310700)
*通信作者:刘喜朋, Tel: +86-21-34204378;E-mail: xpliu@sjtu.edu.cn;
缪晓玲, E-mail: miaoxiaoling@sjtu.edu.cn.
摘要:[目的] 表达纯化嗜酸嗜热硫化叶菌(Sulfolobus acidocaldarius)的核酸内切酶V (Saci_0544),对其核酸内切酶活性及酶学特征进行探究。[方法] 将Sulfolobus acidocaldarius核酸内切酶V (SacEndoV)在大肠杆菌中进行重组表达,经亲和层析纯化得到目标蛋白;利用带有不同类型损伤的寡核苷酸作为底物,结合变性聚丙烯酰胺凝胶电泳技术,鉴定SacEndoV对相应损伤寡核苷酸底物的剪切活性。[结果] SacEndoV特异性剪切含脱氧肌苷(Deoxyinosine)的损伤DNA底物,明显偏好单链DNA底物。SacEndoV在70-95℃温度范围内酶活性高,酶活性依赖于二价金属离子,Mg2+为最佳辅助离子,其最佳反应pH为7.5-8.0,高于200 mmol/L的NaCl会明显抑制其剪切活性。损伤DNA中脱氧肌苷3'端相邻的脱氧核糖核苷酸的结构完整性对于SacEndoV识别并剪切相应底物具有重要影响,脱氧肌苷3'端无碱基位点的存在使得SacEndoV不能够切断损伤DNA。此外,经测定SacEndoV对于含肌苷的损伤RNA底物具有剪切活性。[结论] 本研究证实SacEndoV是一种典型的核酸内切酶V,对含脱氧肌苷的损伤DNA具有特异性的内切酶活性,推测其在Sulfolobus acidocaldarius体内参与脱氧肌苷的切除修复。
关键词:嗜热古菌嗜酸嗜热硫化叶菌核酸内切酶V脱氧肌苷
Recombinant expression and enzymatic characterization of endonuclease V from Sulfolobus acidocaldarius
Wutao Song, Xipeng Liu

 , Xiaoling Miao
, Xiaoling Miao

State Key Laboratory of Microbial Metabolism, School of Life Sciences and Biotechnology, Shanghai Jiao Tong University, Shanghai 200240, China
Received: 17 March 2021; Revised: 14 May 2021; Published online: 17 May 2021
*Corresponding author: Xipeng Liu, Tel: +86-21-34204378;E-mail: xpliu@sjtu.edu.cn;
Xiaoling Miao, E-mail: miaoxiaoling@sjtu.edu.cn.
Foundation item: Supported by the National Key Research and Development Program of China (2018YFC0310700)
Abstract: [Objective] To express and purify the endonuclease V (Saci_0544) from Sulfolobus acidocaldarius, identify its endonuclease activity and enzymatic characterization. [Methods] The endonuclease V (SacEndoV) from Sulfolobus acidocaldarius was expressed in E. coli and purified by affinity chromatography; Oligonucleotides with different types of damage were used as substrates to identify the cleavage activity of SacEndoV. [Results] SacEndoV specifically cleaves damaged DNA substrates containing deoxyinosine. Compared with double-stranded DNA substrates, the enzyme has a clear preference for single-stranded DNA substrates in vitro. The enzyme activity of SacEndoV is excellent in the temperature range of 70-95℃. And its enzyme activity depends on the divalent metal ion, Mg2+ is the best cofactor. The optimal reaction pH of SacEndoV is 7.5-8.0, and NaCl with a concentration higher than 200 mmol/L will significantly inhibit its cleavage activity. The structural integrity of deoxyribonucleotide adjacent to the 3' end of deoxyinosine in the damaged DNA is of great significance for SacEndoV to recognize and cleave the corresponding substrates. The presence of AP sites at the 3' end of deoxyinosine prevents SacEndoV from cleaving damaged DNA. In addition, it has been determined that SacEndoV has cleavage activity on damaged RNA substrates containing inosine. [Conclusion] This study confirmed that SacEndoV is a typical endonuclease V with substrate specificity for damaged DNA containing deoxyinosine, and participates in the repair of deoxyinosine in Sulfolobus acidocaldarius.
Keywords: thermophilic archaeaSulfolobus acidocaldariusendonuclease Vdeoxyinosine
DNA作为细胞中重要的遗传物质通常保持相对稳定,但由于内源性或外源性因素造成的破坏,DNA会发生不同程度的损伤和修饰[1]。DNA碱基的脱氨基作用属于DNA损伤的类型之一,该过程通过水解反应自发发生,也可能由一些含氮的活性化合物介导发生[1-2]。4种DNA碱基中的3种(腺嘌呤,胞嘧啶和鸟嘌呤)会发生脱氨基反应,分别产生次黄嘌呤,尿嘧啶和黄嘌呤碱基类似物。带有脱氨基碱基类似物的非常规核苷酸将在DNA复制过程中整合到新合成的DNA中。由于脱氨基碱基类似物和原始碱基的配对特性不同,非常规核苷酸具有很强的致突变性[3]。对于带有腺嘌呤的脱氧腺苷(dA,deoxyadenosine),一方面,一些含氮的活性化合物能够直接介导DNA中的脱氧腺苷发生脱氨作用,从而形成脱氧肌苷(dI,deoxyinosine) (图 2-A)。另一方面,一类腺苷脱氨酶(ADA,adenosine deaminase)能够将游离的dA转化为dI,后者能够代谢为次黄嘌呤[4]。次黄嘌呤可以被整合入单磷酸脱氧肌苷(dIMP,deoxyinosine monophosphate),然后进一步转化为三磷酸脱氧肌苷(dITP,deoxyinosine triphosphate)。dITP也能够通过dATP的自发脱氨反应产生。在DNA复制过程中,DNA聚合酶将dITP作为底物,其与脱氧胞苷(dC,deoxycytidine)配对,从而导致由A/T转变为C/G的突变。为应对DNA损伤,生物体细胞进化出多种类型的DNA损伤修复策略。其中,常规的碱基切除修复(base excision repair)途径通过烷基腺嘌呤DNA糖基化酶(alkyladenine DNA glycosylase)的作用能够一定程度上切除损伤DNA中的脱氧肌苷[5]。然而,为应对脱氧肌苷造成的突变,生物体细胞还发展出一种特殊的针对脱氧肌苷的切除修复功能,该切除修复途径由核酸内切酶V (endonuclease V)所起始。
核酸内切酶V的催化机制为水解位于脱氧肌苷3′端的第二个磷酸二酯键,形成一个3′羟基和一个5′磷酸基团,且只在含有脱氧肌苷的DNA链上形成单个缺口[6]。核酸内切酶V最初发现于大肠杆菌中,由大肠杆菌nfi基因编码[7]。进一步研究表明EcoEndoV在体外具有很广的底物谱,包括错配碱基(base mismatches),AP位点(apurinic/apyrimidinic sites),以及一些特殊的DNA结构[8-9]。此外,遗传学研究证实,在大肠杆菌体内,EcoEndoV在修复含有脱氧肌苷的受损DNA的过程中发挥关键作用[10-12]。细菌来源的核酸内切酶V中,海栖热胞菌(Thermotoga maritima)核酸内切酶V (TmaEndoV)的生化研究证实其具有与EcoEndoV相似的底物特异性,并在一定程度上阐明了核酸内切酶V的底物识别和催化机制[13-16]。此外,对于EcoEndoV和TmaEndoV晶体结构的解析为核酸内切酶V的底物识别和催化机制提供了直观的阐释[17-19]。
核酸内切酶V在细菌,古菌和真核生物3个生命领域是高度保守的[20]。在真核生物中,小鼠和人类的核酸内切酶V已经得到表征,其对含脱氧肌苷的受损DNA具有比细菌内切核酸酶V更强的底物特异性[21-22]。此外,有两项研究[3, 23]进一步提出人类的核酸内切酶V本质上为核糖核酸酶,其特异性剪切含肌苷的RNA底物,且在RNA代谢中起相应的作用。在古菌中,对于核酸内切酶V的研究目前相对有限。闪烁古生球菌(Archaeoglobus fulgidus)的核酸内切酶V (AfuEndoV)是第一个被表征的古菌核酸内切酶V,该核酸内切酶V特异性识别并剪切含有脱氧肌苷的DNA底物[24]。嗜压嗜热球菌(Thermococcus barophilus)的核酸内切酶V (TbaEndoV)同样具有极强的底物特异性[25],来源于激烈火球菌(Pyrococcus furiosus)的核酸内切酶V (PfuEndoV)却对含脱氧肌苷的受损DNA和含肌苷的RNA底物均显示出典型的核酸内切酶V剪切活性[26]。在嗜酸性铁质原生质体(Ferroplasma acidarmanus)中,研究发现一个特殊的双功能核酸内切酶V,它的底物谱相对较广,含有三类脱氨基碱基(次黄嘌呤,尿嘧啶和黄嘌呤)的DNA均为该酶的目标底物[27]。
硫化叶菌(Sulfolobus)是一类属于泉古菌门的极端嗜酸嗜热古菌。S. acidocaldarius能够在75-80 ℃的高温下生长并保持相对较高的基因组稳定性[28-29]。鉴于S. acidocaldarius在极端环境中保持相对较低基因突变率的特性,该古菌高效的核酸修复系统得到了广泛的研究[29]。因此,为加深古菌核酸内切酶V生物功能的研究,本文通过表达纯化S. acidocaldarius的核酸内切酶V (SacEndoV),在体外对SacEndoV的核酸酶活性以及酶学特性进行了研究。
1 材料和方法 1.1 材料 本实验所用的S. acidocaldarius菌株由德国弗莱堡大学Albers教授馈赠。大肠杆菌菌株DH5α,Rosetta (DE3)购自北京全式金生物技术有限公司,表达载体pET28a (+)为本实验室保存。用于扩增目的基因并构建表达载体的引物均由生工生物工程(上海)股份有限公司合成。用于测定核酸内切酶V活性的损伤寡核苷酸底物由铂尚生物技术(上海)有限公司合成,RNA底物由宝生物工程(大连)有限公司合成,底物序列见表 1。DNA Ladder、蛋白Marker、PrimSTAR DNA聚合酶均购自TaKaRa公司。基因组提取试剂盒,质粒提取试剂盒,PCR产物纯化和胶回收试剂盒,Brandford蛋白浓度测定试剂盒均购自生工生物工程(上海)股份有限公司。ClonExpress II One Step Cloning试剂盒购自诺唯赞生物科技股份有限公司。Ni-NTA蛋白纯化树脂为Bio-Rad公司产品。
表 1. 用于研究SacEndoV核酸内切酶V活性的底物序列 Table 1. Substrates used for analyzing endonuclease V activity of SacEndoV
| Sequences (5′→3′) | Damages | Comments |
| *CAGCCAGGTGTCTCACTXAGCCGACTCGCCACAGT | X=dI | Deaminated base |
| *CAGCCAGGTGTCTCACTXAGCCGACTCGCCACAGT | X=dU | |
| *CAGCCAGGTGTCTCACTXAGCCGACTCGCCACAGT | X=dX | |
| *CAGCCAGGTGTCTCACTXAGCCGACTCGCCACAGT | X=dSpacer | Apurinic/apyrimidinic site |
| *CAGCCAGGTGTCTCACdIXAGCCGACTCGCCACAGT | X=dSpacer | |
| *CAGCCAGGTGTCTCACdIXAGCCGACTCGCCACAGT | X=Spacer C3 | |
| *CAGCCAGGTGTCTCACdIXAGCCGACTCGCCACAGT | X=Spacer C9 | |
| *CAGCCAGGTGTCTCACTXdIGCCGACTCGCCACAGT | X=dSpacer | |
| *CAGCCAGGTGTCTCACTXdIGCCGACTCGCCACAGT | X=Spacer C3 | |
| *CAGCCAGGTGTCTCACTXdIGCCGACTCGCCACAGT | X=Spacer C9 | |
| *CAGCCAGGTGTCTCACTAAGCCGACTCGCCACAGT | No damage | Normal strand |
| *CAGCCAGGTGTCTCACTTAGCCGACTCGCCACAGT | No damage | |
| *CAGCCAGGTGTCTCACTCAGCCGACTCGCCACAGT | No damage | |
| *CAGCCAGGTGTCTCACTGAGCCGACTCGCCACAGT | No damage | |
| ACTGTGGCGAGTCGGCTAAGTGAGACACCTGGCTG | No damage | Complementary strand |
| ACTGTGGCGAGTCGGCTTAGTGAGACACCTGGCTG | No damage | |
| ACTGTGGCGAGTCGGCTCAGTGAGACACCTGGCTG | No damage | |
| ACTGTGGCGAGTCGGCTGAGTGAGACACCTGGCTG | No damage | |
| ACTGTGGCGAGTCGGCTXAGTGAGACACCTGGCTG | X=dI | Deaminated base |
| ACTGTGGCGAGTCGGCTXAGTGAGACACCTGGCTG | X=dU | |
| *CAGCCAGGTGTCTCACTXA | X=dI | Marker |
| *cagccaggugucucacuxagccgacucgccacagu | X=I | Deaminated base |
| acuguggcgagucggcuuagugagacaccuggcug | No damage | Complementary strand |
| *: fluorescent group FAM; uppercase: DNA substrate; lowercase: RNA substrate. | ||
表选项
1.2 表达载体构建 以S.acidocaldarius基因组DNA作为模板,通过PCR扩增核酸内切酶V (Saci_0544)的基因。正向引物序列为5′-GCAGGCTCGCATATGGAAG ATTTTATGATAGA-3′,反向引物序列为5′-GCT GGGTTCGGATCCTTATTCTTTTTTCTTTAGCTC-3′。再用PCR扩增的方法线性化pET28a质粒,正向引物序列为5′-GGATCCGAACCCAGCAA TTCGAGCTCCGTCGACAAG-3′,反向引物序列为5′-CATATGCGAGCCTGCACCCTGGAAGTAC AGGTTTTC-3′。PCR产物经PCR产物纯化试剂盒纯化。用ClonExpress II重组克隆试剂盒连接核酸内切酶V基因和线性化的pET28a质粒,取重组连接产物转化入大肠杆菌DH5α,挑取单克隆菌落PCR鉴定阳性克隆,并进行DNA测序,确定核酸内切酶V的基因序列是否准确无误,最终获得表达载体pET28a(+)-Saci_0544。
在pET28a(+)-Saci_0544的基础上,对SacEndoV基因进行点突变,以构建失活突变体。以pET28a(+)-Saci_0544为模板,通过PCR扩增该表达载体,正向引物序列为5′-TGGTGTTGCC ATAGCTTATAAGGGAAATATAG-3′,反向引物序列为5′-AAGCTATGGCAACACCACATAAATTC TTTAT-3′。将PCR产物与ClonExpress II重组酶在37 ℃下孵育30 min后转化到大肠杆菌DH5α细胞中,挑取单克隆菌落进行DNA测序,以确认突变体是否构建成功。
1.3 重组蛋白的诱导表达和纯化 将重组表达载体pET28a(+)-Saci_0544转化到大肠杆菌Rosetta (DE3)感受态细胞中。挑取阳性单克隆在含有50 μg/mL卡那霉素的LB液体培养基中逐级放大培养。待大肠杆菌培养液的OD600达到0.6-0.8,向培养液中加入IPTG (isopropy-β-D-thiogalactoside,异丙基硫代半乳糖苷)至终浓度0.5 mmol/L,20 ℃培养18 h,诱导重组蛋白表达。培养完成后,离心(4 ℃,8000 r/min,4 min)收集细菌体。菌体沉淀用裂解缓冲液(20 mmol/L Tris-HCl pH 8.0,300 mmol/L NaCl,1 mmol/L PMSF,10%甘油)重悬,并通过超声法破碎。离心分离(4 ℃,10000 r/min,40 min)裂解产物并收集上清液。将Ni-NTA树脂装填到亲和层析柱中,预先用5倍树脂体积的裂解缓冲液在4 ℃下平衡Ni-NTA树脂1 h。然后,将离心上清液加入层析柱中,用10倍柱体积的洗涤缓冲液(20 mmol/L Tris-HCl pH 8.0,300 mmol/L NaCl,20 mmol/L咪唑,1 mmol/L PMSF,10%甘油)洗涤树脂,去除非特异性结合的大肠杆菌蛋白。目标蛋白以洗脱缓冲液(20 mmol/L Tris-HCl pH 8.0,300 mmol/L NaCl,300 mmol/L咪唑,1 mmol/L PMSF,10%甘油)洗脱收集。通过15% SDS-PAGE确定蛋白质的分子量及纯度,超滤法将目标蛋白置换到储存缓冲液(20 mmol/L Tris-HCl pH 8.0,100 mmol/L NaCl,50%甘油)中。蛋白浓度通过Bradford法测定。
1.4 SacEndoV内切核酸酶V活性测定 用以检测SacEndoV的核酸内切酶V活性的寡核苷酸底物序列见表 1,部分底物5′端带有FAM荧光标记。将带有5′ FAM标记的单链底物与其互补单链混合于退火缓冲液(20 mmol/L Tris-HCl pH 8.0,50 mmol/L NaCl)中,80 ℃加热5 min,自然降温至室温,退火形成双链底物。SacEndoV的标准活性测定反应体系(20 μL)包括:20 mmol/L Tris-HCl pH 8.0,1.0 mmol/L MgCl2,1.0 mmol/L DTT,50 nmol/L荧光标记底物和不同浓度的SacEndoV蛋白。标准活性测定反应在55 ℃下进行15 min,加入20 μL反应终止液(50 mmol/L EDTA,0.2% SDS,0.1%溴酚蓝,90%甲酰胺)终止反应。将反应溶液在95 ℃加热5 min,并在冰上冷却后,立即将样品上样到含有8 mol/L尿素的15%变性聚丙烯酰胺凝胶中进行电泳。电泳结束后,凝胶由Amersham Typhoon RGB生物分子成像仪扫描成像,电泳结果的定量分析通过ImageQuant软件进行。
SacEndoV的生化特性表征。反应温度对SacEndoV活性影响的实验在40 ℃至95 ℃的反应温度下进行15 min,反应缓冲液(20 μL)组成为20 mmol/L Tris-HCl pH 8.0,1.0 mmol/L MgCl2,1.0 mmol/L DTT,50 nmol/L荧光标记底物。使用不同二价离子(包括Mg2+、Mn2+、Zn2+、Ca2+、Ni2+、Co2+)来确定离子种类对SacEndoV活性的影响,反应体系中所有二价离子的浓度均为1.0 mmol/L,反应在55 ℃下进行15 min。Mg2+和Mn2+的最佳反应浓度优化实验的Mg2+和Mn2+的浓度范围为0.1 mmol/L至8.0 mmol/L,反应在55 ℃下进行15 min。通过在不同反应pH下测定酶活性,确定SacEndoV的最佳反应pH。pH范围为5.0-10.5,反应在55 ℃下进行15 min。用MES-NaOH制备pH 5.0-7.0的缓冲液,用Tris-HCl制备pH 7.0-9.0的缓冲液,用Gly-NaOH制备pH 9.0-10.5的缓冲液。SacEndoV的耐盐性实验中,反应缓冲液中NaCl的终浓度分别为50、100、200、300、400、500 mmol/L,反应在55 ℃下进行15 min。
2 结果和分析 2.1 SacEndoV及其失活突变体的表达纯化 将pET28a(+)-Saci_0544表达载体转化到E. coli Rosetta (DE3)表达菌株中诱导表达SacEndoV蛋白,表达纯化结果见图 1-A。蛋白样品经15% SDS-PAGE电泳检测,显示明显的目的蛋白条带,目的蛋白的纯度达到90%以上。通过与标准蛋白Marker比较,目标蛋白的分子量约为23.0 kDa,与SacEndoV的理论计算值(22.65 kDa)相符。
 |
| 图 1 SacEndoV及其失活突变体(SacEndoV-D37A)表达纯化 Figure 1 Expression and purification of SacEndoV and its inactivated mutant SacEndoV-D37A. A: 15% SDS-PAGE analysis of recombinant SacEndoV recovered from induced E. coli cells. The gel was stained with Coomassie Blue R-250. Lane M: molecular weight marker; lanes UI and I, uninduced and induced E. coli total proteins; lanes P1 and P2: purified recombinant SacEndoV and its inactivated mutant SacEndoV-D37A. B: Multi-alignment of different endonuclease V sequences from archaea and bacteria. Asterisk indicates the conserved residue mutated in this study. The dashes indicate gaps. Identical residues are shown in black boxes. Residues with conserved and semi-conserved substitutions are shown in gray boxes. |
| 图选项 |
对PfuEndoV的研究表明,突变35位的天冬氨酸残基将导致该酶丧失核酸内切酶V活性[26],并且在TmaEndoV的研究中预测该保守氨基酸残基为核酸内切酶V结合Mg2+的关键氨基酸残基之一[16]。因此,本研究对部分来源于古菌和细菌的核酸内切酶V序列进行多序列比对分析(图 1-B)。结果表明,PfuEndoV的35位的天冬氨酸残基在SacEndoV以及其他参与比对的核酸内切酶V序列中高度保守。在此基础上,本研究构建了一个将37位天冬氨酸残基突变为丙氨酸残基的SacEndoV失活突变体,作为野生型SacEndoV的阴性对照。经过与野生型SacEndoV相同的表达纯化流程,得到突变体蛋白SacEndoV-D37A (图 1-A)。
2.2 SacEndoV核酸内切酶V的活性 SacEndoV对于本研究所使用的损伤DNA底物的剪切机制见图 2-B。经过标准核酸内切酶V活性测定反应,反应产物显示出与标准Marker大小完全一致的单一条带(图 2-C),表明SacEndoV具有典型的核酸内切酶V活性。为了进一步确定SacEndoV的核酸内切酶V活性,利用具有不同配对方式的双链损伤DNA底物检测SacEndoV的剪切活性(图 2-C)。结果显示SacEndoV对所有双链DNA底物均具有核酸内切酶V活性,但相比于单链DNA,SacEndoV对双链DNA的剪切活性相对更低。同时,SacEndoV的失活突变体对于单链和双链损伤DNA底物均不具备剪切活性,表明野生型SacEndoV的核酸内切酶V活性不是来自纯化过程中残留大肠杆菌核酸内切酶V的污染。
 |
| 图 2 SacEndoV核酸内切酶V活性测定 Figure 2 Determination of SacEndoV endonuclease V activity. The reaction mixtures contained 50 nmol/L substrate, various concentrations of SacEndoV in reaction buffer consisted of 20 mmol/L Tris-HCl pH 8.0, 1.0 mmol/L MgCl2, 1.0 mmol/L DTT. A: deoxyinosine formation from the deamination of the exocyclic amino group of the adenine base. B: schematic diagram of endonuclease V cleavage mechanism. C: deoxyinosine-containing DNA cleavage of SacEndoV. DNA cleavage reactions were performed for 15 min at 55 ℃ with 15 nmol/L SacEndoV. D: effect of enzyme concentrations on endonuclease activity of SacEndoV. Various SacEndoV concentrations ranging from 2.5 to 25 nmol/L were added in the DNA cleavage reaction mixtures. DNA cleavage reactions were performed for 15 min at 55 ℃. E: inosine-containing RNA cleavage of SacEndoV. RNA cleavage reactions were performed for 15 min at 55 ℃ with 15 nmol/L SacEndoV. |
| 图选项 |
本研究进一步探究SacEndoV是否以浓度依赖的方式剪切损伤DNA底物。从图 2-D中可看出,SacEndoV对损伤DNA底物的剪切活性呈现酶浓度依赖性,且随着酶浓度的升高而增强。在相同的酶浓度下,SacEndoV对于单链DNA底物的活性显著高于双链DNA底物,说明在体外SacEndoV偏好单链状态的损伤DNA底物。
对于PfuEndoV的研究表明其具有类似于人类核酸内切酶V的对于RNA底物的活性[26],本研究初步探究了SacEndoV是否具有针对RNA中带有次黄嘌呤的肌苷(I,Inosine)的内切酶活性。结果如图 2-E所示,SacEndoV对于含I的单链和双链RNA均具有明显的剪切活性,且对于单链RNA底物的剪切活性高于双链RNA。可见,在体外,SacEndoV对于含I的RNA底物具有剪切活性,且其对于损伤RNA底物的剪切活性是与损伤DNA底物相似的。同时,SacEndoV的失活突变体对于单链和双链RNA底物均未表现出剪切活性,表明其对于RNA底物的活性不是来自于外源蛋白的污染。
2.3 SacEndoV生化特性的表征 SacEndoV经初步测定具有典型的核酸内切酶V活性,为进一步了解其生化特性,本研究对该酶进行了生化表征,结果见图 3。当反应温度为40-65 ℃时,SacEndoV的底物剪切率相对较低(8%-65%)。而反应温度高于70 ℃时,SacEndoV的活性急剧升高,底物剪切率接近100%,且随着温度升高SacEndoV的底物剪切率进入平台期(图 3-A)。因此,SacEndoV在70-95 ℃的温度范围内具有很高的核酸内切酶V活性。
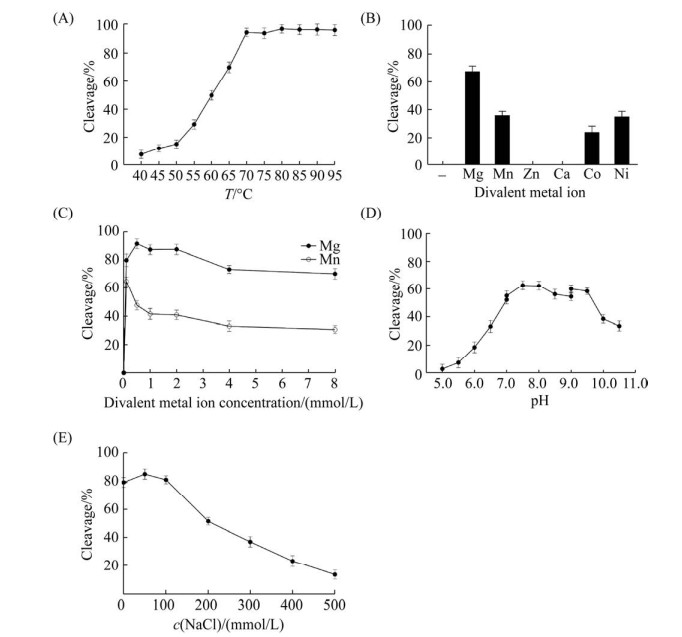 |
| 图 3 SacEndoV生化特性表征 Figure 3 Biochemical characterization of SacEndoV. DNA cleavage reactions were performed using a 35 nt single-stranded DNA as substrate (50 nmol/L). A: effect of temperature on SacEndoV activity, 5.0 nmol/L SacEndoV was added. B: effect of divalent metal ions on SacEndoV activity, 10.0 nmol/L SacEndoV was added. C: effect of Mg2+ and Mn2+ concentrations on SacEndoV activity, 10.0 nmol/L SacEndoV was added. D: effect of pH on SacEndoV activity, 10.0 nmol/L SacEndoV was added. Reaction buffers with pH 5.0 to 7.0 were prepared with MES-NaOH, pH 7.0 to 9.0 with Tris-HCl, and pH 9.0 to 10.5 with Gly-NaOH. E: effect of NaCl concentrations on SacEndoV activity, 10.0 nmol/L SacEndoV was added. |
| 图选项 |
基于极端嗜热古菌核酸内切酶V的研究[25-26],本研究选择Mg2+、Mn2+、Zn2+、Ca2+、Ni2+和Co2+探究不同二价金属离子对SacEndoV活性的影响(图 3-B)。当反应体系中添加Zn2+和Ca2+,SacEndoV没有检测到剪切活性。然而,当Mg2+、Mn2+、Ni2+和Co2+存在时,SacEndoV对于含脱氧肌苷的DNA底物均表现出明显的剪切活性。因此,SacEndoV的核酸内切酶活性以二价金属离子作为辅助因子,且各种二价金属离子的辅助作用为Mg2+ > Mn2+≈Ni2+ > Co2+ > Zn2+≈Ca2+。此外,图 3-C表明,过高浓度的Mg2+和Mn2+将抑制SacEndoV的核酸内切酶活性。但SacEndoV对于Mg2+的耐受程度相对更高,其最优反应浓度在0.5-2.0 mmol/L的范围内。
根据图 3-D的结果,SacEndoV的最优反应pH区间为7.5-8.0。在相对强的酸性和碱性pH范围内(pH < 6.5,pH > 10.0),SacEndoV活性急剧降低,特别是当pH低于5.5时,该酶基本失活。此外,SacEndoV最佳的反应NaCl浓度应当低于50 mmol/L (图 3-E)。当NaCl浓度高于200 mmol/L时,其剪切活性受到明显的抑制,表明SacEndoV对高浓度NaCl不具备耐受性。
2.4 SacEndoV的热稳定性 鉴于SacEndoV在70-95 ℃具有良好的剪切活性,本研究进一步探究该酶在高温下的热稳定性,结果见图 4。将SacEndoV在一系列温度下孵育10、20、40和80 min,然后在标准反应条件下测定酶的残留活性(图 4-A)。当温育温度为55 ℃时,观察到SacEndoV稳定性较强,并且温育80 min后,它仍保留了部分剪切活性(20%)。然而,随着孵育温度的升高,SacEndoV的稳定性急剧下降。尽管在75 ℃孵育10 min后,SacEndoV仍可以保留部分剪切活性(60%),但在85 ℃和95 ℃下孵育10 min后,残余的酶活性十分微弱(20%和10%)。这一结果与部分来源于嗜热古菌的核酸内切酶V并不一致[25-26]。
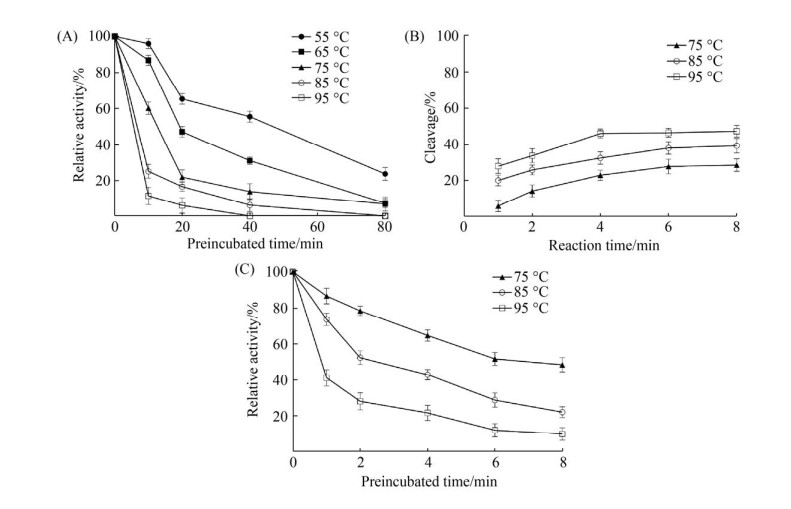 |
| 图 4 SacEndoV的热稳定性 Figure 4 Thermostability of SacEndoV. A: thermostability of SacEndoV. Enzyme was incubated at various temperatures (55 ℃, 65 ℃, 75 ℃, 85 ℃ and 95 ℃, respectively) at a concentration of 10 nmol/L. B: time course of DNA cleavage by SacEndoV. DNA cleavage reactions were performed for 15 min at 75 ℃, 85 ℃ and 95 ℃ with 1.25 nmol/L SacEndoV added. C: thermostability of SacEndoV measured simultaneously with DNA cleavage activity. Enzyme was incubated at various temperatures (75 ℃, 85 ℃ and 95 ℃, respectively) at a concentration of 1.25 nmol/L. |
| 图选项 |
为进一步验证SacEndoV在高温下的酶活性,在降低反应体系酶浓度的前提下同步测定了SacEndoV的活性和热稳定性(图 4-B和图 4-C)。在75-95 ℃的高温下,随着反应时间的延长,SacEndoV对底物的剪切率逐渐增大。并且在4-6 min的反应时间内,不同反应温度下所有酶的底物剪切活性即达到饱和。同时,在相同的反应时间内,随着反应温度的升高,SacEndoV的底物剪切率小幅升高(图 4-B)。因此,SacEndoV确实在高温环境下具有很高的酶活性。此外,该结果说明,图 3-A中,SacEndoV的底物剪切率进入平台期,是由于在反应体系中酶浓度较高的前提下,当反应温度高于70 ℃,温度升高对酶活性的促进作用导致SacEndoV在15 min内几乎将底物完全剪切(底物剪切率接近100%),从而不同反应温度间未显示显著的剪切活性差异。然而,随着孵育时间的延长,SacEndoV残余的酶活性却逐渐降低(图 4-C),表明SacEndoV在高温下保持高酶活性有可能是酶结合底物后,增强了其稳定性所致。
2.5 SacEndoV对不同损伤DNA底物的选择性 研究表明,EcoEndoV和TmaEndoV均具有宽泛的底物谱[9, 13]。在此基础上,本研究利用带有各种不同类型损伤的DNA作为底物,探究SacEndoV的底物特异性(图 5)。如图 5-A所示,本研究测定了SacEndoV对于带有3种脱氨基碱基,AP位点以及4种正常碱基的DNA底物的剪切活性,结果表明其仅剪切含有脱氧肌苷的损伤DNA底物。同时,一系列带有4种常规碱基所有错配类型的双链DNA底物被用于测定SacEndoV的剪切活性(图 5-B和图 5-C)。结果表明,SacEndoV对所有包含错配位点的DNA底物均没有可观察到的剪切活性。可见,不同于细菌来源的EcoEndoV和TmaEndoV,SacEndoV对含有脱氧肌苷的损伤DNA底物具有极强的底物特异性。
 |
| 图 5 SacEndoV对不同损伤DNA底物的选择性 Figure 5 Substrate specificity of SacEndoV. A: cleavage activity of SacEndoV on ssDNA substrates containing I, U, X, AP or normal bases. B, C: cleavage activity of SacEndoV on dsDNA substrates containing different types of mismatched bases. |
| 图选项 |
2.6 底物中特定核苷酸结构完整性对SacEndoV内切核酸酶活性的影响 鉴于核酸内切酶V的典型活性,我们推测DNA底物中脱氧肌苷3′端相邻的脱氧核糖核苷酸对于核酸内切酶V发挥剪切活性具有重要意义。因此,利用脱氧肌苷3′端相邻的脱氧核糖核苷酸被AP位点(无嘧啶/无嘌呤位点)替代的特殊底物,本研究探究了该核苷酸的结构完整性是否对SacEndoV的剪切活性产生影响。图 6-A的结果表明,SacEndoV对这类特殊底物不具备显著的剪切活性,且取代3′端脱氧核糖核苷酸的AP位点的类型对结果无显著影响。本研究进一步测定SacEndoV对脱氧肌苷5′端相邻脱氧核糖核苷酸被AP位点取代的底物的剪切活性(图 6-B)。结果表明,此类型的损伤DNA底物对于SacEndoV的剪切活性无显著影响。此外,在双链DNA状态下,对于该特殊核苷酸结构不完整所造成的SacEndoV活性缺失,互补链上对应的常规核苷酸不具备明显的补偿效应(图 6-C)。因此,本研究初步确定,与脱氧肌苷3′端相邻的脱氧核糖核苷酸结构完整性对于SacEndoV识别并剪切相关底物极其关键。
 |
| 图 6 底物中特定核苷酸结构完整性对SacEndoV活性的影响 Figure 6 Effect of the structural integrity of specific nucleotide in the substrate on the activity of SacEndoV. Normal deoxyinosine-containing damaged DNA substrates were used as control group. A: effect of incomplete structure of deoxyribonucleotide adjacent to the 3′ end of deoxyinosine on SacEndoV activity. Single-stranded DNA was used as a substrate. B: effect of incomplete structure of deoxyribonucleotide adjacent to the 5′ end of deoxyinosine on SacEndoV activity. Single-stranded DNA was used as a substrate. C: compensation effect of nucleotides on the complementary strand for the loss of SacEndoV activity caused by the incomplete structure of certain nucleotide. Double-stranded DNA was used as a substrate. |
| 图选项 |
3 讨论 现有研究已经阐明核酸内切酶V在体外对损伤DNA底物的剪切机制为水解位于脱氧肌苷3′端的第二个磷酸二酯键。据此,本研究证实SacEndoV对于含脱氧肌苷的损伤DNA显示出典型的核酸内切酶V活性,相较于双链DNA底物,SacEndoV在体外对单链DNA底物具有明显的偏好性。SacEndoV展现底物偏好性的推测原因为双链DNA的二级结构或者互补链上的配对碱基与氢键一定程度上阻碍了SacEndoV接触并识别次黄嘌呤。古菌来源的核酸内切酶V中,TbaEndo V具有与SacEndoV一致的偏好性[25],但此特性的生物学意义需要在生物体内进行进一步的探究。此外,SacEndoV的底物谱非常窄,仅对含有脱氧肌苷的损伤DNA底物表现出剪切活性。就底物特异性而言,大部分古菌内切核酸酶V与SacEndoV一致[24-26],但来自F. acidarmanus的双功能内切核酸V底物谱相对更广[27]。因此,除非常规的内切核酸酶V外,古菌来源的核酸内切酶V倾向于对带有脱氧肌苷的损伤DNA表现出极强的底物特异性。此外,除损伤DNA底物,SacEndoV对于含I的RNA底物同样具有剪切活性,这一特性与PfuEndoV以及人类核酸内切酶V是一致的[23, 26]。鉴于核酸内切酶V相对特殊的底物剪切机制,底物中除脱氧肌苷外,与脱氧肌苷的3′端相邻的脱氧核糖核苷酸是一个具有重要意义的核苷酸。基于本文的研究结果,该脱氧核糖核苷酸上碱基的存在对于SacEndoV剪切含脱氧肌苷的DNA底物是必要的,但尚不确定该核苷酸其他部分的完整性是否也对酶的活性产生重大影响。对于SacEndoV及其底物复合物晶体结构的解析将有助于进一步阐明该现象的具体机制。
SacEndoV的生化表征表明,该核酸内切酶在70-95 ℃的温度范围内具有极高的剪切活性。这与S. acidocaldarius的最适生长温度相对一致,一定程度上展现出生物对于生长环境的适应性。极端嗜热古菌在高温环境中面临着以更高的概率和速率发生DNA脱氨基作用的风险[30]。SacEndoV对损伤DNA底物极高的剪切活性有助于S. acidocaldarius在高温环境下维持基因组的稳定性。尽管SacEndoV在高温下具有极高的剪切活性,进一步研究表明其在体外可能不具备良好的热稳定性。由此推断,在高温导致其活性逐渐丧失之前,SacEndoV极高的核酸内切酶活性确保其能够快速完成损伤DNA底物的剪切。此外,SacEndoV展现这一特性的另一可能机制为SacEndoV与底物结合后,所形成的酶和底物的复合物的使得其自身的结构变得更加稳定。即底物的保护作用提高了SacEndoV的热稳定性,使其在高温下保持极高的底物剪切活性。
二价金属离子是核酸内切酶V维持底物剪切活性必要的辅助因子。SacEndoV在Mg2+,Mn2+,Ni2+和Co2+存在时显示出典型的核酸内切酶V活性,但在Zn2+,Ca2+存在时则无法检测到剪切活性。对于所有古菌来源的核酸内切酶V,Mg2+和Mn2+为有助于其维持较高核酸内切酶活性的两种典型辅因子。与SacEndoV相似,PfuEndoV[26]更偏好Mg2+作为辅因子,但对于TbaEndoV[25]而言,Mg2+和Mn2+对其活性的影响几乎是一致的。此外,Ni2+作为辅因子时,SacEndoV和TbaEndo V[25]对含脱氧肌苷的DNA底物表现出剪切活性,但其对PfuEndoV[26]则不具备辅助作用。在Co2+存在的情况下,SacEndoV仍保持相对微弱的底物剪切活性,而目前在其他的古菌核酸内切酶V中没有观察到Co2+的辅助作用。可见,古菌核酸内切酶V需要二价金属离子作为辅助因子,但对二价金属离子类型的偏好性在不同物种之间略有不同。
核酸内切酶V在剪切含有脱氧肌苷的损伤DNA后,仍会与底物保持紧密的结合[31]。此外,核酸内切酶V无法将脱氧肌苷从损伤DNA中切除,因此核酸内切酶V需要招募其他的修复酶来完成脱氧肌苷后续的修复过程。虽然目前对于脱氧肌苷后续修复过程的了解很少,但针对该特殊修复途径提出了多种假说。一类假说提出,DNA聚合酶可能参与脱氧肌苷的切除修复。在大肠杆菌中,前人报道了一个涉及核酸内切酶V,DNA聚合酶I和DNA连接酶的脱氧肌苷修复模型。该模型中,DNA聚合酶I的3′-5′核酸外切酶活性在脱氧肌苷的去除中起主要作用[32-33]。在古菌中,可以识别次黄嘌呤的DNA聚合酶B被认为与脱氧肌苷的修复相关,具体的修复机制仍有待确认[26]。特定的一些具有5′核酸内切酶活性的修复酶也被认为能够协助脱氧肌苷的切除。古菌来源的核酸内切酶Q是一种新型核酸内切酶,其具备从损伤碱基的5′端剪切含脱氧肌苷的DNA底物的催化活性[34]。因此,核酸内切酶Q具有与核酸内切酶V协同修复脱氧肌苷的潜力[25]。具有3′核酸外切酶活性的核酸酶是另一类协助切除脱氧肌苷的潜在修复酶。P. furiosus的AP核酸内切酶(apurinic/apyrimidinic endonuclease)具有3′-5′核酸外切酶活性,表明在核酸内切酶V剪切损伤的DNA链后,其也许能够从缺口处切除脱氧肌苷[35]。当以Mn2+作为辅助因子时,TmaEndoV也表现出3′-5′核酸外切酶活性,但该性质似乎是TmaEndoV特有的[13]。
本研究鉴定并表征了S. acidocaldarius内切核酸酶V,这是第一个对于Sulfolobus属来源的内切核酸酶V生化功能和酶学特征的研究。S. acidocaldarius是研究古菌在高温条件下维持基因组完整性的模式菌株之一。因此,对于SacEndoV的研究有助于丰富古菌来源核酸内切酶V的研究内容,加深对于古菌核酸内切酶V的了解,也为进一步解析S. acidocaldarius脱氧肌苷切除修复途径奠定了基础。
References
| [1] | Lindahl T. Instability and decay of the primary structure of DNA. Nature, 1993, 362(6422): 709-715. DOI:10.1038/362709a0 |
| [2] | Dedon PC, Tannenbaum SR. Reactive nitrogen species in the chemical biology of inflammation. Archives of Biochemistry and Biophysics, 2004, 423(1): 12-22. DOI:10.1016/j.abb.2003.12.017 |
| [3] | Morita Y, Shibutani T, Nakanishi N, Nishikura K, Iwai S, Kuraoka I. Human endonuclease V is a ribonuclease specific for inosine-containing RNA. Nature Communications, 2013, 4: 2273. DOI:10.1038/ncomms3273 |
| [4] | Grunebaum E, Cohen A, Roifman CM. Recent advances in understanding and managing adenosine deaminase and purine nucleoside phosphorylase deficiencies. Current Opinion in Allergy and Clinical Immunology, 2013, 13(6): 630-638. DOI:10.1097/ACI.0000000000000006 |
| [5] | Saparbaev M, Laval J. Excision of hypoxanthine from DNA containing dIMP residues by the Escherichia coli, yeast, rat, and human alkylpurine DNA glycosylases. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(13): 5873-5877. DOI:10.1073/pnas.91.13.5873 |
| [6] | Cao WG. Endonuclease V: an unusual enzyme for repair of DNA deamination. Cellular and Molecular Life Sciences, 2013, 70(17): 3145-3156. DOI:10.1007/s00018-012-1222-z |
| [7] | Gates FT 3rd, Linn S 3rd. Endonuclease v of Escherichia coli. Journal of Biological Chemistry, 1977, 252(5): 1647-1653. DOI:10.1016/S0021-9258(17)40598-9 |
| [8] | Yao M, Kow YW. Strand-specific cleavage of mismatch-containing DNA by deoxyinosine 3'-endonuclease from Escherichia coli. The Journal of Biological Chemistry, 1994, 269(50): 31390-31396. DOI:10.1016/S0021-9258(18)31706-X |
| [9] | Yao M, Kow YW. Cleavage of insertion/deletion mismatches, flap and pseudo-Y DNA structures by deoxyinosine 3'-endonuclease from Escherichia coli. Journal of Biological Chemistry, 1996, 271(48): 30672-30676. DOI:10.1074/jbc.271.48.30672 |
| [10] | Guo GM, Weiss B. Endonuclease V (nfi) mutant of Escherichia coli K-12. Journal of Bacteriology, 1998, 180(1): 46-51. DOI:10.1128/JB.180.1.46-51.1998 |
| [11] | Weiss B. Endonuclease V of Escherichia coli prevents mutations from nitrosative deamination during nitrate/nitrite respiration. Mutation Research/DNA Repair, 2001, 461(4): 301-309. DOI:10.1016/S0921-8777(00)00062-8 |
| [12] | Schouten KA, Weiss B. Endonuclease V protects Escherichia coli against specific mutations caused by nitrous acid. Mutation Research/DNA Repair, 1999, 435(3): 245-254. DOI:10.1016/S0921-8777(99)00049-X |
| [13] | Huang JM, Lu J, Barany F, Cao WG. Multiple cleavage activities of endonuclease V from Thermotoga maritima: ? recognition and strand nicking mechanism. Biochemistry, 2001, 40(30): 8738-8748. DOI:10.1021/bi010183h |
| [14] | Huang JM, Lu J, Barany F, Cao WG. Mutational analysis of endonuclease V from Thermotoga maritima. Biochemistry, 2002, 41(26): 8342-8350. DOI:10.1021/bi015960s |
| [15] | Feng H, Dong L, Klutz AM, Aghaebrahim N, Cao WG. Defining amino acid residues involved in DNA-Protein interactions and revelation of 3'-exonuclease activity in endonuclease V. Biochemistry, 2005, 44(34): 11486-11495. DOI:10.1021/bi050837c |
| [16] | Feng H, Dong L, Cao WG. Catalytic mechanism of endonuclease V: a catalytic and regulatory two-metal model. Biochemistry, 2006, 45(34): 10251-10259. DOI:10.1021/bi060512b |
| [17] | Zhang ZM, Jia Q, Zhou C, Xie W. Crystal structure of E. coli endonuclease V, an essential enzyme for deamination repair. Scientific Reports, 2015, 5: 12754. DOI:10.1038/srep12754 |
| [18] | Dalhus B, Arvai AS, Rosnes I, Olsen ?E, Backe PH, Alseth I, Gao HH, Cao WG, Tainer JA, Bj?r?s M. Structures of endonuclease V with DNA reveal initiation of deaminated adenine repair. Nature Structural & Molecular Biology, 2009, 16(2): 138-143. |
| [19] | Rosnes I, Rowe AD, Vik ES, Forstr?m RJ, Alseth I, Bj?r?s M, Dalhus B. Structural basis of DNA loop recognition by endonuclease V. Structure, 2013, 21(2): 257-265. DOI:10.1016/j.str.2012.12.007 |
| [20] | Aravind L, Walker DR, Koonin EV. Conserved domains in DNA repair proteins and evolution of repair systems. Nucleic Acids Research, 1999, 27(5): 1223-1242. DOI:10.1093/nar/27.5.1223 |
| [21] | Moe AE, Ringvoll J, Nordstrand LM, Eide L, Bj?ra?s M, Seeberg E, Rognes T, Klungland A. Incision at hypoxanthine residues in DNA by a mammalian homologue of the Escherichia coli antimutator enzyme endonuclease V. Nucleic Acids Research, 2003, 31(14): 3893-3900. DOI:10.1093/nar/gkg472 |
| [22] | Mi RJ, Alford-Zappala M, Kow YW, Cunningham RP, Cao WG. Human endonuclease V as a repair enzyme for DNA deamination. Mutation Research, 2012, 735(1/2): 12-18. |
| [23] | Vik ES, Nawaz MS, Andersen PS, Fladeby C, Bj?r?s M, Dalhus B, Alseth I. Endonuclease V cleaves at inosines in RNA. Nature Communications, 2013, 4: 2271. DOI:10.1038/ncomms3271 |
| [24] | Liu J, He B, Qing H, Kow YW. A deoxyinosine specific endonuclease from hyperthermophile, Archaeoglobus fulgidus: a homolog of Escherichia coli endonuclease V. Mutation Research/DNA Repair, 2000, 461(3): 169-177. DOI:10.1016/S0921-8777(00)00054-9 |
| [25] | Wang YX, Zhang LK, Zhu XY, Li YT, Shi HQ, Oger P, Yang ZH. Biochemical characterization of a thermostable endonuclease V from the hyperthermophilic euryarchaeon Thermococcus barophilus Ch5. International Journal of Biological Macromolecules, 2018, 117: 17-24. DOI:10.1016/j.ijbiomac.2018.05.155 |
| [26] | Kiyonari S, Egashira Y, Ishino S, Ishino Y. Biochemical characterization of endonuclease V from the hyperthermophilic archaeon, Pyrococcus furiosus. The Journal of Biochemistry, 2014, 155(5): 325-333. DOI:10.1093/jb/mvu010 |
| [27] | Kanugula S, Pauly GT, Moschel RC, Pegg AE. A bifunctional DNA repair protein from Ferroplasma acidarmanus exhibits O6-alkylguanine-DNA alkyltransferase and endonuclease V activities. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(10): 3617-3622. DOI:10.1073/pnas.0408719102 |
| [28] | Grogan DW, Carver GT, Drake JW. Genetic fidelity under harsh conditions: analysis of spontaneous mutation in the thermoacidophilic archaeon Sulfolobus acidocaldarius. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(14): 7928-7933. DOI:10.1073/pnas.141113098 |
| [29] | Chen LM, Brügger K, Skovgaard M, Redder P, She QX, Torarinsson E, Greve B, Awayez M, Zibat A, Klenk HP, Garrett RA. The genome of Sulfolobus acidocaldarius, a model organism of the Crenarchaeota. Journal of Bacteriology, 2005, 187(14): 4992-4999. DOI:10.1128/JB.187.14.4992-4999.2005 |
| [30] | Wolferen M, Ajon M, Driessen AJM, Albers SV. How hyperthermophiles adapt to change their lives: DNA exchange in extreme conditions. Extremophiles, 2013, 17(4): 545-563. DOI:10.1007/s00792-013-0552-6 |
| [31] | Yao M, Kow YW. Interaction of deoxyinosine 3'-endonuclease from Escherichia coli with DNA containing deoxyinosine. Journal of Biological Chemistry, 1995, 270(48): 28609-28616. DOI:10.1074/jbc.270.48.28609 |
| [32] | Lee CC, Yang YC, Goodman SD, Yu YH, Lin SB, Kao JT, Tsai KS, Fang WH. Endonuclease V-mediated deoxyinosine excision repair in vitro. DNA Repair, 2010, 9(10): 1073-1079. DOI:10.1016/j.dnarep.2010.07.007 |
| [33] | Su KY, Lin LI, Goodman SD, Yen RS, Wu CY, Chang WC, Yang YC, Cheng WC, Fang WH. DNA polymerase I proofreading exonuclease activity is required for endonuclease V repair pathway both in vitro and in vivo. DNA Repair, 2018, 64: 59-67. DOI:10.1016/j.dnarep.2018.02.005 |
| [34] | Shiraishi M, Ishino S, Yamagami T, Egashira Y, Kiyonari S, Ishino Y. A novel endonuclease that may be responsible for damaged DNA base repair in Pyrococcus furiosus. Nucleic Acids Research, 2015, 43(5): 2853-2863. DOI:10.1093/nar/gkv121 |
| [35] | Kiyonari S, Tahara S, Shirai T, Iwai S, Ishino S, Ishino Y. Biochemical properties and base excision repair complex formation of apurinic/apyrimidinic endonuclease from Pyrococcus furiosus. Nucleic Acids Research, 2009, 37(19): 6439-6453. DOI:10.1093/nar/gkp720 |
