刘琬洋1,2,3, 权国梅1,2,3, 刘家奇1,2,3, 连思琪1,2,3, 朱国强1,2,3


1. 扬州大学兽医学院, 江苏 扬州 225009;
2. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 教育部农业与农产品安全国际合作联合实验室, 江苏 扬州 225009;
3. 江苏省动物重要疫病和重要人兽共患病防控技术国际合作联合实验室, 江苏 扬州 225009
收稿日期:2021-01-25;修回日期:2021-03-26;网络出版日期:2021-04-06
基金项目:江苏省高级优势学科;国家自然科学基金(31873010)
*通信作者:朱国强, Tel: +86-514-87972590; Fax: +86-514-87972218; E-mail: yzgqzhu@yzu.edu.cn.
摘要:细菌通过其分泌系统将特定的效应蛋白输送到外界环境或进入靶细胞中,从而在细菌和宿主、细菌和微生物群落的相互作用中占据适应性优势。Ⅵ型分泌系统(The type Ⅵ secretion system,T6SS)是革兰氏阴性菌中广泛存在的大分子分泌装置,其结构和功能类似于可收缩的噬菌体尾针样,通过细胞间直接接触将细菌各种酶或毒素效应蛋白转运到原核和真核生物中,从而介导细菌间竞争以及对宿主的致病过程。有些效应蛋白还可通过非接触依赖的方式进入胞外环境来帮助细菌获取稀缺金属离子,并且它们对应激条件下细胞内金属稳态的维持至关重要。这篇综述总结了Ⅵ型分泌系统的结构、组装及其分泌的效应蛋白,并重点阐述了Ⅵ型分泌系统在多种金属离子转运机制中作用的研究进展,有助于理解T6SS在细菌间相互作用和细菌感染过程中发挥的重要作用。
关键词:Ⅵ型分泌系统效应蛋白细菌间竞争致病性金属转运
Advances of the Gram-negative bacterial type Ⅵ secretion system and its function for metal ion acquisition
Wanyang Liu1,2,3, Guomei Quan1,2,3, Jiaqi Liu1,2,3, Siqi Lian1,2,3, Guoqiang Zhu1,2,3


1. College of Veterinary Medicine, Yangzhou University, Yangzhou 225009, Jiangsu Province, China;
2. Important Disease Animal and Zoonosis Prevention and Control Collaborative Innovation Center of Jiangsu Province, Joint International Research Laboratory of Agriculture and Agri-Product Safety of Ministry of Education, Yangzhou 225009, Jiangsu Province, China;
3. Joint International Research Laboratory of Important Disease Animal and Zoonosis Prevention and Control Technology of Jiangsu Province, Yangzhou 225009, Jiangsu Province, China
Received: 25 January 2021; Revised: 26 March 2021; Published online: 6 April 2021
*Corresponding author: Guoqiang Zhu, Tel: +86-514-87972590; Fax: +86-514-87972218; E-mail: yzgqzhu@yzu.edu.cn.
Foundation item: Supported by the University Superior Disciplines of Jiangsu Province and by the National Natural Science Foundation of China (31873010)
Abstract: Bacterial secretion systems can deliver specific effector molecular to outer environment or directly into target cells, resulting in the adaptive advantage from interaction between bacteria and host or bacteria in microbial communities. The type Ⅵ secretion system (T6SS) is a macromolecular secretory apparatus which is functionally and structurally analogous to the needle-like contractile tail of bacteriophages, wide-spreading in Gram-negative bacteria. It can translocate diverse enzyme and toxins of bacteria into eukaryotic or prokaryotic target cells in a contact-dependent manner. After delivery, the effector proteins can make an impact on both interbacterial competition and pathogenicity. In addition, some effectors can also enter the extracellular milieu in a non-contact dependent manner to help bacteria obtain scarce metal ions, which is essential for the maintenance of intracellular metal homeostasis under stress conditions. In this review, we summarize the advances in understanding the relevant aspects from the structure and assembly to the function of T6SS. We also focus on the broad area of T6SS effector and its mechanism of metal ion translocation, which contributes to our comprehension of the crucial role of T6SS in the microbial competition and host infection.
Keywords: type Ⅵ secretion systemeffector proteinsinterbacterial competitionpathogenicitymetal ion acquisition
在生存和适应环境的过程中,细菌会有效地利用一切资源来保护自身免受外界不良环境影响或机体免疫系统攻击。一方面细菌彼此间会通过合作如交换营养和资源以促进自身生存;另一方面细菌会进化出多种机制以增强其对宿主的侵袭定植能力并引起疾病,这个过程需要蛋白分泌系统的参与,分泌系统负责将胞内物质运输到胞外,对细菌的生长繁殖具有重要作用。目前在细菌中发现了9种不同类型的分泌系统,分别命名为Ⅰ型分泌系统(type Ⅰ secretion system,T1SS)至Ⅸ型分泌系统(type Ⅸ secretion system,T9SS)[1]。
2006年Pukatzki等首先在霍乱弧菌中发现了T6SS[2],随后铜绿假单胞菌、伯克霍尔德氏菌、嗜水气单胞菌等菌株也陆续报道了T6SS的存在[3],如今T6SS已在超过25%的革兰氏阴性菌中得到证实[4]。与T1SS、T3SS和T4SS相似,T6SS也属于双膜镶嵌分泌系统,装置横跨细菌细胞内膜-周质-外膜,能够一步将效应蛋白分泌至细胞外或者直接转运至原核/真核细胞内。这些效应蛋白通常缺乏N-端信号肽序列,在细胞膜之间直接接触时通过特定的通道被转运出去,进而发挥影响细菌或感染宿主的作用,这个过程需要消耗能量。其余5种分泌系统T2SS、T5SS、T7SS、T8SS和T9SS都为单膜镶嵌分泌系统,其效应蛋白含有N-端信号肽序列,依赖普通分泌途径(Sec)或双精氨酸途径(Tat)穿过细胞质膜,以两步法被分泌至细胞外[5]。Ⅵ型分泌系统作为一种重要的蛋白分泌系统,在细菌间竞争和对宿主的致病性中都发挥着重要作用,此外也参与了细菌生物膜的形成、耐药基因的水平转移和金属离子的摄取。本综述将对T6SS的结构组装、效应蛋白和防御机制等方面进行简单介绍,并且重点阐述T6SS参与金属离子转运机制的研究进展。
1 Ⅵ型分泌系统的结构与组装 T6SS广泛分布于革兰氏阴性变形杆菌中,包含12–25个组分,它在结构和功能上与T4噬菌体尾部结构高度同源[6]。T6SS的结构主要包括跨膜复合体(membrane complex,MC)、基座复合体(baseplate complex,BC)和管状结构3个部分[7]。其中跨膜复合体横跨细菌细胞内膜和外膜,由TssJ-TssM-TssL组成,既可作为基座的停靠站,又是效应蛋白转运的通道[8]。基座复合体由TssE-TssF-TssG-TssK组成,它是T6SS鞘管的组装平台并通过构象改变触发外鞘收缩[4]。管状结构的相关组件包括Hcp内管、TssB-TssC外鞘和位于鞘管顶端的VgrG-PAAR (Valine-glycine repeat protein G-proline-alanine-alanine-arginine)针尖复合体[6],它们不仅是T6SS的重要组成成分,还可作为效应蛋白的转运载体或伴侣蛋白辅助运输[9]。
在T6SS组装过程中,跨膜复合体首先锚定到细胞膜上并招募基座复合体,随后Hcp六聚体不断堆叠形成内管,TssB-TssC二聚体在周围聚合形成外鞘[10],VgrG和PAAR在鞘管顶端形成穿刺结构。当T6SS延伸至对侧细胞膜时,外鞘远端的TssA与细胞膜上的TagA结合终止延伸[11]。效应蛋白被招募到Hcp-VgrG-PAAR结构的特定部位等待转运[12]。接下来外鞘收缩释放能量,推动Hcp-VgrG-PAAR复合体分泌至胞外或进入靶细胞的适当位置释放效应蛋白,随后该复合结构发生解离[13]。最后收缩状态的外鞘被AAA+ATP酶ClpV分解为TssB和TssC单体并回收,允许T6SS的下一次组装和分泌[1, 14](图 1)。
 |
| 图 1 型分泌系统的结构与组装[17] Figure 1 The structure and assembly of type Ⅵ secretion system[17]. |
| 图选项 |
2 Ⅵ型分泌系统的效应蛋白 T6SS具有介导细菌间竞争、增强对宿主的致病性、提高环境适应性表型和介导金属离子摄取等多种功能[15],T6SS功能的多样性取决于其分泌的效应蛋白。根据结构可将效应蛋白分为携带延伸功能域的结构蛋白和非结构性分泌蛋白,前者可与Hcp-VgrG-PAAR的某个组分共价结合,后者则与这些组分非共价连接[16]。效应蛋白既可靶向原核细胞的保守结构,如细胞壁、核酸和细胞膜,又可靶向真核细胞和一些特定的细胞分子,有些效应蛋白还可靶向胞外环境以吸收金属离子[17],如表 1所示。
表 1. Ⅵ型分泌系统效应蛋白及功能 Table 1. The functions for the effector proteins of type Ⅵ secretion system
| Target | Effector | Organism | Effector activity | Function | Reference |
| Cell wall | Tse1 | Pseudomonas aeruginosa | Peptidoglycan amidase | Peptidoglycan lysis | [18] |
| Tse3 | Pseudomonas aeruginosa | Peptidoglycan glycoside hydrolase | |||
| Ssp1/2 | Serratia marcescens | Peptidoglycan amidase | [29] | ||
| Tlde1 | Salmonella enteritidis | L, D-carboxypeptidase, L, D-transpeptidase | Impair synthesis of peptidoglycan | [20] | |
| Nucleic acid | Tse2 | Pseudomonas aeruginosa | RNase | Degrade RNA, | [26] |
| Tde | Agrobacterium tumefaciens | DNase | Cause DNA damage, growth inhibition | [22] | |
| PoNe | Vibrio Parahemolyticus | DNase | [30] | ||
| Membrane | Tle1 | Pseudomonas aeruginosa | Phospholipase | Hydrolyze phosphati-dylethanolamine | [24] |
| Tle5 | Pseudomonas aeruginosa | Phospholipase D enzymes | |||
| VasX | Vibrio cholerae | Pore-forming | Ion-selective pores | [26] | |
| Eukaryotic cell | VgrG1 | Vibrio cholerae | Actin cross-linking domain | Prevent cell cytoskeleton rearrangements, Inhibit phagocytosis | [28] |
| VgrG1 | Aeromonas hydrophila | ADP-ribosyltransferase domain | Modifies host actin, induces apoptosis | [9] | |
| VgrG5 | Burkholderia pseudomallei | Cell-fusion domain | Induce multinucleated giant cell | [31] |
表选项
2.1 靶向细胞壁的效应蛋白 细胞壁是细菌细胞的基本结构,在维持渗透压和细胞形态方面具有重要作用,一旦细胞壁屏障被破坏,则细胞生存受威胁甚至死亡,因此细胞壁是抗菌效应蛋白的重要靶标[1]。效应蛋白对细菌细胞壁的破坏主要是通过降解肽聚糖实现的,但是作用位点却存在差异。例如铜绿假单胞菌的Tse1和Tse3是最早被鉴定出水解肽聚糖的效应蛋白[18],但是Tse1具有酰胺酶活性,通过降解肽聚糖五肽交联桥的肽键而裂解细胞壁;而Tse3具有糖苷水解酶活性,通过水解肽聚糖多糖主链的β-1, 4糖苷键而使细胞壁出现孔洞甚至解体,进而杀死细菌[19]。此外效应蛋白也可通过干扰肽聚糖的合成来破坏细胞壁。例如肠炎沙门菌的Tlde1具有L, D-转肽酶和L, D羧肽酶双重活性,通过裂解并修饰肽聚糖前体来降低其可获得性,从而干扰细胞壁的合成并达到杀菌目的[20]。
2.2 靶向核酸的效应蛋白 靶向核酸的效应蛋白实质上发挥核酸酶活性,包括核糖核酸酶RNase和脱氧核糖核酸酶DNase,根据DNAse的作用部位又可分为限制性内切酶和核酸外切酶。这些效应蛋白通过降解RNA分子或者切割特定核苷酸序列上的磷酸二酯键来水解DNA,从而导致细菌生长抑制甚至死亡[1]。例如铜绿假单胞菌的Tse2蛋白是一种RNase,能够降解靶细胞mRNA并干扰基因表达,从而抑制细菌生长[21]。根瘤农杆菌的Tde1和Tde2蛋白为双指核酸酶内切酶(His-Me finger endonucleases),可在靶细胞中诱导SOS反应和靶细胞DNA降解, 从而导致细菌生长停滞并最终死亡[22]。粘质沙雷氏菌Rhs蛋白的C-末端区域编码DNase,利用其N-末端PAAR结构域与VgrG1b结合转运至靶细胞内,能够降解靶细胞DNA,中断复制进而抑制细菌增殖[23]。
2.3 靶向细胞膜的效应蛋白 细胞膜也是细胞的基本结构,它以磷脂双分子层作为基本支架,在维持内环境稳态、调节和控制物质进出细胞、分泌与运输蛋白质方面发挥着重要作用,因此细胞膜也是抗菌效应蛋白的重要靶标。一旦细胞膜脂质被降解,则细胞内外渗透压失衡并且细胞损伤。Ⅵ型脂肪酶(磷脂酶)就是典型的靶向细胞膜的效应蛋白,它包括Tle1–5五个蛋白家族,通过水解细胞膜主要脂质成分磷脂酰乙醇胺来破坏细胞膜,从而发挥抗菌活性[24]。除了降解膜脂外,效应蛋白还可以穿孔的方式破坏细胞膜。例如致孔毒素(pore-forming toxins)通过插入细胞内膜,导致内膜去极化并在细胞膜表面形成离子选择性孔隙,从而改变细胞内外渗透压并最终导致细菌死亡[25],例如霍乱弧菌的VasX蛋白具有C-端colicin结构域,能够在内膜表面形成孔道并损伤膜电位,从而损害细菌细胞[26]。
2.4 靶向特定细胞分子的效应蛋白 除了靶向细胞壁、细胞膜等细菌保守结构外,效应蛋白还可以作用于特定的细胞分子,影响细胞代谢从而发挥毒性作用。例如铜绿假单胞菌的Tse6蛋白可将靶细胞NAD(P)+降解为烟酰胺和ADP-核糖,从而抑制细胞呼吸和合成代谢[25]。蛋白沙雷氏菌的Tre1蛋白是一种腺苷二磷酸转移酶,通过使精氨酸残基核糖化而阻碍细菌微管样蛋白FtsZ的聚合,抑制细胞分裂并导致死亡[22]。铜绿假单胞菌的Tas1蛋白是一种腺苷酸焦磷酸激酶,在营养胁迫条件下使靶细胞(p)ppApp [adenine 5'triphosphate-3'diphosphate and adenine 3', 5'-bis(diphosphate)]快速积累并耗尽ADP和ATP,从而导致细胞内能量失衡以及细胞基本代谢途径的失调[27]。
2.5 抗真核细胞效应蛋白 T6SS的抗真核细胞效应主要包括破坏肌动蛋白细胞骨架、促进细菌的侵袭和定殖、免疫逃逸、激活炎性应答、抗阿米巴和抗真菌等[28]。目前已知的抗真核细胞效应蛋白分为与效应结构域融合的VgrG蛋白和单独的分泌蛋白[26]。例如霍乱弧菌VgrG1蛋白具有肌动蛋白交联结构域,能够阻止宿主肌动蛋白细胞骨架重排、抑制吞噬并刺激宿主免疫应答[28]。嗜水气单胞菌的VgrG1蛋白具有ADP-核糖基转移酶活性,能够抑制宿主肌动蛋白聚合,激活caspase-9并最终导致细胞凋亡[9]。此外粘质链霉菌的Tfe1和Tfe2蛋白可作用于真菌细胞,前者引起细胞质膜去极化并最终导致真菌死亡;后者诱发饥饿反应,使真菌细胞内环境紊乱并导致细胞自噬的发生[17]。总之,靶向真核细胞的效应蛋白通过介导细菌与真核宿主之间的相互作用而引发感染或导致疾病。
3 Ⅵ型分泌系统的防御机制 细菌对T6SS最有效的防御机制是同源免疫蛋白的保护作用。在T6SS基因簇中编码效应蛋白的基因附近通常具有编码同源免疫蛋白的基因,二者可形成同源免疫对(effector-immunity)。当效应蛋白被转运至靶细胞后,同源免疫蛋白利用蛋白质间相互作用与效应蛋白的活性位点结合消除毒素效应。需要强调的是这种特异性保护作用仅针对菌株自身及其亲缘菌株[29]。除了免疫蛋白外,细菌还具有其他机制抵御T6SS的攻击,包括物理屏障、遗传解毒剂和保护性应激[32]。物理屏障是指细菌产生的抑制细胞间紧密接触的物理结构,例如胞外多糖、生物膜基质和死亡细胞“尸体屏障”(corpse barrier)[32]。遗传解毒剂是指由细菌水平基因转移获得的“孤儿”免疫基因,它在肠道微生物群落中比较常见[26]。保护性应激是指在T6SS介导的竞争环境中,靶细菌及其邻近细菌发生应激反应以促进自身生存,即细菌的竞争感知(competition sensing)现象[33],例如铜绿假单胞菌在受到霍乱弧菌TseL蛋白攻击时会激活H1-T6SS (Hcp分泌岛Ⅰ编码的T6SS[34]),从而反过来对霍乱弧菌进行攻击[17]。
4 Ⅵ型分泌系统参与金属离子转运的机制 金属离子是细菌生长发育所必需的微量元素,在多种生命活动过程中都发挥着重要作用,例如充当蛋白质或酶的辅因子,参与糖类、脂质等的合成代谢过程。然而过量的金属离子会催化Fenton反应生成剧毒的羟基自由基,损害细胞的DNA、蛋白质和脂肪等生物大分子,从而对细菌造成毒害作用[35],因此细胞内金属离子的浓度受到严格调控。在对宿主进行侵袭定殖的过程中,细菌进化出有效的金属摄取和调控机制以控制金属离子的吸收和外排,从而维持金属离子的稳态,T6SS就是其中重要的一种[36]。2012年Sana等报道铜绿假单胞菌的铁摄取调控因子(ferric uptake regulator,Fur)能够感应环境中铁离子浓度并负调控H2-T6SS (Hcp分泌岛Ⅱ T6SS)的表达[37],初步提示T6SS与金属离子之间可能存在相关关系。2015年Wang等发现假结核耶尔森氏菌的T6SS4 (假结核耶尔森氏菌基因组编码的第4个T6SS基因簇)能够摄取细胞外环境中的锌离子[38],首次揭示了T6SS在金属离子转运过程中的重要作用。
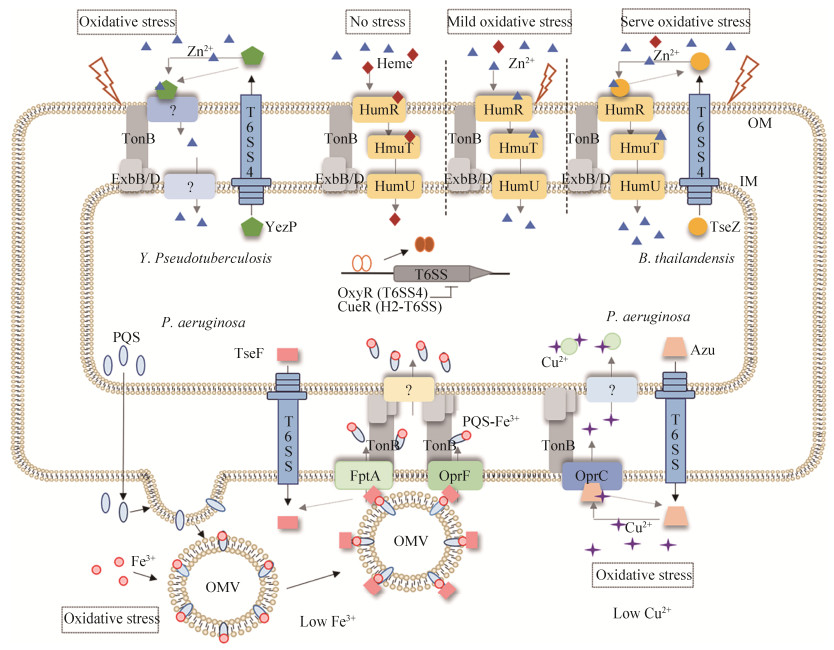
目前研究已经发现T6SS可以参与锌离子、铁离子和铜离子的转运,三者的转运机制相似,基本过程都是由T6SS向细胞外分泌特定的金属结合蛋白,然后在不同类型外膜蛋白的协助下以非接触依赖的方式将环境中的金属离子转运至胞内。不同点在于T6SS分泌金属结合蛋白对胞外金属离子的结合方式不同。金属结合蛋白对铜离子和锌离子采取直接结合的方式,而对铁离子的结合需要外膜囊泡作为铁离子载体参与其中。载有不同金属离子的T6SS金属结合蛋白将离子运送至外膜蛋白,从而在外膜蛋白的协助下将环境中的稀缺金属离子转运进细胞内以满足细菌的营养需要[39],并在不直接对其他细菌造成伤害的情况下通过竞争必需营养来占据生长优势[40]。T6SS介导的金属离子转运机制如图 2所示。
 |
| 图 2 Ⅵ型分泌系统金属离子转运机制[40, 45, 51] Figure 2 The mechanism of metal ion translocation in type Ⅵ secretion system[40, 45, 51]. |
| 图选项 |
4.1 T6SS参与锌离子的转运 锌是生物体内仅次于铁的第二丰富的过渡金属元素,对于维持蛋白质结构和各种生物大分子的稳定性具有重要作用,它对细菌的生长发育、抗氧化、感染和免疫都是极其重要的。共生生物适应宿主的能力或致病菌对宿主的致病程度都取决于它们对宿主体内锌的最大利用度,说明锌对肠道有益菌群以及感染宿主的病原菌的生存定植均非常重要[41]。但是过量的锌也会对细菌表现出毒性作用,如阻滞细菌的生长和代谢等[42]。正常情况下,细菌通过高亲和力的ZnuABC锌转运系统(一组对锌具有高度特异性的ABC型金属转运蛋白)或低亲和力的ZRT/IRT相关蛋白(ZIP)家族转运蛋白ZupT从外界环境或宿主体内摄取锌离子以供自身利用[38]。然而在环境胁迫状态下,转录调节因子响应应激信号并激活细菌T6SS的表达以及金属结合蛋白的分泌,促使细菌通过T6SS摄取环境中的锌离子[43]。T6SS向细胞外分泌金属结合蛋白与环境中的锌离子结合,然后在TonB依赖性外膜转运蛋白的作用下将锌离子转运至细胞内,从而提高细菌的抗胁迫能力,进而增加细菌在氧化应激或营养缺乏环境中的生长优势[36]。T6SS的表达受氧化应激感应调节蛋白OxyR和环境中锌离子浓度的严格调控。T6SS启动子区域含有OxyR结合位点,通过与OxyR结合抑制转录。但是氧化应激条件下OxyR构象改变不再与T6SS的启动子区域结合,从而负调控T6SS的表达[40]。另外,锌限制环境中锌摄取调节因子Zur通过感应锌离子浓度变化激活T6SS的表达,而锌富集环境则抑制T6SS的表达[9]。下面将以假结核耶尔森菌和泰国伯克霍尔德菌为例对T6SS参与锌离子转运的机制进行详细阐述。
假结核耶尔森菌的T6SS4[44]是首个被发现具有金属吸收功能的非接触依赖性T6SS,其作用机制比较典型[40]。在假结核耶尔森菌感染宿主的过程中,宿主为了抑制病原菌的生长进化出一种营养免疫(nutrition immunity)策略,限制病原菌对宿主体内锌离子的获取和利用从而发挥抑菌作用。因此病原菌也进化出相应的机制有效对抗宿主营养免疫,通常是利用经典锌转运系统ZnuABC将锌离子运输至细菌细胞内以达到细菌的生长要求。但是在氧化应激条件下,ZnuABC转运系统的功能受抑制以至于不能满足细菌细胞对锌离子的需求。此时OxyR响应氧化应激信号并发生构象改变,不再与假结核耶尔森氏菌T6SS4启动子区域的OxyR结合位点结合,解除对T6SS4的转录抑制并激活其表达[40]。随后T6SS4向细胞外分泌锌离子结合蛋白YezP (Yersinia extracellular zinc-binding protein),能够结合环境中的锌离子并在TonB依赖性外膜转运蛋白的协助下将锌离子输送至细胞内,缓解细菌细胞内的缺锌状态,从而提高细菌在恶劣环境中或与宿主互作期间的生存能力[38]。总之由T6SS4介导的锌离子转运机制与假结核耶尔森菌的抗胁迫能力和对真核宿主毒力密切相关。
与假结核耶尔森菌相比,泰国伯克霍尔德菌的T6SS参与锌离子摄取和转运的机制更加复杂。该机制由T6SS分泌的锌结合效应蛋白TseZ和TonB依赖性外膜血红素转运蛋白HmuR组成,二者相互作用共同完成锌离子的跨外膜主动转运。HmuR是一种受氧化还原信号调节的双功能转运蛋白,正常情况下运输血红素铁,但是在氧化应激条件下通过形成分子内二硫键切换底物特异性,从而成为锌离子的转运载体[45]。因此,HmuR可作为感应细胞外氧化应激信号的“氧化还原传感器”,确保细胞对外界应激信号作出即时反应。在轻微的氧化应激条件下,这种“微调”机制就可以满足细菌对锌离子的需求。但是当细菌面对严重的氧化应激挑战时,细菌细胞内ROS水平显著增高,OxyR激活T6SS4的表达,促使T6SS4向细胞外分泌锌结合效应蛋白TseZ,吸收环境中的锌离子[46]。随后TseZ在TonB依赖性外膜转运蛋白HmuR的作用下将锌离子转运到细胞内,这个过程受Zur的负调控[47]。在细胞质中锌离子作为抗氧化酶的辅助因子或者竞争性抑制芬顿反应的发生,从而对抗氧化应激[40]。总之,由T6SS-TseZ-HmuR介导的锌离子转运机制通过竞争必需养分增强细菌在恶劣环境中的适应性,同时对于非接触性细菌间竞争和细菌毒力也非常重要。另外,Si等发现泰国伯克霍尔德菌的T6SS4还可通过类似的机制转运锰离子。通过分泌锰结合效应蛋白TseM结合细胞外的锰离子,然后与TonB依赖性外膜转运蛋白MnoT直接相互作用运输锰离子,从而满足氧化应激条件下细胞对锰离子增长的需求[48]。
4.2 T6SS参与铁离子的转运 铁是几乎所有活细胞所必需的微量营养素,对于生物的多种生命活动过程都至关重要,通过充当许多蛋白和酶的重要辅助因子,广泛参与电子转移、DNA合成等过程。在细菌感染期间,无论是入侵的病原体还是宿主细胞都需要铁来维持其基本功能、新陈代谢和细胞增殖[42]。病原菌入侵宿主后,必须从宿主体内获取铁离子才能满足正常的生长和代谢需求。当细胞内铁离子浓度低于10–6 mol/L时称为铁饥饿现象(iron-starvationa)[49],此时不利于细菌的生长。为了抵抗恶劣环境,细菌进化出多种机制来获取铁离子,T6SS就在其中扮演着重要的角色。具体机制为:在环境胁迫条件下,T6SS被激活并向细胞外分泌效应蛋白,吸收外膜囊泡(outer membrane vesicle,OMVs)中的Fe3+-铁载体复合物,然后与外膜受体蛋白结合,将Fe3+-铁载体复合物转运至细胞内[50]。在胞浆中铁离子被释放出来并被细菌利用。铁摄取机制与锌摄取机制的区别在于T6SS效应蛋白不是直接与铁离子结合,而是识别OMVs中的Fe3+-铁载体间接结合铁离子。例如在铜绿假单胞菌中,H3-T6SS分泌效应蛋白TseF,可与OMVs中的PQS-Fe3+结合[51]。PQS (Pseudomonas quinolone system)是一种群体感应信号分子,能够插入细胞外膜并诱导其弯曲形成OMVs,随后PQS迅速结合胞外铁离子形成紧密连接的PQS-Fe3+复合物[41]。最后TseF通过与铁载体受体蛋白FptA和孔蛋白OprF特异性相互作用而将PQS-Fe3+转运至细胞内,从而完成对铁离子的摄取。在这个过程中,TseF作为连接PQS信号分子和FptA/OprF表面受体蛋白的桥梁,以间接的作用参与铁离子的主动转运过程,它对铜绿假单胞菌的毒力具有重要意义,并且能够提高在恶劣环境中的竞争能力[50]。
4.3 T6SS参与铜离子的转运 铜是维持细菌正常生理活动所必需的一种微量金属元素,可作为多种合成代谢酶的辅助因子发挥重要作用,其中最主要的铜蛋白酶为细胞色素c氧化酶和铜超氧化物歧化酶,它们可以发挥抗氧化功能。但是细胞内铜过量蓄积会产生损伤性羟基自由基或破坏氧化呼吸链的Fe-S中心,严重时可导致细胞死亡[52]。有时铜的这种毒性作用可被宿主免疫系统利用,例如细菌感染后铜在巨噬细胞吞噬小体中大量积累,从而吞噬并杀死入侵的细菌[53]。细胞内铜的浓度受到严格控制,因此细菌进化出多种机制来维持铜的稳态平衡,其关键在于Cu2+摄取和外排的相对一致。跨内膜的P1B型ATP酶CopA是细胞内铜外排的主要通道,CopA将Cu2+从胞质转运至周质后,与跨膜的CusCAB孔道系统相互作用将多余的Cu2+转运至细胞外[54]。一般情况下Cu2+的摄取主要依靠高亲和力的铜转运蛋白Ctr[55],但是在环境胁迫条件下,T6SS对细菌摄取Cu2的过程起着重要作用。转录调节因子CueR感应环境中铜离子浓度变化并通过直接结合T6SS启动子区域来调控T6SS的表达和装配。在低铜环境中,CueR响应环境胁迫信号激活T6SS并促使T6SS向细胞外分泌效应蛋白,这些效应蛋白可以结合环境中的Cu2+,然后与TonB依赖性外膜转运蛋白相互作用将Cu2+转运至细胞内[35]。在细胞内Cu2+与特异性铜伴侣蛋白结合并转运到特定的靶蛋白,防止游离Cu2+对细胞产生毒害作用[55]。铜绿假单胞菌的H2-T6SS就是一个典型的例子[35]。当环境中Cu2+浓度较低时,为了维持细胞内铜稳态,CueR通过激活H2-T6SS的表达和装配,使铜结合蛋白Azu与运载蛋白VgrG2b一起被分泌到环境中。同时CueR激活TonB依赖性外膜转运蛋白OprC,将与Azu结合的Cu2+转运至细胞内,增加细菌对胞外Cu2+的摄取,从而提高细菌在恶劣环境中的生存能力[39]。这种由T6SS-Azu-OprC介导的铜转运机制对铜绿假单胞菌的抗菌活性和毒力至关重要,并且有利于细菌适应复杂多变的外界环境。
4.4 金属离子参与T6SS基因表达的调控 T6SS的调控机制非常复杂,不同细菌之间存在一定的差异[14],但基础机制包括群体感应(quorum sensing,QS)、氧化应激(oxidative Stress,OS)、苏氨酸磷酸化途径、双组分系统GacS/GacA和BaeSR等[56]。此外,金属离子也在细菌T6SS的表达调控中发挥着重要作用,例如Burtnick和Brett发现鼻疽伯克霍尔德菌和类鼻疽伯克霍尔德菌中T6SS-1 (cluster1 T6SS)的表达受铁离子和锌离子的负调控[57]。
Fur是最早发现的金属调节蛋白之一,它与细胞内的铁稳态有关,通过感应铁离子浓度来调节T6SS的基因表达[9]。当细胞内铁离子含量充足时,Fur可与T6SS启动子区的Fur盒结合并阻止RNA聚合酶进入,从而抑制T6SS的转录,该过程需要DNA腺嘌呤甲基转移酶参与。当铁不足时,Fur脱离Fur盒,暴露出的GATC基序发生甲基化,阻止Fur的再次结合,此时T6SS基因处于激活状态[15]。目前,Fur可结合区已被证明存在于铜绿假单胞菌的H2-T6SS、肠聚集性大肠杆菌的T6SS和迟缓爱德华菌的T6SS中[57]。与之类似,类鼻疽伯克霍尔德菌T6SS4 (cluster4,类鼻疽伯克霍尔德菌基因组编码的6个T6SS基因簇中的第4个[58])的表达受到锌结合蛋白Zur的调控[40]。Zur属于铁摄取调控因子家族成员,通常编码在锌离子摄取和利用相关基因的上游,通过感应细胞内锌离子浓度变化来调节T6SS的表达和装配,从而维持细胞内锌的动态平衡[41]。当锌离子富集且无氧化应激时,Zur可与T6SS启动子区域的Zur盒特异性结合,抑制T6SS的转录;但是当细胞外锌离子浓度降低时,锌离子不能再作为Zur的感应信号,这种抑制作用也随之解除,T6SS被激活[40]。Zur作为是否启动T6SS转录的开关,受到环境中锌离子浓度的严格调控。即低浓度锌离子诱导表达,而高浓度锌离子却抑制表达。
5 总结和展望 Ⅵ型分泌系统是革兰氏阴性菌中广泛存在的大型分泌装置,它在细菌竞争、宿主致病性以及环境适应等方面都发挥着重要作用。近些年随着冷冻电镜技术的发展,对T6SS的具体结构包括核心组件和其他相对不保守的组分有了比较清晰的认识,但是T6SS的分泌机制以及多样化效应蛋白的交付机制仍需进一步研究。T6SS效应蛋白主要包括两类:“货物”效应蛋白(cargo effectors)和“特殊化”效应蛋白(specialized effectors),它们都需要与(Hcp-)VgrG-PAAR相互作用或进行末端融合而装载到T6SS机器上。理论上讲,T6SS组件可同时装载多种不同的效应蛋白并在一次收缩事件中将它们全部分泌出去,并且一种效应蛋白也可以分别装载到不同的T6SS组件上进行转运。异源效应蛋白转运试验揭示了T6SS介导的效应蛋白转运的特异性和局限性,效应蛋白的转运并不是广泛非特异性的,它在转运过程中也需要一定的条件,包括与特定组分的结合以及组分周围可容纳的空间。那么不同的T6SS组件识别并结合某种或多种效应蛋白的依据是什么,它们如何选择特异性的效应蛋白进行转运?不同的装载事件对效应蛋白转运的效率是否构成影响?多种效应蛋白在一次分泌过程中的协调机制是怎样的?这些问题都有待探讨。效应蛋白的种类和作用靶点的多样性也使得T6SS更加吸引关注。T6SS效应蛋白家族在不同细菌中广泛存在,并且可能作用于不同的细胞靶标,同时水平基因转移和孤儿免疫基因的存在也更加丰富了效应蛋白的多样性。作用于细胞周质的效应蛋白主要发挥溶解活性,而作用于细胞质的效应蛋白则发挥更为广泛的作用。近些年通过比较基因组学和遗传筛选相结合的方法以及生物信息学分析(利用特征基因簇或保守结构域进行预测)鉴定出多样的新型T6SS效应蛋白,大大扩展了我们对T6SS的功能及其用于细菌竞争和宿主致病等的不同机制的认识。T6SS可以对抗或取代共生微生物群落,从而成功在宿主生态位上定植并夺取显著的竞争优势,进而影响微生物群落的结构组成,因此对T6SS及其效应蛋白的研究可能为治疗多种细菌混合感染提供新的线索。另外,由于T6SS效应蛋白转运功能,可以开发针对T6SS靶点的抗菌药物抑制效应蛋白的有效分泌和转运。也可通过开发T6SS的活性抑制剂降低病原菌在宿主体内健康菌群中的竞争能力从而抵抗细菌感染。近期对T6SS的金属摄取功能的研究为T6SS在细菌竞争中的相互作用提供了新的视角,细菌以非接触依赖的方式将效应蛋白直接分泌至胞外环境,吸收环境中的金属离子,从而抵抗宿主营养免疫和对抗氧化应激。这种无毒的细胞外作用允许分泌细菌与宿主防御机制共存,并可能作为抗菌药物开发的一个新的有效靶点。未来可以对T6SS进行改造,使其能够运载药物和抗体等到达特定的靶细胞或者细胞的特定部位,从而实现对疾病的精准治疗。
References
| [1] | Russell AB, Peterson SB, Mougous JD. Type Ⅵ secretion system effectors: poisons with a purpose. Nature Reviews Microbiology, 2014, 12(2): 137-148. DOI:10.1038/nrmicro3185 |
| [2] | Pukatzki S, Ma AT, Sturtevant D, Krastins B, Sarracino D, Nelson WC, Heidelberg JF, Mekalanos JJ. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(5): 1528-1533. DOI:10.1073/pnas.0510322103 |
| [3] | Bingle LE, Bailey CM, Pallen MJ. Type Ⅵ secretion: a beginner's guide. Current Opinion in Microbiology, 2008, 11(1): 3-8. DOI:10.1016/j.mib.2008.01.006 |
| [4] | Basler M, Pilhofer M, Henderson GP, Jensen GJ, Mekalanos JJ. Type Ⅵ secretion requires a dynamic contractile phage tail-like structure. Nature, 2012, 483(7388): 182-186. DOI:10.1038/nature10846 |
| [5] | Yu LZ, Liu FJ, Yan NN, Cheng X, Li YZ, Guo YZ. Progress on secretion systems and secretory products of gram-negative bacteria. Progress in Veterinary Medicine, 2017, 38(8): 80-84. (in Chinese) 余乐正, 柳凤娟, 鄢南南, 程旭, 李益洲, 郭延芝. 革兰阴性菌分泌系统及其分泌产物研究进展. 动物医学进展, 2017, 38(8): 80-84. DOI:10.3969/j.issn.1007-5038.2017.08.017 |
| [6] | Kudryashev M, Wang RYR, Brackmann M, Scherer S, Maier T, Baker D, DiMaio F, Stahlberg H, Egelman EH, Basler M. Structure of the type Ⅵ secretion system contractile sheath. Cell, 2015, 160(5): 952-962. DOI:10.1016/j.cell.2015.01.037 |
| [7] | Navarro-Garcia F, Ruiz-Perez F, Cataldi á, Larzábal M. Type Ⅵ secretion system in pathogenic Escherichia coli: structure, role in virulence, and acquisition. Frontiers in Microbiology, 2019, 10: 1965. DOI:10.3389/fmicb.2019.01965 |
| [8] | Durand E, Nguyen VS, Zoued A, Logger L, Péhau-Arnaudet G, Aschtgen MS, Spinelli S, Desmyter A, Bardiaux B, Dujeancourt A, Roussel A, Cambillau C, Cascales E, Fronzes R. Biogenesis and structure of a type Ⅵ secretion membrane core complex. Nature, 2015, 523(7562): 555-560. DOI:10.1038/nature14667 |
| [9] | Journet L, Cascales E. The type Ⅵ secretion system in Escherichia coli and related species. EcoSal Plus, 2016. DOI:10.1128/ecosalplus.ESP-0009-2015 |
| [10] | Zoued A, Durand E, Brunet YR, Spinelli S, Douzi B, Guzzo M, Flaugnatti N, Legrand P, Journet L, Fronzes R, Mignot T, Cambillau C, Cascales E. Priming and polymerization of a bacterial contractile tail structure. Nature, 2016, 531(7592): 59-63. DOI:10.1038/nature17182 |
| [11] | Shneider MM, Buth SA, Ho BT, Basler M, Mekalanos JJ, Leiman PG. PAAR-repeat proteins sharpen and diversify the type Ⅵ secretion system spike. Nature, 2013, 500(7462): 350-353. DOI:10.1038/nature12453 |
| [12] | Brunet YR, Zoued A, Boyer F, Douzi B, Cascales E. The type Ⅵ secretion TssEFGK-VgrG phage-like baseplate is recruited to the TssJLM membrane complex via multiple contacts and serves as assembly platform for tail tube/sheath polymerization. PLoS Genetics, 2015, 11(10): e1005545. DOI:10.1371/journal.pgen.1005545 |
| [13] | Leiman PG, Basler M, Ramagopal UA, Bonanno JB, Sauder JM, Pukatzki S, Burley SK, Almo SC, Mekalanos JJ. Type Ⅵ secretion apparatus and phage tail-associated protein complexes share a common evolutionary origin. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(11): 4154-4159. DOI:10.1073/pnas.0813360106 |
| [14] | Kong TX, Zhao YX, Du J, Li YJ. The type Ⅵ secretion system. Progress in Biochemistry and Biophysics, 2020, 47(12): 1273-1284. (in Chinese) 孔天翔, 赵依昕, 杜婧, 李颖杰. 细菌六型分泌系统的研究进展. 生物化学与生物物理进展, 2020, 47(12): 1273-1284. |
| [15] | Yuan SQ, Li Q, Mao XH. Advances in regulation and function of the bacterial type Ⅵ secretion system. Microbiology China, 2021, 48(2): 620-626. (in Chinese) 袁思琪, 李倩, 毛旭虎. 细菌Ⅵ型分泌系统的调控与功能研究进展. 微生物学通报, 2021, 48(2): 620-626. |
| [16] | Liang XY, Xu P, Dong T. Effector recognition and translocation by type Ⅵ protein secretion system in Gram-negative bacteria. Microbiology China, 2019, 46(2): 339-344. (in Chinese) 梁小夜, 许平, 董涛. 从效应蛋白视角看革兰氏阴性细菌Ⅵ型蛋白分泌系统底物转运机理. 微生物学通报, 2019, 46(2): 339-344. |
| [17] | Kamal F, Liang XY, Manera K, Pei TT, Kim H, Lam LG, Pun A, Hersch SJ, Dong TG. Differential cellular response to translocated toxic effectors and physical penetration by the type Ⅵ secretion system. Cell Reports, 2020, 31(11): 107766. DOI:10.1016/j.celrep.2020.107766 |
| [18] | Hood RD, Singh P, Hsu F, Güvener T, Carl MA, Trinidad RRS, Silverman JM, Ohlson BB, Hicks KG, Plemel RL, Li M, Schwarz S, Wang WY, Merz AJ, Goodlett DR, Mougous JD. A type Ⅵ secretion system of Pseudomonas aeruginosa targets a toxin to bacteria. Cell Host & Microbe, 2010, 7(1): 25-37. |
| [19] | Russell AB, Hood RD, Bui NK, LeRoux M, Vollmer W, Mougous JD. Type Ⅵ secretion delivers bacteriolytic effectors to target cells. Nature, 2011, 475(7356): 343-347. DOI:10.1038/nature10244 |
| [20] | Sibinelli-Sousa S, Hespanhol JT, Nicastro GG, Matsuyama BY, Mesnage S, Patel A, de Souza RF, Guzzo CR, Bayer-Santos E. A family of T6SS antibacterial effectors related to l, d-transpeptidases targets the peptidoglycan. Cell Reports, 2020, 31(12): 107813. DOI:10.1016/j.celrep.2020.107813 |
| [21] | Li M, Le Trong I, Carl MA, Larson ET, Chou S, de Leon JA, Dove SL, Stenkamp RE, Mougous JD. Structural basis for type Ⅵ secretion effector recognition by a cognate immunity protein. PLoS Pathogens, 2012, 8(4): e1002613.. DOI:10.1371/journal.ppat.1002613 |
| [22] | Jur?nas D, Journet L. Activity, delivery, and diversity of Type Ⅵ secretion effectors. Molecular Microbiology, 2020: span. |
| [23] | Ho BT, Dong TG, Mekalanos JJ. A view to a kill: the bacterial type Ⅵ secretion system. Cell Host & Microbe, 2014, 15(1): 9-21. |
| [24] | Russell AB, LeRoux M, Hathazi K, Agnello DM, Ishikawa T, Wiggins PA, Wai SN, Mougous JD. Diverse type Ⅵ secretion phospholipases are functionally plastic antibacterial effectors. Nature, 2013, 496(7446): 508-512. DOI:10.1038/nature12074 |
| [25] | Hernandez RE, Gallegos-Monterrosa R, Coulthurst SJ. Type Ⅵ secretion system effector proteins: Effective weapons for bacterial competitiveness. Cellular Microbiology, 2020, 22(9): e13241. |
| [26] | Alcoforado Diniz J, Liu YC, Coulthurst SJ. Molecular weaponry: diverse effectors delivered by the Type Ⅵ secretion system. Cellular Microbiology, 2015, 17(12): 1742-1751. DOI:10.1111/cmi.12532 |
| [27] | Ahmad S, Wang BY, Walker MD, Tran HKR, Stogios PJ, Savchenko A, Grant RA, McArthur AG, Laub MT, Whitney JC. An interbacterial toxin inhibits target cell growth by synthesizing (p)ppApp. Nature, 2019, 575(7784): 674-678. DOI:10.1038/s41586-019-1735-9 |
| [28] | Pukatzki S, Ma AT, Revel AT, Sturtevant D, Mekalanos JJ. Type Ⅵ secretion system translocates a phage tail spike-like protein into target cells where it cross-links actin. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(39): 15508-15513. DOI:10.1073/pnas.0706532104 |
| [29] | Russell AB, Singh P, Brittnacher M, Bui NK, Hood RD, Carl MA, Agnello DM, Schwarz S, Goodlett DR, Vollmer W, Mougous JD. A widespread bacterial type Ⅵ secretion effector superfamily identified using a heuristic approach. Cell Host & Microbe, 2012, 11(5): 538-549. |
| [30] | Jana B, Fridman CM, Bosis E, Salomon D. A modular effector with a DNase domain and a marker for T6SS substrates. Nature Communications, 2019, 10: 3595. DOI:10.1038/s41467-019-11546-6 |
| [31] | Burtnick MN, Brett PJ, Harding SV, Ngugi SA, Ribot WJ, Chantratita N, Scorpio A, Milne TS, Dean RE, Fritz DL, Peacock SJ, Prior JL, Atkins TP, Deshazer D. The cluster 1 type Ⅵ secretion system is a major virulence determinant in Burkholderia pseudomallei. Infection and Immunity, 2011, 79(4): 1512-1525. DOI:10.1128/IAI.01218-10 |
| [32] | Robitaille S, Trus E, Ross BD. Bacterial defense against the type Ⅵ secretion system. Trends in Microbiology, 2021, 29(3): 187-190. DOI:10.1016/j.tim.2020.09.001 |
| [33] | Cornforth DM, Foster KR. Competition sensing: the social side of bacterial stress responses. Nature Reviews Microbiology, 2013, 11(4): 285-293. DOI:10.1038/nrmicro2977 |
| [34] | Mougous JD, Cuff ME, Raunser S, Shen A, Zhou M, Gifford CA, Goodman AL, Joachimiak G, Ordo?ez CL, Lory S, Walz T, Joachimiak A, Mekalanos JJ. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus. Science, 2006, 312(5779): 1526-1530. DOI:10.1126/science.1128393 |
| [35] | 韩玉莹. 铜绿假单胞菌Ⅵ型分泌系统(T6SS)介导铜离子转运的分子机制研究. 西北大学博士学位论文, 2020. |
| [36] | Coulthurst S. The Type Ⅵ secretion system: a versatile bacterial weapon. Microbiology: Reading, England, 2019, 165(5): 503-515. DOI:10.1099/mic.0.000789 |
| [37] | Sana TG, Hachani A, Bucior I, Soscia C, Garvis S, Termine E, Engel J, Filloux A, Bleves S. The second type Ⅵ secretion system of Pseudomonas aeruginosa strain PAO1 is regulated by quorum sensing and fur and modulates internalization in epithelial cells. Journal of Biological Chemistry, 2012, 287(32): 27095-27105. DOI:10.1074/jbc.M112.376368 |
| [38] | Wang TT, Si MR, Song YH, Zhu WH, Gao F, Wang Y, Zhang L, Zhang WP, Wei GH, Luo ZQ, Shen XH. Type Ⅵ secretion system transports Zn2+ to combat multiple stresses and host immunity. PLoS Pathogens, 2015, 11(7): e1005020. DOI:10.1371/journal.ppat.1005020 |
| [39] | Han YY, Wang TT, Chen GK, Pu QQ, Liu Q, Zhang YN, Xu LH, Wu M, Liang HH. A Pseudomonas aeruginosa type Ⅵ secretion system regulated by CueR facilitates copper acquisition. PLoS Pathogens, 2019, 15(12): e1008198. DOI:10.1371/journal.ppat.1008198 |
| [40] | DeShazer D. A novel contact-independent T6SS that maintains redox homeostasis via Zn2+ and Mn2+ acquisition is conserved in the Burkholderia pseudomallei complex. Microbiological Research, 2019, 226: 48-54. DOI:10.1016/j.micres.2019.05.007 |
| [41] | Gilston BA, Wang SN, Marcus MD, Canalizo-Hernández MA, Swindell EP, Xue Y, Mondragón A, O'Halloran TV. Structural and mechanistic basis of zinc regulation across the E. coli Zur regulon. PLoS Biology, 2012, 12(11): e1001987. |
| [42] | Nairz M, Weiss G. Iron in infection and immunity. Molecular Aspects of Medicine, 2020, 75: 100864. DOI:10.1016/j.mam.2020.100864 |
| [43] | 高奋. 假结核耶尔森氏菌中Zur差异调控T6SS4和ZnuABC的研究. 西北农林科技大学硕士学位论文, 2016. |
| [44] | Zhang WP, Xu SJ, Li J, Shen XH, Wang Y, Yuan ZM. Modulation of a thermoregulated type Ⅵ secretion system by AHL-dependent Quorum Sensing in Yersinia pseudotuberculosis. Archives of Microbiology, 2011, 193(5): 351-363. |
| [45] | Si MR, Wang Y, Zhang B, Zhao C, Kang YW, Bai HN, Wei DW, Zhu LF, Zhang L, Dong TG, Shen XH. The type Ⅵ secretion system engages a redox-regulated dual-functional heme transporter for zinc acquisition. Cell Reports, 2017, 20(4): 949-959. DOI:10.1016/j.celrep.2017.06.081 |
| [46] | Chiang SM, Schellhorn HE. Regulators of oxidative stress response genes in Escherichia coli and their functional conservation in bacteria. Archives of Biochemistry and Biophysics, 2012, 525(2): 161-169. DOI:10.1016/j.abb.2012.02.007 |
| [47] | Mazzon RR, Braz VS, da Silva Neto JF, do Valle Marques M. Analysis of the Caulobacter crescentus Zur regulon reveals novel insights in zinc acquisition by TonB-dependent outer membrane proteins. BMC Genomics, 2014, 15(1): 1-14. DOI:10.1186/1471-2164-15-1 |
| [48] | Si MR, Zhao C, Burkinshaw B, Zhang B, Wei DW, Wang Y, Dong TG, Shen XH. Manganese scavenging and oxidative stress response mediated by type Ⅵ secretion system in Burkholderia thailandensis. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(11): E2233-E2242. DOI:10.1073/pnas.1614902114 |
| [49] | Zhang PY, Liu MF, Cheng AC. Bacterial iron uptake system and anti-infectious immunity of the host. Life Science Research, 2016, 20(1): 82-88. (in Chinese) 张鹏云, 刘马峰, 程安春. 细菌铁离子利用系统与宿主抗感染免疫. 生命科学研究, 2016, 20(1): 82-88. |
| [50] | Wang RY, Zhang J, Wang B, Hou YW, Wu BY, Hu HZ. Research progress in the type Ⅵ secretion system of Pseudomonas aeruginosa and mechanism of its participation in transport of iron ions. Life Science Research, 2020, 24(5): 404-409, 414. (in Chinese) 王瑞营, 张娟, 王碧, 侯亚文, 吴斌艳, 扈会整. 铜绿假单胞菌中Ⅵ型分泌系统及其参与铁离子转运机制的研究进展. 生命科学研究, 2020, 24(5): 404-409, 414. |
| [51] | Lin JS, Zhang WP, Cheng JL, Yang X, Zhu KX, Wang Y, Wei GH, Qian PY, Luo ZQ, Shen XH. A Pseudomonas T6SS effector recruits PQS-containing outer membrane vesicles for iron acquisition. Nature Communications, 2017, 8: 14888. DOI:10.1038/ncomms14888 |
| [52] | Williams CL, Neu HM, Gilbreath JJ, Michel SLJ, Zurawski DV, Merrell DS. Copper resistance of the emerging pathogen Acinetobacter baumannii. Applied and Environmental Microbiology, 2016, 82(20): 6174-6188. DOI:10.1128/AEM.01813-16 |
| [53] | Shi XS, Darwin KH. Copper homeostasis in Mycobacterium tuberculosis. Metallomics, 2015, 7(6): 929-934. DOI:10.1039/C4MT00305E |
| [54] | Sheldon JR, Skaar EP. Metals as phagocyte antimicrobial effectors. Current Opinion in Immunology, 2019, 60: 1-9. DOI:10.1016/j.coi.2019.04.002 |
| [55] | Ai WL, Cheng N, Han YZ. Molecular mechanisms of copper homeostasis in the cells. Anhui Medical and Pharmaceutical Journal, 2013, 17(5): 724-726. (in Chinese) 艾文龙, 程楠, 韩咏竹. 细胞内铜稳态的分子调控机制研究进展. 安徽医药, 2013, 17(5): 724-726. DOI:10.3969/j.issn.1009-6469.2013.05.002 |
| [56] | Hu LL, Wang CC, Lu WJ, Lu H, Chen HC, Tan C. BaeSR activates type Ⅵ secretion system expression in porcine extra-intestinal pathogenic Escherichia coli to enhance bacterial resistance to zinc stress. Microbial Pathogenesis, 2020, 147: 104357. DOI:10.1016/j.micpath.2020.104357 |
| [57] | Burtnick MN, Brett PJ. Burkholderia mallei and Burkholderia pseudomallei cluster 1 type Ⅵ secretion system gene expression is negatively regulated by iron and zinc. PLoS ONE, 2013, 8(10): e76767. DOI:10.1371/journal.pone.0076767 |
| [58] | Shalom G, Shaw JG, Thomas MS. In vivo expression technology identifies a type Ⅵ secretion system locus in Burkholderia pseudomallei that is induced upon invasion of macrophages. Microbiology: Reading, England, 2007, 153(Pt 8): 2689-2699. |
