刘玉霞1,2, 窦世娟1, 王秀伶1


1. 河北农业大学生命科学学院, 河北 保定 071001;
2. 沧州医学高等专科学校, 河北 沧州 061001
收稿日期:2021-01-08;修回日期:2021-05-31;网络出版日期:2021-06-25
基金项目:国家自然科学基金(31670057);河北省现代农业产业技术体系大豆产后服务与加工专项(HBCT2019190202)
*通信作者:王秀伶, Tel: +86-312-7528257; E-mail: wxling2000@hebau.edu.cn.
摘要:脯氨酸的亲水力极强,是构成蛋白质的唯一亚氨基酸。脯氨酸在植物中的作用和机制已得到广泛研究,除作为渗透调节物质外,脯氨酸还在清除细胞活性氧或作为信号分子调控植物细胞生长发育、增殖或死亡中发挥重要作用。现有研究结果表明,适当浓度的脯氨酸在细菌细胞中发挥重要功能。本文对细菌脯氨酸的合成、降解、在细胞内外的转运及功能进行综述。
关键词:脯氨酸合成降解转运功能
Research progress in proline biosynthesis, degradation and function in bacteria
Yuxia Liu1,2, Shijuan Dou1, Xiuling Wang1


1. College of Life Sciences, Hebei Agricultural University, Baoding 071001, Hebei Province, China;
2. Cangzhou Medical College, Cangzhou 061001, Hebei Province, China
Received: 8 January 2021; Revised: 31 May 2021; Published online: 25 June 2021
*Corresponding author: Xiuling Wang, Tel: +86-312-7528257; E-mail: wxling2000@hebau.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31670057) and by the Project of the Industry & Technology System for Modern Agriculture in Hebei Province (HBCT2019190202)
Abstract: Proline with strong hydrophilic property is the only sub-amino acid being used for protein synthesis. The function and mechanism for proline has been extensively studied in plant. Proline is not only an osmolyte, but it also has important roles in scavenging reactive oxygen species, acting as a signal molecule to regulate growth, development, proliferation and cell death in plant. Recent studies have demonstrated that a proper amount of proline plays important roles in bacterial cells. The biosynthesis, degradation, intracellular and extracellular transport as well as the function of proline produced by bacteria were reviewed in this paper.
Keywords: prolineanabolismcatabolismtransportfunction
L-脯氨酸,简称脯氨酸(proline,Pro),化学名称为吡咯烷酮羧酸,是构成蛋白质的20种基本氨基酸中唯一的亚氨基酸,亲水力极强,是一种天然的渗透保护剂和抗氧化剂[1-2],或作为分子伴侣保护蛋白质的完整性及多种酶的活性[3]。英国****Kemble和Macpherson于1954年在应激条件下的黑麦草中最早发现脯氨酸积累现象[4];1969年法国****Gilles和Schoffeniels发现,无脊椎动物中华绒螯蟹的离体神经细胞在高盐环境也有脯氨酸积累[5]。除在细胞内的积累,脯氨酸的降解过程也有重要作用。据报道,致病性真菌新型隐球菌的活性氧平衡和毒力发挥需要完整的脯氨酸分解代谢途径[6],脯氨酸分解代谢对于布氏锥虫在采蝇媒介中的生存至关重要[7]。近年研究发现,脯氨酸代谢参与响应人体细胞对遗传毒性、代谢性应激、炎症过程等的控制[8],并在多种类型癌症的发生和发展中发挥重要作用[9-12]。
在细菌中,澳大利亚****Christian 1955年在Salmonella oranienburg中首次发现脯氨酸积累与其渗透胁迫耐受性密切相关[13],随后国外****对细菌脯氨酸合成、降解及功能方面展开研究,国内****的研究则大多集中于脯氨酸高产菌株选育与发酵条件优化方面。迄今,有关细菌脯氨酸代谢与功能方面的综述鲜有报道。
1 细菌中脯氨酸的合成与降解 1.1 细菌中脯氨酸的生物合成 目前,已报道的脯氨酸合成途径主要有两条,根据起始物的不同分为谷氨酸(Glu)途径和鸟氨酸(Orn)途径[14-15],目前认为Glu途径是细菌脯氨酸生物合成的主要途径。
1.1.1 谷氨酸途径: 以谷氨酸为起始物的脯氨酸合成途径首先在Escherichia coli中阐明,该途径共经历3个酶促反应和一个自发环化反应(图 1),合成过程依次为:L-谷氨酸(L-glutamate)在γ-谷氨酰激酶(γ-glutamyl kinase,γ-GK)作用下磷酸化生成γ-谷氨酰磷酸(γ-glutamyl phosphate,γ-GP);然后γ-GP被γ-谷氨酰磷酸还原酶(γ-glutamyl phosphate reductase,γ-GPR)催化生成γ-谷氨酸半醛(γ-glutamic semialdehyde,GSA);GSA自发环化,脱去一分子水,生成Δ1-吡咯啉-5-羧酸(Δ1-pyrroline-5-carboxylate,P5C);P5C在Δ1-吡咯啉-5-羧酸还原酶(Δ1-pyrroline-5-carboxylate reductase,P5CR)的作用下生成L-脯氨酸(L-proline)[16]。现有研究结果证实,上述途径广泛存在于真细菌、酿酒酵母、植物和动物中。所不同的是,在细菌和低等的真核生物(如真菌和藻类)中的GK和GPR是离散的单功能酶,而在高等动物和植物体内的GK和GPR则是融合到一起的双功能酶,即P5C合成酶(Δ1-pyrroline-5-carboxylate synthetase,P5CS)。笔者实验室曾分离得到一株严格厌氧梭菌Clostridium sp. AUH-JLC108,该菌株在厌氧条件下能将底物黄豆苷原开环转化为去氧甲基安哥拉紫檀素(O-desmethylangolensin,O-Dma),后经长期耐氧驯化得到其耐氧突变株Clostridium sp. Aeroto-AUH-JLC108[17]。与未驯化的野生菌株相比,耐氧突变株发酵液中检测到脯氨酸的合成与积累。经对脯氨酸合成酶基因的克隆与表达分析,证明了耐氧突变株可以谷氨酸为底物,经上述3种酶催化合成脯氨酸[18]。
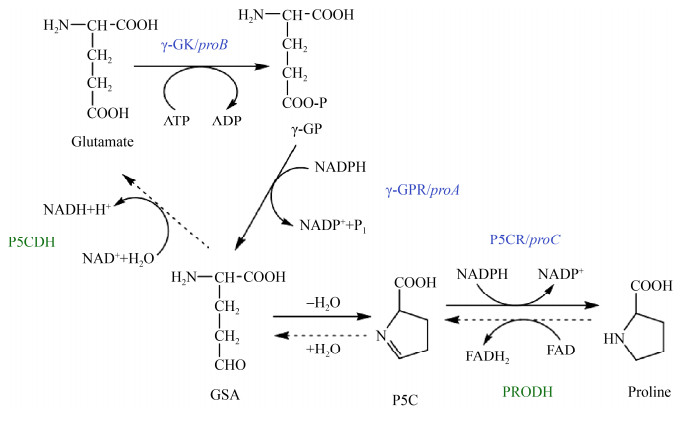 |
| 图 1 细菌脯氨酸的合成与降解(谷氨酸途径) Figure 1 Biosynthesis and degradation of proline in bacteria (glutamate pathway). |
| 图选项 |
1.1.2 鸟氨酸途径: 目前,已报道的比较确定的由鸟氨酸合成脯氨酸的途径有两条(图 2),其中一条途径是:起始物L-鸟氨酸(L-ornithine)在鸟氨酸δ-氨基转移酶(δ-OAT)的作用下形成GSA,GSA自发环化为P5C,之后经P5CR还原为L-脯氨酸。该反应将脯氨酸代谢与精氨酸代谢和尿素循环联系起来[19]。
 |
| 图 2 细菌脯氨酸的合成与降解(鸟氨酸途径) Figure 2 Biosynthesis and degradation of proline in bacteria (ornithine pathway). |
| 图选项 |
目前已知,δ-OAT是一种几乎存在于所有真核生物中的酶,可催化鸟氨酸向谷氨酸或脯氨酸的转化。在原核生物中,OAT (rocD基因)参与精氨酸的降解和脯氨酸的合成[20]。2015年Fichman等通过基因组分析,预测在177种细菌的基因组中存在编码δ-OAT的基因,并发现在牙龈卟啉单胞菌以及一些根瘤菌和芽孢杆菌中,编码δ-OAT的基因位于编码精氨酸分解代谢酶的基因簇中[14]。另外,有研究发现,δ-OAT和参与精氨酸代谢的另外两个酶,即N-乙酰鸟氨酸δ-氨基转移酶(NAcOAT,argD)和N-琥珀酰鸟氨酸δ-氨基转移酶(SOAT)关系密切,均可作用于鸟氨酸[14, 20],因此,在原核生物中很难证明是否存在不同于NAcOAT和SOAT的功能性OAT。1980年,Buxton发现枯草芽孢杆菌proA突变株的营养缺陷需求既可用脯氨酸来满足,又可用精氨酸、瓜氨酸或鸟氨酸来满足[21]。另外,据Belitsky等2001年报道,突变枯草芽孢杆菌δ-OAT和P5CR编码基因导致精氨酸、瓜氨酸或鸟氨酸均不能作为脯氨酸前体而被利用[22]。2011年,Deutch发现腐生葡萄球菌含有OAT和P5CR活性,能利用鸟氨酸作为脯氨酸的来源[23]。
由鸟氨酸合成脯氨酸的另一条途径是L-鸟氨酸被鸟氨酸环化脱氨酶(OCD)催化直接生成L-脯氨酸。该酶于1971年在梭状芽孢杆菌中发现[24],后来在根癌土壤杆菌[25]、苜蓿根瘤菌[26]、流产布鲁氏菌[27]、发根农杆菌[28]、恶臭假单胞菌[29]中被报道。根据Jensen和Wendisch 2013年报道,谷氨酸棒杆菌的基因组包含一个可能的ocd基因,然而,将该基因克隆到质粒中进行表达,在培养基中并未检测到脯氨酸的积累[30];相反,如给谷氨酸棒杆菌补充脯氨酸,该菌株则可通过OCD增加鸟氨酸的产量[31]。该结果表明,谷氨酸棒杆菌中的ocd类似基因编码的蛋白可能更容易趋向从脯氨酸至鸟氨酸的催化方向,但目前尚未见其他基于OCD逆反应从脯氨酸到鸟氨酸的其他文献报道。
1.2 细菌中脯氨酸的降解 脯氨酸代谢的中间产物P5C/GSA可被分解代谢和合成代谢途径共享,但脯氨酸的降解过程并非完全为其合成过程的逆反应,催化反应的酶亦不同。如图 1和2所示,从L-脯氨酸到L-谷氨酸的降解是由PRODH和P5CDH催化的四电子氧化过程[19, 32]:脯氨酸脱氢酶(PRODH)以FAD作为电子受体,脱去L-脯氨酸的2个氢生成P5C;P5C自动开环,结合一分子水,形成GSA;Δ1-吡咯啉-5-羧酸脱氢酶(P5CDH)以NAD+作为电子受体,催化GSA脱氢氧化为L-谷氨酸。由于GSA是被氧化的底物,2013年,国际生物化学与分子生物学联合会命名委员会(IUBMB)建议将P5CDH改为GSADH[19],但Δ1-吡咯啉-5-羧酸脱氢酶的简称目前尚未统一。
参与脯氨酸氧化的PRODH和P5CDH在真核生物和原核生物中均高度保守,所不同的是这两个酶是否融合为一个被称为脯氨酸利用A (PutA)的双功能酶。根据Tanner 2008年报道,脯氨酸降解酶可分为三类:第一类由单功能酶组成,即PRODH域和P5CDH域是分开的;第二类和第三类在同一条PutA多肽中均同时含有PRODH域和P5CDH域,二者的区别在于是否在N末端还含有一个RHH (ribbon-helix-helix) DNA结合域[33],其中含有DNA结合域的PutA具有3种功能,即除具有PRODH和P5CDH酶活外,RHH域使PutA作为putA和putP (编码高亲和力的Na+/脯氨酸转运蛋白)基因的转录调节因子[32, 34]。以往多认为真核生物体内脯氨酸的降解均依赖单功能酶PRODH和P5CDH,原核生物中脯氨酸的降解则依赖双功能PutA。现有研究结果表明,革兰氏阳性细菌中的脯氨酸降解酶为单功能酶,而革兰氏阴性细菌中的脯氨酸降解酶为双功能PutA[35]。
1982年,Meile等提出在革兰氏阴性铜绿假单胞菌PAO中,双功能脯氨酸降解酶的产生受脯氨酸诱导而不受P5C诱导,受柠檬酸盐和氮控制的降解物阻遏[36]。随后的10年中,多位****对鼠伤寒沙门氏菌脯氨酸利用的调节进行了研究。Ostrovsky等1991年研究结果表明,当细胞内脯氨酸缺乏时,PutA酶游离于细胞质中,并作用于put调节子,阻遏putA和putP基因的转录,抑制脯氨酸的降解;而当细胞内脯氨酸浓度较高时,PutA酶则结合在细胞膜上,putA和putP基因转录表达,促进脯氨酸的降解[37]。然而,在渗透胁迫下鼠伤寒沙门氏菌积累的脯氨酸几乎不被降解,因为该条件下脯氨酸降解酶直接被抑制[38]。
在革兰氏阳性枯草芽孢杆菌中,putBCP基因簇(编码高亲和力的脯氨酸转运蛋白PutP、脯氨酸脱氢酶PutB和Δ1-吡咯啉-5-羧酸脱氢酶PutC)的诱导表达受培养基中亚毫摩尔浓度脯氨酸的存在而触发;然而,作为高渗应激保护剂而合成的大量脯氨酸(可达几百毫摩尔)却不能诱导putBCP的转录[39]。笔者以为,造成这种现象的原因可能与脯氨酸在菌体细胞内外的存在状态不同有关:存在于胞外的脯氨酸是作为一种溶质分子存在于培养基的自由水中,因此,脯氨酸被转运进入菌体后可诱导相关酶的表达。McLain等2007年的研究结果证实,当脯氨酸与水的摩尔比分别为1:10、1:15和1:20时,脯氨酸分子间的相互作用较弱,在这3种浓度中均未观察到脯氨酸存在明显的簇化或聚集现象[40]。作为高渗应激保护剂的脯氨酸在菌体细胞内则是以水合分子团簇形式聚集在一起,导致菌体细胞内水流动性减弱,以结合态存在的脯氨酸不再具有底物诱导作用,而是通过变构调节某些蛋白的构型来影响相关酶的活性。在逆境条件下,细胞内的脯氨酸会自然积聚为高浓度[41],高密度液体分子间若形成氢键,有可能发生缔合现象。王朝杰等2007年根据15种脯氨酸的结构特性和红外光谱数据,发现不同构象中存在强弱不同的分子内氢键[42]。除分子内和分子间氢键外,脯氨酸二聚体[43]以及脯氨酸不同异构体可在不同位置与水分子结合形成氢键[44-45]。目前已知,分子间有氢键的液体,一般黏度较大。
2 脯氨酸在细菌细胞内外的转运 现有研究结果表明,在大肠杆菌和沙门氏菌中的脯氨酸转运系统包括PutP、ProP和ProU。当菌株以脯氨酸为碳源或氮源时,PutP是其运输所必需,此时PutP可被外源脯氨酸诱导;ProP和ProU则用于运输渗透保护剂[46-47]。研究发现,当菌株培养在不含脯氨酸的培养基中时,野生型大肠杆菌和鼠伤寒沙门氏菌的胞质脯氨酸水平不受渗透胁迫的调控;当环境中有可供使用的脯氨酸时,在渗透胁迫下菌株会大量积累脯氨酸[48-49]。这表明高渗透压下其胞质脯氨酸水平的增加并非内源性合成,而是通过ProP和ProU运输系统外源吸收的结果。
许多革兰氏阳性细菌脯氨酸的合成或降解则受渗透胁迫调控,在缺乏外源脯氨酸时,可通过增加脯氨酸的内源性合成应对渗透胁迫。与上述革兰氏阴性细菌一样,当革兰氏阳性枯草芽孢杆菌以脯氨酸作为碳或氮源时,其putP基因可由培养基中存在的脯氨酸诱导表达,但脯氨酸作为渗透保护剂吸收则是由OpuE (渗透调节性Na+/脯氨酸转运蛋白)转运体介导的,opuE基因可持续响应高渗透进行诱导表达。opuE和proHJ (渗透适应性脯氨酸合成蛋白基因)操纵子在枯草芽孢杆菌染色体上互不相邻,但渗透胁迫下可被同时诱导。现有研究结果证实,OpuE蛋白是菌体响应渗透胁迫而高水平合成脯氨酸所必要的,此时,OpuE转运蛋白不仅用于搜寻外源脯氨酸作为渗透保护剂,也可以回收盐胁迫条件下菌体细胞从头合成随后释放的脯氨酸[50]。编码脯氨酸转运和生物合成蛋白的基因群组成一个操纵子,渗透胁迫下有利于这些基因的协同控制表达[50]。
Zaprasis等(2014年)发现PutP和OpuE系统同时失活时,枯草芽孢杆菌细胞仍然将脯氨酸作为营养物利用,推测在枯草芽孢杆菌中可能存在第三类脯氨酸转运系统。于是利用putP opuE双突变体对有毒的脯氨酸类似物3, 4-脱氢-dl-脯氨酸(DHP)的敏感性,确定了第三类脯氨酸吸收系统的存在。并进一步利用菌体对放射性同位素标记的γ-氨基丁酸(GABA)和脯氨酸吸收试验,证实了GabP载体不仅作为GABA的吸收系统,同时也是枯草芽孢杆菌的第三类脯氨酸转运体[51]。
3 细菌中脯氨酸功能研究 3.1 作为营养物质参与代谢 革兰氏阴性大肠杆菌、鼠伤寒沙门氏菌、克雷伯菌及革兰氏阳性枯草芽孢杆菌均可以脯氨酸作为唯一氮源或碳源[39, 52],外源脯氨酸经脯氨酸透性酶(proline permease)催化的Na+/脯氨酸同向转运,进入细胞后被降解为谷氨酸,进而参与重要化学反应。除作为唯一氮源或碳源外,脯氨酸还可作为重要的碳源或氮源支持恶臭假单胞菌、幽门螺杆菌和大豆根瘤菌等在各种营养条件下生长[53-55]。在分枝杆菌中,脯氨酸代谢由单功能酶脯氨酸脱氢酶(PruB)和P5C脱氢酶(PruA)介导,由一个独特的DNA结合蛋白PruC调控。当分枝杆菌细胞处于营养缺乏和缺氧环境中时,参与脯氨酸代谢的基因被诱导表达。在缺氧条件下,尽管培养基中存在过量的碳和氮,但添加脯氨酸比不添加的会产生更高的生物量[56]。原因是缺氧条件下,分枝杆菌合成代谢率和分解代谢率之间出现不平衡(甘油过剩),导致丙酮醛的产生。丙酮醛是一种有毒代谢物,可作为葡萄糖、甘油、脂肪酸或蛋白质降解代谢的副产物产生。而脯氨酸代谢产生的P5C可与丙酮醛反应形成无毒的2-乙酰基-1-吡咯啉,从而保护分枝杆菌细胞免受丙酮醛的毒害。
3.2 渗透保护功能 脯氨酸是一种有效的相容性溶质,可抵御高渗透压对细胞生理的不利影响[57-58]。1981年Csonka首先发现,鼠伤寒沙门氏菌的脯氨酸高产菌株获得了渗透抗性[47]。据Dandekar 1988年报道,因脯氨酸生物合成途径中第一种酶的调节区位点中发现了单碱基对变化,改变了反馈抑制作用,导致高水平脯氨酸的合成,使大肠杆菌能够承受渗透胁迫[59]。1992年,Omori对粘质沙雷氏菌突变的proBA操纵子进行分析时得出了同样的结论,发现这种突变同样使GK对脯氨酸介导的反馈抑制的敏感性显著降低,而赋予细胞较高的脯氨酸生产率和增强的渗透耐受性[60]。2011年,Faiza研究了分离自骆驼奶的乳酸菌在M17培养基中对盐胁迫的反应特点,证明脯氨酸是一种有效的渗透保护剂[61]。Zaprasis等的研究结果表明,枯草芽孢杆菌可通过渗透引起的相容性溶质的从头合成与吸收、外源多肽的水解释放[62]、蛋白质氨基酸(谷氨酸、谷氨酰胺、天冬氨酸、天冬酰胺和精氨酸)和非蛋白质氨基酸(鸟氨酸、瓜氨酸)的代谢转化[63]等多种方式积累胞内脯氨酸,对抗高渗透压的影响。Amezaga等1999年的研究结果则表明,在大肠杆菌中,含有脯氨酸的肽主要作用是提供营养物质,不会导致脯氨酸作为相容性溶质的积累[64],即含有脯氨酸的肽不能提供渗透保护。
3.3 抗冷、抗热和抗氧化应激 在大肠杆菌中,脯氨酸作为一种热保护剂,在热应激过程中可减少蛋白质聚集[65]。研究发现,脯氨酸具有与甘油和海藻糖几乎相同的低温保护活性,是一种天然无毒的冷冻保护剂[66]。活性氧(reactive oxygen species,ROS)是分子氧从细胞氧化还原组分接受不同数目电子时形成的。游离脯氨酸通常与活性氧平衡的调节相关,细胞内脯氨酸的积累是一种适应性应激反应,可提供氧化应激保护,该保护作用需要吡咯烷环的仲胺[67-68]。通常情况下,脯氨酸可直接清除某些类型的活性氧,也可保护多种抗氧化酶的稳定性,激活其他的解毒途径[67]。2008年,Krishnan通过氧化应激分析对肝螺杆菌putA基因敲除突变株进行了表征,发现相对于野生型菌株,putA突变菌株显示出脯氨酸水平升高和对氧化应激的抗性,但并未观察到抗氧化基因的上调,认为抗性的显著增加归因于较高的脯氨酸含量,这与脯氨酸作为抗氧化剂的作用一致[68]。2015年,Zhang等通过对比大肠杆菌野生型和putA突变菌株氧化应激反应特征,发现脯氨酸所提供的应激保护是大肠杆菌的一种普遍表型且依赖于PutA,脯氨酸代谢可提高氢过氧化物酶I (由katG编码)的表达和活性,增加氧化应激抗性[32]。笔者实验室研究发现,一定浓度的脯氨酸不仅能够缓解培养基中H2O2对耐氧突变株Aeroto-AUH-JLC108的毒害作用,还可通过保护NADH氧化酶活性来减弱氧胁迫对耐氧突变株有氧生长的影响[69]。
3.4 提高病原菌的致病性 现有研究结果表明,脯氨酸对胞内寄生菌的毒力发挥有重要作用。Smith等2001年的研究发现,脯氨酸生物合成途径中最后一个基因proC发生突变后,结核分枝杆菌在小鼠感染模型中表现出毒力减弱现象[70];2006年,Rachman发现肺结核病人病期内结核分枝杆菌中pruA上调[56, 71];2014年,Lagautriere等发现脯氨酸代谢途径是结核分枝杆菌持续在体内存在的一个重要因素[72]。2014年,Cheng等的研究结果表明,脯氨酸和谷氨酰胺可通过上调NtrY/NtrX、PutA/GlnA以及加速DNA结合蛋白CtrA的降解来调控人单核细胞查菲埃立克体E. chaffeensis (一种严格细胞内寄生菌)的快速增殖,并提高其致病力[73]。另外,2017年Caudill等揭示了Put系统对流产布鲁氏菌在其宿主细胞内复制并存活方面发挥重要作用,Put系统影响毒力的原因可能有2个:提供有效的呼吸途径和/或有助于诱导抗氧化途径[74]。
除对胞内寄生菌外,脯氨酸对非胞内寄生病原菌的毒力发挥也有重要作用。现有研究结果证实,许多病原菌依赖脯氨酸作为关键呼吸底物。2003年,Nagata等研究发现,脯氨酸是幽门螺杆菌在人胃定殖期间优先选择的呼吸底物,在感染幽门螺杆菌患者的胃液中脯氨酸含量比未感染者高10倍[54]。另有研究报道,幽门螺杆菌putA突变株在小鼠中的定殖效率则明显低于野生型菌株[75]。2004年,Schwan等通过对高亲和力脯氨酸转运基因(putP)的突变分析发现,该基因的突变导致金黄色葡萄球菌在几种感染动物模型体内的毒力减弱[76]。在金黄色葡萄球菌感染期间,转运蛋白PutP的高表达以及脯氨酸快速向胞内输入对其致病性至关重要[77]。当遇到高渗环境时,在高亲和力PutP和低亲和力ProP两种转运蛋白介导下,金黄色葡萄球菌细胞内的脯氨酸水平增加,进而发挥渗透调节作用[78]。2017年Halsey等的研究结果表明,脯氨酸对于脓肿形成过程中金黄色葡萄球菌的生长非常重要,此时葡萄糖利用会受到严重限制,而脯氨酸可作为金黄色葡萄球菌的重要碳源和能源[79]。口腔微生物滋生是造成龋齿的主要原因,而口腔生物膜是龋齿形成与防治的关键。Cleaver等2021年的研究结果表明,当营养不足时,口腔细菌生物膜可通过降解蛋白质释放脯氨酸,进而将脯氨酸降解为5-氨基戊酸、丁酸、丙酸和甘氨酸等新的碳源和氮源[80]。
4 结语 脯氨酸可影响生物体的许多代谢过程,脯氨酸代谢在不同生物过程中具有不同的作用机制,包括细胞信号传导、应激保护和能量产生等[81]。脯氨酸代谢的3种氨基酸(脯氨酸、谷氨酸和鸟氨酸)与哺乳动物3个关键的代谢途径(即TCA循环、尿素循环和磷酸戊糖途径)相联系[82],影响NADP+/NADPH水平驱动磷酸戊糖途径(OPPP)[83],而OPPP的碳流量的变化可以促进核苷酸合成以及细胞分裂。最新研究结果表明,上调脯氨酸合成可促进癌细胞增殖[84-85]。笔者实验室获得的耐氧突变株Aeroto-AUH-JLC108在有氧条件下的生长量是未驯化原出发菌株在厌氧条件下的3倍[17],有关脯氨酸积累在耐氧突变株菌体增殖中的作用尚待进一步研究。另外,脯氨酸代谢和转运能力的破坏可显著减弱某些病原体的毒力[70, 77],抑制脯氨酸的代谢与转运可能是治疗某些病原体感染的新策略。
References
| [1] | Saibi W, Feki K, Yacoubi I, Brini F. Bridging between proline structure, functions, metabolism, and involvement in organism physiology. Applied Biochemistry and Biotechnology, 2015, 176(8): 2107-2119. DOI:10.1007/s12010-015-1713-0 |
| [2] | Zhang L, Xue X, Yan J, Yan LY, Jin XH, Zhu XH, He ZZ, Liu J, Li R, Qiao J. L-proline: a highly effective cryoprotectant for mouse oocyte vitrification. Scientific Reports, 2016, 6: 26326. DOI:10.1038/srep26326 |
| [3] | Ben Rejeb K, Abdelly C, Savouré A. Proline, a multifunctional amino-acid involved in plant adaptation to environmental constraints. Biologie Aujourd'Hui, 2012, 206(4): 291-299. DOI:10.1051/jbio/2012030 |
| [4] | Kemble AR, Macpherson HT. Liberation of amino acids in perennial rye grass during wilting. The Biochemical Journal, 1954, 58(1): 46-49. |
| [5] | Gilles R, Schoffeniels E. Isosmotic regulaton in isolated surviving nerves of Eriocheir sinensis Milne Edwards. Comparative Biochemistry and Physiology, 1969, 31(6): 927-939. DOI:10.1016/0010-406X(69)91802-7 |
| [6] | Lee IR, Lui EY, Chow EW, Arras SD, Morrow CA, Fraser JA. Reactive oxygen species homeostasis and virulence of the fungal pathogen Cryptococcus neoformans requires an intact proline catabolism pathway. Genetics, 2013, 194(2): 421-433. DOI:10.1534/genetics.113.150326 |
| [7] | Mantilla BS, Marchese L, Casas-Sánchez A, Dyer NA, Ejeh N, Biran M, Bringaud F, Lehane MJ, Acosta-Serrano A, Silber AM. Proline metabolism is essential for Trypanosoma brucei brucei survival in the tsetse vector. PLoS Pathogens, 2017, 13(1): e1006158. DOI:10.1371/journal.ppat.1006158 |
| [8] | Phang JM, Liu W. Proline metabolism and cancer. Frontiers in Bioscience-landmark, 2012, 17(5): 1835-1845. |
| [9] | Ding ZB, Ericksen RE, Escande-Beillard N, Lee QY, Loh A, Denil S, Steckel M, Haegebarth A, Wai Ho TS, Chow P, Toh HC, Reversade B, Gruenewald S, Han WP. Metabolic pathway analyses identify proline biosynthesis pathway as a promoter of liver tumorigenesis. Journal of Hepatology, 2020, 72(4): 725-735. DOI:10.1016/j.jhep.2019.10.026 |
| [10] | To?oczko-Iwaniuk N, Dziemiańczyk-Pakie?a D, Celińska-Janowicz K, Zar?ba I, Klupczyńska A, Kokot ZJ, Nowaszewska BK, Resze? J, Borys J, Miltyk W. Proline-dependent induction of apoptosis in oral squamous cell carcinoma (OSCC)-the effect of celecoxib. Cancers, 2020, 12(1): 136. DOI:10.3390/cancers12010136 |
| [11] | Liu YT, Mao C, Wang M, Liu N, Ouyang LL, Liu SP, Tang HS, Cao Y, Liu S, Wang X, Xiao DS, Chen CS, Shi Y, Yan Q, Tao YG. Cancer progression is mediated by proline catabolism in non-small cell lung cancer. Oncogene, 2020, 39(11): 2358-2376. DOI:10.1038/s41388-019-1151-5 |
| [12] | Ferreira AGK, Biasibetti-Brendler H, Sidegum DSV, Loureiro SO, Figueiró F, Wyse ATS. Effect of proline on cell death, cell cycle, and oxidative stress in C6 glioma cell line. Neurotoxicity Research, 2021, 39(2): 327-334. DOI:10.1007/s12640-020-00311-z |
| [13] | Christian, J HB. The influence of nutrition on the water relations of Salmonella oranienburg. Australian Journal of Biological Sciences, 1955, 8(1): 75-82. DOI:10.1071/BI9550075 |
| [14] | Fichman Y, Gerdes SY, Kovács H, Szabados L, Zilberstein A, Csonka LN. Evolution of proline biosynthesis: enzymology, bioinformatics, genetics, and transcriptional regulation. Biological Reviews, 2015, 90(4): 1065-1099. DOI:10.1111/brv.12146 |
| [15] | Wu ZY, Li YR, Gu ZH, Ding ZY, Zhang L, Shi GY. Function of glnA, proB and proA genes in L-proline anabolic pathway of Bacillus subtilis. Acta Microbiologica Sinica, 2018, 58(1): 39-50. (in Chinese) 吴志勇, 李由然, 顾正华, 丁重阳, 张梁, 石贵阳. 枯草芽孢杆菌L-脯氨酸合成途径中glnA、proB、proA基因功能探究. 微生物学报, 2018, 58(1): 39-50. |
| [16] | Csonka LN, Leisinger T. Biosynthesis of proline. EcoSal Plus, 2007, 2(2): 1-20. |
| [17] | Li M, Li H, Zhang C, Wang XL, Chen BH, Hao QH, Wang SY. Enhanced biosynthesis of O-desmethylangolensin from daidzein by a novel oxygen-tolerant cock intestinal bacterium in the presence of atmospheric oxygen. Journal of Applied Microbiology, 2015, 118(3): 619-628. DOI:10.1111/jam.12732 |
| [18] | 刘玉霞. 大豆异黄酮开环转化菌株耐氧突变株Aeroto-AUH-JLC108高效增殖机制. 河北农业大学博士学位论文, 2020. |
| [19] | Tanner JJ. Structural biology of proline catabolic enzymes. Antioxidants & Redox Signaling, 2019, 30(4): 650-673. |
| [20] | Ginguay A, Cynober L, Curis E, Nicolis I. Ornithine aminotransferase, an important glutamate-metabolizing enzyme at the crossroads of multiple metabolic pathways. Biology, 2017, 6(1): E18. |
| [21] | Buxton RS. Selection of Bacillus subtilis 168 mutants with deletions of the PBSX prophage. The Journal of General Virology, 1980, 46(2): 427-437. DOI:10.1099/0022-1317-46-2-427 |
| [22] | Belitsky BR, Brill J, Bremer E, Sonenshein AL. Multiple genes for the last step of proline biosynthesis in Bacillus subtilis. Journal of Bacteriology, 2001, 183(14): 4389-4392. DOI:10.1128/JB.183.14.4389-4392.2001 |
| [23] | Deutch CE. L-Proline nutrition and catabolism in Staphylococcus saprophyticus. Antonie Van Leeuwenhoek, 2011, 99(4): 781-793. DOI:10.1007/s10482-011-9552-7 |
| [24] | Costilow RN, Laycock L. Ornithine cyclase (deaminating): purification of a protein that converts ornithine to proline and definition of the optimal assay conditions. Journal of Biological Chemistry, 1971, 246(21): 6655-6660. DOI:10.1016/S0021-9258(19)34165-1 |
| [25] | Dessaux Y, Petit A, Tempé J, Demarez M, Legrain C, Wiame JM. Arginine catabolism in Agrobacterium strains: role of the Ti plasmid. Journal of Bacteriology, 1986, 166(1): 44-50. DOI:10.1128/jb.166.1.44-50.1986 |
| [26] | Soto MJ, van Dillewijn P, Olivares J, Toro N. Ornithine cyclodeaminase activity in Rhizobium meliloti. FEMS Microbiology Letters, 1994, 119(1/2): 209-213. |
| [27] | Kim J, Mayfield JE. Brucella abortus arginase and ornithine cyclodeaminase genes are similar to Ti plasmid arginase and ornithine cyclodeaminase. Biochimica et Biophysica Acta: BBA-Gene Structure and Expression, 1997, 1354(1): 55-57. DOI:10.1016/S0167-4781(97)00125-5 |
| [28] | Trovato M, Maras B, Linhares F, Costantino P. The plant oncogene rolD encodes a functional ornithine cyclodeaminase. Proceedings of the National Academy of the Sciences of the United States of America, 2001, 98(23): 13449-13453. |
| [29] | Alam S, Wang SC, Ruzicka FJ, Frey PA, Wedekind JE. Crystallization and X-ray diffraction analysis of ornithine cyclodeaminase from Pseudomonas putida. Acta Crystallographica Section D, 2004, 60(5): 941-944. DOI:10.1107/S0907444904005256 |
| [30] | Jensen JVK, Wendisch VF. Ornithine cyclodeaminase-based proline production by Corynebacterium glutamicum. Microbial Cell Factories, 2013, 12(1): 1-10. DOI:10.1186/1475-2859-12-1 |
| [31] | Lee SY, Cho JY, Lee HJ, Kim YH, Min J. Enhancement of ornithine production in proline-supplemented Corynebacterium glutamicum by ornithine cyclodeaminase. Journal of Microbiology and Biotechnology, 2010, 20(1): 127-131. DOI:10.4014/jmb.0907.07034 |
| [32] | Zhang L, Alfano JR, Becker DF. Proline metabolism increases katG expression and oxidative stress resistance in Escherichia coli. Journal of Bacteriology, 2015, 197(3): 431-440. DOI:10.1128/JB.02282-14 |
| [33] | Tanner JJ. Structural biology of proline catabolism. Amino Acids, 2008, 35(4): 719-730. DOI:10.1007/s00726-008-0062-5 |
| [34] | Liu LK, Becker DF, Tanner JJ. Structure, function, and mechanism of proline utilization A (PutA). Archives of Biochemistry and Biophysics, 2017, 632: 142-157. DOI:10.1016/j.abb.2017.07.005 |
| [35] | Arentson BW, Sanyal N, Becker DF. Substrate channeling in proline metabolism. Frontiers in Bioscience, 2012, 17(1): 375-388. DOI:10.2741/3932 |
| [36] | Meile L, Soldati L, Leisinger T. Regulation of proline catabolism in Pseudomonas aeruginosa PAO. Archives of Microbiology, 1982, 132(2): 189-193. DOI:10.1007/BF00508729 |
| [37] | Ostrovsky de Spicer P, O'Brien K, Maloy S. Regulation of proline utilization in Salmonella typhimurium: a membrane-associated dehydrogenase binds DNA in vitro. Journal of Bacteriology, 1991, 173(1): 211-219. DOI:10.1128/jb.173.1.211-219.1991 |
| [38] | Ekena K, Maloy S. Regulation of proline utilization in Salmonella typhimurium: How do cells avoid a futile cycle?. Molecular and General Genetics MGG, 1990, 220(3): 492-494. DOI:10.1007/BF00391761 |
| [39] | Moses S, Sinner T, Zaprasis A, St?veken N, Hoffmann T, Belitsky BR, Sonenshein AL, Bremer E. Proline utilization by Bacillus subtilis: uptake and catabolism. Journal of Bacteriology, 2012, 194(4): 745-758. DOI:10.1128/JB.06380-11 |
| [40] | McLain SE, Soper AK, Terry AE, Watts A. Structure and hydration of L-proline in aqueous solutions. The Journal of Physical Chemistry B, 2007, 111(17): 4568-4580. DOI:10.1021/jp068340f |
| [41] | Rabbani G, Choi I. Roles of osmolytes in protein folding and aggregation in cells and their biotechnological applications. International Journal of Biological Macromolecules, 2018, 109: 483-491. DOI:10.1016/j.ijbiomac.2017.12.100 |
| [42] | Wang CJ, Li Y, Yang XY, Lin L. Conformers and properties of proline. Acta Physico-Chimica Sinica, 2007, 23(3): 305-310. (in Chinese) 王朝杰, 李永, 杨新宇, 林丽. 脯氨酸的构象及性质. 物理化学学报, 2007, 23(3): 305-310. |
| [43] | 陈金鹏. 水分子对质子化甘氨酸-脯氨酸二聚体结构及性质的调节效应探讨. 济南大学硕士学位论文, 2011. |
| [44] | Michaux C, Wouters J, Perpète EA, Jacquemin D. Stepwise hydration of protonated proline. The Journal of Physical Chemistry B, 2008, 112(26): 7702-7705. DOI:10.1021/jp8023155 |
| [45] | Suzuki K, Sugiura Y, Takayanagi T, Kita Y, Tachikawa M. Hydration effect on positron binding ability of proline: positron attachment induces proton-transfer to form zwitterionic structure. The Journal of Physical Chemistry A, 2019, 123(6): 1217-1224. DOI:10.1021/acs.jpca.8b11653 |
| [46] | Smith LT. Characterization of a gamma-glutamyl kinase from Escherichia coli that confers proline overproduction and osmotic tolerance. Journal of Bacteriology, 1985, 164(3): 1088-1093. DOI:10.1128/jb.164.3.1088-1093.1985 |
| [47] | Csonka LN. Proline over-production results in enhanced osmotolerance in Salmonella typhimurium. Molecular and General Genetics MGG, 1981, 182(1): 82-86. DOI:10.1007/BF00422771 |
| [48] | Milner JL, McClellan DJ, Wood JM. Factors reducing and promoting the effectiveness of proline as an osmoprotectant in Escherichia coli K12. Journal of General Microbiology, 1987, 133(7): 1851-1860. |
| [49] | Csonka LN. Regulation of cytoplasmic proline levels in Salmonella typhimurium: effect of osmotic stress on synthesis, degradation, and cellular retention of proline. Journal of Bacteriology, 1988, 170(5): 2374-2378. DOI:10.1128/jb.170.5.2374-2378.1988 |
| [50] | Hoffmann T, von Blohn C, Stanek A, Moses S, Barzantny H, Bremer E. Synthesis, release, and recapture of compatible solute proline by osmotically stressed Bacillus subtilis cells. Applied and Environmental Microbiology, 2012, 78(16): 5753-5762. DOI:10.1128/AEM.01040-12 |
| [51] | Zaprasis A, Hoffmann T, Stannek L, Gunka K, Commichau FM, Bremer E. The γ-aminobutyrate permease GabP serves as the third proline transporter of Bacillus subtilis. Journal of Bacteriology, 2014, 196(3): 515-526. DOI:10.1128/JB.01128-13 |
| [52] | Chen LM, Maloy S. Regulation of proline utilization in enteric bacteria: cloning and characterization of the Klebsiella put control region. Journal of Bacteriology, 1991, 173(2): 783-790. DOI:10.1128/jb.173.2.783-790.1991 |
| [53] | V??lchez S, Manzanera M, Ramos JL. Control of expression of divergent Pseudomonas putida put promoters for proline catabolism. Applied and Environmental Microbiology, 2000, 66(12): 5221-5225. DOI:10.1128/AEM.66.12.5221-5225.2000 |
| [54] | Nagata K, Nagata Y, Sato T, Fujino MA, Nakajima K, Tamura T. L-Serine, D- and L-proline and alanine as respiratory substrates of Helicobacter pylori: correlation between in vitro and in vivo amino acid levels. Microbiology: Reading, England, 2003, 149(Pt 8): 2023-2030. |
| [55] | Curtis J, Shearer G, Kohl DH. Bacteroid proline catabolism affects N(2) fixation rate of drought-stressed soybeans. Plant Physiology, 2004, 136(2): 3313-3318. DOI:10.1104/pp.104.044024 |
| [56] | Berney M, Weimar MR, Heikal A, Cook GM. Regulation of proline metabolism in Mycobacteria and its role in carbon metabolism under hypoxia. Molecular Microbiology, 2012, 84(4): 664-681. DOI:10.1111/j.1365-2958.2012.08053.x |
| [57] | Hoffmann T, Bleisteiner M, Sappa PK, Steil L, M?der U, V?lker U, Bremer E. Synthesis of the compatible solute proline by Bacillus subtilis: point mutations rendering the osmotically controlled proHJ promoter hyperactive. Environmental Microbiology, 2017, 19(9): 3700-3720. DOI:10.1111/1462-2920.13870 |
| [58] | Mahipant G, Paemanee A, Roytrakul S, Kato J, Vangnai AS. The significance of proline and glutamate on butanol chaotropic stress in Bacillus subtilis 168. Biotechnology for Biofuels, 2017, 10(1): 1-14. DOI:10.1186/s13068-016-0693-9 |
| [59] | Dandekar AM, Uratsu SL. A single base pair change in proline biosynthesis genes causes osmotic stress tolerance. Journal of Bacteriology, 1988, 170(12): 5943-5945. DOI:10.1128/jb.170.12.5943-5945.1988 |
| [60] | Omori K, Suzuki SI, Imai Y, Komatsubara S. Analysis of the mutant proBA operon from a proline-producing strain of Serratia marcescens. Journal of General Microbiology, 1992, 138(4): 693-699. DOI:10.1099/00221287-138-4-693 |
| [61] | Faiza B, Halima ZK, Nour-Eddine K. Physiological responses of salt stress and osmoprotection with proline in two strains of lactococci isolated from camel's milk in Southern Algeria. African Journal of Biotechnology, 2011, 10(83): 19429-19435. |
| [62] | Zaprasis A, Brill J, Thüring M, Wünsche G, Heun M, Barzantny H, Hoffmann T, Bremer E. Osmoprotection of Bacillus subtilis through import and proteolysis of proline-containing peptides. Applied and Environmental Microbiology, 2013, 79(2): 576-587. DOI:10.1128/AEM.01934-12 |
| [63] | Zaprasis A, Bleisteiner M, Kerres A, Hoffmann T, Bremer E. Uptake of amino acids and their metabolic conversion into the compatible solute proline confers osmoprotection to Bacillus subtilis. Applied and Environmental Microbiology, 2015, 81(1): 250-259. DOI:10.1128/AEM.02797-14 |
| [64] | Amezaga MR, Booth IR. Osmoprotection of Escherichia coli by peptone is mediated by the uptake and accumulation of free proline but not of proline-containing peptides. Applied and Environmental Microbiology, 1999, 65(12): 5272-5278. DOI:10.1128/AEM.65.12.5272-5278.1999 |
| [65] | Chattopadhyay MK, Kern R, Mistou MY, Dandekar AM, Uratsu SL, Richarme G. The chemical chaperone proline relieves the thermosensitivity of a dnaK deletion mutant at 42 degrees C. Journal of Bacteriology, 2004, 186(23): 8149-8152. DOI:10.1128/JB.186.23.8149-8152.2004 |
| [66] | Wang YB, Miao JL, Jiang YH, Liu FM, Zheng Z, Li GY. Roles of proline and soluble sugar in the cold-adaptation of Antarctic ice microalgae. Biotechnology Bulletin, 2016, 32(2): 198-202. (in Chinese) 王以斌, 缪锦来, 姜英辉, 刘芳明, 郑洲, 李光友. 脯氨酸和可溶性糖在南极冰藻低温适应机制中的作用. 生物技术通报, 2016, 32(2): 198-202. |
| [67] | Zhang L. Reactive Oxygen Species homeostasis and proline catabolism. University of Nebraska, 2015. |
| [68] | Krishnan N, Doster AR, Duhamel GE, Becker DF. Characterization of a Helicobacter hepaticus putA mutant strain in host colonization and oxidative stress. Infection and Immunity, 2008, 76(7): 3037-3044. DOI:10.1128/IAI.01737-07 |
| [69] | Liu YX, Cao LL, Dou SJ, Wang XL. Study on biosynthesis and antioxidant activity of proline produced in vitro by an oxygen-tolerant bacterium with soy isoflavone bioconverting activity. Journal of Hebei Agricultural University, 2020, 43(4): 36-42, 48. (in Chinese) 刘玉霞, 曹伶俐, 窦世娟, 王秀伶. 大豆异黄酮开环转化菌株耐氧突变株脯氨酸体外累积及其抗氧化活性研究. 河北农业大学学报, 2020, 43(4): 36-42, 48. |
| [70] | Smith DA, Parish T, Stoker NG, Bancroft GJ. Characterization of auxotrophic mutants of Mycobacterium tuberculosis and their potential as vaccine candidates. Infection and Immunity, 2001, 69(2): 1142-1150. DOI:10.1128/IAI.69.2.1442-1150.2001 |
| [71] | Rachman H, Strong M, Ulrichs T, Grode L, Schuchhardt J, Mollenkopf H, Kosmiadi GA, Eisenberg D, Kaufmann SHE. Unique transcriptome signature of Mycobacterium tuberculosis in pulmonary tuberculosis. Infection and Immunity, 2006, 74(2): 1233-1242. DOI:10.1128/IAI.74.2.1233-1242.2006 |
| [72] | Lagautriere T, Bashiri G, Paterson NG, Berney M, Cook GM, Baker EN. Characterization of the proline-utilization pathway in Mycobacterium tuberculosis through structural and functional studies. Acta Crystallographica Section D, 2014, 70(4): 968-980. DOI:10.1107/S1399004713034391 |
| [73] | Cheng ZH, Lin MQ, Rikihisa Y. Ehrlichia chaffeensis proliferation begins with NtrY/NtrX and PutA/GlnA upregulation and CtrA degradation induced by proline and glutamine uptake. mBio, 2014, 5(6): e02141. |
| [74] | Caudill MT, Budnick JA, Sheehan LM, Lehman CR, Purwantini E, Mukhopadhyay B, Caswell CC. Proline utilization system is required for infection by the pathogenic α-proteobacterium Brucella abortus. Microbiology: Reading, England, 2017, 163(7): 970-979. DOI:10.1099/mic.0.000490 |
| [75] | Nakajima K, Inatsu S, Mizote T, Nagata Y, Aoyama K, Fukuda Y, Nagata K. Possible involvement of put A gene in Helicobacter pylori colonization in the stomach and motility. Biomedical Research: Tokyo, Japan, 2008, 29(1): 9-18. |
| [76] | Schwan WR, Wetzel KJ, Gomez TS, Stiles MA, Beitlich BD, Grunwald S. Low-proline environments impair growth, proline transport and in vivo survival of Staphylococcus aureus strain-specific putP mutants. Microbiology: Reading, England, 2004, 150(Pt 4): 1055-1061. |
| [77] | Schwan WR, Wetzel KJ. Osmolyte transport in Staphylococcus aureus and the role in pathogenesis. World Journal of Clinical Infectious Diseases, 2016, 6(2): 22-27. DOI:10.5495/wjcid.v6.i2.22 |
| [78] | Alreshidi MM, Dunstan RH, Gottfries J, Macdonald MM, Crompton MJ, Ang CS, Williamson NA, Roberts TK. Changes in the cytoplasmic composition of amino acids and proteins observed in Staphylococcus aureus during growth under variable growth conditions representative of the human wound site. PLoS ONE, 2016, 11(7): e0159662. DOI:10.1371/journal.pone.0159662 |
| [79] | Halsey CR, Lei SL, Wax JK, Lehman MK, Nuxoll AS, Steinke L, Sadykov M, Powers R, Fey PD. Amino acid catabolism in Staphylococcus aureus and the function of carbon catabolite repression. mBio, 2017, 8(1): e01434-16. |
| [80] | Cleaver LM, Moazzez RV, Carpenter GH. Evidence for proline utilization by oral bacterial biofilms grown in saliva. Frontiers in Microbiology, 2021, 11: 619968. DOI:10.3389/fmicb.2020.619968 |
| [81] | Christgen SL, Becker DF. Role of proline in pathogen and host interactions. Antioxidants & Redox Signaling, 2019, 30(4): 683-709. |
| [82] | Liu W, Phang JM. Proline dehydrogenase (oxidase) in cancer. BioFactors, 2012, 38(6): 398-406. DOI:10.1002/biof.1036 |
| [83] | Liu W, Hancock CN, Fischer JW, Harman M, Phang JM. Proline biosynthesis augments tumor cell growth and aerobic glycolysis: involvement of pyridine nucleotides. Scientific Reports, 2015, 5: 17206. DOI:10.1038/srep17206 |
| [84] | Guo L, Cui CH, Zhang K, Wang JX, Wang YL, Lu YX, Chen K, Yuan JF, Xiao GZ, Tang B, Sun Y, Wu CY. Kindlin-2 links mechano-environment to proline synthesis and tumor growth. Nature Communications, 2019, 10(1): 845. DOI:10.1038/s41467-019-08772-3 |
| [85] | Ding ZB, Ericksen RE, Lee QY, Han WP. Reprogramming of mitochondrial proline metabolism promotes liver tumorigenesis. Amino Acids, 2021: 1-9. DOI:10.1007/s00726-021-02961-5 |
