张海洋1, 王权1, 刘爽1,2, 戚雪芹1,2, 齐瑜1, 刘鹏选1,2, 李洋洋1,2, 郭容1, 方维焕3, 韩先干1

 , 蒋蔚1
, 蒋蔚1

1. 中国农业科学院上海兽医研究所, 上海 200241;
2. 南京农业大学动物医学院, 江苏 南京 210095;
3. 浙江大学动物科学学院, 浙江 临安 311300
收稿日期:2021-02-19;修回日期:2021-04-02;网络出版日期:2021-09-23
基金项目:国家自然科学基金(31702277);上海市自然科学基金(17ZR1437200);兵团财政科技计划(2020AB025-03);中央级公益性科研院所基本科研业务费专项资金(2020JB07)
*通信作者:韩先干, E-mail: hanxgan@shvri.ac.cn;
蒋蔚, Tel/Fax: +86-21-34293397, E-mail: jiangweijw99@163.com, jiangwei@shvri.ac.cn.
摘要:[目的] 以副溶血弧菌VP2918为研究对象,研究其对副溶血弧菌的生物学特性和致病性的影响。[方法] 利用同源重组技术构建了vp2918基因的基因缺失株(Δvp2918)和互补株(CΔvp2918),并对野生株、缺失株和互补株的细菌生长曲线、运动性、生物被膜形成能力、对HeLa细胞的黏附能力、细胞毒性、对小鼠的致死率和组织载菌量进行分析。[结果] 缺失vp2918基因不影响副溶血弧菌的生长特性、运动性、生物被膜形成能力以及对HeLa细胞的黏附能力。但与野生株相比,Δvp2918对HeLa细胞的毒性作用显著降低;感染Δvp2918的小鼠症状明显减轻,存活率更高;Δvp2918在小鼠脾脏和肝脏中的载菌量显著低于野生株,互补株毒力基本恢复至野生株水平。[结论] vp2918不参与副溶血弧菌的运动性和生物被膜形成能力等过程,但与该菌的致病性相关,为潜在的毒力因子。
关键词:副溶血弧菌vp2918基因缺失生物学功能致病性
Gene deletion and functional analysis of vp2918 gene in Vibrio parahemolyticus
Haiyang Zhang1, Quan Wang1, Shuang Liu1,2, Xueqin Qi1,2, Yu Qi1, Pengxuan Liu1,2, Yangyang Li1,2, Rong Guo1, Weihuan Fang3, Xian'gan Han1

 , Wei Jiang1
, Wei Jiang1

1. Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Science, Shanghai 200241, China;
2. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China;
3. College of Animal Science, Zhejiang University, Lin'an 311300, Zhejiang Province, China
Received: 19 February 2021; Revised: 2 April 2021; Published online: 23 September 2021
*Corresponding author: Xian'gan Han, E-mail: hanxgan@shvri.ac.cn;
Wei Jiang, Tel/Fax: +86-21-34293397, E-mail: jiangweijw99@163.com, jiangwei@shvri.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31702277), by the Shanghai Natural Science Foundation of China (17ZR1437200), by the Key Scientific and Technological Project of Xinjiang Production & Construction Corps (2020AB025-03) and by the Basic Foundation for Scientific Research of State-level Public Welfare Institutes of China (2020JB07)
Abstract: [Objective] By using comparative proteomics, we identified several potential T6SS-2 effectors, including VP2918. The aim of this study is to elucidate the role of VP2918 in biological characteristics and pathogenicity of Vibrio parahaemolyticus. [Methods] The vp2918 gene deletion mutant strain (Δvp2918) and complementary strain (CΔvp2918) were constructed via homologous recombination technology. Subsequently, the growth characteristics, biofilm formation ability, motility, adhesion and cytotoxicity to HeLa cells, and mice lethality rate, bacterial colonization were analyzed in the wild-type strain (WT), Δvp2918 and CΔvp2918. [Results] The biological characteristics analysis in vitro showed that there was no significant difference in growth curve, motility, biofilm formation ability and adhesion ability to HeLa cells among WT, Δvp2918 and CΔvp2918. However, compared with WT, the toxicity of Δvp2918 to HeLa cells was significantly weakened. Animal experimental results showed that compared with the mice infected with WT, the mice infected with Δvp2918 showed slighter symptoms and higher survival rate. The bacterial loads of Δvp2918 were significantly lower than that of WT in spleen and liver of infected mice, whereas the complementation strain restored the virulence to resemble that of WT. [Conclusion] The VP2918 was not associated with the motility and biofilm formation ability, but it was a potential virulence factor and associated with the pathogenic of V. parahaemolyticus.
Keywords: Vibrio parahaemolyticusvp2918gene mutantbiological characteristicspathogenicity
副溶血性弧菌(Vibrio parahaemolyticus,VP)是一种革兰氏阴性菌,广泛分布于海洋和河口环境[1],是沿海地区最主要的食源性病原菌之一[2–4]。食用受该菌污染的海鲜通常会引起急性胃肠炎[5],主要症状包括腹泻、腹部绞痛、恶心、呕吐和低烧[1]。在患者免疫力较差的情况下,该菌会突破肠道屏障,进而引起具有较高致死率的败血症[6]。此外,有研究表明该菌可通过暴露在海水中的伤口建立感染,随后导致严重的坏死性筋膜炎和败血病[7]。该菌也是对虾急性肝胰腺坏死病(AHPND)的病原体,对全球水产养殖业造成严重的威胁[4]。
副溶血性弧菌感染宿主细胞需要多种毒力因子,包括粘附素、溶血素和分泌系统[8]。T6SS是近年来发现的与细菌生存和毒力密切相关的蛋白分泌系统,其通过分泌的效应蛋白参与细菌在环境中的生存和对宿主的致病过程[9–10]。T6SS参与细胞黏附及毒性、抗吞噬、抗菌及破坏先天免疫系统等过程,在细菌致病过程中发挥重要作用[11–12]。T6SS包括T6SS-1和T6SS-2,其中T6SS-2存在于所有副溶血性弧菌菌株中[13]。虽然目前关于副溶血弧菌T6SS-2的功能研究还比较少,但是研究已提示T6SS-2参与副溶血弧菌细菌竞争、细胞黏附和细胞自噬的过程[11–14]。本实验室前期通过构建T6SS-2的主要结构蛋白DotU2的基因缺失株和互补株,发现缺失了dotU2基因的副溶血弧菌致病性明显下降[15]。目前关于T6SS-2效应蛋白的研究还较少,我们前期通过差异蛋白质组学技术比较分析野生株SH112和ΔdotU2的分泌差异蛋白(数据待发表),拟筛选T6SS-2潜在的效应因子,本研究从中选择其中的VP2918进行深入研究。
本研究首先通过构建vp2918基因缺失株及互补株,比较野生株和缺失株在副溶血弧菌生长特性、运动性、生物被膜形成能力、对小鼠毒力及动物组织载菌量等生物学特性。研究结果为鉴定副溶血性弧菌致病性相关的毒力因子以及了解该菌致病机制打下坚实的基础,为该菌引起的疾病提供预防和治疗思路。
1 材料和方法 1.1 菌株、质粒与试剂 副溶血弧菌临床分离株SH112 (tdh+,血清型O3∶K6)、同源重组质粒pYAK1及互补质粒pMMB207、大肠杆菌HB101 (pRK2013)和CC118λpir,均由本实验室保存。Prime STAR DNA聚合酶、限制性内切酶、DNA Fragment Purification Kit均购自TaKaRa公司;细菌质粒提取试剂、细菌RNA提取试剂盒购自天根公司;DNA Marker、DNA Gel Purification Kit、2×PCR Pre Mix购自南京诺唯赞生物科技有限公司;Trizol?试剂购自Invitrogen公司,CytoTox 96?非放射性细胞毒性检测试剂盒购自Promega公司,DMEM细胞培养基和胎牛血清均购自Gibco公司,硫代硫酸盐、柠檬酸盐胆盐蔗糖琼脂培养基(TCBS)购自广东环凯微生物公司;氯霉素(Cm)、卡那霉素(Kan)均为Invitrogen公司产品。
1.2 引物设计 缺失株、互补株引物设计是根据GenBank上副溶血性弧菌RIMD2210633标准株的vp2918基因序列,用Primer 5软件设计引物(表 1),划线部分分别为BamH I、Sma I和Pst I限制性内切酶的酶切位点。引物由上海生工科技有限公司合成。
表 1. 本试验所用引物 Table 1. The primers used for gene mutant strain and complement strain in this study
| Primers | Sequences (5?→3?) | PCR product/bp |
| vp2918-A | CGCGGATCCCTCCCACTTGTTTCATTG | 666 |
| vp2918-B | ACCAAGCTAGTCTAGCAACAGTGATGT | |
| vp2918C | CTAGACTAGCTTGGTCACGATGAAGAAAACG | 547 |
| vp2918-D | TCCCCCGGGTTCATCCGCACAGTAG | |
| vp2918-E | TGTTGTTGCAGGAAGTGA | Wide type: 1959 Mutant: 1422 |
| vp2918-F | GTGTAGCAACCTCTTTCG | |
| sacB-F | ACGGCACTGTCGCAAACTATA | 600 |
| sacB-R | TTCCGTCACCGTCAAAGAT | |
| vp2918-PMMB-F | CGCGGATCCATGACGTTCTGTATTGATGG | 537 |
| vp2918- PMMB-R | AAAACTGCAGTTAGTTCCATGCCTGCTTAAG | |
| The underline indicates the enzyme digestion site. | ||
表选项
1.3 基因缺失株和互补株的构建 参照文献[16]的方法,利用同源重组技术构建基因缺失株。以野生株SH112株基因组为模板,用上游片段引物(vp2918-A/vp2918-B)和下游片段引物(vp2918-C/vp2918-D)分别扩增缺失目的基因上、下游同源臂。再以上、下游同源臂的PCR产物为模板,用vp2918-A/vp2918-D引物进行融合PCR,经酶切、连接后,将融合片段连接到pYAK1载体构建质粒pYAK1-vp2918,转入宿主菌CC118 λpir获得重组菌pYAK1-vp2918-CC118λpir。以pYAK1-VP2918-CC118λpir为供体菌、SH112株为受体菌、pRK2013-HB101为辅助菌进行接合转导。用引物vp2918-E/F筛选、鉴定不含氯霉素抗性基因的缺失株,将成功缺失vp2918并经sacB-F/R扩增无目的条带的菌株命名为Δvp2918。
以SH112基因组为模板,以VP2918-pMMB-F/R为引物,PCR扩增含vp2918基因的开放性阅读框(open reading frame,ORF)片段,回收PCR产物,对目的片段和pMMB207质粒进行双酶切、连接后转化感受态细胞CC118λpir中,于含Cm的LB平板上培养8–12 h。挑取单克隆以VP2918-pMMB- F/R为引物,进行PCR鉴定,将成功构建的互补质粒命名为pMMB-vp2918。含互补质粒pMMB207-vp2918的CC118λpir菌为供体菌,pRK2013-HB101菌为辅助菌,Δvp2918缺失株为受体菌,同1.3方法,进行重组接合试验。在氯霉素的TCBS平板培养,挑取疑似阳性的单克隆菌株,以VP2918-pMMB-F/R为引物作PCR鉴定,阳性互补株命名为CΔVP2918。
1.4 生长曲线、运动性及生物被膜形成能力的测定 将野生株、缺失株和互补株在含有3% NaCl的LB培养基(pH 7.2)中培养,待菌液培养至对数生长期后,转接至100 mL含有3% NaCl的LB中,每隔1 h取各菌液200 μL利用分光光度仪测定各自的吸光度,并绘制各菌株在含3% NaCl的LB培养基中的生长曲线。
取1 μL上述菌液于运动培养基(0.3%琼脂、3% NaCl-LB半固体培养基)上,37 ℃恒温正置培养4–5 h,观察细菌从中央向周围的泳动情况,并进行测量、拍照。
为评价上述菌株生物被膜形成情况,将200 μL (OD600=1.0)菌液分别加至96孔板中,加入3% NaCl-LB液体培养基200 μL/孔作为阴性对照孔,置于37 ℃恒温箱静置培养48 h后弃去96孔板上的细菌培养物上清,并用无菌1×PBS (pH 7.2)清洗2次除去浮游菌体,用200 μL 100%甲醇固定15 min,空气自然风干。随后,加入200 μL的1%结晶紫染色15 min,弃去多余结晶紫,用双蒸水(ddH2O)冲洗3次,待完全干燥后,每孔加入200 μL 95%酒精溶液溶解结晶紫,10 min后用多功能酶标仪测量OD595。每种菌株重复接种8孔,各自取平均值,测定生物被膜的形成情况。
1.5 细胞黏附试验 用含10%胎牛血清的DMEM培养基培养HeLa细胞于24孔板内,待单层细胞布满孔底部90%时,用DMEM洗涤2次后,待用。将野生株、缺失株和互补菌株培养至对数生长期,再用DMEM培养基洗2次并重悬,均以感染率(multiplicity of infection,MOI)为10:1 (菌数: 细胞数)感染HeLa细胞,每孔加200 μL,重复3个孔,置于37 ℃、5% CO2细胞培养箱中孵育1 h。用PBS洗1次,每孔加100 μL预冷的0.5% (体积分数)TritonX-100裂解细胞,作用10 min。最后用无菌的PBS倍比稀释裂解液,并涂布于含有3% NaCl的LB琼脂平板,37 ℃培养过夜,记录单菌落数,计算各细菌株的相对黏附率。
1.6 细胞毒性测定 将HeLa细胞在96孔细胞培养板上培养,用PBS洗涤3遍,每孔加入50 μL不含酚红的DMEM。将野生株、缺失株和互补菌株培养至对数生长期,用PBS洗涤重悬后,加入50 μL的菌液(MOI分别为1:1、1:10和1:100)至上述细胞孔中作为实验孔,重复6个孔。同时设立100 μL的DMEM作为细胞自发对照孔,取90 μL DMEM加10 μL裂解液作为最大释放孔,于37 ℃、5% CO2的细胞培养箱中分别孵育1.5 h。利用CytoTox96试剂盒检测细胞上清中乳酸脱氢酶(LDH)的释放,参照说明书计算各细菌感染HeLa细胞后LDH释放的百分比。
1.7 小鼠存活实验和细菌组织载菌量测定 为了评价vp2918基因缺失对小鼠存活的影响,参照Hiyoshi的方法[17]选用4周龄的ICR小鼠平均分成4组(野生株SH112,Δvp2918,CΔvp2918,空白组),每组6只。将各菌液用生理盐水洗3遍后重悬,100 μL腹腔接种到小鼠体内(5×107 CFU/只)来测定存活曲线;空白组注射相同剂量的无菌生理盐水。从接种后开始计时,连续观察48 h,按孙氏改良寇式法计算SH112、Δvp2918、CΔvp2918对小鼠的存活曲线。
将4周龄ICR小鼠分成4组(野生株SH112,Δvp2918,CΔvp2918,空白组),每组5只,各菌株腹腔注射1×107 CFU/只,空白组注射相同剂量的无菌生理盐水。15 h时后,小鼠眼球摘除采血致死,并浸润于75%酒精中,无菌解剖取其组织研磨。将研磨好的组织用PBS倍比稀释100–104倍,取100 μL接种到TCBS琼脂平板中,次日对平板中的副溶血弧菌数量进行计数,计算各菌株在ICR小鼠肝组织、脾组织中的细菌载量。
1.8 数据分析 实验数据采用GraphPad Prism8软件进行统计分析。单因素方差分析(one-way ANOVA)用于分析运动性和生物膜形成、细胞黏附、组织载菌量测定的数据,双因素方差分析(two-way ANOVA)分析细胞毒性测定数据,用平均数±标准差(X±SD)表示,P < 0.05认为变化显著。使用非参数Mann-Whitney U检验分析小鼠存活实验。
2 结果和分析 2.1 VP2918基因缺失株及互补株鉴定 对野生株SH112、Δvp2918、CΔvp2918进行PCR鉴定,结果见图 1。以野生株DNA为模板,引物vp2918-E/F可以扩增到大小约为1959 bp的条带(泳道1),以缺失株Δvp2918的DNA为模板扩增则只能获得1422 bp大小的条带(泳道2);进一步使用针对vp2918的特异性引物VP2918-pMMB-F/R进行PCR检测,结果表明野生株能够扩增到目的条带(泳道4),而缺失株对应泳道(泳道5)未见相应条带,表明Δvp2918缺失株构建成功。以SH112的DNA为模板,用引物vp2918-E/F能扩增到1422 bp的短条带(泳道3),用VP2918-pMMB-F/R引物能扩增到vp2918目的基因(泳道6),表明互补株CΔvp2918构建成功。
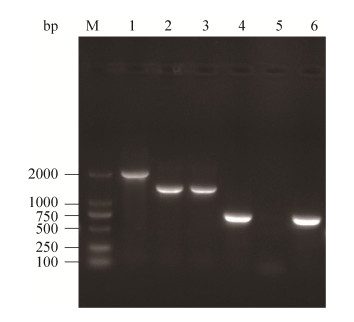 |
| 图 1 VP2918基因缺失株和互补株的PCR鉴定 Figure 1 Identification of vp2918 gene mutant strain and complement strain of V. parahaemolyticus by PCR. M: DL2000; 1–3: SH112 DNA, vp2918 mutant DNA and the DNA of positive complement strain were amplified with primer vp2918-E/F; 4–6: SH112 DNA, vp2918 mutant DNA and the DNA of positive complement strain were amplified with primer vp2918-pMMB-F/R. |
| 图选项 |
2.2 生长曲线、运动性及生物被膜形成能力的测定 野生株SH112、缺失株Δvp2918及互补株 CΔvp2918的生长曲线(图 2)、运动性(图 3-A,3-B) 和生物被膜形成能力(图 4-A,4-B)检测结果表明,各菌株间无显著差异(P > 0.05),表明vp2918的缺失不影响副溶血弧菌的生长能力、运动性及生物被膜形成能力。
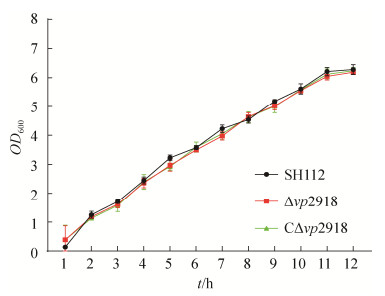 |
| 图 2 各菌株生长曲线测定 Figure 2 Growth curve detection of SH112, Δvp2918 and CΔvp2918 strains. |
| 图选项 |
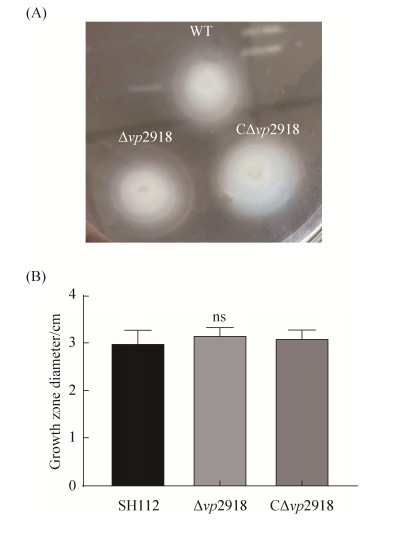 |
| 图 3 运动性分析 Figure 3 Motility analysis of SH112, Δvp2918 and CΔvp2918 strains. A: The swimming patterns of three strains were exhibited in 0.3% agar-3% NaCl-LB plates for 4 h; B: Motility zone diameter (cm) was used to compare the differences in the movement of the strains. ns: P > 0.05. |
| 图选项 |
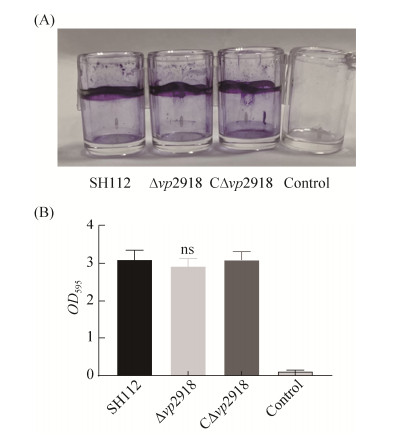 |
| 图 4 各菌株生物被膜形成能力比较 Figure 4 Biofilm formation ability of SH112, Δvp2918 and CΔvp2918 strains. A: The strains were grown in LBN at room temperature, and crystal violet staining was performed at 48 hours; B: Data and error bars were showed to assess biofilm biomass on glass from three independent experiments, each with three replications. ns: P > 0.05. |
| 图选项 |
2.3 对HeLa细胞的黏附能力 对HeLa细胞的黏附结果表明,与野生株比较,缺失株Δvp2918的黏附能力没有明显差异(图 5),表明缺失vp2918基因并不影响副溶血弧菌对HeLa细胞的黏附能力(P > 0.05)。
 |
| 图 5 各菌株对HeLa细胞的黏附作用 Figure 5 Adhesion to HeLa cell monolayers of the strains. ns: P > 0.05. |
| 图选项 |
2.4 细胞毒性测定 如图 6所示,缺失株与野生株对细胞的毒性差异显著(*P<0.05),推测VP2918在副溶血弧菌对宿主细胞感染过程中发挥重要作用。
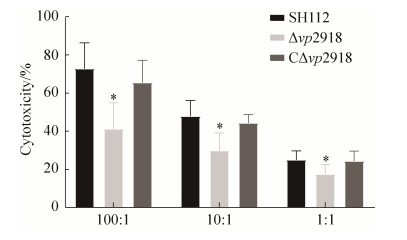 |
| 图 6 各菌株对HeLa细胞的细胞毒性影响 Figure 6 Cytotoxic effects of the SH112, △vp2918 and C△vp2918 strains on HeLa cells. *: P < 0.05. |
| 图选项 |
2.5 小鼠的存活实验 将各菌株以每只5×107 CFU的量腹腔注射试验组小鼠,结果表明(图 7),SH112、Δvp2918和CΔvp2918对小鼠的致死率分别为100%、67%和83%。感染野生株小鼠的死亡时间主要集中在10–24 h,野生株攻毒5 h后的小鼠表现出扎堆颤抖、不喜动的特征,在10–20 h后出现眼球干燥、行动不协调、粪便黏稠等临床症状,并很快死亡;缺失株感染组小鼠集中发病时间在12–24 h内,与野生株感染组相比临床症状相对较轻;而互补株CΔvp2918恢复了大部分野生株的毒力,小鼠具有较明显的临床症状。以上结果表明vp2918基因缺失后能降低副溶血弧菌对小鼠的毒性作用。
 |
| 图 7 各菌株攻毒ICR小鼠后的存活率 Figure 7 The survival rate of ICR mice infected with the SH112, Δvp2918 and CΔvp2918 strains. |
| 图选项 |
2.6 细菌组织载菌量实验 以每只1×107 CFU的量感染ICR小鼠15 h时检测细菌组织载量,结果显示(图 8),感染15 h后缺失株在心脏、脾脏及部分肝组织的细菌定殖数量明显低于野生株(*P < 0.05,**P < 0.005)。互补株定植能力基本恢复到野生株水平,表明缺失vp2918降低VP在小鼠组织中的定殖能力。
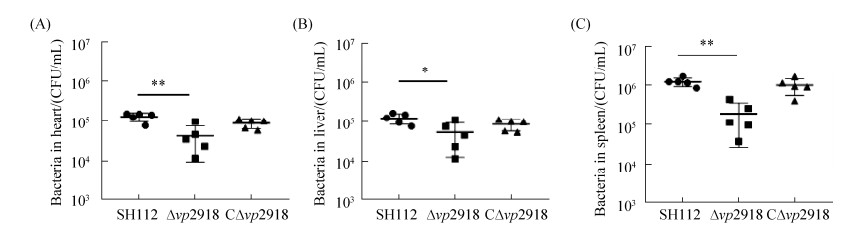 |
| 图 8 各菌株在小鼠心脏(A)、肝(B)和脾组织(C)中的细菌载量 Figure 8 Bacterial loads in heart (A), liver (B) and spleen (C) of infected mice. |
| 图选项 |
3 讨论 副溶血性弧菌不仅严重影响水产养殖业的健康发展,还是人类健康的重大威胁,对该菌致病机制的研究非常重要。副溶血弧菌能够在全球范围内流行,与毒力因子的作用密切相关[18–20]。已有报告表明副溶血弧菌T6SS-2参与细胞黏附和细胞自噬等过程[11–12],与细菌毒力相关。
本实验室前期通过差异蛋白质组学技术比较分析野生株SH112和T6SS-2主要结构基因缺失株ΔdotU2的差异分泌蛋白,选择了其中一个编码未知蛋白的基因vp2918进行深入研究,经在线网站TMHMM Server v. 2.0预测,该基因是一个含有跨膜区域的膜蛋白。膜蛋白位于细菌病原表面,与外界具有广泛接触的机会,在微生物的许多关键生物学功能中发挥重要作用[21]。本研究构建了vp2918基因缺失株和互补株,并比较野生株和缺失株的生物学特性和致病性的差异。细菌的运动性和生物被膜可增强菌体对不利因素的抵抗能力,趋向有益刺激或逃避有害刺激[22–23],研究结果发现缺失vp2918基因不影响副溶血性弧菌的生长特性,同时也不影响副溶血性弧菌运动性和生物被膜的形成能力,提示vp2918基因可能不参与副溶血弧菌在环境中的生存能力。
黏附、定殖或入侵宿主细胞是细菌感染宿主的重要步骤,与细菌的致病机制密切相关[8, 24–25]。本研究发现VP2918不参与副溶血弧菌对HeLa细胞黏附过程,但是在不同感染比下(图 6),vp2918基因缺失株对HeLa细胞的毒性作用均显著低于野生株(P < 0.05),证明VP2918与副溶血弧菌对HeLa细胞的毒性作用密切相关。细菌对细胞产生毒性作用有利于其在宿主体内定殖和侵袭,进而产生致病作用。我们通过对小鼠存活率试验发现,感染vp2918基因缺失株小鼠表现的症状比野生株明显较轻, 且死亡率(67%)低于野生株(100%)。小鼠体内细菌载量结果进一步表明,vp2918基因缺失导致细菌在小鼠组织中的定殖能力显著低于野生株。通过以上实验我们推测,缺失vp2918基因降低了副溶血弧菌对宿主细胞的毒力,进而易被宿主清除,所以在组织中的定殖能力显著降低,进而使得感染小鼠存活率高于野生株和互补株。革兰氏阴性菌的膜蛋白在细菌定殖和侵袭等致病过程中扮演重要角色[26–28]。如铜绿假单胞菌OprG蛋白是OmpW家族的成员之一,在细菌感染早期参与病原破环宿主细胞的过程,缺失该基因后铜绿假单胞菌对细胞的毒性作用显著降低[29]。本实验室前期研究也发现缺失外膜蛋白OmpA基因的副溶血弧菌的毒力也明显下降[30],而且小鼠免疫保护实验结果表明该蛋白可提供一定的免疫保护作用[31]。
本研究通过对vp2918基因缺失株进行生物学特性和致病性分析,表明vp2918基因缺失对副溶血弧菌的基本生物学特性无显著影响,但参与细胞毒性和组织定殖等致病过程,从而影响细菌对小鼠的毒力作用,在副溶血弧菌的致病过程中发挥一定作用。本研究不仅可为副溶血弧菌减毒疫苗开发奠定基础,也可为探讨副溶血性弧菌致病作用的分子机制提供参考。
References
| [1] | Letchumanan V, Chan KG, Lee LH. Vibrio parahaemolyticus: a review on the pathogenesis, prevalence, and advance molecular identification techniques. Frontiers in Microbiology, 2014, 5: 705. |
| [2] | Elmahdi S, DaSilva LV, Parveen S. Antibiotic resistance of Vibrio parahaemolyticus and Vibrio vulnificus in various countries: a review. Food Microbiology, 2016, 57: 128-134. DOI:10.1016/j.fm.2016.02.008 |
| [3] | Farisa Banu S, Rubini D, Murugan R, Vadivel V, Gowrishankar S, Pandian SK, Nithyanand P. Exploring the antivirulent and sea food preservation efficacy of essential oil combined with DNase on Vibrio parahaemolyticus. LWT, 2018, 95: 107-115. DOI:10.1016/j.lwt.2018.04.070 |
| [4] | Lei T, Jiang FF, He M, Zhang JM, Zeng HY, Chen MT, Pang R, Wu S, Wei L, Wang J, Ding Y, Wu QP. Prevalence, virulence, antimicrobial resistance, and molecular characterization of fluoroquinolone resistance of Vibrio parahaemolyticus from different types of food samples in China. International Journal of Food Microbiology, 2020, 317: 108461. DOI:10.1016/j.ijfoodmicro.2019.108461 |
| [5] | O'Boyle N, Boyd A. Manipulation of intestinal epithelial cell function by the cell contact-dependent type Ⅲ secretion systems of Vibrio parahaemolyticus. Frontiers in Cellular and Infection Microbiology, 2014, 3: 114. |
| [6] | Daniels NA, MacKinnon L, Bishop R, Altekruse S, Ray B, Hammond RM, Thompson S, Wilson S, Bean NH, Griffin PM, Slutsker L. Vibrio parahaemolyticus infections in the United States, 1973-1998. The Journal of Infectious Diseases, 2000, 181(5): 1661-1666. DOI:10.1086/315459 |
| [7] | Tena D, Arias M, álvarez BT, Mauleón C, Jiménez MP, Bisquert J. Fulminant necrotizing fasciitis due to Vibrio parahaemolyticus. Journal of Medical Microbiology, 2010, 59(Pt 2): 235-238. |
| [8] | Ghenem L, Elhadi N, Alzahrani F, Nishibuchi M. Vibrio parahaemolyticus: a review on distribution, pathogenesis, virulence determinants and epidemiology. Saudi Journal of Medicine & Medical Sciences, 2017, 5(2): 93-103. |
| [9] | Alcoforado Diniz J, Liu YC, Coulthurst SJ. Molecular weaponry: diverse effectors delivered by the Type Ⅵ secretion system. Cellular Microbiology, 2015, 17(12): 1742-1751. DOI:10.1111/cmi.12532 |
| [10] | Tang JY, Bullen NP, Ahmad S, Whitney JC. Diverse NADase effector families mediate interbacterial antagonism via the Type Ⅵ secretion system. Journal of Biological Chemistry, 2018, 293(5): 1504-1514. DOI:10.1074/jbc.RA117.000178 |
| [11] | Yu Y, Fang LH, Zhang Y, Sheng HX, Fang WH. VgrG2 of Type Ⅵ secretion system 2 of Vibrio parahaemolyticus induces autophagy in macrophages. Frontiers in Microbiology, 2015, 6: 168. |
| [12] | Yu Y, Yang H, Li J, Zhang PP, Wu BB, Zhu BL, Zhang Y, Fang WH. Putative Type Ⅵ secretion systems of Vibrio parahaemolyticus contribute to adhesion to cultured cell monolayers. Archives of Microbiology, 2012, 194(10): 827-835. DOI:10.1007/s00203-012-0816-z |
| [13] | Li P, Kinch LN, Ray A, Dalia AB, Cong Q, Nunan LM, Camilli A, Grishin NV, Salomon D, Orth K. Acute hepatopancreatic necrosis disease-causing Vibrio parahaemolyticus strains maintain an antibacterial Type Ⅵ secretion system with versatile effector repertoires. Applied and Environmental Microbiology, 2017, 83(13): e00737-e00717. |
| [14] | Wang L, Zhou DS, Mao PY, Zhang YQ, Hou J, Hu Y, Li J, Hou SJ, Yang RF, Wang RH, Qiu JF. Cell density- and quorum sensing-dependent expression of Type Ⅵ secretion system 2 in Vibrio parahaemolyticus. PLoS ONE, 2013, 8(8): e73363. DOI:10.1371/journal.pone.0073363 |
| [15] | 白雪瑞. Ⅵ型分泌系统2及Ⅲ型分泌系统对副溶血弧菌生物学特性和致病性的影响. 南京农业大学硕士学位论文, 2017. |
| [16] | Bai XR, Wang Q, Ling J, Wan Y, Chen YJ, Fang WH, Sun WD, Jiang A. Comparison of biological characteristics and cytopathogenicities between T3SS1 and T3SS2 in Vibrio parahaemolyticus. Acta Microbiologica Sinica, 2018, 58(3): 455-466. (in Chinese) 白雪瑞, 王权, 凌娇, 万莹, 陈永军, 方维焕, 孙卫东, 蒋蔚. T3SS1和T3SS2影响副溶血弧菌生物学特性及细胞致病性的比较. 微生物学报, 2018, 58(3): 455-466. |
| [17] | Hiyoshi H, Kodama T, Iida T, Honda T. Contribution of Vibrio parahaemolyticus virulence factors to cytotoxicity, enterotoxicity, and lethality in mice. Infection and Immunity, 2010, 78(4): 1772-1780. DOI:10.1128/IAI.01051-09 |
| [18] | Jiang YH, Chu YB, Xie GS, Li FL, Wang LZ, Huang J, Zhai YX, Yao L. Antimicrobial resistance, virulence and genetic relationship of Vibrio parahaemolyticus in seafood from coasts of Bohai Sea and Yellow Sea, China. International Journal of Food Microbiology, 2019, 290: 116-124. DOI:10.1016/j.ijfoodmicro.2018.10.005 |
| [19] | Li YP, Xie TF, Pang R, Wu QP, Zhang JM, Lei T, Xue L, Wu HM, Wang J, Ding Y, Chen MT, Wu S, Zeng HY, Zhang YX, Wei XH. Food-borne Vibrio parahaemolyticus in China: prevalence, antibiotic susceptibility, and genetic characterization. Frontiers in Microbiology, 2020, 11: 1670. DOI:10.3389/fmicb.2020.01670 |
| [20] | Chaban B, Hughes HV, Beeby M. The flagellum in bacterial pathogens: For motility and a whole lot more. Seminars in Cell & Developmental Biology, 2015, 46: 91-103. |
| [21] | Corbeil LB. Histophilus somni surface proteins. Current Topics in Microbiology and Immunology. Cham: Springer International Publishing, 2015: 89-107. |
| [22] | Han DS, Yu F, Chen X, Zhang R, Li JM. Challenges in Vibrio parahaemolyticus infections caused by the pandemic clone. Future Microbiology, 2019, 14: 437-450. DOI:10.2217/fmb-2018-0308 |
| [23] | Santhakumari S, Nilofernisha NM, Ponraj JG, Pandian SK, Ravi AV. In vitro and in vivo exploration of palmitic acid from Synechococcus elongatus as an antibiofilm agent on the survival of Artemia franciscana against virulent vibrios. Journal of Invertebrate Pathology, 2017, 150: 21-31. DOI:10.1016/j.jip.2017.09.001 |
| [24] | Yang H, de Souza Santos M, Lee J, Law HT, Chimalapati S, Verdu EF, Orth K, Vallance BA. A novel mouse model of enteric Vibrio parahaemolyticus infection reveals that the type Ⅲ secretion system 2 effector VopC plays a key role in tissue invasion and gastroenteritis. mBio, 2019, 10(6): e02608-19. |
| [25] | Zhang LL, Orth K. Virulence determinants for Vibrio parahaemolyticus infection. Current Opinion in Microbiology, 2013, 16(1): 70-77. DOI:10.1016/j.mib.2013.02.002 |
| [26] | Zhou Y, Zhou J, Wang D, Gao Q, Mu X, Gao S, Liu X. Evaluation of ompA and pgtE genes in determining pathogenicity in Salmonella enterica serovar Enteritidis. The Veterinary Journal, 2016, 218: 19-26. DOI:10.1016/j.tvjl.2016.10.009 |
| [27] | Hejair HMA, Zhu YC, Ma JL, Zhang Y, Pan ZH, Zhang W, Yao HC. Functional role of ompF and ompC porins in pathogenesis of avian pathogenic Escherichia coli. Microbial Pathogenesis, 2017, 107: 29-37. DOI:10.1016/j.micpath.2017.02.033 |
| [28] | Maiti B, Dubey S, Munang'Andu HM, Karunasagar I, Karunasagar I, Evensen ?. Application of outer membrane protein-based vaccines against major bacterial fish pathogens in India. Frontiers in Immunology, 2020, 11: 1362. DOI:10.3389/fimmu.2020.01362 |
| [29] | McPhee JB, Tamber S, Bains M, Maier E, Gellatly S, Lo A, Benz R, Hancock REW. The major outer membrane protein OprG of Pseudomonas aeruginosa contributes to cytotoxicity and forms an anaerobically regulated, cation-selective channel. FEMS Microbiology Letters, 2010(2): 241-247. |
| [30] | Bai XR, Wang Q, Chen YJ, Wan Y, Ling J, Wang YL, Jiang W. Biological characteristics and pathogenicity of an ompA mutant of Vibrio parahaemolyticus. Journal of Nanjing Agricultural University, 2018, 41(5): 902-910. (in Chinese) 白雪瑞, 王权, 陈永军, 万莹, 凌娇, 王亚磊, 蒋蔚. 副溶血弧菌ompA基因缺失株的生物学特性及致病性分析. 南京农业大学学报, 2018, 41(5): 902-910. |
| [31] | Wang YL, Wang Q, Bai XR, Bie CN, Chen ZG, Han XG, Jiang W. Expression and immunological characterization of the OmpA protein from Vibrio parahaemolyticus strain SH112. Acta Microbiologica Sinica, 2019, 59(10): 1937-1947. (in Chinese) 王亚磊, 王权, 白雪瑞, 别闯南, 陈兆国, 韩先干, 蒋蔚. 副溶血弧菌SH112株OmpA蛋白的高效表达及免疫学特性. 微生物学报, 2019, 59(10): 1937-1947. |
