聂细荣1,2, 薛明洋2, 林格2, 李逸群2, 范玉顶2, 刘文枝2, 孟彦2, 江南2, 曾令兵2, 周勇2


1. 上海海洋大学水产与生命学院, 上海 201306;
2. 中国水产科学研究院长江水产研究所, 湖北 武汉 430223
收稿日期:2020-12-02;修回日期:2021-01-09;网络出版日期:2021-01-28
基金项目:国家重点研发计划(2019YFD0900105);国家自然科学基金(31802346);国家大宗淡水鱼类产业技术体系建设专项资金(CARS-45-16);湖北省技术创新专项(2018ABA101)
*通信作者:周勇, Tel: +86-27-81785198;Fax: +86-27-81780088;E-mail: zhouy@yfi.ac.cn.
摘要:[目的] 鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus 2,CyHV-2)感染养殖鲫引起的鲫造血器官坏死病,给鲫养殖业造成了重大的经济损失。揭示CyHV-2感染宿主细胞的机制,是建立鲫造血器官坏死病有效防治技术的重要基础。[方法] 本研究针对CyHV-2富含抗原表位的ORF25B区域设计引物,扩增ORF25B基因截短序列。将扩增产物克隆至酵母双杂交诱饵载体pGBKT7,构建诱饵载体pGBKT7-tORF25B,转化至酵母菌株Y2H Gold中。在营养缺陷型培养基上,验证诱饵表达载体pGBKT7-tORF25B对酵母菌Y2H Gold自激活现象和毒性作用。利用酵母双杂交技术,将诱饵菌株pGBKT7-tORF25B/Y2H Gold与鲫脑组织细胞系(GiCB)cDNA文库杂交。[结果] ORF25B基因截短序列扩增大小约为981 bp,成功构建了诱饵菌株pGBKT7-tORF25B/Y2H Gold,自激活和毒性验证结果表明,诱饵表达载体对酵母菌株无自激活现象,也无毒性作用,初步筛选出4种与tORF25B基因编码蛋白互作的宿主蛋白。[结论] 本研究结果为深入开展CyHV-2 ORF25B编码蛋白功能及病毒入侵宿主细胞的机制研究奠定了重要基础。
关键词:鲤疱疹病毒Ⅱ型ORF25B基因酵母双杂交诱饵载体互作蛋白
Construction of a bait vector and preliminary screening of host proteins interacting with Cyprinid herpesvirus 2 ORF25B using yeast two hybrid system
Xirong Nie1,2, Mingyang Xue2, Ge Lin2, Yiqun Li2, Yuding Fan2, Wenzhi Liu2, Yan Meng2, Nan Jiang2, Lingbing Zeng2, Yong Zhou2


1. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China;
2. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Science, Wuhan 430223, Hubei Province, China
Received: 2 December 2020; Revised: 9 January 2021; Published online: 28 January 2021
*Corresponding author: Yong Zhou, Tel: +86-27-81785198; Fax: +86-27-81780088; E-mail: zhouy@yfi.ac.cn.
Foundation item: Supported by the National Key R&D Program of China (2019YFD0900105), by the the National Natural Science Foundation of China (31802346), by the the Earmarked Fund for China Agriculture Research System (CARS-45-16) and by the Key Project of Scientific & Technological Innovation of Hubei Province (2018ABA101)
Abstract: [Objective] The hemopoietic necrosis disease of Carassius auratus gibelio infected by Cyprinid herpesvirus 2 (CyHV-2) has caused huge economic losses to the farming industry of this fish. To reveal the mechanism of CyHV-2 infecting host cells might provide an important basis for the investigations of prevention and control technology for this disease. [Methods] In this study, we designed primers for the epitope rich region of CyHV-2 ORF25B, and amplified truncated ORF25B gene by polymerase chain reaction (PCR). Next, we cloned the amplified product into yeast two hybrid bait expression vector pGBKT7. Then the bait recombinant vector pGBKT7-tORF25B was constructed and we transformed it into yeast Y2H Gold. In addition, we detected the transcriptional self-activation and toxicity of the bait protein on the auxotroph medium. Using yeast two hybrid technique, we hybridized the bait strain pGBKT7-tORF25B/Y2H Gold with GiCB cDNA library. [Results] The truncated ORF25B gene was about 981 bp. It was suggested that the bait strain pGBKT7-tORF25B/Y2H Gold was obtained. And the bait vector was shown to have no toxicity to the yeast cells and no self-activation phenomenon to the report genes. There were four candidate host proteins interacting with tORF25B gene coded protein were preliminarily obtained. [Conclusion] The results of this study have laid a foundation for further study on the protein function of CyHV-2 ORF25B and the mechanism of this virus invasion into host cells.
Keywords: Cyprinid herpesvirus 2ORF25B geneyeast two hybridbait vectorinteracted protein
鲫(Carassius auratus),具有食性广、生长迅速、适应性强、繁育能力高等优点,其肉质鲜嫩,营养价值丰富,深受人们喜爱[1]。2019年我国鲫的养殖产量为275.56万t,占淡水养殖总产量比例为9.14%[2]。然而,随着养殖规模的扩大,集约化程度升高,病害问题成为制约我国鲫养殖产业健康发展的主要瓶颈[3-5]。其中,鲫造血器官坏死病的危害最为严重,其病原为鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus 2,CyHV-2)[6-7]。CyHV-2,又称为疱疹病毒性造血器官坏死症病毒(Herpesviral haemat-opoietic necrosis virus,HVHNV)[8],或金鱼造血器官坏死症病毒(Goldfish haematopoietic necrosis virus,GFHNV)[9],为疱疹病毒目(Herpesvirale)、异疱疹病毒科(Alloherpesviridae)、鲤疱疹病毒属(Cyprinivirus)成员[10]。CyHV-2是双链DNA病毒,有囊膜,病毒直径约175–200 nm,核衣壳呈正二十面体对称,直径为100–110 nm[11]。CyHV-2全基因组测序最先于2013年报道,病毒全长290304 bp,预测的开放阅读框(Open reading frame,ORF)约150个(序列号:JQ815364),这150个ORF编码了病毒所有的结构和功能蛋白[11]。通过对鲤疱疹病毒属3种病毒基因组比较和功能预测分析发现,它们都含有ORF2、TNFR、ORF25和RING四个重要的多基因家族。CyHV-2 ORF25多基因家族成员有ORF25、ORF25B、ORF25C和ORF25D,均编码囊膜蛋白,含有免疫球蛋白结构域[11]。将CyHV-2 ORF25编码基因进行截短原核表达,制备抗ORF25的多克隆抗体,该抗体能特异性识别在鲫脑组织细胞系(Gibel carp brain,GiCB)上增殖的CyHV-2[12]。通过免疫金标记和电镜观察发现,CyHV-2 ORF25基因编码蛋白能与GiCB细胞受体发生特异结合[13]。许晨等[14]利用酵母双杂交技术初步筛选出与CyHV-2 ORF25编码蛋白相互作用的宿主细胞受体RACK1基因。目前对ORF25多基因家族的研究主要集中在ORF25基因[12-16],而尚未见关于ORF25B基因及其编码蛋白功能的研究。
本文通过分析CyHV-2 ORF25B的抗原表位,以富含抗原表位区域的基因序列为靶点,构建酵母双杂交诱饵载体pGBKT7-tORF25B,将诱饵载体转化酵母菌株Y2H Gold后,验证其自激活及毒性。利用酵母双杂交技术,将诱饵菌株pGBKT7-tORF25B/Y2H Gold与GiCB cDNA文库杂交,初步筛选出与ORF25B发生互作的宿主细胞蛋白,以期为深入开展CyHV-2 ORF25B蛋白功能及其与宿主细胞的相互作用机制的研究奠定基础。
1 材料和方法 1.1 材料与主要试剂 酵母双杂交GiCB cDNA文库由本实验室建立并保存[14, 17];病毒样品来源于本实验室采集的CyHV-2阳性鲫组织;X-α-Gal、Aureobasidin A、酵母培养基等均购于美国Clontech公司;大肠杆菌感受态DH5α、pMD19-T载体、PCR反应体系的整套试剂及DNA marker购于宝日医生物技术(北京)有限公司;Y2H Gold酵母感受态和Y187酵母感受态购于上海唯地生物技术有限公司;酵母质粒提取试剂盒购于北京索莱宝科技有限公司;病毒核酸提取试剂盒、质粒提取试剂盒购于美国Omega Bio-Tek公司;限制性内切酶EcoR I、BamH I购于美国New England Biolabs (NEB)公司。
1.2 引物设计与合成 利用TMHMM Server v.2.0、SignaIP 5.0、DNA Star 7.0 (Protean)等生物信息学软件对CyHV-2 (登录号:KM200722.1) ORF25B基因序列进行综合分析,选取该序列一段富含抗原表位的基因设计特异扩增引物tORF25B-F/tORF25B-R,分别在上下游引物加入EcoR I、BamH I等酶切位点和保护碱基;同时设计载体pGBKT7 (5′T7/3′BD)、pGADT7 (5′T7/3′AD)通用引物,以上引物均由武汉天一华煜基因科技有限公司合成(表 1)。
表 1. tORF25B基因扩增引物及pGBKT7、pGADT7通用引物 Table 1. Primers for tORF25B gene amplification and general primers for pGBKT7 and pGADT7
| Primer name | Primer sequence (5′→3′) | Restriction enzyme | Purpose |
| tORF25B-F | CCGGAATTCGAAGTCAACAACGGATCAACTC | EcoR I | Amplification of tORF25B gene |
| tORF25B-R | CGCGGATCCCCTGGATCTCGTCCCCGTCG | BamH I | |
| 5′T7 | TAATACGACTCACTATAGGGCGAGC | General primers (pGBKT7, pGADT7) | |
| 3′BD | TTTTCGTTTTAAAACCTAAGAGTC | ||
| 3′AD | AGATGGTGCACGATGCACAGTT | ||
| The double underline of primer sequence is the restriction site. | |||
表选项
1.3 CyHV-2 tORF25B基因克隆 采用病毒提取试剂盒提取CyHV-2病毒DNA,并进行PCR扩增。25 μL PCR反应体系为:10×Buffer 2.5 μL,tORF25B-F/tORF25B-R引物各0.5 μL,10 mmol/L dNTP Mix 2 μL,病毒总DNA模板1 μL,Taq DNA聚合酶0.25 μL,ddH2O 18.25 μL。PCR反应程序为:95 ℃ 5 min;95 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。将扩增产物进行琼脂糖凝胶电泳,切胶回收目的条带。
1.4 pGBKT7-tORF25B诱饵载体构建 将回收产物tORF25B连接到pMD19-T载体,形成pMD19-T-tORF25B克隆,通过菌落PCR检测获得的阳性克隆送公司测序。提取该阳性质粒,分别用限制性内切酶BamH I和EcoR I对获得的pMD19-T-tORF25B质粒和诱饵载体pGBKT7进行双酶切。琼脂糖凝胶电泳分析酶切结果,回收双酶切完全的tORF25B和pGBKT7后用T4连接酶进行16 ℃过夜连接。连接产物转化至感受态E. coli DH5α后,将菌液涂布在含有卡那霉素的LB平板上筛选重组阳性克隆。利用pGBKT7通用引物(5′T7/3′BD)和tORF25B-F/R特异性引物进行菌落PCR检测,同时进行双酶切验证。将鉴定条带大小正确的质粒送公司测序,测序正确命名为pGBKT7-tORF25B。
1.5 诱饵载体转化酵母菌株Y2H Gold 按照YeastmakerTM Transformation System 2 protocol操作要求,取40 μL Carrier DNA放入沸水中水浴5 min后,迅速插入冰盒中静置冷却,重复一次使其彻底变性。取4支无菌的1.5 mL EP管,每管分别加入2–5 μg诱饵质粒pGBKT7- tORF25B、阳性对照质粒pGBKT7-53、阴性对照质粒pGBKT7-lam、pGADT7-T,各加入100 μL冰上融化的酵母感受态细胞(pGBKT7载体系列用Y2H Gold酵母感受态,pGADT7-T用Y187酵母感受态),Carrier DNA 10 μL,PEG/LiAc 600 μL并轻柔混匀,30 ℃水浴30 min,再将EP管放入42 ℃水浴锅中孵育15 min,期间翻转EP管数次进行混匀。8000 r/min离心2 min,弃上清直至200 μL重悬,涂布于相应的培养皿上,转入Y2H Gold的菌液涂于SD/-Trp缺陷培养平板上,Y187菌液涂布于SD/-Leu缺陷培养平板上,28 ℃培养箱恒温倒置培养48–96 h。
1.6 诱饵载体自激活活性和毒性检测 按照酵母双杂交融合步骤,将阳性对照菌株pGBKT7-53/Y2H Gold和阴性对照菌株pGBKT7- lam/Y2H Gold分别与pGADT7-T/Y187进行杂交融合,构成双杂阳性对照菌株53×T和双杂阴性对照菌株lam×T。将转化后的重组菌株pGBKT7- tORF25B/Y2H Gold、阴性对照lam×T和阳性对照53×T以三等分在同一个培养板上划线,分别划于SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/ Aba三种缺陷平板上,倒置于28 ℃培养箱培养2–4 d,观察菌落生长情况与颜色变化,判断诱饵菌株的自激活情况。同时将它们按10–1等比稀释4个梯度(10–1–10–4),分别取100 μL菌液涂布于SD/-Trp营养缺陷平板上,观察在相同浓度下其生长状态,检测诱饵菌株有无毒性作用。
1.7 文库的多态性检测 鲫鱼脑组织细胞系cDNA文库由本实验室制备并保存[14],复苏后涂布于SD/-Leu缺陷营养平板上,以检测其滴度。随机挑取24个单菌落,摇菌提取酵母核酸,用通用引物pGADT7 (5′T7/ 3′AD)进行菌落PCR,检测文库的多态性。
1.8 互作蛋白筛选及比对分析 参照Clontech酵母双杂交的操作步骤,将pGBKT7-tORF25B/Y2H Gold诱饵菌株与GiCB cDNA文库杂交融合,杂交后的菌液涂于双缺SD/-Leu/-Trp/X-α-Gal/AbA (DDO/X/A)培养板上,28 ℃培养48–96 h,待长出蓝色菌落,将其挑到SD/-Ade/-His/-Leu/-Trp/X-α-Gal/AbA (QDO/X/A)四缺培养板上,继续培养2–4 d,观察菌落生长状态。挑取四缺培养平板上的蓝色菌落进行摇菌提取质粒,用文库引物pGADT7和诱饵通用引物pGBKT7 (表 1)对质粒进行PCR扩增。扩增产物电泳后,将2对引物同时扩增为阳性条带的PCR产物送公司测序。将测序结果在NCBI里进行BlAST比对及开放阅读框分析,初步筛出与CyHV-2 ORF25B互作的细胞受体蛋白基因。
2 结果和分析 2.1 tORF25B基因扩增 以感染CyHV-2患病鲫组织中提取的病毒DNA为模板,tORF25B-F/tORF25B-R为引物进行PCR扩增,扩增产物电泳结果显示,扩增片段的大小约为981 bp (ORF25B截短基因片段大小为963 bp,引物两端的酶切位点和保护性碱基为18 bp),条带符合预期大小(图 1)。
 |
| 图 1 tORF25B基因序列扩增 Figure 1 PCR amplification of tORF25B gene sequence. M: DL2000 marker; lane 1: truncated tORF25B gene; lane 2: negative control. |
| 图选项 |
2.2 诱饵载体pGBKT7-tORF25B的构建 将回收的tORF25B产物连接到载体pMD19-T上,挑菌PCR检测结果符合预期条带,且测序结果比对正确,成功构建了pMD19-T-tORF25B重组质粒。将pMD19-T-tORF25B与pGBKT7的双酶切产物连接转化后,利用pGBKT7 (5′T7/3′BD)通用引物和tORF25B-F/R特异性引物进行菌落PCR,获得大小分别约为1257 bp和981 bp的目的条带,与预期条带大小一致,且双酶切鉴定条带大小也与预期大小一致(图 2)。阳性测序结果与GenBank公布的CyHV-2 ORF25B基因序列比对完全一致。上述结果均表明,已成功构建了诱饵质粒pGBKT7-tORF25B。
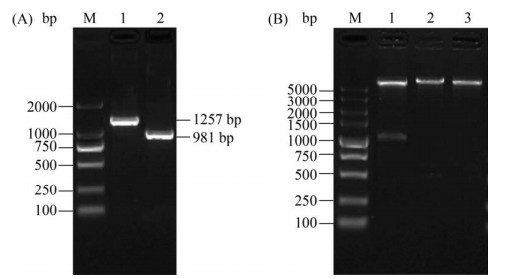 |
| 图 2 重组质粒pGBKT7-tORF25B PCR (A)和双酶切鉴定(B) Figure 2 PCR amplification and digestion identification of pGBKT7-tORF25B. A: PCR amplification of pGBKT7-tORF25B. M: DL2000 marker; lane 1: general primer amplification of pGBKT7-tORF25B; lane 2: specific primer amplification of pGBKT7-tORF25B. B: digestion identification of pGBKT7-tORF25B. M: DL5000 marker; lane 1: digestion of pGBKT7-tORF25B with BamH I and EcoR I; lane 2: identification of BamH I digestion; lane 3: PCR of EcoR I digestion. |
| 图选项 |
2.3 诱饵质粒pGBKT7-tORF25B的表达鉴定 将诱饵质粒pGBKT7-tORF25B转化至酵母菌株Y2H Gold后,挑取单菌落摇菌扩大培养,提取酵母总核酸,用5′T7/3′BD和tORF25B-F/R特异性引物对其进行PCR,扩增获得大小分别约为1257 bp和981 bp的目的条带,且序列比对正确,证明成功获得了重组菌株pGBKT7-tORF25B/ Y2H Gold (图 3)。
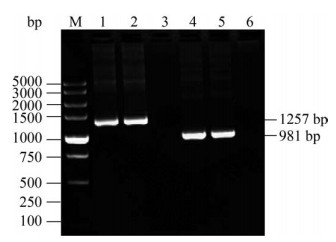 |
| 图 3 pGBKT7-tORF25B酵母转化菌株的PCR检测 Figure 3 Colony PCR result of yeast transformed plasmid pGBKT7-tORF25B. M: DL5000 marker; lane 1: general primer amplification of pGBKT7-tORF25B in Y2H Gold; lane 2: general primer amplification of positive control; lane 3: general primer amplification of negative control; lane 4: specific primer amplification of pGBKT7-tORF25B in Y2H Gold; lane 5: specific primer amplification of positive control; lane 6: specific primer amplification of negative control. |
| 图选项 |
2.4 诱饵载体自激活活性和毒性检测 将成功转化的重组菌株pGBKT7-tORF25B/ Y2H Gold与阴性对照lam×T和阳性对照53×T以三等分分别划线于SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/Aba三种选择性平板,结果显示在SD/-Trp培养皿上3种菌体均长出白色菌落;在X-α-Gal的诱导下,只有阳性对照菌株53×T长出蓝色菌落,而诱饵菌株pGBKT7-tORF25B/ Y2H Gold和阴性对照菌株lam×T均生长出白色菌落,且在加了Aba的SD/-Trp缺陷培养基上诱饵菌株不能生长,如图 4,表明诱饵菌株pGBKT7- tORF25B无自激活现象。
 |
| 图 4 pGBKT7-tORF25B诱饵菌株自激活验证 Figure 4 Autoactivation detection of pGBKT7-tORF25B in Y2H Gold. 1: SD/-Trp medium; 2: SD/-Trp/X-α-Gal medium; 3: SD/-Trp/X-α-Gal/Aba medium. A: 53×T; B: lam×T; C: pGBKT7-tORF25B. |
| 图选项 |
将重组菌株pGBKT7-tORF25B/Y2H Gold与阴性对照lam×T和阳性对照53×T按10–1–10–4倍浓度稀释,分别涂布在SD/-Trp营养缺陷平板上,结果显示在10–4倍梯度下,三种菌株都能肉眼分辨出每个单克隆菌落,其诱饵菌株pGBKT7-tORF25B与阴性对照lam×T和阳性对照53×T菌株在培养板上生长状态良好,菌落大小与数量均差别不大,表明构建的诱饵菌株无毒性(图 5)。
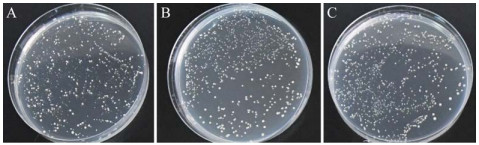 |
| 图 5 pGBKT7-tORF25B毒性验证试验 Figure 5 Toxicity detection of recombinant bait plasmid pGBKT7-ORF25B. A: pGBKT7-tORF 25B; B: lam×T; C: 53×T. |
| 图选项 |
2.5 文库的多态性检测 将实验室保藏的酵母双杂交GiCB cDNA文库复苏后,测得滴度为1.92×106 CFU/mL。从涂布有文库菌液的平板中随机挑取的24株单菌落提取酵母质粒,用5′T7/3′AD引物进行PCR扩增,结果显示产物条带大小上下交错,且大多数在1.0 kb以上(图 6),证明文库具有较好的多态性。
 |
| 图 6 菌落PCR鉴定文库多态性 Figure 6 PCR detection of polmorphism of library. M: DL 2000 marker; lane 1–24: identification of libraby amplification products. |
| 图选项 |
2.6 文库筛选及序列比对 用GiCB cDNA酵母双杂交文库与诱饵菌株pGBKT7-tORF25B进行双杂交,将在双缺培养平板DDO/X/A生长出的阳性蓝斑挑取到四缺平板QDO/X/A反复加压筛选2–3次,最终获得23个阳性克隆(图 7)。提取酵母双杂阳性质粒,经诱饵通用引物5′T7/3′BD鉴定无误后,再用文库通用引物pGADT7鉴定条带分布大小,其电泳结果显示23株阳性克隆大小约750–2000 bp (图 8),将PCR产物送公司测序,测序结果进行BLAST比对及ORF分析,成功初步筛出4种与鱼类相关的互作蛋白基因序列(表 2),分别为RPL6、RPL6L、RHPN1和ALAS1。
 |
| 图 7 QDO/X/A四缺培养基双杂后的阳性菌落 Figure 7 The positive strains of hybridization on QDO/X/A medium. |
| 图选项 |
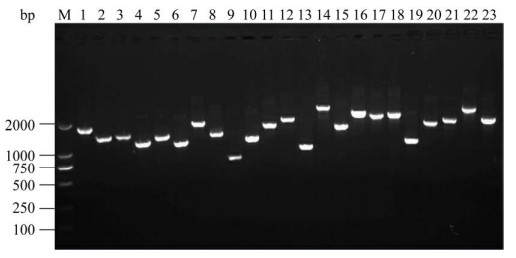 |
| 图 8 酵母双杂质粒PCR初步筛选结果 Figure 8 Yeast plasmid PCR confirmation of positive interactions. M: DL 2000 marker; lane 1–23: positive colony PCR products. |
| 图选项 |
表 2. 与tORF25B蛋白互作的基因 Table 2. Interacting genes with tORF25B protein
| The interacting proteins | GenBank accession No. |
| Danio rerio ribosomal protein L6 (RPL6) | BC093106.1 |
| Carassius auratus 60S ribosomal protein L6-like (RPL6L) | LOC113052749 |
| Carassius auratus rhophilin Rho GTPase binding protein 1 (RHPN1) | XM_026290459.1 |
| Carassius auratus 5′-aminolevulinate synthase 1 (ALAS1) | XM_026240821.1 |
表选项
3 讨论 CyHV-2感染鲫、金鱼及其变种,其引起的疾病流行于世界各地,通常暴发于春秋两季,传播速度快、致死率高达百分之百[3-8]。CyHV-2有6个多基因家族,包括ORF2、ORF22、ORF25、ORF153、TNFR和RING家族。其中ORF25家族编码高度分化的预测1型膜糖蛋白,目前针对ORF25家族的其他成员均有报道,如Zhou等[13]在毕赤酵母中表达了tORF25、tORF25C和tORF25D蛋白,Cao等[18]在利用杆状病毒表达系统表达的9种截短CyHV-2膜糖蛋白中也包含这3个蛋白。上述两个研究报告均发现,在ORF25家族中,ORF25、ORF25C和ORF25D均有一定的免疫原性,可作为潜在候选疫苗。ORF25B作为ORF25家族一员,不同毒株间存在部分碱基突变或缺失,推测这些基因序列多样性可能展示CyHV-2进化史的动态特征[10],目前鲜见关于ORF25B的研究报道。抗原表位是决定抗原特异性的化学基团,也是蛋白质抗原性的基础[19]。本研究通过生物信息学软件分析CyHV-2 ORF25B的抗原表位,截短表达其富含抗原表位的区域,利用酵母双杂交技术,初步筛选出ORF25B的细胞受体,不仅为鲫造血器官坏死病亚单位疫苗靶位点的选择提供数据支撑,也为阐明CyHV-2感染宿主的机理奠定重要基础。
酵母双杂交系统是Fields和Song发明的一种具有很高灵敏性的研究蛋白质间关系的技术[20],该技术目前已在分析已知蛋白间的互作和发现新基因等方面得到广泛运用[21-23]。但酵母双杂交无法避免的缺陷是高假阳性和假阴性结果,而诱饵靶蛋白自激活是造成假阳性结果的主要原因[24-25]。为排除该诱饵菌株具有自激活活性的可能性,本研究将pGBKT7-tORF25B/Y2H Gold涂布在X-α-Gal底物的SD/-Trp缺陷培养基上,发现菌落颜色无变蓝现象,亦不能在SD/-Trp/X- α-Gal/Aba上诱饵菌株生长,表明该诱饵菌株无激活活性,若诱饵菌株和阳性对照菌株53×T一样在底物X-α-Gal的诱导下呈蓝色,且在有Aba抗性的SD/-Trp平板上生长,说明该诱饵菌株存在自激活现象。当诱饵质粒对酵母菌株有毒性作用时,酵母生长速度缓慢或不能生长,此时会对实验结果造成假阴性影响[26]。双杂阴性对照lam×T和阳性对照53×T菌株本身不具有毒性,本研究在SD/-Trp营养缺陷培养平板上,显示出诱饵菌株pGBKT7-tORF25B/Y2H Gold与阴性对照lam×T和阳性对照53×T的菌落大小及数量差异不显著,证明了pGBKT7-tORF25B质粒对酵母菌Y2H Gold的生长无毒性作用。本研究排除了诱饵载体pGBKT7-tORF25B毒性和自激活带来的干扰,可用于下一步筛选酵母双杂交GiCB cDNA文库。
文库质量的好坏对诱饵蛋白的成功筛选十分关键[27],许晨等[14]构建的酵母双杂交GiCB cDNA文库滴度为1.24×106 CFU/mL,插入文库片段大小约为1.5 kb。本研究通过对该文库复苏涂于SD/-Leu平板测得其滴度为1.92×106 CFU/mL,随机挑菌,提取酵母质粒扩增显示文库插入条带大小大多数在1.0 kb以上,多态性较好,符合双杂文库构建要求。利用酵母双杂交GiCB cDNA文库,许晨等[14]筛出CyHV-2 ORF25的受体蛋白RACK1基因。本研究利用该文库,通过对CyHV-2 tORF25B互作蛋白的筛选,在QDO/X/A平板上筛选出23株阳性克隆菌株,其中有19个基因序列或因碱基缺失导致翻译后的氨基酸序列太短,或因起始端编码基因序列移码与宿主细胞氨基酸序列不匹配而被排除。本实验最终初步成功筛选出4种与CyHV-2 tORF25B互作的候选宿主蛋白,分别为核糖体蛋白L6 (ribosomal protein L6,RPL6)、60S核糖体蛋白L6L (60S ribosomal protein L6-like,RPL6L)、Rho蛋白1 (rhophilin Rho GTPase binding protein 1,RHPN1)、5-氨基酮戊酸合成酶(5′-aminolevulinate synthase 1,ALAS1)。
本研究构建了诱饵质粒pGBKT7-tORF25B,证明了诱饵质粒对酵母菌Y2H Gold无毒性和自激活性。利用酵母双杂交技术筛选出4种与ORF25B互作的宿主蛋白基因,研究结果为进一步揭示ORF25B与宿主细胞的相互关系、阐明CyHV-2感染鲫鱼细胞的机制奠定前期基础。
References
| [1] | Zhang JF, Qi TT, Dong CJ, Li XJ. Development of phylogenetic relationship of different crucian carp (Carassius auratus) strains in China. Henan Shuichan, 2018(3): 25-27. (in Chinese) 张江凡, 齐甜甜, 董传举, 李学军. 中国不同鲫鱼品系系统发育关系研究进展. 河南水产, 2018(3): 25-27. |
| [2] | 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2020中国渔业统计年鉴. 北京: 中国农业出版社, 2020. |
| [3] | Fichi G, Susini F, Cocumelli C, Cersini A, Salvadori M, Guarducci M, Cardeti G. New detection of Cyprinid herpesvirus 2 in mass mortality event of Carassius carassius, (L.), in Italy. Journal of Fish Diseases, 2016, 39(12): 1523-1527. DOI:10.1111/jfd.12495 |
| [4] | Luo YZ, Lin L, Liu Y, Wu ZX, Gu ZM, Li LJ, Yuan JF. Haematopoietic necrosis of cultured Prussian carp, Carassius gibelio (Bloch), associated with Cyprinid herpesvirus 2. Journal of Fish Diseases, 2013, 36: 1035-1039. DOI:10.1111/jfd.12110 |
| [5] | Wang L, He JG, Liang LG, Zheng X, Xu P. Mass mortality caused by Cyprinid Herpesvirus 2 (CyHV-2) in Prussian carp (Carassius gibelio) in China. Bulletin- European Association of Fish Pathologists, 2012, 32: 164-173. |
| [6] | Xu J, Zeng LB, Zhang H, Zhou Y, Ma J, Fan YD. Cyprinid herpesvirus 2 infection emerged in cultured gibel carp, Carassius auratus gibelio in China. Veterinary Microbiology, 2013, 166(1/2): 138-144. |
| [7] | Daněk T, Kalous L, Vesely T, Krásová E, Reschová S, Rylková K, Kulich P, Petrtyl M, Pokorová D, Knytl M. Massive mortality of Prussian carp Carassius gibelio in the upper Elbe basin associated with herpesviral hematopoietic necrosis (CyHV-2). Diseases of Aquatic Organisms, 2012, 102(2): 87-95. DOI:10.3354/dao02535 |
| [8] | Jung SJ, Miyazaki T. Herpesviral haematopoietic necrosis of goldfish, Carassius auratus (L.). Journal of Fish Diseases, 1995, 18(3): 211-220. DOI:10.1111/j.1365-2761.1995.tb00296.x |
| [9] | Groff JM, LaPatra SE, Munn RJ, Zinkl JG. A viral epizootic in cultured populations of juvenile goldfish due to a putative herpesvirus etiology. Journal of Veterinary Diagnostic Investigation Official Publication of the American Association of Veterinary Laboratory Diagnosticians Inc, 1998, 10(4): 375-378. DOI:10.1177/104063879801000415 |
| [10] | Davison AJ, Eberle R, Ehlers B, Hayward GS, McGeoch DJ, Minson AC, Pellett PE, Roizman B, Studdert MJ, Thiry E. The order herpesvirales. Archives of Virology, 2009, 154(1): 171-177. DOI:10.1007/s00705-008-0278-4 |
| [11] | Davison AJ, Kurobe T, Gatherer D, Cunningham C, Korf I, Fukuda H, Hedrick RP, Waltzek TB. Comparative genomics of carp herpesviruses. Journal of Virology, 2013, 87(5): 2908-2922. DOI:10.1128/JVI.03206-12 |
| [12] | Zhou Y, Shi YH, Fan YD, Liu WZ, Jiang N, Zhao JQ, Xu C, Zeng LB. Polyclonal antibody preparation and immunogenicity analysis of the prokaryotically expressed Cyprinid herpesvirus Ⅱ ORF25 truncated protein. Freshwater Fisheries, 2018, 48(6): 40-45. (in Chinese) 周勇, 史玉恒, 范玉顶, 刘文枝, 江南, 赵建青, 许晨, 曾令兵. 鲤疱疹病毒Ⅱ型ORF25截短蛋白的多克隆抗体制备与免疫原性分析. 淡水渔业, 2018, 48(6): 40-45. DOI:10.3969/j.issn.1000-6907.2018.06.007 |
| [13] | Zhou Y, Jiang N, Ma J, Fan YD, Zhang LL, Xu J, Zeng LB. Protective immunity in gibel carp, Carassius gibelio of the truncated proteins of cyprinid herpesvirus 2 expressed in Pichia pastoris. Fish & Shellfish Immunology, 2015, 47(2): 1024-1031. |
| [14] | Xu C, Zhou Y, Shi YH, Fan YD, Liu WZ, Jiang N, Zhao JQ, Zeng LB. Construction and preliminary application of the yeast two-hybrid cDNA library from gibel carp brain cells. Freshwater Fisheries, 2019, 49(1): 27-32. (in Chinese) 许晨, 周勇, 史玉恒, 范玉顶, 刘文枝, 江南, 赵建青, 曾令兵. 鲫脑组织细胞系酵母双杂交cDNA文库的构建及初步应用. 淡水渔业, 2019, 49(1): 27-32. DOI:10.3969/j.issn.1000-6907.2019.01.005 |
| [15] | Zhou JX, Li XW, Zhu X, Wang H, Lv WL. Cloning and bioinformatics analysis of ORF25 gene of kio herpesvirus CJ strain. Chinese Journal of Veterinary Drug, 2012, 46(3): 1-4. (in Chinese) 周井祥, 李新伟, 朱霞, 王好, 吕文亮. 锦鲤疱疹病毒CJ株ORF25基因的克隆及生物信息学分析. 中国兽药杂志, 2012, 46(3): 1-4. DOI:10.3969/j.issn.1002-1280.2012.03.001 |
| [16] | Peng JJ, Zhang Q, Jia LL, Lin L, Yuan JF, Zeng LB, Zhou Y, Liu XQ. Prokaryotic expression and preparation of monoclonal antibody against ORF25 protein of cyprinid herpesvirus Ⅱ. Journal of Huazhong Agricultural University, 2017, 36(2): 96-101. (in Chinese) 彭俊杰, 张琪, 贾路路, 林蠡, 袁军法, 曾令兵, 周勇, 刘学芹. 鲤疱疹病毒Ⅱ型(CyHV-2) ORF25蛋白的原核表达及单克隆抗体的制备. 华中农业大学学报, 2017, 36(2): 96-101. |
| [17] | Ma J, Jiang N, LaPatra SE, Jin L, Xu J, Fan YD, Zhou Y, Zeng LB. Establishment of a novel and highly permissive cell line for the efficient replication of cyprinid herpesvirus 2 (CyHV-2). Veterinary Microbiology, 2015, 177(3): 315-325. |
| [18] | Cao ZW, Liu SJ, Nan H, Zhao KX, Xu XD, Wang GX, Ji H, Chen HY. Immersion immunization with recombinant baculoviruses displaying cyprinid herpesvirus 2 membrane proteins induced protective immunity in gibel carp. Fish & Shellfish Immunology, 2019, 93: 879-887. |
| [19] | Ghochikyan A, Petrushina I, Davtyan H, Hovakimyan A, Saing T, Davtyan A, Cribbs DH, Agadjanyan MG. Immunogenicity of epitope vaccines targeting different B cell antigenic determinants of human α-synuclein: feasibility study. Neuroscience Letters, 2014, 560: 86-91. DOI:10.1016/j.neulet.2013.12.028 |
| [20] | Fields S, Song O. A novel genetic system to detect protein-protein interactions. Nature, 1989, 340(6230): 245-246. DOI:10.1038/340245a0 |
| [21] | Fields S, Sternglanz R. The two-hybrid system: an assay for protein-protein interactions. Trends Genet, 1994, 10(8): 286-292. DOI:10.1016/0168-9525(90)90012-U |
| [22] | Chien CT, Bartel PL, Sternglanz R, Fields S. The two-hybrid system: A method to identify and clone genes for proteins that interact with a protein of interest. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88: 9578-9582. DOI:10.1073/pnas.88.21.9578 |
| [23] | Wang ZY, Liu QH, Lu CY, Huang J. Identification of the host interactors of wsvll2 of WSSV by yeast two-hybrid. Progress in Fishery Sciences, 2019, 40(4): 156-162. (in Chinese) 王中一, 刘庆慧, 卢翠玉, 黄倢. 利用酵母双杂交技术筛选与wsv112互作的宿主蛋白. 渔业科学进展, 2019, 40(4): 156-162. |
| [24] | Suter B, Kittanakom S, Stagljar I. Two-hybrid technologies in proteomics research. Current Opinion in Biotechnology, 2008, 19(4): 316-323. DOI:10.1016/j.copbio.2008.06.005 |
| [25] | Luban J, Golf SP. The yeast two-hybrid system for studying Protein-protein interaction. Current Opinion in Biotechnology, 1995, 6(1): 59-64. DOI:10.1016/0958-1669(95)80010-7 |
| [26] | Zhang D, Zhai YZ, Feng GH. Construction and identification of the bait vector containing the gene encoding HCV core protein in yeast two-hybrid system. Journal of Clinical and Experimental Medicine, 2014, 13(16): 1329-1331. (in Chinese) 张丹, 翟永贞, 冯国和. 丙型肝炎病毒核心蛋白酵母双杂交诱饵载体的构建及鉴定研究. 临床和实验医学杂志, 2014, 13(16): 1329-1331. DOI:10.3969/j.issn.1671-4695.2014.16.009 |
| [27] | Li YX, Li F, Zhou XL, Xie FL, Li YG. Screening proteins interacting with the outer membrane protein Opa22 in Mesorhizobium huakuii 7653R with bacterial two-hybrid library. Journal of Huazhong Agricultural University, 2014, 33(2): 28-33. (in Chinese) 李一星, 李芳, 周鑫兰, 谢福莉, 李友国. 利用细菌双杂交文库筛选华癸中慢生根瘤菌7653R中与外膜蛋白Opa22互作的蛋白. 华中农业大学学报, 2014, 33(2): 28-33. DOI:10.3969/j.issn.1000-2421.2014.02.005 |
