徐建中1

 , 刘洁1, 王颖妤1, 张伟国1, 刘立明1,2
, 刘洁1, 王颖妤1, 张伟国1, 刘立明1,2

1. 江南大学生物工程学院, 工业生物技术教育部重点实验室, 江苏 无锡 214122;
2. 江南大学食品科学与技术国家重点实验室, 江苏 无锡 214122
收稿日期:2020-11-26;修回日期:2021-02-03;网络出版日期:2021-06-11
基金项目:国家自然科学基金(31601459);国家双一流轻工业技术与工程一级学科计划(LITE2018-08)
*通信作者:徐建中, Tel/Fax: +86-510-85329312, E-mail: xujianzhong@jiangnan.edu.cn;
刘立明, Tel/Fax: +86-510-85197875, E-mail: mingLL@jiangnan.edu.cn.
摘要:[目的] 通过理性改造柠檬酸合酶(citrate synthase,CS)、丙酮酸脱氢酶系E1p(pyruvate dehydrogenase complex,PDHC,编码基因aceE)和ATP-柠檬酸裂解酶(ATP-Citrate lyase,ACL),有效供应胞内丙酮酸和乙酰-CoA,以提高L-亮氨酸产量。[方法] 以谷氨酸棒杆菌(Corynebacterium glutamicum)为底盘细胞,分析不同CS和PDHC酶活水平对L-亮氨酸合成的影响。随后,考查协同改造CS和PDHC或引入绿硫菌(Chlorobium tepidum)中ACL对L-亮氨酸合成的影响。[结果] 低强度的CS酶活(即重组菌XL-3 PdapA-R2gltA)有利于L-亮氨酸的合成,L-亮氨酸产量达到17.5±0.6 g/L。而改变PDHC酶活水平不利于L-亮氨酸的合成。此外,以启动子PdapA-R2控制CS表达,而以启动子PgapA控制PDHC表达时(即重组菌XL-4),可实现胞内丙酮酸和乙酰-CoA的有效供给,L-亮氨酸产量达到20.2±1.7 g/L,且显著降低副产物产量。若在重组菌XL-4中引入C.tepidum,ACL会显著抑制菌体生长而不利于L-亮氨酸合成,而引入到出发菌XL-3中因胞内丙酮酸和乙酰-CoA得到有效供给,目标重组菌XL-5 L-亮氨酸产量达到18.5±1.2 g/L,比出发菌株XL-3增加了14.2%。[结论] 重组菌XL-4中因协同控制CS和PDHC酶活,从而实现胞内丙酮酸和乙酰-CoA有效供给,促进L-亮氨酸的合成。该研究结果对后续利用代谢工程技术强化微生物合成L-亮氨酸等支链氨基酸具有重要的参考价值。
关键词:谷氨酸棒杆菌L-亮氨酸合成丙酮酸乙酰-CoA协同作用代谢工程
Pyruvate works synergistically with acetyl-CoA to boost L-leucine production
Jianzhong Xu1

 , Jie Liu1, Yingyu Wang1, Weiguo Zhang1, Liming Liu1,2
, Jie Liu1, Yingyu Wang1, Weiguo Zhang1, Liming Liu1,2

1. The Key Laboratory of Industrial Biotechnology of Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
2. State Key Laboratory of food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Received: 26 November 2020; Revised: 3 February 2021; Published online: 11 June 2021
*Corresponding author: Jianzhong Xu, Tel/Fax: +86-510-85329312, E-mail: xujianzhong@jiangnan.edu.cn;
Liming Liu, Tel/Fax: +86-510-85197875, E-mail: mingLL@jiangnan.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31601459) and by the National First-Class Discipline Program of Light Industry Technology and Engineering (LITE2018-08)*
Abstract: [Objective] Pyruvate and acetyl-CoA were efficiently supplied by modifying citrate synthase (CS), pyruvate dehydrogenase complex (PDHC) or ATP-citrate lyase (ACL), thus increasing the L-leucine production in C. glutamicum. [Methods] Firstly, the effects of CS and PDHC activity on L-leucine production were studied using C. glutamicum as chassis cells, and then the effects of co-modifying CS and PDHC as well as introduction of ACL from C. tepidum on L-leucine production were investigated. [Results] The strain with low activity of CS (i.e, C. glutamicum XL-3 PdapA-R2gltA) was beneficial to L-leucine production, and the yield of L-leucine was 17.5±0.6 g/L. However, changing the activity of PDHC is not conducive to L-leucine production. In addition, the strain with expression of CS under the weak promoter PdapA-R2 and expression of PDHC under the medium promoter PgapA (i.e., XL-4) produced 20.2±1.7 g/L of L-leucine. In addition, the yield of by-products in strain XL-4 was significantly decreased. Moreover, the ACL of Chlorobium tepidum was introduced into the recombinant strain XL-4, resulting in the low cell growth and L-leucine production. However, the production of L-leucine of recombinant strain with introduction of ACL in original strain XL-3 (i.e., XL-5) was significantly increased because of the efficient supply of pyruvate and acetyl-CoA. Recombinant strain XL-5 produced 18.5±1.2 g/L of L-leucine, which was 14.2% higher than that of the original strain XL-3. [Conclusion] Pyruvate and acetyl-CoA has been effectively in strain XL-4 by modifying citrate synthase (CS) and pyruvate dehydrogenase complex (PDHC), thus increasing the L-leucine production. Therefoere, the results of this study have important reference value for the following application of metabolic engineering to improve branched-chain amino acid producing strains.
Keywords: Corynebacterium glutamicumL-leucine productionpyruvateacetyl-CoAsynergymetabolic engineering
L-亮氨酸是人和动物自身不能合成而必须依靠外界供给的八大必需氨基酸之一,具有多种生理功能,在食品、动物饲料、化妆品和医药等行业都具有非常广泛的应用。另外,随着人们保健意识的增强,保健品行业对L-亮氨酸的需求也不断增加。从Calvo等首次运用发酵法生产L-亮氨酸至今,发酵法已发展成为生产L-亮氨酸的主要方法[1]。L-亮氨酸的生产菌种主要有乳糖发酵短杆菌(Brevibacterium lactofermentus)、钝齿棒杆菌(C. crenatum)和谷氨酸棒杆菌(C. glutamicum) 等[2]。随着代谢工程技术的发展,代谢工程育种已在多种氨基酸育种中成功应用[3-4],而在L-亮氨酸育种方面还比较落后。因此,利用代谢工程技术改进微生物L-亮氨酸生产性能和提高发酵过程经济性对弥补国内L-亮氨酸生产短板具有重要意义。
随着C. glutamicum的基因组被解析,利用棒杆菌属菌株发酵生产支链氨基酸的生物合成途径和调节机制也已经比较清晰。由图 1可知,以葡萄糖经糖酵解途径生成的丙酮酸为直接前体物,亮氨酸合成途径涉及七步酶促反应,与L-缬氨酸和L-异亮氨酸合成途径涉及相同酶催化的平行和支路反应[5]。现阶段,利用代谢工程技术对C. glutamicum进行改造主要集中在以下几个方面:(1) 解除合成途径中反馈调节或解除转录弱化,提高L-亮氨酸合成途径的效率[6];(2) 阻断副产物支路的通量,使更多代谢流流向L-亮氨酸合成途径[7];(3) 增强合成途径关键酶表达水平,提高L-亮氨酸前体物供应[8];(4) 提高菌株对L-亮氨酸耐受性和向胞外分泌的能力,解除L-亮氨酸的反馈调节作用[9-10];(5) 调控胞内氧化还原水平,提高L-亮氨酸合成效率[11]。上述代谢改造虽取得了较显著的成果,但研究主要围绕支链氨基酸合成的终端代谢途径的改造,而对于改造中心碳代谢途径来提高间接前体物的供给量的研究较少。
 |
| 图 1 以葡萄糖为碳源时C. glutamicum中L-亮氨酸生物合成途径 Figure 1 The biosynthetic pathway of L-leucine from glucose in C. glutamicum. The pathway introduced in C. gluamicum and the modified pathwaies are shown in blue arrows and red arrows, respectively. The bold arrows represent the enhanced pathwaies, and the dot arrows reprent the abridged pathwaies. The key enzymes and coding genes are marked on the lines side. Glc: glucose; PEP: phosphoenolpyruvate; Pyr: pyruvate; OAA: oxaloacetate; Ace-CoA: acetyl-CoA; Cit: citrate; 2-AL: 2-acetolactate; 2, 3-DHIV: 2, 3-dihydroxyl-isovalerate; 2-KIV: 2-ketoisovalerate; 2-IPM: 2-isopropyl-malate; L-Leu: L-leucine. |
| 图选项 |
丙酮酸是在中心碳代谢途径中有着承上启下作用的关键性中间产物,它不仅是糖酵解途径(EMP)的终产物和三羧酸循环(TCA)的底物,同时也是支链氨基酸合成的重要前体物(图 1)。此外,乙酰-CoA连接着中心碳代谢途径中EMP和TCA循环,也是L-亮氨酸合成中重要间接前体物,参与异丙基苹果酸合成酶催化的反应(图 1)。因此,丙酮酸和乙酰-CoA的有效利用直接影响到L-亮氨酸的合成代谢。有研究表明,敲除丙酮酸羧化酶(pyruvate carboxylase,PC)可以降低PC对TCA回补途径中的贡献,有利于丙酮酸的积累,从而促进L-亮氨酸的积累[11]。此外,众多文献指出,强化PC酶活力,有利于丙酮酸进入TCA回补途径合成草酰乙酸,而提高谷氨酸族氨基酸和天冬氨酸族氨基酸的合成[12-13]。针对提高乙酰-CoA供应的遗传改造大多集中在改造酵母菌合成非氨基酸产品,如异丙醇[14]和类异戊二烯[15]。需要指出的是,丙酮酸和乙酰-CoA在L-亮氨酸合成过程中具有重要作用,但是针对两者有效供应的研究却很少。围绕上述问题,本研究通过启动子工程调节丙酮酸脱氢酶系E1p (pyruvate dehydrogenase complex,PDHC,编码基因aceE)和柠檬酸合酶(citrate synthase,CS,编码基因gltA)的酶活力以及引入绿硫菌(Chlorobium tepidum)中ATP-柠檬酸裂解酶(ATP-citrate lyase,ACL,编码基因aclBA),维持胞内丙酮酸和乙酰-CoA的有效供应,提高L-亮氨酸的产量。结果表明,引入外源柠檬酸裂解酶或结合调控PDHC和CS的酶活力有利于L-亮氨酸的合成。
1 材料和方法 1.1 主要试剂 胰蛋白胨、酵母提取物和脑心浸出液购自英国Oxoid公司。质粒提取试剂盒、胶回收试剂盒、DNA聚合酶、DNA Marker和异丙基-β-D-硫代吡喃半乳糖苷(IPTG)购自南京诺唯赞生物科技有限公司。各种限制性内切酶和DNA连接酶购自美国ThermoFisher Scientific公司。
1.2 菌株、质粒、引物和启动子序列 实验过程中涉及的菌株和质粒如表 1所示。出发菌株C. glutamicum XL-3是以课题组通过诱变育种得到的1株L-亮氨酸生产菌株C. glutamicum XQ-9为基础,敲除基因ltbR,同时将基因ilvC第34位、第48位和第49位氨基酸序列分别由S、L和R突变为G、E和F,且在lvE基因位点整合来源于Lysinibacillus sphaericus的基因leuDHLs和在gdh1基因位点整合来源于Bacillus subtilis的基因rocGBs。引物和启动子序列如表 2所示,并由苏州金唯智生物科技有限公司合成。
表 1. 本研究所用到的主要菌种和质粒 Table 1. The main strains and plasmids used in this study
| Strains and plasmids | Characters | References |
| C. glutamicum strains | ||
| ??XL-3 | XQ-9 ΔltbR ilvCS34G, L48E, K49F ΔilvE: : leuDHLs Δgdh: : rocGBs | [16] |
| ??XL-3 PxgltA | The native promoter of gene gltA was replaced by promoter Px in strain XL-3 chromosome | This study |
| ??XL-3 PxaceE | The native promoter of gene aceE was replaced by promoter Px in strain XL-3 chromosome (Px represents a serias of promoters with different transcriptional activity, and the promoters are listed in Table 2) | This study |
| ??XL-3 PxgltA PxaceE | The native promoter of genes gltA and aceE was replaced by promoter Px in strain XL-3 chromosome | This study |
| ??XL-3 PdapA-R2gltA PgapAaceE i.e., XL-4 | The native promoter of genes gltA and aceE was replaced by promoters PdapA-R2 and PgapA in strain XL-3 chromosome, respectively | This study |
| ??XL-3 ΔltbR: : aclBA i.e., XL-5 | Derivative of strain XL-3 with introduction of the optimized gene aclBA from C. tepidum in C. glutamicum ltbR gene loci | This study |
| Plasmids | ||
| ??pK18mobsacB | Integration vector | Stratagene |
| ??pEC-XK99E | Overexpression plasmid with Kan resistance and promoter Ptrc | Stratagene |
| ??pEC-aclBA | Overexpression of aclAB in pEC-XK99E | This study |
| ??pK18mobsacB-?ltbR: : aclBA | Integration vector for introduction of aclBA at ltbRgene loci | This study |
| ??pK18mobsacB-?P12gltA | Integration vector for knockout of the P1 and P2 promoter of the gltA gene | [12] |
| ??pK18mobsacB-?PaceE | Integration vector for knockout of the promoter of the aceE gene | This study |
| ??pK18mobsacB-ΔP12gltA: : Px | Integration vector for replacement of the nature promoter of gltA gene by promoter Px | This study |
| ??pK18mobsacB-ΔPaceE: : Px | Integration vector for replacement of the nature promoter of aceE gene by promoter Px | This study |
表选项
表 2. 本研究所用到的启动子和引物 Table 2. The promoters and pimer pairs used in this study
| Primer pairs | Sequence (5′→3′) | References |
| Promoters | ||
| ??PtacM | TGAGCTGTTGACAATTAATCATCGTGTGGTACCATGTGTGGAATTGTGAGCGGATAACAATT | [19] |
| ??Ptrc | TTGACAATTAATCATCCGGCTCGTAATG | |
| ??PgapA | GAATCCGCTGCAAAATCTTTGTTTCCCCGCTAAAGTTGGGGAC | [20] |
| ??PdapA-R2 | TAGGTTCCTTCCGGGGTTGTTTAACCCCCAAATGAGGGAAGAAGGTAACCTTGAACTCTA | |
| ??PdapA-C13 | TAGGTTATTTGCGGGGTTGTTTAACCCCCAAATGAGGGAAGAACGTAACCTTGAACTCTA | [21] |
| Primers | ||
| ??ltbRUp-F | CCCAAGCTTTCACAGTTGTCGCGCAG (Hind Ⅲ) | Deletion of ltbR gene |
| ??ltbRUp-R | AAGCTCACCTTGAATTTAGCATTTCACCC | |
| ??ltbRDn-F | CTCATGAGACAATAACCCTTCGACGCAC | |
| ??ltbRDn-R | CGCGGATCCGATCGGATTCCTGGCT (BamH Ⅰ) | |
| ??PtrcBA-F | ATTCAAGGTGAGCTTTTGACAATTAATCATCCGGCTCGTAATG | PCR for Ptrc-aclBA- rrnBT1T2 cassette |
| ??PtrcBA-R | GGGTTATTGTCTCATGAG | |
| ??aclA-F | ATGAGCATTCTCGCAAATAAAGATACCCGG | Verification of aclA gene |
| ??aclA-R | TTACTTCTTGTCGGGAACCGGGC | |
| ??gltAP12-L-F | CGGAATTCAAACATGCATAGCGTTTTCAATAGTTCGGTGTCG (EcoR Ⅰ) | [12] |
| ??gltAP12-L-R | CGGGATCCGGGCCTAGGGAAAGGATGATCTCGTA (BamH Ⅰ) | |
| ??gltAP12-R-F | CGGGATCCGTTTCTCGAGTGGGCCGAACAAATATGTTTGAAAGGAT (BamH Ⅰ) | [12] |
| ??gltAP12-R-R | CCCAAGCTTGCATGAACTGGGACTTGAAGTCCTC (Hind Ⅲ) | |
| ??PaceE-L-F | CGGGATCCTGCCTTGGTCTGCACGAGACCTGC (BamH Ⅰ) | PCR for promoter of aceE left arm, PaceE-L |
| ??PaceE-L-R | GCTCTAGACCGAAGATTTGTTTTACAGACTGTGACG (Xba Ⅰ) | |
| ??PaceE-R-F | GCTCTAGACCAACAGGAGGTGTGGAAATGGCCG (Xba Ⅰ) | PCR for promoter of aceE right arm, PaceE-R |
| ??PaceE-R-R | CCCAAGCTTACCGCGGACAGGTCCGTCGAGACGCTG (Hind Ⅲ) | |
| ??PtacM-F | TGAGCTGTTGACAATTAATCATCG | PCR verification |
| ??Ptrc-F | TTGACAATTAATCATCCGGC | PCR verification |
| ??PgapA-F | GAATCCGCTGCAAAATC | PCR verification |
| ??PdapA-R2-F | TAGGTTCCTTCCGGGGTTG | PCR verification |
| The letters with underline represent cleavage sites, and the inclined letters represent homologous sequences. | ||
表选项
1.3 培养条件与培养基 37 ℃、100 r/min下培养Escherichia coli,30 ℃、100 r/min下培养C. glutamicum。在特定条件下,添加50 μg/mL或加25 μg/mL卡那霉素(Kan)用于筛选E. coli和C. glutamicum重组菌株。
LB培养基(g/L):蛋白胨10、酵母提取物5、NaCl 10,pH 7.0。LBG培养基:LB培养基添加5 g/L葡萄糖。Epo培养基:LBG培养基添加30 g/L甘氨酸、4 g/L异烟肼和1 g/L吐温-80。LBHIS培养基:LB培养基添加91 g/L山梨醇和18.5 g/L脑心浸出液。种子培养基(g/L):葡萄糖30、玉米浆30、硫酸铵5、酵母浸膏10、柠檬酸钠10、K2HPO4·3H2O 1.3、MgSO4·7H2O 0.4、MnSO4·4H2O 0.01、L-蛋氨酸0.4、生物素2×10–4、硫胺素3×10–4。发酵培养基(g/L):葡萄糖130、玉米浆25、硫酸铵15、醋酸铵15、柠檬酸钠2、K2HPO4·3H2O 1.3、MgSO4·7H2O 0.5、L-蛋氨酸0.7、L-谷氨酸0.5、L-异亮氨酸0.06、MnSO4·H2O 0.01、生物素1×10–4、硫胺素2×10–4、CaCO3 30。所有培养基用20% (M/V) NaOH调节pH 7.0–7.2,并于121 ℃灭菌20 min,发酵培养基于115 ℃灭菌10 min。
1.4 质粒和菌株的构建方法 1.4.1 质粒pEC-aclBA和pK18mobsacB-?ltbR: :aclBA的构建: 根据来源于C. tepidum的ACL氨基酸序列[17],以谷氨酸棒状杆菌宿主作为标准经密码子优化后,在其编码基因上游加入C. glutamicum SD识别序列并通过基因合成的方法连接到质粒pEC-XK99E中,从而获得目的重组质粒pEC-aclBA。以质粒pEC-aclBA为模板和以PtrcBA-F/PtrcBA-R为引物进行PCR,获得aclBA基因表达框Ptrc-aclBA-rrnBT1T2。随后,进行融合PCR获得重组片段ltbRUp-Ptrc-aclBA-rrnBT1T2-ltbRDn[18]。最后,利用限制性内切酶Hind Ⅲ和BamH Ⅰ对质粒pK18mobsacB和片段ltbRUp-Ptrc- aclBA-rrnBT1T2 ltbRDn进行双酶切并酶连,获得目标重组质粒pK18mobsacB-?ltbR: : aclBA。
1.4.2 质粒pK18mobsacB-?PaceE、pK18mobsacB- P12gltA: : Px和pK18mobsacB-PaceE: : Px的构建: 以C. glutamicum XQ-9基因组为模板,利用引物对PaceE-L-F/PaceE-L-R和PaceE-R-F/PaceE-R-R分别扩增出aceE基因启动子上游片段PaceE-L和aceE基因启动子下游片段PaceE-R。利用限制性核酸内切酶BamH Ⅰ、Xba Ⅱ和Hind Ⅲ对片段PaceE-L和PaceE-R以及质粒pK18mobsacB进行酶切,酶切结束后回收线性化质粒。然后以PaceE-L和PaceE-R为DNA模板,线性化质粒pK18mobsacB为载体模板按照一定比例混匀进行无缝克隆连接,获得重组质粒pK18mobsacB-?PaceE。
根据表 2中启动子核酸序列通过基因合成得到不同强度的启动子(PtacM、Ptrc、PgapA、PdapA-R2和PdapA-C13),并且利用限制性核酸内切酶Xba Ⅰ和BamH Ⅰ将它们分别酶连到重组质粒pK18mobsacB-?PaceE和pK18mobsacB- ?P12gltA中,从而获得目的重组质粒pK18mobsacB- ΔPaceE: : Px和pK18mobsacB-ΔP12gltA: : Px。目标重组质粒的具体鉴定方法参照Wang等提出的方法进行[22]。
1.4.3 C. glutamicum重组菌株的构建: 将重组质粒pK18mobsacB-?ltbR: : aclBA、pK18mobsacB- ΔPaceE: : Px和pK18mobsacB-ΔP12gltA: : Px分别电转至C. glutamicum XL-3感受态细胞,并筛选出目标重组菌C. glutamicum XL-3 ΔltbR: : aclBA (即XL-5)、C. glutamicum XL-3 PxaceE和C. glutamicum XL-3 PxgltA。将重组质粒pK18mobsacB-ΔP12gltA: : Px电转至C. glutamicum XL-3 PxaceE感受态细胞中,并筛选出目标重组菌株C. glutamicum XL-3 PxaceE PxgltA。目标重组菌株的具体筛选和鉴定方法参照Wang等提出的方法进行[22]。将重组质粒pK18mobsacB-?ltbR: : aclBA电转至C. glutamicum XL-4感受态细胞中,并筛选出目标重组菌株C. glutamicum XL-4 ΔltbR: : aclBA。
1.5 酶活测定 参照王颖妤建立的方法破碎细胞获得细胞破碎液,然后通过离心得到的上清为粗酶液[14],该粗酶液被立即用于酶活性的测定。PDHC的酶活测定参照Blombach等建立的方法进行[23]。CS的酶活测定参照Xu等建立的方法进行[12],且参照Kim和Tabita建立的方法测定ACL的酶活力[17]。PDHC和ACL酶活单位定义为反应中每分钟消耗1 μmol NADH所需要的酶量。CS酶活单位定义为反应中每分钟消耗1 μmol乙酰-CoA所需要的酶量。
1.6 菌体生长情况的分析 将定时取样的发酵液用0.25 mol/L的稀盐酸溶液稀释26倍后,用紫外分光光度计测定OD562,具体测定方法参照王颖妤建立的方法进行[18]。
1.7 胞内乙酰-CoA的检测分析 参照Lian等建立的方法,收集破碎细胞[24],获得含有乙酰-CoA的上清液。随后,采用试剂盒Acetyl-CoA Assay Kit (Abcam, Cambridge,UK)特异性检测乙酰-CoA。具体步骤参考试剂盒说明书进行。
1.8 葡萄糖含量及产物浓度的测定 发酵液离心5 min (4 ℃、12000 r/min)后取上清并将其稀释100倍,通过生物传感分析仪SBA-40C测定发酵液中残留的葡萄糖含量,具体测定方法参照王颖妤建立的方法进行[18]。此外,发酵液稀释一定倍数后用0.25 μm滤膜过滤后利用高效液相色谱仪(HPLC)测定L-亮氨酸及其副产物(如L-缬氨酸、L-丙氨酸、丙酮酸和乙酸)的浓度,具体实验方法参照Feng等建立的方法进行[25]。
2 结果和分析 2.1 目的重组菌株的筛选与鉴定 参照“材料和方法”中论述的方法,构建了重组质粒pK18mobsacB-?ltbR: : aclBA、pK18mobsacB- ΔP12gltA: : Px和pK18mobsacB-ΔPaceE: : Px,并对候选重组质粒进行双酶切或PCR验证,从而确定目的重组质粒。从图 2-A可知,所选择的质粒都带有目的片段,为目的重组质粒。随后,参照“材料和方法”中论述的重组菌株方法,依次将目的重组质粒pK18mobsacB-?ltbR: : aclBA、pK18mobsacB- ΔP12gltA: : Px和pK18mobsacB-ΔPaceE: : Px电转至C. glutamicum感受态细胞中,通过二次同源重组筛选出目的重组菌株。经过PCR验证,确定目标重组菌株(图 2-B)。
 |
| 图 2 目的重组质粒和目的重组菌株的验证 Figure 2 Comfirmation of target plasmids (A) and recombinant strains (B). A: lane 1: pK18mobsacB- ?ltbR: : aclBA digested by Hind Ⅲ and BamH Ⅰ; lane 2–6: confirmation of pK18mobsacB-ΔP12gltA: : Px by PCR using Px-F/gltAP12-R-R as primer pairs; lane 7–11: confirmation of pK18mobsacB-ΔPaceE: : Px by PCR using Px-F/PaceE-R-R as primer pairs. B: lane 1–3: confirmation of strain XL-3 by PCR using Px-F/gltAP12-R-R, Px-F/PaceE-R-R and PtrcBA-F/PtrcBA-R as primer pairs, respectively; lane 4–5: confirmation of strain XL-4 by PCR using Px-F/gltAP12-R-R and Px-F/PaceE-R-R as primer pairs, respectively; lane 6: confirmation of XL-5 by PCR using PtrcBA-F/PtrcBA-R as primer pairs. |
| 图选项 |
2.2 调节柠檬酸合酶CS酶活性可调控乙酰-CoA积累量和菌体生长 我们前期研究发现,通过失活胞内PC和丙氨酸转移酶(AvtA),有利于胞内丙酮酸的积累,从而促进L-亮氨酸的合成[11]。这一结果表明,提高L-亮氨酸前体物丙酮酸的积累量有利于L-亮氨酸的合成。然而,L-亮氨酸合成过程中除了需要丙酮酸作为重要前体物外,乙酰-CoA也是重要的间接前体物(图 1)。为此,本研究首次通过调节柠檬酸合酶(CS)酶活性来调节乙酰-CoA的胞内积累量。CS是三羧酸循环中第一个限速酶,催化草酰乙酸耦合乙酰-CoA形成柠檬酸(图 1)。本研究选择不同转录强度的启动子来控制CS编码基因gltA的表达,获得一系列的重组菌株C. glutamicum XL-3 PxgltA(即XL-3 PtacMgltA、XL-3 PtrcgltA、XL-3 PgapAgltA、XL-3 PdapA-R2gltA和XL-3 PdapA-C13gltA)。上述重组菌株表现出不同的胞内CS酶活力(表 3),表明通过替换不同转录强度的启动子可以控制CS的表达水平,进而影响胞内CS酶活力。启动子强度越高,CS酶活力越强;启动子强度越低,CS酶活力越弱。
表 3. 重组菌和出发菌胞内CS比酶活力 Table 3. Specific activity of CS in recombinant and original strains
| C. glutamicum | XL-3 | XL-3 PtacMgltA | XL-3 PtrcgltA | XL-3 PgapAgltA | XL-3 PdapA-R2gltA | XL-3 PdapA-C13gltA |
| CS/(U/mg protein) | 1.87±0.13 | 2.69±0.20 | 2.28±0.25 | 1.98±0.14 | 0.21±0.02 | 0.07±0.01 |
表选项
为了确定出发菌株XL-3改造后是否改变了胞内乙酰-CoA水平,本文对出发菌株和重组菌株进行摇瓶发酵并测定胞内乙酰-CoA (发酵24 h) 及胞外L-亮氨酸含量(发酵72 h),结果如图 3所示。从图 3-A可以看出,不同重组菌株XL-3 PxgltA胞内乙酰-CoA水平不一,其中携带有超强启动子PtacM控制gltA表达的重组菌株(即XL-3 PtacMgltA)胞内乙酰-CoA水平最低(35.9±7.8 nmol/OD562),携带有超弱启动子PdapA-C13控制gltA表达的重组菌株(即XL-3 PdapA-C13gltA)胞内乙酰-CoA水平最高(222.5±17.3 nmol/OD562)。需要指出的是,重组菌株XL-3 PdapA-C13gltA菌体生长受到明显抑制,仅为出发菌株的37.6% (OD562=37.8±4.5 vs. OD562=14.2±1.6;图 3-B)。此外,由于不同重组菌株中胞内乙酰-CoA水平不同,不同重组菌株积累的L-亮氨酸也不同,其中携带有弱启动子PdapA-R2控制gltA表达的重组菌株(即XL-3 PdapA-R2gltA)中L-亮氨酸产量最高(17.5±0.6 g/L;图 3-C),比出发菌株增加了8%。
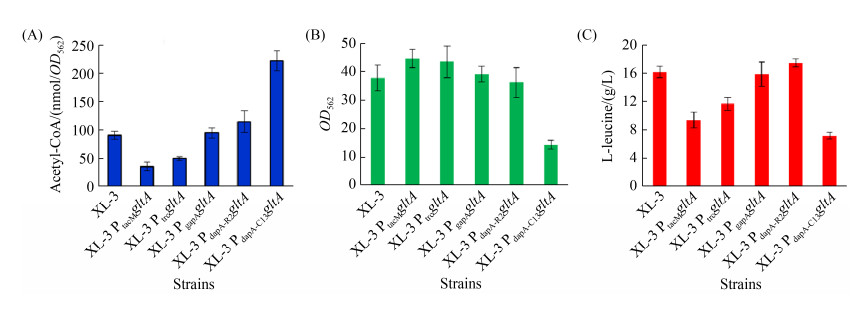 |
| 图 3 CS改造后不同菌株胞内乙酰-CoA水平(A)以及菌体生长(B)和L-亮氨酸发酵(C)情况 Figure 3 Acetyl-CoA (A), cell growth (B) and L-leucine production (C) of strains with modification of CS. |
| 图选项 |
2.3 丙酮酸脱氢酶系E1p参与调控乙酰-CoA积累量和菌体生长 C. glutamicum中除CS参与调控胞内乙酰-CoA水平外,丙酮酸脱氢酶系也参与调控胞内乙酰-CoA水平(图 1)。丙酮酸脱氢酶系是由丙酮酸脱氢酶(E1p;PDHC)、二氢硫辛酰胺转乙酰酶、二氢硫辛酸脱氢酶组成的酶系,催化丙酮酸氧化脱羧形成乙酰-CoA和释放1分子CO2[3]。有文献报道称,失活PDHC有利于支链氨基酸中L-缬氨酸的合成,其原因是因为可以提高胞内丙酮酸的供应[3]。然而,失活PDHC导致胞内无法合成乙酰-CoA,从而影响L-亮氨酸的合成。为了考察PDHC酶活力对L-亮氨酸合成的影响,本研究选择不同转录强度的启动子来控制PDHC编码基因aceE的表达,获得一系列的重组菌株C. glutamicum XL-3 PxaceE (即XL-3 PtacMaceE、XL-3 PtrcaceE、XL-3 PgapAaceE、XL-3 PdapA-R2aceE和XL-3 PdapA-C13aceE)。上述重组菌株表现出不同的胞内PDHC酶活力(表 4),表明通过替换不同转录强度的启动子可以控制PDHC的表达水平,进而影响胞内PDHC酶活力。启动子强度越高,PDHC酶活力越强;启动子强度越低,PDHC酶活力越弱。
表 4. 重组菌和出发菌胞内PDHC比酶活力 Table 4. Specific activity of PDHC in recombinant and original strains
| C. glutamicum | XL-3 | XL-3 PtacMaceE | XL-3 PtrcaceE | XL-3 PgapAaceE | XL-3 PdapA-R2aceE | XL-3 PdapA-C13aceE |
| PDHC/(mU/mg protein) | 94.3±5.2 | 146.2±11.8 | 129.5±13.4 | 105.4±10.2 | 15.7±1.6 | 4.5±0.6 |
表选项
PDHC是细胞生长的关键性酶,控制着TCA循环的入口(图 1)[3]。由于不同重组菌株胞内PDHC的酶活性不同,导致菌体胞内乙酰-CoA水平和菌体量不同(图 4-A、B)。从图 4-A、B可知,胞内PDHC酶活力越高,胞内乙酰-CoA水平越高,且菌体生长越好。然而,需要指出的是,胞内PDHC酶活力过高和过低都不利于L-亮氨酸的合成(图 4-C)。尽管重组菌株XL-3 PtacMaceE胞内乙酰-CoA水平最高(113.5±6.7 nmol/OD562),但胞外L-亮氨酸积累量显著降低(6.3±0.9 g/L)。当菌株携带有中等启动子PgapA控制aceE表达的重组菌株(即XL-3 PgapAaceE)时,其L-亮氨酸产量最高(15.7±1.5 g/L;图 4-C),但仍然比出发菌株XL-3低(15.7±1.5 g/L vs. 16.2±0.8 g/L)。结果表明单方面考虑增加或减弱PDHC的酶活来改变乙酰CoA的积累量并没有对L-亮氨酸的产量有积极的影响,因为酶PDHC的底物丙酮酸同样对L-亮氨酸的积累有重要的作用。
 |
| 图 4 PDHC改造后不同菌株胞内乙酰-CoA水平(A)以及菌体生长(B)和L-亮氨酸发酵(C)情况 Figure 4 Acetyl-CoA (A), cell growth (B) and L-leucine production (C) of strains with modification of PDHC. |
| 图选项 |
2.4 协同改造柠檬酸合酶和丙酮酸脱氢酶系E1p可有效供应胞内丙酮酸和乙酰-CoA 从图 3可知,适当的降低胞内CS酶活力,有利于胞内乙酰-CoA的积累,从而促进L-亮氨酸的合成。然而,虽然重组菌XL-3 PdapA-R2gltA中L-亮氨酸产量(17.5±0.6 g/L)高于重组菌XL-3 PdapA-C13gltA (7.2±0.7 g/L),但是单位菌体生产强度略低于XL-3 PdapA-C13gltA [0.48 g/(L·OD562) vs. 0.50 g/(L·OD562)]。这一结果表明,重组菌XL-3 PdapA-R2gltA可能因为胞内乙酰-CoA供应不足而影响L-亮氨酸的合成。此外,当提高胞内PDHC酶活力时,可以提高胞内乙酰-CoA的含量,但是也会促进菌体生长(图 4),其原因可能是更多的乙酰-CoA在CS催化下进入TCA循环,从而为菌体生长提供能源和四碳二羧酸[12]。但是,胞内PDHC酶活力过高,会降低胞内丙酮酸含量(表 5),从而影响L-亮氨酸的合成。为此,下一步在重组菌XL-3 PdapA-R2gltA中调节PDHC酶活力,尝试协同改造CS和E1p来有效供应胞内丙酮酸和乙酰-CoA,从而提高L-亮氨酸的产量。
表 5. 不同菌株中丙酮酸和副产物含量 Table 5. The concentration of pyruvate and by-products in different strains
| C. glutamicum | L-valnine/ (g/L) | L-alanine/ (g/L) | Pyruvate/(g/L) | Acetate/(g/L) | |||
| 24 h | 72 h | 24 h | 72 h | ||||
| XL-3 | 4.39±0.38 | 3.75±0.24 | 0.32±0.04 | 0.17±0.02 | 0.28±0.03 | 0.74±0.05 | |
| XL-3 PtacMgltA | 1.18±0.21 | 1.57±0.13 | 0.27±0.02 | 0.13±0.01 | 0.23±0.03 | 0.36±0.01 | |
| XL-3 PtrcgltA | 1.53±0.14 | 1.45±0.16 | 0.45±0.07 | 0.14±0.03 | 0.27±0.03 | 0.41±0.02 | |
| XL-3 PgapAgltA | 2.03±0.15 | 1.69±0.21 | 0.47±0.03 | 0.22±0.01 | 0.31±0.01 | 0.62±0.04 | |
| XL-3 PdapA-R2gltA | 3.83±0.42 | 3.57±0.36 | 0.53±0.02 | 0.24±0.03 | 0.32±0.01 | 0.65±0.06 | |
| XL-3 PdapA-C13gltA | 1.38±0.11 | 1.15±0.13 | 0.15±0.01 | 0.06±0.02 | 0.13±0.01 | 0.15±0.02 | |
| XL-3 PtacMaceE | 1.54±0.18 | 1.62±0.12 | 0.27±0.01 | 0.07±0.01 | 0.57±0.03 | 1.02±0.14 | |
| XL-3 PtrcaceE | 1.55±0.06 | 1.76±0.13 | 0.29±0.03 | 0.14±0.01 | 0.54±0.07 | 1.00±0.07 | |
| XL-3 PgapAaceE | 1.95±0.13 | 1.87±0.17 | 0.26±0.03 | 0.16±0.01 | 0.36±0.02 | 0.76±0.06 | |
| XL-3 PdapA-R2aceE | 2.19±0.21 | 1.94±0.12 | 0.37±0.01 | 0.21±0.01 | 0.23±0.03 | 0.58±0.04 | |
| XL-3 PdapA-C13aceE | 0.98±0.01 | 0.93±0.01 | 0.17±0.02 | 0.11±0.02 | 0.23±0.02 | 0.21±0.03 | |
| XL-3 PdapA-R2gltA PtacMaceE | 1.37±0.14 | 1.52±0.15 | 0.13±0.03 | 0.06±0.01 | 0.56±0.07 | 1.23±0.07 | |
| XL-3 PdapA-R2gltA PtrcaceE | 1.39±0.12 | 1.48±0.11 | 0.31±0.05 | 0.11±0.02 | 0.42±0.03 | 0.95±0.05 | |
| XL-3 P dapA-R2gltA PgapAaceE (i.e., XL-4) | 2.36±0.21 | 2.14±0.13 | 0.31±0.02 | 0.11±0.01 | 0.31±0.03 | 0.71±0.06 | |
| XL-3 P dapA-R2gltA PdapA-R2aceE | 2.88±0.24 | 2.93±0.18 | 0.62±0.03 | 0.28±0.04 | 0.28±0.02 | 0.67±0.08 | |
| XL-3 P dapA-R2gltAPdapA-C13aceE | 0.23±0.02 | 0.45±0.06 | 0.17±0.02 | 0.08±0.01 | 0.15±0.02 | 0.26±0.04 | |
| XL-5 | 4.76±0.32 | 4.01±0.23 | 0.35±0.02 | 0.18±0.03 | 0.36±0.01 | 1.03±0.11 | |
表选项
摇瓶发酵结果表明,重组菌菌体生长性能、胞内乙酰-CoA水平以及产物会随着胞内PDHC酶活力的变化而发生变化(表 5和图 5)。需要指出的是,具有高PDHC酶活力的重组菌株(即XL-3 PdapA-R2gltA PtacMaceE和XL-3 PdapA-R2gltA PtrcaceE),尽管胞内乙酰-CoA水平高于出发菌株XL-3和重组菌XL-3 PdapA-R2gltA,但其L-亮氨酸产量仍然低于出发菌株XL-3和重组菌XL-3 PdapA-R2gltA (图 5)。此外,重组菌株XL-3 PdapA-R2gltA PtacMaceE和XL-3 PdapA-R2gltA PtrcaceE胞内乙酸浓度有一定的增加,分别为1.23±0.07 g/L和0.95±0.05 g/L (表 5),比重组菌(0.74±0.05 g/L)分别增加了66.2%和28.4%。副产物含量越多,就越不利于L-亮氨酸的积累。然而,当重组菌种PDHC酶活力降低时,菌体生长受到抑制,同时增加了L-缬氨酸和L-丙氨酸的积累量。例如,重组菌XL-3 PdapA-R2gltA PdapA-C13aceE摇瓶发酵72 h后,菌体量仅为菌株XL-3 PdapA-R2gltA的18.5% (OD562= 36.2±5.3 vs. OD562=6.7±0.8;图 5-B)。重组菌XL-3 PdapA-R2gltA PgapAaceE (即菌株XL-4)表现出最佳的发酵性能,该菌株L-亮氨酸产量达到20.2±1.7 g/L (图 5-C),比菌株XL-3 PdapA-R2gltA增加了15.4%,比菌株XL-3增加了24.7%。此外,重组菌XL-3 PdapA-R2gltA PgapAaceE发酵液中乙酸浓度有所降低,且L-缬氨酸和L-丙氨酸浓度也显著降低,副产物含量降低有利于L-亮氨酸的积累(表 5)。这一结果表明,协同改造CS和PDHC,可以调节胞内丙酮酸和乙酰-CoA供应,从而影响L-亮氨酸的合成。当以弱启动子PdapA-R2控制CS编码基因gltA表达,而以中等启动子PgapA控制PDH编码基因aceE表达时(即重组菌XL-4),胞内丙酮酸和乙酰-CoA得到有效供给,从而促进L-亮氨酸的合成。
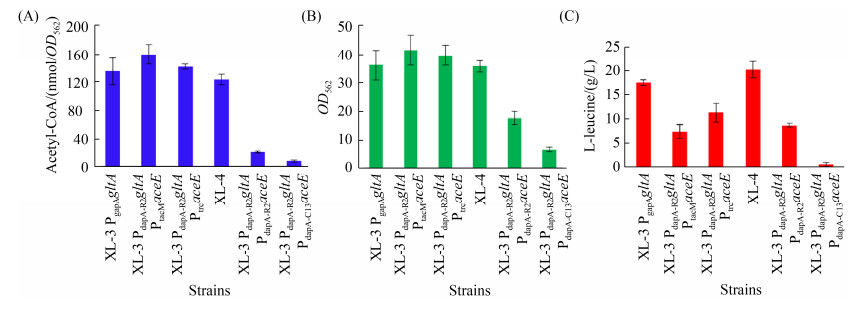 |
| 图 5 协同改造CS和PDHC后不同菌株胞内乙酰-CoA水平(A)以及菌体生长(B)和L-亮氨酸发酵(C)情况 Figure 5 Acetyl-CoA (A), cell growth (B) and L-leucine production (C) of strains with modification of CS and PDHC. |
| 图选项 |
2.5 引入外源柠檬酸裂解酶来平衡胞内丙酮酸和乙酰-CoA供应 ATP-柠檬酸裂解酶(ACL)以ATP为辅因子,催化柠檬酸裂解形成乙酰-CoA和草酰乙酸(图 1)[17]。本研究尝试在重组菌XL-3和XL-4中引入来源于绿硫菌(C. tepidum)的ACL,进一步调节胞内丙酮酸和乙酰-CoA的供应。考虑到ACL可催化柠檬酸形成乙酰-CoA和草酰乙酸,草酰乙酸在脱羧酶作用下形成丙酮酸或在CS作用下形成柠檬酸(图 1)[12],从而同时调节胞内丙酮酸和乙酰-CoA水平以及菌体生长。本研究在重组菌XL-3中引入ACL,获得重组菌株XL-3 ΔltbR: : aclBA (即菌株XL-5)。ACL酶活分析表明,重组菌株XL-5具有ACL酶活性[1.18±0.09 (U/mg protein)],而出发菌株XL-3未检测出ACL酶活。与出发菌株XL-3不同,重组菌XL-5表现出延滞的菌体生长,但最终菌体量两者基本一致(图 6-A)。此外,重组菌XL-5 L-亮氨酸产量达到18.5±1.2 g/L (图 6-B),比出发菌株XL-3增加了14.2%。这一结果表明,来源于绿硫菌的ACL可以调节C. glutamicum胞内乙酰-CoA和丙酮酸的水平,从而调节L-亮氨酸的合成。需要指出的是,重组菌XL-5中胞外副产物(如L-缬氨酸、L-丙氨酸和乙酸)浓度有一定的增加(表 5)。但是在XL-4中,虽然获得了重组菌株,但并没有提高L-亮氨酸的产量,其原因是重组菌XL-4 ΔltbR: : aclBA生长受到显著抑制。我们推测,由于低活性CS和引入外源ACL,使得胞内原本入不敷出的柠檬酸更加短缺,从而限制了三羧酸循环通路,而不能为菌体生长提供足够的能量和四碳二羧酸[12]。
 |
| 图 6 菌株XL-3和XL-5菌体生长(A)和L-亮氨酸合成(B)情况 Figure 6 The cell growth (A) and L-leucine production (B) in strains XL-3 and XL-5. |
| 图选项 |
3 讨论 目前关于L-亮氨酸高产菌株研究主要集中在改造支链氨基酸终端合成途径中关键酶来调节胞内直接前体物供应水平[6, 11, 24],或改造中心碳代谢途径来调节胞内丙酮酸的供应[3, 5],从而实现L-亮氨酸的高产合成。然而,关于胞内乙酰-CoA供给水平影响L-亮氨酸合成的研究较少。本研究围绕胞内乙酰-CoA供应水平对L-亮氨酸合成的影响,通过启动子工程理性改造PDHC、CS和ACL,平衡胞内L-亮氨酸合成重要间接前体物丙酮酸和乙酰-CoA的供应,提高了L-亮氨酸的产量。
在L-亮氨酸合成途径中,2分子的丙酮酸在乙酰羟酸合成酶催化作用下,脱羧缩合形成α-乙酰乳酸,因此丙酮酸的有效利用直接影响L-亮氨酸的产量[26]。我们的前期研究结果也指出,失活丙酮酸羧化酶和丙氨酸转移酶,有利于胞内丙酮酸的积累,从而促进L-亮氨酸的合成[16]。然而,L-亮氨酸合成过程中除了需要丙酮酸作为重要前体物外,乙酰-CoA也是重要的前体物(图 1)。为了提高胞内乙酰-CoA的供应,本研究首次通过调节CS酶活性来调节乙酰-CoA的胞内积累量。CS是TCA循环中第一个限速酶,催化草酰乙酸耦合乙酰-CoA形成柠檬酸(图 1)[12]。前期研究表明,通过改变CS编码基因gltA启动子转录活性,可以降低胞内CS酶活,从而导致草酰乙酸的积累[12]。CS酶活降低之后它的反应减弱,导致更少的乙酰-CoA反应形成柠檬酸,所以胞内的乙酰-CoA得到了积累。我们的研究结果证实了这一理论:当将C. glutamicum中gltA编码基因替换成弱启动子或超弱启动子时,胞内乙酰-CoA水平比出发菌株要高(图 3-A)。此外,需要指出的是,当重组菌株CS酶活不低于出发菌株的15%时,菌体生长不受影响(图 3-B),这一结果与已报道的文献一致[12, 27]。在低CS酶活下,由于胞内乙酰-CoA得到有效供应,所有重组菌株中L-亮氨酸得到有效积累,如重组菌株XL-3 PdapA-R2gltA L-亮氨酸产量达到17.5±0.6 g/L (图 3-C),比出发菌株增加了6.8%。然而,虽然重组菌XL-3 PdapA-R2gltA中L-亮氨酸产量最高,但是单位菌体生产强度却低于XL-3 PdapA-C13gltA。此外,重组菌株XL-3 PdapA-R2gltA还积累了大量的副产物,如L-缬氨酸和L-丙氨酸。有文献报道称,失活PDHC有利于支链氨基酸中L-缬氨酸的合成,其原因是降低胞内丙酮酸流向乙酰-CoA合成[3]。这一结果表明,重组菌XL-3 PdapA-R2gltA可能因为胞内乙酰-CoA供应不足而影响L-亮氨酸的合成。虽然,PDHC直接参与乙酰-CoA的合成,且我们的研究结果也表明,提高PDHC酶活力有利于提高胞内乙酰-CoA的积累(图 4-A),但是由于胞内丙酮酸的供应不足,并不能实现重组菌株中L-亮氨酸的高效合成(图 4-C)。因此,平衡胞内丙酮酸和乙酰-CoA的供应,对提高L-亮氨酸的合成非常重要。为此,本研究在重组菌XL-3 PdapA-R2gltA中调节PDHC酶活力,通过协同改造CS和PDHC来平衡胞内丙酮酸和乙酰-CoA供给。研究发现,当以弱启动子PdapA-R2控制CS编码基因gltA表达,而以中等启动子PgapA控制PDHC编码基因aceE表达时(即重组菌XL-3 PdapA-R2gltA PgapAaceE,XL-4),胞内丙酮酸和乙酰-CoA供给水平和平衡,能够促进L-亮氨酸的合成。需要指出的是,具有高PDHC酶活力的重组菌株尽管胞内乙酰-CoA水平高于重组菌XL-3 PdapA-R2gltA,但其L-亮氨酸产量要低于重组菌XL-3 PdapA-R2gltA,且胞内乙酸浓度有一定的增加(表 5和图 5)。这是因为高PDHC酶活促进丙酮酸形成乙酰-CoA,从而降低了L-亮氨酸合成所需的丙酮酸量,而胞内过多的乙酰-CoA会进一步转化形成乙酸[28]。然而,当重组菌种PDHC酶活力降低时,菌体生长受到抑制,同时增加了L-缬氨酸和L-丙氨酸的积累量。这是因为低PDHC酶活使得胞内乙酰-CoA供应不足,从而阻碍了TCA循环,而胞内过多的丙酮酸会进一步转化成其他以丙酮酸为前体物的副产物,如L-缬氨酸和L-丙氨酸等[16]。因此,协同改造CS和PDHC,可以调节胞内丙酮酸和乙酰-CoA供应,从而影响L-亮氨酸的合成。最终获得的重组菌XL-4 L-亮氨酸产量达到20.2±1.7 g/L,比菌株XL-3 PdapA-R2gltA增加了15.4%,且副产物浓度也显著降低(表 5和图 5-C)。此外,ATP-柠檬酸裂解酶(ACL)以ATP为辅因子,催化柠檬酸裂解形成乙酰-CoA和草酰乙酸(图 1)[17]。C. glutamicum中不存在ACL,通过引入外源ACL或可调节胞内丙酮酸和乙酰-CoA水平以及菌体生长。然而,在重组菌XL-4中引入来源于绿硫菌(C. tepidum)的ACL,由于胞内柠檬酸供应不足,菌体生长受到显著抑制[12]。有趣的是,在未改变CS酶活的重组菌XL-3中引入ACL (即重组菌XL-3 ΔltbR: : aclBA,XL-5)不会影响菌体生长,且可以提高L-亮氨酸产量,L-亮氨酸产量达到18.5±1.2 g/L (图 6)。这一结果表明,在C. glutamicum中引入外源ACL同样可以调节胞内乙酰-CoA和丙酮酸的水平,从而调节L-亮氨酸的合成。
综上所述,本研究表明通过启动子工程协同改造CS和E1p或引入外源ACL可以调节C. glutamicum胞内丙酮酸和乙酰-CoA供应水平,从而提高L-亮氨酸的产量。这些结果为利用代谢工程技术强化微生物合成L-亮氨酸等支链氨基酸提供了一定的理论指导和技术支持。需要指出的是,本实验获得的重组菌株XL-4和XL-5胞内仍然存在一定量的以丙酮酸为前体物的副产物(如L-缬氨酸和L-丙氨酸),这表明在L-亮氨酸合成过程中丙酮酸和乙酰-CoA并未完全实现平衡供应。因此,后期对L-亮氨酸高产菌株选育时需要进一步平衡丙酮酸和乙酰-CoA的供应,并且考虑阻断与L-亮氨酸竞争前体物质的L-丙氨酸的合成途径,从而实现L-亮氨酸高效清洁发酵生产。
References
| [1] | Calvo JM, Kalyanpur MG, Stevens CM. 2-isopropylmalate and 3-isopropylmalate as intermediates in leucine biosynthesis. Biochemistry, 1962, 1(6): 1157-1161. DOI:10.1021/bi00912a029 |
| [2] | 张跃. 应用DNA重组技术构建L-亮氨酸产生菌. 江南大学硕士学位论文, 2014. |
| [3] | Bartek T, Rudolf C, Ker?en U, Klein B, Blombach B, Lang S, Eikmanns BJ, Oldiges M. Studies on substrate utilisation in L-valine-producing Corynebacterium glutamicum strains deficient in pyruvate dehydrogenase complex. Bioprocess and Biosystems Engineering, 2010, 33(7): 873-883. DOI:10.1007/s00449-010-0410-1 |
| [4] | Xu JZ, Ruan HZ, Yu HB, Liu LM, Zhang WG. Metabolic engineering of carbohydrate metabolism systems in Corynebacterium glutamicum for improving the efficiency of L-lysine production from mixed sugar. Microbial Cell Factories, 2020, 19(1): 1-15. DOI:10.1186/s12934-019-1269-8 |
| [5] | Wang YY, Xu JZ, Zhang WG. Metabolic engineering of L-leucine production in Escherichia coli and Corynebacterium glutamicum: a review. Critical Reviews in Biotechnology, 2019, 39(5): 633-647. DOI:10.1080/07388551.2019.1577214 |
| [6] | Huang QG, Liang L, Wu WB, Wu SG, Huang JZ. Metabolic engineering ofCorynebacterium glutamicum to enhance L-leucine production. African Journal of Biotechnology, 2017, 16(18): 1048-1060. DOI:10.5897/AJB2017.15911 |
| [7] | Vogt M, Haas S, Klaffl S, Polen T, Eggeling L, van Ooyen J, Bott M. Pushing product formation to its limit: Metabolic engineering of Corynebacterium glutamicum for L-leucine overproduction. Metabolic Engineering, 2014, 22: 40-52. DOI:10.1016/j.ymben.2013.12.001 |
| [8] | Zhang SH, Zeng XF, Ren M, Mao XB, Qiao SY. Novel metabolic and physiological functions of branched chain amino acids: a review. Journal of Animal Science and Biotechnology, 2017, 8(1): 1-12. DOI:10.1186/s40104-016-0130-8 |
| [9] | Zhang XC, Guo YY, Liu X, Chen XG, Wu Q, Chen GQ. . Engineering cell wall synthesis mechanism for enhanced PHB accumulation in E. coli. Metabolic Engineering, 2018, 45: 32-42. DOI:10.1016/j.ymben.2017.11.010 |
| [10] | Song Y, Li JH, Shin HD, Du GC, Liu L, Chen J. One-step biosynthesis of α-ketoisocaproate from L-leucine by an Escherichia coli whole-cell biocatalyst expressing an L-amino acid deaminase from Proteus vulgaris. Scientific Reports, 2015, 5: 12614. DOI:10.1038/srep12614 |
| [11] | Wang YY, Shi K, Chen PD, Zhang F, Xu JZ, Zhang WG. Rational modification of the carbon metabolism of Corynebacterium glutamicum to enhance L-leucine production. Journal of Industrial Microbiology & Biotechnology, 2020, 47(6/7): 485-495. DOI:10.1007/s10295-020-02282-8 |
| [12] | Xu JZ, Wu ZH, Gao SJ, Zhang WG. Rational modification of tricarboxylic acid cycle for improving L-lysine production in Corynebacterium glutamicum. Microbial Cell Factories, 2018, 17(1): 1-13. DOI:10.1186/s12934-017-0850-2 |
| [13] | Peters-Wendisch PG, Schiel B, Wendisch VF, Katsoulidis E, M?ckel B, Sahm H, Eikmanns BJ. Pyruvate carboxylase is a major bottleneck for glutamate and lysine production by Corynebacterium glutamicum. Journal of Molecular Microbiology and Biotechnology, 2001, 3(2): 295-300. |
| [14] | Hirokawa Y, Kubo T, Soma Y, Saruta F, Hanai T. Enhancement of acetyl-CoA flux for photosynthetic chemical production by pyruvate dehydrogenase complex overexpression in Synechococcus elongatus PCC 7942. Metabolic Engineering, 2020, 57: 23-30. DOI:10.1016/j.ymben.2019.07.012 |
| [15] | Meadows AL, Hawkins KM, Tsegaye Y, Antipov E, Kim Y, Raetz L, Dahl RH, Tai AN, Mahatdejkul-Meadows T, Xu L, Zhao LS, Dasika MS, Murarka A, Lenihan J, Eng D, Leng JS, Liu CL, Wenger JW, Jiang HX, Chao L, Westfall P, Lai J, Ganesan S, Jackson P, Mans R, Platt D, Reeves CD, Saija PR, Wichmann G, Holmes VF, Benjamin K, Hill PW, Gardner TS, Tsong AE. Rewriting yeast central carbon metabolism for industrial isoprenoid production. Nature, 2016, 537(7622): 694-697. DOI:10.1038/nature19769 |
| [16] | Wang YY, Zhang F, Xu JZ, Zhang WG, Ch en, X L, L iu, L M. Improvement of L-leucine production in Corynebacterium glutamicum by altering the redox flux. International Journal of Molecular Sciences, 2019, 20(8): 2020-2034. DOI:10.3390/ijms20082020 |
| [17] | Kim W, Tabita FR. Both subunits of ATP-citrate lyase from Chlorobium tepidum contribute to catalytic activity. Journal of Bacteriology, 2006, 188(18): 6544-6552. DOI:10.1128/JB.00523-06 |
| [18] | 王颖妤. 代谢工程改造谷氨酸棒杆菌发酵生产L-亮氨酸. 江南大学硕士学位论文, 2020. |
| [19] | 徐大庆. 黄色短杆菌载体系统的构建及其产L-缬氨酸代谢工程育种的初步研究. 江南大学博士学位论文, 2010. |
| [20] | Pátek M, Ne?vera J. Promoters and plasmid vectors of Corynebacterium glutamicum. //Yukawa H, Inui M (eds). Corynebacterium glutamicum: Biology and Biotechnology. Berlin Heidelberg: Springer, 2013: 51-88. |
| [21] | Vasicová P, Pátek M, Nesvera J, Sahm H, Eikmanns B. Analysis of the Corynebacterium glutamicum dapA promoter. Journal of Bacteriology, 1999, 181(19): 6188-6191. DOI:10.1128/JB.181.19.6188-6191.1999 |
| [22] | Wang LP, Yu HB, Xu JZ, Ruan HZ, Zhang WG. Deciphering the crucial roles of AraC-type transcriptional regulator Cgl2680 on NADPH metabolism and L-lysine production in Corynebacterium glutamicum. World Journal of Microbiology and Biotechnology, 2020, 36(6): 1-15. |
| [23] | Blombach B, Schreiner ME, Moch M, Oldiges M, Eikmanns BJ. Effect of pyruvate dehydrogenase complex deficiency on L-lysine production with Corynebacterium glutamicum. Applied Microbiology and Biotechnology, 2007, 76(3): 615-623. DOI:10.1007/s00253-007-0904-1 |
| [24] | Lian JZ, Si T, Nair NU, Zhao HM. Design and construction of acetyl-CoA overproducing Saccharomyces cerevisiae strains. Metabolic Engineering, 2014, 24: 139-149. DOI:10.1016/j.ymben.2014.05.010 |
| [25] | Feng LY, Xu JZ, Zhang WG. Improved l-leucine production in Corynebacterium glutamicum by optimizing the aminotransferases. Molecules, 2018, 23(9): 2102. DOI:10.3390/molecules23092102 |
| [26] | Westbrook AW, Ren X, Moo-Young M, Chou CP. Metabolic engineering of Bacillus subtilis forl-valine overproduction. Biotechnology and Bioengineering, 2018, 115(11): 2778-2792. DOI:10.1002/bit.26789 |
| [27] | Van Ooyen J, Noack S, Bott M, Reth A, Eggeling L. Improved L-lysine production with Corynebacterium glutamicum and systemic insight into citrate synthase flux and activity. Biotechnology and Bioengineering, 2012, 109(8): 2070-2081. DOI:10.1002/bit.24486 |
| [28] | Hirokawa Y, Kubo T, Soma Y, Saruta F, Hanai T. Enhancement of acetyl-CoA flux for photosynthetic chemical production by pyruvate dehydrogenase complex overexpression in Synechococcus elongatus PCC 7942. Metabolic Engineering, 2020, 57: 23-30. DOI:10.1016/j.ymben.2019.07.012 |
