李志月1, 张显1, 饶志明1,2, 张荣珍1


1. 江南大学生物工程学院, 教育部工业生物技术重点实验室, 江苏 无锡 214122;
2. 江南大学粮食发酵工艺与技术国家工程实验室, 江苏 无锡 214122
收稿日期:2020-12-03;修回日期:2021-03-24;网络出版日期:2021-03-24
基金项目:国家重点研究发展计划(2018YFA0900300);国家自然科学基金(31970045);国家轻工业技术与工程一流学科计划(LITE2018-12);高等学校学科创新引智计划(111-2-06);江苏省高校学术计划;宁夏回族自治区重点研发计划(2020BFH02011)
*通信作者:张荣珍, Tel: +86-510-85197760;Fax: +86-510-85918201;E-mail: rzzhang@jiangnan.edu.cn.
摘要:[目的] 构建一株以廉价原料乳糖为底物合成塔格糖的重组菌株,实现一步法高效生物合成稀有糖——塔格糖。[方法] 从Escherichia coli K-12基因组中,PCR扩增出阿拉伯糖异构酶araA和β-半乳糖苷酶lacZ基因,以SD-AS为连接子,利用pET28a-1载体串联表达于Escherichia coli BL21(DE3),获得重组菌E.coli BL21/pET28a-araA-lacZ,对重组菌全细胞催化合成塔格糖的条件进行了工艺优化与放大研究。[结果] araA和lacZ基因在E.coli BL21中同时高效表达,在最优条件(pH 8.0、温度50℃、5 mmol/L Mn2+、添加0.5 mol/L硼酸和0.1% SDS)下,E.coli BL21/pET28a-araA-lacZ全细胞转化100 g/L乳糖,合成塔格糖最高产量达24.03±2.03 g/L,乳糖到塔格糖的摩尔转化率为45.67%,随着底物乳糖浓度的提高,塔格糖产量呈不同程度的提高,当投加500 g/L底物乳糖时,全细胞合成塔格糖产量最高达83.81±1.38 g/L。[结论] 通过2个关键靶酶的编码基因araA和lacZ在E.coli BL21细胞中进行共表达,实现了以重组菌全细胞为催化剂转化廉价底物乳糖,一步法高效合成稀有糖塔格糖,该研究为生物法制备低能量的功能性稀有糖奠定了较好的研究基础。
关键词:β-半乳糖苷酶阿拉伯糖异构酶塔格糖乳糖生物催化
One-step synthesis of lactose to tagatose by co-expressing β-galactosidase and arabinose isomerase
Zhiyue Li1, Xian Zhang1, Zhiming Rao1,2, Rongzhen Zhang1


1. Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Bioengineering, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Received: 3 December 2020; Revised: 24 March 2021; Published online: 24 March 2021
*Corresponding author: Rongzhen Zhang, Tel: +86-510-85197760;Fax: +86-510-85918201;E-mail: rzzhang@jiangnan.edu.cn.
Foundation item: Supported by the National Key Research and Development Program of China (2018YFA0900300), by the National Natural Science Foundation of China (31970045), by the National First-Class Discipline Program of Light Industry Technology and Engineering (LITE2018-12), by the Program of Introducing Talents of Discipline to Universities (111-2-06), by the Top-Notch Academic Programs Project of Jiangsu Higher Education Institutions and by the Key Research and Development Program of Ningxia Hui Autonomous Region (2020BFH02011)
Abstract: [Objective] To achieve the high-efficiency synthesis of lactose to tagatose in one-step, we cloned β-galactosidase gene (lacZ) and arabinose isomerase gene (araA) from Escherichia coli K-12 genome and co-expressed in E. coli BL21(DE3). [Methods] The araA and lacZ genes were amplified from the E. coli K-12 genome by PCR. The two genes with SD-AS sequence as a linker were cloned into the expression vector pET28a-1 to get the recombinant plasmid pET28a-araA-lacZ, which was transformed into the competent cells of E. coli BL21(DE3) to obtain E. coli BL21/pET28a-araA-lacZ. The synthesis conditions of tagatose by whole cells of E. coli BL21/pET28a-araA-lacZ were optimized and the process was scaled up. [Results] The araA and lacZ genes were efficiently co-expressed in E. coli BL21 simultaneously. The optimal conditions for the synthesis of tagatose by the whole cells of E. coli BL21/pET28a-araA-lacZ were determined: pH 8.0, 50℃, 5 mmol/L Mn2+, 0.5 mol/L borate and 0.1% SDS as permeabilizing agent. Under these optimal conditions, the highest yield of tagatose was 24.03±2.03 g/L with a molar conversion rate of 45.67% using 100 g/L lactose as substrate. The yield of tagatose was increased with the increasment of the substrate lactose concentration. The yield of tagatose was 83.81±1.38 g/L with 500 g/L lactose as substrate. [Conclusion] The genes lacZ and araA coding two target enzymes were co-expressed in E. coli BL21 to realize the efficient synthesis of high valued rare sugar tagatose from the cheap substrate lactose in one step. This research has laid a good research foundation for the preparation of low-energy functional sugars by biological methods.
Keywords: β-galactosidasearabinose isomerasetagatoselactosebiocatalysis
塔格糖是果糖的差向异构体,甜度近似于蔗糖,但热量仅为蔗糖的1/3[1],具有抑制高血糖、改善肠道菌群、不致龋齿等多种生理功效,是一种低能量高功能的稀有糖,也是保健品开发和食品升级的良好甜味替代剂,广泛应用于食品、医药、化妆品等领域[2]。随着塔格糖市场的扩大,塔格糖的高效制备成为亟待解决的问题。
塔格糖可以由半乳糖通过化学法或酶法合成[3-4]。化学法合成塔格糖存在污染环境、副产物多且反应利用强酸强碱对反应容器和反应条件要求极高等缺点[3]。酶法合成塔格糖具有反应条件温和、副产物少和安全高效等特点。阿拉伯糖异构酶能够催化半乳糖异构化生成塔格糖[1],但该反应存在对半乳糖不利的动力学、阿拉伯糖异构酶热稳定性低和平衡常数低(酶催化的反应达到平衡时,半乳糖和塔格糖的比例约为7:3)等问题[5-6]。为解决这些问题,Bober和Nair利用锚定蛋白将乳酸杆菌来源的L-阿拉伯糖异构酶锚定在植物乳杆菌细胞质膜上,经化学渗透化处理后分批催化48 h,半乳糖到塔格糖的转化率为85%[2];Lee等对嗜温菌Bacillus halodurans、嗜热菌Geobacillus stearothermophilus和超嗜热菌Thermotoga maritima来源的阿拉伯糖异构酶进行结构稳定性分析,发现嗜热菌的阿拉伯糖异构酶比嗜温菌的阿拉伯糖异构酶更依赖于金属离子来维持酶的稳定性[7];Xu等利用藻酸盐对阿拉伯糖异构酶进行固定化,同时添加与半乳糖摩尔比为1:10的硼酸使反应平衡向塔格糖移动[4]。
β-半乳糖苷酶,即乳糖酶,可以催化乳糖的水解和转糖苷,分别生成水解产物半乳糖和葡萄糖以及转糖苷产物低聚半乳糖[8]。不同来源的β-半乳糖苷酶催化反应时倾向水解或转糖苷的情况不同,大肠杆菌来源的β-半乳糖苷酶具有较强的水解活性,而环状芽孢杆菌来源的β-半乳糖苷酶则具有较强的转糖苷活性[9]。β-半乳糖苷酶可与阿拉伯糖异构酶协同催化廉价乳糖,一步法合成塔格糖,如图 1所示。2012年,Wanarska等报道,重组巴斯德毕赤酵母在表达了Arthrobacter chlorophenolicus来源的β-半乳糖苷酶后,能够分解乳糖生成半乳糖,半乳糖再经Arthrobacter sp. 22c来源的L-阿拉伯糖异构酶催化后生成塔格糖,实现了乳糖水解率为90%,半乳糖到塔格糖转化率为30%[6]。2017年,Jayamuthunagai等将乳清渗透物中的乳糖水解成葡萄糖和半乳糖后,利用褐藻酸盐固定化的植物乳杆菌催化其中的半乳糖生产塔格糖,获得半乳糖到塔格糖38%的转化率[10]。木糖还原酶能够催化半乳糖的还原生成半乳糖醇,半乳糖醇可在半乳糖醇脱氢酶的氧化下生成塔格糖,2019年,Liu等利用木糖还原酶和半乳糖醇脱氢酶的氧化还原反应克服了异构化反应的热力学极限,以乳糖为底物生成37.69 g/L的塔格糖,反应液中塔格糖和半乳糖的比例为9:1,但半乳糖并不是木糖还原酶的天然底物,且反应过程存在半乳糖醇的积累,因此利用该途径实现产业化还需要对关键酶进行挖掘改造[11]。2020年,Zhang等在商业化β-半乳糖苷酶和Lactobacillus plantarum来源的重组阿拉伯糖异构酶的催化作用下,利用两阶段的同时糖化和生物转化(SSB)从乳清粉生物合成塔格糖,96 h后塔格糖浓度为51.5 g/L,转化率为36.8% (以乳糖计),但该研究在第二阶段新加入的大肠杆菌工程菌无疑增加了生产的成本[1]。
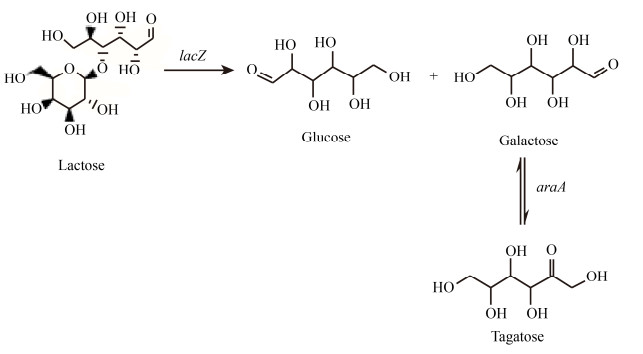 |
| 图 1 以乳糖为底物的塔格糖生物合成途径 Figure 1 The biosynthetic pathway of tagatose with lactose as substrate. |
| 图选项 |
本研究将E. coli K-12来源的β-半乳糖苷酶和阿拉伯糖异构酶在E. coli BL21(DE3)中进行串联共表达,通过对全细胞催化过程中的pH、温度、Mn2+、硼酸和细胞通透剂添加等因素的优化,实现了以廉价乳糖为底物,以全细胞为催化剂,一步法合成塔格糖。本研究为全细胞催化低值化学品、高效制备高附加值的功能性糖提供了借鉴。
1 材料和方法 1.1 菌株、质粒、培养基及试剂 E. coli K-12(DE3)、E. coli BL21(DE3)、表达载体pET28a-1由实验室保藏,引物委托苏州金唯智生物科技有限公司合成。其中扩增araA基因的引物为F1 (5′-ATGGGTCGCGGATCCGAATT CATGACGATTTTTGATAATTATG-3′)和F2 (5′-CT CGAGTGCGGCCGCAAGCTTTTAGCGACGAAATCCGTAATA-3′);扩增lacZ基因的引物为F3 (5′-GGGTCGCGGATCCGAATTCTGACCATGATTACGGATTCACTGG-3′)和F4 (5′-GGTGGTGCTCGA GTGCGGCCGCAAGCTTTTATTTTTGACACCA-3′)。
LB培养基:蛋白胨10 g/L,NaCl 10 g/L,酵母粉5 g/L。固体培养基添加2%的琼脂。DNA分子量标准、蛋白分子量标准和感受态制备试剂盒等购自TaKaRa公司。琼脂糖凝胶DNA回收试剂盒、小量质粒提取试剂盒、细菌DNA基因组提取试剂盒和BCA蛋白浓度测定试剂盒购于上海捷瑞生物工程有限公司;高保真DNA聚合酶2× Phanta? Max Master Mix、ClonExpress? Ultra One Step Cloning Kit重组克隆试剂盒等购自南京诺唯赞生物科技有限公司。塔格糖标准品购自Sigma公司。其他分析纯试剂均购自国药集团化学试剂有限公司。
1.2 菌株构建 根据设计的引物,以E. coli K-12基因组为模板,分别扩增出β-半乳糖苷酶编码基因lacZ和阿拉伯糖异构编码基因araA。利用EcoR Ⅰ和Hind Ⅲ限制性内切酶对表达载体pET28a-1进行酶切处理。将lacZ和araA基因片段利用ClonExpress? Ultra One Step Cloning Kit重组克隆试剂盒分别连接到表达载体pET28a-1的EcoR Ⅰ和Hind Ⅲ两酶切位点之间,利用感受态细胞转化法转化到E. coli BL21(DE3),分别构建表达lacZ和araA的重组菌E. coli BL21/pET28a-lacZ和E. coli BL21/pET28a-araA。利用引物扩增出中间添加SD-AS序列(GAAGGAGATATACC)作为连接子的两基因lacZ和araA后,连接到表达载体pET28a-1的EcoR Ⅰ和Hind Ⅲ两酶切位点之间,转化E. coli BL21(DE3)感受态细胞,构建出双基因串联位置不同的共表达重组菌E. coli BL21/pET28a-araA- lacZ和E. coli BL21/pET28a-lacZ-araA。
1.3 lacZ和araA基因的表达、酶蛋白的纯化 将重组菌活化后接种于10 mL LB液体培养基中,37 ℃、180 r/min培养12 h后以1%接种量转接于50 mL LB液体培养基,37 ℃、180 r/min培养至OD600值约0.6左右时,加入终浓度为0.5 mmol/L的诱导剂IPTG,25 ℃培养10 h,8000 r/min离心5 min收集菌体,用生理盐水洗涤细胞2次,将菌体悬浮于pH 8.0的Na2HPO4-柠檬酸缓冲液中。
将收集到的菌体经洗涤悬浮处理,用Scientz-Ⅱ D型超声破碎仪(20 MHz,65%振幅,工作1 s,停3 s)破碎15 min后,10000 r/min离心20 min,收集上清液(即为粗酶液)和沉淀,SDS-PAGE分析蛋白表达情况。采用镍柱亲和层析法对粗酶液进行纯化,借助AKTA Prime蛋白纯化仪将粗酶液流经预平衡的HisTrap FF crude预装柱(0.7 cm×2.5 cm),用含有0–200 mmol/L咪唑的洗脱缓冲液进行线性梯度洗脱,洗脱缓冲液流速为0.1 mL/min,利用280 nm波长的紫外线检测信号监测洗脱出溶液中的蛋白含量,收集目标蛋白,将目标蛋白样品进行SDS-PAGE分析。获得的纯酶用于酶活测定。
1.4 酶活测定 酶活测定反应体系(1 mL):利用Na2HPO4-柠檬酸缓冲液(0.2 mol/L,pH 7.0)配置酶液和底物溶液,在反应体系中添加500 μL浓度为200 g/L的底物溶液、200 μL酶液和300 μL Na2HPO4-柠檬酸缓冲液(0.2 mol/L,pH 7.0),37 ℃下反应20 min,沸水浴终止反应。蛋白质浓度利用BCA蛋白浓度测定试剂盒测定,以牛血清白蛋白为标准蛋白。β-半乳糖苷酶酶活定义为:标准条件下(pH 7.0、37 ℃)以乳糖为底物,每分钟催化生成1 μmol产物葡萄糖所需酶量为一个酶活单位;阿拉伯糖异构酶酶活定义为:标准条件下(pH 7.0、37 ℃)以半乳糖为底物,每分钟催化生成1 μmol产物塔格糖所需酶量为一个酶活单位。
利用HPLC方法检测样品中糖的种类及含量,具体条件为:Carbomix-Ca-NP色谱柱,超纯水为流动相,流速0.4 mL/min,柱温80 ℃,示差检测器,检测温度50 ℃,进样量20 μL。
1.5 重组菌粗酶液催化活力的验证 反应体系(1 mL):利用Na2HPO4-柠檬酸缓冲液(0.2 mol/L,pH 8.0)配置粗酶液和底物溶液,在反应体系中添加500 μL浓度为200 g/L的底物溶液、200 μL粗酶液和300 μL Na2HPO4-柠檬酸缓冲液(0.2 mol/L,pH 8.0),50 ℃条件下反应20 min,沸水浴终止反应。利用HPLC检测塔格糖生成量,计算相对酶活力。在此反应体系的基础上进行粗酶液最适催化pH、温度、金属离子的反应和粗酶液催化乳糖生成塔格糖的反应。
1.6 共表达重组菌全细胞转化乳糖合成塔格糖条件优化 全细胞催化反应体系总体积为10 mL:用0.2 mol/L pH 8.0的Na2HPO4-柠檬酸作为缓冲液使反应体系中乳糖终浓度为100 g/L,控制细胞浓度OD600为40,50 ℃条件下反应48 h,沸水浴终止反应。利用HPLC对反应液中成分及含量进行检测。在此反应体系的基础上进行全细胞催化反应条件的优化反应。
2 结果和分析 2.1 菌株构建及lacZ和araA基因的表达、纯化及酶活测定 以E. coli K-12基因组为模板,成功扩增出1500 bp左右的araA基因和3000 bp左右的lacZ基因,将lacZ和araA基因片段分别连接到表达载体pET28a-1上。设计两基因araA和lacZ中间添加SD-AS序列的引物以扩增araA和lacZ基因,将两基因连接到表达载体pET28a-1上,导入E. coli BL21(DE3)感受态细胞,获得单独表达lacZ和araA的重组菌E. coli BL21/pET28a-lacZ和E. coli BL21/pET28a-araA、双基因共表达重组菌E. coli BL21/pET28a-araA-lacZ和E. coli BL21/ pET28a-lacZ-araA。重组菌进行诱导、培养和细胞破碎离心后,对破碎后的上清液(粗酶液)和沉淀进行SDS-PAGE分析,结果如图 2-A–D所示,在116 kDa和55 kDa处出现明显条带,分别与β-半乳糖苷酶和阿拉伯糖异构酶的理论分子量吻合(β-半乳糖苷酶蛋白简称为LacZ,阿拉伯糖异构酶蛋白简称为L-AI),araA和lacZ两个基因在重组菌E. coli BL21/pET28a-lacZ、E. coli BL21/ pET28a-araA、E. coli BL21/pET28a-araA-lacZ和E. coli BL21/pET28a-lacZ-araA中均实现了表达,且主要为可溶性表达,分布于细胞破碎上清液中,细胞破碎沉淀中仅含有微量包涵体。
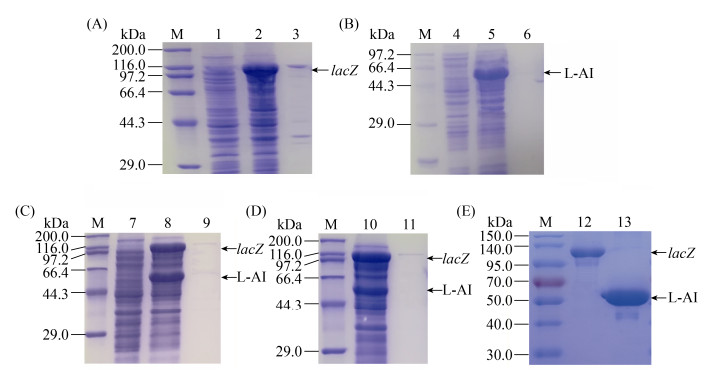 |
| 图 2 LacZ和L-AI蛋白表达与纯化的SDS-PAGE分析 Figure 2 The SDS-PAGE analysis of LacZ and L-AI expression in E. coli and purification. A: expression of LacZ and L-AI in E. coli BL21/pET28a-lacZ; B: E. coli BL21/pET28a-araA; C: E. coli BL21/pET28a-araA-lacZ; D: E. coli BL21/pET28a-lacZ-araA; E: purified enzyme LacZ and L-AI. M: protein marker; 1, 4, 7: the crude enzyme of E. coli BL21/pET28a; 2, 5, 8, 10: the crude enzyme of E. coli BL21/pET28a-lacZ, E. coli BL21/pET28a-araA, E. coli BL21/pET28a-araA-lacZ, E. coli BL21/pET28a-lacZ-araA sepertately; 3, 6, 9, 11: the precipitate of E. coli BL21/pET28a-lacZ, E. coli BL21/pET28a-araA, E. coli BL21/pET28a-araA-lacZ, E. coli BL21/pET28a-lacZ-araA sepertately; 12–13: the purified enzyme of LacZ and L-AI. |
| 图选项 |
利用镍柱亲和层析法对重组菌E. coli BL21/ pET28a-lacZ和E. coli BL21/pET28a-araA的粗酶液进行了分离纯化,SDS-PAGE结果(图 2-E)显示,已获得电泳纯β-半乳糖苷酶和阿拉伯糖异构酶的纯酶。利用纯酶液进行酶活测定,β-半乳糖苷酶和阿拉伯糖异构酶的比酶活分别为135.5 U/mg和34.54 U/mg。E. coli BL21/pET28a-araA-lacZ粗酶液中β-半乳糖苷酶和阿拉伯糖异构酶的酶活分别为93.62 U/mL和23.41 U/mL,E. coli BL21/pET28a-lacZ-araA粗酶液中β-半乳糖苷酶和阿拉伯糖异构酶的酶活分别为107.36 U/mL和16.27 U/mL,可以看出重组菌E. coli BL21/pET28a- lacZ-araA粗酶液中阿拉伯糖异构酶酶活相对于重组菌E. coli BL21/pET28a-araA-lacZ粗酶液中的阿拉伯糖异构酶有所降低。
2.2 重组菌粗酶液催化活力的验证 对E. coli BL21/pET28a-araA-lacZ和E. coli BL21/pET28a-lacZ-araA粗酶液催化乳糖生成塔格糖的能力进行测试,同时在相同的培养条件下对两株重组菌进行培养,收集菌体经处理使菌悬液细胞浓度一致(OD600=40)后破碎离心获得粗酶液,因此,某种程度上,基本能够保证反应体系中两重组菌粗酶液的酶蛋白量相对一致。反应体系放大到10 mL,以0.2 mol/L pH 8.0的Na2HPO4-柠檬酸为缓冲液使乳糖终浓度为100 g/L,添加2 mL粗酶液,50 ℃条件下进行反应,在反应的第0、6、18、24 h取500 μL反应液经处理后利用HPLC分析反应液中的成分及含量。如图 3所示。重组菌E. coli BL21/pET28a-araA-lacZ粗酶液催化乳糖生成塔格糖的能力要优于E. coli BL21/pET28a-lacZ-araA。因此后续将重组菌E. coli BL21/pET28a-araA-lacZ的粗酶液作为一个整体对其催化特性进行初步探索。
 |
| 图 3 E. coli BL21/pET28a-araA-lacZ和E. coli BL21/pET28a-lacZ-araA粗酶液催化乳糖生成塔格糖进程曲线 Figure 3 The crude enzyme of E. coli BL21/ pET28a-araA-lacZ and E. coli BL21/pET28a-lacZ- araA catalyzing lactose to tagatose. |
| 图选项 |
对重组菌E. coli BL21/pET28a-araA-lacZ粗酶液催化反应的pH、温度、金属离子、热稳定性等催化活力进行了测定,以塔格糖的产量作为判断粗酶液活性的指标,测定了各条件下的相对酶活。
对粗酶液生成塔格糖最适反应pH测定时,利用0.2 mol/L Na2HPO4-柠檬酸(pH 2.2–8.0)、Tris-HCl (pH 8.0–9.0)或NaOH-甘氨酸(pH 9.0–10.0)作为缓冲液分别在pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0条件下50 ℃反应20 min。以0.2 mol/L Na2HPO4-柠檬酸(pH 8.0)为缓冲液,在30、40、50、60、70 ℃的温度下测定粗酶最适反应温度。结果如图 4-A和4-B所示,重组菌E. coli BL21/pET28a-araA-lacZ粗酶液催化乳糖生成塔格糖的最适pH为9.0 (Tris-HCl),粗酶液催化乳糖生成塔格糖的最适温度为50 ℃。据文献报道,pH过高会加剧糖的梅拉德反应[12],不利于塔格糖的积累,且在pH 8.0和pH 9.0时,粗酶催化的相对转化率均保持在90%以上,因此测定了Na2HPO4-柠檬酸(pH 8.0)和Tris-HCl (pH 9.0)两种缓冲液对粗酶液催化乳糖生成塔格糖的影响。放大反应体系到10 mL,利用不同的缓冲液使反应体系中乳糖终浓度为100 g/L,加入粗酶液2 mL,在50 ℃条件下进行反应,在反应的0、6、12、18、24 h取500 μL反应液进行HPLC分析。如图 5所示,在较长时间的转化反应中,Na2HPO4-柠檬酸(pH 8.0)更利于塔格糖的生成。因此后续采用Na2HPO4-柠檬酸(pH 8.0)作为缓冲液进行生物催化反应。大肠杆菌E. coli K-12来源的β-半乳糖苷酶的最适催化pH为7.2[13],大肠杆菌E. coli K-12来源的阿拉伯糖异构酶最适pH为8.0[14],当双酶的粗酶形式催化乳糖合成塔格糖时最适pH为8.0,这可能是因为双酶在催化乳糖生成塔格糖的过程中,虽然不在β-半乳糖苷酶的最适催化pH,但其催化活性依然很高。所以乳糖很快被利用,半乳糖积累(如图 5所示),当双酶催化乳糖生成塔格糖的pH倾向于阿拉伯糖异构酶的最适pH时会增加塔格糖的生成量。大肠杆菌E. coli K-12来源的β-半乳糖苷酶的最适催化温度为40 ℃[13],大肠杆菌E. coli K-12来源的阿拉伯糖异构酶的最适催化温度为40–50 ℃[15],温度升高,阿拉伯糖异构酶催化的可逆异构化反应倾向于塔格糖合成的方向,因此在保证酶催化过程中酶活稳定性的条件下,温度升高转化率相应提高。
 |
| 图 4 pH和温度对重组菌株E. coli BL21/pET28a-araA-lacZ粗酶的影响 Figure 4 Effect of pH and temperature on crude enzyme catalyzing the synthesis of tagatose. A: effect of pH; B: effect of temperature. |
| 图选项 |
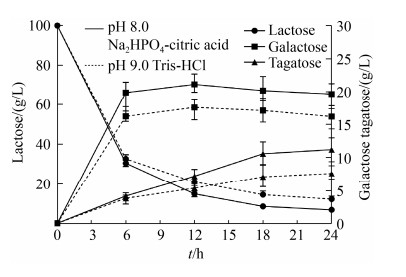 |
| 图 5 不同缓冲液对E. coli BL21/pET28a-araA-lacZ粗酶液催化乳糖生成塔格糖的影响 Figure 5 Effect of different buffer on crude enzyme of E. coli BL21/pET28a-araA-lacZ catalyzing lactose to tagatose. |
| 图选项 |
粗酶的热稳定性测定在Na2HPO4-柠檬酸缓冲液(pH 8.0)中进行,分别在4、30、50 ℃水浴5、12、24、48、72、96、120 h后取200 μL酶液加入上述1 mL酶活测定反应体系,测定生成产物量,计算相对粗酶活力。结果如图 6所示,50 ℃处理120 h时催化乳糖生成塔格糖的能力仍为初始时的一半,能够保证塔格糖的稳定合成。
 |
| 图 6 重组菌E. coli BL21/pET28a-araA-lacZ的粗酶温度稳定性 Figure 6 The thermal stability of E. coli BL21/ pET28a-araA-lacZ crude enzyme. |
| 图选项 |
据报道金属离子会对阿拉伯糖异构酶的催化有影响[1, 3, 16],为了验证不同金属离子对双酶催化反应的影响,在各反应组中加入终浓度为5 mmol/L的不同金属离子溶液:MnCl2、CoCl2、FeCl2、CuCl2、ZnCl2、MgCl2或NiCl2溶液,结果如图 7所示。反应过程中Cu2+、Zn2+、Ni2+的存在不利于塔格糖的生成,Mn2+、Co2+、Fe2+会不同程度促进塔格糖的生成,尤其是Mn2+,使乳糖到塔格糖的转化率相对于不添加金属离子时提高了1.5倍。
 |
| 图 7 不同金属离子对E. coli BL21/pET28a-araA-lacZ粗酶的影响 Figure 7 Effect of different metal ions on crude enzyme of E. coli BL21/pET28a-araA-lacZ catalyzing lactose to tagatose. |
| 图选项 |
2.3 共表达重组菌全细胞转化条件优化 与粗酶催化过程相比,全细胞催化具有抗环境扰动性和更低的有效酶成本的特点[17],因此本研究优化了重组菌E. coli BL21/pET28a-araA-lacZ全细胞转化pH、温度、金属离子Mn2+、硼酸、细胞通透剂添加等条件。
2.3.1 共表达重组菌全细胞转化反应的最适pH和温度的测定: 利用0.2 mol/L Na2HPO4-柠檬酸(pH 2.2–8.0)、Tris-HCl (pH 8.0–9.0)和NaOH-甘氨酸(pH 9.0–10.0)作为缓冲液分别在pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0条件下测定全细胞催化最适反应pH值。分别在30、40、50、60、70 ℃条件下测定全细胞催化最适反应温度。如图 8-A所示,pH对全细胞催化塔格糖合成影响趋势相似,缓冲液选用pH 8.0的Na2HPO4-柠檬酸。最适温度为60 ℃,由于β-半乳糖苷酶和阿拉伯糖异构酶在50 ℃时热稳定性更好,且在50 ℃和60 ℃时乳糖到塔格糖的质量转化率分别为15.65%和16.23%,并无较大差异(图 8-B)。考虑到塔格糖合成时间较长,为避免温度过高导致产物塔格糖发生严重的梅拉德反应和酶活的丧失,因此,后续选用50 ℃作为E. coli BL21/ pET28a-araA-lacZ的全细胞催化温度。
 |
| 图 8 pH和温度对E. coli BL21/pET28a-araA-lacZ全细胞催化合成塔格糖的影响 Figure 8 Effect of pH and temperature on E. coli BL21/pET28a-araA-lacZ catalyzing the synthesis of tagatose. A: effect of pH; B: effect of temperature. |
| 图选项 |
2.3.2 最适金属离子Mn2+浓度、硼酸浓度及细胞通透剂种类: 由于对E. coli BL21/pET28a-araA- lacZ粗酶液催化活力的验证过程中,金属离子Mn2+能促进塔格糖的生成,因此对在不同浓度(1、3、5、7、9、10 mmol/L)的MnCl2条件下的全细胞催化活性进行了检测分析,结果(图 9-A)表明,当Mn2+浓度为5 mmol/L时,全细胞E. coli BL21/ pET28a-araA-lacZ合成塔格糖的效率最高,乳糖到塔格糖的质量转化率为18.5%。
 |
| 图 9 Mn2+和硼酸浓度对E. coli BL21/pET28a-araA-lacZ全细胞催化合成塔格糖的影响 Figure 9 Effect of Mn2+ and boric acid concentrations on E. coli BL21/pET28a-araA-lacZ catalyzing the synthesis of tagatose. A: effect of Mn2+ concentrations; B: effect of boric acid concentrations. |
| 图选项 |
已有研究发现,硼酸可与塔格糖结合形成塔格糖-硼酸复合物,该复合物不参与半乳糖和塔格糖的异构反应,且硼酸与塔格糖的亲和力高于与半乳糖的亲和力,可推动异构反应向塔格糖生成方向移动,显著提高产物塔格糖的生成量[4, 17]。测定全细胞最适催化硼酸浓度时,添加最适浓度的MnCl2,反应体系中的硼酸终浓度分别为0、0.1、0.3、0.5、0.7、0.9 mol/L。结果如图 9-B所示,通过添加不同浓度的硼酸,对塔格糖的合成具有较大影响。一定范围内,随着硼酸浓度的升高,塔格糖生成量增加,当硼酸浓度为0.5 mol/L时,反应液中塔格糖的浓度最高,为20.75 g/L,硼酸浓度超过0.5 mol/L时,塔格糖生成量随硼酸浓度的升高而降低。硼酸-塔格糖复合物中的硼酸可在下游工程的纯化过程中除去。Lim等使用Amberite IRA-743和Dowex X50X8树脂(4:1,V/V)进行层析可将形成的塔格糖-硼酸复合物中的硼酸去除,去除率达到99%以上[18]。
全细胞催化过程中菌体细胞以静息活细胞的状态存在,底物和产物通过细胞膜上特定的运输蛋白进出细胞,底物和产物的流通性直接影响产物的转化效率。Kim等通过改造甲基半乳糖苷转运系统转运蛋白mglB,来降低半乳糖和塔格糖的摄取率,使细胞膜对底物和产物产生差异选择性,推动反应平衡向塔格糖移动[16]。为解决这一问题,在全细胞反应体系的基础上添加最适浓度的MnCl2和硼酸,各实验组中分别添加0.1%的TritonX-100、SDS、CTAB、溶菌酶、油酸处理等细胞通透剂,结果如图 10-A所示,在多种细胞通透剂中,SDS能够达到最好的透化效果,当添加SDS进行重组菌E. coli BL21/pET28a-araA-lacZ全细胞催化时,乳糖到塔格糖的质量转化率较添加前提高了1.2倍左右,此时转化率为23.86%,且反应达到相对平衡所需时间相对缩短(图 10-B)。
 |
| 图 10 不同透化条件对E. coli BL21/pET28a-araA-lacZ全细胞催化合成塔格糖的影响 Figure 10 Effect of different permeabilized agents on E. coli BL21/pET28a-araA-lacZ catalyzing the synthesis of tagatose. A: effect of different permeabilized agents; B: whole-cell catalysis with or without SDS. |
| 图选项 |
2.3.3 反应体系中细胞浓度的优化: 放大转化体系为100 mL,在乳糖终浓度为100 g/L、0.2 mol/L pH 8.0 Na2HPO4-柠檬酸作为缓冲液,添加终浓度为5 mmol/L MnCl2、0.5 mol/L硼酸和0.1% SDS,控制细胞浓度OD600值分别为20、30、40、50、60、70,50 ℃进行反应,在反应的0、20、40、70、90 h取样测定底物和产物量的变化。当反应体系中菌体细胞密度OD600为50时,塔格糖生成量达到最高,产量为24.03 g/L (如图 11所示)。在一定范围内,当全细胞菌悬液浓度越高,塔格糖生成量相应提高,但超过一定范围,因菌浓过高介质流通缓慢导致底物和产物流动性下降,相应转化率也随之下降。
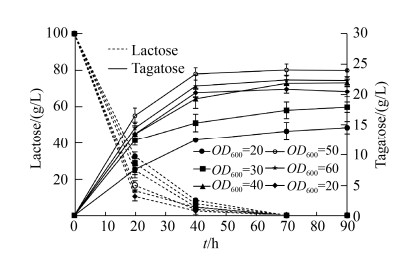 |
| 图 11 E. coli BL21/pET28a-araA-lacZ菌悬液浓度对转化的影响 Figure 11 Effect of cell concentration of E. coli BL21/pET28a-araA-lacZ on catalyzing the synthesis of tagatose. |
| 图选项 |
2.3.4 不同底物浓度下塔格糖的生成: 将重组菌E. coli BL21/pET28a-araA-lacZ在全细胞最适转化条件下进行全细胞转化的放大实验。转化体系为100 mL,投加乳糖使反应体系中的乳糖终浓度分别为100、200、300、400、500 g/L的,在转化第0、5、10、20、40、70、90 h时取1 mL反应液,经处理后利用HPLC检测底物残余量和产物生成量,分析塔格糖的转化效率。结果如图 12所示,反应40 h后,塔格糖生成趋于缓慢。重组菌E. coli BL21/pET28a-araA-lacZ全细胞催化100 g/L乳糖,合成塔格糖的最大产量可达24.03±2.03 g/L,乳糖到塔格糖的质量转化率为24.03%。在500 g/L乳糖为底物的条件下,塔格糖生成量达到83.81±1.38 g/L,乳糖到塔格糖的质量转化率为16.76%。随着底物乳糖浓度的增加,反应到达平衡所需时间也增加,转化率也有不同程度的降低。这很可能由于乳糖浓度越高,反应体系流动阻力越大,底物和产物流通性下降;另一方面,乳糖浓度过高会促进β-半乳糖苷酶的转糖苷功能合成低聚半乳糖,从而影响中间产物半乳糖的合成,且葡萄糖和半乳糖会抑制β-半乳糖苷酶的反应[8]。
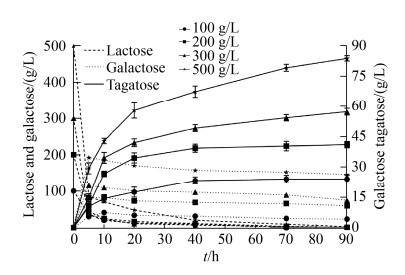 |
| 图 12 E. coli BL21/pET28a-araA-lacZ全细胞催化不同浓度的乳糖转化塔格糖 Figure 12 The synthesis of tagatose by the whole-cell of E. coli BL21/pET28a-araA-lacZ at different lactose concentrations. |
| 图选项 |
3 讨论 E. coli K-12自身含有阿拉伯糖异构酶基因和β-半乳糖苷酶基因,但阿拉伯糖异构酶和β-半乳糖苷酶本底水平表达效率低,一般检测不到酶活性[19],在前人研究过程中,对E. coli K-12来源的β-半乳糖苷酶和阿拉伯糖异构酶的研究较明晰[20],且大肠杆菌来源的β-半乳糖苷酶的水解效果优于其他微生物来源的β-半乳糖苷酶[9]。E. coli BL21(DE3)是以T7 RNA聚合酶为表达系统的高效外源基因的蛋白表达宿主,表达效率较高。因此,本研究利用连接了SD-AS序列偶联E. coli K-12来源的阿拉伯糖异构酶和β-半乳糖苷酶在E. coli BL21(DE3)宿主中共表达,从而实现了从较廉价的乳糖为底物一步转化合成产物塔格糖。
通过优化共表达重组菌株E. coli BL21/ pET28a-araA-lacZ催化乳糖合成塔格糖的多种反应条件,使其合成产物的转化率达到最高。如通过添加金属离子Mn2+能够显著提高催化效率[3]。由于硼酸与塔格糖的亲和力高于半乳糖,塔格糖可与硼酸结合生成塔格糖-硼酸复合物,该物质不参与半乳糖和塔格糖的异构化可逆反应[18],当全细胞转化过程添加硼酸时,为了达到平衡,半乳糖和塔格糖的异构化可逆反应向合成塔格糖的方向移动,塔格糖的生成量显著增加[11]。利用全细胞的形式进行生物转化存在细胞膜作为胞内与外界的屏障阻碍底物产物进出的现象,当添加SDS时,这种表面活性剂会破坏膜上蛋白,使细胞膜屏障作用降低,增加了底物和产物的流通,并且底物和产物在细胞膜两侧不同程度的分布,也能较好地促进反应向产物合成的方向进行[2]。最终重组菌株E. coli BL21/pET28a-araA-lacZ静息全细胞催化底物乳糖合成产物塔格糖的最优条件为:pH 8.0、50 ℃,添加5 mmol/L Mn2+、0.5 mol/L硼酸和0.1%的SDS作细胞通透剂,重组菌悬液浓度OD600值为50的条件下,投加100 g/L底物乳糖,可生成塔格糖最高产量达24.03±2.03 g/L,乳糖到塔格糖的质量转化率为24.03%,摩尔转化率为45.67%,随着底物投加量的增加,塔格糖产量有不同程度的提高,在500 g/L乳糖载量下,全细胞转化合成塔格糖产量最高可达83.81±1.38 g/L,该产量为国内利用乳糖一步法合成塔格糖的最高报道水平。由于大肠杆菌转化制备一些食品添加剂时,有可能会带入一些肠毒素,后续研究将利用枯草芽孢杆菌或酵母菌等食品安全菌株作为酶表达的宿主细胞,进行两种靶酶的异源共表达,更安全更高效催化乳糖等低值底物,合成更高附加值的产物塔格糖等。为了β-半乳糖苷酶和阿拉伯糖异构酶协同催化乳糖生成塔格糖的反应获得更好的催化效果,后续还可以对两个关键酶的启动子或核糖体结合位点等作进一步的优化调控。
References
| [1] | Zhang GY, Zabed HM, Yun JH, Yuan J, Zhang YF, Wang Y, Qi XH. Two-stage biosynthesis of D-tagatose from milk whey powder by an engineered Escherichia coli strain expressing L-arabinose isomerase from Lactobacillus plantarum. Bioresource Technology, 2020, 305: 123010. DOI:10.1016/j.biortech.2020.123010 |
| [2] | Bober JR, Nair NU. Galactose to tagatose isomerization at moderate temperatures with high conversion and productivity. Nature Communications, 2019, 10: 4548. DOI:10.1038/s41467-019-12497-8 |
| [3] | Du MG, Zhao DY, Cheng SS, Sun D, Chen M, Gao ZQ, Zhang CZ. Towards efficient enzymatic conversion of D-galactose to D-tagatose: purification and characterization of L-arabinose isomerase from Lactobacillus brevis. Bioprocess and Biosystems Engineering, 2019, 42(1): 107-116. DOI:10.1007/s00449-018-2018-9 |
| [4] | Xu Z, Li S, Fu FG, Li GX, Feng XH, Xu H, Ouyang PK. Production of D-tagatose, a functional sweetener, utilizing alginate immobilized Lactobacillus fermentum CGMCC2921 cells. Applied Biochemistry and Biotechnology, 2012, 166(4): 961-973. DOI:10.1007/s12010-011-9484-8 |
| [5] | Roh HJ, Kim P, Park YC, Choi JH. Chouayekh HEA. Bioconversion of D-galactose into D-tagatose by expression of L-arabinose isomerase. Applied Biochemistry and Biotechnology, 2011, 31(1): 1-4. |
| [6] | Marta W, Józef K. A method for the production of D-tagatose using a recombinant Pichia pastoris strain secreting beta-D-galactosidase. Microbial Cell Factories, 2012, 11: 113. DOI:10.1186/1475-2859-11-113 |
| [7] | Lee DW, Hong YH, Choe EA, Lee SJ, Kim SB, Lee HS, Oh JW, Shin HH, Pyun YR. A thermodynamic study of mesophilic, thermophilic, and hyperthermophilic l-arabinose isomerases: The effects of divalent metal ions on protein stability at elevated temperatures. FEBS Letters, 2005, 579(5): 1261-1266. DOI:10.1016/j.febslet.2005.01.027 |
| [8] | Zhao L, Zhou YZ, Qin S, Qin PP, Chu JL, He BF. Β-galactosidase BMG without galactose and glucose inhibition: Secretory expression in Bacillus subtilis and for synthesis of oligosaccharide. International Journal of Biological Macromolecules, 2018, 120: 274-278. DOI:10.1016/j.ijbiomac.2018.07.148 |
| [9] | Lu LL, Li ZY, Xiao M. Recent progress on galacto-oligosaccharides synthesis by microbial, β-galactosidase-a review. Acta Microbiologica Sinica, 2008, 48(7): 980-985. |
| [10] | Jayamuthunagai J, Srisowmeya G, Chakravarthy M, Gautam P. D-tagatose production by permeabilized and immobilized Lactobacillus plantarum using whey permeate. Bioresource Technology, 2017, 235: 250-255. DOI:10.1016/j.biortech.2017.03.123 |
| [11] | Liu JJ, Zhang GC, Kwak S, Oh EJ, Yun EJ, Chomvong K, Cate JHD, Jin YS. Overcoming the thermodynamic equilibrium of an isomerization reaction through oxidoreductive reactions for biotransformation. Nature Communications, 2019, 10: 1356. DOI:10.1038/s41467-019-09288-6 |
| [12] | Shin KC, Sim DH, Seo MJ, Oh DK. Increased production of food-grade D-tagatose from D-galactose by permeabilized and immobilized cells of Corynebacterium glutamicum, a GRAS host, expressing D-galactose isomerase from Geobacillus thermodenitrificans. Journal of Agricultural and Food Chemistry, 2016, 64(43): 8146-8153. DOI:10.1021/acs.jafc.6b03588 |
| [13] | Craven GR, Steers E, Anfinsen CB. Purification, composition, and molecular weight of the beta-galactosidase of Escherichia coli k12. The Journal of Biological Chemistry, 1965, 240: 2468-2477. DOI:10.1016/S0021-9258(18)97348-5 |
| [14] | Yoon SH, Kim P, Oh DK. Properties of L-arabinose isomerase from Escherichia coli as biocatalyst for tagatose production. World Journal of Microbiology and Biotechnology, 2003, 19(1): 47-51. DOI:10.1023/A:1022575601492 |
| [15] | 张留权. 联合β-半乳糖苷酶和阿拉伯糖异构酶酶法合成D-塔格糖的研究. 华东理工大学硕士学位论文, 2012. |
| [16] | Zheng ZJ, Xie JX, Liu P, Li X, Ouyang J. Elegant and efficient biotransformation for dual production of d-tagatose and bioethanol from cheese whey powder. Journal of Agricultural and Food Chemistry, 2019, 67(3): 829-835. DOI:10.1021/acs.jafc.8b05150 |
| [17] | Kim JH, Lim BC, Yeom SJ, Kim YS, Kim HJ, Lee JK, Lee SH, Kim SW, Oh DK. Differential selectivity of the Escherichia coli cell membrane shifts the equilibrium for the enzyme-catalyzed isomerization of galactose to tagatose. Applied Microbiology and Biotechnology, 2008, 74(8): 2307-2313. |
| [18] | Lim BC, Kim HJ, Oh DK. High production of D-tagatose by the addition of boric acid. Biotechnology Progress, 2007, 23(4): 824-828. DOI:10.1002/bp070056y |
| [19] | 刘新颖. 大肠杆菌工程菌发酵乳糖制备D-塔格糖的研究. 山东大学硕士学位论文, 2014. |
| [20] | Zhan YJ, Xu Z, Li S, Liu XL, Xu L, Feng XH, Xu H. Coexpression of β-D-galactosidase and L-arabinose isomerase in the production of D-tagatose: a functional sweetener. Journal of Agricultural and Food Chemistry, 2014, 62(11): 2412-2417. DOI:10.1021/jf4042485 |
