刘洪艳

 , 袁媛, 张姗, 李凯强
, 袁媛, 张姗, 李凯强 天津科技大学海洋与环境学院, 天津 300457
收稿日期:2021-01-20;修回日期:2021-04-07;网络出版日期:2021-04-14
基金项目:国家自然科学基金(41606157)
作者简介:刘洪艳,博士,副教授,硕士研究生导师。近年来,以海洋沉积物中的兼性厌氧细菌为研究对象,在海洋微生物治理重金属污染方面开展基础研究工作。主持国家自然科学基金项目1项,主持天津市自然科学基金项目2项。第一作者发表SCI论文10篇.
*通信作者:刘洪艳, Tel/Fax: +86-22-60601458; E-mail: hongyanliu1214@163.com.
摘要:[目的] 在异化铁还原细菌培养体系中,通过外加电子穿梭体,分析电子穿梭体种类与浓度对细菌异化铁还原性质的影响。[方法] 以一株发酵型异化铁还原细菌Clostridium butyricum LQ25为研究对象,设置水溶性介体蒽醌-2-磺酸钠和核黄素作为外加电子穿梭体。[结果] 在氢氧化铁为电子受体、葡萄糖为电子供体培养条件下,不同浓度蒽醌-2-磺酸钠和核黄素对菌株LQ25异化铁还原效率影响具有显著性差异。外加蒽醌-2-磺酸钠浓度为0.5 mmol/L时,菌株累积产生Fe(Ⅱ)浓度最高,为12.95±0.08 mg/L,相比对照组提高88%。核黄素浓度为100 mg/L时,菌株累积产生Fe(Ⅱ)浓度是11.06±0.04 mg/L,相比对照组提高61%。外加电子穿梭体能够改变菌株LQ25发酵产物中丁酸和乙酸浓度,提高乙酸相对含量。[结论] 蒽醌-2-磺酸钠和核黄素作为外加电子穿梭体能显著促进细菌异化铁还原效率,为揭示发酵型异化铁还原细菌胞外电子传递机制提供实验支持。
关键词:Clostridium butyricum LQ25蒽醌-2-磺酸钠核黄素Fe(Ⅱ)浓度
Characteristics of Fe(Ⅲ) reduction by Fe(Ⅲ)-reducing bacterium Clostridium butyricum LQ25 under the condition of electron shuttles
Liu Hongyan

 , Yuan Yuan, Zhang Shan, Li Kaiqiang
, Yuan Yuan, Zhang Shan, Li Kaiqiang College of Marine and Environmental Sciences, Tianjin University of Science & Technology, Tianjin 300457, China
Received: 20 January 2021; Revised: 7 April 2021; Published online: 14 April 2021
*Corresponding author: Liu Hongyan, Tel/Fax: +86-22-60601458; E-mail: hongyanliu1214@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (41606157)
Abstract: [Objective] This study aimed to investigate the characteristics of microbial Fe(Ⅲ) reduction under the condition of adding electron shuttles. [Methods] The effects of anthraquinone-2-sulfonic acid (AQS) and riboflavin on cell growth and Fe(Ⅱ) concentration by a fermenting bacterium Clostridium butyricum LQ25 were investigated. [Results] The results showed that Fe(Ⅱ) concentrations were significantly different under the series of electron shuttle concentrations, Fe(OH)3 as electron acceptor and glucose as electron donor. The highest Fe(Ⅱ) concentration under Fe(Ⅲ)-reducing conditions by strain LQ25 was 12.95±0.08 mg/L at the AQS concentration of 0.5 mmol/L, which was 88% higher compared to the control without added AQS. When riboflavin was added as the electron shuttle, Fe(Ⅱ) concentration was 11.06±0.04 mg/L at the riboflavin concentration of 100 mg/L, which was 61% higher compared to the control. The adding of electron shuttles could change the concentration of butyrate and acetic acid in fermentation products by strain LQ25, with the increasing of relative content of acetic acid. [Conclusion] The adding of electron shuttle AQS and riboflavin could significantly promote microbial Fe(Ⅲ) reduction, which will provide the experimental evidence for the mechanism of extracellular electron transfer by fermentative Fe(Ⅲ)-reducing bacteria.
Keywords: Clostridium butyricum LQ25anthraquinone-2-sulfonic acid (AQS)riboflavinFe(Ⅱ) concentration
异化铁还原是指细菌在细胞内氧化有机物并释放出电子,在细胞外电子受体接受电子被还原[1]。由于异化铁还原细菌在有机废水处理[2]、重金属污染去除[3-4]以及生物能源开发[5]等方面具有广阔的应用前景,异化铁还原细菌胞外电子传递机理的研究引起****们广泛关注[6-7]。希瓦氏菌(Shewanella oneidensis)和地杆菌(Geobacter sulfurreducens)是研究呼吸型异化铁还原细菌的模式菌。其基因组中含有大量细胞色素c的编码序列,胞外电子传递过程中细胞色素c对电子从细胞内膜传递到细胞外膜至关重要。希瓦氏菌胞外电子传递中内膜蛋白CymA、膜周质细胞色素c以及外膜蛋白复合物MtrABC共同实现跨膜电子传递[8]。吴云当等以模式菌Shewanella oneidensis MR-1为例,研究发现电子传递按照内膜-周质-外膜的顺序,由内至外的电子传递链是CymA→MtrA→MtrB→OmcA/MtrC→Fe3+[9]。地杆菌胞外电子传递由内膜蛋白MacA、膜周质细胞色素c以及外膜蛋白复合物OMCs共同实现。地杆菌细菌中细胞色素c种类更丰富,且膜蛋白复合物OMCs与MtrABC没有同源性,这也表明呼吸型异化铁还原细菌胞外电子传递机制的多样性[10-11]。
2014年Vecchia等以一株发酵型的异化铁还原菌Desulfotomaculum reducens strain MI-1为研究对象,通过SDS-PAGE以及质谱分析研究发现,该菌株没有相关的多血红素细胞色素c参与电子传递。这是关于发酵型异化铁还原细菌胞外电子传递机制的首次报导[12]。李曦研究发酵型异化铁还原细菌Anoxybacter fermentans DY22613T时,发现该菌株基因组序列没有编码细胞色素c的基因,胞外电子传递过程缺少细胞色素c。发酵型菌株DY22613T属于革兰氏阳性菌,具有很厚的细胞壁,其胞外电子过程中电子如何跨越细胞壁的机理还不清楚。这意味着发酵型异化铁还原细菌胞外电子传递过程不同于呼吸型异化铁还原细菌[13]。
对于缺少细胞色素c的发酵型异化铁还原细菌,利用电子穿梭体可能是胞外电子传递的一种策略[14]。电子穿梭体具有氧化态和还原态,在胞内接受电子而被还原,传递电子至胞外电子受体表面,失去电子而被氧化,通过氧化还原过程,实现了电子的跨膜转移。因此,电子穿梭体可作为铁还原菌与胞外电子受体接触的媒介,使细菌脱离了需要与胞外电子受体直接接触的限制。
醌类物质是一种电子穿梭体,其醌基基团接受电子被还原为氢醌,释放电子再重新氧化形成醌。电子通过醌与氢醌之间的转化,实现异化铁还原细菌与胞外电子受体之间的电子传递。Newman和Kolter研究异化铁还原细菌Shewanella putrefaciens MR-1,首次提出微生物可以利用自身分泌的某种醌类物质作为电子穿梭体传递电子的机制[15]。异化铁还原菌Shewanella putrefaciens CN32在不含有电子穿梭体AQDS培养条件下铁还原率是16.80%,而在添加AQDS的培养条件下,其铁还原率可达到24.30%[16]。此外,AQDS作为电子穿梭体能够加快电子转移速率,从而增强菌株Geobacter sulfurreducens还原Cr(Ⅵ)[3]。Liu等研究发现在外源电子穿梭体AQS存在的条件下,温度不仅可以改变菌株Shewanella oneidensis MR-1的生理特性,也能改变AQS的特性从而影响生物的电子传递速率[17]。
核黄素类也能够作为电子穿梭体进行电子传递,主要包括3种物质,分别是:黄素单核苷酸(FMN)、黄素腺嘌呤二核苷酸(FAD)以及核黄素(Riboflavin即维生素B2),并且这三者之间可以相互转化。You等利用革兰氏阳性菌株Bacillus megaterium LLD-1为材料,外加核黄素的实验表明,核黄素对于该菌株胞外电子传递过程至关重要[18]。Zhou等分析了AQDS和核黄素对Shewanella oneidensis MR-1还原Fe(Ⅲ)的影响,结果表明核黄素的增强作用明显高于AQDS[19]。Canstein等首次研究发现希瓦氏菌能够产生黄素单核苷酸(FMN)和核黄素,并分泌到胞外起电子穿梭的作用,加速对结晶性较弱的Fe(Ⅲ)氧化物的还原[20]。许多****将核黄素介导的胞外电子传递反应应用于环境中污染物的处理,王萍萍等研究表明,Shewanella putrefaciens分泌核黄素能明显加速电子向U(Ⅵ)的转移,提高了还原U(Ⅵ)效率[21]。
前期研究中,从海洋沉积物中筛选得到一株革兰氏阳性细菌Clostridium butyricum LQ25。菌株LQ25属于发酵型异化铁还原细菌。论文以菌株LQ25为研究对象,设置水溶性介体AQS和核黄素作为外加电子穿梭体,分析电子穿梭体种类与浓度对细菌异化铁还原效率的影响。旨在进一步揭示发酵型异化铁还原细菌胞外电子传递机制,为异化铁还原细菌在重金属污染等生物处理的应用提供理论依据。
1 材料和方法 1.1 材料
1.1.1 菌株: Clostridium butyricum LQ25由本课题组成员分离自渤海海洋沉积物(GenBank号:MK156151)
1.1.2 菌株LQ25培养(g/L): 氯化钠4.0,氯化镁0.1,磷酸氢二钾1.5,半胱氨酸0.5,酵母粉1.0,葡萄糖20.0,胰蛋白胨4.0。菌株LQ25接种到含100 mL培养基的血清瓶中,充氮气5 min,密封瓶口。培养条件:pH 7±0.5,温度32 ℃。厌氧培养36 h。以合成的氢氧化铁作为电子受体。氢氧化铁溶液配制:称取10.82 g的FeCl3·6H2O于1000 mL烧杯中,再加入666 mL超纯水,调pH至7.0左右,静置沉降,出现红褐色沉淀,主要是中性条件下的氢氧化铁,洗涤3次,定容至200 mL,终浓度为200 mmol/L。
1.2 电子穿梭体 外加电子穿梭体AQS至培养液的浓度分别为0.1、0.2、0.3、0.4、0.5和0.6 mmol/L,对照组不加AQS。电子穿梭体核黄素浓度梯度为5、25、50、75、100和150 mg/L,对照组不加核黄素。菌株LQ25分别接种于上述含不同浓度电子穿梭体培养液中,3组重复样。恒温培养12 h后,分别测定菌体密度OD600、蛋白质含量、累积Fe(Ⅱ)浓度、铁还原酶活以及发酵产物,分析外加电子穿梭体对异化铁还原细菌LQ25生长及铁还原性质的影响。
1.3 异化Fe(Ⅲ)还原性质 Fe(Ⅱ)浓度根据邻菲啰啉法测定[22],当缓冲溶液为弱酸性时,邻菲啰啉可以与Fe(Ⅱ)生成稳定的橙红色配合物,并在波长510 nm处具有最大吸光值,且Fe(Ⅱ)浓度大小与吸光值是成正比的。具体步骤如下:吸取1 mL 0.1%邻菲啰啉溶液和1 mL乙酸-乙酸钠(pH=4.6)缓冲液到10 mL比色管中,再加1 mL待测样,加水定容至10 mL,摇匀静置10 min后,测其OD510。根据标曲计算Fe(Ⅱ)含量。
按文献[23]测定异化Fe(Ⅲ)还原酶活性,步骤如下:采用超声波破碎仪对菌株LQ25细胞进行破碎,取细胞破碎液2 mL、PBS溶液2 mL、NADH (电子供体) 200 μL和柠檬酸铁(电子受体) 15 μL,加超纯水定容至10 mL。对照组反应体系不加电子供体NADH,其余条件相同。恒温培养,30 ℃,1 h。反应结束,测定该反应液于510 nm处光吸收值。标准曲线计算Fe(Ⅱ)浓度。自定义酶活单位:10 mL体系中,1 mg蛋白1 h产生1 μmol Fe(Ⅱ)为1个酶活,用U来表示。U=1 μmol/(h·mg)。
1.4 分析方法 利用分光光度计测定菌液在波长600 nm处的吸光值,以此来表示菌液密度。菌体蛋白质含量测定利用考马斯亮蓝法。发酵产物分析测定利用气相色谱质谱仪GC-2010。培养结束后,取菌液20 mL,离心(5000 r/min,5min),取上清10 mL置于顶空瓶中,在旋转蒸发仪上水浴(50 ℃)旋蒸30 min,然后用取样针头吸附30 min。测定条件是:色谱柱:HP-FFAP毛细管分析柱(30 m×0.53 mm,膜厚1.0 μm,惠普公司生产);载气是N2,10 mL/min;检测器是FID;柱箱温度:程序升温,初始温度为40 ℃,恒温3 min后,以20 ℃/min的速率升温至220 ℃。
2 结果和分析 2.1 异化铁还原细菌LQ25生长 菌株LQ25在葡萄糖为电子供体和氢氧化铁为电子受体厌氧培养条件下细胞生长曲线见图 1。在培养12 h时,菌株LQ25开始进入对数生长期,培养24 h时,细胞生长达到稳定期,OD600最高达到1.5195±0.0100。培养36 h时,菌株进入衰亡期,OD600下降至1.231±0.060。对于未添加氢氧化铁对照组与异化铁培养体系实验组,菌株细胞生长在培养初期没有显著差异(P > 0.05)。当培养12 h后对照组和实验组之间细胞生长差异极显著(P < 0.01)。未添加氢氧化铁的对照组在培养24 h时细胞生长到达稳定期,OD600最高为1.013±0.020。培养36 h时,菌株细胞生长进入衰亡期,OD600下降至0.821±0.040。
 |
| 图 1 菌株LQ25生长曲线 Figure 1 The growth curve of Clostridium butyricum LQ25 |
| 图选项 |
2.2 电子穿梭体对菌株LQ25生长的影响
2.2.1 蒽醌-2-磺酸钠(AQS): 菌株LQ25分别接种于含不同浓度蒽醌-2-磺酸钠(AQS)培养基中,无添加AQS培养为对照组。培养24 h时,测定不同AQS浓度下菌株LQ25生长及蛋白质含量,见图 2。AQS浓度为0.1-0.5 mmol/L时,细胞生长随着AQS浓度增加而提高,当AQS浓度为0.5 mmol/L时,OD600和蛋白质含量最高,随AQS浓度继续增加,细胞生长开始下降。在设定AQS浓度范围内(0.1-0.6 mmol/L),实验组细胞生长相比对照组(未添加AQS)均有所提高。显著性分析显示,3个AQS浓度组(0.1、0.2和0.3 mmol/L)之间对菌株蛋白质含量的影响没有显著差异(P > 0.05),而且其蛋白质含量极显著低于其他浓度组(0.4、0.5和0.6 mmol/L) (P < 0.01)。6个浓度组中,浓度0.4 mmol/L AQS对菌株LQ25蛋白质含量的影响相较于其他浓度组具有极显著差异(P < 0.01)。当AQS浓度为0.5 mmol/L时,菌株蛋白质含量最高(95.07±3.73 mg/L),相较于对照组提高41%。浓度组0.5和0.6 mmol/L之间对菌株蛋白质含量影响差异不显著(P > 0.05)。研究结果显示不同浓度电子穿梭体AQS对菌株LQ25生长具有极显著的促进作用(P < 0.01)。
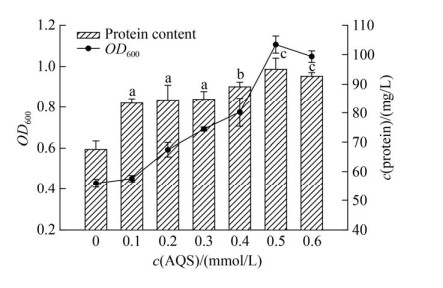 |
| 图 2 电子穿梭体AQS浓度对菌株LQ25生长影响 Figure 2 The effects of concentration of electron shuttle AQS on cell growth by strain LQ25. Lowercase letters indicate different significance at 0.01 level, P < 0.01. n=3, Error bars=s.e.m. |
| 图选项 |
2.2.2 核黄素(VB2): 设置核黄素浓度5、25、50、75、100和150 mg/L,核黄素浓度对菌株LQ25生长的影响如图 3。核黄素浓度在5-100 mg/L,菌株细胞生长和蛋白质含量与核黄素浓度成正相关,当核黄素浓度为100 mg/L时,菌体蛋白质含量最高,相较于对照组(不添加核黄素)蛋白质含量提高26%。显著性分析显示,核黄素浓度为5 mg/L对菌株LQ25蛋白质含量具有显著促进(P < 0.05),其他核黄素浓度组都是极显著促进菌株LQ25生长及蛋白质含量(P < 0.01)。低浓度组(5、25和50 mg/L)之间对菌株蛋白质含量的影响没有显著差异(P > 0.05),同样地,高浓度组(75、100和150 mg/L)之间对菌株蛋白质含量的影响不显著(P > 0.05)。而两个高低浓度组对菌株LQ25生长的影响具有极显著差异(P < 0.01),由此可见,核黄素浓度是影响菌株LQ25生长的重要因素。
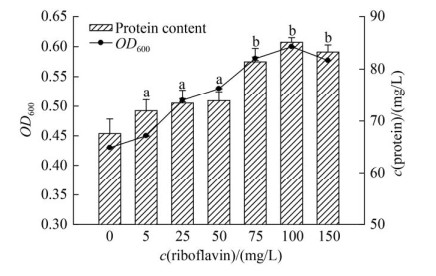 |
| 图 3 电子穿梭体核黄素浓度对菌株LQ25生长影响 Figure 3 The effects of concentration of electron shuttle riboflavin on cell growth by strain LQ25. Lowercase letters indicate different significance at 0.01 level, P < 0.01. n=3, Error bars=s.e.m. |
| 图选项 |
2.3 电子穿梭体对菌株LQ25异化铁还原性质的影响
2.3.1 蒽醌-2-磺酸钠(AQS): AQS浓度对菌株LQ25异化铁还原产生Fe(Ⅱ)浓度及铁还原酶活性的影响见图 4。AQS浓度在0.1-0.5 mmol/L,菌株LQ25异化Fe(Ⅲ)效率随AQS浓度增加而提高。当AQS浓度为0.5 mmol/L时,累积Fe(Ⅱ)浓度及铁还原酶活性达到最高,分别是12.95±0.08 mg/L和3.83±0.09 U,Fe(Ⅱ)浓度相较于对照组提高88%,铁还原酶活性是对照组的2.9倍。除0.1 mmol/L浓度组外,添加不同浓度电子穿梭体AQS实验组产生Fe(Ⅱ)浓度较对照组都有极显著提高(P < 0.01)。不接种菌株LQ25的对照组,含不同浓度AQS的培养基都没有测定出Fe(Ⅱ)的浓度。这表明培养液中Fe(Ⅱ)的累积由菌株LQ25异化还原Fe(Ⅲ)产生。各浓度组之间对菌株铁还原产生Fe(Ⅱ)浓度影响具有极显著差异(P < 0.01)。由此可见,AQS作为电子穿梭体加入异化铁还原培养体系能够显著提高菌株LQ25异化铁还原效率,AQS浓度是影响菌株异化铁还原过程的重要因素。
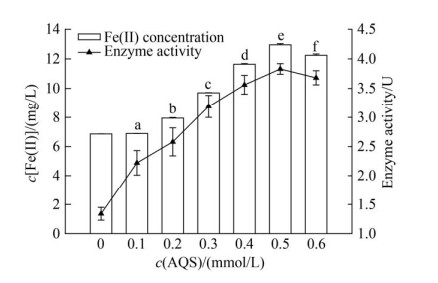 |
| 图 4 电子穿梭体AQS浓度对菌株LQ25异化铁还原影响 Figure 4 The effects of concentration of electron shuttle AQS on Fe(Ⅲ) reduction by strain LQ25 (lowercase letters indicate different significance at 0.01 level, P < 0.01) (n=3, Error bars=s.e.m.) |
| 图选项 |
2.3.2 核黄素(VB2): 核黄素(VB2)对菌株LQ25异化铁还原的影响见图 5。加入电子穿梭体核黄素,Fe(Ⅱ)累积产生浓度和铁还原酶活性随着核黄素浓度的增加呈现先升后降的趋势。在核黄素浓度为100 mg/L时,Fe(Ⅱ)浓度和铁还原酶活性最高,分别是11.06±0.04 mg/L和2.64±0.02 U。Fe(Ⅱ)浓度相较于对照组提高61%,铁还原酶活性是对照组1.9倍。不接种菌株LQ25的对照组,含不同浓度核黄素的培养基都没有测定出Fe(Ⅱ)的浓度。添加不同浓度的核黄素组,其对菌株LQ25异化铁还原效率具有极显著提高(P < 0.01)。在6个浓度组中,核黄素5 mg/L浓度组对菌株LQ25异化铁还原影响具有极显著性差异(P < 0.01),其他5个浓度梯度组(25、50、75、100和150 mg/L)之间对菌株LQ25异化铁还原影响没有显著性差异(P > 0.05)。根据产生Fe(Ⅱ)的累积浓度和培养基Fe(Ⅲ)的初始浓度,两者比值表示为铁还原率。根据数据计算,不同核黄素浓度下(0、5、25、50、75、100和150 mg/L),菌株LQ25铁还原率(平均值)分别是24.5%、35%、38.1%、38.9%、39.3%、39.2%和37.7%。显著性分析显示,5个浓度梯度组(25、50、75、100和150 mg/L)之间对菌株LQ25异化铁还原率的影响没有显著性差异(P > 0.05)。由此可见,核黄素作为外加电子穿梭体可促进菌株LQ25异化铁还原效率,核黄素浓度变化没有显著影响菌株异化铁还原过程。
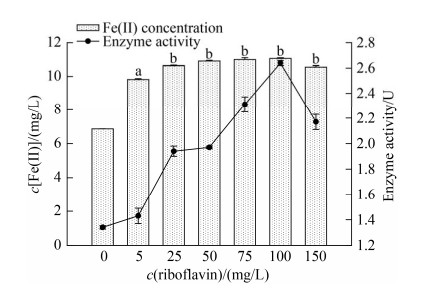 |
| 图 5 电子穿梭体核黄素浓度对菌株LQ25异化铁还原影响 Figure 5 The effects of concentration of electron shuttle riboflavin on Fe(Ⅲ) reduction by strain LQ25. Lowercase letters indicate different significance at 0.01 level, P < 0.01. (n=3, Error bars=s.e.m.) |
| 图选项 |
2.4 电子穿梭体对菌株LQ25发酵产物的影响 在没有外加电子穿梭体时,菌株LQ25在葡萄糖为电子供体、氢氧化铁为电子受体的异化铁培养体系下发酵产物主要是丁酸和乙酸。从表 1可以看出,无外加电子穿梭体时,菌株LQ25发酵液组分中,丁酸浓度是444.2 μL/mL,乙酸浓度是56.6 μL/mL,表现为典型的丁酸型发酵。外加电子穿梭体AQS的浓度为0.5 mmol/L时,菌株LQ25发酵液中乙酸浓度是对照组的4.43倍,达到251.2 μL/mL。外加电子穿梭体核黄素的浓度为100 mg/L时,发酵液中乙酸浓度是对照组的2.49倍。结果表明,外加电子穿梭体能够提高菌株LQ25发酵产物中乙酸相对含量。
表 1. 电子穿梭体对菌株LQ25发酵产物影响 Table 1. The effect of electron shuttles on fermentation products by strain LQ25
| Electron shuttles | Butyric acid/(μL/mL) | Acetic acid/ (μL/mL) | Relative content of acetic acid/% |
| Control | 444.2 | 56.6 | 12.7 |
| AQS | 434.7 | 251.2 | 36.6 |
| Riboflavin | 293.4 | 141.2 | 32.5 |
表选项
3 讨论 醌类物质是一种典型的外加电子穿梭体,如,蒽醌-2, 6-二磺酸盐(AQDS)接受电子被还原为2, 6-蒽氢醌-二磺酸盐(氢醌),释放电子被氧化为蒽醌-2, 6-二磺酸盐(醌)。电子穿梭体蒽醌-2, 6-二磺酸盐AQDS浓度影响细菌胞外电子传递效率。Bai等将铁还原细菌与胞外电子受体铁氧化物或针铁矿进行空间隔离(分离长度2 cm),当外加AQDS浓度增加10倍,铁还原速率从0.07增加到0.19 μmol/d,表明铁还原速率与电子穿梭体AQDS浓度有关[24]。Gerlach等研究电子穿梭体浓度对菌株Cellulomonas sp. ES6铁还原的影响,随着AQDS浓度增加铁还原效率也会相应提高,当AQDS浓度达到0.5 mmol/L时,铁还原效率最高,是对照组的1.5倍[25]。在针铁矿未达到饱和吸附之前,AQDS浓度越高,针铁矿解离速率也越大[26]。刘亮等研究发现AQDS浓度在1-500 μmol/L范围内,实验用3株细菌Klebsiella pneumonia L17、Aeromonas hydrophila HS01及Shewanella decolorationis S12异化铁还原效率与AQDS成正相关关系。而当AQDS浓度提高至1000 μmol/L,3株细菌的异化铁还原率都出现不同程度下降[27]。菌株Shewanella putrefaciens在以针铁矿为电子受体的异化铁培养条件下,外加电子穿梭体AQDS促进菌株还原过程。当AQDS浓度从0.025 mmol/L增大到0.3 mmol/L时,针铁矿还原率从50%增大到60%,变化幅度不大。可能是对于浓度为2.0 mmol/L的电子受体针铁矿,低浓度(如0.025 mmol/L)的AQDS已经能够完全承担电子传递,即使再增大AQDS浓度,针铁矿还原率没有出现明显提升[28]。
随着AQS浓度升高,AQS促进菌株异化铁还原效率下降的因素可能有两个方面:一方面,若电子穿梭体浓度较高,可能对微生物有毒害作用,抑制细胞代谢和生长[29];另一方面,AQS是电子传递的介质,本身不产生电子,菌株氧化有机物产生的电子数量是有限的,当添加的AQS超过一定界限后,多余的AQS不能完成电子传递的功能[30]。
以累积Fe(Ⅱ)浓度为指标,添加AQS和核黄素最高可分别提升菌株LQ25异化铁还原效率88%和61%。相比较典型外加电子穿梭体AQS,核黄素作为电子穿梭体促进菌株LQ25异化铁还原效率的影响相对较弱。周雨行等研究发现添加核黄素能够提高菌株Shewanella oneidensis的铁硫还原能力,证实核黄素具有较强的电子传递功能,加速对水体As(Ⅴ)的吸附[31]。Li等分析电子穿梭体核黄素对菌株Shewanella decolorationis NTOU1的电子传递效率的影响,结果显示浓度高于10 μmol时,核黄素可以显著提高菌株的电子传递效率[32]。事实上,核黄素作为外加型电子穿梭体能够提高胞外电子传递效率,同时,在许多菌株中发现核黄素可作为内在型电子穿梭体,并以此提高菌株胞外电子传递效率。Canstein等首次研究发现异化铁还原模式菌Shewanella自身能分泌核黄素介导胞外电子传递[20]。Wu等利用菌株Shewanella oneidensis MR-1为材料,研究发现电子受体能够影响菌株分泌核黄素从而影响胞外电子传递[33]。核黄素无论作为外加型还是内在型电子穿梭体,因其辅助形式FMN或FAD接受电子被还原为FMNH2或FADH2,也称为黄素氢醌;给出电子后,再转化为氧化型FMN或FAD。FMN和FAD能够接受电子及释放电子进行氧化和还原反应,是一种典型电子传递物质。而关于菌株LQ25是否分泌核黄素作为内在型电子穿梭体,还需进一步证实。
菌株LQ25属于发酵型异化Fe(Ⅲ)还原细菌,即在菌株异化铁还原过程中会产生中间代谢产物,如甲酸、乙酸、丁酸及乙醇等[34]。刘进超等研究发现,菌株Clostridium pasteurianum DSM525在氧化铁为电子受体培养下,其发酵产物乙酸和丁酸产量相比对照有显著增加[14]。由此可见,乙酸和丁酸含量能在一定程度上反映菌株发酵代谢类型以及异化铁还原细菌胞外电子传递状态。梭菌利用葡萄糖发酵代谢途径中,铁氧还蛋白氧化还原酶催化丙酮酸生成乙酰CoA,其中一部分可以生成乙酸,而另一部分则生成丁酸,乙酰CoA是乙酸和丁酸代谢途径的分节点[35]。根据纯培养梭菌发酵代谢途径[36],对于乙酸代谢支路,1分子葡萄糖转化成2分子乙酸可获得4分子ATP,反应见公式(1)。
| $\begin{array}{l}{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{12}}}}{{\rm{O}}_{\rm{6}}}{\rm{ + 2NA}}{{\rm{D}}^ + }{\rm{ + 4ADP + 4Pi + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to \\{\rm{2C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH + 2NADH + 2}}{{\rm{H}}^ + }{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{ + 2C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4ATP}}\end{array}$ | 公式(1) |
| $\begin{array}{l}{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{12}}}}{{\rm{O}}_{\rm{6}}}{\rm{ + 3ADP + 3Pi + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to \\{\rm{C}}{{\rm{H}}_{\rm{3}}}{\left( {{\rm{C}}{{\rm{H}}_{\rm{2}}}} \right)_{\rm{2}}}{\rm{COOH + 2}}{{\rm{H}}_{\rm{2}}}{\rm{ + 2C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 3ATP}}\end{array}$ | 公式(2) |
实验菌株LQ25分离自海洋沉积物,是一株发酵型异化铁还原细菌。关于电子穿梭体介导下菌株LQ25的还原机制研究,将有助于进一步揭示发酵型异化铁还原菌的铁还原机制,从而推动有关微生物异化铁还原机制的研究进程。
4 结论 异化铁还原细菌Clostridium butyricum LQ25分离自海洋沉积物。在异化铁还原培养体系中,菌株LQ25能够以葡萄糖为电子供体和氢氧化铁为电子受体进行异化铁还原。在外加电子穿梭体蒽醌-2-磺酸钠时,菌株LQ25异化铁还原累积产生Fe(Ⅱ)浓度都极显著提高(P < 0.01)。当蒽醌-2-磺酸钠浓度为0.5 mmol/L时,累积Fe(Ⅱ)浓度为12.95±0.08 mg/L,相比对照组提高88%。核黄素作为外加电子穿梭体添加至培养体系,菌株LQ25生长和异化铁还原都显著提高。当核黄素浓度为100 mg/L时,累积Fe(Ⅱ)浓度是11.06±0.04 mg/L,相比对照组提高61%。发酵产物分析结果表明,外加电子穿梭体能够改变菌株LQ25发酵产物中丁酸和乙酸相对含量。相比对照组,外加蒽醌-2-磺酸钠和核黄素实验组中发酵产物乙酸相对含量分别提高24%和20%。研究结果为丰富发酵型异化铁还原细菌胞外电子传递机制提供实验支持。
References
| [1] | Si YB, Wang J. Influence of dissimilatory iron reduction on the speciation and bioavailability of heavy metals in soil. Environmental Science, 2015, 36(9): 3533-3542. (in Chinese) 司友斌, 王娟. 异化铁还原对土壤中重金属形态转化及其有效性影响. 环境科学, 2015, 36(9): 3533-3542. |
| [2] | Wu K, Yang YR, Zhou C, Jiang J, Si YB. Organic acids enhanced and Fe(Ⅲ) reduction mediated sulfamethoxazole degradation by Shewanella oneidensis MR-1. Acta Scientiae Circumstantiae, 2019, 39(7): 2117-2124. (in Chinese) 吴康, 杨玉蓉, 周晨, 蒋瑾, 司友斌. 有机酸强化Fe(Ⅲ)还原介导的Shewanella oneidensis MR-1降解磺胺甲噁唑. 环境科学学报, 2019, 39(7): 2117-2124. |
| [3] | He YX, Gong YF, Su YM, Zhang YL, Zhou XF. Bioremediation of Cr (Ⅵ) contaminated groundwater by Geobacter sulfurreducens: Environmental factors and electron transfer flow studies. Chemosphere, 2019, 221: 793-801. DOI:10.1016/j.chemosphere.2019.01.039 |
| [4] | Si YB, Zou Y, Liu XH, Si XY, Mao JD. Mercury methylation coupled to iron reduction by dissimilatory iron-reducing bacteria. Chemosphere, 2015, 122: 206-212. DOI:10.1016/j.chemosphere.2014.11.054 |
| [5] | Zhang YC, Xiao LL, Wang OM, Liu FH. Hydrogen-producing and electrochemical properties of a dissimilatory Fe(Ⅲ) reducer Clostridium bifermentans EZ-1. Acta Microbiologica Sinica, 2018, 58(4): 525-537. (in Chinese) 张月超, 肖雷雷, 王欧美, 刘芳华. 异化铁还原梭菌Clostridium bifermentans EZ-1产氢与电化学特性. 微生物学报, 2018, 58(4): 525-537. |
| [6] | Li GY, Zeng X, Shao ZZ. Dissimilatory iron reducing microorganisms in South Mid-Atlantic Ridge hydrothermal fields and their mineralized products. Acta Microbiologica Sinica, 2019, 59(7): 1295-1306. (in Chinese) 李光玉, 曾湘, 邵宗泽. 南大西洋中脊热液区异化铁还原微生物及其矿化产物分析. 微生物学报, 2019, 59(7): 1295-1306. |
| [7] | 韩蕊. Shewanella oneidensis MR-1外膜细胞色素c介导的胞外电子传递过程研究. 华南理工大学博士学位论文, 2016. |
| [8] | Liu PC, Zhu WW, Xiao X. Metabolic networks of electricigens Shewanella for anaerobic respiration. Microbiology China, 2015, 42(11): 2238-2244. (in Chinese) 刘鹏程, 朱雯雯, 肖翔. 产电微生物Shewanella菌厌氧呼吸代谢网络研究进展. 微生物学通报, 2015, 42(11): 2238-2244. |
| [9] | Wu YD, Li FB, Liu TX. Mechanism of Extracellular electron transfer among microbe-humus-mineral in soil: A review. Acta Pedologica Sinica, 2016, 53(2): 277-291. (in Chinese) 吴云当, 李芳柏, 刘同旭. 土壤微生物-腐殖质-矿物间的胞外电子传递机制研究进展. 土壤学报, 2016, 53(2): 277-291. |
| [10] | Sun D, Wan XY, Liu WZ, Xia X, Huang FL, Wang AJ, Smith JA, Dang Y, Holmes DE. Characterization of the genome from Geobacter anodireducens, a strain with enhanced current production in bioelectrochemical systems. RSC Advances,, 2019, 9(44): 25890-25899. DOI:10.1039/C9RA02343G |
| [11] | Liu X, Jing XY, Ye Y, Zhan J, Ye J, Zhou SG. Bacterial vesicles mediate extracellular electron transfer. Environmental Science & Technology Letters, 2020, 7(1): 27-34. |
| [12] | Dalla Vecchia E, Suvorova EI, Maillard J, Bernier-Latmani R. Fe(Ⅲ) reduction during pyruvate fermentation by Desulfotomaculum reducens strain MI-1. Geobiology, 2014, 12(1): 48-61. DOI:10.1111/gbi.12067 |
| [13] | Li X, Zeng X, Qiu DH, Zhang Z, Zhang XB, Shao ZZ. Extracellular electron transfer in fermentative bacterium Anoxybacter fermentans DY22613T isolated from deep-sea hydrothermal sulfides. Science of the Total Environment, 2020, 722: 137723. DOI:10.1016/j.scitotenv.2020.137723 |
| [14] | Liu JC, Liu FH, Zhang YC, Meng DL, Wang XM, Xiao LL. Iron and manganese oxides enhance electron output efficiency of Clostridium pasteurianum. Microbiologica China, 2020, 47(1): 24-34. (in Chinese) 刘进超, 刘芳华, 张月超, 孟德龙, 王学明, 肖雷雷. 铁锰氧化物提高巴斯德梭菌电子输出率. 微生物学通报, 2020, 47(1): 24-34. |
| [15] | Newman DK, Kolter R. A role for excreted quinones in extracellular electron transfer. Nature, 2000, 405(6782): 94-97. DOI:10.1038/35011098 |
| [16] | Wang HM, Liu S, Liu D. Comparison between redective dissolution of jarosite by sulfate reducing bacteria and dissimilatory iron reducing bacteria. Earth Science, 2015, 40(2): 305-316. (in Chinese) 王红梅, 刘烁, 刘邓. 硫酸盐还原菌及异化铁还原菌对黄钾铁矾还原作用的对比. 地球科学, 2015, 40(2): 305-316. |
| [17] | Liu W, Wu YD, Liu XT, Li FB, Dong H, Jing MQ. Influence of incubation temperature on 9, 10-anthraquinone-2-sulfonate (aqs)-mediated extracellular electron transfer. Frontiers in Microbiology, 2019, 10: 464. DOI:10.3389/fmicb.2019.00464 |
| [18] | You LX, Liu LD, Xiao Y, Dai YF, Chen BL, Jiang YX, Zhao F. Flavins mediate extracellular electron transfer in Gram-positive Bacillus megaterium strain LLD-1. Bioelectrochemistry, 2018, 119: 196-202. DOI:10.1016/j.bioelechem.2017.10.005 |
| [19] | Zhou C, Wang HQ, Si YB, Wu K, Yousaf A. Electron shuttles enhance the degradation of sulfamethoxazole coupled with Fe(Ⅲ) reduction by Shewanella oneidensis MR-1. Environmental Toxicology and Pharmacology, 2018, 62: 156-163. DOI:10.1016/j.etap.2018.07.006 |
| [20] | Canstein H, Ogawa J, Shimizu S, Lloyd JR. Secretion of flavins by Shewanella Species and their role in extracellular electron transfer. Applied and Environmental Microbiology, 2008, 74(3): 615-623. DOI:10.1128/AEM.01387-07 |
| [21] | Wang PP, Dong FQ, He HC, Liu MX, Luo ZP, Wang XH, Zhou L, Huo TT. Research on riboflavin and AQS mediated P25 photocatalytic reduction of uranium (Ⅵ). Industrial Minerals & Processing, 2019, 48(4): 59-64. (in Chinese) 王萍萍, 董发勤, 何辉超, 刘明学, 罗昭培, 王旭辉, 周磊, 霍婷婷. 核黄素及AQS介导P25光电子还原铀(Ⅵ)研究. 化工矿物与加工, 2019, 48(4): 59-64. |
| [22] | Liu HY, Wang S. Characteristics of chromate reduction by Fe(Ⅲ) reduction using mixed bacteria from marine sediment. Marine Sciences, 2019, 43(5): 19-26. (in Chinese) 刘洪艳, 王珊. 海洋沉积物中异化铁还原细菌还原重金属Cr(Ⅵ)研究. 海洋科学, 2019, 43(5): 19-26. |
| [23] | Wang JC, Lin Y, Sun BL. Localization and characterization of Fe(Ⅲ) reductase of Desulfovibrio dechloracetivorans strain SF3. Journal of University of Science and Technology of China, 2009, 39(4): 337-343. (in Chinese) 王佳晨, 林洋, 孙宝林. Desulfovibrio dechloracetivorans strain SF3三价铁还原酶的定位和性质的研究. 中国科学技术大学学报, 2009, 39(4): 337-343. |
| [24] | Bai YG, Mellage A, Cirpka OA, Sun TR, Angenent LT, Haderlein SB, Kappler A. AQDS and redox-active NOM enables microbial Fe(Ⅲ)-mineral reduction at cm-scales. Environmental Science and Technology, 2020, 54(7): 4131-4139. DOI:10.1021/acs.est.9b07134 |
| [25] | Gerlach R, Field EK, Viamajala S, Peyton BM, Apel WA, Cunningham AB. Influence of carbon sources and electron shuttles on ferric iron reduction by Cellulomonas sp. strain ES6. Biodegradation, 2011, 22(5): 983-995. DOI:10.1007/s10532-011-9457-1 |
| [26] | Zhu WH, He XY, Wang RH, Huang TL. Influence of quinone organic matter on the characteristics of the microbial dissimilatory reduction of goethite. Acta Scientiae Circumstantiae, 2014, 34(9): 2286-2291. (in Chinese) 朱维晃, 何晓娅, 王瑞华, 黄廷林. 蒽醌类有机质对针铁矿异化还原解离特征影响. 环境科学学报, 2014, 34(9): 2286-2291. |
| [27] | Liu L, Yang Y, Li XF, Zhang WY, Feng JS. Relationship between the properties and the electron mediating effect of electron shuttles for the bioreduction of goethite. Journal of Changzhou University: Natural Science Edition, 2016, 28(6): 86-94. (in Chinese) 刘亮, 杨彦, 李晓芳, 张文艺, 冯俊生. 铁生物还原过程电子介体电子穿梭效应与其性质关系研究. 常州大学学报: 自然科学版, 2016, 28(6): 86-94. |
| [28] | 王瑞华. "醌-针铁矿-微生物"相互作用特征及其对有机污染物降解的初步试验研究. 西安建筑科技大学博士学位论文, 2015. |
| [29] | Nevin KP, Lovley DR. Potential for nonenzymatic reduction of Fe(Ⅲ) via electron shuttling in subsurface sediments. Environmental Science & Technology, 2000, 34(12): 2472-2478. |
| [30] | Liu AK, Gu MQ, Wei SZ, Wu GX. Enhanced anaerobic degradation of direct blue 15 by anthraquinone-2, 6-disulfonate (AQDS). Water Purification Technology, 2019, 38(2): 63-68. (in Chinese) 刘爱科, 顾梦琪, 魏书斋, 吴光学. 蒽醌-2, 6-二磺酸(AQDS)强化厌氧降解直接蓝15. 净水技术, 2019, 38(2): 63-68. |
| [31] | Zhou YH, Nie ZY, Xia X, Xia JL, Liu LZ, Wang N. Microbe-mediated iron-sulfur reduction coupled adsorption behavior of As(Ⅴ) in water. Technology of Water Treatment, 2018, 44(8): 35-40. (in Chinese) 周雨行, 聂珍媛, 夏旭, 夏金兰, 刘李柱, 王娜. 微生物铁硫还原耦合水体中As(Ⅴ)吸附行为研究. 水处理技术, 2018, 44(8): 35-40. |
| [32] | Li SL, Wang YJ, Chen YC, Liu SM, Yu CP. Chemical characteristics of electron shuttles affect extracellular electron transfer: Shewanella decolorationis NTOU1 Simultaneously exploiting acetate and mediators. Frontiers in microbiology, 2019, 10: 399. DOI:10.3389/fmicb.2019.00399 |
| [33] | Wu C, Cheng YY, Li BB, Li WW, Li DB, Yu HQ. Electron acceptor dependence of electron shuttle secretion and extracellular electron transfer by Shewanella oneidensis MR-1. Bioresource Technology, 2013, 136: 711-714. DOI:10.1016/j.biortech.2013.02.072 |
| [34] | Dong YR, Sanford RA, Chang YJ, McInerney MJ, Fouke BW. Hematite reduction buffers acid generation and enhances nutrient uptake by a fermentative iron reducing bacterium, Orenia metallireducens strain Z6. Environmental Science & Technology, 2017, 51(1): 232-242. |
| [35] | Lee J, Jang YS, Han MJ, Kim JY, Lee SY. Deciphering Clostridium tyrobutyricum metabolism based on the whole-genome sequence and proteome analyses. mBio, 2016, 7(3): e00743-16. DOI:10.1128/mbio.00743-16 |
| [36] | Dwidar M, Park JY, Mitchell RJ, Sa ng. The future of butyric acid in industry. The Scientific World Journal, 2012, 2012: 1-10. |
