张文博, 李昱龙, 周蕾, 沈东霞, 朱丽华, 樊奔


南京林业大学林学院, 南方现代林业协同创新中心, 江苏南京 210037
收稿日期:2020-06-06;修回日期:2020-07-04;网络出版日期:2020-07-10
基金项目:国家重点研发计划(2018YFC1200400);国家自然科学基金(31970097);江苏省高校自然科学研究重大项目(17KJA220001)
*通信作者:樊奔, Tel: +86-25-85427301;E-mail: fanben@njfu.edu.cn.
摘要:[目的] 由松材线虫导致的松树萎蔫病是松树的毁灭性病害,也是我国最主要的林业病害之一。本研究测评了在农业上广泛使用的、我国微生物肥料行业主要菌种资源之一——贝莱斯芽孢杆菌,对松材线虫的潜在抑杀性能。[方法] 选用贝莱斯芽孢杆菌的代表性菌株FZB42为材料,测定对不同条件下的菌液上清、不同菌株的菌液上清、细菌素plantazolicin的提取物以及菌体直接接触等方式,对松材线虫死亡率/存活率的影响,并构建FZB42生物膜合成缺损菌株,测定比较其对松材线虫存活率的影响。[结果] 相比于Landy培养基,使用LB培养基得到的菌液上清,对松材线虫具有明显抑杀性,培养48 h的菌液上清比培养24 h的菌液上清抑杀性更强,同时,菌液上清的抑杀效能随浓度升高及处理时间增长而有所增加。其中,使用培养48 h后收集的LB菌液上清处理48 h,松材线虫死亡率可高达约50%。之前报道对秀丽隐杆线虫有杀线虫活性的细菌素plantazolicin,经不同突变株上清以及plantazolicin提取物测试,被证实对松材线虫无抑制作用。直接接触实验表明,尽管FZB42的生物膜形成作用会刺激松材线虫提高抗胁迫能力,但整体而言,菌体接触对松材线虫亦有明显抑杀效果。[结论] 本研究通过严格细致的测试证明,贝莱斯芽孢杆菌FZB42对松材线虫具有抑杀性,该抑杀作用的分子基础和作用机理有待深入挖掘,但其与plantazolicin无关。作为安全性好、研究开发程度高的一类生防菌株,贝莱斯芽孢杆菌在防治松材线虫病方面的潜在价值值得关注。
关键词:贝莱斯芽孢杆菌FZB42松材线虫杀线虫活性plantazolicin
Inhibition of pine wood nematode Bursaphelenchus xylophilus by rhizobacterium Bacillus velezensis FZB42
Wenbo Zhang, Yulong Li, Lei Zhou, Dongxia Shen, Lihua Zhu, Ben Fan


Co-Innovation Center for Sustainable Forestry in Southern China, College of Forestry, Nanjing Forestry University, Nanjing 210037, Jiangsu Province, China
Received: 6 June 2020; Revised: 4 July 2020; Published online: 10 July 2020
*Corresponding author: Ben Fan, Tel: +86-25-85427301; E-mail: fanben@njfu.edu.cn.
Foundation item: Supported by the National Key R & D Program of China (2018YFC1200400), by the National Natural Science Foundation of China (31970097) and by the Key Scientific Project for Jiangsu Provincial Universities (17KJA220001)
Abstract: [Objective] Pine wilt disease caused by the pine wood nematode Bursaphelenchus xylophilus is a destructive disease of pines and one of the most dangerous forestry diseases in China. Bacillus velezensis strains are widely used in agriculture as microbial agents for promoting plant growth and the major bacterial resources in China's microbial fertilizer industry. In this study we evaluated the inhibition of Bu. xylophilus by Ba. velezensis. [Methods] Ba. velezensis FZB42 was used as a representative strain in the study. The inhibition was determined using supernatants of FZB42 cultures under different conditions, the supernatants of different mutants, the extract of plantazolicin, and the direct FZB42 contact on the mortality/survival rate of Bu. xylophilus. An FZB42 mutant deficient in biofilm formation was constructed and its effect on the survival rate of Bu. xylophilus was also determined. [Results] Compared with Landy medium, the supernatant of FZB42 cultured in LB medium had a significant inhibitory effect on Bu. xylophilus. The supernatant collected at the 48th hour after inoculation was more inhibitory than that collected at the 24th hour. The inhibitory efficacy improved with the increase of supernatant concentration and treatment time. Using LB culture supernatant collected at the 48th hour to treat nematodes for 48 h could result in a mortality rate of the nematodes as high as about 50%. The tests with the supernatants of different mutants and the culture extracts showed that plantazolicin, a bacteriocin reported to have a nematocidal activity against Caenorhabditis elegans, had no inhibitory effect on Bu. xylophilus. Direct contact experiments also showed that FZB42 significantly decreased the survival rate of Bu. xylophilus, although the bacterial biofilm formation could enhance Bu. xylophilus resistance to stress. [Conclusion] We demonstrated with laborious but strict assays that Ba. velezensis FZB42 had an inhibitory effect on the pine wood nematode Bu. xylophilus. The molecular basis and mechanism of the inhibitory effect need to be further explored, but it has proved to be not related with plantazolicin. As a group of biocontrol strains with good safety, profound basis research and high degree of development, the potential application value of Ba. velezensis in the control of the pine wood nematode deserves our attention.
Keywords: Bacillus velezensisFZB42Bursaphelenchus xylophilusnematocidal activityplantazolicin
由松材线虫(Bursaphelenchus xylophilus)引起的松萎蔫病(pine wilt disease,PWD),是一种毁灭性的松树流行病,在东亚地区尤为严重,也是我国最主要的林业病害。目前,我国遭受松萎蔫病危害的森林面积不断扩大,直接和间接经济损失累积上千亿元[1-2],林业部门面临的防控形势异常严峻;而对其治理方式,当前仍以预防和清除病死疫木方式为主,总的来说,尚无非常有效的根除或控制手段。
近10余年,国内外植物根际微生物的研究有了长足发展,人们对“植物—微生物”相互作用的机制有了更加深刻的理解,以微生物肥料为主要形式的根际微生物开发利用产业,在我国正蓬勃发展。在各类根际微生物中,芽孢杆菌由于能够产生抗逆性极强的芽孢,在菌剂的生产、运输、存储和应用过程中具有突出的优势;因此,由芽孢杆菌制成的微生物肥料占据了我国80%的产品市场,而在各类芽孢杆菌中,使用最多的菌种则是贝莱斯芽孢杆菌(Bacillus velezensis)。
贝莱斯芽孢杆菌FZB42是同类细菌中研究最为深入的代表性菌株之一[3-5],迄今为止,关于该菌株的学术论文已有300多篇[6]。FZB42曾是解淀粉芽孢杆菌植物亚种(Ba. amyloliquefaciens plantarum)的模式菌株[3],但2016年有研究表明,该亚种和更早命名的贝莱斯芽孢杆菌,乃同种异名[4-5],故将FZB42更名为贝莱斯芽孢杆菌。FZB42将约10%的基因组资源,都用于抗生素或细菌素等拮抗物质的合成,其中包括几种聚酮类化合物(difficidin,bacillaene,macrolactin)、脂肽类化合物(surfactin,fengycin,bacillomycin D)以及一种抑菌能力十分突出的二肽化合物bacilysin[7-14]。这些抗生素对应的基因基础、合成途径和调控机制等方面大多已被深入研究。此外,FZB42还能够产生强健的生物膜,具有高效的根部定殖能力,这对于帮助植物抵御病原微生物的侵袭,亦有显著贡献。
总的来说,FZB42作为实验材料,已被用于多种抗生素的分子基础和合成路径研究,为该类菌株在农业上的施用提供了理论依据,但迄今为止,该类菌株在林业上的应用研究仍寥寥无几。2011年,研究者在FZB42中鉴定出了1种新的噻唑/恶唑类型的细菌素(命名为plantazolicin)[15-16],2013年有报道认为,plantazolicin具有抑杀秀丽隐杆线虫(Caenorhabditis elegans)的活性[17],这促使我们去思考,该物质是否也有杀死松材线虫的活性。因此,在本研究中我们使用FZB42对松材线虫的潜在抑制性进行了测定评价,为松萎蔫病防控工作摸索新的突破方向和思路。
1 材料和方法 1.1 培养基、菌株和虫株 全文所用菌株及虫株信息详见表 1。松材线虫AMA3c1为野生松材线虫Bu. xylophilus AMA3的全同胞近交系,使用灰葡萄孢菌饲养AMA3c1。FZB42野生型为本实验室保藏,其衍生突变株RS06和RS31由德国洪堡大学Rainer Borriss教授赠送,生物膜突变株FBS262和FBS296为本研究中构建。各菌株使用LB或Landy培养基培养[18],需要补充相应抗生素之处见文中信息。plantazolicin生产培养基参见文献[15]。
表 1. 文中使用的线虫、真菌和细菌菌株 Table 1. Nematode, fungal and bacterial strains used
| Strains | Description | Sources or references |
| AMA3c1 | Bu. xylophilus derivate | [19] |
| FZB42 | Ba. velezensis, wild type | Laboratory stock |
| RS06 | FZB42, sfp: : emAM bacA: : cmR, deficient in lipopeptides, polyketides and bacilysin | [18] |
| RS31 | RS06, pznC: : spc, does not produce plantazolicin | [15] |
| FBS262 | FZB42, tasA: : speR | This work |
| FBS296 | FZB42, tasA: : speR,epsA: : kmR | This work |
表选项
1.2 无菌松材线虫制备 使用Zhu等描述的方法制备无菌线虫[19],简述如下:首先用Baermann漏斗收集线虫,然后将收集的线虫悬浮液倒在无菌盖玻片上,使其在25 ℃培养皿中产卵4–6 h。将附着在盖玻片表面的虫卵用无菌水冲洗几次,去除线虫。盖玻片用15% H2O2消毒60 min,然后再用无菌水冲洗3次。随后,将盖玻片上消过毒的虫卵置于灰葡萄孢的平板上,使其在25 ℃下孵化。在无菌条件下用Baermann漏斗收集繁殖的线虫,保存在4 ℃冰箱备用。使用前检查无菌情况,避免污染。
1.3 plantazolicin粗提物制备 从FZB42细胞中提取plantazolicin的方法参考文献[17]。简言之,将FZB42在PZN生产培养基上培养1 d,从5个平板上收集菌落,溶解于21 mL乙腈与9 mL蒸馏水的混合液中。再将30 μL的甲酸添加到混合物中,充分涡旋,然后8000 r/min离心20 min收集上清液。将上清液用0.45 μm滤膜过滤,然后用旋转蒸发仪小心干燥(30 ℃,100 r/min,80 mbar)。将干燥后的提取物溶于2 mL (乙腈-水-甲酸)混合液,然后转移至无菌管中,再次用真空蒸发仪蒸发。称重干燥后的提取物,溶解于特定体积的甲醇中,进行后续HPLC-ESI-MS分析和线虫实验。
1.4 HPLC–ESI-MS分析 提取物分离使用UltiMate 3000 UHPLC色谱系统(Thermo Fisher Scientific)。使用Sun Fire C18 (4.6 mm×150 mm)色谱柱,流速设置为0.4 mL/min,线性梯度为20%至98%乙腈和0.1%甲酸8 min,并将98%乙腈保持2 min。质谱分析使用LTQ Orbitrap XL质谱仪(Thermo Fisher Scientific),以阳离子模式进行,质量窗口设置为500–1400 Da。
1.5 FZB42生物膜合成缺陷菌株的构建 提取FZB42的全基因组DNA为模板,使用引物FBO797 (5′-TATGAGCAGACAGAGGAAAA-3′)和FBO800 (5′-GATAAAAAAAG-CAAAACGAT-3′)进行PCR扩增tasA区段,转入T载体后,以限制性内切酶EcoR I切开,插入壮观霉素抗性基因(speR)片段,构建重组质粒pFB219。再将pFB219转化FZB42,挑选阳性克隆进行菌落PCR验证,得到正确的突变体FBS262(ΔtasA: : speR)。同理,使用引物FBO801 (5?-GCTCTCCTATTCCCGTGT-3?)和FBO804 (5?-AATAGAAGATAAATGTAAAAAGC-3?)进行PCR扩增epsA区段,以卡那霉素抗性基因(kmR)为标记,构建重组质粒pFB218。再将该质粒转化FBS262,挑选阳性克隆,测序验证得到突变株FBS296 (ΔtasA: speR; ΔepsA: kmR)。
1.6 芽孢悬液制备 芽孢悬液制备参考文献[20]。
1.7 不同处理下松材线虫死亡/存活率检验
1.7.1 用FZB42菌液上清处理: 将FZB42野生型在LB或Landy培养基中分别培养24 h和48 h,收集菌液并离心,将上清转移到新管中,过滤除去细菌细胞。然后将40 μL或120 μL上清添加至24孔板中,再加入360 μL无菌松材线虫悬液(约1000条),立即对上清分别进行1:9和1:3稀释。温育24 h和48 h后,分别计算线虫的死亡率。阴性对照不加上清,仅加相应体积的LB或者Landy培养基,处理和对照均设置4个重复。通过显微观察确定松材线虫的死亡情况:每次用10倍物镜观察20 μL线虫悬浮液,如果观察到线虫不运动,且用细针轻轻敲击其身体不引起任何反应,则认为线虫死亡。含plantazolicin的菌液上清实验,除培养基不同之外,其余步骤类似上述过程。
1.7.2 用plantazolicin粗提物处理: 用甲醇将plantazolicin提取物的浓度分别调整为600 mg/mL和300 mg/mL。在24孔板每孔中加入360 μL无菌水和20 μL FZB42细胞提取物,然后再加入20 μL松材线虫悬液(约2000条)进行测试。对照孔用20 μL甲醇代替plantazolicin粗提物,处理和对照设5个重复。25 ℃下孵育18、28、40、64、96 h后,分别确定线虫死亡率。确定线虫的死亡的方法同上清液测试。
1.7.3 菌体接触处理: 将FZB42野生型和生物膜合成缺陷株FBS296,分别按1%接种量接种到DSM孢子形成培养基中,37 ℃、200 r/min培养36 h后,离心收集芽孢。用无菌PBS缓冲液(pH 7.0)将芽孢沉淀洗涤3次,最后用相同的PBS缓冲液稀释至OD600 3.0,再将10 μL孢子悬浮液用1 mL线虫悬液(约3000条)稀释,将稀释液置于24孔板中,25 ℃温育2、4、6、8、10、12 d后分别确定线虫的存活率。对照组不含细菌,每组设置3个重复,每孔取样3次进行观察,每次观察5 μL悬液。
1.8 数值统计 使用卡方检验比较线虫死亡率或存活率的差异显著性。
2 结果和分析 2.1 不同条件下FZB42菌液上清对松材线虫的抑制作用 为了测试贝莱斯芽孢杆菌FZB42对松材线虫的潜在抑制性,我们优先采用了一种简单方便的策略:将无菌松材线虫置于一定浓度的FZB42菌液上清中,培养一段时间后检测其死亡率。由于FZB42在不同生长时间、不同培养基中,会以不同的效率生成不同的代谢产物(包括抗生素),因此我们使用了两种培养基(常用普通培养基LB和FZB42抗生素生成常用培养基Landy培养基),两个生长时期(培养24和48 h后)取样的上清,按两种比例稀释(1:3和1:9)添加至线虫悬液,并分别处理松材线虫24 h和48 h后进行检测。
测试结果如图 1和表 2所示,在上清浓度为1:9稀释的情况下,只有1组处理与对照有差别;而在1:3稀释的情况下,有5组处理与对照有差别,这说明1:3稀释的上清,对线虫有较明显的抑制作用。两种培养液上清的对比发现,添加LB培养液的上清,有4组处理与对照有显著差别,其对线虫的抑制率高出对照组10%–20%;而添加Landy培养基的上清,只有两组处理与对照有差别,且仅比对照组高3%–5%,这说明FZB42在LB中产生的代谢物对松材线虫有强烈的抑制作用。
 |
| 图 1 不同条件下贝莱斯芽孢杆菌FZB42上清液对松材线虫死亡率的影响 Figure 1 Effects of different culture supernatants of Ba. velezensis FZB42 on the mortality of Bu. xylophilus. The supernatants of Ba. velezensis FZB42 cultured in LB and in Landy medium (LD) were collected at the 24th (24S) and the 48th (48S) hour after inoculation and then diluted with Bu. xylophilus suspension by 1:9 or 1:3. The control (CK) contained no supernatant but only LB or Landy medium. Death rates of the nematodes were determined after incubation for 24 h or 48 h. Four replicates were used for each group. Significance of the discrepancies were calculated by Chi-square test according to the data in Table 2. *: P < 0.05; **: P < 0.001; ****: P < 0.0001. |
| 图选项 |
表 2. 添加贝莱斯芽孢杆菌FZB42菌液后松材线虫死亡/存活情况统计 Table 2. Statistics of dead or survived Bu. xylophilus in suspensions supplemented with different Ba. velezensis FZB42 supernatants
| Dilution | Nematode status | With supernatants from LB | With supernatants from Landy medium | |||||||||||||
| Incubation for 24 h | Incubation for 48 h | Incubation for 24 h | Incubation for 48 h | |||||||||||||
| CK | 24S | 48S | CK | 24S | 48S | CK | 24S | 48S | CK | 24S | 48S | |||||
| 1:9 | Dead | 1 | 10 | 4 | 2 | 8 | 16 | 0 | 0 | 4 | 2 | 7 | 4 | |||
| Survived | 32 | 211 | 112 | 72 | 83 | 78 | 35 | 38 | 78 | 75 | 77 | 123 | ||||
| 1:3 | Dead | 2 | 9 | 17 | 24 | 16 | 53 | 0 | 5 | 6 | 0 | 4 | 6 | |||
| Survived | 80 | 39 | 51 | 104 | 54 | 52 | 31 | 69 | 89 | 181 | 107 | 127 | ||||
| Each number is an accumulation of replicates from four wells (80 μL in total). 24S: the supernatants collected at the 24th hour after inoculation. 48S: the supernatants collected at the 48th hour after inoculation. Death rate=dead nematodes/(dead nematodes+survived nematodes)×100%. | ||||||||||||||||
表选项
从线虫处理时间上可以发现,处理48 h导致的线虫死亡率明显偏高于处理24 h,这与常理相符,也为后续研究提供了一个基本的参考。其次,在LB中培养48 h后收集的上清,比培养24 h后收集的上清有更加明显的抑制效果,因此我们推测,FZB42抑制物质的产生主要集中于稳定期中后期。综合来看,对线虫抑制程度最高的处理组,是使用48 h收集的LB培养液上清处理线虫48 h,这种条件下松材线虫死亡率高达约50%,而其他处理组的抑杀率基本都在20%以下。
上述这些数据为以后分离鉴定FZB42的抑制物质,提供了基本的参数依据。
2.2 不同菌株上清对松材线虫的抑制作用 为了测试FZB42产生的plantazolicin是否具有抑杀松材线虫的活性,利用与上述实验类似的方法,对3株细菌(FZB42野生型、突变株RS06和RS31)的培养液上清进行测定。为了方便比较,将检测结果分别按照处理时间和上清液的稀释倍数分组展示。从图 2-A、2-B、2-C可知,在同样处理时间条件下,随着上清液浓度增加松材线虫的死亡率明显提高,说明了松材线虫所受的抑制效果具有浓度依赖性;但是在同一稀释倍数下,3个菌株上清的抑制性均无统计学上的显著差异(图 2-D、2-E、2-F)。与野生型相比,RS06菌株丧失了大部分抗生素合成能力,而RS31是在RS06基础上构建的,进一步丧失了plantazolicin的合成能力。因此,这里的结果暗示,RS06所不能合成的那些抗生素和plantazolicin,对线虫均无显著的抑制作用。
 |
| 图 2 3种菌株上清对松材线虫死亡率的影响 Figure 2 Effect of the culture supernatants of three strains on the mortality of Bu. xylophilus. The supernatants of Ba. velezensis FZB42 wild type, the mutants RS06 and RS31, cultured in plantazolicin production medium were diluted with Bu. xylophilus suspension by 1:5 (D), 1:2 (E) or 2:1 (F). Death rates of the nematodes were determined after incubation for 10 h (A), 28 h (B) and 48 h (C). Four replicates were used for each group. Significance of the discrepancies were calculated by Chi-square test. |
| 图选项 |
2.3 plantazolicin提取物对松材线虫的抑制性 由于考虑到plantazolicin在上清中的浓度不够高而导致上述实验无差别的结论,因此我们决定对plantazolicin进行提取和再实验。提取物通过HPLC结合ESI质谱分析。HPLC图谱中显示一个特异峰,该峰出现在FZB42和RS06的提取物中,但没有出现在RS31的提取物中,这与RS31中plantazolicin合成基因簇被破坏的性质一致;另外,该特异性峰的持留时间(RT)为7.32 min (图 3-A),与之前报道的plantazolicin的保留时间相近。ESI-MS进一步分析表明,该峰对应分子的m/z= 1336.48 [M+H]+和m/z=668.74 [M+2H]2+,表明该化合物的分子量为1335.47 g/mol (图 3-B),MS谱图和分子量与以前的报告完全相同,这些结果表明成功提取了plantazolicin。
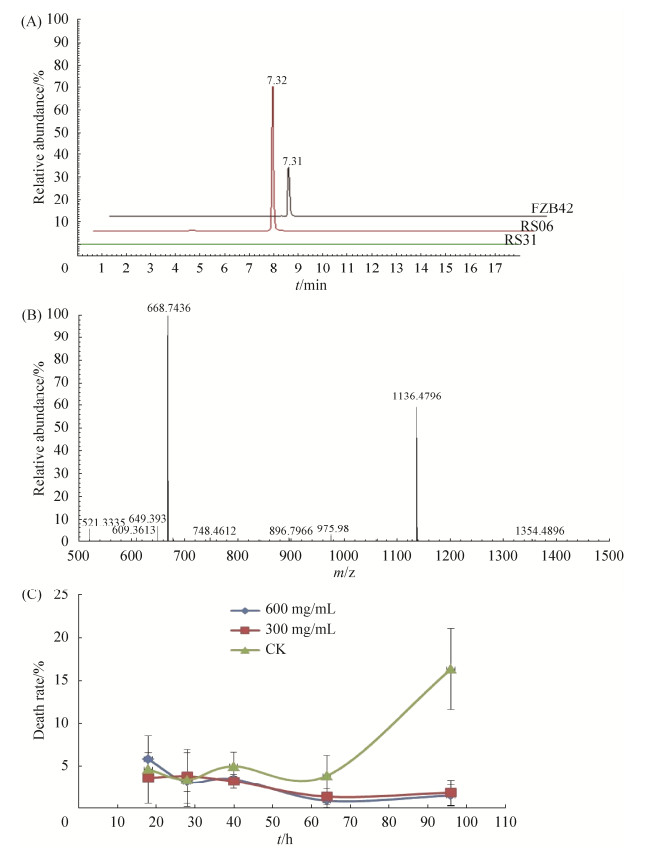 |
| 图 3 plantazolicin提取物的HPLC-MS分析及其对松材线虫死亡率的影响 Figure 3 HPLC-MS analysis of plantazolicin extract and its effects on the mortality of Bu. xylophilus. A: HPLC chromatogram of plantazolicin extract synthesized by FZB42, RS06 (△sfp) and RS31 (△sfp, △pznC); B: the mass spectrum of plantazolicin extracted from FZB42. The ions with m/z 668.74 [M+2H]2+ and m/z 1336.48 [M+H]+ represent the typical molecular mass of plantazolicin; C: the effect of plantazolicin extract on the death rates of Bu. xylophilus. The plantazolicin extract were added to Bu. xylophilus at two final concentrations (300 mg/mL and 600 mg/mL) and assayed. Death rates were determined at the 18th, 28th, 40th, 64th and 96th hour after inoculation. |
| 图选项 |
将plantazolicin提取物以两种浓度(600 mg/mL和300 mg/mL,均远高于之前报告[17])加至松材线虫悬液中,分别测试其对松材线虫存活的影响。从图 3-C可以看出,在前64 h内,用plantazolicin提取物处理的线虫的死亡率低于5%,且与对照组之间并无显著差异。在第96 h后,对照组(仅添加甲醇)中线虫死亡率增加到约24%,而此时两种浓度plantazolicin处理线虫的死亡率竟然仍低于2%。该结果表明,在长时间处理(96 h)之后,高浓度plantazolicin提取物,不仅没有明显的杀线虫作用,甚至延长了松材线虫的存活。这个结果尽管出乎意料,但似乎与近年两篇野生型枯草芽孢杆菌能够延长秀丽隐杆线虫寿命的报道相一致[20-21]。
2.4 FZB42直接接触对松材线虫存活的影响 野生型枯草芽孢杆菌能够形成生物膜的能力,在其延长秀丽隐杆线虫寿命的作用中扮演了重要角色[20]。贝莱斯芽孢杆菌是枯草芽孢杆菌的近缘菌种,而FZB42形成生物膜的能力也十分突出,因此,为了验证FZB42生物膜形成相关过程是否影响了松材线虫的存活,我们首先构建了FZB42的生物膜生成受损突变株FBS296。菌落PCR验证挑选出的阳性转化子经DNA测序结果表明,FBS296中参与生物膜胞外基质主要成分(EPS和淀粉样蛋白TasA)合成的基因均被破坏。图 4-A和4-B显示,与FZB42野生型相比,FBS296的菌落光滑平坦,几乎没有任何皱褶,在液体培养基表面也几乎不能形成薄膜,这说明FBS296在固-气和固-液表面的生物膜形成能力完全丧失。
 |
| 图 4 贝莱斯芽孢杆菌FZB42菌体接触及其生物膜合成能力对松材线虫存活的影响 Figure 4 Effects of direct contact of Ba. velezensis FZB42 and its ability of biofilm formation on the survival of Bu. xylophilus. Morphological appearance of colonies (A) and pellicles (B) formed by the FZB42 wild type and the mutant FBS296 deficient in biofilm formation; C: effects of the FZB42 wild type and FBS296 on the survival of Bu. xylophilus. Spores from the wild type and FBS296 were applied to Bu. xylophilus and their survival rates were determined in 12 days. The control contained no bacterium (n=9). |
| 图选项 |
将FZB42和FBS296的芽孢分别添加至线虫悬液中,观察其对线虫存活的影响。从图 4-C可以看出,FZB42直接接触处理与无细菌的对照相比,松材线虫存活率在前4 d内并无显著差异,但在第6天、第8天和第10天,处理比对照的存活率低约10%。这表明,FZB42直接接触对松材线虫具有抑制作用。与野生型FZB42相比,FBS296处理松材线虫的存活率更低,且其抑制效果在第4天即明显显现,而此时FZB42野生型与无菌对照并无明显差别。这说明,FZB42形成生物膜的能力对松材线虫的存活有助益作用,这在一定程度上降低了对松材线虫的抑制效果,当丧失生物膜形成能力后,则其对松材线虫的抑杀性更加凸显出来。
3 讨论 松萎蔫病威胁着东亚地区数百万公顷的松树,因此切实控制松萎蔫病的直接病原——松材线虫,是从根本上解决松萎蔫病蔓延的有效方式。而生物防治的方法,显然是其中最具研究价值并有利于环境保护的一类方法。作为革兰氏阳性植物生防菌株的典范,贝莱斯芽孢杆菌FZB42对各类农业植物的促生作用,以及对诸多植物病原菌的拮抗作用,已被广泛研究[6],但是迄今为止,尚未有人对其对松材线虫的潜在抑杀性进行评价。
在本研究中,我们测试了FZB42对松材线虫生长的影响。将来自不同培养基、不同时期、不同浓度和不同处理时间的FZB42菌液添加至松材线虫悬液,测定松材线虫的死亡率,发现FZB42菌液上清具有抑杀松材线虫的效果,其中在LB培养基和1:3稀释上清条件下,对松材线虫具有明显的抑杀效果;而收集48 h的LB培养液上清处理松材线虫48 h,可使抑杀率达到约50%。这些测定条件尽管并非十分细致,但是这些测定结果确立了一个基本结论,并勾勒出了抑制效果发生的基本条件,为后续研究和未来的机理性深入研究奠定了基础。例如,已有的研究表明,FZB42至少能产生13种拮抗物质(多数可归类为抗生素)[6],这些拮抗物质生产的最适培养基和峰值时间各不相同,其中多种抗生素(例如fengycin,bacillomycin D, difficidin)的优选培养基是Landy培养基,但本研究发现,LB培养液上清对松材线虫的抑制效果明显优于Landy培养液,这暗示了在Landy培养基中高产的那几种抗生素并非抑制松材线虫的主要物质;相反,在LB培养基中积累的某种(某些)代谢物,则似乎应该为抑制效果负责。这些研究结果为后续找寻上清中的抑制物质提供了参考的线索。
先前Liu等的研究认为,FZB42具有针对秀丽隐杆线虫的抑杀活性,这种活性是由FZB42所产生的细菌素plantazolicin所介导的[17],但该文中仅对杀线活性进行了测试,并未对其机理进行研究。在本研究中,无论使用不同突变株的上清(RS06 vs RS31),还是使用纯化过的plantazolicin提取物,均未发现plantazolicin对松材线虫具有抑杀作用。不仅如此,在实验中我们发现,添加plantazolicin粗提物,反而能够明显提高松材线虫的存活率,这促使我们去进一步探究其原因,并关注FZB42生物膜形成能力对松材线虫的影响。近年来有报道表明,枯草芽孢杆菌能够延长秀丽隐杆线虫的寿命[20-21],这种有益作用至少跟两个因素有关,一是枯草芽孢杆菌产生的信号分子一氧化氮(NO)分子可以跨物种发挥调节作用[20];二是枯草芽孢杆菌在秀丽隐杆线虫肠道内发生定殖并形成生物膜,生物膜生成促进了细菌NO分子和一种寡肽(CSF)的产生,CSF在枯草芽孢杆菌群感阈值效应(quorum sensing)中发挥自体诱导物的作用,并和NO协同,能够延长线虫寿命,抵御其抗胁迫的能力[21]。贝莱斯芽孢杆菌和枯草芽孢杆菌的亲缘关系很近[5],因此plantazolicin提取物促进松材线虫存活率的结果,可以说是和上述报道一致的。而利用生物膜缺损突变株FBS296的研究表明,FZB42的生物膜形成能力,确实对提高松材线虫的存活率有贡献,因此,FZB42对松材线虫应该同时存在两种影响,一种是抑制作用,一种是增强了线虫的抗胁迫能力,但从整体上看,添加FZB42菌株还是降低了松材线虫的存活率(图 4-C)。
综上所述,本研究通过繁重的测定工作,确定了贝莱斯芽孢杆菌对松材线虫具有抑制作用,并对其产生作用效果的基本条件和不同方式进行了分析评价,排除了plantazolicin是抑制物质的可能性,初探了生物膜形成能力对松材线虫的影响。在未来的工作中,仍有很多值得深入研究的地方,例如进一步优化FZB42抑制效果的作用条件,鉴定抑制松材线虫的具体物质,探索抑制效果的分子机理等等。本文的结果,为这些深入研究奠定了基础,也为松树萎蔫病的生物防治工作,提供了可供参考的视角和可供开发的微生物资源。
References
| [1] | Ding XL, Ye JR, Lin SX, Wu XQ, Li DW, Nian B. Deciphering the molecular variations of pine wood nematode Bursaphelenchus xylophilus with different virulence. PLoS One, 2016, 11(5): e0156040. DOI:10.1371/journal.pone.0156040 |
| [2] | Ye JR. Epidemic status of pine wilt disease in China and its prevention and control techniques and counter measures. Scientia Silvae Sinicae, 2019, 55(9): 1-10. (in Chinese) 叶建仁. 松材线虫病在中国的流行现状、防治技术与对策分析. 林业科学, 2019, 55(9): 1-10. |
| [3] | Borriss R, Chen XH, Rueckert C, Blom J, Becker A, Baumgarth B, Fan B, Pukall R, Schumann P, Spr?er C, Junge H, Vater J, Pühler A, Klenk HP. Relationship of Bacillus amyloliquefaciens clades associated with strains DSM 7T and FZB42T: a proposal for Bacillus amyloliquefaciens subsp. amyloliquefaciens subsp. nov. and Bacillus amyloliquefaciens subsp. plantarum subsp. nov. based on complete genome sequence comparisons. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(8): 1786-1801. DOI:10.1099/ijs.0.023267-0 |
| [4] | Dunlap CA, Kim SJ, Kwon SW, Rooney AP. Bacillus velezensis is not a later heterotypic synonym of Bacillus amyloliquefaciens; Bacillus methylotrophicus, Bacillus amyloliquefaciens subsp. plantarum and 'Bacillus oryzicola' are later heterotypic synonyms of Bacillus velezensis based on phylogenomics. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(3): 1212-1217. DOI:10.1099/ijsem.0.000858 |
| [5] | Fan B, Blom J, Klenk HP, Borriss R. Bacillus amyloliquefaciens, Bacillus velezensis, and Bacillus siamensis form an "operational group B. amyloliquefaciens" within the B. subtilis species complex. Frontiers in Microbiology, 2017, 8: 22. |
| [6] | Fan B, Wang C, Song XF, Ding XL, Wu LM, Wu HJ, Gao XW, Borriss R. Bacillus velezensis FZB42 in 2018: the gram-positive model strain for plant growth promotion and biocontrol. Frontiers in Microbiology, 2018, 9: 2491. DOI:10.3389/fmicb.2018.02491 |
| [7] | Chen XH, Koumoutsi A, Scholz R, Eisenreich A, Schneider K, Heinemeyer I, Morgenstern B, Voss B, Hess WR, Reva O, Junge H, Voigt B, Jungblut PR, Vater J, Süssmuth R, Liesegang H, Strittmatter A, Gottschalk G, Borriss R. Comparative analysis of the complete genome sequence of the plant growth-promoting bacterium Bacillus amyloliquefaciens FZB42. Nature Biotechnology, 2007, 25(9): 1007-1014. DOI:10.1038/nbt1325 |
| [8] | Chen XH, Koumoutsi A, Scholz R, Schneider K, Vater J, Süssmuth R, Piel J, Borriss R. Genome analysis of Bacillus amyloliquefaciens FZB42 reveals its potential for biocontrol of plant pathogens. Journal of Biotechnology, 2009, 140(1/2): 27-37. |
| [9] | Fan B, Chen XH, Budiharjo A, Bleiss W, Vater J, Borriss R. Efficient colonization of plant roots by the plant growth promoting bacterium Bacillus amyloliquefaciens FZB42, engineered to express green fluorescent protein. Journal of Biotechnology, 2011, 151(4): 303-311. DOI:10.1016/j.jbiotec.2010.12.022 |
| [10] | Fan B, Borriss R, Bleiss W, Wu XQ. Erratum to: gram-positive Rhizobacterium Bacillus amyloliquefaciens FZB42 colonizes three types of plants in different patterns. Journal of Microbiology, 2013, 51(4): 544. DOI:10.1007/s12275-013-0723-2 |
| [11] | Fan B, Carvalhais LC, Becker A, Fedoseyenko D, von Wirén N, Borriss R. Transcriptomic profiling of Bacillus amyloliquefaciens FZB42 in response to maize root exudates. BMC Microbiology, 2012, 12: 116. DOI:10.1186/1471-2180-12-116 |
| [12] | Fan B, Li L, Chao YJ, F?rstner K, Vogel J, Borriss R, Wu XQ. dRNA-seq reveals genomewide TSSs and noncoding RNAs of plant beneficial rhizobacterium Bacillus amyloliquefaciens FZB42. PLoS One, 2015, 10(11): e0142002. DOI:10.1371/journal.pone.0142002 |
| [13] | Fan B, Li YL, Li L, Peng XJ, Bu C, Wu XQ, Borriss R. Malonylome analysis of rhizobacterium Bacillus amyloliquefaciens FZB42 reveals involvement of lysine malonylation in polyketide synthesis and plant-bacteria interactions. Journal of Proteomics, 2017, 154: 1-12. |
| [14] | Chowdhury SP, Hartmann A, Gao XW, Borriss R. Biocontrol mechanism by root-associated Bacillus amyloliquefaciens FZB42 - a review. Frontiers in Microbiology, 2015, 6: 780. |
| [15] | Scholz R, Molohon KJ, Nachtigall J, Vater J, Markley AL, Süssmuth RD, Mitchell DA, Borriss R. Plantazolicin, a novel microcin B17/streptolysin s-like natural product from Bacillus amyloliquefaciens FZB42. Journal of Bacteriology, 2011, 193(1): 215-224. |
| [16] | Kalyon B, Helaly SE, Scholz R, Nachtigall J, Vater J, Borriss R, Süssmuth RD. Plantazolicin A and B: structure elucidation of ribosomally synthesized thiazole/oxazole peptides from Bacillus amyloliquefaciens FZB42. Organic Letters, 2011, 13(12): 2996-2999. |
| [17] | Liu ZZ, Budiharjo A, Wang PF, Shi H, Fang J, Borriss R, Zhang KQ, Huang XW. The highly modified microcin peptide plantazolicin is associated with nematicidal activity of Bacillus amyloliquefaciens FZB42. Applied Microbiology and Biotechnology, 2013, 97(23): 10081-10090. DOI:10.1007/s00253-013-5247-5 |
| [18] | Chen XH, Scholz R, Borriss M, Junge H, M?gel G, Kunz S, Borriss R. Difficidin and bacilysin produced by plant-associated Bacillus amyloliquefaciens are efficient in controlling fire blight disease. Journal of Biotechnology, 2009, 140(1/2): 38-44. |
| [19] | Zhu LH, Ye JR, Negi S, Xu XL, Wang ZL, Ji JY. Pathogenicity of aseptic Bursaphelenchus xylophilus. PLoS One, 2012, 7(5): e38095. |
| [20] | Donato V, Ayala FR, Cogliati S, Bauman C, Costa JG, Le?ini C, Grau R. Bacillus subtilis biofilm extends Caenorhabditis elegans longevity through downregulation of the insulin-like signalling pathway. Nature Communications, 2017, 8(1): 14332. DOI:10.1038/ncomms14332 |
| [21] | Gusarov I, Gautier L, Smolentseva O, Shamovsky I, Eremina S, Mironov A, Nudler E. Bacterial nitric oxide extends the lifespan of C. elegans. Cell, 2013, 152(4): 818-830. |
