刘晓迪1,2, 冯曾威2, 朱红惠1, 姚青2


1. 广东省科学院微生物研究所, 华南应用微生物国家重点实验室, 广东省菌种保藏与应用重点实验室, 广东 广州 510070;
2. 华南农业大学园艺学院, 广东省微生物信号与病害防治重点实验室, 广东 广州 510642
收稿日期:2020-10-20;修回日期:2020-12-12;网络出版日期:2021-03-09
基金项目:广东省科技创新战略专项资金(重点领域研发计划)(2018B020205001);国家自然科学基金(42077040);广东省科学院“千名博士(后)计划”引进专项(2021GDASYL-20210103023)
作者简介:姚青, 男, 农学博士, 华南农业大学园艺学院教授。常年从事土壤微生物与园艺植物的互作研究, 重点研究丛枝菌根真菌与园艺植物之间的共生关系、园艺土壤中的微生物资源及其利用等。近年来主要关注丛枝菌根脂质生物学, 调查了脂质代谢在丛枝菌根真菌生长发育、共生关系建立和非共生产孢等过程中的作用, 探讨了脂质代谢在环境胁迫影响共生体中的调控模式.
*通信作者:姚青。Tel: +86-20-85286902; Fax: +86-20-85280228; E-mail: yaoqscau@scau.edu.cn.
摘要:[目的] 揭示脱落酸(ABA)对丛枝菌根(AM)真菌侵染和产孢的影响,建立利用外源ABA促进孢子产量的高效菌剂扩繁方法。[方法] 利用番茄毛状根和AM真菌Rhizophagus irregularis DAOM 197198建立双重培养体系,通过外源施用ABA、赤霉素(GA)或者使用ABA、GA的缺陷突变体,染色观察菌根侵染,荧光定量PCR测定丛枝发育和脂质合成运输相关基因的表达,统计丛枝和孢子的数量,从而揭示ABA对AM真菌侵染和产孢的影响。[结果] ABA缺陷突变体not中的F%(侵染频率)、a%(丛枝丰度)、丛枝数量,以及丛枝发育特异性相关基因EXO70A1-like(LOC101253481)、脂质合成运输相关基因RAM2和STR2的表达均显著低于其野生型MT;外源施用ABA显著促进了F%、M%(侵染强度)、丛枝数量、孢子产量,以及脂质合成运输相关基因RAM2和STR2的表达,外源添加ABA处理的孢子产量约为不添加处理的4.5倍;外源GA处理极显著抑制了菌根侵染的所有指标和孢子产量;GA缺陷突变体gib3与其野生型MM的AM真菌侵染之间没有显著差异,但gib3的孢子产量显著高于MM。[结论] ABA通过促进脂质的合成和运输,提高AM真菌的侵染和丛枝形成,进而增加AM真菌的孢子产量。
关键词:脱落酸丛枝菌根真菌丛枝形成孢子产量赤霉素
The regulatory effect of abscisic acid on colonization and sporulation of arbuscular mycorrhizal fungus
Xiaodi Liu1,2, Zengwei Feng2, Honghui Zhu1, Qing Yao2


1. Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application, State Key Laboratory of Applied Microbiology Southern China, Institute of Microbiology, Guangdong Academy of Sciences, Guangzhou 510070, Guangdong Province, China;
2. Guangdong Key Laboratory of Microbial Signaling and Disease Control Laboratory, College of Horticulture, South China Agricultural University, Guangzhou 510642, Guangdong Province, China
Received: 20 October 2020; Revised: 12 December 2020; Published online: 9 March 2021
*Corresponding author: Qing Yao. Tel: +86-20-85286902; Fax: +86-20-85280228; E-mail: yaoqscau@scau.edu.cn.
Foundation item: Supported by the Guangdong Technological Innovation Strategy of Special Funds (Key Areas of Research and Development Program) (2018B020205001), by the National Natural Science Foundation of China (42077040) and by the Guangdong Academy of Sciences "1000 Post-doctorate" Special Fund (2021GDASYL-20210103023)
Abstract: [Objective] To reveal the effects of abscisic acid (ABA) on the colonization and sporulation of arbuscular mycorrhiza (AM) fungi, and to establish a highly efficient propagation methods by promoting spore production with exogenous ABA. [Methods] We established the dual culture system with tomato hairy roots and AM fungus Rhizophagus irregularis DAOM 197198, and the exogenous ABA and gibberellin (GA) were applied, or the deficient mutants of ABA and GA were employed. The mycorrhizal colonization was observed after staining, the expression of genes involved in the development of arbuscules and the synthesis and transfer of lipids were measured with qRCR, and the numbers of arbuscules and spores were counted, in order to reveal the effects of ABA on the colonization and sporulation of AM fungus. [Results] In the ABA-deficient mutant not, F% (mycorrhizal frequency), a% (arbuscular abundance), number of arbuscules, and the expression of arbuscule development-specific gene EXO70A1-like (LOC101253481) and the lipid synthesis and transfer related genes RAM2 and STR2 were significantly lower than those in the wild-type MT. Exogenous application of ABA significantly promoted F%, M% (mycorrhizal intensity), number of arbuscules, spore production, and the expression of RAM2 and STR2. The spore production applied with exogenous ABA was approximately 4.5 times of that without application. Exogenous GA significantly inhibited all parameters of mycorrhizal colonization and spore production. The spore production of GA-deficient mutant gib3 was significantly higher than that of the wild-type MM, although there was no significant difference in mycorrhizal colonization between gib3 and MM. [Conclusion] By promoting the lipid synthesis and transfer, ABA increases the colonization and arbuscular formation of AM fungi, and further enhances AM fungal sporulation.
Keywords: abscisic acidarbuscular mycorrhizal fungiarbuscular formationspore productiongibberellin
丛枝菌根(arbuscular mycorrhiza,AM)真菌是土壤中普遍存在的球囊霉亚门(Glomeromycotina)真菌,可以与80%以上的陆生植物建立共生关系,为植物提供氮和磷等矿质养分,并从宿主植物获得碳源,供给自身的生长发育和繁殖[1]。AM真菌与植物建立共生关系后,能够提高农作物对许多生物与非生物胁迫的耐受性,比如提高农作物对养分贫瘠、干旱、重金属毒害、酸碱度胁迫、病虫害等的耐受性,改善农作物的生长势,进而提高农作物的产量、改善农作物的品质[2-3]。在农林业生产(尤其是可持续生产)中能够发挥重要的作用,具有很大的应用潜力。
目前,AM真菌的纯培养尚未取得成功,因此并未在农林业生产中大量应用。现有的商业化菌剂是利用与宿主植物的共生来生产的,菌剂扩繁方式较为复杂,限制了菌剂的生产。孢子是AM真菌的繁殖体,孢子数量是衡量菌剂质量的关键指标。AM真菌的孢子储存大量营养,其主要成分是中性脂(三酰基甘油)[4]。但AM真菌并不能从头合成脂肪酸,需要从植物中获取脂肪酸以供给自己的生长繁殖[5-6]。在AM共生体中,丛枝是两者之间进行物质交换的主要场所,丛枝在皮层细胞内不断分支形成巨大的表面积[7],而丛枝这个膜结构含有大量的磷脂[4]。丛枝衰老崩溃后,脂质从丛枝通过外生菌丝转移到AM真菌的产孢菌丝,有利于孢子形成[8]。因此,丛枝形成及丛枝丰度对于孢子形成、菌剂质量非常关键。
AM真菌与植物建立共生过程中需要一系列信号分子,植物激素作为重要的信号物质不仅调控植物的生长发育,也能调控AM的共生关系。Herrera-Medina等[9]的研究表明脱落酸(abscisic acid,ABA)能够促进AM真菌侵染,尤其是提高丛枝丰度。Liu等[10]发现外源添加ABA能够促进异形根孢囊霉菌株DAOM 197198 (Rhizophagus irregularis DAOM 197198)在非共生状态下孢子的产生,说明ABA能够调控AM真菌的侵染和孢子的形成,但是ABA对共生状态下AM真菌产孢的影响未见报道。在共生状态下,丛枝是AM真菌共生体物质和信息交换的核心结构,丛枝丰度受到抑制或者促进与宿主植物提供给AM真菌的脂类减少或增加密切相关[4],而孢子是存贮脂质的结构,AM真菌通过丛枝从植物获得的脂质最终以孢子的形式贮存。基于ABA能够促进丛枝的形成,而丛枝对于孢子形成具有关键作用,因此,我们推测ABA能够促进共生状态下孢子的形成。
在植物体中,赤霉素(gibberellin,GA)是与ABA具有拮抗关系的一类植物激素[11],外源GA会抑制植物体内ABA的合成,而GA缺乏会促进ABA的合成。最近的研究发现,GA也参与丛枝的形成,GA合成缺陷的豌豆突变体根系中丛枝丰度很高,但是叶片施用10 μL的GA使得丛枝比例降低到野生型水平[12]。这表明GA也可能影响AM真菌的孢子形成,但是目前尚未见相关报道。通过调控植物体内的GA含量,可以调控植物体内ABA含量,因此,我们推测外源添加GA或者利用GA缺陷突变体可能通过调控植物体内ABA含量而抑制或者促进孢子产量。
为了验证上述的推测,本试验以番茄毛状根为宿主材料,接种AM真菌,通过添加外源ABA或者GA,使用ABA缺陷突变体或者GA缺陷突变体,明确在AM真菌与植物共生过程中,ABA对AM真菌侵染和产孢的影响模式和作用机制。本研究的结果有助于建立一种便捷高效的促进AM真菌产孢的方法,也能加深对AM真菌生理生化特性的认识,丰富AM真菌生物学内容,从而为AM真菌在农林业生产上的应用奠定理论基础。
1 材料和方法 1.1 生物材料 本试验使用的植物材料是番茄(Solanum lycopersicum),品种为‘新金丰一号’,种子购买于市场,发芽率在90%以上。番茄ABA缺陷突变体和GA缺陷突变体与对应的野生型种子从加州大学戴维斯分校国家植物种质系统生物科学系Tomato Genetics Resource Center (TGRC)种子资源库(http://tgrc.ucdavis.edu/)获得。not (notabilis)为ABA缺陷突变体,其9-顺式-环氧类胡萝卜素双加氧酶合成酶突变,类胡萝卜素双加氧酶是ABA合成过程中所需要的关键酶[13],Micro-Tom (MT)为其野生型;gib3 (gibberellin-deficient-3)为GA缺陷突变体,Moneymaker (MM)为其野生型。
番茄种子消毒后,播种到装有MS培养基的组培瓶中培养获得无菌苗。将无菌苗制备的外植体用发根农杆菌Agrobacterium rhizogenes ACCC10060ACCC 10060 (广东省微生物菌种保藏中心)诱导毛状根,除菌后备用。
AM真菌异形根孢囊霉Rhizophagus irregularis DAOM 197198从加拿大的Premier Tech公司购买,使用毛状根接种AM真菌双重培养体系扩繁孢子。培养3个月孢子成熟后用于本试验。
1.2 外源ABA对AM真菌侵染、丛枝发育和脂质运输的影响 将毛状根与菌株DAOM 197198建立共生关系,采用两因子完全随机设计,即番茄基因型(野生型MT和ABA缺陷突变体not)和ABA处理(+ABA和–ABA)。ABA(Sigma,A1049)施用浓度为10–7 mol/L,使用直径15 cm的培养皿,倒入MSR培养基[14]。每个培养皿上均匀接种约100个孢子,置于25 ℃恒温培养箱中暗培养5 d,在孢子开始萌发后将8条长约5 cm的毛状根呈辐射状径向均匀置于培养皿中,根系距孢子约0.5 cm,培养皿用封口膜封口后置于25 ℃恒温培养箱中暗培养。每个处理5个重复,4个处理共28个培养皿,培养8周后取样。
1.3 外源ABA对AM真菌孢子产量的影响 毛状根与菌株DAOM 197198共生后,设2个外源ABA处理(+ABA和–ABA)。ABA施用浓度为10–7 mol/L,在9 cm培养皿中倒入MSR培养基,每个培养皿上均匀接种约50个孢子,置于25 ℃恒温培养箱中暗培养5 d,在孢子开始萌发后将3条长约3 cm的毛状根呈辐射状径向均匀置于培养皿中。培养条件与1.2相同。每个处理5个重复,2个处理共14个培养皿,培养12周后统计孢子数量。
1.4 利用GA验证ABA对AM真菌侵染和产孢的影响 毛状根与菌株DAOM 197198共生后,采用两因子完全随机设计,即番茄基因型(野生型MM和GA缺陷突变体gib3)和GA处理(+GA和–GA)处理,GA施用浓度为10–5 mol/L。使用的培养皿、孢子接种方法、根系放置方式及培养条件与1.2节相同,培养8周后取样。
取样时,将培养基连同根系一并转移到500 mL的锥形瓶中,加入200 mL浓度为10 mmol/L、pH 6.0的柠檬酸钠溶液,然后置于摇床上以200 r/min的转速振荡30 min,将根系上的MSR培养基溶解根。用清水清洗根系,用吸水纸擦干后测定鲜重,将老根去除,细根剪成约1 cm的根段混匀。部分根系保存在4 ℃冰箱用于根系侵染率的测定;部分根系分成0.2 g/份,保存于–80 ℃冰箱中,用于提取RNA测定相关基因的表达。
1.5 菌根侵染率的测定 根据Phillips和Haymann的方法[15],用台盼蓝对根段染色,测定根系侵染率。根据Trouvelot等[16]的方法使用软件MYCOCALC (http://www.dijon.inra.fr/mychintec/Mycocal-prg/Download.html)对结果进行计算,用3个参数描述菌根侵染状况:F% (根系中的菌根侵染频率)、M% (根系中的菌根侵染强度)和a% (侵染根系中的丛枝丰度)。通常,F%和M%反映了总侵染,而a%反映了丛枝的侵染(即丛枝丰度)。
1.6 丛枝数量和孢子数量的测定 随机挑取20条约1 cm长的染色根段,在显微镜下观察根系侵染,统计每条根段上的丛枝数量。在培养皿底部画1 cm×1 cm的方形网格,在体式显微镜下观察并统计每个网格中孢子的数量,将所有网格中孢子数相加即为该样品的孢子数量。
1.7 相关基因表达的定量 用plant RNA kit R6827 (Omega公司,广州)和TransScript One-Step gDNA Removal Kit and cDNA Synthesis SuperMix (北京TransGen生物技术有限公司)提取RNA并反转录;使用罗氏公司的LightCycler 480Ⅱ荧光定量PCR仪进行RT-PCR。10 μL反应体系为:5 μL iTaqTM Universal SYBR? Green Supermix (2×),正反向引物各0.5 μL (10 μmol/L),cDNA模板1 μL和无菌去离子水(RNase-free & DNase-free) 3 μL。反应条件为:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 30 s,39–42个循环;溶解曲线分析从65 ℃加热至95 ℃ (每6 s间隔上升0.5 ℃)。每个样品2个平行。根据公式2–△△Ct以肌动蛋白为内标来计算[17-18]。
进行定量的相关基因和相关引物的序列见表 1。所有引物序列均通过生工生物工程(上海)股份有限公司广州合成部合成,使用时按照说明书稀释到所需浓度后使用。
表 1. 本文用到的基因引物序列 Table 1. Primers used in this study
| Gene | Primer sequence (5′→3′) | Reference |
| EXO70A1-like (LOC101253481) | F: CCTCAGAGATTTTTGCTGGTG | [19] |
| R: AAGGCCAAGCTCAAAGAAGAC | ||
| EXO70B1 (LOC101260888) | F: CTCCAAAATCAGGAGGTGGAT | |
| R: CAGCAAAGCAAACTGAACCAAC | ||
| EXO70A1-like (LOC101261477) | F: GTCTTTTTGAGTGCCTTCCAAC | |
| R: AGGGATAAGAGCTGGTGGTGTAT | ||
| RAM2 | F: GATGGAACATTACTTCGAGGAC | [4] |
| R: CTCCGAGACGAAGTAGTAAAGAAG | ||
| STR2 | F: GGACATAGGGAAGCCGATAA | |
| R: AGCCCACCCATTGACACTTT | ||
| Actin | F: TTCCGTTGCCCAGAGGTCCT | |
| R: GGGAGCCAAGGCAGTGATTTC |
表选项
1.8 数据分析 所有结果为4次或5次重复的平均值。使用IBM SPSS Statistics Version 21.0软件(SPSS Inc.,Chicago,IL)对数据进行使用多重比较(Tukey HSD)、两因子方差分析分析(ANOVA),使用Origin 8.5制图。
2 结果和分析 2.1 脱落酸对AM真菌侵染的影响 根系侵染观察表明,与野生型MT相比,not突变体的菌根侵染和丛枝丰度都较低。此外,外源添加ABA提高了菌根侵染,在not突变体中尤为明显(图 1)。
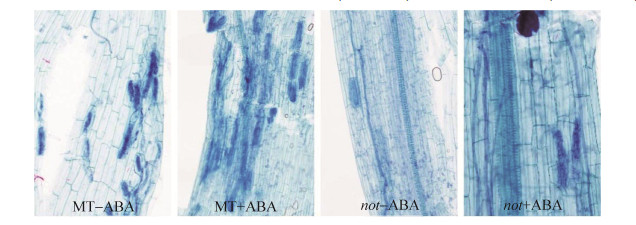 |
| 图 1 不同ABA处理根系台盼蓝染色图片 Figure 1 Trypan blue staining images of roots treated with ABA or not. |
| 图选项 |
对侵染数据的分析表明,外源添加ABA处理的所有侵染指标均大于不添加处理,且外源添加ABA处理显著促进了F% (P=0.000)和M% (P=0.000),而not突变体中F% (P=0.016)和a% (P=0.016)显著低于野生型(图 2,表 2)。根据丛枝数量的统计结果,添加外源ABA的野生型处理为8.9个/cm,显著高于不添加ABA的野生型处理(4.0个/cm),不添加ABA的not突变体处理为0.5个/cm,添加ABA导致丛枝数量增加至2.4个/cm,可见外源ABA (P=0.003)和基因型(P=0.000)对丛枝数量都产生了显著的影响(图 2,表 2)。以上结果表明外源ABA能够促进AM真菌对根系的侵染,尤其促进丛枝的数量。
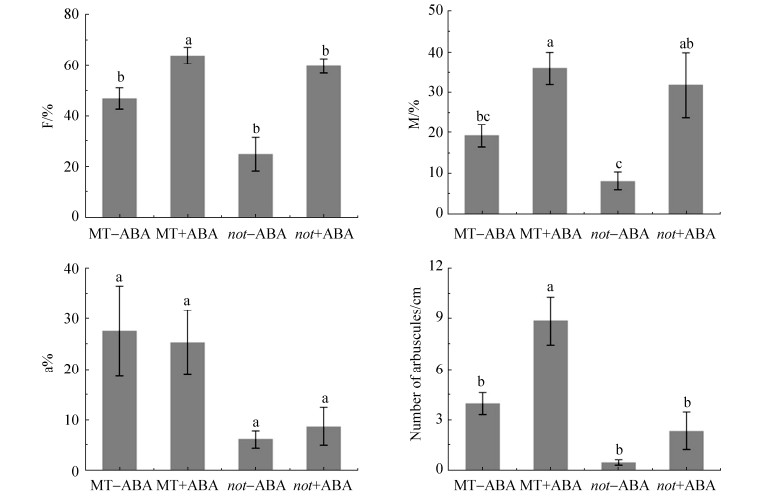 |
| 图 2 ABA对AM真菌侵染的影响 Figure 2 Effect of ABA on mycorrhizal colonization and the amount of arbuscules. F: mycorrhizal frequency in root system; M: mycorrhizal intensity in root system; a%: arbuscule abundance in colonized roots. Different lowercase letters indicate significant difference at P≤0.05. |
| 图选项 |
表 2. ABA对AM真菌侵染的影响的双因子方差分析(P值) Table 2. Two-way ANOVA of ABA effect on mycorrhizal colonization (P value)
| Treatment | F% | M% | a% | Number of arbuscules |
| ABA | 0.000 | 0.000 | 0.981 | 0.003 |
| Genotype | 0.016 | 0.080 | 0.016 | 0.000 |
| ABA×Genotype | 0.083 | 0.402 | 0.735 | 0.122 |
表选项
EXO70基因编码植物中囊泡的一个亚基,丛枝形成与EXO70的表达密切相关[19]。通过对EXO70基因表达的分析可以看出,EXO70A1-like (LOC101261477)和EXO70B1 (LOC101260888)在两个基因型之间没有显著差异,但是EXO70A1- like (LOC101253481)基因在not中的表达受到显著抑制(表 3),表明EXO70A1-like (LOC101253481)可能是番茄根系中参与AM真菌诱导丛枝周膜(periarbuscular membrane,PAM)形成的主要基因,从基因表达水平上验证了ABA缺乏能够抑制丛枝形成。
表 3. ABA对EXO70s基因相对表达量的影响 Table 3. Effects of ABA on the relative expression levels of EXO70s
| Genotype | EXO70A1-like (LOC101253481) | EXO70A1-like (LOC101261477) | EXO70B1 (LOC101260888) |
| not | 0.20±0.03 | 1.10±0.07 | 0.89±0.15 |
| MT | 1.60±0.24** | 1.01±0.11 | 0.94±0.11 |
| All the data are presented as the means±SE (n=4).**: significant difference at P≤0.005 between not and MT. | |||
表选项
2.2 ABA对脂质合成运输相关基因RAM2和STR2表达的影响 RAM2和STR2是脂质合成转运的关键基因,参与AM真菌与植物共生中脂质的合成运输[5]。AM真菌共生过程中需要宿主植物提供脂质来保证自身的生长发育,此外,孢子的主要成分是脂质,孢子的形成需要大量脂质的积累。因此,RAM2和STR2对于孢子的形成也是非常关键的基因。从结果中可以看出,外源添加ABA显著促进了RAM2 (P=0.006)和STR2 (P=0.014)基因的表达,而not突变体则显著抑制了RAM2 (P=0.007)和STR2 (P=0.009)基因的表达(表 4)。在野生型中,外源添加ABA导致RAM2和STR2的表达分别提高2.48和14.70倍;在not突变体中,外源添加ABA导致RAM2和STR2的表达分别提高2.66和1.95倍(表 4)。显然,外源ABA能够促进番茄根系中菌根特异性的脂类的合成和向AM真菌的运输。
表 4. ABA对STR2和RAM2基因相对表达量的影响 Table 4. Effect of ABA on the relative expression levels of STR2 and RAM2
| Genotype | ABA treatment | RAM2 | STR2 |
| MT | –ABA | 1.00±0.00 b | 1.00±0.00 b |
| +ABA | 2.48±0.56 a | 14.70±4.83 a | |
| not | –ABA | 0.38±0.13 b | 0.20±0.06 b |
| +ABA | 1.01±0.26 b | 0.39±0.13 b | |
| Two-way ANOAV (P value) | |||
| ABA | 0.006 | 0.014 | |
| Genotype | 0.007 | 0.009 | |
| ABA×Genotype | 0.021 | 0.016 | |
| All the data are presented as the means±SE (n=4). Different lowercase letters indicate significant difference at P≤0.05 in each column. | |||
表选项
2.3 ABA对AM真菌产孢的影响 在野生型接种菌株DAOM 197198的共生体系中,外源添加ABA显著促进了孢子的产生,培养12周后添加处理的孢子数量约为不添加处理孢子数量的4.5倍,达到822.3个/皿(表 5)。
表 5. ABA对孢子数量的影响 Table 5. Effect of ABA on the number of spores
| ABA treatment | The number of spores (/plate) |
| +ABA | 822.3±441.1* |
| –ABA | 183.8±91.9 |
| All the data are presented as the means±SE (n=4).*: significant difference at P≤0.05 between +ABA and –ABA. | |
表选项
2.4 利用GA对ABA菌根效应的验证 为了进一步明确外源ABA对AM真菌侵染和产孢的影响,我们使用ABA的拮抗性植物激素GA及其缺陷突变体gib3进行验证。从结果中可以看出,外源添加GA降低了野生型和gib3突变体中的菌根侵染,F% (P=0.006)、M% (P=0.006)和a% (P=0.006)均显著降低(图 3,表 6)。通过对孢子数量的统计发现,外源添加GA显著抑制了孢子数量(P=0.000),而gib3突变体显著增加了孢子数量(P=0.006);在不添加外源GA的gib3突变体共生体系中,孢子数量平均高达6769个/皿(图 3,表 6)。显然,作为ABA的拮抗性植物激素,外源GA的作用与外源ABA相反,能够抑制菌根侵染和孢子的形成。
 |
| 图 3 GA对AM真菌侵染和产孢的影响 Figure 3 Effect of GA on mycorrhizal colonization and sporulation. F: mycorrhizal frequency in root system; M: mycorrhizal intensity in root system; a%: arbuscule abundance in colonized roots. Different lowercase letters indicate significant difference at P≤0.05. |
| 图选项 |
表 6. GA对AM真菌侵染的影响的双因子方差分析(P值) Table 6. Two-way ANOVA of GA effect on mycorrhizal colonization (P value)
| Treatment | F% | M% | a% | Number of spores |
| GA | 0.000 | 0.000 | 0.000 | 0.003 |
| Genotype | 0.112 | 0.121 | 0.122 | 0.006 |
| GA×Genotype | 0.474 | 0.675 | 0.467 | 0.006 |
表选项
3 讨论 在本研究中,外源ABA处理促进了AM真菌侵染,显著增加了丛枝数量;GA与ABA在植物体内具有拮抗作用,通过使用外源GA处理或GA缺陷突变体分别抑制或促进了AM真菌的侵染、丛枝丰度。这些结果表明外源ABA能够促进AM真菌侵染和丛枝的形成。Herrera-Medina等在土壤中每2周喷施20 mL 50 μmol/L的ABA溶液能够促进番茄菌根中AM真菌的侵染长度和丛枝丰度,且明确指出ABA决定了AM真菌的丛枝的形成和功能[9];ABA缺陷突变体中菌根侵染和丛枝形成受到了严重的抑制[20-21],而添加ABA能够部分恢复突变体中的菌根侵染和丛枝的发育和功能,使用钨酸钠(ABA合成抑制剂)会显著抑制AM的侵染丛枝的形成。这些研究表明外源ABA对AM真菌侵染和丛枝发育有促进作用,而ABA缺陷和外源施用ABA合成抑制剂能抑制AM真菌侵染和丛枝形成,与我们的结论一致。
本研究中外源添加ABA显著提高了不同处理菌根中RAM2、STR2的表达量。RAM2编码3-磷酸甘油酰基转移酶,并参与内质网中的脂质合成[22];STR2合成编码位于PAM中的ATP结合转运蛋白,其对于丛枝形成是必不可少的[5]。RAM2和STR2是丛枝形成过程中脂质合成和运输的关键基因,因此,我们的结果表明外源ABA促进了菌根中脂质的合成和运输。
本研究结果表明ABA促进孢子的形成。Liu等发现外源ABA能够在非共生和共生前状态下直接促进AM真菌的孢子形成[10],关于ABA对共生状态下孢子形成的影响未见报道,而本研究首次证实了ABA对共生状态下AM真菌产孢的促进作用。AM真菌与宿主植物共生过程中,在根系表面形成菌足,向根内生长形成根内菌丝和丛枝,然后形成外生菌丝和孢子。在这个过程中,丛枝具有核心作用。但是,丛枝寿命短,仅为7.5–8.5 d[23],由于丛枝由大量的膜结构组成,含有丰富的磷脂,因此丛枝的衰老与降解可能对包括产孢在内的AM生物学过程产生重要影响。研究指出,AM真菌的丛枝丰度与中性脂积累密切相关[4, 24];衰老的丛枝中含有大量的中性脂[8];Feng等[4]观察到丛枝的降解和中性脂的积累是同步的。Kobae等[8]通过实时成像技术进一步观察到中性脂随后从根内菌丝转运至根外菌丝,而AM真菌孢子主要成分是中性脂(三酰基甘油)。这些结果表明在AM共生过程中,丛枝在衰老崩溃后其中的磷脂可能被水解转化为中性脂,并转移到AM真菌孢子中储存。我们推测,外源ABA促进宿主根系中AM真菌特异性脂类的合成和向AM真菌的运输,从而提高丛枝丰度和丛枝数量,大量的丛枝中含有丰富的脂类,是孢子形成的物质基础,在丛枝衰老崩溃后形成中性脂,从根内菌丝转移至根外菌丝,最终形成大量的孢子[25]。
ABA是植物受到环境胁迫后应激反应所产生的激素[26]。植物面对胁迫时产生内源性ABA,并可能传递给AM真菌,诱导AM真菌的生殖生长,从而促进产孢。在本试验中,我们没有对共生体系施加环境胁迫,因此AM真菌和根系的生长发育均未受影响,但是外源ABA可能作为胁迫信号分子能够激发AM真菌作出胁迫响应,增加菌丝的分枝,增强与宿主植物的共生与吸收养分的功能,促进丛枝的形成与产孢。
本研究结果表明,ABA能够促进AM真菌侵染和丛枝数量,进而促进孢子的形成。根据本研究结果,选择AM真菌侵染率和丛枝丰度高的宿主植物进行菌剂扩繁,有可能提高孢子数量和菌剂质量。此外,使用外源ABA和赤霉素缺陷突变体进行菌剂扩繁,能够显著增加AM菌根真菌的产孢量,具有广泛的应用前景。
References
| [1] | Aroca R, Porcel R, Ruiz-Lozano JM. How does arbuscular mycorrhizal symbiosis regulate root hydraulic properties and plasma membrane aquaporins in Phaseolus vulgaris under drought, cold or salinity stresses?. New Phytologist, 2007, 173(4): 808-816. DOI:10.1111/j.1469-8137.2006.01961.x |
| [2] | Seguel A, Cumming JR, Klugh-Stewart K, Cornejo P, Borie F. The role of arbuscular mycorrhizas in decreasing aluminium phytotoxicity in acidic soils: a review. Mycorrhiza, 2013, 23(3): 167-183. DOI:10.1007/s00572-013-0479-x |
| [3] | Miransari M, Abbasipour H, Karimi J, Zadeh MRA, Saeidi A. Arbuscular mycorrhizal fungi and alleviation of soil stresses. Plant Biology, 2010, 12(4): 563-569. |
| [4] | Feng Z, Liu X, Feng G, Zhu H, Yao Q. Linking lipid transfer with reduced arbuscule formation in tomato roots colonized by arbuscular mycorrhizal fungus under low pH stress. Environmental Microbiology, 2020, 22(3): 1036-1051. DOI:10.1111/1462-2920.14810 |
| [5] | Jiang Y, Wang W, Xie Q, Liu N, Liu L, Wang D, Zhang X, Yang C, Chen X, Tang D, Wang E. Plants transfer lipids to sustain colonization by mutualistic mycorrhizal and parasitic fungi. Science, 2017, 356(6343): 1172-1175. DOI:10.1126/science.aam9970 |
| [6] | Luginbuehl LH, Oldroyd GED. Understanding the arbuscule at the heart of endomycorrhizal symbioses in plants. Current Biology, 2017, 27(17): R952-R963. DOI:10.1016/j.cub.2017.06.042 |
| [7] | Javot H, Penmetsa RV, Terzaghi N, Cook DR, Harrison MJ. A Medicago truncatula phosphate transporter indispensable for the arbuscular mycorrhizal symbiosis. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(5): 1720-1725. DOI:10.1073/pnas.0608136104 |
| [8] | Kobae Y, Gutjahr C, Paszkowski U, Kojima T, Fujiwara T, Hata S. Lipid droplets of arbuscular mycorrhizal fungi emerge in concert with arbuscule collapse. Plant and Cell Physiology, 2014, 55(11): 1945-1953. DOI:10.1093/pcp/pcu123 |
| [9] | Herrera-Medina MJ, Steinkellner S, Vierheilig H, Ocampo Bote JA, García Garrido JM. Abscisic acid determines arbuscule development and functionality in the tomato arbuscular mycorrhiza. New Phytologist, 2007, 175(3): 554-564. DOI:10.1111/j.1469-8137.2007.02107.x |
| [10] | Liu X, Feng Z, Zhu H, Yao Q. Exogenous abscisic acid and root volatiles increase sporulation of Rhizophagus irregularis DAOM 197198 in asymbiotic and pre-symbiotic status. Mycorrhiza, 2019, 29(6): 581-589. DOI:10.1007/s00572-019-00916-z |
| [11] | Murcia G, Pontin M, Piccoli P. Role of ABA and Gibberellin A3 on gene expression pattern of sugar transporters and invertases in Vitis vinifera cv. Malbec during berry ripening. Plant Growth Regulation, 2018, 84(2): 275-283. DOI:10.1007/s10725-017-0338-4 |
| [12] | Martín-Rodríguez Já, Ocampo JA, Molinero-Rosales N, Tarkowská D, Ruíz-Rivero O, García-Garrido JM. Role of gibberellins during arbuscular mycorrhizal formation in tomato: new insights revealed by endogenous quantification and genetic analysis of their metabolism in mycorrhizal roots. Physiologia Plantarum, 2015, 154(1): 66-81. DOI:10.1111/ppl.12274 |
| [13] | López-Ráez JA, Kohlen W, Charnikhova T, Mulder P, Undas AK, Sergeant MJ, Verstappen F, Bugg TDH, Thompson AJ, Ruyter-Spira C, Bouwmeester H. Does abscisic acid affect strigolactone biosynthesis?. New Phytologist, 2010, 187(2): 343-354. DOI:10.1111/j.1469-8137.2010.03291.x |
| [14] | Declerck S, Dupré de Boulois H, Bivort C, Delvaux B. Extraradical mycelium of the arbuscular mycorrhizal fungus Glomus lamellosum can take up, accumulate and translocate radiocaesium under root-organ culture conditions. Environmental Microbiology, 2003, 5(6): 510-516. DOI:10.1046/j.1462-2920.2003.00445.x |
| [15] | Phillips JM, Hayman DS. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society, 1970, 55(1): 158-161. DOI:10.1016/S0007-1536(70)80110-3 |
| [16] | Trouvelot A, Kough JL, Gianinazzi-Pearson V. Mesure du taux de mycorhization VA d'un systeme radiculaire. Recherche de methodes d'estimation ayant une significantion fonctionnelle. //Mycorrhizae: Physiology and Genetics, INRA: Paris, France, 1986: 217-221. |
| [17] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [18] | Chen A, Hu J, Sun S, Xu G. Conservation and divergence of both phosphate- and mycorrhiza-regulated physiological responses and expression patterns of phosphate transporters in solanaceous species. New Phytologist, 2007, 173(4): 817-831. DOI:10.1111/j.1469-8137.2006.01962.x |
| [19] | Liu X, Feng Z, Zhao Z, Zhu H, Yao Q. Acidic soil inhibits the functionality of arbuscular mycorrhizal fungi by reducing arbuscule formation in tomato roots. Soil Science and Plant Nutrition, 2020, 66(2): 275-284. DOI:10.1080/00380768.2020.1721320 |
| [20] | Aroca R, Alguacil MD, Vernieri P, Ruiz-Lozano JM. Plant responses to drought stress and exogenous ABA application are modulated differently by mycorrhization in tomato and an ABA-deficient mutant (sitiens). Microbial Ecology, 2008, 56(4): 704-719. DOI:10.1007/s00248-008-9390-y |
| [21] | Martín Rodriguez Já, León Morcillo R, Vierheilig H, Antonio Ocampo J, Ludwig-Müller J, García Garrido JM. Mycorrhization of the notabilis and sitiens tomato mutants in relation to abscisic acid and ethylene contents. Journal of Plant Physiology, 2010, 167(8): 606-613. DOI:10.1016/j.jplph.2009.11.014 |
| [22] | Wang E, Schornack S, Marsh JF, Gobbato E, Schwessinger B, Eastmond P, Schultze M, Kamoun S, Oldroyd GED. A common signaling process that promotes mycorrhizal and oomycete colonization of plants. Current Biology, 2012, 22(23): 2242-2246. DOI:10.1016/j.cub.2012.09.043 |
| [23] | Kobae Y, Hata S. Dynamics of periarbuscular membranes visualized with a fluorescent phosphate transporter in arbuscular mycorrhizal roots of rice. Plant and Cell Physiology, 2010, 51(3): 341-353. DOI:10.1093/pcp/pcq013 |
| [24] | van Aarle IM, Olsson PA, S?derstr?m B. Arbuscular mycorrhizal fungi respond to the substrate pH of their extraradical mycelium by altered growth and root colonization. New Phytologist, 2002, 155(1): 173-182. DOI:10.1046/j.1469-8137.2002.00439.x |
| [25] | Feng Z, Liu X, Zhu H, Yao Q. Responses of arbuscular mycorrhizal symbiosis to abiotic stress: a lipid-centric perspective. Frontiers in Plant Science, 2020, 11: 578919. DOI:10.3389/fpls.2020.578919 |
| [26] | Ren CG, Kong CC, Xie ZH. Role of abscisic acid in strigolactone-induced salt stress tolerance in arbuscular mycorrhizal Sesbania cannabina seedlings. BMC Plant Biology, 2018, 18(1): 74. DOI:10.1186/s12870-018-1292-7 |
