吕燕1,2, 李秀颖1, 王晶晶1,2, 金慧娟1,2, 崔逸儒1,2, 杨毅1

 , 严俊1
, 严俊1

1. 中国科学院沈阳应用生态研究所, 污染生态与环境工程重点实验室, 辽宁 沈阳 110016;
2. 中国科学院大学, 北京 100049
收稿日期:2020-05-31;修回日期:2020-08-26;网络出版日期:2020-10-12
基金项目:国家自然科学基金(41673126,41977295);中国科学院前沿科学重点研究计划(ZDBS-LY-DQC038);辽宁省“兴辽英才计划”(XLYC1807139)
作者简介:严俊, 中国科学院沈阳应用生态研究所研究员。主要从事有机污染物的厌氧生物降解以及相关的微生态过程研究, 尤其关注原位修复土壤与地下水环境中典型有机污染物的生物技术研究。科技部重点研发项目课题负责人, 近年来主持国家自然科学基金面上项目、科技部重点研发专项课题, 参与国家自然科学基金重点项目、美国国家卫生研究院R01项目。在Nature Chemical Biology、The ISME Journal、Environmental Microbiology、Environmental Science & Technology、Applied and Environmental Microbiology等主流期刊发表SCI论文40余篇, 论文被引用约1500次.
*通信作者:杨毅。Tel: +86-24-83970426;E-mail: yangyi@iae.ac.cn;
严俊。E-mail: junyan@iae.ac.cn.
摘要:[目的] 分离鉴定新型有机卤呼吸细菌,拓展有机氯污染物降解菌种资源。[方法] 在限制性培养基中,基于特定脱卤微生物的能量代谢特点以及对抗生素的抗性特征,应用绝迹稀释法从脱氯富集培养物中分离纯化新型有机卤呼吸细菌。通过添加酵母提取物和聚合酶链反应-限制性片段长度多态性等方法鉴定菌株纯度。通过考察细胞形态、16S rRNA系统发育树以及对有机氯化物的利用能力来描述此新型菌株的基本特征。[结果] 菌株GP是一株来自脱卤单胞菌属(Dehalogenimonas)的新型有机卤呼吸细菌,可耐受1.0 g/L的氨苄青霉素和0.1 g/L的万古霉素,其细胞平面形态为直径0.4-0.8 μm的不规则圆形。在乙酸作碳源、氢气作电子供体的条件下,菌株GP可利用1,1-二氯乙烯和一氯乙烯作为电子受体进行有机卤呼吸,脱氯终产物为无毒害的乙烯。16S rRNA系统发育分析表明,菌株GP与Dehalogenimonas formicexedens菌株NSZ-14有高达99.5%的同源性,但两菌株对有机氯化物底物的利用范围不同。[结论] 从脱氯富集培养物中分离纯化出一株新型有机卤呼吸细菌,为深入研究脱卤单胞菌这一重要脱卤微生物的遗传学信息和生理生化性质提供了新材料。
关键词:有机卤呼吸脱卤单胞菌有机氯化物厌氧分离技术
Isolation and basic characterization of a novel organohalide-respiring bacterium within the genus Dehalogenimonas
Yan Lü1,2, Xiuying Li1, Jingjing Wang1,2, Huijuan Jin1,2, Yiru Cui1,2, Yi Yang1

 , Jun Yan1
, Jun Yan1

1. Key Laboratory of Pollution Ecology and Environmental Ecology, Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, Liaoning Province, China;
2. University of Chinese Academy of Sciences, Beijing 100049, China
Received: 31 May 2020; Revised: 26 August 2020; Published online: 12 October 2020
*Corresponding author: Yi Yang. Tel: +86-24-83970426; E-mail: yangyi@iae.ac.cn;
Jun Yan. E-mail: junyan@iae.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (41673126, 41977295), by the CAS Key Research Program of Frontier Sciences (ZDBS-LY-DQC038) and by the Liaoning Revitalization Talents Program (XLYC1807139)
Abstract: [Objective] To isolate and characterize a novel organohalide-respiring bacterium and expand the diversity of dehalogenating microorganisms. [Methods] Based on the specialized energy metabolism and antibiotic resistance of certain dehalogenating microorganisms, we adapted the dilution-to-extinction strategy in defined mineral salts medium for the isolation of an anaerobic bacterium from a dehalogenating enrichment culture. Culture purity was investigated by yeast extract addition to growth medium and PCR-RFLP analysis on 16S rRNA gene amplicon. The basic characteristics of this novel microorganism were described in terms of cell morphology, 16S rRNA gene phylogeny and the ability to utilize chlorinated compounds as electron acceptors. [Results] A novel organohalide-respiring bacterial isolate, strain GP, belonging to Dehalogenimonas genus, was obtained. Strain GP is able to dechlorinate 1, 1-dichloroethene (1, 1-DCE) and grow at the presence of 1 g/L ampicillin and 0.1 g/L vancomycin. Cell morphology of strain GP is irregular disc-shaped coccus with a 0.4-0.8 μm diameter. Strain GP couples growth with reductive dechlorination of 1, 1-DCE and vinyl chloride to nontoxic ethene using acetate as carbon source and hydrogen as electron donor. Phylogenetic analysis indicated that the 16S rRNA gene of strain GP shares 99.5% sequence similarity to that of Dehalogenimonas formicexedens NSZ-14, which grows with different types of chlorinated compounds. [Conclusion] A novel organohalide-respiring bacterium strain GP was isolated from a dehalogenating enrichment culture. This work expands the Dehalogenimonas pangenome and provides new biomaterial for detailed biochemical and physiological characterizations of Dehalogenimonas microorganisms.
Keywords: organohalide respirationDehalogenimonaschlorinated compoundsanaerobic isolation technique
随着现代化学合成技术的发展,大量人工合成的有机氯化物被广泛应用于化工业、制药业、印染业和农业等众多领域[1]。例如,四氯乙烯和三氯乙烯在全世界范围被广泛用作有机溶剂、干洗剂和金属去污剂等[2];一氯乙烯是高分子化工合成聚氯乙烯塑料产品的重要单体化合物[3];1, 2-二氯丙烷可以直接用作土壤熏蒸剂和土壤杀虫剂[4]。有机氯化物密度大、水溶性低且在土壤中迁移性强,因此,这类化合物一旦进入土壤可通过土壤淋溶作用最终渗透到地下水环境中[5-6]。氯乙烯和氯甲烷类有机氯化物是我国长三角、珠三角和京津冀地区地下水环境中最常检出的一类污染物[7]。有机氯化物对生物体具有一定的毒害作用和致癌风险,如四氯乙烯、二氯乙烯、氯乙烷和氯苯等被归类为疑似致癌物,若人体长期接触不仅会对肾脏和肝脏造成损伤,还会对免疫系统和神经系统产生毒害作用[8-9];一氯乙烯和三氯乙烯被世界卫生组织等多家国际机构认定为人体致癌物,可引发肝癌、白血病和帕金森症等疾病[10-12]。
在地下水等厌氧环境中,脱卤微生物对于有机氯化物的降解与转化非常重要。作为严格厌氧或兼性厌氧细菌,脱卤微生物以有机卤化物作为最终电子受体进行产能代谢的过程被称为有机卤呼吸(organohalide respiration),因此,这类脱卤微生物又被称为有机卤呼吸细菌[13]。在这个过程中,有机卤化物中的碳-卤键断裂,有机卤取代基以无机卤的形式被释放,有机卤化物进而被转化为无毒或低毒的终产物,或者生物降解性更高的中间产物[13]。有机卤呼吸细菌不仅对有机氯污染场地的修复至关重要,其在全球卤素循环过程中也发挥着重要作用[14]。目前已知的有机卤呼吸细菌分布于变形杆菌门(Proteobacteria)、厚壁菌门(Firmicutes)和绿弯菌门(Chloroflexi)[15]。其中,绿弯菌门中的脱卤球菌属(Dehalococcoides)由于其独有的将一氯乙烯脱氯还原至乙烯的能力而受到广泛关注,其成员在四氯乙烯与三氯乙烯污染场地的修复过程中起着关键作用[16]。绿弯菌门中的脱卤单胞菌属(Dehalogenimonas)是近年来发现的一种新型有机卤呼吸细菌。相对于其他已经得到深入研究的脱卤微生物种属,目前脱卤单胞菌属下仅分离得到了5株纯培养菌株,分别为Dehalogenimonas lykanthroporepellens菌株BL-DC-9、Dehalogenimonas lykanthroporepellens菌株BL-DC-8、Dehalogenimonas alkenigignens菌株IP3-3、Dehalogenimonas alkenigignen菌株SBP-1以及Dehalogenimonas formicexedens菌株NSZ-14[17-20]。以上这些脱卤单胞菌利用氯代烷烃类化合物(例如1, 2-二氯乙烷、1, 2-二氯丙烷、1, 1, 2-三氯乙烷)作为电子受体产生能量供给生长繁殖[17-20]。
脱卤单胞菌属微生物属于严格厌氧、专性有机卤呼吸细菌,不能利用葡萄糖、乳酸或者酵母膏等底物进行厌氧发酵,生长相对较慢,细胞增倍周期约为2 d[17-20]。脱卤单胞菌对氧化还原电位和营养条件(例如维生素B12)有着严格的要求,不能在固体培养条件下生长[17-20]。通过在最简营养成分液体培养基中进行连续接种稀释,直至获得接近单细胞培养物的方法(绝迹稀释法,dilution-to-extinction)是将脱卤单胞菌属细菌与其他优势共存微生物(例如产甲烷菌、产乙酸菌)分离最常用的手段[21-22]。鉴于脱卤单胞菌细胞不含细胞壁组分,因此在绝迹稀释的操作过程中添加细胞壁合成抑制类抗生素(例如氨苄青霉素和万古霉素)是抑制杂菌生长、提高获得纯培养物成功率的一种常用策略,成功地应用在脱卤单胞菌属BL-DC-9等菌株以及脱卤球菌属195等菌株的分离纯化工作[17-20]。另一方面,由于无法进行划线分离、挑取单菌落等常规固体培养基形式下的操作,给脱卤单胞菌的纯度鉴定带来了一定的困难。研究人员通常采用16S rRNA基因Sanger测序、基因组测序、qPCR、显微镜细胞形态观察、富营养培养以及聚合酶链反应-限制性片段长度多态性(PCR-RFLP)这些技术中的至少3种来验证专性有机卤呼吸细菌培养物的纯度[23-24]。其中,PCR-RFLP技术的原理是根据目标基因的DNA序列特征选择特定的限制性内切酶,将目标基因PCR扩增后进行酶切反应,观察产物DNA片段的数量与长度来判定目标DNA中是否存在杂质DNA[23]。例如,基于脱卤球菌属多个菌株的16S rRNA基因序列特征,Sung等通过分析Hha I、Msp I和Rsa I对16S rRNA基因DNA进行酶切后所产生的片段数量与长度,并结合其他纯度验证实验结果,完成了脱卤球菌GT菌株的分离和纯化的研究工作[24]。
Yang等于2017年报道了一个通过接种葡萄渣堆肥建立的厌氧富集培养物GP,其能够以多种氯乙烯类化合物(例如三氯乙烯、1, 1-二氯乙烯)作为电子受体进行脱氯生长并将其完全脱氯至乙烯[25]。宏基因组学与16S rRNA基因qPCR分析结果表明,一株新型脱卤单胞菌是富集培养物GP中丰度最高的有机卤呼吸细菌,并将其暂时命名为“Dehalogenimonas etheniformans”菌株GP[25]。本研究应用绝迹稀释方法并结合抗生素添加的培养条件,从该富集培养物中分离纯化了新型有机卤呼吸菌株GP,并从细胞形态学特性、有机氯降解性能及16S rRNA系统发育方面描述了菌株GP的基本特征。菌株GP的分离纯化拓展了对脱卤单胞菌属的认识,为后续的基因组分析以及进一步鉴定其生理生化性质提供了研究基础。
1 材料和方法 1.1 材料
1.1.1 脱氯富集培养物: 厌氧混合培养物GP是一个通过接种葡萄渣堆肥样品建立的具有脱氯降解氯乙烯类化合物功能的富集培养体系。培养物GP的详细描述与培养方法参见Yang等的报道[25]。
1.1.2 化学与分子生物学试剂: 一氯乙烯(99% 纯度)、乙烯(99%纯度)和甲烷(99.5%纯度)等气体购自大连大特气体有限公司。1, 1-二氯乙烯(1, 1-dichloroethene,1, 1-DCE)等氯代烯烃和氯代烷烃化合物(≥97%纯度)均购自美国SIGMA试剂公司。细菌DNA提取试剂盒购自中国天根生化科技有限公司。PCR试剂盒TaKaRa Taq? R001A购自宝生物工程(大连)有限公司,琼脂糖凝胶DNA回收试剂盒购自中国天根生物科技有限公司,限制性内切酶Hha I购自美国New England Biolabs公司。
1.2 厌氧基础培养基 厌氧基础培养基的详细配制方法及步骤参照L?ffler等的报道[22]。培养基的组分(每升)如下:(1) 无机盐,NaCl 1.0 g、MgCl2·6H2O 0.5 g、KH2PO4 0.2 g、NH4Cl 0.3 g、KCl 0.3 g、CaCl2·2H2O 0.015 g;(2)微量元素,FeCl2·4H2O 1.5 mg、CoCl2·6H2O 190 μg、MnCl2·4H2O 100 μg、ZnCl2 70 μg、H3BO3 6 μg、Na2MoO4·2H2O 36 μg、NiCl2·6H2O 24 μg、CuCl2·2H2O 2 μg、Na2SeO3·5H2O 6 μg、Na2WO4·2H2O 8 μg;(3) 还原剂,L-半胱氨酸24 mg、DL-二硫苏糖醇77 mg、Na2S·9H2O 48 mg。刃天青(0.25 mg/L)和NaHCO3 (2.52 g/L)分别为氧指示剂和缓冲盐,并调节培养基pH至7.2–7.3。
1.3 厌氧分离纯化 分装10 mL液体培养基至20 mL安捷伦气相色谱玻璃顶空进样瓶,将顶空置换为CO2/N2 (20/80,V/V)混合气后以蓝胶塞和铝盖密封进样瓶。121 ℃灭菌15 min并冷却至室温后,分别加入改良配方的Wolin混合维生素溶液[26]、5 mmol/L乙酸(碳源)、2 mL氢气(电子供体)以及1 μL 1, 1-DCE (电子受体),接种1% (V/V)富集培养物GP并以10倍梯度绝迹稀释方法分离脱卤微生物,每个稀释度设置单重复,分离流程如图 1所示。接种后的进样瓶正立于30 ℃培养箱中避光静置培养,定期监测培养物中1, 1-DCE的减少和脱氯产物的生成情况。1, 1-DCE被完全消耗的高稀释度培养液首先被转接至含有100 mL同样成分培养基的160 mL厌氧血清瓶,当5 μL 1, 1-DCE底物再次被消耗完后转接至添加万古霉素(0.1 g/L)和氨苄青霉素(1.0 g/L)的培养基中,保持以1, 1-DCE作为电子受体的生长条件进行多次传代转接。
 |
| 图 1 绝迹稀释法分离菌株GP的操作流程 Figure 1 The dilution-to-extinction process for the isolation of strain GP. |
| 图选项 |
1.4 16S rRNA基因PCR、测序与系统发育分析 使用无菌注射器与针头抽取菌液5 mL,以真空抽滤法将细胞收集至直径25 mm、孔径0.22 μm的无菌纤维滤膜。使用土壤总DNA提取试剂盒依照厂家说明书步骤从滤膜上提取细菌DNA,以Qubit 3.0荧光定量仪(美国赛默飞公司)定量DNA浓度。采用细菌16S rRNA通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′),使用ABI Veriti热循环仪(美国赛默飞公司)进行PCR扩增反应。PCR反应体系(50 μL)为:10×PCR Buffer (含Mg2+) 5 μL、dNTPs混合液(4种dNTP各2.5 mmol/L) 4 μL、正向与反向引物各0.5 μmol/L、Taq聚合酶(5 U/μL) 0.25 μL、DNA模板(约100 ng)、无核酸酶超纯水,涡旋混匀反应体系并短暂离心。反应条件为:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 100 s,35个循环;72 ℃ 10 min。使用琼脂糖凝胶DNA回收试剂盒纯化1.5 kb目标DNA片段,操作步骤按照试剂盒厂家说明书进行。纯化后的16S rRNA基因扩增产物在冰袋冷藏条件下邮寄至苏州金唯智生物科技有限公司,以引物27F和1492R进行Sanger测序。通过检查测序原始ab1文件中各个核苷碱基位置是否存在重叠峰初步验证菌株纯度,拼接正向及反向测序序列得到接近完整的16S rRNA基因,在GenBank数据库中进行BLAST搜索比对,下载相似性较高的模式菌株的序列,并用Geneious v11.1.5软件中MAFFT V7.388工具排列对齐多个16S rRNA序列,应用PhyML v3.3工具构建系统发育树[27]。
1.5 脱卤微生物纯度鉴定 本研究中采用富营养培养和聚合酶链反应-限制性片段长度多态性(PCR-RFLP)两种方法来进一步鉴定菌株纯度。
1.5.1 富营养培养鉴定法: 按以上所述流程配制同样组分但不含1, 1-DCE的厌氧培养基,添加灭菌后的酵母提取物(1.0 g/L),接种1% (V/V)菌株GP菌液并于30 ℃避光静置培养。观察培养液的生长状况,以15 d内无肉眼可见的培养液变浑浊现象判定GP菌液中不含有杂菌。
1.5.2 PCR-RFLP鉴定法: 按照1.4方法扩增16S rRNA基因,以琼脂糖凝胶法切胶纯化16S rRNA基因扩增产物。纯化后的PCR扩增产物经Qubit 3.0荧光定量仪定量后,转移至PCR管进行限制性内切酶Hha I酶切反应。反应体系(50 μL)为:DNA 1 μg、CutSmart酶切缓冲液5 μL、限制性内切酶Hha I 1 μL (20 units)、超纯水。轻轻将PCR管内溶液混匀并短暂离心,之后将PCR管置于37 ℃水浴中反应1 h。反应结束后,以2.5%的琼脂糖凝胶电泳法检测酶切产物。酶切产物上样量为5 μL,D2000 DNA Marker [100-2000 bp,天根生物科技(北京)有限公司]为DNA分子量标准参照,电泳缓冲液为0.5×TBE,电场强度为5 V/cm,电泳时间为50 min。电泳结果用紫外凝胶成像系统(美国BIO-RAD公司)进行拍照。比较理论预测结果与实际酶切产物的数量与长度来判断是否存在非目标DNA。
1.6 扫描电子显微镜(SEM) 收集适量菌体并用冷冻胶水固定在冷冻传输样品台上,然后将其插入不高于–143.1 ℃的过冷液氮雪泥中进行快速冷冻固定。在真空条件下,将固定好的样品转移至制样舱中的冷台上进行冷冻升华处理,升华温度为–90 ℃,升华时间为10 min。通过溅射镀膜方式在样品表面镀一层铂导电层,将样品转移至冷场扫描电镜Regulus 8100 (日本日立公司)样品舱中的冷台上进行观察和拍照[28]。
1.7 菌株低温冷冻保藏方法 在螺口玻璃瓶内配置60% (V/V)甘油水溶液,旋紧瓶盖后于121 ℃灭菌15 min。待溶液冷却至室温后连同50 mL无菌塑料离心管和2 mL无菌冷冻小管一并转移至厌氧手套箱(美国Coy公司),拧松瓶盖和管盖并放置48 h以去除甘油溶液、离心管和冷冻小管中的残余氧气。将处于指数生长末期(> 90%的1, 1-DCE已经被转化为乙烯)的菌株GP培养瓶转移至厌氧手套箱,打开铝盖与橡胶塞,以无菌一次性移液管将等体积菌液和甘油溶液转移至离心管,混匀并分装至多个冷冻小管。拧紧管盖后将冷冻小管转移出厌氧手套箱并立即放入–80 ℃保藏。每间隔1–2月取出一个冷冻小管,于厌氧箱内解冻并接种于1.3中所述成分培养基中,通过检测1, 1-DCE的脱氯产物判断菌株GP在该冷冻保藏条件下的存活能力。
1.8 有机氯化物利用能力测试 在含有100 mL如1.3所述成分基础培养基的160 mL玻璃血清瓶中分别加入0.5–0.6 mmol/L液相浓度的四氯乙烯、1, 1, 1-三氯乙烷、1, 1, 2-三氯乙烷、1, 2-二氯丙烷和1, 1, 2-三氯丙烷。待有机相完全溶解后接种3% (V/V)的新鲜GP菌液。含有以上一种有机氯但未接种的培养基作为阴性对照。气相色谱法定期监测有机氯底物浓度变化以及脱氯产物产生的情况。
1.9 气相色谱分析方法 使用安捷伦7890B气相色谱仪(美国安捷伦公司)检测甲烷、有机氯及其脱氯降解产物。所用检测器为火焰离子化检测器(FID),色谱柱为DB-624毛细管柱(60 m×0.32 mm×1.8 μm,美国安捷伦公司)。气相色谱参数设置如下:进样口温度200 ℃,载气为高纯氦气,柱流量1 mL/min;柱温箱初始温度为60 ℃,保持2 min,然后以25 ℃/min的速度升温至200 ℃,保持1 min;FID检测器温度300 ℃,氢气流量为30 mL/min,空气流量为350 mL/min,氮气尾吹气流量为25 mL/min。
1.10 气相色谱-质谱联用分析方法 采用气相色谱-质谱联用法鉴定1, 1-DCE脱氯降解产物化学结构。TRACE 1300气相色谱仪(美国赛默飞公司)的参数设置如下:进样口温度为150 ℃,色谱柱为PoraPlot Q毛细管柱(25 m×0.32 mm×10 μm,美国安捷伦公司),载气为高纯氦气,柱流量1.5 mL/min;柱温箱初始温度为45 ℃,保持1 min,然后以20 ℃/min的速度升温至200 ℃,保持9 min。ISQ 7000质谱仪(美国赛默飞公司)的关键参数设置如下:电子轰击离子源(EI)温度为280 ℃,接口温度为280 ℃;在全扫描模式下采集数据,分子量扫描范围为15–200 m/z,扫描间隔为0.3 s。
2 结果和分析 2.1 新型脱卤单胞菌株的分离纯化 本研究中绝迹稀释法的梯度设置如图 1所示。气相色谱监测结果显示发生有机氯降解现象的最大稀释度为10–10的培养液,其中所添加的1, 1-DCE在50 d内被完全消耗并伴随降解产物的生成。相比作为接种源的富集培养物GP,10–10稀释度培养液中浑浊度在裸眼观察下并不明显,且培养瓶顶空未检测到甲烷产生。10–10稀释度培养物在含有同样成分但添加了两种抗生素(0.1 g/L万古霉素和1.0 g/L氨苄青霉素)的培养基中多次转接(> 10次)并正常生长,且所有转接培养瓶中均未监测到甲烷,表明高稀释度接种与连续转接有效排除了富集培养物GP中的产甲烷菌。16S rRNA基因Sanger测序结果显示在所有有效核苷碱基读数位置均无发现重叠峰现象,初步表明了培养物的纯度。通过拼接正向与反向引物测序结果,获得了接近完整的、涵盖了从21-bp到1410-bp位置的16S rRNA基因序列。经过与GenBank中已有序列的BLAST比对,发现此16S rRNA序列与Yang等所报道的富集培养物GP中占优势的Candidatus “Dehalogenimonas etheniformans”菌株GP的16S rRNA序列(GenBank No. KY777753.1)完全一致。此部分结果表明我们初步分离了富集培养物GP中的有机卤呼吸细菌Candidatus “Dehalogenimonas etheniformans”菌株GP,其具有与其他脱卤单胞菌株相同的耐受高浓度万古霉素和氨苄青霉素的能力。
2.2 脱卤单胞菌株GP的纯度鉴定 目前已知的所有脱卤单胞菌株均为专性有机卤呼吸细菌,不具备利用酵母提取物进行厌氧发酵生长的能力。在静置避光培养15 d后,额外添加了酵母提取物但不含1, 1-DCE的培养液以及未接种的阴性对照组中均未产生肉眼可见浑浊,表明没有杂菌。使用NEBcutter V2.0软件(美国New England Biolabs公司)分析了一些常用限制性内切酶对于脱卤单胞菌株GP的16S rRNA基因序列的酶切结果,软件预测结果如表 1所示。通过综合考虑酶切条带数量、各条带的电泳分离间距、以及最大与最小条带的合适长度,我们选择了限制性内切酶Hha I对菌株GP的16S rRNA基因DNA进行了酶切反应,结果如图 2所示。反应后,对应位置上的菌株GP的16S rRNA基因DNA (约1500 bp)被完全消化,并相应产生了3条酶切片段。通过与DNA标准条带的比对,酶切反应产生的3个片段的大小分别约为1050、250和120 bp,与软件预测的Hha I酶切产生的特异性片段数量(3个)与长度(1017、244和91 bp)基本一致,并且电泳胶图上没有发现额外的酶切片段。因此,综合16S rRNA基因Sanger测序、酵母提取物培养以及PCR-RFLP的分析结果,可以推断菌株GP培养液中无杂菌污染。
表 1. 菌株GP 16S rRNA基因DNA限制性内切酶酶切产物预测 Table 1. Recognition sites of some restriction endonucleases and the predicated digestion fragments of strain GP's 16S rRNA gene
| Endonuclease | Cutting site | Number of fragments | Length of fragments/bp |
| Hha I | 5′···GCG▼C···3′ 3′···C▲GCG···5′ | 3 | 1017, 244, 91 |
| HinF I | 5′···G▼ANTC···3′ 3′···CTNA▲G···5′ | 4 | 1064, 169, 101, 25 |
| Taq I | 5′···T▼CGA···3′ 3′···AGC▲T···5′ | 5 | 663, 464, 120, 87, 25 |
| Msp I | 5′···C▼CGG···3′ 3′···GGC▲C···5′ | 5 | 573, 463, 190, 125, 8 |
表选项
 |
| 图 2 菌株GP 16S rRNA基因DNA的Hha I酶切产物的电泳分离图 Figure 2 Gel electrophoresis of PCR-RFLP products. Lane M: DNA ladder; lane 1: the Hha I digestion products of strain GP's 16S rRNA gene DNA; lane 2: non-digested strain GP's 16S rRNA gene DNA (negative control). |
| 图选项 |
2.3 菌株GP的基本性质描述
2.3.1 形态学特征、生长与保藏条件: 在1, 1-DCE脱氯生长条件下培养30 d后,菌株GP的培养液呈现不明显白色浑浊。同样培养条件下,菌株GP不能在普通固体培养基(2%琼脂糖)或半固体培养基(1%低熔点琼脂糖)介质中生长,该结果与之前报道的脱卤单胞菌BL-DC-9菌株不能在固态培养基上生长的结果一致[17]。SEM形态学分析结果如图 3所示,菌株GP细胞在平面外观上表现为不规则圆形,直径在0.4 μm到0.8 μm间,没有观察到鞭毛。SEM观察过程中未发现其他形态的细胞。在pH 7.2厌氧基础培养基和30 ℃培养条件下,菌株GP以乙酸为碳源、氢气为电子供体、1, 1-DCE为电子受体进行有机卤呼吸生长。在30%甘油保护液中,菌株GP可在–80 ℃条件下长期冷冻保藏。
 |
| 图 3 菌株GP细胞形态的SEM电镜图 Figure 3 Cell morphology of strain GP revealed by scanning electron microscope (SEM). |
| 图选项 |
2.3.2 菌株GP的脱氯降解性能: 在进行1, 1-DCE脱氯生长的过程中,气相色谱分析检测到两种代谢产物(图 4-A),其色谱柱保留时间分别为3.34 min和2.84 min。1, 1-DCE首先被转化为3.34 min的化合物,其不断积累并在菌株GP生长过程中进一步向2.84 min的化合物转化。如图 4-B所示,1, 1-DCE与3.34 min的中间代谢产物在经过30 d的培养后被完全转化为2.84 min的化合物,并且其峰面积不再随着培养时间的增加而变化,表明该2.84 min的化合物为1, 1-DCE降解的终产物。通过与标准品的色谱柱保留时间比对(图 4-C),这两种1, 1-DCE脱氯代谢产物分别对应一氯乙烯和乙烯。
 |
| 图 4 菌株GP培养液中1, 1-DCE脱氯降解产物的气相色谱分析结果 Figure 4 Gas chromatograms (GC) of 1, 1-DCE and its dechlorination products in strain GP culture. A: The GC retention times of two dechlorination daughter products in 1, 1-DCE dechlorinating strain GP cultures; B: The GC retention time of 1, 1-DCE dechlorination final product; C: The GC retention times of 1, 1-DCE standard, vinyl chloride standard and ethene standard. |
| 图选项 |
接着,我们采用了气相色谱-质谱联用分析方法进一步确认了1, 1-DCE脱氯中间产物和终产物的化学结构。菌株GP培养液顶空样品的总离子流色谱图(图 5-A)同样显示1, 1-DCE的脱氯降解过程中产生了2种代谢产物,其色谱柱保留时间分别为7.42 min和3.63 min。质谱分析表明,7.42 min出现的化合物的质荷比(m/z)为62.02 (图 5-B),符合含有35Cl稳定同位素的一氯乙烯的计算分子量(62.00 Da),其质谱指纹图谱(图 5-B)经与仪器自带的NIST (美国国家标准技术研究所)质谱数据库的检索比对后,该化合物被确认为一氯乙烯。通过同样的质谱分析流程,发现3.63 min所对应的化合物的质荷比为28.10 (图 5-C),该数值与乙烯的计算分子量28.05 Da相符合,NIST质谱数据库的检索结果进一步确认该化合物为乙烯。
 |
| 图 5 菌株GP培养液中1, 1-DCE脱氯降解产物的气相色谱-质谱联用分析结果 Figure 5 Mass spectrometry analysis of 1, 1-DCE dechlorination products in strain GP cultures. A: The total ion current chromatogram of 1, 1-DCE and two dechlorination products; B: The mass spectrum of 1, 1-DCE dechlorination product with a retention time of 7.42 min; C: The mass spectrum of 1, 1-DCE dechlorination product with a retention time of 3.63 min. |
| 图选项 |
因此,结合气相色谱与气质联用两种方法的分析结果可以得出结论,菌株GP对于1, 1-DCE的脱氯降解的中间代谢产物为一氯乙烯,终产物为乙烯。纯培养条件下菌株GP的脱氯降解能力与在富集培养物GP中观察到的现象一致。在以四氯乙烯或者氯代烷烃类化合物作为电子受体的培养条件下,有机氯底物的起始浓度无显著变化,并且未检测到相应脱氯产物(例如三氯乙烯、乙烯、丙烯)的产生,表明菌株GP具有较高的底物专一性,只能利用特定结构的氯乙烯类化合物,不能利用四氯乙烯、1, 1, 1-三氯乙烷、1, 1, 2-三氯乙烷、1, 2-二氯丙烷和1, 1, 2-三氯丙烷。
2.4 菌株GP的系统发育分析 我们选取了来自绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)以及变形杆菌门(Proteobacteria)的29株典型有机卤呼吸细菌进化了系统发育分析。进化树分析结果如图 6所示,菌株GP的16S rRNA基因与所有已知脱卤单胞菌属的细菌有着高达95.3%–99.5%的序列相似度。脱卤单胞菌属、脱卤球菌属以及尚未正式命名的Candidatus “Dehalobium chlorocoercia”均来自于绿弯菌门。因此,菌株GP表现出与脱卤球菌属菌株和“Dehalobium chlorocoercia”较高的进化相关性,其16S rRNA基因序列相似度分别为89.5%–89.9%和86.1%。脱硫杆菌属(Desulfitobacterium)与脱卤杆菌属(Dehalobacter)属于厚壁菌门下的典型脱卤微生物,利用氯乙烯类和氯苯酚类有机氯化合物进行有机卤呼吸过程,其16S rRNA基因与菌株GP的序列相似度分别为68.9%–73.7%和70.3%–74.5%。菌株GP与来自变形杆菌门的脱卤微生物种属也表现出了较低的进化相关性,与硫螺旋菌属(Sulfurospirillum)、厌氧粘杆菌属(Anaeromyxobacter)以及地质杆菌属下lovleyi种(Geobacter lovleyi)的16S rRNA基因序列相似度分别为70.3%–71.2%、72.5%–73.2%和73.7%。系统发育分析结果再次确认了菌株GP在分类学上属于脱卤单胞菌属。在对氯乙烯类有机氯的代谢能力上,菌株GP与进化距离较远的厚壁菌门与变形杆菌门下的脱卤微生物有一定的相似性,表明仅仅基于16S rRNA基因序列相似性不足以准确评价有机卤呼吸细菌的脱氯功能。
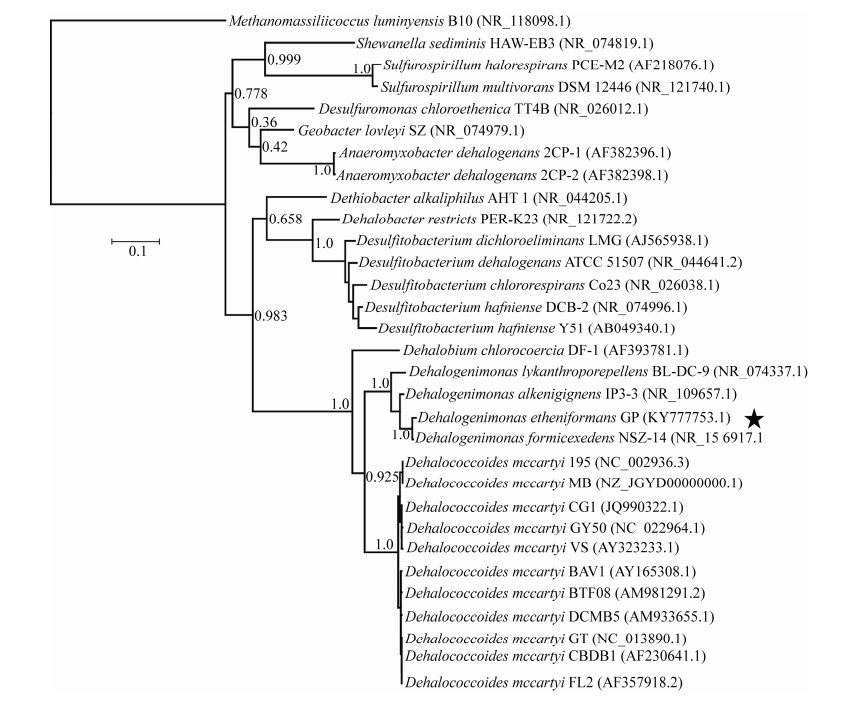 |
| 图 6 菌株GP基于16S rRNA基因序列的系统发育树 Figure 6 Phylogenetic tree of strain GP's 16S rRNA gene. Numbers in parentheses: GenBank accession number; Numbers in branch points: branch support values; Bar length=0.1: nucleotide divergence between sequences. |
| 图选项 |
3 讨论 本研究分离纯化了一株来自脱卤单胞菌属的新型有机卤呼吸细菌GP,提供了多重实验证据验证了培养物纯度,并描述了其细胞形态、脱氯能力以及16S rRNA系统发育等基本特征。菌株GP与同为脱卤单胞菌属的菌株NSZ-14有着高达99.5%的序列相似性。研究证明,菌株NSZ-14以及之前已分离的脱卤单胞菌属的菌株均只能专性利用氯代烷烃类化合物来进行生长繁殖,不具备脱氯降解氯代烯烃类化合物的能力[17-20]。菌株GP可以利用1, 1-DCE和一氯乙烯作为电子受体,产生乙烯作为还原性脱氯反应终产物,是目前已知的唯一能够利用一氯乙烯进行生长的脱卤单胞菌属成员。
脱卤单胞菌属是新近发现的一类专性有机卤呼吸细菌,该属的首个菌株于2009年分离自美国路易斯安娜州的一个超级基金污染场地(superfund site)[17]。近年来的研究表明,脱卤单胞菌不但在污染场地,并且在未污染生态系统中也有着广泛的分布,是自然界中卤素循环的重要驱动者[29]。受限于纯培养菌株的数量,目前对于脱卤单胞菌属的遗传学信息以及生理生化性质仍然缺乏一个全面的认识。虽然当代高通量测序以及环境组学技术等分子手段的发展为在混合培养条件下研究难分离难培养微生物提供了极大的便利,然而,对目标微生物进行全面的生理生化鉴定以准确描述其分类学特征仍然极大地依赖于获取纯培养物[15]。例如,对于不同结构有机氯化物的利用能力是评价有机卤呼吸细菌的一个重要生理指标,主要体现在脱氯途径、中间产物以及终产物等。在混合培养条件下,由于常常涉及到多个脱卤微生物种群间的协同脱氯作用,因此难以准确描述单个种群对有机氯化物的利用能力,也为评价与追踪其在有机氯污染场地的原位生物修复过程中所起到的作用带来了一些不便。菌株GP的分离纯化工作为完整描述其对于不同有机氯化物的利用能力提供了可能性,也为进一步完善对于脱卤单胞菌这一重要有机卤呼吸属微生物的认识提供了基础。
菌株GP的分离对于修复四氯乙烯和三氯乙烯污染场地有着重要的意义。在氯乙烯类有机氯污染场地的原位生物修复过程中常见的一个问题是高毒性中间产物二氯乙烯和一氯乙烯的积累与降解停滞[30]。虽然多个种属的脱卤微生物(例如脱卤杆菌、地质杆菌等)能够将四氯乙烯和三氯乙烯降解至二氯乙烯,然而之前的研究表明只有来自脱卤球菌属的成员能够完成二氯乙烯和一氯乙烯至无毒害乙烯的脱氯转化,脱卤球菌属微生物的存在是能否完全解毒降解氯乙烯类污染物的重要指标之一[31-32]。本项研究完整证明了非脱卤球菌属的有机卤呼吸细菌也可以利用一氯乙烯进行还原性脱氯生长,并将其完全降解至乙烯。因此,菌株GP的成功分离不但完善了对脱卤微生物的物种多样性和功能多样性的认识,也为氯乙烯类污染场地的彻底修复提供了重要的菌种资源。
致谢
感谢美国田纳西大学Frank L?ffler教授为本研究提供了脱氯富集培养物GP,感谢浙江大学朱利中教授课题组李亚如博士在菌株GP细胞SEM扫描电镜图拍摄过程中提供的技术支持。
References
| [1] | Loos R, Locoro G, Comero S, Contini S, Schwesig D, Werres F, Balsaa P, Gans O, Weiss S, Blaha L, Bolchi M, Gawlik BM. Pan-European survey on the occurrence of selected polar organic persistent pollutants in ground water. Water Research, 2010, 44(14): 4115-4126. DOI:10.1016/j.watres.2010.05.032 |
| [2] | Wypych G. Handbook of Solvents. 3rd ed. Toronto: ChemTec Publishing, 2019. |
| [3] | Jakubowicz I, Yarahmadi N, Gevert T. Effects of accelerated and natural ageing on plasticized polyvinyl chloride (PVC). Polymer Degradation and Stability, 1999, 66(3): 415-421. DOI:10.1016/S0141-3910(99)00094-4 |
| [4] | L?ffler FE, Champine JE, Ritalahti KM, Sprague SJ, Tiedje JM. Complete reductive dechlorination of 1, 2-dichloropropane by anaerobic bacteria. Applied and Environmental Microbiology, 1997, 63(7): 2870-2875. DOI:10.1128/AEM.63.7.2870-2875.1997 |
| [5] | Pimviriyakul P, Wongnate T, Tinikul R, Chaiyen P. Microbial degradation of halogenated aromatics: molecular mechanisms and enzymatic reactions. Microbial Biotechnology, 2020, 13(1): 67-86. DOI:10.1111/1751-7915.13488 |
| [6] | Volpe A, Del Moro G, Rossetti S, Tandoi V, Lopez A. Remediation of PCE-contaminated groundwater from an industrial site in southern Italy: A laboratory-scale study. Process Biochemistry, 2007, 42(11): 1498-1505. DOI:10.1016/j.procbio.2007.07.017 |
| [7] | Huang BB, Lei C, Wei CH, Zeng GM. Chlorinated volatile organic compounds (Cl-VOCs) in environment-sources, potential human health impacts, and current remediation technologies. Environment International, 2014, 71: 118-138. DOI:10.1016/j.envint.2014.06.013 |
| [8] | Zuo JE, Xiao JH, Chen LL. A review on reductive dechlorination of chlorinated organic pollutants under anaerobic condition. Techniques and Equipment for Environmental Pollution Control, 2003, 4(6): 43-48. (in Chinese) 左剑恶, 肖晶华, 陈莉莉. 氯代有机污染物在厌氧条件下还原脱氯的研究进展. 环境污染治理技术与设备, 2003, 4(6): 43-48. |
| [9] | Bove FJ, Fulcomer MC, Klotz JB, Esmart J, Dufficy EM, Savrin JE. Public drinking water contamination and birth outcomes. American Journal of Epidemiology, 1995, 141(9): 850-862. DOI:10.1093/oxfordjournals.aje.a117521 |
| [10] | Scott CS, Jinot J. Trichloroethylene and cancer: systematic and quantitative review of epidemiologic evidence for identifying hazards. International Journal of Environmental Research and Public Health, 2011, 8(11): 4238-4271. DOI:10.3390/ijerph8114238 |
| [11] | Kielhorn J, Melber C, Wahnschaffe U, Aitio A, Mangelsdorf I. Vinyl chloride: still a cause for concern. Environmental Health Perspectives, 2000, 108(7): 579-588. DOI:10.1289/ehp.00108579 |
| [12] | Goldman SM, Quinlan PJ, Ross JW, Marras C, Meng CI, Bhudhikanok GS, Comyns K, Korell M, Chade AR, Kasten M, Priestley B, Chou KL, Fernandez HH, Cambi F, Langston JW, Tanner CM. Solvent exposures and Parkinson disease risk in twins. Annals of Neurology, 2012, 71(6): 776-784. DOI:10.1002/ana.22629 |
| [13] | Hug LA, Maphosa F, Leys D, L?ffler FE, Smidt H, Edwards EA, Adrian L. Overview of organohalide-respiring bacteria and a proposal for a classification system for reductive dehalogenases. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 2013, 368(1616): 20120322. DOI:10.1098/rstb.2012.0322 |
| [14] | Yang Y, Zhang YZ, Li XY, Zeng XF, Song YF, Yan J. Roles of Dehalococcodia Class in the biogeochemical cycle of organohalides. Acta Scientiae Circumstantiae, 2019, 39(10): 3207-3214. (in Chinese) 杨毅, 张耀之, 李秀颖, 曾祥峰, 宋玉芳, 严俊. 脱卤球菌纲(Dehalococcodia Class)在有机卤化物生物地球化学循环中的作用. 环境科学学报, 2019, 39(10): 3207-3214. |
| [15] | Richardson RE. Genomic insights into organohalide respiration. Current Opinion in Biotechnology, 2013, 24(3): 498-505. DOI:10.1016/j.copbio.2013.02.014 |
| [16] | L?ffler FE, Ritalahti KM, Zinder SH. Dehalococcoides and reductive dechlorination of chlorinated solvents//Stroo HF, Leeson A, Ward CH. Bioaugmentation for Groundwater Remediation. New York: Springer, 2013: 39-88. |
| [17] | Yan J, Rash BA, Rainey FA, Moe WM. Isolation of novel bacteria within the Chloroflexi capable of reductive dechlorination of 1, 2, 3-trichloropropane. Environmental Microbiology, 2009, 11(4): 833-843. DOI:10.1111/j.1462-2920.2008.01804.x |
| [18] | Bowman KS, Nobre MF, Da Costa MS, Rainey FA, Moe WM. Dehalogenimonas alkenigignens sp. nov., a chlorinated-alkane-dehalogenating bacterium isolated from groundwater. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(pt 4): 1492-1498. |
| [19] | Key TA, Bowman KS, Lee I, Chun J, Albuquerque, da Costa MS, Rainey FA, Moe WM. Dehalogenimonas formicexedens sp. nov., a chlorinated alkane-respiring bacterium isolated from contaminated groundwater. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(5): 1366-1373. DOI:10.1099/ijsem.0.001819 |
| [20] | Moe WM, Yan J, Nobre MF, Da Costa MS, Rainey FA. Dehalogenimonas lykanthroporepellens gen. nov., sp. nov., a reductively dehalogenating bacterium isolated from chlorinated solvent-contaminated groundwater. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(11): 2692-2697. DOI:10.1099/ijs.0.011502-0 |
| [21] | Maymó-Gatell X, Chien YT, Gossett JM, Zinder SH. Isolation of a bacterium that reductively dechlorinates tetrachloroethene to ethene. Science, 1997, 276(5318): 1568-1571. DOI:10.1126/science.276.5318.1568 |
| [22] | L?ffler FE, Sanford RA, Ritalahti KM. Enrichment, cultivation, and detection of reductively dechlorinating bacteria. Methods in Enzymology, 2005, 397: 77-111. |
| [23] | Sung Y, Fletcher KE, Ritalahti KM, Apkarian RP, Ramos-Hernández N, Sanford RA, Mesbah NM, L?ffler FE. Geobacter lovleyi sp. nov. strain SZ, a novel metal-reducing and tetrachloroethene-dechlorinating bacterium. Applied and Environmental Microbiology, 2006, 72(4): 2775-2782. DOI:10.1128/AEM.72.4.2775-2782.2006 |
| [24] | Sung Y, Ritalahti KM, Apkarian RP, L?ffler FE. Quantitative PCR confirms purity of strain GT, a novel trichloroethene-to-ethene-respiring Dehalococcoides isolate. Applied and Environmental Microbiology, 2006, 72(3): 1980-1987. DOI:10.1128/AEM.72.3.1980-1987.2006 |
| [25] | Yang Y, Higgins SA, Yan J, ?im?ir B, Chourey K, Iyer R, Hettich RL, Baldwin B, Ogles DM, L?ffler FE. Grape pomace compost harbors organohalide-respiring Dehalogenimonas species with novel reductive dehalogenase genes. The ISME Journal Multidisciplinary Journal of Microbial Ecology, 2017, 11(12): 2767-2780. |
| [26] | Wolin EA, Wolin MJ, Wolfe RS. Formation of methane by bacterial extracts. Journal of Biological Chemistry, 1963, 238(8): 2882-2886. DOI:10.1016/S0021-9258(18)67912-8 |
| [27] | Kearse M, Moir R, Wilson A, Stones-Havas S, Cheung M, Sturrock S, Buxton S, Cooper A, Markowitz S, Duran C, Thierer T, Ashton B, Meintjes P, Drummond A. Geneious Basic: An integrated and extendable desktop software platform for the organization and analysis of sequence data. Bioinformatics, 2012, 28(12): 1647-1649. DOI:10.1093/bioinformatics/bts199 |
| [28] | Xiao Y, Li TT, Zhou F, Zuo YX. Cryo-scanning electron microscopy and its application in the research of life science. Journal of Chinese Electron Microscopy Society, 2015, 34(5): 447-451. (in Chinese) 肖媛, 李婷婷, 周芳, 左艳霞. 冷冻扫描电镜及其在生命科学研究中的应用. 电子显微学报, 2015, 34(5): 447-451. DOI:10.3969/j.issn.1000-6281.2015.05.016 |
| [29] | Atashgahi S, H?ggblom MM, Smidt H. Organohalide respiration in pristine environments: implications for the natural halogen cycle. Environmental Microbiology, 2018, 20(3): 934-948. DOI:10.1111/1462-2920.14016 |
| [30] | Dolinová I, ?trojsová M, ?erník M, Něme?ek J, Machá?ková J, ?evc? A. Microbial degradation of chloroethenes: a review. Environmental Science and Pollution Research, 2017, 24(15): 13262-13283. DOI:10.1007/s11356-017-8867-y |
| [31] | L?ffler FE, Yan J, Ritalahti KM, Adrian L, Edwards EA, Konstantinidis KT, Müller JA, Fullerton H, Zinder SH, Spormann AM. Dehalococcoides mccartyi gen. nov., sp. nov., obligately organohalide-respiring anaerobic bacteria relevant to halogen cycling and bioremediation, belong to a novel bacterial class, Dehalococcoidia classis nov., order Dehalococcoidales ord. nov. and family Dehalococcoidaceae fam. nov., within the phylum Chloroflexi. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(Pt 2): 625-635. |
| [32] | Aeppli C, Hofstetter TB, Amaral HIF, Kipfer R, Schwarzenbach RP, Berg M. Quantifying in situ transformation rates of chlorinated ethenes by combining compound-specific stable isotope analysis, groundwater dating, and carbon isotope mass balances. Environmental Science & Technology, 2010, 44(10): 3705-3711. |
