王哲1, 储引娣1, 张艳娟1, 李军2

 , 范恩国1
, 范恩国1

1. 中国医学科学院基础医学研究所, 北京协和医学院基础学院病原学系, 医学分子生物学国家重点实验室, 北京 100005;
2. 中国医学科学院北京协和医学院, 北京协和医院皮肤科, 北京 100730
收稿日期:2020-05-09;修回日期:2020-07-03;网络出版日期:2020-08-18
基金项目:国家自然科学基金(31770901);中国医学科学院医学与健康科技创新工程(2017-I2M-1-012);北京协和医学院“中央高校基本科研业务费”(3332019065)
*通信作者:李军, Tel: +86-10-69151500, E-mail: lijun35@hotmail.com;
范恩国, Tel: +86-10-69156984, E-mail: enguo.fan@ibms.pumc.edu.cn.
摘要:梅毒是由梅毒螺旋体(Treponema pallidum)亚种苍白螺旋菌引起的性传播感染性疾病,主要通过母婴感染或性接触的方式传播。梅毒螺旋体的外膜蛋白在梅毒螺旋体的传播和宿主的黏附等方面起重要作用,因此,鉴定可以作为抗生素作用靶点的梅毒螺旋体外膜蛋白一直是梅毒疫苗开发的研究重点。本文重点阐述了梅毒螺旋体外膜蛋白的结构功能等特性,并将目前针对细菌外膜蛋白为靶点的药物的研究进展进行总结,以期为针对梅毒螺旋体的外膜蛋白为靶点的相关药物的研发提供一些新思路。
关键词:梅毒螺旋体外膜蛋白抗生素药物靶点
Outer membrane protein in Treponema pallidum
Zhe Wang1, Yindi Chu1, Yanjuan Zhang1, Jun Li2

 , Enguo Fan1
, Enguo Fan1

1. State Key Laboratory of Medical Molecular Biology, Department of Microbiology and Parasitology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100005, China;
2. Department of Dermatology, Chinese Academy of Medical Sciences, Peking Union Medical College, Peking Union Medical College Hospital, Beijing 100730, China
Received: 9 May 2020; Revised: 3 July 2020; Published online: 18 August 2020
*Corresponding author: Jun Li, Tel: +86-10-69151500, E-mail: lijun35@hotmail.com;
Enguo Fan, Tel: +86-10-69156984, E-mail: enguo.fan@ibms.pumc.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31770901), by the CAMS Innovation Fund for Medical Sciences (2017-I2M-1-012) and by the Beijing Union Medical College "Fundamental Research Funds for the Central Universities"(3332019065)
Abstract: Syphilis, an infectious disease caused by Treponema pallidum subspecies pallidum, is mainly transmitted through mother-to-child infection or sexual contact. The outer membrane proteins of T. pallidum play important roles in the transmission and the adhesion to the hosts. Therefore, the identification of outer membrane proteins from T. pallidum, which can be used as the target of antibiotics, has become the research focus of vaccine development for syphilis. This review focuses on the structural and functional research of the outer membrane proteins of T. pallidum, and also summarizes the current research progresses on the development of drugs that target bacterial outer membrane proteins, in order to provide an overview and perspective aiming at the development of new drugs against T. pallidum.
Keywords: Treponema pallidumouter membrane proteinsantibioticsdrug targets
尽管梅毒螺旋体是人类最早发现的主要细菌病原体之一,但我们对梅毒发病机理的了解远远落后于其他常见细菌感染,而且由于梅毒螺旋体不能体外培养和无法进行遗传操作[1],更是极大地限制了对梅毒螺旋体致病机理的研究。目前,在临床上,青霉素是治疗梅毒首选的有效药物[2]。但是,近年来抗生素的大量滥用加速了梅毒螺旋体对药物的耐受性,如果今后出现了对青霉素耐药的菌株,将对防控梅毒产生巨大的挑战。因此,尽快开发针对梅毒有效的疫苗至关重要。
大部分细菌感染的病原菌都属于革兰氏阴性菌,革兰氏阴性细菌的外膜(outer membrane,OM)不仅是阴性菌最重要的保护屏障,而且作为一种选择性渗透屏障,控制着细菌与外界环境的物质交流。细菌耐药的核心策略之一,就是通过改变其外膜的结构进而改变其通透性,从而有效地阻止抗生素穿过外膜进入细菌细胞内发挥作用,故细菌的这一策略有效地阻碍了许多目前使用的抗生素在临床中的应用[3]。因此,破坏细菌的外膜不仅可导致细菌与外界交流的障碍并可直接导致细菌的死亡,而且可使原本无法穿透外膜的抗生素更易于到达细菌细胞内的作用靶点,从而达到老药新用的效果。细菌外膜上的外膜蛋白(outer membrane proteins,OMPs)不仅是外膜的核心组分,且在细菌的免疫原性、致病性和耐药性等方面都具有核心功能,同时其位于外膜上的这一特点,使其更易为抗生素所识别并结合,故细菌OMPs可作为理想的新型抗生素作用靶点,用于新型抗生素的开发。
1 梅毒螺旋体外膜 革兰氏阴性细菌具有内外两层膜,内膜(inter membrane,IM)是典型的对称型甘油磷脂双分子层结构,外膜(OM)是包含甘油磷脂的内部小叶和含有脂多糖(LPS)的外部小叶的不对称双层结构[4]。IM和OM之间的区域称为周质(periplasm)。IM和OM都包含许多锚定的脂蛋白以及众多的整合膜蛋白[5]。在IM中,这些完整的膜蛋白包含多个跨膜螺旋结构域;而在OM中,它们大多数会折叠成跨膜β-桶状结构域[6],简称为β-桶状外膜蛋白,这种常见的β-桶形结构还可以形成多聚体以及包含结构和复杂性不同的周质或细胞外结构域,有助于β-桶形结构的进一步稳定[7]。
像所有螺旋体一样,梅毒螺旋体是一种螺旋状的、能动性很高的细菌,由围绕周质空间的脆弱外膜(OM)、肽聚糖(peptidoglycan)-细胞质膜复合物和原生质(protoplasm)圆柱体组成。它的运动性细胞器-内鞭毛(flagellum)被封闭在周质空间内(图 1)。有研究表明,梅毒螺旋体属于革兰氏阴性细菌,但其细胞膜的结构、组成和物理性质与典型的革兰氏阴性细菌明显不同[8]。梅毒螺旋体的OM除了缺乏脂多糖外,跨膜蛋白(通常统称为稀有OMPs)的密度也较低。在两项独立的研究[9-10]中探索了梅毒螺旋体外膜的相对抗原惰性,其中通过冷冻断裂电子显微镜观察到的梅毒螺旋体仅含有罕见的整合蛋白,其外膜蛋白大约是大肠杆菌(Escherichia coli)外膜中发现数量的1%,并且很容易被诸如离心和重悬之类的操作破坏[11]。OMPs的缺乏是梅毒螺旋体超强免疫逃逸能力的超微结构基础,并由此得名“隐性病原体”[8]。梅毒螺旋体如何以最低限度的OM来满足其营养需求并执行其复杂的生物发生过程?曾有人提出,梅毒螺旋体的复制速度极慢(约30 h)[12],这也许是生存所需的表面分子密度与隐身需求之间的进化“折衷”。
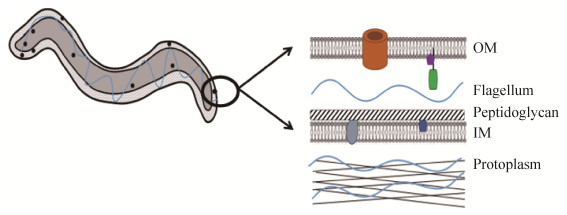 |
| 图 1 梅毒螺旋体结构模式图 Figure 1 Structural diagram of Treponema pallidum. |
| 图选项 |
梅毒螺旋体OMPs可能是重要的毒力因子,也是与免疫反应相互作用的分子,对这些蛋白的研究对于了解梅毒螺旋体可引起多阶段疾病并建立终生感染的机制至关重要,甚至可能对有效的梅毒疫苗的开发也具有重要意义。梅毒螺旋体外膜的脆弱性[13]、其相对较低的跨膜蛋白丰度[1]以及梅毒螺旋体OMPs与革兰氏阴性菌外膜中特征明确的蛋白质之间缺乏强烈的序列相关性[9]等特点,使得表征梅毒螺旋体表面分子的工作变得十分复杂。近年来,通过利用基因组序列、计算工具和生物信息学等多种方法,研究人员们鉴定出了许多梅毒螺旋体OMPs。在这里,我们将其分为β-桶OMPs和外表面脂蛋白两大类进行阐述。
2 梅毒螺旋体中的β-桶OMPs 目前,在已经鉴定的梅毒螺旋体OMPs中,多数OMPs会折叠形成β-桶形结构域。与革兰氏阴性菌中的β-桶OMPs类似,梅毒螺旋体中的β-桶OMPs似乎也具有转运底物的功能,并且可能会参与梅毒螺旋体免疫逃逸和免疫清除等生理过程。因此,深入了解梅毒螺旋体中的β-桶OMPs对研究梅毒螺旋体的致病机理至关重要,进而有利于梅毒疫苗的开发。
2.1 TprC/D/I和TprK 随着1998年T. pallidum基因组的发表,梅毒螺旋体重复蛋白(T. pallidum repeat proteins,Tprs)被鉴定出来,它是一种与齿垢密螺旋体(T. denticola,人类及黑猩猩口腔中的一种非致病螺旋体)的主要表面蛋白具有序列同源性的蛋白家族,由12个成员组成,依次命名为TprA-TprL[9]。其中,TprC/D/I (TP0117/TP0131/TP0620)被认为是假定的梅毒螺旋体OMPs,在天然状态下丰度很低(每个细胞约200个分子)[14]。研究表明,其具有位于周质空间的N端主要外鞘蛋白(major outer sheath Protein,MOSPN)和OM包埋的C端MOSP (MOSPC)三聚体桶[15-16],其间的中央可变区(central variable region,CVR)表示存在于所有Tprs直系同源物中的序列可变延伸(图 2-A)。重组体TprC/D/I的分析还表明,它们的β-桶结构域(图 2-B)在脂质体中形成了水通道[17],这与它们作为孔蛋白的潜在功能是一致的。与革兰氏阴性菌的孔蛋白一样,TprC/D/I形成带有对于三聚化必不可少的β-桶结构域的三聚体[17]。
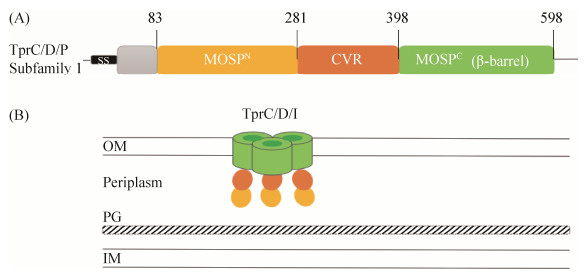 |
| 图 2 TprC/D/I的结构域和结构模型 Figure 2 Structural domains and configrations of TprC/D/I. A: TprC/D/I have the same structural domains; B: structural configurations of TprC/D/I. The cartoon was adapted from Kumar S et al.[22] |
| 图选项 |
另外,TprK (TP0897)是Tprs家族中研究较为清楚的一种蛋白,其免疫原性强,拥有Tprs家族中最强的细胞免疫反应靶点[18]。有研究预测TprK的N末端有3个保守的表面暴露环[14, 19]。此外,TprK还具有极强的抗原变异性[20],曾有人假设TprK的这种抗原变异将有助于梅毒螺旋体逃脱宿主免疫系统的清除,使梅毒病原体在宿主中持续存在,后期使用兔子模型获得的实验结果验证了该假设[21]。总而言之,Tprs家族在研究梅毒螺旋体的致病机制和相关疫苗研发等方面都具有重要意义。
2.2 TP0326 2000年,Cameron等使用差异筛选策略于梅毒螺旋体(T. pallidum)中,发现了Tp92 (后被命名为TP0326),并指出TP0326与革兰氏阴性菌OMP的序列具有相似性,但当时其功能尚不明确[23]。10年后,TP0326被报道是唯一一种与E. coli BamA同源的梅毒螺旋体的OMP[24],也是唯一由T. pallidum基因组编码的与已知的革兰氏阴性OMPs具有序列同源性的蛋白[25]。TP0326属于Omp85超家族,与超家族的其他成员一样,TP0326具有双结构域(图 3-A),由表面暴露的两亲性的C端β-桶状结构和包含多肽转运相关(polypeptide transport-associated,POTRA)的5个重复区域组成,并以非常低的拷贝数表达(每个细胞约100个分子)[25]。另外,TP0326可能会与BAM (β-barrel assembly machinery)复合物中的其他亚基结合并与周质中的分子伴侣相互作用[25]。因此,梅毒螺旋体似乎已经设计出一种策略:在具有超强免疫逃逸能力的基础上,利用BAM途径介导其自身极为罕见的OM生物发生。
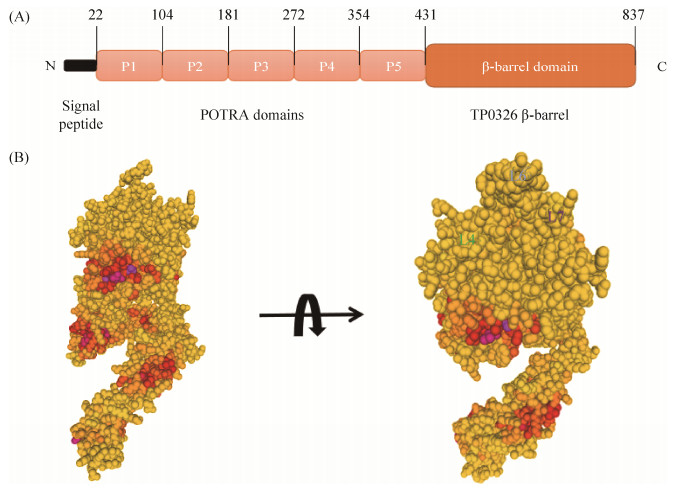 |
| 图 3 TP0326/BamA——梅毒螺旋体BAM复合体的核心成分 Figure 3 TP0326/BamA, the core component of the Treponema pallidum BAM complex. A: Structral domains of TP0326; B: Predictive structure of TP0326. The cartoon was adapted from Radolf JD et al.[34], Figure B was generated by using Swiss model software. |
| 图选项 |
基于淋病奈瑟氏球菌(Neisseria gonorrhoeae)[26]已解析结构的同源模型预测,TP0326包含与BamA相似的16链β-桶状结构(图 3-B)[27],β1和β16链之间形成不稳定的氢键,理论上二者可以分开以允许新生OMPs侧向插入外膜。另外,3个细胞外环(L4、L6和L7)组成闭塞的细胞外开口的圆顶[28],从而将通道内的OMP从侧面引导到梅毒螺旋体的OM脂质双层中。
近期,有研究发现TP0326可以通过MyD88 (myeloid differentiation factor 88)/NF-?B (nuclear factor kappaB)途径促进人微血管内皮细胞-1和巨噬细胞分泌促炎性细胞因子:肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)、白介素-1β (interleukin-1β,IL-1β)和白介素-6 (interleukin-6,IL-6)[29],并促进巨噬细胞分泌白介素-8 (Interleukin-8,IL-8),从而使中性粒细胞和淋巴细胞积累到感染部位,增加感染部位炎性细胞的浸润程度,并加重该部位的免疫病理损害[30]。而且,TP0326还可以通过识别人单核细胞表面的CD14 (LPS受体)/TLR2 (Toll-like receptor 2)介导细胞死亡,并且细胞死亡率会随TP0326处理浓度的增加和/或处理时间的延长而增加[31]。此外,最新的研究表明,TP0326还可能通过诱导趋化素的分泌参与内皮细胞的活化过程[32]。另外,我们的临床试验表明,在梅毒螺旋体感染早期,患者血清中白介素-2 (interleukin-2,IL-2)水平与正常对照组相比明显升高[33],增强了宿主对梅毒螺旋体的免疫反应,有利于梅毒螺旋体的清除。以上这些发现可能为研究梅毒螺旋体的致病机制提供重要的实验依据。
2.3 TP0548/TP0856/TP0858/TP0859/TP0865 通常情况下,细菌细胞膜对长链脂肪酸(long-chain fatty acids,LCFAs)的渗透性很高,但是在革兰氏阴性细菌中,由于其外膜严格的选择性渗透作用[3],LCFAs的OM转运需要利用专用的转运蛋白FadL (来自E. coli的长链脂肪酸转运蛋白),其含有一个侧向开口的14链β-桶状结构,可以将疏水性分子运输到OM脂质双层中[35]。如前所述,由于梅毒螺旋体与革兰氏阴性细菌在OM成分等方面的差异,梅毒螺旋体的OM对LCFAs的渗透性应该更高,因此,有人提出梅毒螺旋体似乎是通过扩散的方式获得LCFAs[36]。不久后,研究人员发现梅毒螺旋体中含有5个FadLs结构直系同源物(分别是TP0548、TP0856、TP0858、TP0859和TP0865)。根据结构模型预测,其在β-桶形内腔中均具有一个FadLs特征性的N末端结构域,这对于正确转运疏水性分子至关重要[35]。此外,一种或多种FadLs也可能与其他相关的转运蛋白相互作用,从而将疏水性分子转运至周质空间中[37-38]。
2.4 TP0969 在漫长的自然演化过程中,细菌已经进化出多种机制来保护自身免受细胞毒性分子(包括抗生素)的侵害[39]。其中,主动外排是细菌较为重要的耐药机制,它是指由各种外排蛋白共同介导的把抗生素等药物从细菌细胞内主动泵出的过程[40]。在众多的主动外排系统中,耐药结节分化超家族(drug-resistant nodule differentiation superfamily,RND)最为常见。所有的RND型主动外排系统均由属于RND家族的内膜转运蛋白、内膜相关质膜融合蛋白和外排通道蛋白这三部分组成[41]。其中,Murakami[42]最先报道的E. coli AcrAB系统(RND型主动外排系统中的一种)就是由内膜蛋白(AcrB)、连接蛋白(AcrA)和外膜通道蛋白(TolC)组成的。其中,TolC是1个三聚体,每个蛋白单体提供12链β-桶中的4个跨膜链[43]。研究表明,梅毒螺旋体中含有与E. coli TolC[44]直系同源的外膜通道蛋白TP0969[34]。此外,还确定了AcrA (TP0965)和AcrB (TP0790)的直系同源物,并预测它们会与TP0969形成完整的RND型主动外排系统[44]。
2.5 TP0126/TP0733 OmpW是一种常见于革兰氏阴性细菌中的小型单体OMP[45]。E.coli OmpW具有8链β-桶状结构,并带有长而窄的疏水通道。OmpWs被证明是功能多样的蛋白,可以保护细菌免受环境压力[46]、增强细菌毒力[47]和通过替代补体途径消除有毒有害物质[48]等。研究人员发现梅毒螺旋体基因组能够编码2个OmpWs直系同源物TP0126和TP0733[49]。并且发现重组TP0126具有β-折叠的二级结构[50],间接验证了上述发现。
2.6 TP0515 TP0515是LptD (lipopolysaccharide transport D)的直系同源物,LptD是革兰氏阴性细菌的OM成分,与Lpt复合物(LptA-LptG)[51]中的另外几种成分组合形成一个跨越周质区域的ATP依赖性的转运装置,负责将脂多糖从其内膜的合成位点传递到OM外部小叶中[52]。根据Gu等于2015年解析的LptD结构[53],推测TP0515由一个采用β-卷曲折叠的周质N端结构域和一个26链β-桶状结构域组成,其中β1和β26链之间以不完全氢键的方式结合,使得β-桶通道可以横向打开,从而有利于底物的进入和后续的释放。与革兰氏阴性菌中的Lpt途径类似,梅毒螺旋体似乎也进化出了一套相关的转运装置。由于梅毒螺旋体OM缺少脂多糖,因此,猜测该转运装置的底物可能还包括先前鉴定的OM糖脂[54]。
3 梅毒螺旋体中的外表面脂蛋白 除了β-桶OMPs以外,梅毒螺旋体中的一部分OMPs还会形成表面暴露的脂蛋白,并且其中大多数脂蛋白都能作为黏附素发挥相应的作用,进而影响梅毒感染期间其病原菌的传播和黏附等过程。另外,这类脂蛋白位于梅毒螺旋体表面的特点,将更有利于其作为抗生素靶点被识别,进而有助于进行相关药物的研发。
3.1 TP0751 TP0751是一种与梅毒螺旋体传播有关的黏附蛋白,已被证明能够与层粘连蛋白[55]等多种细胞外基质成分结合。Houston等先后证明TP0751能够与TP0750形成复合物,在降解血块和细胞外基质、促进梅毒螺旋体的传播和附着等方面起作用[56-57]。然而,由于其表达量太低,无法通过间接免疫荧光检测(IFA)或基于化学发光的免疫印迹分析等方法检测到[58]。近期,研究人员进行了探究TP0751免疫抑制兔梅毒螺旋体向远处器官扩散能力的试验。结果显示,与2个未免疫的对照组相比,所有3个用TP0751免疫的动物均表现出减缓的病变发展,抑制了梅毒螺旋体的传播,并增加了病变部位的细胞浸润[59]。该研究结果表明,TP0751有望作为疫苗候选物,针对TP0751的疫苗也许能够缓解由梅毒螺旋体感染引起的相关症状,可能为解决全球范围内日益增加的梅毒威胁提供解决方案。
3.2 TP0155和TP0483 微阵列数据表明梅毒螺旋体蛋白TP0155和TP0483的丰度都比较低[60]。纯化的TP0155和TP0483能够与纤连蛋白结合[61]。其中,TP0155优先结合纤连蛋白的基质形式,以此来介导梅毒螺旋体对宿主细胞的直接附着;而TP0483既可以结合纤连蛋白的基质形式,也可以结合纤连蛋白的可溶性形式,其中可溶性的纤连蛋白充当梅毒螺旋体TP0483受体和宿主细胞之间的桥联分子,以此来介导梅毒螺旋体对宿主细胞的间接附着[61]。而且,这种附着机制已经在金黄色葡萄球菌(Staphylococcus aureus)[62]等多种细菌病原体中观察到。该机制也许能够使梅毒病原体在宿主细胞的不同位置进行定殖,从而发挥不同的作用。
3.3 TP0136 TP0136是一种假定的梅毒螺旋体外表面脂蛋白,已被表征为纤连蛋白结合脂蛋白黏附素,其在纤连蛋白结合中的作用是由Brinkman等首次提出[63],之后被Ke等证实[64]。同时,他们还证明TP0136的N末端区域主要负责与血浆纤连蛋白结合,中央和C末端区域也存在结合位点[63-64]。另外,他们还发现TP0136在梅毒螺旋体菌株之间具有序列异质性[61-62],可能会使其在梅毒螺旋体菌株之间产生表面抗原的多样性,从而有助于梅毒螺旋体逃避宿主免疫系统的识别和清除。近期,有研究表明TP0136对不同组织衍生而来的细胞具有不同的粘附特异性,并猜测原因可能是这些细胞产生纤连蛋白的水平不同[65]。另外,最新的一项研究发现,抗TP0136抗体可促进病变中炎性细胞的浸润并加剧组织损伤,从而显著延迟伤口愈合的时间[66]。因此,了解梅毒感染过程中TP0136的重要作用可以促进我们对梅毒螺旋体发病机理的了解。
3.4 TP0453 研究发现,TP0453的晶体结构由α/β/α折叠组成,并包含5个稳定折叠的两亲性螺旋(amphipathic helix,AH)[67]。在高浓度的非离子型去污剂的存在下,TP0453通过两组AH的侧向移动使其构象由闭合状态转变为开放状态,并伴随着大疏水腔的暴露,这表明TP0453在结构上是动态的,但其在插入膜后会形成稳定的二聚体[67]。而且,TP0453结构中的α螺旋会插入到OM的周质小叶中,使其既能够促进小分子(例如营养素等)跨过OM转运,又能够防止自身被抗体接近和识别[68]。显然,这种机制似乎与梅毒螺旋体能够逃避免疫系统的识别并持续感染的策略一致。另外,TP0453的结构与结核分枝杆菌(Mycobacterium tuberculosis)两种脂蛋白LprG和LppX (二者能够将复杂脂质转运到M. tuberculosis外膜)的已解析结构具有相似性[69-70],表明TP0453可能在梅毒螺旋体的OM生物发生过程中充当脂质、糖脂和/或其衍生物的转运蛋白。
3.5 TP0435 TP0435 (也称为Tpp17)可以看作是一种细胞黏附素[71],多年来一直被认为是一种主要的梅毒螺旋体抗原,在梅毒的血清学诊断中具有很大的用途。2015年,Brautigam等人在TP0435的晶体结构中发现,该蛋白质以八链反平行β-桶为主体,并在其N末端具有α-螺旋结构[72]。与常见的跨膜β-桶结构不同,TP0435的β-桶十分稳定,并且其中心没有可供底物进出的通道,而是充满了氨基酸侧链,这表明该蛋白质似乎具有非常特殊的功能,可能代表了梅毒螺旋体中一种新型的OMPs。Chan等人通过免疫电子显微镜(IEM)和梅毒螺旋体的调理吞噬作用,证明了至少有少量天然TP0435位于梅毒螺旋体外表面[71]。
4 以外膜蛋白为靶点的药物研究进展 在E. coli中,OMPs首先在细胞质中合成带有一个N端信号肽序列的前体蛋白,该信号肽序列介导了OMPs前体蛋白通过Sec蛋白复合体穿过阴性菌内膜而进入周质的过程[73]。随后分子伴侣(SurA和Skp等)结合内膜信号肽酶切除信号肽后形成的成熟OMPs,并护送它们穿过周质至OM的内表面(图 4),并在BAM的作用下将OMPs插入OM并最终形成正确的桶状蛋白结构[74]。不同种属细菌中的BAM蛋白复合体含有不同的组分。
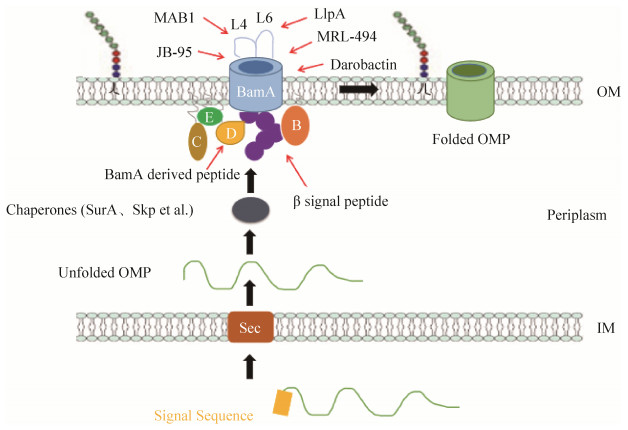 |
| 图 4 外膜蛋白(OMPs)的生成及BAM的已知抑制剂 Figure 4 Production of outer membrane proteins (OMPs) and known inhibitors of BAM. |
| 图选项 |
E. coli中的BAM复合物是由分别称为BamA、BamB、BamC、BamD和BamE的5个成分组成的蛋白质复合体。该复合体的核心和必不可少的亚基之一BamA,在所有具有外膜的细菌中以及在源自内共生细菌的真核生物细胞器(如线粒体和叶绿体)中功能保守[75],对OMPs的膜组装至关重要[76]。而在BAM复合物的另外4种脂蛋白中,只有BamD是必需的,它从周质伴侣分子中接收未折叠的OMPs,并与未折叠的OMPs的C端“β-信号”肽(位于未折叠OMPs的C末端区域的一个信号序列,对其组装至关重要)区结合[77]。其余3种非核心的脂蛋白(BamB、BamC和BamE)可能参与了β-桶状蛋白插膜后由复合体释放到外膜的过程(本组未发表结果)。
虽然目前我们对梅毒螺旋体的OM生物发生过程知之甚少,但是其OMPs的组装和正确折叠对其生存和生长等生理过程的重要性是毋庸置疑的。因此,针对OMPs组装和正确折叠的抑制剂将阻碍多种细胞功能的发挥。OMPs的生物发生提供了多种潜在的杀菌抑菌机制,从而为新型抗生素的研发提供了新靶标。下文将概述近期以外膜蛋白为靶点的几种抑菌抗菌策略,从而为基于梅毒螺旋体OMPs的新药开发提供一个思路。
4.1 BamA线性衍生肽 有研究报道了针对BAM复合物折叠OMPs过程的一种抑制剂[77],该抑制剂包含15-mer (monomerie unit)的肽,其序列由靠近BamA的C末端765-779序列衍生而来。该衍生肽能够与BamD结合并抑制BAM复合物折叠OMPs[77]。而且,当在E. coli过表达该衍生肽时,显示该肽与BamD在体内确实发生了相互作用,并引起其生长、OM渗透性和OMPs生成的缺陷[77]。由于无法穿越OM,预计该肽不会对全细胞显示抗菌活性。但是,这项研究为寻找拟肽类抗生素以干扰OMPs组装开辟了可能性。
4.2 拟肽抗生素JB-95 在另一项研究中,称为JB-95的环状β-发夹状肽显示出针对E. coli的低微摩尔MIC (~0.25 μg/mL),并具有与BAM复合物相互作用的能力[78]。用JB-95处理的细胞表现出几种OMPs的表达减少和OM应激反应基因的表达增加,表明它可能在抑制BAM功能中发挥一定的作用[78]。此外,在多肽筛选中鉴定出的JB-95也表现出抑制革兰氏阳性细菌的活性,表明其对BAM缺乏特异性。由于BAM活性对脂质双层流动性敏感[79],因此猜测JB-95可能是一种与膜的流动性相关的抗生素。对JB-95靶标和作用机理的阐明,还有待进一步研究。
4.3 单克隆抗体MAB1 近期的一项研究鉴定出了能够抑制BamA的单克隆抗体MAB1,它是通过利用E. coli和纯化的E. coli BamA免疫小鼠筛选出来的[79]。MAB1能够抑制BamA并且对E. coli具有杀菌作用。报告称,MAB1与BamA的胞外环4(图 4)结合,似乎抑制了BamA折叠OMPs的能力,其对必需OMPs (如新生BamA)折叠的抑制也可能导致细胞死亡[79]。脂多糖结构、NaCl浓度和生长温度等条件的改变都会改变MAB1对BamA的抑制能力[79]。因此,还需更多的工作验证MAB1的临床潜力。MAB1的发现提供了一个非常好的思路:由于MAB1无法穿越OM,MAB1不需要穿透OM就可以抑制BamA,证明BamA的功能可以被细胞外抑制剂抑制,从而极大地拓展了发现新抑制剂的空间。
4.4 天然抗菌肽LlpA 除了胞外环4,BamA的另一个表面暴露环,即环6 (图 4),对于OMP折叠也至关重要,其构象在暴露状态和掩埋状态之间循环[80]。因此,环6也可以作为细胞外抑制剂的优选靶标。有研究发现了靶向BamA胞外环6的天然抗菌肽[81],一种称为LlpA的凝集素样细菌素,大小约28 kDa。遗传分析表明,BamA介导了LlpA对敏感菌株的杀伤作用[80]。有人提出该杀伤机制可能是通过LlpA β-发夹环的延伸来干扰BamA的门控动力学,从而导致未折叠的OMPs在周质中积累并导致相关的下游反应[81],但是该假说的真实性还需要进一步验证。
4.5 β信号模拟物 未折叠OMPs通常在对应于C末端β-链的区域中包含一个信号序列(β-信号),该信号序列可能参与未折叠OMPs和BAM复合物的初始相互作用[82-84]。尽管该信号序列不是严格保守的,但β-信号通常包含疏水性残基和介于其间的非保守极性残基[82]。最近报道了一种环状肽,其功能类似于将未折叠的OMPs靶向线粒体中BamA同源蛋白的β-信号[84]。使用体外测定法,该β-信号肽被证明可以抑制β-桶状蛋白进入线粒体。另外,利用分离的线粒体进行光亲和交联分析,证实了该β-信号肽与折叠复合物的几种组分均发生了相互作用[85]。这项研究进一步表明了使用多肽或适当设计的折叠肽模拟物靶向β-桶状蛋白组装复合体的潜力。
4.6 小分子化合物MRL-494 最近,研究人员利用筛选策略鉴定出了一种小分子化合物MRL-494[86],该化合物通过靶向革兰氏阴性菌BAM复合物中的BamA来抑制OMPs的装配过程。MRL-494与BamA表面暴露区域的相互作用,可能是通过破坏BamA的必要构象变化来抑制BAM复合物装配OMPs的能力[86]。显然,还需要做更多的工作以研究此过程中BamA的具体构象变化和作用机制。另外,研究还发现在缺乏OM的微生物(如革兰氏阳性菌)中,MRL-494会严重损害其细胞质膜[86]。因此,猜测在革兰氏阳性菌这类缺乏OM的微生物中,细胞质膜是MRL-494的靶标。总之,MRL-494这类细胞外抑制剂的发现避免了革兰氏阴性菌的外膜通透性屏障和多药耐药性外排泵的作用。
4.7 小分子化合物Darobactin 最新的一项研究发现了一种新的化合物Darobactin[87],它是通过筛选发光杆菌(Photorhabdus)分离株获得的。Darobactin是一种由沉默的操纵子编码的小分子化合物,在体外和感染动物模型中均对革兰氏阴性菌具有活性,但对革兰氏阳性菌几乎没有活性[87]。使用体外蛋白重折叠测定法,发现Darobactin能够抑制BAM复合物的功能[87]。而且,在等温滴定量热(ITC)实验中,研究人员还观察到Darobactin能够直接与BAM复合物中的BamA特异性相互作用,进而稳定BamA的封闭侧向门构象,防止其打开并阻止BAM复合物将OMPs插入到OM脂质双层中[87]。研究Darobactin抑制BAM复合物功能的具体机制将有助于新型抗生素的开发。
5 展望 OMPs作为梅毒螺旋体的重要组成部分,在其早期感染的黏附和侵袭中起着至关重要的作用。尽管研究梅毒螺旋体的致病机制还存在很多障碍,但近年来,梅毒螺旋体OMPs的相继发现为阐明该菌隐性致病性的结构、生理和调节等方面开辟了新途径。生物信息学研究告诉我们,梅毒螺旋体的OMPs库似乎比以前所认识的更加复杂多样,OMPs成分也比以前认为的更像典型的革兰氏阴性菌。因此,参考革兰氏阴性菌OMPs和寻找针对其OMPs为靶点的相关药物将对鉴定梅毒螺旋体OMPs、研究其致病机理和研发有效的梅毒疫苗具有重要的指导意义。
鉴于梅毒螺旋体不能体外培养和无法进行遗传操作的困难[1],极大地限制了其致病机理研究,故建立一个高效的梅毒螺旋体外膜蛋白研究体系以进行其致病机理、耐药性及相关疫苗的研发,成为当务之急。我们前期已使用外膜衍生的膜囊泡及脂质体等构建了通用型外膜蛋白研究系统[88],该系统不仅是专门用于研究外膜蛋白的首个通用型离体研究方法,而且我们的前期结果表明,该系统具有较大的可拓展性。使用该系统,我们也首次提供了最为直接的生化证据,证明了百日咳杆菌(Bordetella pertussis)中单个桶状外膜蛋白FhaC是分泌病原蛋白FhaB的唯一通道[89-90]。因此,针对梅毒机理研究的高效研究方法匮乏的瓶颈性难题,我们力求构建梅毒螺旋体外膜蛋白功能研究体系,进行梅毒螺旋体外膜蛋白功能研究,并结合现代药物筛选手段,为开发以梅毒外膜蛋白为靶点的疫苗和新型药物奠定基础。
References
| [1] | Radolf JD, Norgard MV, Schulz WW. Outer membrane ultrastructure explains the limited antigenicity of virulent Treponema pallidum. Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(6): 2051-2055. DOI:10.1073/pnas.86.6.2051 |
| [2] | Stamm LV. Global challenge of antibiotic-resistant Treponema pallidum. Antimicrobial Agents and Chemotherapy, 2010, 54(2): 583-589. DOI:10.1128/AAC.01095-09 |
| [3] | Nikaido H. Molecular basis of bacterial outer membrane permeability revisited. Microbiology and Molecular Biology Reviews, 2003, 67(4): 593-656. DOI:10.1128/MMBR.67.4.593-656.2003 |
| [4] | Konovalova A, Kahne DE, Silhavy TJ. Outer membrane biogenesis. Annual Review of Microbiology, 2017, 71: 539-556. DOI:10.1146/annurev-micro-090816-093754 |
| [5] | Narita SI, Tokuda H. Bacterial lipoproteins; biogenesis, sorting and quality control. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2017, 1862(11): 1414-1423. |
| [6] | Ranava D, Caumont-Sarcos A, Albenne C, Ieva R. Bacterial machineries for the assembly of membrane -embedded β-barrel proteins. FEMS Microbiology Letters, 2018, 365(10): fny087. |
| [7] | Naveed H, Liang J. Weakly stable regions and protein-protein interactions in beta-barrel membrane proteins. Current Pharmaceutical Design, 2014, 20(8): 1268-1273. DOI:10.2174/13816128113199990071 |
| [8] | Salazar JC, Hazlett KRO, Radolf JD. The immune response to infection with Treponema pallidum, the stealth pathogen. Microbes and Infection, 2002, 4(11): 1133-1140. DOI:10.1016/S1286-4579(02)01638-6 |
| [9] | Fraser CM, Norris SJ, Weinstock GM, White O, Sutton GG, Dodson R, Gwinn M, Hickey EK, Clayton R, Ketchum KA, Sodergren E, Hardham JM, McLeod MP, Salzberg S, Peterson J, Khalak H, Richardson D, Howell JK, Chidambaram M, Utterback T, McDonald L, Artiach P, Bowman C, Cotton MD, Fujii C, Garland S, Hatch B, Horst K, Roberts K, Sandusky M, Weidman J, Smith HO, Venter JC. Complete genome sequence of Treponema pallidum, the syphilis spirochete. Science, 1998, 281(5375): 375-388. DOI:10.1126/science.281.5375.375 |
| [10] | Walker EM, Zampighi GA, Blanco DR, Miller JN, Lovett MA. Demonstration of rare protein in the outer membrane of Treponema pallidum subsp. pallidum by freeze-fracture analysis. Journal of Bacteriology, 1989, 171(9): 5005-5011. DOI:10.1128/JB.171.9.5005-5011.1989 |
| [11] | Cox DL, Chang P, McDowall AW, Radolf JD. The outer membrane, not a coat of host proteins, limits antigenicity of virulent Treponema pallidum. Infection and Immunity, 1992, 60(3): 1076-1083. DOI:10.1128/IAI.60.3.1076-1083.1992 |
| [12] | Magnuson HJ, Eagle H, Fleischman R. The minimal infectious inoculum of Spirochaeta pallida (Nichols strain) and a consideration of its rate of multiplication in vivo. American Journal of Syphilis, Gonorrhea, and Venereal Diseases, 1948, 32(1): 1-18. |
| [13] | LaFond RE, Lukehart SA. Biological basis for syphilis. Clinical Microbiology Reviews, 2006, 19(1): 29-49. DOI:10.1128/CMR.19.1.29-49.2006 |
| [14] | Centurion-Lara A, Giacani L, Godornes C, MoliniBJ, Reid TB, Lukehart SA. Fine analysis of genetic diversity of the tpr gene family among treponemal species, subspecies and strains. PLoS Neglected Tropical Diseases, 2013, 7(5): e2222. DOI:10.1371/journal.pntd.0002222 |
| [15] | Anand A, Luthra A, Edmond ME, Ledoyt M, Caimano MJ, Radolf JD. The major outer sheath protein (Msp) of Treponema denticola has a bipartite domain architecture and exists as periplasmic and outer membranespanning conformers. Journal of Bacteriology, 2013, 195(9): 2060-2071. DOI:10.1128/JB.00078-13 |
| [16] | Puthenveetil R, Kumar S, Caimano MJ, Dey A, Anand A, Vinogradova O, Radolf JD. The major outer sheath protein forms distinct conformers and multimeric complexes in the outer membrane and periplasm of Treponema denticola. Scientific Reports, 2017, 7(1): 13260. DOI:10.1038/s41598-017-13550-6 |
| [17] | Anand A, LeDoyt M, Karanian C, Luthra A, Koszelak-Rosenblum M, Malkowski MG, Puthenveetil R, Vinogradova O, Radolf JD. Bipartite topology of Treponema pallidum repeat proteins C/D and I: outer membrane insertion, trimerization, and porin function require a C-terminal β-barrel domain. Journal of Biological Chemistry, 2015, 290(19): 12313-12331. DOI:10.1074/jbc.M114.629188 |
| [18] | Zhang YJ, Wu YM. Research status of Treponema pallidum TprK membrane protein. Progress in Microbiology and Immunology, 2009, 7(2): 68-70. (in Chinese) 张跃军, 吴移谋. 梅毒螺旋体TprK膜蛋白的研究现状. 微生物学免疫学进展, 2009, 7(2): 68-70. |
| [19] | LaFond RE, Centurion-Lara A, Godornes C, Rompalo AM, Van Voorhis WC, Lukehart SA. Sequence diversity of Treponema pallidum subsp. pallidum tprK in human syphilis lesions and rabbit-propagated isolates. Journal of Bacteriology, 2003, 185(21): 6262-6268. DOI:10.1128/JB.185.21.6262-6268.2003 |
| [20] | LaFond RE, Molini BJ, Van Voorhis WC, Lukehart SA. Antigenic variation of TprK V regions abrogates specific antibody binding in syphilis. Infection and Immunity, 2006, 74(11): 6244-6251. DOI:10.1128/IAI.00827-06 |
| [21] | Edmondson DG, Hu B, Norris SJ. Long-term in vitro culture of the syphilis spirochete Treponema pallidum subsp. pallidum. mBio, 2018, 9(3): e01153-18. |
| [22] | Kumar S, Caimano MJ, Anand A, Dey A, Hawley KL, LeDoyt ME, La Vake CJ, Cruz AR, Ramirez LG, Pa?těková L, Bezsonova I, ?majs D, Salazar JC, Radolf JD. Sequence variation of rare outer membrane protein β-barrel domains in clinical strains provides insights into the evolution of Treponema pallidum subsp. pallidum, the syphilis spirochete. mBio, 2018, 9(3): e01006-18. |
| [23] | Cameron CE, Lukehart SA, Castro C, Molini B, Godornes C, Van Voorhis WC. Opsonic potential, protective capacity, and sequence conservation of the Treponema pallidum subspecies pallidum Tp92. Journal of Infectious Diseases, 2000, 181(4): 1401-1413. DOI:10.1086/315399 |
| [24] | Cox DL, Luthra A, Dunham-Ems S, Desrosiers DC, Salazar JC, Caimano MJ, Radolf JD. Surface immunolabeling and consensus computational framework to identify candidate rare outer membrane proteins of Treponema pallidum. Infection and Immunity, 2010, 78(12): 5178-5194. DOI:10.1128/IAI.00834-10 |
| [25] | Desrosiers DC, Anand A, Luthra A, Dunham-Ems SM, LeDoyt M, Cummings MAD, Eshghi A, Cameron CE, Cruz AR, Salazar JC, Caimano MJ, Radolf JD. TP0326, a Treponema pallidum β-barrel assembly machinery a (BamA) orthologue and rare outer membrane protein. Molecular Microbiology, 2011, 80(6): 1496-1515. DOI:10.1111/j.1365-2958.2011.07662.x |
| [26] | Noinaj N, Kuszak AJ, Gumbart JC, Lukacik P, Chang H, Easley NC, Lithgow T, Buchanan SK. Structural insight into the biogenesis of β-barrel membrane proteins. Nature, 2013, 501(7467): 385-390. DOI:10.1038/nature12521 |
| [27] | Luthra A, Anand A, Radolf JD. Treponema pallidum in gel microdroplets: a method for topological analysis of BamA (TP0326) and localization of rare outer membrane proteins//Buchanan S, Noinaj N. The BAM Complex. New York, NY: Humana Press, 2015: 67-75. |
| [28] | Luthra A, Anand A, Hawley KL, LeDoyt M, La Vake CJ, Caimano MJ, Cruz AR, Salazar JC, Radolf JD. A homology model reveals novel structural features and an immunodominant surface loop/opsonic target in the Treponema pallidum BamA ortholog TP_0326. Journal of Bacteriology, 2015, 197(11): 1906-1920. DOI:10.1128/JB.00086-15 |
| [29] | Luo X, Zhang XH, Zhao T, Zeng TB, Liu W, Deng MX, Zhao FJ. A preliminary study on the proinflammatory mechanisms of Treponema pallidum outer membrane protein Tp92 in human macrophages and HMEC-1 cells. Microbial Pathogenesis, 2017, 110: 176-183. DOI:10.1016/j.micpath.2017.06.046 |
| [30] | El-Shafaey ES, Ateya A, Ramadan H, Saleh R, Elseady Y, Abo El Fadl E, El-Khodery S. Single nucleotide polymorphisms in IL8 and TLR4 genes as candidates for digital dermatitis resistance/susceptibility in holstein cattle. Animal Biotechnology, 2017, 28(2): 131-137. DOI:10.1080/10495398.2016.1242489 |
| [31] | Luo X, Zhang XH, Gan L, Zhou CL, Zhao T, Zeng TB, Liu SQ, Xiao YJ, Yu J, Zhao FJ. The outer membrane protein Tp92 of Treponema pallidum induces human mononuclear cell death and IL-8 secretion. Journal of Cellular and Molecular Medicine, 2018, 22(12): 6039-6054. DOI:10.1111/jcmm.13879 |
| [32] | Zhang RL, Wang QQ. The Treponema pallidum outer membrane protein Tp92 activates endothelial cells via the chemerin/CMKLR1 pathway. International Journal of Medical Microbiology, 2020, 310(3): 151416. DOI:10.1016/j.ijmm.2020.151416 |
| [33] | Li J, Wang LN, Zheng HY. Levels of interleukin-2 in peripheral blood of patients with secondary syphilis. Medical Journal of Peking Union Medical College Hospital, 2012, 3(4): 395-397. (in Chinese) 李军, 王林娜, 郑和义. 二期梅毒患者外周血白细胞介素-2水平. 协和医学杂志, 2012, 3(4): 395-397. |
| [34] | Radolf JD, Kumar S. The Treponema pallidum outer membrane//Adler B. Spirochete Biology: The Post Genomic Era. Cham: Springer, 2017: 1-38. |
| [35] | Van den Berg B, Black PN, Clemons WJ Jr, Rapoport TA. Crystal structure of the long-chain fatty acid transporter FadL. Science, 2004, 304(5676): 1506-1509. DOI:10.1126/science.1097524 |
| [36] | Cox DL, Radolf JD. Insertion of fluorescent fatty acid probes into the outer membranes of the pathogenic spirochaetes Treponema pallidum and Borrelia burgdorferi. Microbiology, 2001, 147(5): 1161-1169. DOI:10.1099/00221287-147-5-1161 |
| [37] | Brautigam CA, Deka RK, Schuck P, Tomchick DR, Norgard MV. Structural and thermodynamic characterization of the interaction between two periplasmic Treponema pallidum lipoproteins that are components of a TPR-protein-associated TRAP transporter (TPAT). Journal of Molecular Biology, 2012, 420(1/2): 70-86. |
| [38] | Deka RK, Brautigam CA, Goldberg M, Schuck P, Tomchick DR, Norgard MV. Structural, bioinformatic, and in vivo analyses of two Treponema pallidum lipoproteins reveal a unique TRAP transporter. Journal of Molecular Biology, 2012, 416(5): 678-696. DOI:10.1016/j.jmb.2012.01.015 |
| [39] | Sassone-Corsi M, Raffatellu M. No vacancy: how beneficial microbes cooperate with immunity to provide colonization resistance to pathogens. The Journal of Immunology, 2015, 194(9): 4081-4087. DOI:10.4049/jimmunol.1403169 |
| [40] | Rao Y, Zeng ZL. Active efflux mechanism of antibiotic resistance. World Notes on Antibiotics, 2002, 23(3): 109-114. (in Chinese) 饶勇, 曾振灵. 抗生素耐药性的主动外排机制. 国外医药抗生素分册, 2002, 23(3): 109-114. |
| [41] | Zhang Y, Song YH, Liu MT, Li Y. Research progress on resistance-nodulation-division efflux systems in Pseudomonas aeruginosa. World Notes on Antibiotics, 2010, 31(1): 29-33. (in Chinese) 张芸, 宋英华, 刘明涛, 李玉. 铜绿假单胞菌RND型外排系统研究进展. 国外医药抗生素分册, 2010, 31(1): 29-33. |
| [42] | Murakami S, Nakashima R, Yamashita E, Yamaguchi A. Crystal structure of bacterial multidrug efflux transporter AcrB. Nature, 2002, 419(6907): 587-593. DOI:10.1038/nature01050 |
| [43] | Phan G, Picard M, Broutin I. Focus on the outer membrane factor OprM, the forgotten player from efflux pumps assemblies. Antibiotics, 2015, 4(4): 544-566. DOI:10.3390/antibiotics4040544 |
| [44] | Koronakis V, Sharff A, Koronakis E, Luisi B, Hughes C. Crystal structure of the bacterial membrane protein TolC central to multidrug efflux and protein export. Nature, 2000, 405(6789): 914-919. DOI:10.1038/35016007 |
| [45] | Nandi B, Nandy RK, Sarkar A, Ghose AC. Structural features, properties and regulation of the outermembrane protein W (OmpW) of Vibrio cholerae. Microbiology, 2005, 151(9): 2975-2986. DOI:10.1099/mic.0.27995-0 |
| [46] | Asakura H, Kawamoto K, Haishima Y, Igimi S, Yamamoto S, Makino SI. Differential expression of the outer membrane protein W (OmpW) stress response in enterohemorrhagic Escherichia coli O157:H7 corresponds to the viable but non-culturable state. Research in Microbiology, 2008, 159(9/10): 709-717. |
| [47] | Wu XB, Tian LH, Zou HJ, Wang CY, Yu ZQ, Tang CH, Zhao FK, Pan JY. Outer membrane protein OmpW of Escherichia coli is required for resistance to phagocytosis. Research in Microbiology, 2013, 164(8): 848-855. DOI:10.1016/j.resmic.2013.06.008 |
| [48] | Li WY, Wen LY, Li CC, Chen R, Ye ZC, Zhao J, Pan JY. Contribution of the outer membrane protein OmpW in Escherichia coli to complement resistance from binding to factor H. Microbial Pathogenesis, 2016, 98: 57-62. DOI:10.1016/j.micpath.2016.06.024 |
| [49] | Haynes AM, Godornes C, Ke WJ, Giacani L. Evaluation of the protective ability of the Treponema pallidum subsp. pallidum Tp0126 OmpW homolog in the rabbit model of syphilis. Infection and Immunity, 2019, 87(8): e00323-19. |
| [50] | Giacani L, Brandt SL, Ke WJ, Reid TB, Molini BJ, Iverson-Cabral S, Ciccarese G, Drago F, Lukehart SA, Centurion-Lara A. Transcription of TP0126, Treponema pallidum putative OmpW homolog, is regulated by the length of a homopolymeric guanosine repeat. Infection and Immunity, 2015, 83(6): 2275-2289. DOI:10.1128/IAI.00360-15 |
| [51] | Sperandeo P, Martorana AM, Polissi A. The lipopolysaccharide transport (Lpt) machinery: a nonconventional transporter for lipopolysaccharide assembly at the outer membrane of Gram-negative bacteria. Journal of Biological Chemistry, 2017, 292(44): 17981-17990. DOI:10.1074/jbc.R117.802512 |
| [52] | Okuda S, Sherman DJ, Silhavy TJ, Ruiz N, Kahne D. Lipopolysaccharide transport and assembly at the outer membrane: the PEZ model. Nature Reviews Microbiology, 2016, 14(6): 337-345. DOI:10.1038/nrmicro.2016.25 |
| [53] | Gu YH, Stansfeld PJ, Zeng Y, Dong HH, Wang WJ, Dong CJ. Lipopolysaccharide is inserted into the outer membrane through an intramembrane hole, a lumen gate, and the lateral opening of LptD. Structure, 2015, 23(3): 496-504. DOI:10.1016/j.str.2015.01.001 |
| [54] | Radolf JD, Robinson EJ, Bourell KW, Akins DR, Porcella SF, Weigel LM, Jones JD, Norgard MV. Characterization of outer membranes isolated from Treponema pallidum, the syphilis spirochete. Infection and Immunity, 1995, 63(11): 4244-4252. DOI:10.1128/IAI.63.11.4244-4252.1995 |
| [55] | Cameron CE. Identification of a Treponema pallidum laminin-binding protein. Infection and Immunity, 2003, 71(5): 2525-2533. DOI:10.1128/IAI.71.5.2525-2533.2003 |
| [56] | Houston S, Taylor JS, Denchev Y, Hof R, Zuerner RL, Cameron CE. Conservation of the host-interacting proteins Tp0750 and pallilysin among Treponemes and restriction of proteolytic capacity to Treponema pallidum. Infection and Immunity, 2015, 83(11): 4204-4216. DOI:10.1128/IAI.00643-15 |
| [57] | Houston S, Russell S, Hof R, Roberts AK, Cullen P, Irvine K, Smith DS, Borchers CH, Tonkin ML, Boulanger MJ, Cameron CE. The multifunctional role of the pallilysin-associated Treponema pallidum protein, Tp 0750, in promoting fibrinolysis and extracellular matrix component degradation. Molecular Microbiology, 2014, 91(3): 618-634. DOI:10.1111/mmi.12482 |
| [58] | Parker ML, Houston S, Pětro?ová H, Lithgow KV, Hof R, Wetherell C, Kao WC, Lin YP, Moriarty TJ, Ebady R, Cameron CE, Boulanger MJ. The structure of Treponema pallidum Tp0751(pallilysin) reveals a non-canonical lipocalin fold that mediates adhesion to extracellular matrix components and interactions with host cells. PLoS Pathogens, 2016, 12(9): e1005919. DOI:10.1371/journal.ppat.1005919 |
| [59] | Lithgow KV, Hof R, Wetherell C, Phillips D, Houston S, Cameron CE. A defined syphilis vaccine candidate inhibits dissemination of Treponema pallidum subspecies pallidum. Nature Communications, 2017, 8(1): 14273. DOI:10.1038/ncomms14273 |
| [60] | ?majs D, McKevitt M, Howell JK, Norris SJ, Cai WW, Palzkill T, Weinstock GM. Transcriptome of Treponema pallidum: gene expression profile during experimental rabbit infection. Journal of Bacteriology, 2005, 187(5): 1866-1874. DOI:10.1128/JB.187.5.1866-1874.2005 |
| [61] | Cameron CE, Brown EL, Kuroiwa JMY, Schnapp LM, Brouwer NL. Treponema pallidum fibronectin-binding proteins. Journal of Bacteriology, 2004, 186(20): 7019-7022. DOI:10.1128/JB.186.20.7019-7022.2004 |
| [62] | Peacock SJ, Foster TJ, Cameron BJ, Berendt AR. Bacterial fibronectin-binding proteins and endothelial cell surface fibronectin mediate adherence of Staphylococcus aureus to resting human endothelial cells. Microbiology, 1999, 145(12): 3477-3486. DOI:10.1099/00221287-145-12-3477 |
| [63] | Brinkman MB, McGill MA, Pettersson J, Rogers A, Matějková P, ?majs D, Weinstock GM, Norris SJ, Palzkill T. A novel Treponema pallidum antigen, TP0136, is an outer membrane protein that binds human fibronectin. Infection and Immunity, 2008, 76(5): 1848-1857. DOI:10.1128/IAI.01424-07 |
| [64] | Ke WJ, Molini BJ, Lukehart SA, Giacani L. Treponema pallidum subsp. pallidum TP0136 protein is heterogeneous among isolates and binds cellular and plasma fibronectin via its NH2-terminal end. PLoS Neglected Tropical Diseases, 2015, 9(3): e0003662. DOI:10.1371/journal.pntd.0003662 |
| [65] | Djokic V, Giacani L, Parveen N. Analysis of host cell binding specificity mediated by the Tp0136 adhesin of the syphilis agent Treponema pallidum subsp. pallidum. PLoS Neglected Tropical Diseases, 2019, 13(5): e0007401. DOI:10.1371/journal.pntd.0007401 |
| [66] | Li QL, Tong ML, Liu LL, Lin LR, Lin Y, Yang TC. Effect of anti-TP0136 antibodies on the progression of lesions in an infected rabbit model. International Immunopharmacology, 2020, 83: 106428. DOI:10.1016/j.intimp.2020.106428 |
| [67] | Luthra A, Zhu GY, Desrosiers DC, Eggers CH, Mulay V, Anand A, McArthur FA, Romano FB, Caimano MJ, Heuck AP, Malkowski MG, Radolf JD. The transition from closed to open conformation of Treponema pallidum outer membrane-associated lipoprotein TP0453 involves membrane sensing and integration by two amphipathic helices. Journal of Biological Chemistry, 2011, 286(48): 41656-41668. DOI:10.1074/jbc.M111.305284 |
| [68] | Hazlett KRO, Cox DL, Decaffmeyer M, Bennett MP, Desrosiers DC, La Vake CJ, La Vake ME, Bourell KW, Robinson EJ, Brasseur R, Radolf JD. TP0453, a concealed outer membrane protein of Treponema pallidum, enhances membrane permeability. Journal of Bacteriology, 2005, 187(18): 6499-6508. DOI:10.1128/JB.187.18.6499-6508.2005 |
| [69] | Drage MG, Tsai HC, Pecora ND, Cheng TY, Arida AR, Shukla S, Rojas RE, Seshadri C, Moody DB, Boom WH, Sacchettini JC, Harding CV. Mycobacterium tuberculosis lipoprotein LprG (Rv1411c) binds triacylated glycolipid agonists of Toll-like receptor 2. Nature Structural & Molecular Biology, 2010, 17(9): 1088-1095. |
| [70] | Sulzenbacher G, Canaan S, Bordat Y, Neyrolles O, Stadthagen G, Roig-Zamboni V, Rauzier J, Maurin D, Laval F, Daffé M, Cambillau C, Gicquel B, Bourne Y, Jackson M. LppX is a lipoprotein required for the translocation of phthiocerol dimycocerosates to the surface of Mycobacterium tuberculosis. The EMBO Journal, 2006, 25(7): 1436-1444. DOI:10.1038/sj.emboj.7601048 |
| [71] | Chan K, Nasereddin T, Alter L, Centurion-Lara A, Giacani L, Parveen N. Treponema pallidum lipoprotein TP0435 expressed in Borrelia burgdorferi produces multiple surface/periplasmic isoforms and mediates adherence. Scientific Reports, 2016, 6(1): 25593. DOI:10.1038/srep25593 |
| [72] | Brautigam CA, Deka RK, Liu WZ, Norgard MV. Insights into the potential function and membrane organization of the TP 0435(T p17) lipoprotein from Treponema pallidum derived from structural and biophysical analyses. Protein Science, 2015, 24(1): 11-19. DOI:10.1002/pro.2576 |
| [73] | Pugsley AP. The complete general secretory pathway in gram-negative bacteria. Microbiology Reviews, 1993, 57(1): 50-108. DOI:10.1128/MR.57.1.50-108.1993 |
| [74] | Hagan CL, Silhavy TJ, Kahne D. β-barrel membrane protein assembly by the Bam complex. Annual Review of Biochemistry, 2011, 80: 189-210. DOI:10.1146/annurev-biochem-061408-144611 |
| [75] | Webb CT, Heinz E, Lithgow T. Evolution of the β-barrel assembly machinery. Trends in Microbiology, 2012, 20(12): 612-620. DOI:10.1016/j.tim.2012.08.006 |
| [76] | Genevrois S, Steeghs L, Roholl P, Letesson JJ, van der Ley P. The Omp85 protein of Neisseria meningitidis is required for lipid export to the outer membrane. The EMBO Journal, 2003, 22(8): 1780-1789. DOI:10.1093/emboj/cdg174 |
| [77] | Hagan CL, Wzorek JS, Kahne D. Inhibition of the β-barrel assembly machine by a peptide that binds BamD. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(7): 2011-2016. DOI:10.1073/pnas.1415955112 |
| [78] | Urfer M, Bogdanovic J, Lo Monte F, Moehle K, Zerbe K, Omasits U, Ahrens CH, Pessi G, Eberl L, Robinson JA. A peptidomimetic antibiotic targets outer membrane proteins and disrupts selectively the outer membrane in Escherichia coli. Journal of Biological Chemistry, 2016, 291(4): 1921-1932. DOI:10.1074/jbc.M115.691725 |
| [79] | Storek KM, Auerbach MR, Shi HD, Garcia NK, Sun DW, Nickerson NN, Vij R, Lin ZH, Chiang N, Schneider K, Wecksler AT, Skippington E, Nakamura G, Seshasayee D, Koerber JT, Payandeh J, Smith PA, Rutherford ST. Monoclonal antibody targeting the β-barrel assembly machine of Escherichia coli is bactericidal. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(14): 3692-3697. DOI:10.1073/pnas.1800043115 |
| [80] | Leonard-Rivera M, Misra R. Conserved residues of the putative L6 loop of Escherichia coli BamA play a critical role in the assembly of β-barrel outer membrane proteins, including that of BamA itself. Journal of Bacteriology, 2012, 194(17): 4662-4668. DOI:10.1128/JB.00825-12 |
| [81] | Ghequire MGK, De Canck E, Wattiau P, Van Winge I, Loris R, Coenye T, De Mot R. Antibacterial activity of a lectin-like Burkholderia cenocepacia protein. MicrobiologyOpen, 2013, 2(4): 566-575. DOI:10.1002/mbo3.95 |
| [82] | Robert V, Volokhina EB, Senf F, Bos MP, Van Gelder P, Tommassen J. Assembly factor Omp85 recognizes its outer membrane protein substrates by a species-specific C-terminal motif. PLoS Biology, 2006, 4(11): e377. DOI:10.1371/journal.pbio.0040377 |
| [83] | Noinaj N, Gumbart JC, Buchanan SK. The β-barrel assembly machinery in motion. Nature Reviews Microbiology, 2017, 15(4): 197-204. DOI:10.1038/nrmicro.2016.191 |
| [84] | Jores T, Klinger A, Gro? LE, Kawano S, Flinner N, Duchardt-Ferner E, W?hnert J, Kalbacher H, Endo T, Schleiff E, Rapaport D. Characterization of the targeting signal in mitochondrial β-barrel proteins. Nature Communications, 2016, 7(1): 12036. DOI:10.1038/ncomms12036 |
| [85] | Robinson JA. Folded synthetic peptides and other molecules targeting outer membrane protein complexes in Gram-negative bacteria. Frontiers in Chemistry, 2019, 7: 45. DOI:10.3389/fchem.2019.00045 |
| [86] | Hart EM, Mitchell AM, Konovalova A, Grabowicz M, Sheng J, Han XQ, Rodriguez-Rivera FP, Schwaid AG, Malinverni JC, Balibar CJ, Bodea S, Si Q, Wang H, Homsher MF, Painter RE, Ogawa AK, Sutterlin H, Roemer T, Black TA, Rothman DM, Walker SS, Silhavy TJ. A small-molecule inhibitor of BamA impervious to efflux and the outer membrane permeability barrier. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(43): 21748-21757. DOI:10.1073/pnas.1912345116 |
| [87] | Imai Y, Meyer KJ, Iinishi A, Favre-Godal Q, Green R, Manuse S, Caboni M, Mori M, Niles S, Ghiglieri M, Honrao C, Ma XY, Guo JJ, Makriyannis A, Linares-Otoya L, B?hringer N, Wuisan ZG, Kaur H, Wu RR, Mateus A, Typas A, Savitski MM, Espinoza JL, O'Rourke A, Nelson KE, Hiller S, Noinaj N, Sch?berle TF, D'Onofrio A, Lewis K. A new antibiotic selectively kills Gram-negative pathogens. Nature, 2019, 576(7787): 459-464. DOI:10.1038/s41586-019-1791-1 |
| [88] | Norell D, Heuck A, Tran-Thi TA, G?tzke H, Jacob-Dubuisson F, Clausen T, Daley DO, Braun V, Müller M, Fan EG. Versatile in vitro system to study translocation and functional integration of bacterial outer membrane proteins. Nature Communications, 2014, 5(1): 5396. DOI:10.1038/ncomms6396 |
| [89] | Fan EG, Norell D, Müller M. An in vitro assay for substrate translocation by FhaC in liposomes//Buchanan S, Noinaj N. The BAM Complex. New York, NY: Humana Press, 2015: 111-125. |
| [90] | Fan EG, Fiedler S, Jacob-Dubuisson F, Müller M. Two-partner secretion of Gram-negative bacteria: a single β-barrel protein enables transport across the outer membrane. Journal of Biological Chemistry, 2012, 287(4): 2591-2599. DOI:10.1074/jbc.M111.293068 |
