郑有坤1

 , 唐明秀2, 刘淑云3, 吴剑波1
, 唐明秀2, 刘淑云3, 吴剑波1

1. 西南医科大学药物与功能性食品研究中心, 四川 泸州 646000;
2. 西南医科大学附属中医医院, 四川 泸州 646000;
3. 西南医科大学附属医院, 四川 泸州 646000
收稿日期:2020-03-26;修回日期:2020-05-12;网络出版日期:2020-08-18
基金项目:西南医科大学科研基金(2019ZZD018);国家自然科学基金(21974019)
*通信作者:郑有坤, Tel/Fax:+86-830-3161673, E-mail:zyktmx@swmu.edu.cn;
吴剑波, Tel/Fax:+86-830-3161702, E-mail:jbwucn1996@yahoo.com.
摘要:[目的] 研究大肠杆菌tRNA合成底物类似物4,6-二氨基-2-巯基嘧啶功能化的金纳米粒子(gold nanoparticles,AuNPs)对革兰氏阴性多药耐药细菌的抗菌特性。[方法] 以4,6-二氨基-2-巯基嘧啶为表面配体合成AuNPs,采用肉汤稀释法测定其对4种临床分离的革兰氏阴性多药耐药细菌的最低抑菌浓度(MIC)。通过不同浓度AuNPs处理后经平板计数绘制不同菌株的时间-杀菌动力学曲线。以铜绿假单胞菌为代表菌株,采用激光共聚焦显微镜、透射电子显微镜和凝胶电泳分析AuNPs对细菌细胞组分的损伤。通过亚致死浓度反复诱导评估细菌对AuNPs的耐药性演化。并以MTT实验初步评估了AuNPs对哺乳动物细胞的生物相容性。[结果] 4,6-二氨基-2-巯基嘧啶介导的AuNPs平均粒径为6.8 nm,zeta电位为+38.4 mV。该AuNPs对4种临床分离的革兰氏阴性多药耐药细菌均表现出时间和浓度依赖的抗菌活性,MIC值介于4-8 μg/mL之间。抗菌机制研究显示AuNPs主要通过诱导细菌细胞膜损伤和DNA断裂导致细菌死亡。耐药性演化评估发现细菌在为期30 d的反复诱导下也基本不会对该AuNPs产生耐药性。细胞毒性结果显示AuNPs对哺乳动物细胞具有良好的生物相容性,在浓度达到256 μg/mL时正常肝细胞L02和正常肺细胞AT II的存活率仍高达85%以上。[结论] 小分子介导的AuNPs对临床分离的革兰氏阴性多药耐药细菌具有较好的抗菌活性,在应对当前严峻的多药耐药细菌感染方面具有潜在的应用价值。
关键词:金纳米粒子抗菌活性多药耐药细菌耐药性
Antibacterial properties of small molecule-functionalized gold nanoparticles against Gram-negative multidrug-resistant bacteria
Youkun Zheng1

 , Mingxiu Tang2, Shuyun Liu3, Jianbo Wu1
, Mingxiu Tang2, Shuyun Liu3, Jianbo Wu1

1. Drug Discovery Research Center, Southwest Medical University, Luzhou 646000, Sichuan Province, China;
2. The Affiliated Traditional Chinese Medicine Hospital of Southwest Medical University, Luzhou 646000, Sichuan Province, China;
3. The Affiliated Hospital of Southwest Medical University, Luzhou 646000, Sichuan Province, China
Received: 26 March 2020; Revised: 12 May 2020; Published online: 18 August 2020
*Corresponding author: Youkun Zheng, Tel/Fax: +86-830-3161673, E-mail:zyktmx@swmu.edu.cn;
Jianbo Wu, Tel/Fax: +86-830-3161702, E-mail: jbwucn1996@yahoo.com.
Foundation item: Supported by the Scientific Research Foundation of Southwest Medical University (2019ZZD018) and by the National Natural Science Foundation of China (21974019)
Abstract: [Objective] In this study, we investigated the antibacterial properties of 4, 6-diamino-2mercaptopyrimidine-functionalized gold nanoparticles (AuNPs) against Gram-negative multidrug-resistant (MDR) bacteria. [Methods] Minimum inhibitory concentration (MIC) of AuNPs against 4 clinically isolated Gram-negative MDR bacteria was determined by the broth dilution method. Time-kill curves within 24 h were drawn by plate counting after treatment with different concentrations of AuNPs. Employing Pseudomonas aeruginosa as a representative strain, the damage of AuNPs to bacterial cell components was studied using laser scanning confocal microscopy, transmission electron microscopy, and gel electrophoresis. The evolution of potential drug resistance of bacteria to AuNPs was evaluated by repeatedly exposed to AuNPs at a sublethal concentration. The biocompatibility of AuNPs to mammalian cells was evaluated by MTT analysis. [Results] The average size of synthesized AuNPs was 6.8 nm, and the zeta potential was +38.4 mV. The AuNPs showed timeand concentration-dependent antibacterial activity against the 4 Gram-negative MDR bacteria, with MIC values ranging from 4 to 8 μg/mL. The AuNPs killed these MDR bacteria through a combined mechanism including cell membrane destruction and DNA damage. No resistance development toward the AuNPs was demonstrated even after continuous passage for 30 d. Preliminary cytotoxicity assay results showed that AuNPs have excellent biocompatibility to mammalian cells, and the survival rate of normal L02 liver cells and normal AT II lung cells is still more than 85% when the concentration reaches 256 μg/mL. [Conclusion] Small molecule-mediated AuNPs have excellent antibacterial activity against Gram-negative MDR bacteria, and potential application value in dealing with severe MDR bacterial infection.
Keywords: gold nanoparticlesantibacterial activitymultidrug-resistant bacteriadrug resistance
当前,多药耐药细菌感染已成为全球公共卫生最大威胁的之一,特别是泛耐药及ESKAPE (由多药耐药鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌、肠杆菌、耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌组成,意为抗生素的失效)类群的出现,使得情况进一步恶化[1-2]。根据WHO最新的报告,与其他疾病导致的死亡人数相比,多药耐药细菌感染已成为人类死亡的主要诱因,如果得不到有效控制,到2050年每年将导致1000万人死亡[3]。由于细胞外膜(outer membrane)的存在,革兰氏阴性细菌相比革兰氏阳性细菌更难杀死,且更容易产生耐药性,导致更严重的感染[4]。同时,相对多种药物对革兰氏阳性细菌的有效性,目前针对革兰氏阴性多药耐药细菌感染的治疗药物十分稀缺[4-5]。因此,开发新型抗菌药物用于有效应对革兰氏阴性多药耐药细菌感染显得尤为重要。
纳米医学的发展为多药耐药细菌感染的治疗提供了新的策略。为克服传统抗菌治疗的不足,各种功能化的纳米材料被用于细菌感染的治疗应用[6-8]。在这些纳米材料中,金纳米材料因独特的物理化学性质和卓越的生物相容性在近年来受到广泛关注。相较于其他纳米材料,金纳米材料具有易制备、易功能化、比表面积大、细胞毒性低等优势[9]。此外,由于金纳米材料复杂的抗菌机制,细菌很难对其产生耐药性[10-11]。一系列基于金纳米材料的纳米抗生素被开发应用于多药耐药细菌感染的治疗研究,展现出极大的应用前景[12-14]。因此,深入研究金纳米材料的抗菌应用潜力,对于应对日益严峻的多药耐药细菌感染,特别是革兰氏阴性细菌引起的多药耐药感染,具有十分重要的意义。
4, 6-二氨基-2-巯基嘧啶(4, 6-diamino-2- mercaptopyrimidine,DAMP)为大肠杆菌tRNA合成底物2-巯基嘧啶的类似物,本身并不具有抗菌活性,通常被作为一些抗菌药物的中间体使用[15]。之前的研究显示一些药物中间体功能化的AuNPs也具有很好的抗菌活性[16-17]。因此,本研究以DAMP为功能配体合成AuNPs,以临床分离的大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌和肺炎克雷伯菌4种多药耐药细菌为代表菌株评估该AuNPs对革兰氏阴性多药耐药细菌的抗菌特性,以期为革兰氏阴性多药耐药细菌感染的治疗提供新的研究思路。
1 材料和方法 1.1 主要材料 氯金酸、硼氢化钠、噻唑蓝(MTT)和DAMP购买于Sigma-Aldrich;琼脂糖和左氧氟沙星购买于阿拉丁试剂有限公司;LIVE/DEAD BacLight Bacterial Viability Kit购买于Invitrogen;细菌DNA提取试剂盒购买于北京天根生化科技有限公司;多药耐药大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌分离自呼吸道感染患者痰液,分别对14、15、12、10种常见抗生素或抗生素组合耐药[15],所有菌株都采用Luria-Bertani (LB)培养基培养。正常肝细胞L02和正常肺细胞AT II购买于江苏凯基生物技术有限公司,使用含10%胎牛血清的DMEM培养基培养。
1.2 AuNPs的合成与表征 DAMP-AuNPs的合成参考文献[18]的方法进行。取10 mL 20 mmol/L溶于50%乙醇的DAMP与10 mL 10 mmol/L的氯金酸溶液混合,于4 ℃水浴10 min,剧烈搅拌下加入2 mL 10 mmol/L的硼氢化钠,保持均匀转速搅拌3 h。待反应完成后,采用透析的方法对AuNPs进行纯化。
AuNPs的形貌采用日本JEOL JEM-2100透射电子显微镜观察;粒径统计采用Nano Measurer软件进行;紫外光谱和傅里叶变换红外光谱(FTIR)的测定分别采用Thermo Fisher的Biomate 3S分光光度计和Nicolet iS5红外光谱仪读取;zeta电位采用英国马尔文的Nano ZS Zetasizer 90测定;激光共聚焦显微拍摄使用日本尼康的Ti-E共聚焦显微成像系统。
1.3 MIC测定 AuNPs对4种多药耐药细菌MIC值的测定参照文献[19]进行。将浓度为1.0×106 CFU/mL的细菌悬浮液接种到96孔板中,每孔总体积为100 μL,AuNPs的终浓度分别为0、0.25、0.50、1.00、2.00、4.00、8.00、16.00、32.00、64.00、128.00 μg/mL。待振荡混合均匀后,置于37 ℃培养24 h,肉眼观察培养基不浑浊的最低AuNPs浓度孔即代表其MIC。同时,以抗生素左氧氟沙星和DAMP作为对照同时进行实验。所有测试重复3次,取平均值。
1.4 杀菌动力学曲线测定 为进一步评估AuNPs的抗菌活性,采用时间-杀菌动力学曲线测定不同时间点不同浓度AuNPs处理下细菌的存活情况[20]。分别将1.0×105 CFU/mL的菌悬液与不同浓度的AuNPs混合,37 ℃在摇床振荡培养24 h,分别于培养0、1、3、6、12、18、24 h后吸取100 μL样品稀释涂布于LB固体培养基,培养24 h后统计菌落数。重复3次,取平均值绘制细菌生长曲线。
1.5 细菌细胞损伤测定 以多药耐药的铜绿假单胞菌为代表菌株,采用LIVE/DEAD BacLight Bacterial Viability Kit细菌死活鉴定试剂盒进行细菌细胞膜损伤情况测定。该试剂盒能根据细菌细胞膜的完整性进行区别染色,其中细胞膜完整的被SYTO 9染料沾染显示绿色荧光,细胞膜损伤的细菌则被碘化丙啶(PI)染成红色。将1.0×108 CFU/mL的铜绿假单胞菌和2×MIC值浓度的AuNPs混合,37 ℃培养6 h,然后根据试剂盒使用说明进行染色,采用共聚焦激光扫描显微镜拍照观察。为进一步观察AuNPs对细菌细胞的破坏,采用投射电子显微镜(TEM)观察处理前后的细菌形貌变化。以无菌生理盐水(NS)相同处理作为对照组进行比较。
1.6 DNA损伤测定 采用琼脂糖凝胶电泳分析AuNPs处理后细菌基因组DNA的损伤情况。将1.0×108 CFU/mL的铜绿假单胞菌和10 μg/mL的AuNPs混合,37 ℃培养6 h,离心收集菌体。细菌DNA提取采用天根生物的TIANamp Bacteria DAN Kit试剂盒进行,具体步骤根据试剂盒说明进行。取10 μL提取的DNA采用1.5%的琼脂糖凝胶电泳进行检测,120 V电泳30 min后采用凝胶成像系统(Bio-Rad)拍照。NS处理作为对照组进行比较。
1.7 细菌耐药性演化评估 采用铜绿假单胞菌作为代表菌株测定细菌对AuNPs的耐药性情况,具体参照文献[21]的方法进行。1/3 MIC的AuNPs反复诱导细菌,连续30 d,测定每次诱导之后的MIC值。若某天测定的MIC发生变化,则下一天AuNPs的使用浓度为该MIC值的1/3,以此类推。同时,以左氧氟沙星作为对照同时进行实验。
1.8 细胞毒性测定 以L02和AT II细胞系为代表,采用MTT实验评估AuNPs对哺乳动物细胞的细胞毒性,具体参照文献[15]的方法进行。AuNPs的终浓度分别为0、1、2、4、8、16、32、64、128、256 μg/mL。细胞存活率(%)以试验组的测量值与对照组(未加AuNPs)测量值的比值表示。
2 结果和分析 2.1 AuNPs的表征 通过硼氢化钠的还原,DAMP功能化的AuNPs被成功合成。如图 1所示,合成的DAMP- AuNPs呈均匀的球形颗粒,平均粒径约为6.8 nm,在波长514 nm处有最大紫外吸收峰。经FTIR确定,DAMP已功能化于AuNPs表面(图 1-D)。通过Nano ZS Zetasizer 90测定,DAMP-AuNPs的表面带正电荷,zeta电位为+38.4 mV。
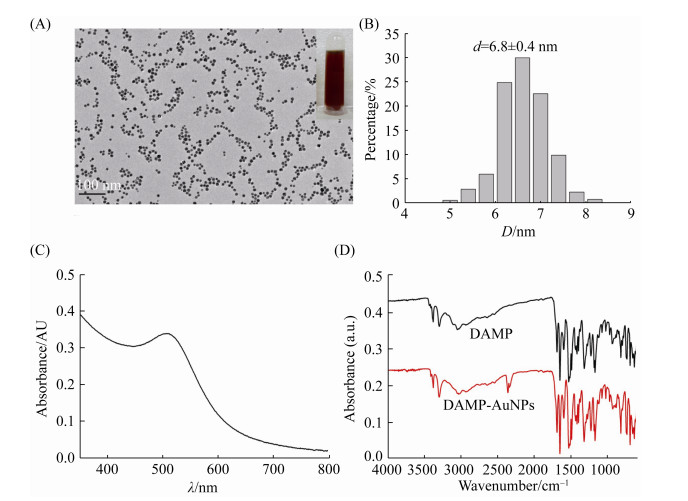 |
| 图 1 DAMP-AuNPs的表征 Figure 1 Characterization of DAMP-AuNPs. A: photograph and TEM image; B: size distribution; C: UV-vis spectrum; D: FTIR spectra. |
| 图选项 |
2.2 MIC值 为评估DAMP-AuNPs对革兰氏阴性多药耐药细菌的抗菌潜力,采用肉汤稀释法测定了DAMP- AuNPs的MIC值。如表 1所示,DAMP本身对4种多药耐药细菌基本不具有抗菌活性,MIC和MBC均≥128 μg/mL。相比之下,DAMP-AuNPs对临床分离的多药耐药对大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌均表现出较强的抗菌活性,MIC值分别为4、4、8、8 μg/mL。作为对照,4种多药耐药细菌对左氧氟沙星的MIC为8-32 μg/mL,已产生明显的耐药性[15]。
表 1. DAMP-AuNPs对4种革兰氏阴性多药耐药细菌的MIC值(μg/mL) Table 1. MIC (μg/mL) and MBC (μg/mL) of DAMP-AuNPs against representative Gram-negative multidrug-resistant bacteria
| Pathogens | DAMP-AuNPs | DAMP | Levofloxacin |
| Escherichia coli | 4 | ≥128 | 32 |
| Pseudomonas aeruginosa | 4 | ≥128 | 16 |
| Acinetobacter baumannii | 8 | ≥128 | 8 |
| Klebsiella pneumoniae | 8 | ≥128 | 16 |
表选项
2.3 杀菌动力学曲线 分别采用终浓度为0、2、4、8、16 μg/mL的DAMP-AuNPs在24 h内测定了其对4种革兰氏阴性多药耐药细菌的时间-杀菌动力学曲线。如图 2所示,DAMP-AuNPs的杀菌行为随浓度和时间的变化而改变。在未添加DAMP-AuNPs的处理组中,4种细菌的生长趋势基本一致,在后期趋于平稳,这可能与培养基营养消耗有关。对于大肠杆菌而言,在0.5×MIC浓度下(2 μg/mL),DAMP-AuNPs显示出微弱的抑菌作用;当浓度达到或超过1×MIC (4 μg/mL),DAMP-AuNPs对大肠杆菌显示出持续的抑菌活性,并随着时间延长清除的细菌增多;随着浓度的增加,DAMP- AuNPs的抗菌活性也显著提升,并加快了杀菌作用的进程,当浓度达到4×MIC (16 μg/mL),DAMP- AuNPs可在12 h内清除所有细菌(图 2-A)。由图 2-B可知,0.5×MIC (2 μg/mL)的DAMP-AuNPs对铜绿假单胞菌即表现出较好的抑制作用,1×MIC (4 μg/mL)的DAMP-AuNPs在24 h内能很好地抑制铜绿假单胞菌的生长;随着浓度的增加,DAMP-AuNPs的抗菌活性显著增强,当浓度达到2×MIC (8 μg/mL)和4×MIC (16 μg/mL),DAMP- AuNPs分别可在6 h和3 h内清除所有细菌,显示出超快的杀菌效应。而对于鲍曼不动杆菌而言,0.5×MIC (4 μg/mL)的DAMP-AuNPs即表现出较好的抑菌活性,当浓度达到2×MIC (16 μg/mL)时,DAMP-AuNPs可在18 h内清除所有细菌(图 2-C);肺炎克雷伯菌和鲍曼不动杆菌的时间-杀菌动力学相似,只不过DAMP-AuNPs对肺炎克雷伯菌的抗菌活性相对较弱,在浓度达到2×MIC (16 μg/mL)时也需要24 h才能清除所有细菌(图 2-D)。
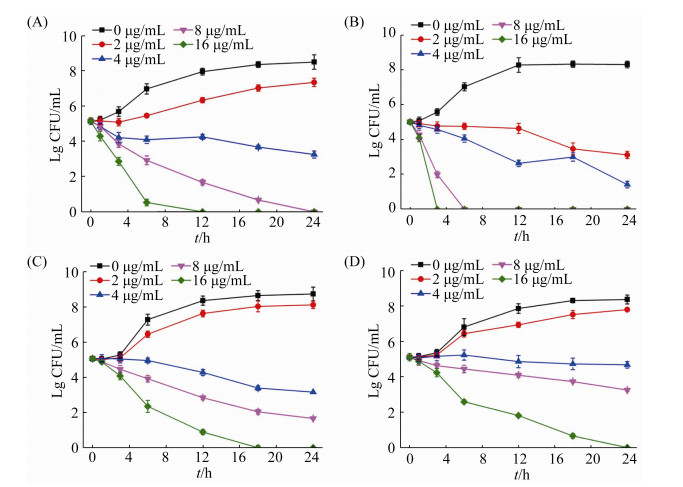 |
| 图 2 不同浓度DAMP-AuNPs对4种革兰氏阴性多药耐药细菌的时间-杀菌动力学曲线 Figure 2 Time-kill curves of DAMP-AuNPs against multidrug-resistant E. coli (A), P. aeruginosa (B), A. baumannii (C) and K. pneumonia (D) at different concentrations with different time. |
| 图选项 |
2.4 细胞膜和DNA损伤 以多药耐药铜绿假单胞菌为代表菌株初步研究了DAMP-AuNPs的抗菌作用机制。由于DAMP-AuNPs表面具有较高的正电荷,因此可通过静电作用吸附到细菌表面,提高DAMP-AuNPs破坏细菌细胞膜进入细胞的可能。为验证DAMP-AuNPs对细菌细胞膜的破坏,首先采用细菌死活染色试剂盒进行了细菌死活沾染,结果如图 3-A所示。激光共聚焦显微拍摄结果显示,对照组NS处理的铜绿假单胞菌几乎仅显示出绿色荧光,基本没有红色荧光发射,表明所有的细胞膜结构完整,未被破坏。相反,当使用10 μg/mL的DAMP-AuNPs处理细菌6 h以后,几乎所有的细菌细胞都显示出红色荧光发射,表明细菌细胞膜基本完全被破坏,细菌死亡。
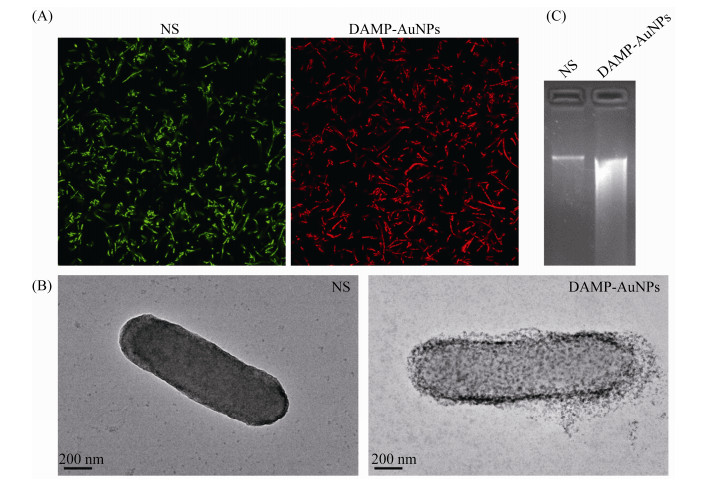 |
| 图 3 DAMP-AuNPs对铜绿假单胞菌细胞膜和DNA损伤观察 Figure 3 DAMP-AuNPs damage to cell membrane and DNA of multidrug-resistant P. aeruginosa. A: Laser scanning confocal microscope images of P. aeruginosa untreated and treated with DAMP-AuNPs. The dead cells were visualized by PI staining (red), while the SYTO 9 (green) helped to identify all cells; B: TEM micrographs of P. aeruginosa untreated or treated with DAMP-AuNPs. Scale bars=200 nm; C: Agarose gel electrophoresis result of the extracted genomic DNA of P. aeruginosa untreated and treated DAMP-AuNPs. |
| 图选项 |
进一步的TEM也用于细菌细胞膜破坏的观察,结果如图 3-B所示。DAMP-AuNPs处理之后,铜绿假单胞菌细胞显示出破碎状态,而对照组的细菌细胞显示出完整的细胞形态。此外,TEM还显示DAMP-AuNPs大量聚集于细菌表面,结果确认了DAMP-AuNPs能强烈地和病原菌相互作用,可通过细胞损伤杀灭多药耐药细菌。
当细胞膜破坏之后,金纳米粒子能更容易地进入细菌细胞,直接或间接地与细胞组分作用,如诱导DNA破坏。为验证这一点,采用琼脂糖凝胶电泳分析了DAMP-AuNPs处理铜绿假单胞菌后的细菌基因组DNA损伤情况,结果如图 3-C所示。可以看出,NS处理的细菌DNA条带完整紧凑,显示出完整的DNA结构。相反,DAMP-AuNPs处理的细菌DNA电泳条带显示出显著的拖尾效应,存在大量断裂的DNA片段,表明DAMP-AuNPs诱导了严重的DNA破坏。
2.5 耐药性演化 为评估细菌对DAMP-AuNPs的耐药性,采用铜绿假单胞菌为代表菌株测定了其对DAMP-AuNPs的耐药性演化,同时以左氧氟沙星作为对照进行测定。如图 4所示,铜绿假单胞菌在经过左氧氟沙星4 d的诱导之后便开始产生耐药性,在整个的测试周期内MIC增加了16倍。相反,在30 d的反复诱导下,除某几天MIC略有变化外,铜绿假单胞菌基本未对DAMP-AuNPs产生耐药性。
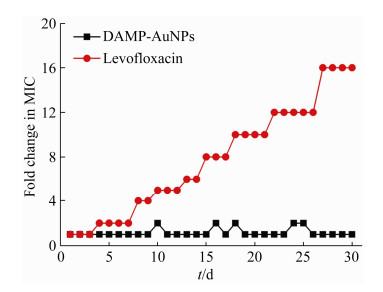 |
| 图 4 铜绿假单胞菌对DAMP-AuNPs的耐药性演化 Figure 4 Development of drug resistance toward DAMP-AuNPs and levofloxacin against P. aeruginosa upon multiple sublethal dose exposures. |
| 图选项 |
2.6 生物相容性 以L02和AT II细胞系为哺乳动物细胞模型,采用MTT实验初步评价了AuNPs的细胞毒性。如图 5所示,AuNPs对肝细胞和肺细胞毒性较低,在浓度高达256 μg/mL下细胞的存活率仍高达85%以上,这一浓度已远远高于AuNPs对细菌的MIC值,显示出AuNPs良好的生物相容性。
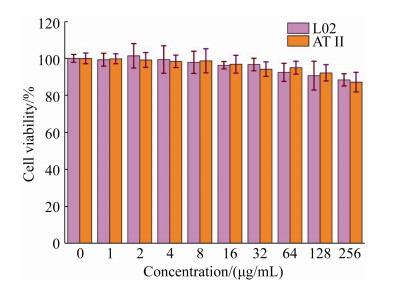 |
| 图 5 不同浓度DAMP-AuNPs处理对L02和AT II细胞活性的影响 Figure 5 Cell viability of L02 and AT II cells treated with different concentrations of DAMP-AuNPs. |
| 图选项 |
3 讨论 革兰氏阴性细菌可导致严重的感染,并产生极其严重的耐药性。据统计,在发达经济体,每年因多药耐药细菌导致的数十万死亡病例,其中三分之二以上为革兰氏阴性细菌造成[22]。在当前最严重的ESKAPE类群中,除耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌以外均为革兰氏阴性细菌。而目前针对革兰氏阴性多药耐药细菌开展抗菌药物开发的研究相对较少。本研究针对革兰氏阴性细菌开展抗菌药物研究,以临床患者痰液分离的多药耐药大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌和肺炎克雷伯菌为对象评估了药物中间体DAMP功能化AuNPs的抗菌特性,显示出较高的抗菌活性,对于革兰氏阴性多药耐药细菌的感染治疗具有重要意义。
AuNPs是最近被广泛研究的一类纳米材料,在生物医学领域受到了广泛关注,在应对多药耐药细菌感染方面也极具应用前景[8-9]。相比广泛研究的银纳米粒子和石墨烯纳米片,AuNPs具有卓越的生物相容性,对哺乳动物和人体细胞基本不会产生毒性作用[6, 23]。在过去的研究中,大多数研究仅将AuNPs作为载体,通过将抗生素、抗菌肽以及一些阳离子抗菌物质功能化于AuNPs表面,从而发挥抗菌效应[24]。例如,Rotello等[12]研究发现,阳离子配体功能化的AuNPs能作为高效的抗菌剂用于多药耐药细菌感染治疗。本研究发现基本不具有抗菌活性的DAMP功能化的AuNPs也显示出较好的抗菌活性,对4种代表性革兰氏阴性多药耐药细菌MIC值介于4-8 μg/mL之间,显示出很好的应用前景。此外,DAMP- AuNPs的抗菌活性随时间和浓度的变化而有所不同,这与其他类型的纳米抗菌剂类似[20, 25]。而从图 5可以看出,AuNPs对动物细胞则显示出较低的细胞毒性,这也与金纳米材料固有的生物相容性一致。AuNPs对动物细胞和细菌选择性的毒性可能与二者细胞结构不同有关,如动物细胞溶酶体的吞噬作用和线粒体内膜障碍[26],极大地降低了AuNPs对哺乳动物细胞的伤害,从而使得AuNPs显示出良好的生物相容性。
之前的研究表明,纳米材料的表面配体特性深刻影响其抗菌特性。例如,Zheng等[27]发现,AuNPs的表面配体类别和所带电荷均对其抗菌活性产生显著影响。本研究合成的AuNPs表面带有较高的正电荷,可通过静电作用吸附于细菌表面,进而破坏细菌细胞结构(图 3-B)。这可能也是表面带负电荷的6-巯基己酸介导合成的AuNPs (~6 nm)对革兰氏阳性细菌和革兰氏阴性细菌均不表现出抗菌活性的原因之一[28]。确实,目前发现大多数抗菌纳米材料均通过阳离子配体功能化发挥抗菌活性[8]。
一般而言,AuNPs主要通过破坏细菌细胞结构、损伤内部组分、抑制细胞代谢等途径杀灭细菌,或者作为药物载体将抗菌药物聚集于细菌表面,通过局部高浓度的抗生素杀灭细菌[15]。从图 3可以看出,DAMP-AuNPs主要通过破坏细菌细胞膜、诱导细菌DNA损伤杀灭细菌,这与之前的研究结果一致[25]。
长期用药导致的细菌耐药性是当年细菌感染治疗最大的挑战之一,也是细菌耐药性产生的最主要因素。任何一个新投入使用的抗生素,使用一段时间之后都会毫无例外地诱导耐药菌株的出现[7],甚至包括广谱抗菌的银纳米粒子[29]。本研究以铜绿假单胞菌作为代表菌株测定了其对DAMP-AuNPs的耐药性,结果显示在30 d内细菌基本未对DAMP-AuNPs产生耐药性。相反,作为对照,铜绿假单胞菌对左氧氟沙星的MIC已增加了16倍。确实,耐左氧氟沙星的铜绿假单胞菌已被广泛发现并已成为当前公共卫生的一个巨大威胁[30]。而目前未见有关细菌耐受抗菌金纳米材料的报道。这些结果都表明,DAMP-AuNPs作为一个新颖的纳米抗菌剂不仅能抑制革兰氏阴性多药耐药细菌的生长,还可能有效避免细菌耐药性的发生,具有巨大的应用前景。这可能也与AuNPs复杂的抗菌作用机制有关,复杂的抗菌机制需要细菌克服更多的障碍才可能产生耐药性演化[25]。因此,深入研究AuNPs对多药耐药细菌的抗菌性能和作用机制,对于应对当前严峻的多药耐药细菌感染,特别是耐药性异常严重的革兰氏阴性多药耐药细菌感染,具有十分重要的意义。
References
| [1] | Zumla A, Memish ZA, Maeurer M, Bates M, Mwaba P, Al-Tawfiq JA, Denning DW, Hayden FG, Hui DS. Emerging novel and antimicrobial-resistant respiratory tract infections:new drug development and therapeutic options. The Lancet Infectious Diseases, 2014, 14(11): 1136-1149. DOI:10.1016/S1473-3099(14)70828-X |
| [2] | Wang J, Wang XH, Xu H. Antimicrobial resistance and dissemination of multidrug resistant organisms-A review. Acta Microbiologica Sinica, 2016, 56(11): 1671-1679. (in Chinese) 王娟, 王新华, 徐海. 多重耐药菌在人类、动物和环境的耐药和传播机制. 微生物学报, 2016, 56(11): 1671-1679. |
| [3] | de Kraker MEA, Stewardson AJ, Harbarth S. Will 10 million people die a year due to antimicrobial resistance by 2050?. PLoS Medicine, 2016, 13(11): e1002184. DOI:10.1371/journal.pmed.1002184 |
| [4] | Lam SJ, O'Brien-Simpson NM, Pantarat N, Sulistio A, Wong EHH, Chen YY, Lenzo JC, Holden JA, Blencowe A, Reynolds EC, Qiao GG. Combating multidrug-resistant Gram-negative bacteria with structurally nanoengineered antimicrobial peptide polymers. Nature Microbiology, 2016, 1(11): 16162. DOI:10.1038/nmicrobiol.2016.162 |
| [5] | Levy SB, Marshall B. Antibacterial resistance worldwide:causes, challenges and responses. Nature Medicine, 2004, 10(12): S122-S129. |
| [6] | Chen XQ, Jiang JX, Ren ZH, Li J, Zhang HY, Xu JG, Du HM. Antibacterial activity of silver nanoparticles against multiple drug resistant strains. Acta Microbiologica Sinica, 2017, 57(4): 539-549. (in Chinese) 陈学情, 蒋家璇, 任志鸿, 李娟, 张红英, 徐建国, 杜华茂. 纳米银的抗菌特性及对多重耐药菌株的抗菌作用. 微生物学报, 2017, 57(4): 539-549. |
| [7] | Huh AJ, Kwon YJ. "Nanoantibiotics":a new paradigm for treating infectious diseases using nanomaterials in the antibiotics resistant era. Journal of Controlled Release, 2011, 156(2): 128-145. DOI:10.1016/j.jconrel.2011.07.002 |
| [8] | Gupta A, Mumtaz S, Li CH, Hussain I, Rotello VM. Combatting antibiotic-resistant bacteria using nanomaterials. Chemical Society Reviews, 2019, 48(2): 415-427. DOI:10.1039/C7CS00748E |
| [9] | Yang X, Yang MX, Pang B, Vara M, Xia YN. Gold nanomaterials at work in biomedicine. Chemical Reviews, 2015, 115(19): 10410-10488. DOI:10.1021/acs.chemrev.5b00193 |
| [10] | Miller KP, Wang L, Benicewicz BC, Decho AW. Inorganic nanoparticles engineered to attack bacteria. Chemical Society Reviews, 2015, 44(21): 7787-7807. DOI:10.1039/C5CS00041F |
| [11] | Xie YZY, Liu Y, Yang JC, Liu Y, Hu FP, Zhu K, Jiang XY. Gold Nanoclusters for targeting methicillin-resistant Staphylococcus aureus in vivo. Angewandte Chemie International Edition, 2018, 57(15): 3958-3962. DOI:10.1002/anie.201712878 |
| [12] | Li XN, Robinson SM, Gupta A, Saha K, Jiang ZW, Moyano DF, Sahar A, Riley MA, Rotello VM. Functional gold nanoparticles as potent antimicrobial agents against multi-drug-resistant bacteria. ACS Nano, 2014, 8(10): 10682-10686. DOI:10.1021/nn5042625 |
| [13] | Yang P, Pageni P, Rahman MA, Bam M, Zhu TY, Chen YP, Nagarkatti M, Decho AW, Tang CB. Gold nanoparticles with antibiotic-metallopolymers toward broad-spectrum antibacterial effects. Advanced Healthcare Materials, 2019, 8(6): 1800854. DOI:10.1002/adhm.201800854 |
| [14] | Zhao YQ, Sun YJ, Zhang YD, Ding XK, Zhao NN, Yu BR, Zhao H, Duan S, Xu FJ. Well-defined gold nanorod/polymer hybrid coating with inherent antifouling and photothermal bactericidal properties for treating an infected hernia. ACS Nano, 2020, 14(2): 2265-2275. DOI:10.1021/acsnano.9b09282 |
| [15] | Zheng YK, Liu WW, Qin ZJ, Chen Y, Jiang H, Wang XM. Mercaptopyrimidine-conjugated gold nanoclusters as nanoantibiotics for combating multidrug-resistant superbugs. Bioconjugate Chemistry, 2018, 29(9): 3094-3103. DOI:10.1021/acs.bioconjchem.8b00452 |
| [16] | Yang XL, Yang JC, Wang L, Ran B, Jia YX, Zhang LM, Yang G, Shao HW, Jiang XY. Pharmaceutical intermediate-modified gold nanoparticles:against multidrug-resistant bacteria and wound-healing application via an electrospun scaffold. ACS Nano, 2017, 11(6): 5737-5745. DOI:10.1021/acsnano.7b01240 |
| [17] | Zhang JJ, Mou L, Jiang XY. Surface chemistry of gold nanoparticles for health-related applications. Chemical Science, 2020, 11(4): 923-936. DOI:10.1039/C9SC06497D |
| [18] | Zhao YY, Ye CJ, Liu WW, Chen R, Jiang XY. Tuning the composition of AuPt bimetallic nanoparticles for antibacterial application. Angewandte Chemie International Edition, 2014, 53(31): 8127-8131. DOI:10.1002/anie.201401035 |
| [19] | Wiegand I, Hilpert K, Hancock REW. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols, 2008, 3(2): 163-175. DOI:10.1038/nprot.2007.521 |
| [20] | Li SH, Wang ZJ, Wei YF, Wu CY, Gao SP, Jiang H, Zhao XQ, Yan H, Wang XM. Antimicrobial activity of a ferrocene-substituted carborane derivative targeting multidrug-resistant infection. Biomaterials, 2013, 34(4): 902-911. DOI:10.1016/j.biomaterials.2012.10.069 |
| [21] | Zheng YK, Liu WW, Chen Y, Jiang H, Yan H, Kosenko I, Chekulaeva L, Sivaev I, Bregadze V, Wang XM. A highly potent antibacterial agent targeting methicillin-resistant Staphylococcus aureus based on cobalt bis(1, 2-dicarbollide) alkoxy derivative. Organometallics, 2017, 36(18): 3484-3490. DOI:10.1021/acs.organomet.7b00426 |
| [22] | Boucher HW, Talbot GH, Bradley JS, Edwards JE, Gilbert D, Rice LB, Scheld M, Spellberg B, Bartlett J. Bad bugs, no drugs:no ESKAPE! An update from the Infectious Diseases Society of America. Clinical Infectious Diseases, 2009, 48(1): 1-12. DOI:10.1086/595011 |
| [23] | Xia MY, Xie Y, Yu CH, Chen GY, Li YH, Zhang T, Peng Q. Graphene-based nanomaterials:the promising active agents for antibiotics-independent antibacterial applications. Journal of Controlled Release, 2019, 307: 16-31. DOI:10.1016/j.jconrel.2019.06.011 |
| [24] | Zhao YY, Jiang XY. Multiple strategies to activate gold nanoparticles as antibiotics. Nanoscale, 2013, 5(18): 8340-8350. DOI:10.1039/c3nr01990j |
| [25] | Zhang XD, Chen XK, Yang JJ, Jia HR, Li YH, Chen Z, Wu FG. Quaternized silicon nanoparticles with polarity-sensitive fluorescence for selectively imaging and killing gram-positive bacteria. Advanced Functional Materials, 2016, 26(33): 5958-5970. DOI:10.1002/adfm.201602185 |
| [26] | Marrache S, Dhar S. Engineering of blended nanoparticle platform for delivery of mitochondria-acting therapeutics. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(40): 16288-16293. DOI:10.1073/pnas.1210096109 |
| [27] | Zheng KY, Setyawati MI, Leong DT, Xie JP. Surface ligand chemistry of gold nanoclusters determines their antimicrobial ability. Chemistry of Materials, 2018, 30(8): 2800-2808. DOI:10.1021/acs.chemmater.8b00667 |
| [28] | Zheng KY, Setyawati MI, Leong DT, Xie JP. Antimicrobial gold nanoclusters. ACS Nano, 2017, 11(7): 6904-6910. DOI:10.1021/acsnano.7b02035 |
| [29] | Paná?ek A, Kvítek L, Smékalová M, Ve?e?ová R, Kolá? M, R?derová M, Dy?ka F, ?ebela M, Prucek R, Tomanec O, Zbo?il R. Bacterial resistance to silver nanoparticles and how to overcome it. Nature Nanotechnology, 2018, 13(1): 65-71. DOI:10.1038/s41565-017-0013-y |
| [30] | Mikura S, Wada H, Okazaki M, Nakamura M, Honda K, Yasutake T, Higaki M, Ishii H, Watanabe T, Tsunoda T, Goto H. Risk factors for bacteraemia attributable to Pseudomonas aeruginosa resistant to imipenem, levofloxacin, or gentamicin. Journal of Hospital Infection, 2011, 79(3): 267-268. DOI:10.1016/j.jhin.2011.07.003 |
