于淑媛1, 冀禹彤1, 陈秋艳1, 梅朱园1, 姜艳平1,2, 崔文1,2, 周晗1,2, 王丽1,2, 乔薪瑗1,2, 徐义刚1,2, 李一经1,2, 唐丽杰1,2


1. 东北农业大学动物医学学院, 黑龙江 哈尔滨 150030;
2. 农业农村部动物疫病病原生物学重点实验室东北科学观测实验站, 黑龙江 哈尔滨 150030
收稿日期:2020-04-16;修回日期:2020-07-30;网络出版日期:2020-09-27
基金项目:“十三五”国家重点研发计划(2018YFD0500600);国家自然科学基金(31672461)
*通信作者:唐丽杰, Tel:+86-451-55190824, Fax:+86-451-55190363, E-mail:tanglijie@163.com.
摘要:牛乳铁蛋白肽是由牛乳铁蛋白经消化酶水解产生的一类具有广谱抑菌活性的短肽;乳酸乳球菌作为食品级微生物,既有天然的益生作用,又是理想的表达牛乳铁蛋白肽的载体。[目的] 探究重组乳酸乳球菌pAMJ399-LFcinBA/MG1363表达牛乳铁蛋白肽的抑菌活性。[方法] 利用牛乳铁蛋白肽标准品绘制定量标准曲线来确定重组牛乳铁蛋白肽的含量,利用牛津杯法及微量肉汤稀释法测定重组牛乳铁蛋白肽对大肠杆菌、金黄色葡萄球菌等35株细菌的抑菌活性及最小抑菌浓度,利用扫描电镜、透射电镜、荧光显微镜、凝胶阻滞试验、黏附试验来探究重组牛乳铁蛋白肽对菌体结构、细菌DNA及黏附力的影响,利用CCK-8检测其对RAW 264.7细胞的毒性作用,并对小鼠红细胞溶血率进行测定。[结果] 重组乳酸乳球菌上清中牛乳铁蛋白肽的浓度为24.39 μg/mL,重组牛乳铁蛋白肽对测试的25株致病菌均有不同程度的抑制作用,抑菌浓度范围在16-128 μg/mL,但对9株乳酸菌以及粪肠球菌没有明显的抑制作用,对大肠杆菌、金黄色葡萄球菌、多杀性巴氏杆菌、鸡白痢沙门菌的菌体完整性具有不同程度的破坏作用,其主要作用靶点为细菌的细胞膜,可以与细菌DNA结合并抑制细菌对Caco-2、IPEC细胞的黏附作用,重组牛乳铁蛋白肽对小鼠红细胞及RAW 264.7细胞没有明显的细胞毒性。[结论] 乳酸乳球菌表达重组牛乳铁蛋白肽的抑菌活性与牛乳铁蛋白肽标准品相一致,通过直接作用于细菌细胞膜、胞内核酸或抑制细菌对正常细胞的黏附作用等多方面实现抑制或杀死细菌,发挥广谱的抗菌活性,且对真核细胞没有明显的细胞毒性作用。
关键词:牛乳铁蛋白肽重组乳酸乳球菌抑菌活性
Antibacterial activity of the recombinant bovine lactoferrin peptide expressed by Lactococcus lactis
Shuyuan Yu1, Yutong Ji1, Qiuyan Chen1, Zhuyuan Mei1, Yanping Jiang1,2, Wen Cui1,2, Han Zhou1,2, Li Wang1,2, Xinyuan Qiao1,2, Yigang Xu1,2, Yijing Li1,2, Lijie Tang1,2


1. School of Veterinary Medicines, Northeast Agricultural University, Harbin 150030, Heilongjiang Province, China;
2. Northeast Scientific Inspection Observation Station, Key Laboratory of Animal Pathogen Biology of Ministry of Agriculture and Affairs, Harbin 150030, Heilongjiang Province, China
Received: 16 April 2020; Revised: 30 July 2020; Published online: 27 September 2020
*Corresponding author: Lijie Tang, Tel: +86-451-55190824; Fax: +86-451-55190363; E-mail:tanglijie@163.com.
Foundation item: Supported by the National Research Program during the Thirteen Five-Year Plan Period (2018YFD0500600) and by the National Natural Science Foundation of China (31672461)
Abstract: Bovine lactoferrin peptides are short peptides with broad spectrum antimicrobial activity produced by hydrolysis of bovine lactoferrin by pepsin. As a food-grade microorganism, Lactococcus lactis has a natural probiotic effect, and it is an ideal bacterial vector for expressing bovine lactoferrin peptide. [Objective] To investigate the antibacterial activity of bovine lactoferrin peptide expressed by the recombinant L. lactis pAMJ399-LFcinBA/MG1363. [Methods] We used the standard of bovine lactoferrin peptide to determine a quantitative standard curve to determine the concentration of the bovine lactoferrin peptide expressed in the supernatants of the recombinant strain, and used the Oxford Cup method to determine the inhibitory effects of the recombinant bovine lactoferrin peptide on 35 strains of bacteria including Escherichia coli and Staphylococcus aureus. And we used the broth microdilution method to determine the minimal inhibitory concentrations. We explored the effects of the recombinant lactoferrin peptide on a number of pathogenic bacteria using scanning electron microscopy, transmission electron microscopy, and fluorescence microscopy. We used gel retardation assay and adhesion test to investigate the effects of the recombinant lactoferrin peptide on bacterial DNA and adhesion. We used CCK-8 to detect its toxic effects on RAW 264.7 cells and to determine the hemolytic rate of red blood cells in mice. [Results] The results showed that the concentration of the bovine lactoferrin peptide expressed in the supernatants of the recombinant strain was 24.39 μg/mL and the recombinant lactoferrin peptide showed inhibition on 25 strains of pathogenic bacteria used in the experiment. Its antibacterial concentration range was 16-128 μg/mL, but had no obvious inhibitory effect on 9 kinds of lactic acid bacteria and 1 strain of Enterococcus faecalis. It destroyed the integrity of E. coli, Staph. aureus, Pasteurella multocida and Salmonella pullorum, targeting the bacterial membranes. It could bind to bacterial DNA and inhibit bacterial adhesion to Caco-2 and IPEC cells. The recombinant lactoferrin peptide had no obvious cytotoxic effect on mouse red blood cells and RAW 264.7 cells. [Conclusion] The recombinant bovine lactoferrin peptide had the same antibacterial activity as the standard of bovine lactoferrin peptide. It could inhibit or kill bacteria by targeting the membranes of bacteria, intracellular nucleic acids and inhibiting the adhesion of bacteria to normal cells, exerting its broad-spectrum antibacterial activity, and had no obvious cytotoxicity to eukaryotic cells.
Keywords: bovine lactoferrin peptideLactococcus lactisantibacterial activity
牛乳铁蛋白肽是牛乳铁蛋白在酸性环境下经胃蛋白酶水解,从N端释放出的一类具有多种生物学活性的短肽,具有抗菌、抗病毒、抗寄生虫、免疫调节等多种功能[1]。牛乳铁蛋白肽应用于食品中,安全无毒副作用、没有残留的隐患、更不会对环境造成潜在威胁,被广泛用作食品防腐剂、营养添加剂等[2-5]。由于牛乳铁蛋白肽广谱的抑菌活性,以及其对抗生素耐药菌株的杀伤作用,使其在新型抗菌肽类药物领域具有广阔的发展前景。但是牛乳铁蛋白肽的来源受限,纯化方法复杂,生产成本高,因此借助外源基因表达系统可以显著降低牛乳铁蛋白肽的生产成本,为其应用于生产实践提供了基础。
乳酸乳球菌作为表达外源蛋白的宿主菌具有诸多优势:第一、乳酸乳球菌是安全的食品级微生物[6];第二、抗原性弱,作为载体本身不会引起强烈的免疫应答;第三、不产生任何细胞外蛋白酶,有利于外源蛋白的完整性及功能的正常发挥[7-9]。已有研究表明,乳铁蛋白肽的抑菌特性与铁离子饱和度有关,缺铁乳铁蛋白肽对耐药菌株均有不同程度的抑制生长作用,而不抑制乳酸菌的生长[10-12]。因此,乳酸乳球菌是理想的表达牛乳铁蛋白肽的载体,利用乳酸乳球菌表达牛乳铁蛋白肽,既能降低牛乳铁蛋白肽的生产成本,又能发挥乳酸菌的益生性和牛乳铁蛋白肽的生物学活性。
本研究利用实验室构建的表达牛乳铁蛋白肽(LFcinB和LFampinB)的乳酸乳球菌[13],对其抑菌活性及抑菌浓度范围进行测定,利用电镜及荧光显微镜观察其对细菌菌体结构的影响,利用凝胶阻滞试验和黏附试验,探究其对细菌DNA及黏附力的影响,并通过细胞毒性试验明确其对真核细胞的毒性作用,旨在阐明乳酸乳球菌表达的牛乳铁蛋白肽的抑菌活性,为重组乳酸乳球菌表达牛乳铁蛋白肽在生产实践中的应用提供理论依据。
1 材料和方法 1.1 菌株和细胞 表达牛乳铁蛋白肽的重组乳酸乳球菌pAMJ399-LFcinBA/MG1363由东北农业大学动物医学学院微生物与免疫实验室构建并保存;金黄色葡萄球菌(Staphylococcus aureus) CVCC546、金黄色葡萄球菌(Staph. aureus) CMCC26003、金黄色葡萄球菌(Staph. aureus) ATCC6538、金黄色葡萄球菌(Staph. aureus) ATCC43300、酿脓链球菌(Streptococcus pyogenes) ATCC21059、猪链球菌(Str. suis) YBS3、猪链球菌(Str. suis) T9、李氏杆菌(Listeria monocytogenes) CVCC0583、干酪乳杆菌(Lactobacillus casei) ATCC393、副干酪乳杆菌(Lac. paracasei) KLDSI.0652、乳酸乳球菌(L. lactis) NZ900、乳酸乳球菌(L. lactis) PNZ8112、罗伊氏乳杆菌(Lac. reuteri) CO21、德式乳杆菌(Lac. delbrueckii)、戊糖乳杆菌(Lac. pentosus) KLDSI.0344、植物乳杆菌(Lac. plantarum) ATCC8014、粪肠球菌(Enterococcus faecalis)、短小乳杆菌(Lac. brevis) HF1.7、大肠杆菌(Escherichia coli) CVCC10141、产肠毒素性大肠杆菌(Enterotoxigenic E. coli) ATCC25922、禽致病性大肠杆菌(Avian pathogenic E. coli) CVCC1551、禽致病性大肠杆菌(Avian pathogenic E. coli) CVCC1553、禽致病性大肠杆菌(Avian pathogenic E. coli) CVCC1562、副溶血性弧菌(Vibrio parahemolyticus) ATCC17802、溶藻性弧菌(V. alginolyticus) ATCC33787、霍乱弧菌(V. cholerae) 569B、拟态弧菌(V. mimicus) ATCC33653、费氏柠檬酸杆菌(Citrobter freumdii) ATCC43864、鸡白痢沙门菌(Salmonella pullorum) CVCC528、鼠伤寒沙门菌(S. typhimurium) SL1344、猪霍乱沙门氏菌(S. choleraesuis) CVCC79102、粘质沙雷氏菌(Serratia marcescens) ATCC8100、小肠结肠炎耶尔森氏菌(Yersinia enterocolitica) ATCC9610、多杀性巴氏杆菌(Pasteurella multocida) P1059、福氏志贺氏菌(Shigella flexneri) ATCC12022,以及RAW 264.7细胞株、Caco-2细胞株、IPEC细胞株、分泌抗牛乳铁蛋白肽LFampinB单克隆抗体的细胞株2C6[14],均由东北农业大学动物医学学院微生物与免疫实验室保存。
1.2 主要试剂 牛乳铁蛋白肽标准品(LFcinB,LFampinB)购自武汉星皓医药有限公司;Calcein-AM购自江苏凯基生物技术股份有限公司;LB培养基(酵母提取物5 g、胰蛋白胨10 g、氯化钠10 g,去离子水定容至1 L);碱性蛋白胨水、胰蛋白胨大豆肉汤、葡萄糖肉浸液肉汤、MRS、M17培养基均购自青岛海博生物技术有限公司;CCK-8检测试剂盒购自上海碧云天生物技术有限公司;DMEM细胞培养基购自Thermo Fisher Scientific公司;胎牛血清购自于Gbico公司;辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG购自Thermo Fisher Scientific公司。
1.3 表达牛乳铁蛋白肽的重组乳酸乳球菌的鉴定 参考已报道的方法[13],将重组菌pAMJ399- LFcinBA/MG1363 (LFcinBA)接种于GM17培养基中,于30 ℃静置培养24 h (OD600≈3.0)。收集细菌细胞沉淀和上清液,将上清液用三氯乙酸(TCA)浓缩,细胞沉淀用溶菌酶作用。将处理好的上清和沉淀样品,采用Tricine-SDS-PAGE进行电泳分析,并以同样条件培养和处理的pAMJ399/MG1363乳酸乳球菌作为对照。将蛋白转移到PVDF膜上,用鼠源抗LFampinB单克隆抗体2C6进行孵育,使用辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG抗体(1︰10000)作为二抗,利用化学发光底物显影。
1.4 重组乳酸乳球菌表达牛乳铁蛋白肽的定量分析 通过间接酶联免疫吸附试验[15](ELISA)分析重组牛乳铁蛋白肽的含量:将LFampinB标准品用PBS稀释至不同浓度(10、20、30、40、50、60、70、80、90和100 μg/mL)。将不同浓度LFampinB溶液包被酶标板,用含有5%脱脂奶粉的PBS封闭,一抗为鼠源抗LFampinB单克隆抗体2C6,二抗为HRP标记的山羊抗小鼠IgG抗体(1︰10000),利用TMB显色液进行显色,用酶标仪检测在450 nm处的吸光度。用相同的方法检测重组菌LFcinBA上清液的吸光度,pAMJ399/ MG1363的上清液用作阴性对照。
1.5 牛津杯法测定牛乳铁蛋白肽的抑菌活性 采用文献[16]介绍的方法,将病原菌培养至OD600=1.0,进行活菌计数,用无菌PBS稀释成106 CFU/mL,取1 mL稀释后的菌液,均匀涂布于固体平板中,将平板平均分为4个区,每区放置一个牛津杯,将过滤除菌后,将pH为7.0的重组菌LFcinBA上清(根据1.4方法确定上清中牛乳铁蛋白肽的浓度)、空载体菌pAMJ399/MG1363上清、无菌PBS、氯霉素(0.01 g/mL)各100 μL加入牛津杯中,根据不同细菌的最适生长温度分别培养12 h。利用游标卡尺测量抑菌圈直径。
1.6 微量肉汤稀释法测定牛乳铁蛋白肽最小抑菌浓度(MIC) 微量肉汤稀释法[17]步骤为:利用TCA浓缩重组菌LFcinBA上清,用PBS重悬,调节pH为7.0,使其牛乳铁蛋白肽浓度为256 μg/mL (根据1.4测定的重组牛乳铁蛋白肽的浓度以及浓缩倍数计算得到),过滤除菌后倍比稀释,使重组牛乳铁蛋白肽的终浓度分别为256、128、64、32、16、8、4、2 μg/mL,pAMJ399/MG1363上清处理方式相同,病原菌用培养液稀释成105 CFU/mL的菌悬液,96孔板每孔加100 μL菌悬液,分别加入100 μL含不同浓度重组牛乳铁蛋白肽的重组菌LFcinBA上清,并设pAMJ399/MG1363上清对照、PBS对照、氯霉素(0.01 g/mL)对照,根据不同细菌的最适生长温度培养12 h,用酶标仪检测OD600,根据吸光值以及肉眼观察无显在菌落于孔板底部,判定其最小抑菌浓度。
1.7 电镜法检测牛乳铁蛋白肽的抑菌效果 1.7.1 扫描电镜观察: 将大肠杆菌、金黄色葡萄球菌、多杀性巴氏杆菌、鸡白痢沙门菌用培养基稀释成105 CFU/mL细菌悬液,加入最小抑菌浓度的重组牛乳铁蛋白肽、牛乳铁蛋白肽标准品,加入相同体积的pAMJ399/MG1363上清、无菌PBS作为对照,37 ℃培养12 h,收集菌体,依次进行固定、脱水等步骤,将样品进行冷冻干燥,用E-1010 (HITACHI)型离子溅射镀膜仪在样品表面镀上一层厚100–150 ?的金属膜,利用扫描电镜观察。
1.7.2 透射电镜观察: 菌体处理方式同1.7.1,收集菌体依次进行固定、脱水、包埋、聚合和修块,利用超薄切片机切片、醋酸铀-枸橼酸铅双染色、透射电镜观察。
1.7.3 荧光显微镜观察: 参照文献[18]的方法,将大肠杆菌、金黄色葡萄球菌培养至对数生长期,用培养液将其稀释成105 CFU/mL细菌悬液,取1 mL菌液加入1 μL Calcein-AM混合均匀,37 ℃避光作用20 min,PBS清洗菌体沉淀3次,稀释后放入96孔板中,分别利用0.6 mg/mL的牛乳铁蛋白肽标准品、重组菌LFcinBA上清(重组牛乳铁蛋白肽的浓度为0.6 mg/mL)作用标记后的大肠杆菌和金黄色葡萄球菌,同时设置PBS及pAMJ399/MG1363上清对照,计时,大肠杆菌组每分钟1次,金黄色葡萄球菌组每30 s一次观察荧光变化。利用Image J软件分析平均荧光强度的变化。
1.8 凝胶阻滞试验 利用细菌基因组提取试剂盒提取大肠杆菌、金黄色葡萄球菌基因组DNA,配置结合缓冲液[5%甘油、10 mmol/L Tris-HCl (pH 8.0)、1 mmol/L EDTA、1 mmol/L β-巯基乙醇、20 mmol/L KCl、50 μg/mL牛血清白蛋白],将重组牛乳铁蛋白肽与细菌基因组分别按照2︰1、4︰1、8︰1、16︰1、32︰1和64︰1的比例加入20 μL体系中,利用结合缓冲液补齐20 μL体系,分别设置重组牛乳铁蛋白肽组、牛乳铁蛋白肽标准品组、pAMJ399/ MG1363上清对照组及基因组阳性对照组,37 ℃孵育1 h,用1%琼脂糖凝胶电泳,观察结果[19]。
1.9 重组牛乳铁蛋白肽对细菌黏附作用的影响 将大肠杆菌、鸡白痢沙门菌、金黄色葡萄球菌、酿脓链球菌用无菌PBS制备成活菌数为105 CFU/mL的细菌悬液,培养Caco-2及IPEC细胞,分别将含有105个细胞的完全DMEM培养液移入24孔板中,5% CO2、37 ℃培养箱培养24 h,待细胞长满至80%融合时,更换完全DMEM培养液,将100 μL细菌悬液加入到24孔板中[20],分别加入最小抑菌浓度的重组牛乳铁蛋白肽、牛乳铁蛋白肽标准品、pAMJ399/MG1363上清及PBS溶液,37 ℃孵育4 h,用无菌PBS清洗3次,利用革兰氏染色方法进行染色,显微镜观察,随机选取20个视野进行细菌计数。
1.10 牛乳铁蛋白肽的细胞毒性检测 1.10.1 溶血率测定: 参照文献介绍的方法[19],制备红细胞悬液终浓度为1%,取90 μL红细胞悬液加入10 μL不同浓度(256、128、64、32、16、8、4、2、1 μg/mL)的牛乳铁蛋白肽,分别设置重组牛乳铁蛋白肽组、相同处理方法的pAMJ399/MG1363上清组、牛乳铁蛋白肽标准品组、空白对照PBS以及阳性对照0.5% Triton X-100,37 ℃孵育30 min,然后4 ℃、1000 r/min离心5 min,各吸取50 μL上清,用酶标仪测定各孔在405 nm和562 nm下的吸光度,分别得到OD405、OD562和ODDelta值,通过公式(1)计算重组牛乳铁蛋白肽对小鼠红细胞的溶血率。
 | 公式(1) |
2 结果和分析 2.1 重组牛乳铁蛋白肽的鉴定及定量分析 免疫印迹试验结果显示,重组菌LFcinBA的上清和菌体沉淀均出现约13 kDa的目的条带(图 1-A),根据标准曲线确定重组菌LFcinBA上清液中的牛乳铁蛋白肽浓度为24.39 μg/mL (图 1-B)。
 |
| 图 1 重组乳酸乳球菌pAMJ399-LFcinBA/MG1363表达牛乳铁蛋白肽的鉴定及定量分析结果 Figure 1 Identification and quantification of recombinant L. lactis pAMJ399-LFcinBA/MG1363 expressing bovine lactoferrin peptide. A: the result of Western blotting. M: Trans2K Plus II DNA marker; line 1: the supernatants of pAMJ399/MG1363; line 2: the supernatants of pAMJ399-LFcinBA/MG1363; line 3: the bacterial pellets of pAMJ399-LFcinBA/MG1363; line 4: the bacterial pellets of pAMJ399/MG1363. B: the standard curve of the standard of lactoferrin peptide. X: the concentration of LFampinB. Y: the optical density at 450 nm. |
| 图选项 |
2.2 重组牛乳铁蛋白肽的抑菌活性 利用牛津杯法测定重组牛乳铁蛋白肽的抑菌活性,结果如表 1所示。对于金黄色葡萄球菌、链球菌、李氏杆菌等革兰氏阳性病原菌,重组菌LFcinBA组抑菌圈直径与pAMJ399/MG1363组抑菌圈直径存在显著差异,但对于乳酸菌没有明显的抑制效果;对于大肠杆菌、沙门氏菌等革兰氏阴性病原菌,重组菌LFcinBA组抑菌圈直径与pAMJ399/MG1363组抑菌圈直径存在显著差异,证明重组牛乳铁蛋白肽对所测试的病原菌均具有广谱的抑菌活性,但对乳酸菌无明显抑菌作用,推测乳酸菌的特有成分可能会影响牛乳铁蛋白肽发挥其抑菌功能。
表 1. 重组牛乳铁蛋白肽的抑菌圈直径(cm) Table 1. Inhibition diameter of the recombinant bovine lactoferrin peptide (cm)
| Strains | PBS | LFcinBA | pAMJ399/MG1363 | Chloromycetin (0.01 g/mL) |
| Gram-positive bacteria | ||||
| ??Staph. aureus CMCC26003 | – | 0.86±0.04* | 0.74±0.01 | 2.63±0.09 |
| ??Staph. aureus CVCC546 | – | 0.79±0.03* | 0.70±0.01 | 3.50±0.10 |
| ??Staph. aureus ATCC6538 | – | 0.82±0.02* | 0.74±0.01 | 2.51±0.01 |
| ??Staph. aureus ATCC43300 | – | 0.98±0.06* | 0.80±0.03 | 4.40±0.13 |
| ??Str. pyogenes ATCC21059 | – | 0.88±0.01** | 0.83±0.01 | 2.33±0.03 |
| ??Str. suis YBS3 | – | 1.73±0.02** | 0.87±0.02 | 3.04±0.01 |
| ??Str. suis T9 | – | 1.11±0.02* | 0.79±0.01 | 2.50±0.02 |
| ??Lis. monocytogenes CVCC0583 | – | 0.99±0.01** | – | 4.50±0.01 |
| ??L. casei NZ900 | – | – | – | 5.29±0.17 |
| ??L. lactis PNZ8112 | – | – | – | 1.83±0.01 |
| ??Lac. casei ATCC393 | – | – | – | 5.81±0.01 |
| ??Lac. paracasei KLDSI.0652 | – | – | – | 5.74±0.08 |
| ??Lac. reuteri CO21 | – | – | – | 4.91±0.03 |
| ??Lac. delbrueckii | – | – | – | 5.81±0.03 |
| ??Lac. pentosus KLDSI.0344 | – | – | – | 4.44±0.01 |
| ??Lac. plantarum ATCC8014 | – | – | – | 6.30±0.01 |
| ??Lac. brevis HF1.7 | – | – | – | 4.45±0.03 |
| ??Ent. faecalis | – | – | – | 4.52±0.01 |
| Gram-negative bacteria | ||||
| ??E. coli CVCC10141 | – | 0.79±0.03* | 0.69±0.03 | 1.27±0.09 |
| ??Enterotoxigenic E. coli ATCC25922 | – | 0.81±0.02* | 0.69±0.04 | 1.27±0.04 |
| ??Avian pathogenic E. coli CVCC1551 | – | 0.99±0.01** | – | 2.27±0.01 |
| ??Avian pathogenic E. coli CVCC1553 | – | 0.95±0.02** | – | 3.73±0.02 |
| ??Avian pathogenic E. coli CVCC1562 | – | 1.03±0.01** | – | 2.30±0.01 |
| ??V. parahemolyticus ATCC17802 | – | 0.87±0.01* | 0.82±0.01 | 2.50±0.07 |
| ??V. alginolyticus ATCC33787 | – | 0.90±0.04* | 0.81±0.05 | 2.80±0.13 |
| ??V. cholerae 569B | – | 0.84±0.01** | 0.76±0.02 | 2.01±0.08 |
| ??V. mimicus ATCC33653 | – | 0.91±0.04* | 0.80±0.02 | 2.72±0.10 |
| ??C. freumdii ATCC43864 | – | 0.92±0.01** | 0.82±0.01 | 2.64±0.05 |
| ??S. pullorum CVCC528 | – | 1.10±0.07* | 0.86±0.04 | 2.80±0.03 |
| ??S. typhimurium SL1344 | – | 0.86±0.02* | 0.77±0.03 | 2.60±0.15 |
| ??S. choleraesuis CVCC79102 | – | 0.86±0.01** | – | 2.12±0.02 |
| ??Ser. marcescens ATCC8100 | – | 1.00±0.06* | 0.80±0.02 | 1.69±0.14 |
| ??Y. enterocolitica ATCC9610 | – | 0.80±0.01** | 0.74±0.01 | 1.50±0.14 |
| ??P. multocida P1059 | – | 0.87±0.03* | 0.77±0.02 | 2.94±0.17 |
| ??Sh. flexneri ATCC | – | 0.82±0.03* | 0.73±0.02 | 2.37±0.07 |
| –: no obvious zone of inhibition; *: the diameter of the inhibition zone of the LFcinBA group and pAMJ399/MG1363 group is significantly different (0.01 < P < 0.05); **: the diameter of the inhibition zone of the LFcinBA group and pAMJ399/MG1363 group is extremely significantly different (P < 0.01). | ||||
表选项
2.3 重组牛乳铁蛋白肽的最小抑菌浓度 利用微量肉汤稀释法测定重组牛乳铁蛋白肽对细菌的最小抑菌浓度,结果如表 2所示。对病原菌的抑菌浓度范围在16–128 μg/mL,在检测浓度范围内,对乳酸菌没有明显的抑制作用,此结果与抑菌圈直径测定结果相一致,进一步证明了重组牛乳铁蛋白肽具有广谱的抑菌活性,但是对于乳酸菌的抑制效果不明显。
表 2. 重组牛乳铁蛋白肽的最小抑菌浓度 Table 2. Minimal inhibitory concentrations of the recombinant bovine lactoferrin peptide
| Strains | MIC/(μg/mL) |
| Gram-positive bacteria | |
| ??Staph. aureus CMCC26003 | 16 |
| ??Staph. aureus CVCC546 | 32 |
| ??Staph. aureus ATCC6538 | 64 |
| ??Staph. aureus ATCC43300 | 16 |
| ??Str. pyogenesATCC21059 | 32 |
| ??Str. suis YBS3 | 64 |
| ??Str. suis T9 | 64 |
| ??Lis. monocytogenes CVCC0583 | 128 |
| ??L. lactis NZ900 | – |
| ??L. lactis PNZ8112 | – |
| ??Lac. casei ATCC393 | – |
| ??Lac. paracasei KLDSI.0652 | – |
| ??Lac. reuteri CO21 | – |
| ??Lac. delbrueckii | – |
| ??Lac. pentosus KLDSI.0344 | – |
| ??Lac. plantarum ATCC8014 | – |
| ??Lac. brevis HF1.7 | – |
| ??Ent. faecalis | – |
| Gram-negative bacteria | |
| ??E. coli CVCC10141 | 16 |
| ??Enterotoxigenic E. coli ATCC25922 | 32 |
| ??Avian pathogenic E. coli CVCC1551 | 32 |
| ??Avian pathogenic E. coli CVCC1553 | 64 |
| ??Avian pathogenic E. coli CVCC1562 | 32 |
| ??V. parahemolyticus ATCC17802 | 32 |
| ??V. alginolyticus ATCC33787 | 32 |
| ??V. cholerae 569B | 16 |
| ??V. mimicus ATCC33653 | 64 |
| ??C. freumdii ATCC43864 | 64 |
| ??S. pullorum CVCC528 | 128 |
| ??S. typhimurium SL1344 | 64 |
| ??S. choleraesuis CVCC79102 | 64 |
| ??Ser. marcescens ATCC8100 | 32 |
| ??Y. enterocolitica ATCC9610 | 64 |
| ??P. multocida P1059 | 64 |
| ??Sh. flexneri ATCC | 32 |
| –: no obvious antibacterial effect in the experiment. | |
表选项
2.4 电镜法检测重组牛乳铁蛋白肽的抑菌效果 2.4.1 扫描电镜观察结果: 利用扫描电镜观察结果如图 2所示,pAMJ399/MG1363组和PBS对照组菌体形态完整、形状规则、细胞膜表面光滑,经最小抑菌浓度的重组牛乳铁蛋白肽作用后,重组菌LFcinBA组及牛乳铁蛋白肽标准品组菌体表面出现了不同程度的凸起、破损或凹陷,表明重组牛乳铁蛋白肽对细菌结构具有一定的破坏作用。
 |
| 图 2 扫描电镜观察结果 Figure 2 Observation results of scanning electron microscope. A: PBS; B: pAMJ399/MG1363; C: pAMJ399- LFcinBA/MG1363; D: the standard of bovine lactoferrin peptide. 1: E. coli CVCC10141; 2: Staph. aureus CMCC26003; 3: P. multocida P1059; 4: S. pullorum CVCC528. |
| 图选项 |
2.4.2 透射电镜观察结果: 利用透射电镜观察结果如图 3所示,pAMJ399/MG1363组和PBS对照组菌体细胞膜结构完整,菌体表面超微结构致密均匀,而标准品组及重组菌LFcinBA组,其菌体内出现空泡化区域,细胞部分区域结构不明显、呈弥散状,细菌细胞壁和细胞膜结构破损甚至脱落,可见内容物外泄,说明重组牛乳铁蛋白肽对细菌的细胞膜具有一定的破坏作用。
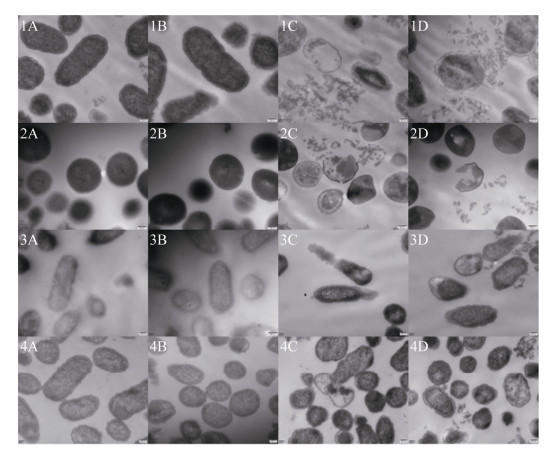 |
| 图 3 透射电镜观察结果 Figure 3 Observation results of transmission electron microscope. A: PBS; B: pAMJ399/MG1363; C: pAMJ399-LFcinBA/MG1363; D: the standard of bovine lactoferrin peptide. 1: E. coli CVCC10141; 2: Staph. aureus CMCC26003; 3: P. multocida P1059; 4: S. pullorum CVCC528. |
| 图选项 |
2.4.3 荧光显微镜观察结果: 对于大肠杆菌,标准品组与重组菌LFcinBA组作用6 min,每1 min拍照观察,其荧光强度逐渐减弱,作用6 min后其荧光基本消失,而PBS组及pAMJ399/MG1363对照组,其荧光强度略有降低,但变化不明显;对于金黄色葡萄球菌,标准品组与重组菌LFcinBA组作用3 min,每30 s拍照观察,其荧光强度逐渐减弱,作用3 min后其荧光基本消失,而PBS组及pAMJ399/MG1363对照组,其荧光强度略有降低,可能是受到曝光等条件的影响,但整体变化不明显(图 4),推测重组牛乳铁蛋白肽对大肠杆菌及金黄色葡萄球菌的质膜具有损伤作用。
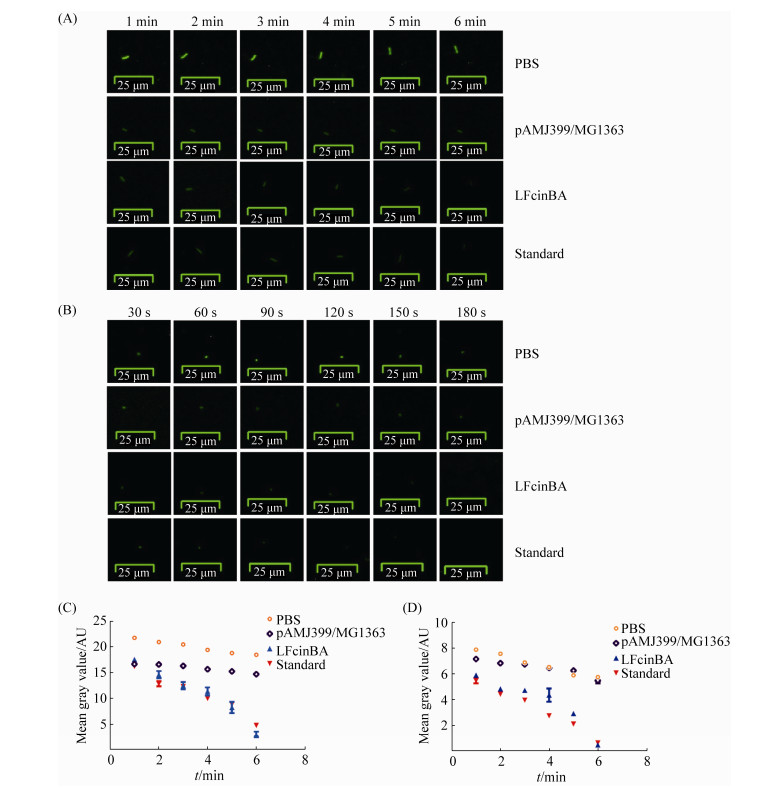 |
| 图 4 荧光显微镜观察结果 Figure 4 Observation results of fluorescence microscopy. A: E. coli CVCC10141; B: Staph. aureus CMCC26003; C: gray value of E. coli CVCC10141; D: gray value of Staph. aureus CMCC26003. |
| 图选项 |
2.5 重组牛乳铁蛋白肽对细菌DNA的影响 凝胶阻滞试验结果表明,当重组牛乳铁蛋白肽与大肠杆菌基因组DNA的质量比为16︰1时,完全抑制大肠杆菌DNA的迁移,且随着质量比的增加,其抑制迁移的效果越明显;当重组牛乳铁蛋白肽与金黄色葡萄球菌基因组DNA的质量比为64︰1时,完全抑制金黄色葡萄球菌DNA的迁移(图 5),说明重组牛乳铁蛋白肽可能通过抑制细菌DNA的迁移,发挥抑制细菌生长的作用。
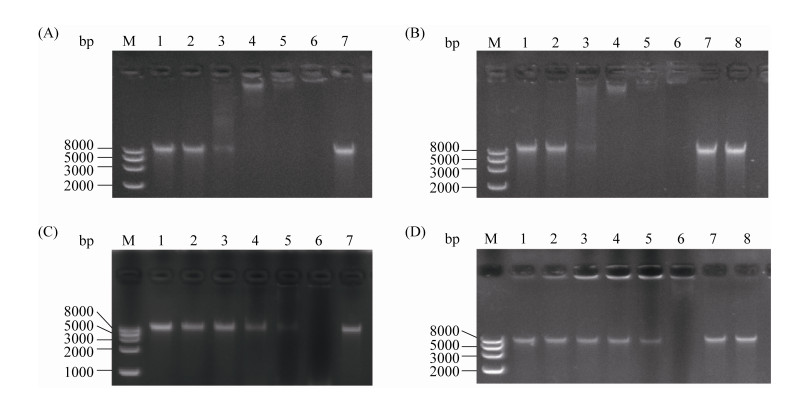 |
| 图 5 重组牛乳铁蛋白肽对细菌DNA的影响效果 Figure 5 Effects of the recombinant bovine lactoferrin peptide on bacterial DNA. A: effects of the recombinant bovine lactoferrin peptide on the DNA of E. coli CVCC10141; B: effects of the standard of bovine lactoferrin peptide on the DNA of E. coli CVCC10141; C: effects of the recombinant bovine lactoferrin peptide on the DNA of Staph. aureus CMCC26003; D: effects of the standard of bovine lactoferrin peptide on the DNA of Staph. aureus CMCC26003. M: Trans2K Plus II DNA marker; line 1: the ratio of bovine lactoferrin peptide to DNA was 2:1; line 2: the ratio of bovine lactoferrin peptide to DNA was 4:1; line 3: the ratio of bovine lactoferrin peptide to DNA was 8:1; line 4: the ratio of bovine lactoferrin peptide to DNA was 16:1; line 5: the ratio of bovine lactoferrin peptide to DNA was 32:1; line 6: the ratio of bovine lactoferrin peptide to DNA was 64:1; line 7: DNA positive control; line 8: pAMJ399/MG1363 control. |
| 图选项 |
2.6 重组牛乳铁蛋白肽对细菌黏附作用的影响 细菌黏附试验结果显示,对于大肠杆菌、鸡白痢沙门菌、金黄色葡萄球菌、酿脓链球菌,重组菌LFcinBA组与pAMJ399/MG1363组细菌数量存在极显著差异(P < 0.01),与PBS组细菌数量也存在极显著差异(P < 0.01),重组菌LFcinBA组与牛乳铁蛋白肽标准品组没有明显差异(P > 0.05) (图 6),证明重组牛乳铁蛋白肽能够抑制以上4种细菌对Caco-2细胞和IPEC细胞的黏附,从而阻碍了病原菌侵入正常细胞。
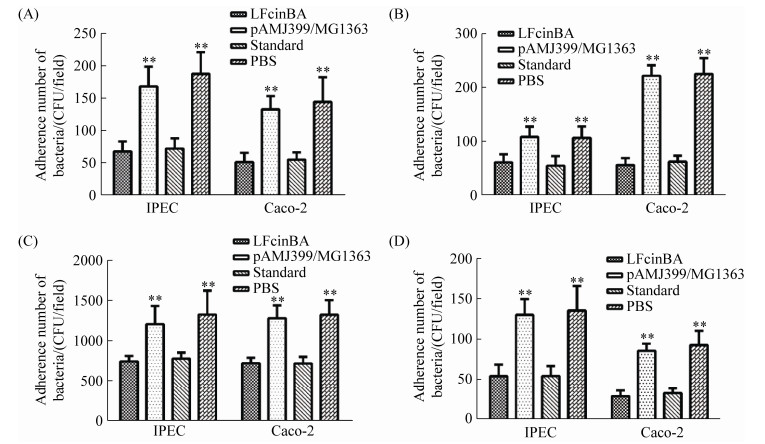 |
| 图 6 黏附试验结果 Figure 6 The results of adhesion test. A: E. coli CVCC10141; B: S. pullorum CVCC528; C: Staph. aureus CMCC26003; D: Str. pyogenes ATCC21059. |
| 图选项 |
2.7 重组牛乳铁蛋白肽的细胞毒性 溶血率试验结果显示,牛乳铁蛋白肽标准品组、重组菌LFcinBA组、pAMJ399/MG1363组对小鼠红细胞的溶血率很低,均小于2%,且无剂量依赖性(图 7-A),表明重组牛乳铁蛋白肽对红细胞没有明显的毒性;抑制率结果显示,牛乳铁蛋白肽标准品组、重组菌LFcinBA组、pAMJ399/MG1363组细胞生长抑制作用较小,抑制率均小于10%,且没有明显的剂量依赖性(图 7-B),显微镜下观察细胞形态与对照组细胞形态没有明显的差异,说明重组牛乳铁蛋白肽没有明显的细胞毒性。
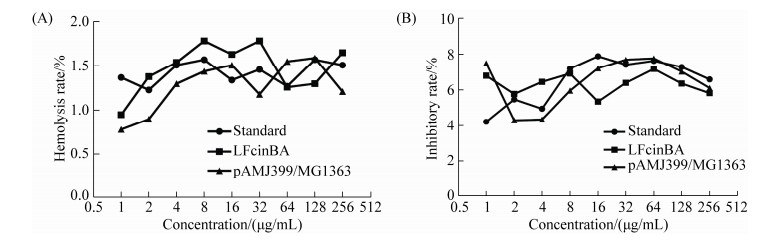 |
| 图 7 重组牛乳铁蛋白肽对真核细胞的细胞毒性 Figure 7 Cytotoxicity of the recombinant bovine lactoferrin peptide on eukaryotic cells. A: hemolysis rate; B: inhibitory rate. |
| 图选项 |
3 讨论 牛乳铁蛋白肽作为一种多功能活性肽,已广泛应用于婴幼儿乳品领域,但其高成本限制了在大众食品尤其是动物生产领域的应用。降低牛乳铁蛋白肽成本的最佳生产方式是以基因工程技术进行生产,揭示重组牛乳铁蛋白肽是否仍具有抑菌活性具有重要意义。
对重组牛乳铁蛋白肽的抑菌活性进行分析,抑菌试验结果表明,重组牛乳铁蛋白肽对测试的25株革兰氏阳性及革兰氏阴性细菌均有不同程度的抑制作用(表 1、表 2)。Bellamy等利用28株致病菌研究证实,牛乳铁蛋白肽具有广谱的抑菌活性[21]。本研究表明,重组牛乳铁蛋白肽对乳酸菌和粪肠球菌没有明显的抑制作用,这与Oda等[22]报道的牛乳铁蛋白肽对特定益生菌(如双歧杆菌和乳酸菌)没有抑制作用相一致。有研究显示,粪肠球菌在生长过程中释放一种蛋白酶(明胶酶),与M4肽酶家族相似,可以水解含有特定疏水性氨基酸的蛋白;铜绿假单胞菌分泌的蛋白酶也属M4肽酶家族,可以水解抗菌肽LL-37,使抗菌肽LL-37失去活性[23]。由于牛乳铁蛋白肽与抗菌肽LL-37均属于阳离子抗菌肽,且都含有大量疏水性氨基酸,据此我们推测,重组牛乳铁蛋白肽可能被粪肠球菌蛋白酶降解,从而失去对粪肠球菌的抑菌活性。LFcinB对特定益生菌(如双歧杆菌和乳酸菌)具有促生长作用,其可能的机制为,LFcinB与益生菌表面某些蛋白结合[10, 22-23],如双歧杆菌膜表面的蛋白可以与乳铁蛋白相结合,该蛋白还可以调节GAPDH的活性,在细菌生长过程中,乳铁蛋白与GAPDH相结合从而调节氧化应激活性[24]。乳铁蛋白肽还可以上调某些糖蛋白,而后者也是益生菌生长中的必要成分。此外,乳铁蛋白肽的二硫键或半胱氨酸残基被认为可能是益生菌的营养载体。我们推测,牛乳铁蛋白肽可以调节氧化应激反应,并为益生菌生长提供必要的营养物质,从而可以促进益生菌的生长而不发挥抑菌活性。
牛乳铁蛋白肽发挥抑菌活性主要通过非特异性地作用于细菌的细胞膜[18],本研究结果(图 2、图 3)证明,经重组牛乳铁蛋白肽作用后,菌体结构完整性受到破坏,菌体内部出现空泡化区域,细胞膜出现破损、脱落,可见有内容物外泄;而图 4结果显示,经牛乳铁蛋白肽作用后,细胞内的钙黄绿素大量渗漏,证明重组牛乳铁蛋白肽对细菌菌体结构破坏的主要作用靶点为细菌的细胞膜,这与已报道的牛乳铁蛋白肽主要作用机制[25]一致。这种作用机制可能是由于牛乳铁蛋白肽的阳离子性使得细菌细胞膜中的负电荷与之结合,其两亲性结构可以插入细胞膜内,引起细胞膜上孔洞的形成或膜的破坏。也有研究证明,疏水性氨基酸可能是抗菌肽结合细胞膜的重要靶点。Vogel等研究证明,牛乳铁蛋白肽中的色氨酸和精氨酸在发挥抑菌活性方面起到重要作用,因为将这两个位点突变后,其抑菌活性大大降低[26]。
除了作用于细胞膜外,Moniruzzaman等[27-28]证明,牛乳铁蛋白肽可能通过细胞内的作用机制来发挥抑菌活性,如牛乳铁蛋白肽可以与细菌DNA相结合,抑制大分子蛋白质的合成等。本研究结果证明,重组牛乳铁蛋白肽可以结合细菌DNA,并抑制DNA的迁移(图 5),虽然目前还未证实牛乳铁蛋白肽通过何种机制作用于DNA,但广泛认为,牛乳铁蛋白肽的阳离子性可以与带负电荷的DNA以静电方式相结合。Yonezawa等[29]证明,抗菌肽Tachyplesin I可以借助自身反向平行的β折叠结构与DNA双链的小沟相结合,而LFcinB在溶液中也呈现反向平行的β折叠结构,因此我们推测,LFcinB可能与抗菌肽Tachyplesin I具有相似的机制。当牛乳铁蛋白肽与细菌DNA结合后,可能会影响DNA的复制、RNA转录以及蛋白质翻译等过程,阻碍了细菌的正常生命代谢活动,从而抑制细菌生长或直接杀死细菌。图 6结果显示,重组牛乳铁蛋白肽可以抑制细菌对Caco-2、IPEC细胞的黏附,由于细菌黏附作用主要依靠黏附素以及细胞内的ECM蛋白[30],因此我们推测,牛乳铁蛋白肽可能对细菌黏附相关蛋白有一定的作用,从而影响细菌对细胞的黏附作用。
抗菌肽在生产应用中除了发挥良好的抑菌活性外,其安全性也是非常重要的。有研究证实,游离状态下的LFcinB没有明显的细胞毒性作用[19],而本研究的体外细胞毒性试验结果也显示,重组牛乳铁蛋白肽对小鼠红细胞及RAW264.7细胞等正常真核细胞没有明显的细胞毒性作用,且不呈剂量依赖性(图 7),因此,重组牛乳铁蛋白肽具有非常广阔的应用前景。但是牛乳铁蛋白肽的细胞毒性存在选择性,LFcinB对多种癌细胞具有较强的细胞毒性作用,如乳腺癌、结肠癌及卵巢癌细胞系等,但是对于正常人的淋巴细胞及成纤维细胞等没有明显的不利影响[31]。目前LFcinB的选择性机制尚不明确,可能的机制认为,LFcinB作为具有两亲性的阳离子肽可以与癌细胞带负电荷的膜相互作用,而正常细胞的细胞膜为电中性,从而影响了LFcinB对膜的作用[31]。与传统化疗药物对细胞的非特异性毒性相比,LFcinB对细胞的选择性细胞毒性,使其在治疗某些癌症等方面具有广阔的发展前景,对于牛乳铁蛋白肽的细胞毒性的影响因素以及选择性毒性的作用机制,还需要我们进一步的研究,以确保其可以更加安全且高效地应用于生产中。
综上结果表明,重组牛乳铁蛋白肽对真核细胞没有明显的细胞毒性,且抑菌活性与牛乳铁蛋白肽标准品一致,既可以直接作用于细菌细胞膜,导致细胞膜破损,又可以透过细胞膜进入细胞内,作用于胞内核酸或抑制大分子物质合成,还可以抑制细菌对正常细胞的黏附作用,从而多方面地抑制细菌的生长,发挥其广谱的抗菌活性。因此,重组牛乳铁蛋白肽具有非常广阔的应用前景。
References
| [1] | Gifford JL, Hunter HN, Vogel HJ. Lactoferricin:a lactoferrin-derived peptide with antimicrobial, antiviral, antitumor and immunological properties. Cellular and Molecular Life Sciences, 2005, 62(22): 2588-2598. DOI:10.1007/s00018-005-5373-z |
| [2] | Ahmadinia K, Yan DY, Ellman M, Im HJ. The anti-catabolic role of bovine lactoferricin in cartilage. Biomolecular Concepts, 2013, 4(5): 495-500. DOI:10.1515/bmc-2013-0013 |
| [3] | Han ZL, Xu XX. Inbibitional effects of LfcinB as one new food additives on cell growth of cancer. Food Research and Development, 2014, 35(23): 17-20. (in Chinese) 韩兆莲, 许晓曦. 新型食品添加剂LfcinB对肿瘤细胞生长的抑制作用. 食品研究与开发, 2014, 35(23): 17-20. DOI:10.3969/j.issn.1005-6521.2014.23.005 |
| [4] | Quintieri L, Caputo L, Monaci L, Deserio D, Morea M, Baruzzi F. Antimicrobial efficacy of pepsin-digested bovine lactoferrin on spoilage bacteria contaminating traditional Mozzarella cheese. Food Microbiology, 2012, 31(1): 64-71. DOI:10.1016/j.fm.2012.02.015 |
| [5] | Yu H, Jiang YP, Cui W, Wu X, He J, Qiao XY, Li YJ, Tang LJ. Comparison of expression and antibacterial activities of recombinant porcine lactoferrin expressed in four Lactobacillus species. Chinese Journal of Biotechnology, 2014, 30(9): 1372-1380. (in Chinese) 于慧, 姜艳平, 崔文, 武啸, 何佳, 乔薪瑗, 李一经, 唐丽杰. 猪乳铁蛋白在4种重组乳杆菌中的表达及抑菌活性比较. 生物工程学报, 2014, 30(9): 1372-1380. |
| [6] | Zhang HC, Chen W. Advances in expression systems for Lactic acid bacteria. Letters in Biotechnology, 2007, 18(2): 345-347. (in Chinese) 张虎成, 陈薇. 食品级乳酸菌表达系统研究进展. 生物技术通讯, 2007, 18(2): 345-347. DOI:10.3969/j.issn.1009-0002.2007.02.051 |
| [7] | Galdeano CM, Perdigón G. The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity. Clinical and Vaccine Immunology, 2006, 13(2): 219-226. DOI:10.1128/CVI.13.2.219-226.2006 |
| [8] | Nouaille S, Ribeiro LA, Miyoshi A, Pontes D, Le Loir Y, Oliveira SC, Langella P, Azevedo V. Heterologous protein production and delivery systems for Lactococcus lactis. Genetics and Molecular Research, 2003, 2(1): 102-111. |
| [9] | Shi D, Song Y, Li YJ. Progress on Lactococcus lactis expressing heterologous antigens as live mucosal vaccines. Acta Microbiologica Sinica, 2006, 46(4): 680-683. (in Chinese) 史达, 宋岩, 李一经. 乳酸乳球菌作为黏膜免疫活载体疫苗传递抗原的研究进展. 微生物学报, 2006, 46(4): 680-683. DOI:10.3321/j.issn:0001-6209.2006.04.037 |
| [10] | Vega-Bautista A, De La Garza M, Carrero JC, Campos-Rodríguez R, Godínez-Victoria M, Drago-Serrano ME. The impact of lactoferrin on the growth of intestinal inhabitant bacteria. International Journal of Molecular Science, 2019, 20(19): 4707. DOI:10.3390/ijms20194707 |
| [11] | Griffiths EA, Duffy LC, Schanbacher FL, Dryja D, Leavens A, Neiswander RL, Qiao HP, DiRienzo D, Ogra P. In vitro growth responses of bifidobacteria and enteropathogens to bovine and human lactoferrin. Digestive Diseases and Sciences, 2003, 48(7): 1324-1332. DOI:10.1023/A:1024111310345 |
| [12] | Arnold RR, Brewer M, Gauthier JJ. Bactericidal activity of human lactoferrin:sensitivity of a variety of microorganisms. Infection and Immunity, 1980, 28(3): 893-898. |
| [13] | Meng QS, Jiang YP, Cui W, Li HB, Qiao XY, Ge JW, Li YJ, Tang LJ. Co-expression of two different bovine lactoferrin-peptides in Lactococcus lactis. Animal Husbandry & Veterinary Medicine, 2013, 45(4): 1-4. (in Chinese) 孟庆森, 姜艳平, 崔文, 李海滨, 乔薪瑗, 葛俊伟, 李一经, 唐丽杰. 两段牛乳铁蛋白肽基因在乳酸乳球菌中的共表达. 畜牧与兽医, 2013, 45(4): 1-4. |
| [14] | 于淑媛.乳酸乳球菌表达牛乳铁蛋白肽的抑菌活性及机制分析.东北农业大学硕士学位论文, 2020. |
| [15] | Lin QY, Shi YM, Song LY, Li XC, Tan HC, Yu SY, Jiang YP, Cui W, Qiao XY, Wang L, Zhou H, Xu YG, Li YJ, Tang LJ. Study on the recombinant chicken origin Lactobacillus expressing bovine lactoferrin peptides against IBDV infection. Chinese Journal of Preventive Veterinary Medicine, 2019, 41(4): 402-407. (in Chinese) 林庆宇, 师一鸣, 宋丽影, 李雪纯, 谭宏超, 于淑媛, 姜艳平, 崔文, 乔薪瑗, 王丽, 周晗, 徐义刚, 李一经, 唐丽杰. 表达牛乳铁蛋白肽的重组鸡源乳酸杆菌抗IBDV感染的研究. 中国预防兽医学报, 2019, 41(4): 402-407. |
| [16] | Han YZ, Deng Z, Zhang B, You CZ, Cong Y, Li PL. Optimization of fermentation conditions for production of antifungal peptides by Bacillus amyloliquefaciens H15 and comparison of extraction methods for antifungal peptides. Food Science, 2015, 36(15): 135-141. (in Chinese) 韩玉竹, 邓钊, 张宝, 游成真, 丛苑, 李平兰. 解淀粉芽孢杆菌H15产抗菌肽的发酵条件优化和提取方法比较研究. 食品科学, 2015, 36(15): 135-141. DOI:10.7506/spkx1002-6630-201515025 |
| [17] | Wang C, Zhang WF, Niu MF, Guo XL, Li DY, Chen FY. Molecular design and antibacterial activity of cecropin-like antibacterial peptide. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(8): 600-604. (in Chinese) 王臣, 张巫凡, 牛明福, 郭香玲, 李德元, 陈溥言. 天蚕素类抗菌肽CLP的设计及其活性测定. 中国预防兽医学报, 2016, 38(8): 600-604. |
| [18] | Hossain F, Moghal MMR, Islam MZ, Moniruzzaman M, Yamazaki M. Membrane potential is vital for rapid permeabilization of plasma membranes and lipid bilayers by the antimicrobial peptide lactoferricin B. Journal of Biological Chemistry, 2019, 294(27): 10449-10462. DOI:10.1074/jbc.RA119.007762 |
| [19] | 刘倚帆.动物源抗菌肽的分子改良及其对猪肠道上皮屏障功能的保护作用研究.浙江大学博士学位论文, 2012. |
| [20] | Duary RK, Rajput YS, Batish VK, Grover S. Assessing the adhesion of putative indigenous probiotic lactobacilli to human colonic epithelial cells. Indian Journal of Medical Research, 2011, 134(5): 664-671. DOI:10.4103/0971-5916.90992 |
| [21] | Bellamy W, Takase M, Wakabayashi H, Kawase K, Tomita M. Antibacterial spectrum of lactoferricin B, a potent bactericidal peptide derived from the N-terminal region of bovine lactoferrin. Journal of Applied Bacteriology, 1992, 73(6): 472-479. DOI:10.1111/j.1365-2672.1992.tb05007.x |
| [22] | Oda H, Wakabayashi H, Yamauchi K, Abe F. Lactoferrin and bifidobacteria. Biometals, 2014, 27(5): 915-922. DOI:10.1007/s10534-014-9741-8 |
| [23] | Vega SC, Martínez DA, Chalá MDS, Vargas HA, Rosas JE. Design, synthesis and evaluation of branched RRWQWR-based peptides as antibacterial agents against clinically relevant gram-positive and gram-negative pathogens. Frontiers in Microbiology, 2018, 9: 329. DOI:10.3389/fmicb.2018.00329 |
| [24] | Oda H, Wakabayashi H, Yamauchi K, Sato T, Xiao JZ, Abe F, Iwatsuki K. Isolation of a bifidogenic peptide from the pepsin hydrolysate of bovine lactoferrin. Applied and Environmental Microbiology, 2013, 79(6): 1843-1849. DOI:10.1128/AEM.03343-12 |
| [25] | Shai Y. Mode of action of membrane active antimicrobial peptides. Biopolymers, 2002, 66(4): 236-248. DOI:10.1002/bip.10260 |
| [26] | Vogel HJ, Schibli DJ, Jing WG, Lohmeier-Vogel EM, Epand RF, Epand RM. Towards a structure-function analysis of bovine lactoferricin and related tryptophanand arginine-containing peptides. Biochemistry and Cell Biology, 2002, 80(1): 49-63. DOI:10.1139/o01-213 |
| [27] | Pirkhezranian Z, Tahmoorespur M, Daura X, Monhemi H, Sekhavati MH. Interaction of camel lactoferrin derived peptides with DNA:a molecular dynamics study. BMC Genomics, 2020, 21(1): 60. DOI:10.1186/s12864-020-6458-7 |
| [28] | Moniruzzaman M, Islam MZ, Sharmin S, Dohra H, Yamazaki M. Entry of a six-residue antimicrobial peptide derived from lactoferricin B into single vesicles and Escherichia coli cells without damaging their membranes. Biochemistry, 2017, 56(33): 4419-4431. DOI:10.1021/acs.biochem.6b01274 |
| [29] | Yonezawa A, Kuwahara J, Fujii N, Sugiura Y. Binding of tachyplesin I to DNA revealed by footprinting analysis:significant contribution of secondary structure to DNA binding and implication for biological action. Biochemistry, 1992, 31(11): 2998-3004. DOI:10.1021/bi00126a022 |
| [30] | Vaca DJ, Thibau A, Schütz M, Kraiczy P, Happonen L, Malmstr?m J, Kempf VAJ. Interaction with the host:the role of fibronectin and extracellular matrix proteins in the adhesion of gram-negative bacteria. Medical Microbiology and Immunology, 2020, 209(3): 277-299. |
| [31] | Mader JS, Salsman J, Conrad DM, Hoskin DW. Bovine lactoferricin selectively induces apoptosis in human leukemia and carcinoma cell lines. Molecular Cancer Therapeutics, 2005, 4(4): 612-624. DOI:10.1158/1535-7163.MCT-04-0077 |
