祝贤彬1, 刘紫薇1, Uzzal Hossain M.D.1, 周行1, 曾宪春1,2


1. 中国地质大学(武汉)环境学院, 湖北 武汉 430074;
2. 中国地质大学(武汉)生物地质与环境地质国家重点实验室, 湖北 武汉 430074
收稿日期:2019-10-10;修回日期:2020-01-22;网络出版日期:2020-03-09
基金项目:国家自然科学基金(41472257)
作者简介:曾宪春, 博士、中国地质大学(武汉)环境学院教授、博士生导师, 生物地质与环境地质国家重点实验室研究员, 国际杂志(Frontiers in Bioscience)(IF:3.5)编委(Managing Editor)、国家科技奖励评选办公室评审专家, 湖北省生物物理学会常务理事、民建武汉市委委员。在武汉大学先后获得生物化学专业学士、分子生物学专业硕士、微生物学专业博士学位。2001-2008年先后赴德国马普免疫学研究所、美国国家卫生研究院和美国马里兰大学医学院从事研究工作; 2009年在美国科贝尔国际公司任部门负责人。主要从事分子生物学、地质微生物学和环境基因组学领域的研究工作。近年来发表SCI期刊论文52篇, 其中以第一作者或通讯作者发表 41篇(第一作者22篇, 通讯作者19篇), 论文被引用近1100余次。2005年获湖北省自然科学一等奖, 2008年获国际基因组先驱者奖(Genomic Pioneer Awards)提名奖.
*通信作者:曾宪春。Tel:+86-27-67883481;E-mail:xianchun_zeng@hotmail.com.
摘要:[目的] 探究江汉平原土著砷还原微生物如何介导臭葱石的溶解和释放过程,以及硝酸盐和硫酸盐对该过程的影响。[方法] 采集江汉平原高砷沉积物,利用多轮传代富集方法筛选出一株兼性厌氧砷还原菌;克隆其16S rRNA基因、砷还原酶基因(arsC)、硫代硫酸盐还原酶基因(phsA)、硝酸盐还原酶基因(nar)以获得其分类地位;分析该细菌的As(Ⅴ)、NO3-、Fe(Ⅲ)、S2O32-还原功能;利用microcosm技术分析该菌株催化臭葱石中不可溶砷和铁的溶解和释放作用及硝酸盐和硫酸盐对此过程的影响;采用X-射线衍射(XRD)和扫描电镜(SEM)等方法对细菌作用前后的矿物表面形貌进行分析。[结果] 16S rRNA基因测序结果表明该细菌为柠檬酸杆菌属(Citrobacter sp.),故命名为Citrobacter sp.A11;在Citrobacter sp.A11作用下,0.45 mmol/L As(Ⅴ)在4 d内被还原成As(Ⅲ),2.0 mmol/L S2O32-在6 d内被还原成S2-,1.0 mmol/L Fe(Ⅲ)在3 d内被还原成Fe(Ⅱ),140.0 mg/L NO3-在28 h内被还原成NO2-;经过28 d该细菌的催化作用使得体系中不可溶砷和铁的释放量分别为33.68 μmol/L、51.93 μmol/L;硫酸根的加入使得砷和铁的释放量分别增长了41.04%和34.30%,硝酸根的加入则使砷和铁释放量分别降低了35.07%和53.46%。XRD、SEM-EDS分析表明,细菌作用后的臭葱石表面形貌发生明显改变,并出现细小且分散的溶解性颗粒。[结论] 本次研究从江汉平原高砷沉积物中富集分离得到一株兼性厌氧砷还原细菌Citrobacter sp.A11,能有效还原As(Ⅴ)、S2O32-、NO3-、Fe(Ⅲ);砷还原细菌Citrobacter sp.A11能显著促进臭葱石中砷和铁的溶解和释放,硫酸根离子的存在会促进细菌介导臭葱石中固态砷、铁的释放,而硝酸根离子的存在则对此过程起明显抑制作用。
关键词:砷还原菌硫酸根硝酸根臭葱石江汉平原
Isolation and identification of a novel As-reducing bacterium for the reductive dissolution of scorodite
Xianbin Zhu1, Ziwei Liu1, M.D. Uzzal Hossain1, Xing Zhou1, Xian-Chun Zeng1,2


1. School of Environmental Studies, China University of Geosciences(Wuhan), 430074, Hubei Province, China;
2. State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences(Wuhan), 430074, Hubei Province, China
Received: 10 October 2019; Revised: 22 January 2020; Published online: 9 March 2020
*Corresponding author: Xian-Chun Zeng, Tel:+86-27-67883481. E-mail: xianchun_zeng@hotmail.com.
Foundation item: Supported by the Fund Project: by the National Natural Science Foundation of China (41472257)
Abstract: [Objective] This study aimed to investigate the reductive dissolution of scorodite by an indigenous As-resistant bacterium isolated from the Jianghan plain and the influences of nitrate and sulfate on the mobilization in this microbiological process. [Methods] We used the microbial enrichment technique to isolate a facultative anaerobic arsenate-reducing strain (A11), amplified the 16S rRNA and functional genes (arsenate-reductase gene, thiosulfate reductase gene and nitrate reductase genes) from the bacterial cells, and analyzed arsenate-, ferric iron-, thiosulfate-, and nitrate-reducing activities of this strain. We also examined the abilities of A11 cells to catalyze the mobilization and release of As and Fe from scorodite under anaerobic conditions, and further explored how sulfate and nitrate affected this microbial process. The microbial reduction and dissolution of the scorodite mineral were verified by XRD and SEM-EDS analysis. [Results] Citrobacter sp. A11 completely reduced 0.45 mmol/L As(Ⅴ), 2 mmol/L S2O32-, 1 mmol/L Fe(Ⅲ) and 140 mg/L NO3- in 4 days, 6 days, 3 days, 28 hours, respectively. In the presence of A11 cells, approximately 33.68 μmol/L As(Ⅲ) and 51.93 μmol/L Fe(Ⅱ) were released from the scorodite slurries after 28 days of anaerobic incubations. The presence of sulfate caused 41.04% and 34.30% increases of the A11-catalyzed release of As(Ⅲ) and Fe(Ⅱ) over the course of 28 days. However, the addition of nitrate caused 35.07%, 53.46% decreases of the A11-catalyzed release of As(Ⅲ) and Fe(Ⅱ), respectively. XRD and SEM-EDS observations for the reduced scorodite revealed that the mineral particles were altered dramatically. The particles size of the treated scorodite was much smaller than the control one. [Conclusion] Citrobacter sp. A11 strain has been identified with the ability of arsenate, thiosulfate, ferric iron and nitrate reduction, also can efficiently catalyze the mobilization and release of As and Fe from scorodite under anaerobic conditions, and this process enhanced when sulfate was added to the reactions. However, this process was inhibited when nitrate was added.
Keywords: As-resistant bacteriasulfatenitratescoroditeJianghan plain
地下水高砷污染是全球范围内面临的巨大环境问题,已经有报道超过70多个国家的1.5亿人口暴露在高砷环境中[1-2]。而长期饮用高砷地下水(10–300 μg/L)会出现如皮肤损伤、神经系统并发症、糖尿病、呼吸系统并发症、肝肾功能障碍等疾病[3]。天然过程和人类活动均会导致矿物中固态砷迁移到地下水中[4-5]。
微生物活动介导含砷矿物的溶解和释放是导致水体砷污染重要的因素之一[5-9]。已有文献大量报道了砷还原微生物能够有效促进其从固态矿物砷迁移到水相中[10],Sulfurospirillum barnesii SES-3菌能还原吸附在水铁矿上的固相砷从而导致其释放到水相中[11];Shewanella putrefaciens CN32菌可以有效促进Pb-As jarosite、含砷水铁矿、含砷针铁矿的中固相砷释放[12-14];Bacillus sp. JQ、Desulfitobacterium sp. DJ-3和Exiguobacterium sp. DJ-4这三株菌均能明显促进含砷针铁矿中砷的溶解和释放[15]。此外常见环境因子的大量存在会对微生物介导固相砷的溶解和释放产生一定影响[16-19]。臭葱石(FeAsO4·2H2O)作为一种天然磷铝石矿物,含水的砷酸铁,具有含砷量高、稳定性强和毒性低等优点[20-21],鲜少有研究涉及砷还原菌对臭葱石中固态砷铁的溶解和释放作用,以及环境因子对这一过程的影响。
江汉平原作为典型的高砷地下水研究区域,国内外研究****已从水文地球化学,微生物生态学,微生物分子生物学等众多方向探究了其地下水和沉积物的高砷成因及修复手段[18, 22-24]。江汉平原地下水主要以HCO3-CaMg型为主,富含可溶性的Fe、Mn和P化合物,铵离子浓度较高;沉积物中砷的含量高达11–108 mg/kg,远高于地壳中的平均含量2–5 mg/kg[23, 25]。因其丰富的地球化学特性,有利于研究其土著微生物不同的还原功能特性,溶解和释放固态砷、铁的能力,以及环境因子存在对其释放作用导致的不同响应。目前,已有江汉平原砷循环微生物的研究主要集中在其群落功能鉴定,以及有关砷循环微生物多样性的探讨[18, 22, 26-27]。尚无研究报道江汉平原土著砷还原微生物如何参与臭葱石中固态砷、铁溶解和释放过程,以及此过程中典型环境因子的介导作用。
本研究通过从江汉平原高砷沉积物中获得土著砷还原菌株,了解其不同还原功能特性,分析其介导臭葱石的溶解和释放固态砷的能力,以及探究典型环境因子对此过程的不同影响效果,以加深人们对高砷地下水形成的认识,为砷污染环境提供修复依据。
1 材料和方法 1.1 砷还原菌的富集、分离和纯化 本研究所使用样品为湖北省仙桃市沙湖镇夹河村(北纬30.1°,东经113.6°)钻井深度为90 m的高砷沉积物[22],采样地点如图 1所示。将1.5 g新鲜厌氧保存的沉积物样品加到已高温灭菌且除氧的10.0 mL MM培养基,加入5.0 mmol/L乳酸钠和1.0 mmol/L As(Ⅴ)分别作为体系中的电子供体和受体。将此混合液完全密封且避光于30 ℃的恒温摇床培养。每隔12 h取样检测As(Ⅴ)被还原的情况。当As(Ⅴ)完全转变为As(Ⅲ)后,再抽取1 mL原始富集液转接到与初始富集完全一致的培养基中。待As(Ⅴ)完全还原,则继续转接,往复操作3次,得到砷还原功能的菌液[18],梯度稀释菌液,利用Hungate厌氧滚管技术分离获得纯培养菌株。砷还原菌的16S rRNA基因、砷还原酶基因(arsC)、硫代硫酸盐还原酶基因(phsA)、硝酸盐还原酶基因(nar)分别参考文献[28-30]进行扩增、克隆及鉴定,引物参考表 1。
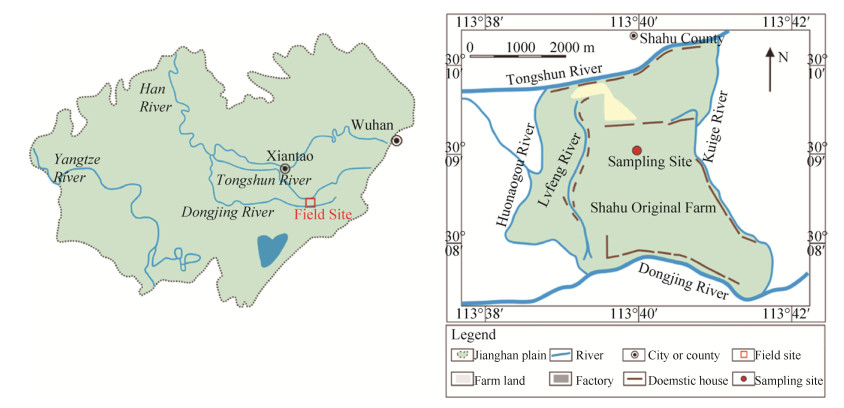 |
| 图 1 研究区及采样点位置示意图 Figure 1 Location of the study area and sampling site for the Jianghan plain sediments. |
| 图选项 |
表 1. 本研究所使用的PCR引物 Table 1. PCR primers used in this study
| Target genes | Sequences of primers(5′→3′) | Reference |
| 16S rRNA | AGAGTTTGATCCTGGCTCAG (Forward) | [28] |
| TACGGCTACCTTGTTACGACTT (Reverse) | ||
| arsC | TCGCGTAATACGCTGGAGAT (Forward) | [28] |
| ACTTTCTCGCCGTCTTCCTT (Reverse) | ||
| narG | TAYGTSGGSCARGARAA (Forward) | [29] |
| TTYTCRTACCABGTBGC (Reverse) | ||
| phsA | AATGTGATCACATT (Forward) | [30] |
| AATGTGACCGACTT (Reverse) |
表选项
1.2 砷还原菌Citrobacter sp. A11还原功能鉴定 探究分离得到的可培养砷还原菌Citrobacter sp. A11对于不同电子受体的利用情况。此砷还原菌是一株兼性厌氧菌,能够在有氧的条件下生长,且其生物量明显多于厌氧环境中。为了获取更多的菌体,首先在有氧的条件下活化培养,MM培养基中加入10.0 mmol/L乳酸钠、20.0 μL维生素、50.0 μL微量元素溶液、并加入1.0 mmol/L砷酸钠溶液(刺激细菌砷相关酶基因的持续表达)。将细菌接种到此MM培养基中,置于37 ℃摇床有氧培养,将生长至对数中后期的细菌,离心(5000 r/min,10 min)后收集菌体。并用预先除氧灭菌的MM培养基洗涤3次后,浓缩至一定浓度备用,分装成等体积按1%的接种量分别接种到不同的还原功能验证体系,同时设置不加细菌的多种对照组。根据不同元素的还原功能,按不同时间连续取悬液,高速离心(10000×g,10 min)采集上清液,检测体系中的As(Ⅴ)、As(Ⅲ)、S2O32–、S2–、NO3–、NO2–、NH4+、Fe(Ⅲ)、Fe(Ⅱ)的含量。其中NO3–还原功能验证体系所用培养基为不加NH4Cl的MM培养基。
1.3 硝酸根/硫酸盐对砷还原菌介导臭葱石中砷铁释放的影响 为研究硝酸盐和硫酸盐对砷还原菌介导的臭葱石中不可溶性砷和铁释放影响设置了4组实验(①臭葱石颗粒悬浊液;②臭葱石颗粒悬浊液,添加细菌和电子供体乳酸钠;③臭葱石颗粒悬浊液,添加细菌、电子供体乳酸钠和硫酸盐;④臭葱石颗粒悬浊液,添加细菌、电子供体乳酸钠和硝酸盐)。臭葱石悬浊液的配制方法为臭葱石研磨过200目筛后,用去离子水反复清洗冷冻干燥备用;称取0.1 g臭葱石粉末,添加到含有50.0 mL的MM培养基(不加NH4Cl)的血清瓶中除氧、灭菌。将培养至对数期的细菌离心(6000 g,10 min),并用MM培养基清洗2次后收集菌体,分装成等体积接种到含50.0 mL MM的血清瓶中,使各个实验组的细菌浓度一致、乳酸钠的浓度为10.0 mmol/L、硝酸钠的浓度为10.0 mmol/L、硫酸盐的浓度为10.0 mmol/L。所有实验组均为两组,避光于30 ℃、120 r/min摇床培养,并于0、1、3、5、7、14 d在手套箱中取悬液,离心(10000×g,5 min)并检测上清液中可溶性砷、铁、NO3–、NO2–、SO42–、乳酸钠的含量。
1.4 矿物物相表征 将1.3不同前处理作用42 d后的矿物样品,离心弃去上清收集粉末,真空冷冻干燥备用。X射线粉末晶体衍射(XRD)用来分析矿物表层原子排布的前后变化,XRD的型号为Scintag X1(CuKα)。其操作过程是:仪器的15 kV,管流40 mA,扫描范围为0–70°,步长为0.01°,扫描速度每步0.05 s。扫描电镜(SEM)分析矿物表面形貌的变化,其型号为Hitachi SU8010。操作过程中,仪器的加速电压为0.1–30 kV,同时联用X射线能谱仪(EDS)分析其元素的组成。
1.5 水相化学成分分析 体系中的可溶性砷用原子荧光光谱仪(AFS-9600,北京海光)检测。可溶性铁的检测用Ferrozine分光光度法检测。体系中NO2–和NH4+的检测方法分别是N-(1-萘基)-乙二胺分光光度法和纳氏试剂分光光度法。NO3–则采用离子色谱法(DX-120,Dionex,USA)检测。SO42–利用铬酸钡分光光度法检测其浓度。乳酸钠采用HPLC-PDA仪器检测:流动相10.0 mmol/L KH2PO4,pH 2.5,柱温30 ℃,洗脱条件为0–21 min时间段,其流速为0.3 mL/min;在21–33 min时间段,其流速为0.8 mL/min;在33–37 min时间段,流速为0.3 mL/min,检测波长206 nm,进样量为10 μL[18, 31]。
2 结果 2.1 一株新的砷还原菌分离鉴定 利用厌氧多轮传代富集方法筛选得到了一株可培养的兼性厌氧菌砷还原菌A11,16S rRNA基因序列分析表明,A11与Citrobacter pasteurii具有最高的相似性,故将这株菌命名为Citrobacter sp. A11。为了进一步了解这株菌的砷还原能力,扩增了这株菌的砷还原酶基因(图 2-A)。测序结果表明,该序列对应的氨基酸序列与Enterobacteriaceae最为接近,其相似性为93.6%。扩增得到的硫代硫酸盐还原酶基因(图 2-B)氨基酸序列则与Citrobacter sp. MH181794的相似度最高,为97%。同样从菌株Citrobacter sp. A11扩增得到了两段不同的硝酸盐还原酶基因(图 2-C),其相似性为13.3%,且来自于两个不同的硝酸盐还原酶亚家族。其中A11-Nar-1与Citrobacter freundii sp. R17的相似性最高,为98.5%,A11-Nar-2则与Salmonella enterica sp. SA20031245的相似性最高,为80.5%。这些不同功能的还原酶基因表明菌株Citrobacter sp. A11存在着多种不同的砷、硫、氮等元素相关信号转导机制,以应对复杂的自然环境。
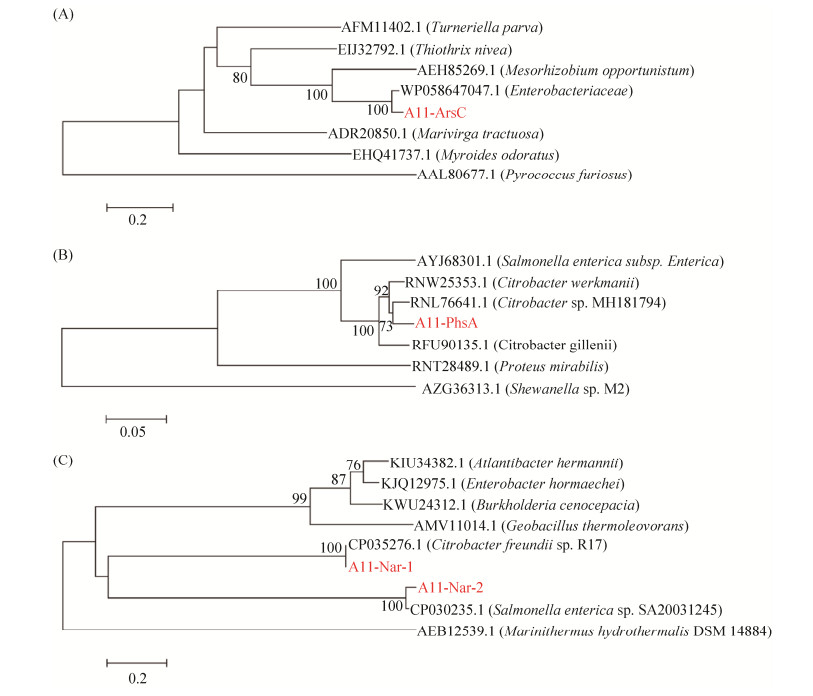 |
| 图 2 Citrobacter sp. A11的砷还原酶(ArsC)基因(A)、硫代硫酸盐还原酶(PhsA)基因(B)、硝酸盐还原酶(Nar)基因(C)进化树分析 Figure 2 Cloning and phylogenetic characterization of the arsenate reductase (ArsC) gene (A), thiosulfate reductase (PhsA) gene (B), nitrate reductase (Nar) genes (C) from Citrobacter sp. A11. The tree was constructed using the neighbor-joining method. Numbers on the branches are bootstrap values based on 1000 replicates. Only the bootstrap values greater than 50% are shown. |
| 图选项 |
2.2 砷、硫代硫酸盐、硝酸盐、铁还原功能鉴定 在厌氧条件下,Citrobacter sp. A11可以利用乳酸钠作为电子供体,分别还原As(Ⅴ)、S2O32–、NO3–、Fe(Ⅲ)。将一定数目的Citrobacter sp. A11接种到含0.45 mmol/L As(Ⅴ)的MM培养基中,结果如图 3-A所示,Citrobacter sp. A11能够在4 d内将0.45 mmol/L As(Ⅴ)完全还原;如图 3-B所示,Citrobacter sp. A11能够在6 d内将2 mmol/L S2O32–完全还原;如图 3-C所示,Citrobacter sp. A11能够在3 d内将1.0 mmol/L柠檬酸铁还原成Fe(Ⅱ)。同样,Citrobacter sp. A11能有效在28 h左右完全将140 mg/L NO3–还原成NO2–(如图 3-D),但其还原NO2–的能力则十分缓慢,在此培养体系30 d才能检测到少量NH4+产生。并如图 3所示,未加细菌的对照组均未能检测到这些电子供体的还原。
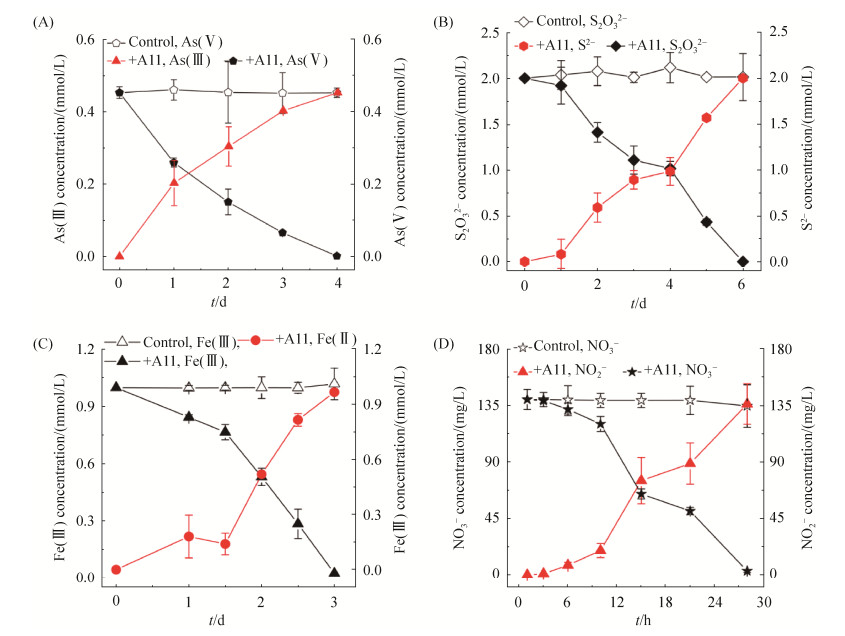 |
| 图 3 厌氧条件下Citrobacter sp. A11对砷As(Ⅴ) (A)、硫代硫酸根S2O32– (B)、铁Fe(Ⅲ) (C)、硝酸根NO3– (D)还原曲线 Figure 3 Arsenate- (A), thiosulfate- (B), ferric iron (C) and nitrate- (D) reducing activities using lactate as the sole electron donor under anaerobic conditions of Citrobacter sp. A11. Each test was repeated three times in parallel, and the results were expressed as "mean standard deviation". |
| 图选项 |
2.3 硝酸根/硫酸盐对砷还原菌介导臭葱石中砷与铁释放的影响 砷还原菌株Citrobacter sp. A11能有效促进臭葱石的溶解与释放,硝酸盐和硫酸盐这两种常见环境因子的加入会对砷还原菌介导的不可溶砷溶解与释放作用产生不同的影响,结果见图 4。在同等水化学条件下,不加砷还原菌的对照组(仅加乳酸钠溶液至MM培养基中)并未能检测到明显的砷释放。这与臭葱石矿物结构有关,它作为一种含水砷酸铁晶体矿物,结构稳定,在室温条件下自发释放砷和铁能力较弱。图 4-A、B表明砷还原菌株Citrobacter sp. A11能有效促进臭葱石中固相砷和铁转变为可溶态砷和铁;在体系中添加硝酸根会出现抑制作用,使得转变成可溶性砷和铁的能力变弱;而在体系中添加硫酸根后,砷和铁的释放量明显升高。由图 4-A可知,加入菌株A11和乳酸钠实验组作用后的第14、21、28天,检测到溶液中的可溶性砷分别为22.02、24.32和33.68 μmol/L;实验体系中额外加入硝酸盐使得可溶性砷释放下降了10.90%、16.90%、35.07%;而额外加入硫酸盐则使得可溶性砷的释放增加了61.58%、118.59%、69.60%。硝酸盐不仅能作为细菌易于利用电子受体之一竞争对As(Ⅴ)的还原作用,而且会抑制细菌中砷还原酶的表达[31]。故硝酸盐的加入能够有效抑制砷还原菌对臭葱石中固态砷的释放作用。硫酸盐作为砷还原菌可利用营养物质加入则会促进其对臭葱石中固态砷的还原、溶解和释放作用。同样矿物自发释放铁的能力也较弱(图 4-B可知),加入菌株和乳酸钠的实验组,在实验的第14、21、28天,检测到可溶性铁分别为48.43、50.22和51.93 μmol/L;而额外加入硝酸盐后,体系中的铁释放含量分别下降了66.94%、58.62%、53.46%;加入硫酸盐的体系则分别增加了9.77%、14.52%、34.30%。这一结果与硝酸盐和硫酸盐对砷释放的结果十分契合,表明了固态砷和铁释放具有较强的耦合性和一致性。这与已有的研究结果相一致:Fan等通过XPS、XAS和μ-XRF研究证实土壤中大部分的砷的氧化与铁的形态转变有关联性[32]。Bennett等研究表明土壤溶液中Fe(Ⅱ)浓度与As浓度存在显著正相关关系(r=0.896,P < 0.001),水淹缺氧条件是引起铁还原溶解进而导致砷释放的关键环节[33]。
 |
| 图 4 硫酸盐和硝酸盐对砷还原菌Citrobacter sp. A11介导的臭葱石中砷(A)、铁(B)的溶解与释放的影响 Figure 4 Effects of nitrate and sulfate on the Citrobacter sp. A11-catalyzed mobilization, reduction and release of insoluble arsenic (A) and iron (B) from the sterilized mineral slurries of scorodite, under strict anaerobic condition. |
| 图选项 |
结合已有研究人员对臭葱石自身的化学溶解进行了探讨[34]。将10.0 g化学反应合成的臭葱石添加至500.0 mL的体系,400–500 r/min,pH 1.15 (±0.05),在50、70和90 ℃这3个温度条件下,作用300 min后,检测到As的释放分别为10、50和130 μmol/L;作用40 d后,As的释放可达100、125和350 μmol/L。而在室温、中性、0.1 g/50 mL (前者为1 g/50 mL)的条件下,砷还原微生物能够在作用的第28天释放34.0 μmol/L As(Ⅲ)。对比结果发现砷还原微生物释放能力远大于高温酸性等人为条件下介导的臭葱石溶解和释放,且释放出的As(Ⅲ)毒性远大于化学自溶的As(Ⅴ)。
2.4 体系中硝酸根、硫酸根和乳酸钠的变化 硝酸盐实验体系中NO3–的变化如图 5-A所示,NO3–能快速还原成NO2–,但并未能监测到NH4+的产生。当体系反应到28 d后,体系中的NO2–才逐渐降低,直到作用的35 d后能产生大概7.11 mmol/L左右的NH4+。这表明砷还原菌A11并不能快速还原NO2–,这可能是因为A11中并没有代谢NO2–的酶。硫酸盐实验体系中SO42–的变化如图 5-B所示,砷还原菌A11并不具有硫酸盐的还原能力,故体系中硫酸盐变化不大,仅降低了1.59 mmol/L,推测硫酸盐可能作为一种营养物质被砷还原菌所利用。作用到42 d对照组和实验组中乳酸钠被利用的情况如图 5-C所示,对照组的乳酸钠并未发生变化,这表明水化学体系中,没有发生氧化还原反应去利用乳酸钠;加入硝酸盐的实验组中,不仅利用乳酸钠作为电子供体去还原含砷矿物中固态砷铁,还需利用额外的乳酸钠还原硝酸盐,故乳酸钠被砷还原菌利用得最多(9.34 mmol/L);而额外加入硫酸盐消耗的乳酸钠(7.85 mmol/L)比仅加入细菌(5.59 mmol/L)的多,又因加入硫酸盐促进了砷还原菌对臭葱石中固态砷的溶解、还原和释放作用。
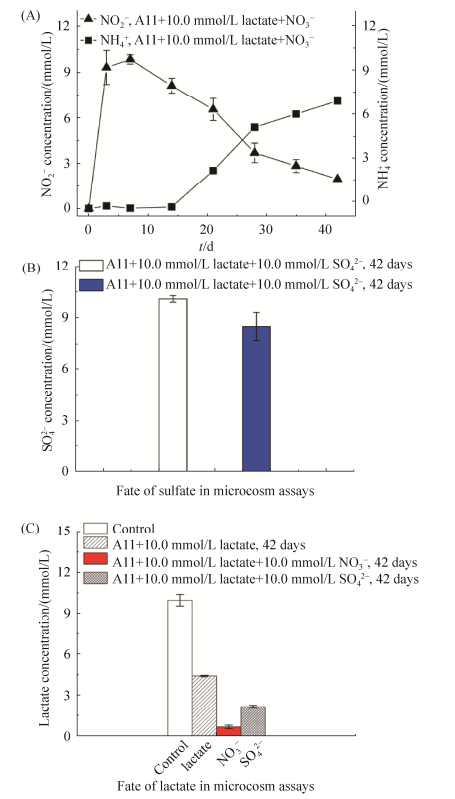 |
| 图 5 体系中额外添加硝酸盐的变化(A)、硫酸盐的变化(B)和不同实验体系中电子供体乳酸钠的变化(C) Figure 5 Fate of nitrate (A), sulfate (B), lactate (C) during the A11-microbial reactions in the sterilized mineral slurries of scorodite, under strict anaerobic condition. |
| 图选项 |
2.5 砷还原菌Citrobacter sp. A11作用产物XRD分析 XRD用来检测臭葱石与砷还原菌作用前后矿物表层原子排布的变化。图 6-A是不同条件下臭葱石与砷还原菌作用前后XRD图谱对比:绿色曲线代表仅加乳酸钠的对照组,黑色为加入细菌作用的实验组,蓝色代表加入硫酸盐的实验组,红色则是加入硝酸盐的实验组。细菌作用后,额外加入硫酸盐的实验组产生了一个新的峰(020),XRD衍射图谱鉴定其成分为蓝铁矿(vivianite,Fe3(PO4)2)。这说明了加入硫酸盐后砷还原菌能够有效促使臭葱石的溶解和释放,并导致含有二价铁的固态物质产生。对比细菌作用前后的XRD图谱,臭葱石主要的2个峰(111,200)的峰高(Hight)从439、454降到211、294;它们的晶面间距(d值,即原子间距)从5.59、3.17变到5.61、3.18;它们的半峰宽(FWHM)则从0.089、0.067变到0.076、0.069。这些结果均表明了砷还原菌能够使得体系中的不可溶矿物形态砷转变为可溶态砷,从而促进了固态含砷矿物的表面溶解,改变了其表层的原子排布结构。而向体系中额外加入10.0 mmol/L硝酸盐时,峰高变化到296、355,同时晶面间距为5.60、3.18,本峰宽为0.082、0.068,表明硝酸盐的存在会抑制细菌介导含砷矿物不可溶砷形态的改变。在体系中额外加入硫酸盐,则会促进细菌对含砷矿物溶解作用,使得固态含砷矿物这种表面溶解作用更加彻底,并能形成了新的物相。
 |
| 图 6 砷还原菌Citrobacter sp. A11作用臭葱石前后矿物XRD图谱的变化 Figure 6 XRD patterns of the scorodite treated by the Citrobacter sp. A11-cells in the presence or absence of 10.0 mmol/L nitrate and sulfate, or without bacterial treatment (blank controls). A: Comparison of XRD patterns of scorodite under different treatment conditions and standard spectra in PDF database; B: Comparison of XRD patterns of scorodite under different treatment conditions under characteristic peak of 020; C: Comparison of XRD patterns of scorodite under different treatment conditions under characteristic peak of 111; D: Comparison of XRD patterns of scorodite under different treatment conditions under characteristic peak of 200. |
| 图选项 |
2.6 砷还原菌Citrobacter sp. A11作用产物SEM-EDS分析 SEM-EDS用来说明砷还原菌株作用于含砷矿物前后表面形貌及元素组成含量的改变。图 7 A–H分别是仅加入乳酸钠作用后的矿物对照组(A、E),加砷还原菌株作用的实验组(B、F),加硫酸盐的实验组(C、G),以及加硝酸盐的实验组(D、H)。比较A–D这四张图的变化发现细菌A11作用后的臭葱石粒径(B–C)明显小于仅加入乳酸钠的臭葱石对照样品(A),这说明了砷还原菌株对矿物形态有明显的溶解作用。微生物作用矿物后,颗粒呈不规则状,黏附在一起,出现了很多细小的块状颗粒,而未处理的臭葱石样品表面则相对光滑。当体系中额外添加硝酸盐,作用后的矿物颗粒明显大于仅加细菌作用的,这也从侧面反映了硝酸盐的加入会抑制固态矿物中砷的溶解和释放。而硫酸盐的加入则明显促进了臭葱石的溶解,使之变成更加细小分散的颗粒。图 7-E–H利用能谱仪说明了细菌作用前后微区成分元素种类和含量的改变。细菌作用前后,微区结构的Fe、As、O这三种元素的成分也发生了一些改变。同样说明了砷还原菌促进了臭葱石的表面溶解,使得其形态发生改变。而且值得注意的是加入硫酸盐的实验组,发现微区矿物形成了新的物相,且能谱仪元素结果与XRD图谱的结果一致。
 |
| 图 7 砷还原菌A11作用矿物前后表面形貌及微区元素组成成分的变化 Figure 7 SEM and SEM-EDS observations of the residuals of scorodite (SEM: A, B, C, D; EDS: E, F, G, H) after 42 days of treatment by the A11 cells in the presence or absence of 10.0 mmol/L nitrate and sulfate, or without bacterial treatment (abiotic controls). E: The control group in the presence of lactate; B, F: The treatment by the A11 cells; C, G: The treatment by the A11 cells in the presence of 10.0 mmol/L sulfate; D, H: The treatment by the A11 cells in the presence of 10.0 mmol/L nitrate. |
| 图选项 |
3 讨论 本次研究从江汉平原典型高砷沉积物中分离和筛选出一株兼性厌氧柠檬酸杆菌Citrobacter sp. A11。首先分析了此细菌能有效还原As(Ⅴ)、NO3–、Fe(Ⅲ)、S2O32–等多种常见电子受体,并成功克隆出其对应的还原酶基因,这一结果说明了极端缺氧的地下高砷环境会促使其土著微生物进化出拥有砷、硫、氮、铁等多种元素不同的代谢功能。接着本研究验证了砷还原菌株Citrobacter sp. A11能有效地促进臭葱石中固态砷的溶解和释放,与Zhu等研究臭葱石的化学自身溶解现象相比,砷还原微生物催化的臭葱石溶解和释放能力显著大于高温强酸等人为条件[34];此外还发现砷还原微生物能有效改变矿物表层原子排布,使其溶解成更多更微小的颗粒。而这与前人的研究结果一致,如丁苏苏[35]发现砷还原菌BH02-C能将臭葱石中固态砷、铁释放,并同时还原溶解态的Fe(Ⅲ)和As(Ⅴ);Guo等发现砷还原菌M17-5和M17-1均能有效促进臭葱石中固态砷和铁的溶解,并释放量为非生物对照组的29–36.2倍[28];Lukasz Prewniak同样认为细菌催化砷还原作用是导致砷污染的主要原因,并提出了砷还原菌如何催化臭葱石中固态砷溶解和还原模型。不少****已从腐殖质、生物炭、AQDS及维生素B等常见有机环境因子对微生物介导土壤中固态砷溶解和释放的影响展开了相关研究[16, 19, 36-37],但针对于无机环境因子对此过程的影响还鲜少有研究涉及。因此本研究针对NO3–和SO42–这两种常见的环境因子[38-39]对砷和铁溶解和释放产生影响展开探讨,发现加入的SO42–会成为砷还原菌可利用的营养物质促进其对臭葱石中固态砷的还原、溶解和释放作用,而加入到体系中的NO3–不仅作为一种能够竞争As(Ⅴ)还原的电子受体,且还能有效抑制细菌中砷还原酶的表达[31],使得砷和铁溶解和释放能力产生一定程度的抑制作用。通过对高砷沉积物中获得的土著砷还原微生物的功能特性及其固相砷的溶解释放作用展开系列研究,有助于我们更深入地了解土著砷还原微生物在地下水中砷迁移转化中发挥着重要的作用,有利于更好地阐明江汉平原高砷地下水的形成机制及影响因素,有益于为高砷污染地下水环境中微生物修复提供更详细的理论依据。
4 结论 (1) 从江汉平原高砷沉积物样品中分离出一株砷还原菌,命名为Citrobacter sp. A11。此砷还原菌株能够在厌氧的条件下有效还原As(Ⅴ)、NO3–、Fe(Ⅲ)、S2O32–。
(2) 砷还原菌A11能有效促进臭葱石中固态砷和铁转化为可溶态砷和铁;在体系中额外添加硫酸盐和硝酸盐均会对柠檬酸杆菌Citrobacter sp. A11介导臭葱石溶解和释放作用产生不同影响效果:体系中添加硫酸盐,会促进砷和铁的释放;而与之相反,添加硝酸盐则会出现一定程度的抑制作用。
(3) XRD和SEM-EDS分析结果表明,砷还原菌A11能明显促进臭葱石表面溶解作用,并改变臭葱石的表层原子排布、表面形貌及微区元素组成,额外添加硫酸盐会促进细菌对臭葱石的改变,而硝酸盐的加入会抑制这种现象的发生。
References
| [1] | Guo HM, Wen DG, Liu ZY, Jia YF, Guo Q. A review of high arsenic groundwater in Mainland and Taiwan, China:distribution, characteristics and geochemical processes. Applied Geochemistry, 2014, 41: 196-217. DOI:10.1016/j.apgeochem.2013.12.016 |
| [2] | Lièvremont D, Bertin PN, Lett MC. Arsenic in contaminated waters:biogeochemical cycle, microbial metabolism and biotreatment processes. Biochimie, 2009, 91(10): 1229-1237. DOI:10.1016/j.biochi.2009.06.016 |
| [3] | Li G, Sun GX, Williams PN, Nunes L, Zhu YG. Inorganic arsenic in Chinese food and its cancer risk. Environment International, 2011, 37(7): 1219-1225. DOI:10.1016/j.envint.2011.05.007 |
| [4] | Wu Y, Zhou XY, Lei M, Yang J, Ma J, Qiao PW, Chen TB. Migration and transformation of arsenic:contamination control and remediation in realgar mining areas. Applied Geochemistry, 2017, 77: 44-51. DOI:10.1016/j.apgeochem.2016.05.012 |
| [5] | Biswas A, Majumder S, Neidhardt H, Halder D, Bhowmick S, Mukherjee-Goswami A, Kundu A, Saha D, Berner Z, Chatterjee D. Groundwater chemistry and redox processes:depth dependent arsenic release mechanism. Applied Geochemistry, 2011, 26(4): 516-525. DOI:10.1016/j.apgeochem.2011.01.010 |
| [6] | DeLemos JL, Bostick BC, Renshaw CE, Stürup S, Feng XH. Landfill-stimulated iron reduction and arsenic release at the coakley superfund site (NH). Environmental Science & Technology, 2006, 40(1): 67-73. |
| [7] | Islam FS, Gault AG, Boothman C, Polya DA, Charnock JM, Debashis C, Lloyd JR. Role of metal-reducing bacteria in arsenic release from Bengal delta sediments. Nature, 2004, 430(6995): 68-71. DOI:10.1038/nature02638 |
| [8] | Mumford AC, Barringer JL, Benzel WM, Reilly PA, Young LY. Microbial transformations of arsenic:mobilization from glauconitic sediments to water. Water Research, 2012, 46(9): 2859-2868. DOI:10.1016/j.watres.2012.02.044 |
| [9] | Oremland RS, Stolz JF. Arsenic, microbes and contaminated aquifers. Trends in Microbiology, 2005, 13(2): 45-49. DOI:10.1016/j.tim.2004.12.002 |
| [10] | Yamamura S, Amachi S. Microbiology of inorganic arsenic:from metabolism to bioremediation. Journal of Bioscience and Bioengineering, 2014, 118(1): 1-9. DOI:10.1016/j.jbiosc.2013.12.011 |
| [11] | Zobrist J, Dowdle PR, Davis JA, Oremland RS. Mobilization of arsenite by dissimilatory reduction of adsorbed arsenate. Environmental Science & Technology, 2000, 34(22): 4747-4753. |
| [12] | Huang JH, Voegelin A, Pombo SA, Lazzaro A, Zeyer J, Kretzschmar R. Influence of arsenate adsorption to ferrihydrite, goethite, and boehmite on the kinetics of arsenate reduction by shewanella putrefaciens strain CN-32. Environmental Science & Technology, 2011, 45(18): 7701-7709. |
| [13] | Smeaton CM, Walshe GE, Smith AML, Hudson-Edwards KA, Dubbin WE, Wright K, Beale AM, Fryer BJ, Weisener CG. Simultaneous release of Fe and As during the reductive dissolution of Pb-As jarosite by shewanella putrefaciens CN32. Environmental Science & Technology, 2012, 46(23): 12823-12831. |
| [14] | Tufano KJ, Reyes C, Saltikov CW, Fendorf S. Reductive processes controlling arsenic retention:revealing the relative importance of iron and arsenic reduction. Environmental Science & Technology, 2008, 42(22): 8283-8289. |
| [15] | Cai XL, Zhang ZN, Yin NY, Du HL, Li ZJ, Cui YS. Comparison of arsenate reduction and release by three As(Ⅴ)-reducing bacteria isolated from arsenic-contaminated soil of Inner Mongolia, China. Chemosphere, 2016, 161: 200-207. DOI:10.1016/j.chemosphere.2016.06.102 |
| [16] | Qiao JT, Li XM, Li FB, Liu TX, Young LY, Huang WL, Sun K, Tong H, Hu M. Humic substances facilitate arsenic reduction and release in flooded paddy soil. Environmental Science & Technology, 2019, 53(9): 5034-5042. |
| [17] | Kulkarni HV, Mladenov N, McKnight DM, Zheng Y, Kirk MF, Nemergut DR. Dissolved fulvic acids from a high arsenic aquifer shuttle electrons to enhance microbial iron reduction. The Science of the Total Environment, 2018, 615: 1390-1395. DOI:10.1016/j.scitotenv.2017.09.164 |
| [18] | Wang JN, Zeng XC, Zhu XB, Chen XM, Zeng X, Mu Y, Yang Y, Wang YX. Sulfate enhances the dissimilatory arsenate-respiring prokaryotes-mediated mobilization, reduction and release of insoluble arsenic and iron from the arsenic-rich sediments into groundwater. Journal of Hazardous Materials, 2017, 339: 409-417. DOI:10.1016/j.jhazmat.2017.06.052 |
| [19] | Yamamura S, Sudo T, Watanabe M, Tsuboi S, Soda S, Ike M, Amachi S. Effect of extracellular electron shuttles on arsenic-mobilizing activities in soil microbial communities. Journal of Hazardous Materials, 2018, 342: 571-578. DOI:10.1016/j.jhazmat.2017.08.071 |
| [20] | Drewniak L, Styczek A, Majder-Lopatka M, Sklodowska A. Bacteria, hypertolerant to arsenic in the rocks of an ancient gold mine, and their potential role in dissemination of arsenic pollution. Environmental Pollution, 2008, 156(3): 1069-1074. DOI:10.1016/j.envpol.2008.04.019 |
| [21] | Jahromi FG, Ghahreman A. In-situ oxidative arsenic precipitation as scorodite during carbon catalyzed enargite leaching process. Journal of Hazardous Materials, 2018, 360: 631-638. DOI:10.1016/j.jhazmat.2018.08.019 |
| [22] | Chen XM, Zeng XC, Wang JN, Deng YM, Ma T, E G, Mu Y, Yang Y, Li H, Wang YX. Microbial communities involved in arsenic mobilization and release from the deep sediments into groundwater in Jianghan plain, Central China. The Science of the Total Environment, 2017, 579: 989-999. DOI:10.1016/j.scitotenv.2016.11.024 |
| [23] | Gan YQ, Wang YX, Duan YH, Deng YM, Guo XX, Ding XF. Hydrogeochemistry and arsenic contamination of groundwater in the Jianghan Plain, central China. Journal of Geochemical Exploration, 2014, 138: 81-93. DOI:10.1016/j.gexplo.2013.12.013 |
| [24] | Zhou Y, Wang YX, Li YL, Zwahlen F, Boillat J. Hydrogeochemical characteristics of central Jianghan Plain, China. Environmental Earth Sciences, 2013, 68(3): 765-778. DOI:10.1007/s12665-012-1778-9 |
| [25] | Duan YH, Gan YQ, Wang YX, Deng YM, Guo XX, Dong CJ. Temporal variation of groundwater level and arsenic concentration at Jianghan Plain, central China. Journal of Geochemical Exploration, 2015, 149: 106-119. DOI:10.1016/j.gexplo.2014.12.001 |
| [26] | Gao J, Zheng TL, Deng YM, Jiang HC. Indigenous iron-reducing bacteria and their impacts on arsenic release in arsenic-affected aquifer in Jianghan plain. Earth Science, 2017, 42(5): 716-726. (in Chinese) 高杰, 郑天亮, 邓娅敏, 蒋宏忱. 江汉平原高砷地下水原位微生物的铁还原及其对砷释放的影响. 地球科学, 2017, 42(5): 716-726. |
| [27] | Li HM, Deng YM, Luo LW, Wang YX, Duan YH, Dong CJ, Gan YQ. Geochemistry of high arsenic shallow aquifers sediment of the Jianghan Plain. Geological Science and Technology Information, 2015, 34(3): 178-184. (in Chinese) 李红梅, 邓娅敏, 罗莉威, 王焰新, 段艳华, 董创举, 甘义群. 江汉平原高砷含水层沉积物地球化学特征. 地质科技情报, 2015, 34(3): 178-184. DOI:10.3969/j.issn.1009-6248.2015.03.019 |
| [28] | Guo HM, Liu ZY, Ding SS, Hao CB, Xiu W, Hou WG. Arsenate reduction and mobilization in the presence of indigenous aerobic bacteria obtained from high arsenic aquifers of the Hetao basin, Inner Mongolia. Environmental Pollution, 2015, 203: 50-59. DOI:10.1016/j.envpol.2015.03.034 |
| [29] | Li S, Li XM, Li FB. Effect of Fe(Ⅱ) on denitrification and associated functional microbial communities. China Environmental Science, 2018, 38(1): 263-274. (in Chinese) 李爽, 李晓敏, 李芳柏. Fe(Ⅱ)对反硝化过程及其功能微生物群落的影响. 中国环境科学, 2018, 38(1): 263-274. DOI:10.3969/j.issn.1000-6923.2018.01.030 |
| [30] | Heinzinger NK, Fujimoto SY, Clark MA, Moreno MS, Barrett EL. Sequence analysis of the phs operon in Salmonella typhimurium and the contribution of thiosulfate reduction to anaerobic energy metabolism. Journal of Bacteriology, 1995, 177(10): 2813-2820. DOI:10.1128/JB.177.10.2813-2820.1995 |
| [31] | Zhu XB, Zeng XC, Chen XM, Wu WW, Wang YX. Inhibitory effect of nitrate/nitrite on the microbial reductive dissolution of arsenic and iron from soils into pore water. Ecotoxicology, 2019, 28(5): 528-538. DOI:10.1007/s10646-019-02050-0 |
| [32] | Fan JX, Wang YJ, Liu C, Wang LH, Yang K, Zhou DM, Li W, Sparks DL. Effect of iron oxide reductive dissolution on the transformation and immobilization of arsenic in soils:new insights from X-ray photoelectron and X-ray absorption spectroscopy. Journal of Hazardous Materials, 2014, 279: 212-219. DOI:10.1016/j.jhazmat.2014.06.079 |
| [33] | Bennett WW, Teasdale PR, Panther JG, Welsh DT, Zhao HJ, Jolley DF. Investigating arsenic speciation and mobilization in sediments with DGT and DET:a mesocosm evaluation of oxic-anoxic transitions. Environmental Science & Technology, 2012, 46(7): 3981-3989. |
| [34] | Zhu XY, Nordstrom DK, McCleskey RB, Wang RC, Lu XC, Li SL, Teng HH. On the thermodynamics and kinetics of scorodite dissolution. Geochimica et Cosmochimica Acta, 2019, 265: 468-477. DOI:10.1016/j.gca.2019.09.012 |
| [35] | 丁苏苏.厌氧土著砷还原菌的特性及其对砷和铁迁移转化的影响.中国地质大学(北京)硕士学位论文, 2016. http://cdmd.cnki.com.cn/Article/CDMD-11415-1016184520.htm |
| [36] | Qiao JT, Li XM, Hu M, Li FB, Young LY, Sun WM, Huang WL, Cui JH. Transcriptional activity of arsenic-reducing bacteria and genes regulated by lactate and biochar during arsenic transformation in flooded paddy soil. Environmental Science & Technology, 2018, 52(1): 61-70. |
| [37] | Chen Z, Wang YP, Jiang XL, Fu D, Xia D, Wang HT, Dong GW, Li QB. Dual roles of AQDS as electron shuttles for microbes and dissolved organic matter involved in arsenic and iron mobilization in the arsenic-rich sediment. The Science of the Total Environment, 2017, 574: 1684-1694. DOI:10.1016/j.scitotenv.2016.09.006 |
| [38] | Luo ZB, Hu SY, Chen DJ, Zhu B. From production to consumption:a coupled human-environmental nitrogen flow analysis in China. Environmental Science & Technology, 2018, 52(4): 2025-2035. |
| [39] | Hao TW, Xiang PY, Mackey HR, Chi K, Lu H, Chui HK, van Loosdrecht MCM, Chen GH. A review of biological sulfate conversions in wastewater treatment. Water Research, 2014, 65: 1-21. DOI:10.1016/j.watres.2014.06.043 |
