董新燕, 刘雪, 刘曼妮, 张翔凌, 王国庆


四川大学华西公共卫生学院/四川大学华西第四医院, 四川 成都 610041
收稿日期:2019-09-09;修回日期:2019-10-29;网络出版日期:2019-11-21
基金项目:四川省科技厅重点研发项目(2019YFS0304)
*通信作者:王国庆。E-mail:huaxiwgq@163.com.
摘要:肠道微生物在平衡健康与疾病的过程中起着重要作用。嗜粘蛋白阿克曼菌(Akkermansia muciniphila)是肠道微生物中的一种,其在降解肠道粘蛋白方面的特性使其成为肠腔与宿主细胞黏膜界面的关键生物。嗜粘蛋白阿克曼菌与肥胖、糖尿病、心血管代谢疾病和低度炎症呈负相关。口服嗜粘蛋白阿克曼菌可改善小鼠代谢疾病的相关症状,嗜粘蛋白阿克曼菌有望成为治疗2型糖尿病和肥胖的候选药物。本综述通过总结现有关于嗜粘蛋白阿克曼菌在糖尿病和肥胖症中发挥作用的研究,指出嗜粘蛋白阿克曼菌调节宿主和肠道微生物群之间相互作用可能存在的机制,为嗜粘蛋白阿克曼菌的进一步研究和糖尿病的新药研发提供思路。
关键词:嗜粘蛋白阿克曼菌糖尿病肥胖
Role of Akkermansia muciniphila in diabetes and obesity
Xinyan Dong, Xue Liu, Manni Liu, Xiangling Zhang, Guoqing Wang


West China School of Public Health and West China Fourth Hospital, Sichuan University, Chengdu 610041, Sichuan Province, China
Received: 9 September 2019; Revised: 29 October 2019; Published online: 21 November 2019
*Corresponding author: Guoqing Wang, E-mail: huaxiwgq@163.com.
Foundation item: Supported by the Key Research and Development Projects of Science and Technology Department of Sichuan Province (2019YFS0304)
Abstract: Gut microbiota plays a significant role in the balance between health and disease. Akkermansia muciniphila is one of the intestinal bacteria and its specialization in mucin degradation makes it a key organism at the mucosal interface between the lumen and host cells. A. muciniphila is found inversely associated with obesity, diabetes, cardiometabolic diseases and low-grade inflammation. Oral administration of A. muciniphila reduces the symptoms of metabolic disease in mice. Therefore, A. muciniphila is a promising candidate for the treatment of diabetes and obesity. Here, we summarize the existing data on A. muciniphila and its role in diabetes and obesity, to provide insight into the intricate mechanisms of A. muciniphila regulation of the cross-talk between the host and gut microbiota, so as to provide ideas for further research on A. muciniphila bacteria and the development of new drugs for diabetes.
Keywords: Akkermansia muciniphiladiabetesobesity
嗜粘蛋白阿克曼菌(Akkermansia muciniphila)是一种粘蛋白分解细菌,它栖息在人类和许多其他动物的肠道中[1]。菌株MucT于2004年由Derrien分离,为卵圆形,革兰阴性的厌氧菌[2]。作为在粪便中发现的疣微菌门的代表,嗜粘蛋白阿克曼菌能以肠上皮表面的肠黏液作为其唯一的碳源、氮源和生长能量来源。在成长的不同阶段,人体肠道中都有嗜粘蛋白阿克曼菌定植。婴儿时期,嗜粘蛋白阿克曼菌可作为肠道菌群生长状况和多样性的标志物[3],从生命早期到成年的过程中,嗜粘蛋白阿克曼菌的数量显著增加[4]。
人体的肠道表面覆盖着一层黏液层,它可以保护肠上皮细胞,使其免受潜在病原微生物和毒物的入侵。黏液层的主要成分是由肠上皮的杯状细胞所分泌的粘蛋白,这些粘蛋白以蛋白质为骨架,连接了多种多样的糖链[5]。对于共生的微生物来说,黏液层可以提供其生存生长所需的营养物质[6],但并不是所有附着在黏液层的细菌都具有分解粘蛋白的能力。作为粘蛋白分解细菌,嗜粘蛋白阿克曼菌蛋白组的预测结果显示,有11% (66种)的蛋白质参与粘蛋白分解过程。粘蛋白被分解后产生大量的小分子代谢产物,这些小分子对机体代谢系统产生积极影响[7]。嗜粘蛋白阿克曼菌的黏液层附着和粘蛋白分解的特性可能是其在健康方面发挥重要作用的主要原因。
近年来,一些流行病学和动物实验的研究都表明嗜粘蛋白阿克曼菌在调节代谢紊乱中发挥着重要作用,包括肥胖、糖尿病、肝脏疾病和心血管疾病[8-10]。鉴于上述的研究发现,有****指出嗜粘蛋白阿克曼菌有望成为继乳酸菌、双歧杆菌之后的下一代的益生菌[11]。许多研究观察到嗜粘蛋白阿克曼菌与肥胖和糖尿病存在联系,相比于正常糖耐量的人群,糖尿病前期的病人粪便样本嗜粘蛋白阿克曼菌丰度较低,提示了二者可能存在相关关系[12]。在动物研究中,研究者发现高脂饮食小鼠和瘦素缺乏小鼠的粪便中嗜粘蛋白阿克曼菌含量均非常显著地(分别为100倍和3300倍)低于所对应的对照组[13]。然而,嗜粘蛋白阿克曼菌与宿主作用的确切信号通路仍需要进一步的研究,本文综述了嗜粘蛋白阿克曼菌在糖尿病和肥胖中发挥作用的最新研究,分析探讨其作用机制,为嗜粘蛋白阿克曼菌的深入研究、糖尿病的预防和治疗提供思路。
1 提升肠道的屏障功能 肠道屏障是人体中最广泛和重要的屏障之一,由共生的微生物、肠上皮细胞和黏液层构成,将外界环境(肠腔内容物)和人体分隔开来[14]。屏障的主体部分是肠上皮细胞层,在防止病原入侵方面起到重要的物理屏障作用。细胞间的连接是肠上皮细胞的重要功能部分,细胞间的连接分为缝隙连接、桥粒、贴壁连接和紧密连接[15]。其中,紧密连接由富含放线菌素的刷状边界和多糖-蛋白质复合物组成,也称为闭锁小带,是肠上皮细胞屏障功能的重要组成部分。这些复合物由大约35种不同的蛋白质组成,在细胞周围形成环状的连续带状结构,位于侧膜和顶膜的边缘[16]。肠道通透性是描述肠屏障功能的可测量指标,正常的肠道通透性被定义为在没有中毒、炎症或肠道功能受损迹象的健康个体中发现的稳定的通透性[14]。细胞间紧密连接的打开会增加肠道通透性,允许微生物、微生物产物和外来抗原进入粘膜和毛细血管,这些外源物质的入侵会导致炎症相关因子的分泌并激活免疫系统(图 1)。研究发现许多疾病包括代谢疾病均与肠道屏障和肠道通透性的改变有关[17-19]。
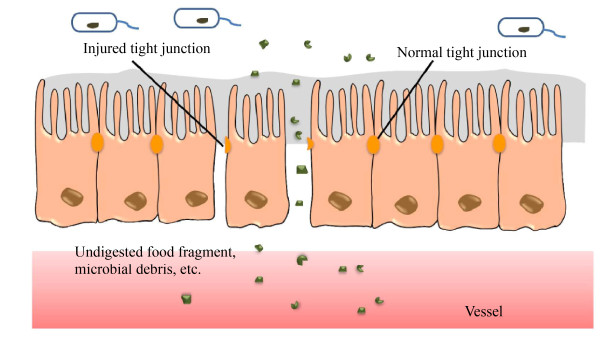 |
| 图 1 肠道通透性增加示意图 Figure 1 Schematic diagram of increased intestinal permeability. |
| 图选项 |
在健康人的肠道中,嗜粘蛋白阿克曼菌含量为3%-5%,它在调节肠道屏障功能、机体自身稳态和代谢方面发挥了重要作用[1]。Chelakkot等的研究发现在高脂饮食诱导的糖尿病小鼠中,给予嗜粘蛋白阿克曼菌产生的细胞外囊泡(A. muciniphila-derived extracellular vesicles,AmEVs)可增强肠上皮紧密连接的功能,减少体重的增加,改善葡萄糖耐量;AmEVs可以使脂多糖(lipopolysaccharide,LPS)干预的单层Caco-2细胞的跨膜电阻恢复至正常水平,但大肠杆菌产生的细胞外囊泡并没有这样的作用[20]。2017年,研究人员鉴定出嗜粘蛋白阿克曼菌MucT菌株产生的一种高丰度的外膜类菌毛样结构蛋白,发现该蛋白可直接参与免疫调节,并可增强跨肠上皮运输的阻力[21]。Reunanen等采用体外细胞研究表明,嗜粘蛋白阿克曼菌能够黏附在肠上皮细胞上,并增强肠细胞单层的完整性,这提示嗜粘蛋白阿克曼菌可能具有修复受损肠道屏障的能力[22]。肠道屏障功能受损这一机制不仅与2型糖尿病的发生发展相关,并且同1型糖尿病也有一定的关系,1型糖尿病的潜在机制涉及自身免疫系统对胰岛β细胞的攻击和破坏,研究发现,患有1型糖尿病的儿童患者中肠道通透性增加[23]。嗜粘蛋白阿克曼菌的干预可以延迟非肥胖性糖尿病小鼠的病情发展,抑制胰岛Toll受体的表达和自身免疫反应,促进小鼠肠上皮杯状细胞分泌黏液,降低隐窝深度。其中一个可能的相关机制是嗜粘蛋白阿克曼菌可以增强肠道屏障的局部作用,通过刺激黏液的产生增厚黏液层,维持肠道内微生物群与宿主的空间隔离,这种隔离可以降低免疫反应的水平,从而减轻自身免疫[24]。嗜粘蛋白阿克曼菌与肠上皮细胞间的相互作用是其发挥作用的重要环节,目前研究多集中在菌体对体外细胞模型相关指标的改善,对于具体发挥功能的菌体结构或代谢物仍需进一步的探索。
2 调节内源性大麻素系统 内源性大麻素系统(endocannabinoid system,ECS)由内源性大麻素和大麻素受体蛋白组成。内源性大麻素是一类内源性脂质,可以作为配体与大麻素受体结合。内源性大麻素为逆行性神经递质,即在突触后释放,然后以逆行信使的方式作用于突触前的受体。常见的活性较强的内源性大麻素有N-花生四烯酰乙醇胺(N-arachidonoylethanolamide,AEA)和2-花生四烯酰甘油(2-arachidonoylglycerol,2-AG),除上述两种配体之外,一些结构与之相似的化学物质同样可以在ECS中发挥一定的作用,如2-palmitoylglycerol (2-PG)和2-oleoylglycerol (2-OG)。大麻素受体蛋白在哺乳动物中枢神经系统(包括大脑)、周围神经系统和组织细胞中均有一定的表达,两个已经被确定的大麻素受体蛋白分别为CB1 (cannabinoid receptor 1,CB1)和CB2 (cannabinoid receptor 2,CB2),二者均为G蛋白偶联受体。研究表明,内源性大麻素系统的失衡参与了LPS的水平紊乱、肠道通透性增加、肠道的慢性炎症水平加剧以及肠道菌群失调的过程[25]。有****指出,下调CB1受体的表达是一种很有前途的治疗肥胖和肥胖引发的2型糖尿病的方法[26]。
肠道通透性的增加导致革兰阴性细菌成分从肠道进入体内,血浆LPS水平的增加,引起代谢性内毒素血症,促进肥胖和2型糖尿病患者炎症和胰岛素抵抗的发生。一方面,LPS通过与Toll样受体4 (Toll-like receptor 4,TLR4)及其共受体结合,引发级联反应,最终导致促炎分子的释放,干扰葡萄糖和胰岛素代谢的调节。另一方面,LPS会导致脂肪组织内的巨噬细胞内源性大麻素特别是AEA的大量生成,从而加剧内脏脂肪堆积、血糖升高和胰岛素抵抗[27]。以嗜粘蛋白阿克曼菌干预高脂饮食喂养的小鼠,发现其肠道屏障功能改善,2-AG、2-OG、2-PG水平升高,代谢性内毒素血症水平降低[13],尽管肠道屏障功能的提升和因嗜粘蛋白阿克曼菌干预而产生的相关生物活性脂质之间的作用机制并不清楚,但这一结果提示了内源性大麻素系统和屏障功能的联系。16S rRNA宏基因组测序显示,在CB1受体被阻断的小鼠的粪便中,嗜粘蛋白阿克曼菌的相对丰富度显著增加[28]。在饮食诱导肥胖的模型小鼠中阻断CB1受体,可以降低炎症因子和血浆LPS水平,降低肠道通透性,改善高血糖相关症状和提高胰岛素敏感性[28]。研究证实了嗜粘蛋白阿克曼菌与内源性大麻素系统之间的相关性,但生物活性水平的改变是导致代谢改善的直接原因还是通路中的一环仍需要进一步的证实。
3 产生短链脂肪酸 短链脂肪酸(short chain fatty acids,SCFAs)是在能够影响宿主代谢的细菌代谢物里被研究较多的一类物质,又称为挥发性脂肪酸(volatile fatty acids,VFAs)。SCFAs是一类碳原子少于6个的脂肪酸,是人体肠道细菌代谢的主要终产物。可溶性膳食纤维,如低聚半乳糖和低聚果糖,通过肠道菌群的发酵可生成醋酸盐(acetate)、丙酸盐(propionate)和丁酸盐(butyrate),是三种最常见的SCFAs。SCFAs被吸收进入血液循环,一方面可以作为肠道细胞的能量来源和物质合成基质,另一方面可以作为信号分子,与受体结合后,激活下游通路,具有调节宿主糖脂代谢和调节胰岛素敏感性的作用[29]。在大型人群队列中进行的微生物组学研究显示,粪便中丁酸盐含量较多的受试者对胰岛素更加敏感,而丙酸盐产生或摄取异常的受试者2型糖尿病的发病概率增加[30]。
已有****运用代谢组学的研究方法在分子水平验证了嗜粘蛋白阿克曼菌的粘蛋白分解特性和产丙酸盐、丁酸盐的能力[31]。Belzer等将嗜粘蛋白阿克曼菌与几种常见的不分解粘蛋白且栖息于黏液层的细菌Anaerostipes caccae、Eubacterium hallii和Faecalibacterium prausnitzii在体外进行共培养后,发现由嗜粘蛋白阿克曼菌分解黏液多糖产生的醋酸盐等可以被上述3种细菌通过丁酰辅酶A转移酶途径合成丁酸盐类。此外,嗜粘蛋白阿克曼菌可以分解岩藻糖产生1, 2-丙二醇,随后被E. hallii分解为丙酸盐[32]。Chia等通过对细菌转录水平的研究发现嗜粘蛋白阿克曼菌与产丁酸细菌Anaerostipes caccae在物质利用层面存在一定的关系,当将两种细菌进行共培养时,嗜粘蛋白阿克曼菌的黏液分解酶的表达量增加,表明嗜粘蛋白阿克曼菌是黏膜生境中的关键生物[33]。SCFAs的产生是多种细菌共同作用的结果,上述研究证实嗜粘蛋白阿克曼菌分解粘蛋白的产物可以作为其他产SCFAs细菌的原料,提示嗜粘蛋白阿克曼菌的丰度与SCFAs的丰度有一定的正相关关系,嗜粘蛋白阿克曼菌对粘蛋白的分解可能是SCFAs产生过程中的关键一步。
4 降低炎症水平 在传统定义中,炎症是指组织在应对损伤时产生的免疫反应,主要表现为肿胀、发红、疼痛和发热。慢性低度炎症(chronic low-grade inflammation)与传统炎症存在相似的分子机制和信号通路,主要表现为血液中炎性细胞因子如α肿瘤坏死因子(tumor necrosis factor α,TNF-α)、C反应蛋白(C-reactive protein,CRP)和白细胞介素6 (interleukin-6,IL-6)出现较低水平(通常2-3倍)的增加,是肥胖和2型糖尿病的共同特征[34]。细菌的LPS可以作为慢性低度炎症的触发因子,血浆LPS水平的增加会使炎症反应调节异常,引发体重的增加,降低胰岛素敏感性[35]。TLR4是LPS的受体之一,在先天性免疫中起重要作用。刺激TLR4会激活炎症前通路,诱导多种细胞因子的表达。炎症通路在肥胖动物和人类组织中被激活,在肥胖相关的胰岛素抵抗中发挥重要作用[36]。
目前已经有大量的研究证实嗜粘蛋白阿克曼菌的抗炎作用,在高脂饮食的干预下,小鼠的炎症水平与粪便中嗜粘蛋白阿克曼菌的含量呈负相关关系[9]。Zhao等的研究发现,对正常饲料饲喂的小鼠灌胃嗜粘蛋白阿克曼菌,其血浆中与LPS结合并帮助其转移至TLR4受体复合物的LBP (LPS-binding protein,LPS结合蛋白)水平降低,同时,抗炎因子如α-生育酚和β-谷甾醇的水平升高[37]。嗜粘蛋白阿克曼菌的干预可以降低2型糖尿病模型大鼠的炎症水平,表现为血清LPS、TNF-α水平的降低[38]。最新的研究发现,补充嗜粘蛋白阿克曼菌可以降低小鼠衰老过程中炎症因子水平[39]。研究并不仅限于嗜粘蛋白阿克曼菌的完整菌体,科学家开始关注该菌发挥健康促进作用的细菌结构成分。Ashrafian等的研究发现,嗜粘蛋白阿克曼菌的外膜囊泡蛋白可以在体外降低Caco-2细胞TLR4表达,并且这种效应与剂量无关[40]。这可能与外膜囊泡蛋白与细胞之间的作用机制相关,Caco-2细胞可能对嗜粘蛋白阿克曼菌的外膜囊泡蛋白具有一定的耐受,蛋白对TLR4受体表达进行调节的机制需要进一步的研究。
5 展望 嗜粘蛋白阿克曼菌在糖尿病中发挥了一定的作用已经被证实,但嗜粘蛋白阿克曼菌干预和代谢相关指标改善之间的确切机制仍不明朗,仍需进一步的探索。近来在人体实验中,巴氏灭活的菌体相较于活菌在改善代谢方面展现了更为卓越的作用[41],我们认为产生这种差异的原因可能与其发挥作用的机制紧密相关,可以将巴氏灭活对菌体蛋白活性的改变作为突破口,通过原核表达系统对含量较高的关键蛋白进行逐一研究,进而探明嗜粘蛋白阿克曼菌与机体作用的机制。此外,目前的菌体干预研究很少关注胃对菌体的消化作用,胃酸、胃蛋白酶对菌体的消解与其发挥功能间的关系需要综合细胞实验和动物实验进行探讨。
嗜粘蛋白阿克曼菌对肠道屏障的保护功能可能是其发挥作用的关键一步,屏障功能的提升可以减少肠道内LPS的入血,使低度炎症的水平降低,从而调节机体代谢情况,但嗜粘蛋白阿克曼菌作用于肠上皮细胞的分子机制仍需进一步的探索。机制研究是应用研究的基础,但值得注意的是,由于各机制之间相互作用的复杂性,需要研究者更广泛地关注变化之中的因果关系,找到其中的关键通路,为进一步的应用研究提供思路。
References
| [1] | Belzer C, de Vos WM. Microbes inside-from diversity to function:the case of Akkermansia. The ISME Journal Volume, 2012, 6(8): 1449-1458. DOI:10.1038/ismej.2012.6 |
| [2] | Derrien M, Vaughan EE, Plugge CM, de Vos WM. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(5): 1469-1476. DOI:10.1099/ijs.0.02873-0 |
| [3] | Grze?kowiak L, Gr?nlund MM, Beckmann C, Salminen S, von Berg A, Isolauri E. The impact of perinatal probiotic intervention on gut microbiota:double-blind placebo-controlled trials in Finland and Germany. Anaerobe, 2012, 18(1): 7-13. DOI:10.1016/j.anaerobe.2011.09.006 |
| [4] | Derrien M, Collado MC, Ben-Amor K, Salminen S, de Vos WM. The Mucin degrader Akkermansia muciniphila is an abundant resident of the human intestinal tract. Applied and Environmental Microbiology, 2008, 74(5): 1646-1648. DOI:10.1128/AEM.01226-07 |
| [5] | Johansson MEV, Larsson JMH, Hansson GC. The two mucus layers of colon are organized by the MUC2 mucin, whereas the outer layer is a legislator of host-microbial interactions. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(S1): 4659-4665. |
| [6] | Sicard JF, Le Bihan G, Vogeleer P, Jacques M, Harel J. Interactions of intestinal bacteria with components of the intestinal mucus. Frontiers in Cellular and Infection Microbiology, 2017, 7: 387. DOI:10.3389/fcimb.2017.00387 |
| [7] | van Passel MWJ, Kant R, Zoetendal EG, Plugge CM, Derrien M, Malfatti SA, Chain PSG, Woyke T, Palva A, de Vos WM, Smidt H. The genome of Akkermansia muciniphila, a dedicated intestinal mucin degrader, and its use in exploring intestinal metagenomes. PLoS One, 2011, 6(3): e16876. DOI:10.1371/journal.pone.0016876 |
| [8] | Plovier H, Everard A, Druart C, Depommier C, van Hul M, Geurts L, Chilloux J, Ottman N, Duparc T, Lichtenstein L, Myridakis A, Delzenne NM, Klievink J, Bhattacharjee A, van der Ark KCH, Aalvink S, Martinez LO, Dumas ME, Maiter D, Loumaye A, Hermans MP, Thissen JP, Belzer C, de Vos WM, Cani PD. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice. Nature Medicine, 2017, 23(1): 107-113. DOI:10.1038/nm.4236 |
| [9] | Schneeberger M, Everard A, Gómez-Valadés AG, Matamoros S, Ramírez S, Delzenne NM, Gomis R, Claret M, Cani PD. Akkermansia muciniphila inversely correlates with the onset of inflammation, altered adipose tissue metabolism and metabolic disorders during obesity in mice. Scientific Reports, 2015, 5: 16643. DOI:10.1038/srep16643 |
| [10] | Li J, Lin SQ, Vanhoutte PM, Woo CW, Xu AM. Akkermansia muciniphila protects against atherosclerosis by preventing metabolic endotoxemia-induced inflammation in Apoe-/- Mice. Circulation, 2016, 133(24): 2434-2446. DOI:10.1161/CIRCULATIONAHA.115.019645 |
| [11] | O'Toole PW, Marchesi JR, Hill C. Next-generation probiotics:the spectrum from probiotics to live biotherapeutics. Nature Microbiology, 2017, 2(5): 17057. DOI:10.1038/nmicrobiol.2017.57 |
| [12] | Zhang XY, Shen DQ, Fang ZW, Jie ZY, Qiu XM, Zhang CF, Chen YL, Ji LN. Human gut microbiota changes reveal the progression of glucose intolerance. PLoS One, 2013, 8(8): e71108. DOI:10.1371/journal.pone.0071108 |
| [13] | Everard A, Belzer C, Geurts L, Ouwerkerk JP, Druart C, Bindels LB, Guiot Y, Derrien M, Muccioli GG, Delzenne NM, de Vos WM, Cani PD. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(22): 9066-9071. DOI:10.1073/pnas.1219451110 |
| [14] | Bischoff SC, Barbara G, Buurman W, Ockhuizen T, Schulzke JD, Serino M, Tilg H, Watson A, Wells JM. Intestinal permeability-a new target for disease prevention and therapy. BMC Gastroenterology, 2014, 14: 189. DOI:10.1186/s12876-014-0189-7 |
| [15] | Khan N, Asif AR. Transcriptional regulators of claudins in epithelial tight junctions. Mediators of Inflammation, 2015, 2015: 219843. |
| [16] | Groschwitz KR, Hogan SP. Intestinal barrier function:molecular regulation and disease pathogenesis. Journal of Allergy and Clinical Immunology, 2009, 124(1): 3-20. DOI:10.1016/j.jaci.2009.05.038 |
| [17] | Viggiano D, Ianiro G, Vanella G, Bibbò S, Bruno G, Simeone G, Mele G. Gut barrier in health and disease:focus on childhood. European Review for Medical and Pharmacological Sciences, 2015, 19(6): 1077-1085. |
| [18] | Camilleri M, Madsen K, Spiller R, van Meerveld BG, Verne GN. Intestinal barrier function in health and gastrointestinal disease. Neurogastroenterology & Motility, 2012, 24(6): 503-512. |
| [19] | Heyman M, Abed J, Lebreton C, Cerf-Bensussan N. Intestinal permeability in coeliac disease:insight into mechanisms and relevance to pathogenesis. Gut, 2012, 61(9): 1355-1364. DOI:10.1136/gutjnl-2011-300327 |
| [20] | Chelakkot C, Choi Y, Kim DK, Park HT, Ghim J, Kwon Y, Jeon J, Kim MS, Jee YK, Gho YS, Park HS, Kim YK, Ryu SH. Akkermansia muciniphila-derived extracellular vesicles influence gut permeability through the regulation of tight junctions. Experimental & Molecular Medicine, 2018, 50(2): e450. |
| [21] | Ottman N, Reunanen J, Meijerink M, Pietil? TE, Kainulainen V, Klievink J, Huuskonen L, Aalvink S, Skurnik M, Boeren S, Satokari R, Mercenier A, Palva A, Smidt H, de Vos WM, Belzer C. Pili-like proteins of Akkermansia muciniphila modulate host immune responses and gut barrier function. PLoS One, 2017, 12(3): e0173004. DOI:10.1371/journal.pone.0173004 |
| [22] | Reunanen J, Kainulainen V, Huuskonen L, Ottman N, Belzer C, Huhtinen H, de Vos WM, Satokari R. Akkermansia muciniphila adheres to enterocytes and strengthens the integrity of the epithelial cell layer. Applied and Environmental Microbiology, 2015, 81(11): 3655-3662. DOI:10.1128/AEM.04050-14 |
| [23] | Harbison JE, Roth-Schulze AJ, Barry SC, Tran CD, Ngui K, Penno MA, Wentworth J, Colman PG, Thomson R, Craig ME, Papenfuss AT, Giles L, Harrison LC, Couper J. Gut microbiome dysbiosis and increased intestinal permeability in Australian children with islet autoimmunity and type 1 diabetes. Diabetes, 2018, 6(S1): 71. |
| [24] | H?nninen A, Toivonen R, P?ysti S, Belzer C, Plovier H, Ouwerkerk JP, Emani R, Cani PD, de Vos WM. Akkermansia muciniphila induces gut microbiota remodelling and controls islet autoimmunity in NOD mice. Gut, 2018, 67(8): 1445-1453. DOI:10.1136/gutjnl-2017-314508 |
| [25] | Muccioli GG, Naslain D, B?ckhed F, Reigstad CS, Lambert DM, Delzenne NM, Cani PD. The endocannabinoid system links gut microbiota to adipogenesis. Molecular Systems Biology, 2010, 6: 392. DOI:10.1038/msb.2010.46 |
| [26] | Lu D, Dopart R, Kendall DA. Controlled downregulation of the cannabinoid CB1 receptor provides a promising approach for the treatment of obesity and obesity-derived type 2 diabetes. Cell Stress and Chaperones, 2016, 21(1): 1-7. DOI:10.1007/s12192-015-0653-5 |
| [27] | Liu J, Bátkai S, Pacher P, Harvey-White J, Wagner JA, Cravatt BF, Gao B, Kunos G. Lipopolysaccharide induces anandamide synthesis in macrophages via CD14/MAPK/phosphoinositide 3-kinase/NF-κB independently of platelet-activating factor. The Journal of Biological Chemistry, 2003, 278(45): 45034-45039. DOI:10.1074/jbc.M306062200 |
| [28] | Mehrpouya-Bahrami P, Chitrala KN, Ganewatta MS, Tang CB, Murphy EA, Enos RT, Velazquez KT, McCellan J, Nagarkatti M, Nagarkatti P. Blockade of CB1 cannabinoid receptor alters gut microbiota and attenuates inflammation and diet-induced obesity. Scientific Reports, 2017, 7(1): 15645. DOI:10.1038/s41598-017-15154-6 |
| [29] | Koh A, de Vadder F, Kovatcheva-Datchary P, B?ckhed F. From dietary fiber to host physiology:short-chain fatty acids as key bacterial metabolites. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [30] | Sanna S, van Zuydam NR, Mahajan A, Kurilshikov A, Vila VA, V?sa U, Mujagic Z, Masclee AM, Jonkers DMAE, Oosting M, Joosten LAB, Netea MG, Franke L, Zhernakova A, Fu JY, Wijmenga C, McCarthy MI. Causal relationships among the gut microbiome, short-chain fatty acids and metabolic diseases. Nature Genetics, 2019, 51(4): 600-605. DOI:10.1038/s41588-019-0350-x |
| [31] | Ottman N, Davids M, Suarez-Diez M, Boeren S, Schaap PJ, Martins dos Santos VAP, Smidt H, Belzer C, de Vos WM. Genome-Scale model and omics analysis of metabolic capacities of Akkermansia muciniphila reveal a preferential mucin-degrading lifestyle. Applied and Environmental Microbiology, 2017, 83(18): e01014-17. DOI:10.1128/AEM.01014-17 |
| [32] | Belzer C, Chia LW, Aalvink S, Chamlagain B, Piironen V, Knol J, de Vos WM. Microbial metabolic networks at the mucus layer lead to diet-independent butyrate and vitamin B12 production by intestinal symbionts. mBio, 2017, 8(5): e00770-17. DOI:10.1128/mBio.00770-17 |
| [33] | Chia LW, Hornung BVH, Aalvink S, Schaap PJ, de Vos WM, Knol J, Belzer C. Deciphering the trophic interaction between Akkermansia muciniphila and the butyrogenic gut commensal Anaerostipes caccae using a metatranscriptomic approach. Antonie van Leeuwenhoek, 2018, 111(6): 859-873. DOI:10.1007/s10482-018-1040-x |
| [34] | Chen L, Chen R, Wang H, Liang FX. Mechanisms linking inflammation to insulin resistance. International Journal of Endocrinology, 2015, 2015: 508409. |
| [35] | Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C, Waget A, Delmée E, Cousin B, Sulpice T, Chamontin B, Ferrières J, Tanti JF, Gibson GR, Casteilla L, Delzenne NM, Alessi MC, Burcelin R. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes, 2007, 56(7): 1761-1772. DOI:10.2337/db06-1491 |
| [36] | Shi H, Kokoeva MV, Inouye K, Tzameli I, Yin HL, Flier JS. TLR4 links innate immunity and fatty acid-induced insulin resistance. Journal of Clinical Investigation, 2006, 116(11): 3015-3025. DOI:10.1172/JCI28898 |
| [37] | Zhao SQ, Liu W, Wang JQ, Shi J, Sun YK, Wang WQ, Ning G, Liu RX, Hong J. Akkermansia muciniphila improves metabolic profiles by reducing inflammation in chow diet-fed mice. Journal of Molecular Endocrinology, 2017, 58(1): 1-14. |
| [38] | Zhang L, Qin QQ, Liu MN, Zhang XL, He F, Wang GQ. Akkermansia muciniphila can reduce the damage of gluco/lipotoxicity, oxidative stress and inflammation, and normalize intestine microbiota in streptozotocin-induced diabetic rats. Pathogens and Disease, 2018, 76(4): fty028. |
| [39] | van der Lugt B, van Beek AA, Aalvink S, Meijer B, Sovran B, Vermeij WP, Brandt RMC, de Vos WM, Savelkoul HFJ, Steegenga WT, Belzer C. Akkermansia muciniphila ameliorates the age-related decline in colonic mucus thickness and attenuates immune activation in accelerated aging Ercc1-/Δ7 mice. Immunity & Ageing, 2019, 16: 6. |
| [40] | Ashrafian F, Behrouzi A, Shahriary A, Ahmadi Badi S, Davari M, Khatami S, Rahimi Jamnani FR, Fateh A, Vaziri F, Siadat SD. Comparative study of effect of Akkermansia muciniphila and its extracellular vesicles on toll-like receptors and tight junction. Gastroenterology and Hepatology from Bed to Bench, 2019, 12(2): 163-168. |
| [41] | Depommier C, Everard A, Druart C, Plovier H, van Hul M, Vieira-Silva S, Falony G, Raes J, Maiter D, Delzenne NM, de Barsy M, Loumaye A, Hermans MP, Thissen JP, de Vos WM, Cani PD. Supplementation with Akkermansia muciniphila in overweight and obese human volunteers:a proof-of-concept exploratory study. Nature Medicine, 2019, 25(7): 1096-1103. DOI:10.1038/s41591-019-0495-2 |
