陈华海1, 吴柳1, 唐成1, 王欣2, 尹业师1


1. 湖南科技学院化学与生物工程学院, 湘南优势植物资源综合利用湖南省重点实验室, 湖南 永州 425199;
2. 浙江省农业科学院植物保护与微生物研究所, 浙江 杭州 310021
收稿日期:2019-04-09;修回日期:2019-06-22;网络出版日期:2019-08-05
基金项目:国家自然科学基金(31800119);湖南省自然科学基金(2018JJ3200);湖南科技学院应用特色学科建设项目
作者简介:尹业师,研究员,湖南科技学院化学与生物工程学院副院长,湘南优势植物资源综合利用湖南省重点实验室主任,永州市瑶药现代化工程技术研究中心主任。中国科学院微生物研究所博士,美国马歇尔大学医学院博士后。入选湖南省121创新人才工程第三层次和湖南省“三区人才”。主要从事肠道微生物与植物提取物研究。主持中央引导地方科技发展专项、国家自然科学青年基金、国家863计划课题和湖南省自然科学基金等科研项目;以主要作者在ISME J、Applied and Environmental Microbiology、Molecular Microbiology、Frontiers in Microbiology、FEMS Microbiology Ecology等期刊发表论文70多篇;以第一发明人申报中国发明专利5项。兼职湖南省生物化学与分子生物学学会理事、中华医学会消化病学分会微生态组委员,担任Journal of Agricultural and Food Chemistry、Journal of Functional Foods、Frontiers in Microbiology、《微生物学报》、《生物工程学报》和《微生物学通报》等期刊审稿专家.
*通信作者:尹业师, E-mail: yinyeshi@126.com.
摘要:动物实验研究表明,肠道分节丝状菌(segmented filamentous bacteria,SFB)是一种革兰氏染色阳性梭菌;具有物种选择性定殖特性,主要定殖在回肠末端上皮细胞表面;具有调节宿主免疫系统成熟,刺激Th17细胞特异性分化和促进肠道表面免疫球蛋白A(sIgA)分泌等功能;在防御病原微生物感染和诱发自身免疫性疾病发生发展等方面发挥重要作用。虽然在众多脊椎动物中均能检测到SFB的存在,但关于人SFB的研究报道甚少。有研究表明人体肠道样品中能检测到SFB的存在,且对临床样品进行调查研究发现,人体肠道SFB与免疫调控和疾病症状等存在一定的相关性。但由于SFB在人体肠道中丰度极低,且在同一个体中可能存在不同的SFB菌株,SFB单细菌分离与纯培养仍然是进一步研究人体肠道SFB免疫调节功能的必由之路。
关键词:人体肠道分节丝状菌免疫调节宿主特异性单细菌培养
Research progress of human intestinal segmented filamentous bacteria
Huahai Chen1, Liu Wu1, Cheng Tang1, Xin Wang2, Yeshi Yin1


1. Key Laboratory of Comprehensive Utilization of Advantage Plants Resources in Hunan South, College of Chemistry and Bioengineering, Hunan University of Science and Engineering, Yongzhou 425199, Hunan Province, China;
2. Institute of Plant Protection and Microbiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, Zhejiang Province, China
Received: 9 April 2019; Revised: 22 June 2019; Published online: 5 August 2019
*Corresponding author: Yeshi Yin, E-mail: yinyeshi@126.com.
Foundation item: Supported by the National Natural Science Foundation of China (31800119), by the Hunan Natural Science Foundation (2018JJ3200) and by the Construction Project of Applied Characteristic Discipline in Hunan University of Science and Engineering
Abstract: Intestinal Segmented Filamentous Bacteria (SFB) is a Gram-positive Clostridium spp. with selective colonization of species, as shown by experiments. SFB mainly colonize on the surface of intestinal epithelial cells at the end of the ileum, to regulate the maturation of host immune system, stimulate the specific differentiation of CD4+ Th17 cells and promote the secretion of intestinal surface immunoglobulin A (sIgA). SFB play very important roles in preventing pathogenic microbial infection and induction of occurrence and development of autoimmune diseases. Although SFB can be detected in many vertebrates, few studies have been reported on human SFB. Studies have shown that SFB can be detected in human intestinal samples, and the investigation of clinical samples shows that there is a certain correlation of SFB in human intestinal tract with immune regulation and disease symptoms. However, due to the extremely low abundance of SFB in human intestinal tract and the possible existence of different SFB strains in the same individual, isolation and pure culture of SFB single bacteria are still the only way to further study the immune regulation function of human SFB.
Keywords: human segmented filamentous bacteria (SFB)immunoregulationhost specificitysingle bacterial culture
肠道分节丝状菌(SFB)是一种分布非常广泛的革兰氏阳性梭菌[1],已经在人、小鼠、大鼠、猪、狗、猫、猕猴、短尾猿、家禽、南非爪蟾蜍、鲤鱼、松鼠、喜鹊和斑鸠等宿主体内检测到SFB的存在[2-3]。SFB具有3个主要特征:(1) SFB主要黏附/定殖在回肠末端回盲部粘膜上皮细胞表面[1, 4],具有物种选择性定殖特性和年龄依赖性,来源于不同物种的SFB不能交叉定殖,且在断奶前后SFB的丰度相对较高[5-8];(2) SFB定殖能促进Th17细胞分化和Th17相关细胞因子表达[9-11],SFB是最早报道的单一一种细菌具有如此强大免疫调节功能的肠道菌。(3) SFB基因组较少,属于微需氧异养微生物[12-13],体外纯培养非常困难,到目前为止仍属于未可培养微生物。SFB因其独特的菌体形态而得名,因其重要的免疫调节功能而广受关注。
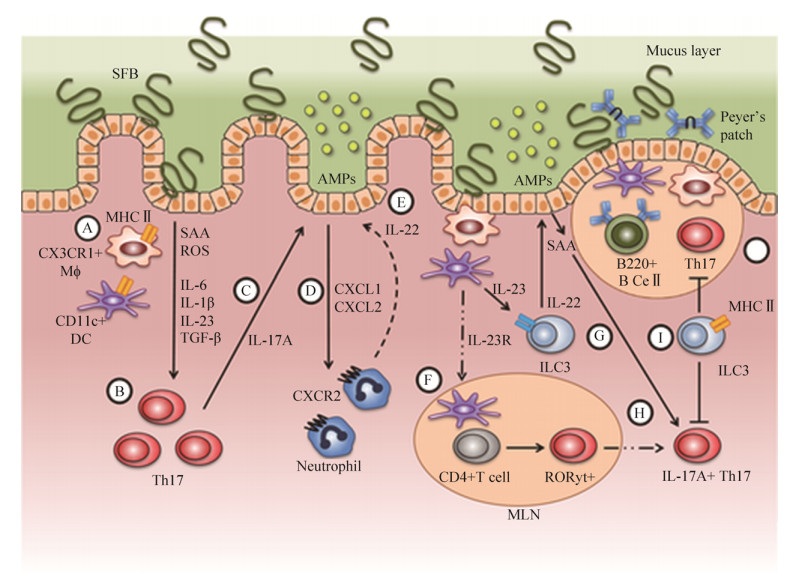
小鼠SFB研究发现,SFB免疫调节网络非常复杂(图 1)[14]。包括(A) MHCII介导的CD11c+细胞抗原递呈,刺激局部细胞因子分泌;(B)分泌的细胞因子促进固有层淋巴结(LP)初始T细胞分化为Th17细胞;(C) Th17细胞分泌的IL-17A等细胞因子作用于肠道上皮细胞,促进上皮屏障保护功能;(D) IL-22与CXCL1和CXCL2共同刺激中性粒细胞募集;(E) Th17细胞分泌的IL-17A和中性粒细胞分泌的IL-22作用于肠道上皮细胞,触发抗菌肽(AMPS)释放;(F) SFB抗原通过肠系膜淋巴结(MLNs)树突状细胞(DCs)迁移,启动表达转录因子ROR?t+和分泌IL-23;(G) IL-23与ILC3上的IL-23R结合促进IL-22分泌;(H)小肠上皮细胞(IECS)释放的血清淀粉样蛋白A(SAA)与来源于ILC3的IL-22发生反应,作用于从MLN返回肠道的ROR?t+ T细胞,促进IL-17A分泌;(I) ILC3通过MHCII直接抑制Th17细胞反应;(J) SFB定殖促进派氏结生发中心形成和B细胞分泌SIgA等。但到目前为止,SFB免疫调节分子和免疫调节机制仍有待进一步研究。尽管Yang等发现来源于SFB基因SFBNYU_003340和SFBNYU_004990的蛋白多肽可以被T细胞受体识别,从而启动Th17细胞分化[15],Wang等研究发现SFB鞭毛蛋白在体内和体外均具有SFB单一菌定殖类似免疫调节功能(frontiers immunology审稿中),Ladinsky等发现SFB利用微生物粘附触发的内吞作用(MATE)将T细胞抗原转移到回肠上皮细胞中,并调节宿主T细胞稳态[16]等。但到目前为止,SFB分子免疫调节机制仍不清楚。
 |
| 图 1 SFB免疫调节网络示意图[14] Figure 1 Schematic map of SFB immune regulation[14]. |
| 图选项 |
由于肠道定殖是SFB发挥免疫调节功能的重要前提[17]。SFB定殖相关研究也广受关注。SFB在小肠末端的定殖具有明显的物种特异性。Tannock等研究发现给无菌小鼠灌胃普通小鼠回肠匀浆样品,数日后前无菌小鼠回肠黏膜能检测到SFB;而灌胃普通大鼠回肠匀浆样品,前无菌小鼠回肠黏膜上没有检测到SFB[7]。在小鼠SFB与鸡SFB之间也存在类似的宿主选择性定殖现象[8]。另外,SFB定殖具有一定的年龄依赖性,SFB主要定殖在免疫系统尚未发育完善的幼龄小鼠和小鸡肠道[5-8]。然而,SFB物种特异性定殖机制仍有待进一步研究。团队前期研究发现SFB鞭毛蛋白序列在遗传进化分析时具有明显的宿主特异性分布特性,且与大鼠SFB鞭毛蛋白相比,小鼠SFB鞭毛蛋白更多的与小鼠肠道组织粘附相关蛋白相互作用,而大鼠SFB鞭毛蛋白更多的与小鼠小肠组织中溶酶体蛋白相互作用。推测大鼠SFB不能在小鼠回肠末端定殖的主要原因可能是由于其鞭毛蛋白在小鼠肠道环境中不稳定,容易被降解,从而影响其定殖[18]。
关于SFB定殖具有刺激肠道Th17细胞分化和促进Th17细胞相关细胞因子分泌的功能已得到普遍认可,但其对宿主健康的影响仍然是大家关注的重点之一。一方面,在正常情况下,SFB定殖不引起肠道炎症等不良反应。而且SFB定殖可以通过促进α防御素、抗菌肽和紧密连接蛋白等的表达[19-21],帮助宿主防御病原微生物,如柠檬酸杆菌、鼠伤寒沙门氏菌、肠致病性大肠杆菌、耐甲氧西林金黄色葡萄球菌、烟曲霉、弓形虫和阿米巴虫等的感染[22-26]。另一方面,SFB可能是某些疾病发生发展的重要诱因之一。有研究报道SFB在诱发小鼠自身免疫性关节炎和自身免疫性EAE (小鼠多发性硬化的临床前模型)中发挥重要作用[27-28]。另外,SFB诱导的IL-17A信号可加重与小鼠非酒精性脂肪肝相关肥胖诱导的肝损伤[29]。最近有研究也表明,SFB诱导的肠道Th17细胞反应可影响中枢神经系统发育,通过母婴传播携带SFB的后代,更容易出现神经发育异常[30-31]。
鉴于动物实验研究发现,SFB具有调节宿主免疫系统发育和维持免疫平衡等重要功能,在帮助宿主防御病原微生物感染和诱发自身免疫性疾病发生等方面发挥重要作用。人体肠道SFB的检测及对人体健康的影响受到广泛关注。
1 人体肠道SFB的检测及其在人群中的分布 尽管Klaasen等通过光学显微镜观察到人回肠组织中有SFB样细菌黏附在上皮细胞和黏液层[32];Yin等[33]和Jonsson等[34]报道使用16S rRNA基因PCR扩增能在儿童和成人粪便样品中检测到SFB阳性;Chen等使用FISH原位杂交和LC/MS/MS等在小孩肠洗液样品中观察到SFB样形态细菌和检测到SFB特异性肽段[35],但人体肠道中是否存在SFB仍存在一定的争议。Caselli等在获得小鼠SFB全基因组信息后,将小鼠SFB基因组序列与数据库中人肠道菌群宏基因组数据进行比对分析,结果在人肠道宏基因组数据中没有找到与SFB特异基因片段具有较高同源性的序列[36]。
不同研究团队报道SFB阳性率存在一定差异的原因可能有二个:(1) SFB在肠道样品中丰度非常低,一般在10–6–10–7水平[35],而且志愿者年龄和身体健康状态等可能影响SFB阳性率。Yin等研究发现,SFB在人体内的定殖具有年龄依赖性,大多数2岁以内的儿童粪便样品中可以检测到SFB阳性,但在3岁以后的个体中很少能检测到SFB存在[33]。Chen等研究发现,SFB在来自临床青少年患者的回盲部肠洗液中普遍存在,且不论性别和年龄(0–16岁)(Microbial Ecology返修)。因此采样部位和样品个体的健康状况等可能是影响人体肠道SFB阳性率高低的重要原因之一。(2)不同饮食组成和药物使用等会影响SFB丰度和阳性率。Jonsson等研究发现摄入高纤维饮食后增加了肠道中SFB的百分比含量[34];McAleer等研究报道万古霉素处理后,小鼠肠道中SFB定殖数量减少[26];Zwirzitz等报道硫酸粘杆菌素和林肯霉素处理后,猪回肠粘膜上的分节丝状菌(SFB)数量减少190多倍[37]。
2 人体肠道SFB遗传多样性分析 虽然尚未能在体外分离获得人体SFB单个菌株,但从遗传信息分析发现,人体内SFB具有丰富的生物多样性。Yin等对小鼠、鸡和人的SFB 16S rRNA基因多样性通过克隆文库测序和序列比对分析发现,三种来源不同的SFB16S rRNA基因,不仅具有丰富的遗传多样性,而且具有宿主特异性[33]。最近,Chen等进一步使用高通量测序方法对人和小鼠SFB的16S rRNA基因和SFB鞭毛蛋白基因fliC3-4进行测序分析发现,在儿童肠洗液样品中可以检测到多个SFB OTU,说明不同个体间SFB菌株可能存在差异,且即使是同一个体中也普遍存在多个不同的SFB菌株(Microbial Ecology返修)。有证据表明Th17细胞在控制SFB定殖过程中发挥重要作用[21]。缺乏粘附上皮能力的SFB突变体不能诱导肠内Th17分化[17]。这些研究结果提示我们进一步研究人SFB对宿主的免疫调节功能,需要在SFB单菌株水平进行才更有意义。
3 人体肠道SFB与宿主免疫调节和疾病之间的关系 虽然小鼠实验研究表明,SFB定殖具有调节T淋巴细胞分化和刺激肠道sIgA分泌等功能,与抵抗病原微生物感染和促进自身免疫性疾病发生等相关。但人体肠道SFB是否具有类似功能还有待进一步研究。尽管Caselli和Finotti等分别使用显微镜和PCR检测的方法发现在溃疡性结肠炎患者肠道样品中有SFB样细菌存在[38-39],但Chen等使用分子生物学方法对162名患者肠洗液样品进行分析发现SFB与大肠息肉、大肠炎、炎性肠病、嗜酸细胞性胃肠炎等疾病没有显著相关性[21]。然而,Chen等最近研究结果表明,SFB阳性率在便血患者中显著高于腹痛和腹泻患者(Microbial Ecology返修)。这可能是由于前者检测的样品为长期患病的志愿者,很多志愿者在样品收集前已经使用过药物或其它方法治疗,而后者收集的肠洗液样品大多来源于初诊患者,其肠道菌群受到药物治疗等的干预较少。
在人体SFB免疫调节功能研究方面,Chen等研究发现,SFB阳性样品的肠道总SIgA含量明显更高,而且RNA-Seq和定量PCR分析表明,SFB阳性样品肠道组织中与T细胞和B细胞受体信号通路及Th17细胞分化通路相关的基因表达量明显更高[21]。Chen等最新研究也发现,SFB阳性率与患者血清中IgG浓度呈正相关,但与血清中IgA、IgE和IgM浓度并无明显相关性(Microbial Ecology返修)。人体肠道SFB对人体免疫系统的调节作用及其对人类健康的影响还有待进一步研究。
4 人体肠道SFB的体外富集培养 关于SFB的体外纯培养目前仍是业界难题。虽然早在19世纪70年代,这种形态特殊的细菌就引起了科学家们的关注,并试图对SFB进行体外分离培养[1, 40],但遗憾的是到目前为止仍未能在体外对SFB进行纯培养。目前,日、美等国的SFB相关研究也主要依赖于使用SFB单一定殖悉生小鼠模型来完成。鉴于小鼠和大鼠SFB全基因组测序分析,发现大鼠和小鼠SFB基因组缺少编码与维生素、氨基酸和核苷酸合成相关的基因,同时缺少很多与多糖降解和利用相关的基因,如三羧酸循环等[12-13, 41-42]。所以SFB的生长繁殖必然依赖于其所定殖的宿主或共生环境中的其它微生物。Schnupf等采用与宿主上皮细胞共培养的方法发现小鼠SFB可以在体外进行分化,可以由椭圆形分化成长丝状[43],但其生长速度非常缓慢,隔一周传代后培养液中SFB数量显著减少,而且很难再完成由长丝状变为椭圆形再变成长丝状的生长周期[43]。所以SFB体外纯培养方法仍需要继续改进。而且目前对小鼠SFB的体外培养都是以SFB单一定殖小鼠的肠道内容物为接种物,其仍然是一个混合菌群培养,因为团队前期研究发现小鼠SFB即使是在同一个体中也具有不同的亚型或菌株[33]。
5 讨论和展望 尽管动物研究发现SFB具有非常重要的生理功能,但人SFB相关研究仍鲜见报道,其对人体的免疫调节功能及其与人类疾病发生发展的相关性还有待进一步研究。通过对人类小肠肠洗液样品使用PCR、FISH、免疫组化、扫描电镜、SFB特异基因高通量测序和LC/MS/MS分析等,发现人体肠道中确实能检测到SFB的存在。但由于人体肠道样品的收集受到伦理与技术限制,且SFB在人体肠道中丰度极低,其对人体免疫系统的调节作用及其对人类健康的影响仍有待进一步研究。由于SFB具有丰富的多样性,即使在同一个体中也可能存在不同的SFB菌株,且突变后的菌株可能影响其定殖能力,从而影响其免疫调节功能[44]。因此建立体外SFB单细菌分离与纯培养是解决当前人体SFB功能及其与人类疾病相关性的必由之路。但仍面临很多挑战:(1)需要想办法获得纯的人SFB菌群或菌株,然后再与肠上皮细胞或肠道组织进行共培养;(2)尚未获得人SFB基因组信息,所以无法确定人SFB与小鼠SFB的遗传信息有多大差异,很难进行人SFB精准检测;(3)鉴于SFB宿主特异性定殖的特点[7],小鼠SFB在体外共培养的条件是否适用于人SFB的培养仍有待进一步研究。
References
| [1] | Davis CP, Savage DC. Habitat, succession, attachment, and morphology of segmented, filamentous microbes indigenous to the murine gastrointestinal tract. Infection and Immunity, 1974, 10(4): 948-956. |
| [2] | Klaasen HL, Van der Heijden PJ, Stok W, Poelma FG, Koopman JP, Van Den Brink ME, Bakker MH, Eling WM, Beynen AC. Apathogenic, intestinal, segmented, filamentous bacteria stimulate the mucosal immune system of mice. Infection and Immunity, 1993, 61(1): 303-306. |
| [3] | Tajima K, Ohmori H, Tohno M, Ohtsu H, Tsukahara T, Aminov R. Segmented filamentous bacteria are a major group in terminal ileum of piglets. Anaerobe, 2013, 23: 109-111. DOI:10.1016/j.anaerobe.2013.07.004 |
| [4] | Garland CD, Lee A, Dickson MR. Segmented filamentous bacteria in the rodent small intestine:Their colonization of growing animals and possible role in host resistance to Salmonella. Microbial Ecology, 1982, 8(2): 181-190. DOI:10.1007/BF02010451 |
| [5] | Liao NB, Yin YS, Sun GC, Xiang C, Liu DH, Yu HD, Wang X. Colonization and distribution of segmented filamentous bacteria (SFB) in chicken gastrointestinal tract and their relationship with host immunity. FEMS Microbiology Ecology, 2012, 81(2): 395-406. DOI:10.1111/j.1574-6941.2012.01362.x |
| [6] | Jiang HQ, Bos NA, Cebra JJ. Timing, localization, and persistence of colonization by segmented filamentous bacteria in the neonatal mouse gut depend on immune status of mothers and pups. Infection and Immunity, 2001, 69(6): 3611-3617. DOI:10.1128/IAI.69.6.3611-3617.2001 |
| [7] | Tannock GW, Miller JR, Savage DC. Host specificity of filamentous, segmented microorganisms adherent to the small bowel epithelium in mice and rats. Applied and Environmental Microbiology, 1984, 47(2): 441-442. |
| [8] | Allen PC. Comparative study of long, segmented, filamentous organisms in chickens and mice. Laboratory Animal Science, 1992, 42(6): 542-547. |
| [9] | Ivanov Ⅱ, Atarashi K, Manel N, Brodie EL, Shima T, Karaoz U, Wei DG, Goldfarb KC, Santee CA, Lynch SV, Tanoue T, Imaoka A, Itoh K, Takeda K, Umesaki Y, Honda K, Littman DR. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell, 2009, 139(3): 485-498. DOI:10.1016/j.cell.2009.09.033 |
| [10] | Goto Y, Panea C, Nakato G, Cebula A, Lee C, Diez MG, Laufer TM, Ignatowicz L, Ivanov Ⅱ. Segmented filamentous bacteria antigens presented by intestinal dendritic cells drive mucosal Th17 cell differentiation. Immunity, 2014, 40(4): 594-607. DOI:10.1016/j.immuni.2014.03.005 |
| [11] | Gaboriau-Routhiau V, Rakotobe S, Lécuyer E, Mulder I, Lan A, Bridonneau C, Rochet V, Pisi A, De Paepe M, Brandi G, Eberl G, Snel J, Kelly D, Cerf-Bensussan N. The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses. Immunity, 2009, 31(4): 677-689. DOI:10.1016/j.immuni.2009.08.020 |
| [12] | Sczesnak A, Segata N, Qin X, Gevers D, Petrosino JF, Huttenhower C, Littman DR, Ivanov Ⅱ. The genome of Th17 cell-inducing segmented filamentous bacteria reveals extensive auxotrophy and adaptations to the intestinal environment. Cell Host & Microbe, 2011, 10(3): 260-272. |
| [13] | Kuwahara T, Ogura Y, Oshima K, Kurokawa K, Ooka T, Hirakawa H, Itoh T, Nakayama-Imaohji H, Ichimura M, Itoh K, Ishifune C, Maekawa Y, Yasutomo K, Hattori M, Hayashi T. The lifestyle of the segmented filamentous bacterium:a non-culturable gut-associated immunostimulating microbe inferred by whole-genome sequencing. DNA Researchh:an International Journal for Rapid Publication of Reports on Genes and Genomes, 2011, 18(4): 291-303. DOI:10.1093/dnares/dsr022 |
| [14] | Flannigan KL, Denning TL. Segmented filamentous bacteria-induced immune responses:a balancing act between host protection and autoimmunity. Immunology, 2018, 154(4): 537-546. DOI:10.1111/imm.12950 |
| [15] | Yang Y, Torchinsky MB, Gobert M, Xiong HH, Xu M, Linehan JL, Alonzo F, Ng C, Chen A, Lin XY, Sczesnak A, Liao JJ, Torres VJ, Jenkins MK, Lafaille JJ, Littman DR. Focused specificity of intestinal TH17 cells towards commensal bacterial antigens. Nature, 2014, 510(7503): 152-156. DOI:10.1038/nature13279 |
| [16] | Ladinsky MS, Araujo LP, Zhang X, Veltri J, Galan-Diez M, Soualhi S, Lee C, Irie K, Pinker EY, Narushima S, Bandyopadhyay S, Nagayama M, Elhenawy W, Coombes BK, Ferraris RP, Honda K, Iliev ID, Gao N, Bjorkman PJ, Ivanov Ⅱ. Endocytosis of commensal antigens by intestinal epithelial cells regulates mucosal T cell homeostasis. Science, 2019, 363(6431): eaat4042. DOI:10.1126/science.aat4042 |
| [17] | Atarashi K, Tanoue T, Ando M, Kamada N, Nagano Y, Narushima S, Suda W, Imaoka A, Setoyama H, Nagamori T, Ishikawa E, Shima T, Hara T, Kado S, Jinnohara T, Ohno H, Kondo T, Toyooka K, Watanabe E, Yokoyama SI, Tokoro S, Mori H, Noguchi Y, Morita H, Ivanov Ⅱ, Sugiyama T, Nu?ez G, Camp JG, Hattori M, Umesaki Y, Honda K. Th17 cell induction by adhesion of microbes to intestinal epithelial cells. Cell, 2015, 163(2): 367-380. DOI:10.1016/j.cell.2015.08.058 |
| [18] | Chen HH, Yin YS, Wang YL, Wang X, Xiang C. Host specificity of flagellins from segmented filamentous bacteria affects their patterns of interaction with mouse ileal mucosal proteins. Applied and Environmental Microbiology, 2017, 83(18): e01061-17. |
| [19] | Lee JS, Tato CM, Joyce-Shaikh B, Gulen MF, Cayatte C, Chen Y, Blumenschein WM, Judo M, Ayanoglu G, McClanahan TK, Li XX, Cua DJ. Interleukin-23-independent IL-17 production regulates intestinal epithelial permeability. Immunity, 2015, 43(4): 727-738. DOI:10.1016/j.immuni.2015.09.003 |
| [20] | Maxwell JR, Zhang Y, Brown WA, Smith CL, Byrne FR, Fiorino M, Stevens E, Bigler J, Davis JA, Rottman JB, Budelsky AL, Symons A, Towne JE. Differential roles for interleukin-23 and interleukin-17 in intestinal immunoregulation. Immunity, 2015, 43(4): 739-750. DOI:10.1016/j.immuni.2015.08.019 |
| [21] | Kumar P, Monin L, Castillo P, Elsegeiny W, Horne W, Eddens T, Vikram A, Good M, Schoenborn AA, Bibby K, Montelaro RC, Metzger DW, Gulati AS, Kolls JK. Intestinal interleukin-17 receptor signaling mediates reciprocal control of the gut microbiota and autoimmune inflammation. Immunity, 2016, 44(3): 659-671. DOI:10.1016/j.immuni.2016.02.007 |
| [22] | Chung H, Pamp SJ, Hill JA, Surana NK, Edelman SM, Troy EB, Reading NC, Villablanca EJ, Wang S, Mora JR, Umesaki Y, Mathis D, Benoist C, Relman DA, Kasper DL. Gut immune maturation depends on colonization with a host-specific microbiota. Cell, 2012, 149(7): 1578-1593. DOI:10.1016/j.cell.2012.04.037 |
| [23] | Edelblum KL, Sharon G, Singh G, Odenwald MA, Sailer A, Cao S, Ravens S, Thomsen I, El Bissati K, McLeod R, Dong C, Gurbuxani S, Prinz I, Mazmanian SK, Turner JR. The microbiome activates CD4 T-cell-mediated immunity to compensate for increased intestinal permeability. Cellular and Molecular Gastroenterology and Hepatology, 2017, 4(2): 285-297. DOI:10.1016/j.jcmgh.2017.06.001 |
| [24] | Burgess SL, Buonomo E, Carey M, Cowardin C, Naylor C, Noor Z, Wills-Karp M, Petri Jr WA. Bone marrow dendritic cells from mice with an altered microbiota provide interleukin 17A-dependent protection against Entamoeba histolytica colitis. mBio, 2014, 5(6): e01817-14. |
| [25] | Gauguet S, D'Ortona S, Ahnger-Pier K, Duan BY, Surana NK, Lu R, Cywes-Bentley C, Gadjeva M, Shan Q, Priebe GP, Pier GB. Intestinal microbiota of mice influences resistance to Staphylococcus aureus pneumonia. Infection and Immunity, 2015, 83(10): 4003-4014. DOI:10.1128/IAI.00037-15 |
| [26] | McAleer JP, Nguyen NLH, Chen K, Kumar P, Ricks DM, Binnie M, Armentrout RA, Pociask DA, Hein A, Yu A, Vikram A, Bibby K, Umesaki Y, Rivera A, Sheppard D, Ouyang WJ, Hooper LV, Kolls JK. Pulmonary Th17 antifungal immunity is regulated by the gut microbiome. Journal of Immunology, 2016, 197(1): 97-107. DOI:10.4049/jimmunol.1502566 |
| [27] | Teng F, Klinger CN, Felix KM, Bradley CP, Wu E, Tran NL, Umesaki Y, Wu HJJ. Gut microbiota drive autoimmune arthritis by promoting differentiation and migration of Peyer's patch T follicular helper cells. Immunity, 2016, 44(4): 875-888. DOI:10.1016/j.immuni.2016.03.013 |
| [28] | Lee YK, Menezes JS, Umesaki Y, Mazmanian SK. Proinflammatory T-cell responses to gut microbiota promote experimental autoimmune encephalomyelitis. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(S1): 4615-4622. |
| [29] | Harley ITW, Stankiewicz TE, Giles DA, Softic S, Flick LM, Cappelletti M, Sheridan R, Xanthakos SA, Steinbrecher KA, Sartor RB, Kohli R, Karp CL, Divanovic S. IL-17 signaling accelerates the progression of nonalcoholic fatty liver disease in mice. Hepatology, 2014, 59(5): 1830-1839. DOI:10.1002/hep.26746 |
| [30] | Kim S, Kim H, Yim YS, Ha S, Atarashi K, Tan TG, Longman RS, Honda K, Littman DR, Choi GB, Huh JR. Maternal gut bacteria promote neurodevelopmental abnormalities in mouse offspring. Nature, 2017, 549(7673): 528-532. DOI:10.1038/nature23910 |
| [31] | Shin Yim Y, Park A, Berrios J, Lafourcade M, Pascual LM, Soares N, Yeon Kim J, Kim S, Kim H, Waisman A, Littman DR, Wickersham IR, Harnett MT, Huh JR, Choi GB. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature, 2017, 549(7673): 482-487. DOI:10.1038/nature23909 |
| [32] | Klaasen HLBM, Koopman JP, Van Den Brink ME, Bakker MH, Poelma FGJ, Beynen AC. Intestinal, segmented, filamentous bacteria in a wide range of vertebrate species. Laboratory Animals, 1993, 27(2): 141-150. DOI:10.1258/002367793780810441 |
| [33] | Yin YS, Wang Y, Zhu LY, Liu W, Liao NB, Jiang MZ, Zhu BL, Yu HD, Xiang C, Wang X. Comparative analysis of the distribution of segmented filamentous bacteria in humans, mice and chickens. The ISME Journal, 2013, 7(3): 615-621. DOI:10.1038/ismej.2012.128 |
| [34] | Jonsson H. Segmented filamentous bacteria in human ileostomy samples after high-fiber intake. FEMS Microbiology Letters, 2013, 342(1): 24-29. DOI:10.1111/1574-6968.12103 |
| [35] | Chen B, Chen HH, Shu XL, Yin YS, Li J, Qin JJ, Chen LJ, Peng KR, Xu F, Gu WZ, Zhao H, Jiang LQ, Li LJ, Song J, Elitsur Y, Yu HD, Jiang MZ, Wang X, Xiang C. Presence of segmented filamentous bacteria in human children and its potential role in the modulation of human gut immunity. Frontiers in Microbiology, 2018, 9: 1403. DOI:10.3389/fmicb.2018.01403 |
| [36] | Caselli M, Cassol F, Gentili V, Di Luca D. Genome sequences of segmented filamentous bacteria in animals:implications for human research. Gut Microbes, 2012, 3(5): 401-405. DOI:10.4161/gmic.20736 |
| [37] | Zwirzitz B, Pinior B, Metzler-Zebeli B, Handler M, Gense K, Knecht C, Ladinig A, Dzieciol M, Wetzels SU, Wagner M, Schmitz-Esser S, Mann E. Microbiota of the gut-lymph node axis:depletion of mucosa-associated segmented filamentous bacteria and enrichment of Methanobrevibacter by colistin sulfate and linco-spectin in pigs. Frontiers in Microbiology, 2019, 10: 599. DOI:10.3389/fmicb.2019.00599 |
| [38] | Caselli M, Tosini D, Gafà R, Gasbarrini A, Lanza G. Segmented filamentous bacteria-like organisms in histological slides of ileo-cecal valves in patients with ulcerative colitis. American Journal of Gastroenterology, 2013, 108(5): 860-861. DOI:10.1038/ajg.2013.61 |
| [39] | Finotti A, Gasparello J, Lampronti I, Cosenza LC, Maconi G, Matarese V, Gentili V, Di Luca D, Gambari R, Caselli M. PCR detection of segmented filamentous bacteria in the terminal ileum of patients with ulcerative colitis. BMJ Open Gastroenterology, 2017, 4(1): e000172. DOI:10.1136/bmjgast-2017-000172 |
| [40] | Chase DG, Erlandsen SL. Evidence for a complex life cycle and endospore formation in the attached, filamentous, segmented bacterium from murine ileum. Journal of Bacteriology, 1976, 127(1): 572-583. |
| [41] | Pamp SJ, Harrington ED, Quake SR, Relman DA, Blainey PC. Single-cell sequencing provides clues about the host interactions of segmented filamentous bacteria (SFB). Genome Research, 2012, 22(6): 1107-1119. DOI:10.1101/gr.131482.111 |
| [42] | Prakash T, Oshima K, Morita H, Fukuda S, Imaoka A, Kumar N, Sharma VK, Kim SW, Takahashi M, Saitou N, Taylor TD, Ohno H, Umesaki Y, Hattori M. Complete genome sequences of rat and mouse segmented filamentous bacteria, a potent inducer of th17 cell differentiation. Cell Host & Microbe, 2011, 10(3): 273-284. |
| [43] | Schnupf P, Gaboriau-Routhiau V, Gros M, Friedman R, Moya-Nilges M, Nigro G, Cerf-Bensussan N, Sansonetti PJ. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature, 2015, 520(7545): 99-103. DOI:10.1038/nature14027 |
