刘丽君1

 , 汪洋1, 刘双江2,3, 姜成英2,3
, 汪洋1, 刘双江2,3, 姜成英2,3

1. 西安医学院基础医学部病原生物学教研室, 陕西 西安 710021;
2. 中国科学院微生物研究所, 微生物资源前期开发国家重点实验室, 北京 100101;
3. 环境微生物技术联合实验室, 北京 100101
收稿日期:2019-01-28;修回日期:2019-04-05;网络出版日期:2019-06-18
基金项目:国家自然科学基金(31600040,31670124,91851206),陕西省教育厅科研计划(16JK1654),陕西省高校科协青年人才托举项目(20160231)
*通信作者:刘丽君, Tel:+86-29-86132856, E-mail:lijunliu2015@foxmail.com;
姜成英, Tel:+86-10-64807581, E-mail:jiangcy@im.ac.cn.
摘要:微生物参与的还原性无机硫化合物的氧化过程是硫地球化学循环的重要组成部分,也可应用于生物冶金工业及酸性矿水治理等方面。嗜热古菌是高温环境中存在的一群特殊的微生物,其所参与的异化型硫氧化途径复杂多样,涉及众多氧化还原酶以及硫转运蛋白。本文将结合我们的研究工作,就参与异化型硫氧化代谢过程的嗜热古菌的种类,以及它们所参与的硫氧化过程进行系统的介绍。
关键词:嗜热微生物古菌异化型硫氧化
Advances in dissimilatory sulfur oxidation pathways in thermophilic archaea
Lijun Liu1

 , Yang Wang1, Shuangjiang Liu2,3, Chengying Jiang2,3
, Yang Wang1, Shuangjiang Liu2,3, Chengying Jiang2,3

1. Department of Pathogen Biology, School of Basic Medical Science, Xi'an Medical University, Xi'an 710021, Shaanxi Province, China;
2. State Key Laboratory of Microbial Resources, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
3. IMCAS-RCEECAS Joint-Laboratory of Microbial Technology for Environmental Science, Beijing 100101, China
Received: 28 January 2019; Revised: 5 April 2019; Published online: 18 June 2019
*Corresponding author: Lijun Liu, Tel:+86-29-86132856, E-mail:lijunliu2015@foxmail.com;
Chengying Jiang, Tel:+86-10-64807581, E-mail:jiangcy@im.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31600040, 31670124, 91851206), by the Fund of the Educational Department of Shaanxi Province (16JK1654) and by the Fund of Youth Talents Support of Shaanxi University Association of Science and Technology (20160231)
Abstract: Microorganisms-involved oxidation processes of reduced inorganic sulfur compounds (RISCs) are significant components of sulfur geochemical cycle, and could also be applied in biomining industry and acid mine water treatment. Thermophilic archaea are a special group of microorganisms in high temperature environments. They participate in a variety of dissimilatory sulfur oxidation pathways, involving many redox enzymes and sulfur transporter proteins. In this review, the species of thermophilic archaea involved in the metabolic processes of dissimilatory sulfur oxidation, and the sulfur oxidation processes they participate in will be systematically introduced in combination with our research work.
Keywords: thermophilic microorganismsarchaeadissimilatory sulfur oxidation
硫元素以多种价态形式存在于自然界,为地球上十大元素之一。微生物参与的还原性无机硫化合物(reduced inorganic sulfur compounds,RISCs)的氧化过程是硫地球化学循环的重要组成部分,关联着自然界氮、碳及氧等其他元素的地球化学循环,甚至影响着全球环境问题[1-3]。
多年来,虽然对参与硫氧化代谢的微生物资源、硫代谢途径等进行了广泛的研究,揭示了硫代谢微生物菌种及代谢途径的多样性[4],丰富了人们对微生物硫代谢的认识,促进了硫代谢微生物在生物冶金工业及酸性矿水治理方面的应用,但是由于硫代谢系统的多样性及复杂性,国内外对于硫代谢系统的认识还很不全面。为了更深入地了解嗜热古菌异化型硫氧化途径的最新研究进展,本文就参与异化型硫氧化代谢过程的嗜热古菌,以及它们所参与的硫氧化过程进行了系统的介绍。
1 异化型硫氧化过程 元素硫在自然界中广泛存在,纯净的元素硫以黄色的晶体形式存在,又称作硫磺。硫是所有生命体的基本元素,广泛用于生物化学合成过程中。无机硫具有多种不同的化合价,如?2、?1、0、+4、+5和+6价。无机硫化合物在生物体内的生物学功能分为两个方面,一方面参与硫的同化过程,用于合成含硫的有机物,如维生素和氨基酸[5];另一方面作为电子供体或者电子受体参与硫的异化过程,通过电子传递偶联能量的储存。异化型硫能量代谢几乎专一地存在于原核生物中,包括古菌和细菌[4]。
还原性无机硫化合物(RISCs)的异化氧化过程通过光能或化能微生物的呼吸过程与能量转化相关联。RISCs能够作为厌氧光合生长、好氧或者厌氧化能生长过程中的电子供体,在大多数情况下它最终被氧化成硫酸,氧化过程产生的电子,在化能营养型微生物中用于呼吸链和二氧化碳固定过程中的能量转化,厌氧光合细菌则利用光能来传递氧化过程中获得的电子,用于二氧化碳的固定[4]。
微生物参与的RISCs氧化过程是硫地球化学循环的重要组成部分,在农业、废物处理以及生物冶金过程中都有重要的应用。
2 参与异化型硫氧化过程的嗜热古菌 基于对16S (18S) rRNA基因序列的研究结果,Carl R. Woese于1977年提出生物分类“三域学说”,古菌被确定为不同于细菌和真核生物的特殊类群[6]。迄今为止,古菌域已含有包括Euryarchaeota、Crenarchaeota、Thaumarchaeota、Bathyarchaeota、Odinarchaeota、Heimdallarchaeota、Korarchaeota和Nanoarchaeota在内的多个门类[7]。
地球上的高温环境包括火山喷气孔、热泉、间歇喷泉、深海热液喷口等;还有一些人为制造的高温环境,比如高温反应器、堆肥设施等。嗜热微生物(thermophiles)是高温环境中存在的主要微生物类群,包括嗜热细菌和嗜热古菌。嗜热微生物包括中度嗜热微生物(moderately thermophiles)和极端嗜热微生物(extreme thermophiles),其中中度嗜热微生物的最适生长温度通常为40?60 ℃,极端嗜热微生物的最适生长温度通常高于60 ℃[8]。
硫化物和硫的氧化是高温环境中存在的主要生物氧化过程。参与硫氧化的嗜热古菌存在于广古菌门(Euryarchaeota)和泉古菌门(Crenarchaeota)中,包括Euryarchaeota中的Acidiplasma以及Crenarchaeota中硫化叶菌目(Sulfolobales)的Acidianus、Metallosphaera、Sulfolobus和Sulfurisphaera等属,这些菌的主要生理特征详见表 1。
表 1. 嗜热硫氧化古菌的种类及其代谢特点 Table 1. Metabolic features of sulfur-oxidizing thermophilic archaea
| Thermophiles | Nutritional type | Optimal temperature and pH | Representative species | Electron donor |
| Euryarchaeota | ||||
| ??Acidiplasma | Facultatively anaerobic. Chemoorganotrophic | Moderately thermophilic, 42–45 ℃. Acidophilic, pH 1.4–1.6 | Acidiplasma aeolicum | S4O62– |
| Crenarchaeota | ||||
| ??Acidianus | Facultatively anaerobic. Chemolithoautotrophic | Extreme thermophilic, 45–96 ℃. Acidophilic, pH 1.5–2.5 | Acidianus ambivalens Acidianus brierleyi Acidianus copahuensie Acidianus sulfidivorans Acidianus manzaensis | S0 |
| Sulfurisphaera | Facultatively anaerobic. Chemolithoautotrophic | Extreme thermophilic, 60–96 ℃. Acidophilic, pH 1.5–6.0 | Sulfurisphaera javensis Sulfurisphaera ohwakuensis Sulfurisphaera tokodaii | S0, FeS2, S4O62– |
| Sulfolobus | Aerobic. Chemolithoautotrophic | Extreme thermophilic, 65–70 ℃ Acidophilic, pH 1.0–4.5 | Sulfolobus metallicus | S0, sulfidic ores |
| ??Metallosphaera | Obligately aerobic. Facultatively chemolithoautotrophic | Extreme thermophilic, 74 ℃. Acidophilic, pH 1.0–4.5 | M. sedula M. cuprina M. yellowstonensis M. hakonensis | S0, sulfidic ores |
表选项
Acidiplasma为兼性厌氧的嗜酸菌,中度嗜热,为化能有机营养型。Acidiplasma aeolicum不能单独利用S0、连四硫酸钾或硫代硫酸钠进行生长。在Fe2+和0.02% (W/V)酵母提取物存在时,Acidiplasma aeolicum能够氧化连四硫酸钾,且达到其最佳的生长状态[9]。
Acidianus和Sulfurisphaera属均为兼性厌氧。Acidianus属在有氧条件下能够氧化含硫化合物、H2和Fe2+,厌氧条件下可以将H2作为电子供体,还原S0生成H2S营自养生长[10-14]。Sulfurisphaera属的成员在厌氧条件下能够利用S0,厌氧且存在酵母时能够利用FeCl3;有氧条件下,能够利用S0、pyrite、K2S4O6和H2进行化能自养生长,包括Sulfurisphaera javensis、Sulfurisphaera ohwakuensis和Sulfurisphaera tokodaii (原为Sulfolobus tokodaii)[15]。
Sulfolobus和Metallosphaera属的成员均严格好氧。Sulfolobus属的部分菌株能够氧化含硫化合物进行自养生长,但多数菌株则利用有机物进行异养生长[16]。Metallosphaera属主要通过氧化还原性无机含硫化合物(尤其是硫化矿物)或S0获得能量进行自养生长,也可以利用有机底物营异养生长[17-18]。
3 嗜热古菌参与的异化型硫氧化途径 目前,在古菌中尚未发现普遍存在于硫氧化细菌中的Sox (sulfur-oxidizing)途径和Dsr (dissimilatory sulfite reductase)途径,古菌的硫氧化具有独特的酶和途径。
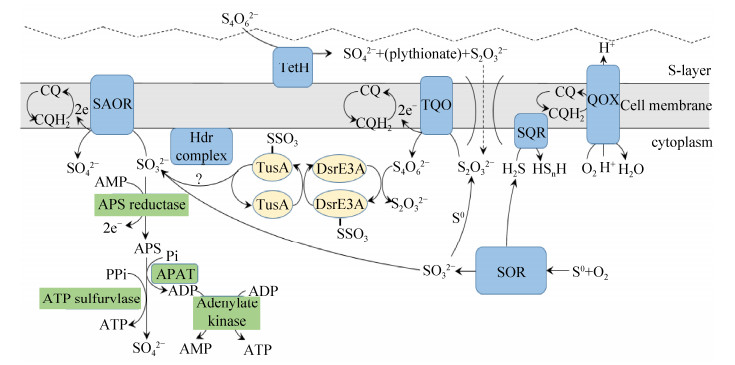
3.1 元素硫S0的氧化 SOR (sulfur oxygenase reductase)最早在Acidianus ambivalens中被发现并研究,该酶起始该菌中的有氧硫氧化过程——催化依赖于氧气的元素硫S0的歧化反应,生成亚硫酸(sulfite,SO32–)、硫代硫酸(thiosulfate,S2O32–)和硫化氢(H2S),S0在反应过程中同时充当电子供体和电子受体。反应中产生的硫代硫酸可能由亚硫酸和S0之间的化学反应生成而来(图 1)[11]。此后,在Acidianus tengchongensis和Acidianus brierleyi中也检测到了SOR活性[19-20]。
 |
| 图 1 嗜热硫氧化古菌异化型硫氧化途径模式图 Figure 1 The model of dissimilatory sulfur oxidation pathways in thermophilic archaea |
| 图选项 |
SOR的晶体结构解析结果发现,它是由24个相同的单体构成的同型多聚体,内部为中空球状构型,每个单体都有一个催化反应的活性口袋,包括1个单核非血红素铁位点和3个保守的半胱氨酸(C31、C101和C104),定点突变实验证实3个保守的Cys对催化反应都是必需的,推测C31参与结合反应底物,而C101和C104参与硫的歧化反应。SOR催化反应的可能底物是以链状形式存在的多聚硫烷的硫原子(polysulfane),该底物带负电荷,通过由4个单体聚合构成的烟囱状突起的非极性通道,进入SOR多聚体内部带正电的纳米级反应空间。反应产物(H2S、sulfite和thiosulfate)的出口则是由三聚体构成的更窄的极性通道。SOR催化硫氧化不需要外界的辅因子和电子载体,不参与电子的传递和底物水平磷酸化[21-23]。SOR在Acidianus ambivalens和Acidianus tengchongensis细胞中的分布位置存在差异,它仅存在于前者的细胞质中,而在后者的细胞质中和细胞质膜上均检测到SOR的活性[24]。
SOR的同源蛋白在Acidianus属的成员中分布广泛,包括Acidianus hospitalis、Acidianus copahuensis、Acidianus sulfidivorans、Acidianus manzaensis和Acidianus. brierleyi,除此之外,在Sulfolobaceae科的Sulfurisphaera tokodaii和Sulfolobus metallicus中也存在SOR。但Metallosphaera以及该科的其他成员中并不存在SOR,据此推测,在这些嗜热硫氧化的古菌中可能存在其他的关键蛋白参与元素硫S0初始的氧化过程,这有待进一步研究揭示。蛋白序列分析发现Euryarchaeota中Picrophilus (P.) torridus、P. oshimae、Ferroplasma (F.) acidarmanus、F. acidiphilum和Acidiplasma aeolicum中存在SOR相似蛋白[23, 25],但是关于这些蛋白的功能研究还未见报道。
3.2 硫化物的氧化 硫化物:醌氧化还原酶(sulfide:quinone oxidoreductase,SQR)在生物体中广泛存在,在古菌、细菌,真菌、昆虫以及人类等真核生物中均被发现[26]。
通过对不同来源SQRs的结构和序列特征进行分析比较,Marcia等将该酶分为Types I–VI六类[27]。基于之前的分类结果,Sousa等于2018年又对SQRs重新分类,新分类与Marcia等的分类不完全一致,但存在一些相似之处[28]。有关两种分类的比较,在陈静等的综述中有详细的描述[29]。
在两种分类方法中,来自古菌Sulfolobales目的SQRs均属于Type V SQRs。该类型的典型代表来自于Acidianus ambivalens[27]。Type V SQRs的序列特征是在154–178位置(SQR在Acidianus ambivalens中的编号)含有一个延长的“capping loop”。在Acidianus ambivalens中,SOR催化S0还原产生的H2S被位于细胞膜上的SQR氧化(图 1)。SQR在细胞膜上以二聚体的形式存在,2个亚基不对称分布。解析该酶的三维结构,发现其具有两个氧化还原活性中心,一个是共价连接的辅因子黄素腺嘌呤二核苷酸(FAD,flavin adenine dinucleotide),另一个是与FAD相邻的一对半胱氨酸残基(C178和C350),这一对半胱氨酸残基由3个硫原子组成的硫链连接。反应底物H2S可能通过位于FAD re-side的通道进入催化反应中心,被氧化生成多硫化物H-Sn-H (可能由4个或5个硫原子构成),该反应产物又可以进一步作为SOR的反应底物,氧化H2S产生的电子用于还原位于FAD si-side的醌,进入呼吸链,偶联能量的产生[30]。
对蛋白序列的分析发现SQR同源蛋白在古菌中广泛分布。Acidianus和Metallosphaera属多个成员都具有SQR同源蛋白,如Acidianus hospitalis、Acidianus sulfidivorans、Acidianus manzaensis、Acidianus brierleyi以及M. sedula、M. cuprina、M. yellowstonensis和M. hakonensis[31-33]。此外,Sulfolobus metallicus、Sulfolobus islandicus、Sulfolobus sp. A20、Sulfurisphaera tokodaii、Saccharolobus solfataricus、Sulfodiicoccus acidiphilus、P. oshimae、P. torridus、F. acidiphilum、F. acidarmanus等以及Acidiplasma和Thermoplasma属成员中也存在SQR (Acidianus ambivalens)的高同源性蛋白。SQR的广泛分布,而且在Acidianus hospitalis中还存在不止一个拷贝,说明其在古菌硫氧化过程中发挥重要的作用。
3.3 硫代硫酸的氧化 在嗜热古菌Acidianus ambivalens中,硫代硫酸由位于细胞膜上的硫代硫酸:醌氧化还原酶(thiosulfate:quinone oxidoreductase,TQO)氧化生成连四硫酸(tetrathionate,TT),氧化过程产生的电子通过电子受体醌(caldariella quinones,CQ)传递给末端醌:氧氧化还原酶(terminal quinol:oxygen oxidoreductase),用于还原氧气,产生质子梯度,从而偶联能量的产生。TQO由2个亚基组成,大亚基DoxA和小亚基DoxD;末端醌:氧氧化还原酶则由3个亚基组成DoxB、DoxC和DoxE;这2个氧化还原酶可能形成一个不牢固的复合物而有利于CQ在其间传递电子。Acidianus ambivalens中还存在另一个拷贝的DoxDA (DoxD2和DoxA2),但其具体功能未知,与DoxDA在进化上相互独立[34]。通过蛋白序列比对发现,在Acidianus属的成员、Saccharolobus solfataricus和Sulfolobus islandicus中,都存在DoxD2和DoxA2的同源蛋白,而Metallosphaera属的成员中仅存在DoxD2的同源蛋白,无DoxA2同源蛋白存在。
DoxA和DoxD同源蛋白的编码基因在Crenarchaeota中多个属的成员中存在,如Acidianus和Metallosphaera属的成员、Sulfolobus metallicus、Sulfolobus islandicus、Sulfolobus sp. A20、Sulfurisphaeratokodaii、Saccharolobus solfataricus、Sulfodiicoccus acidiphilus、Acidilobus saccharovorans等和Vulcanisaeta及Euryarchaeota的Acidiplasma aeolicum、Acidiplasma cupricumulans、P.torridus以及P. oshimae中都存在[35]。DoxDA在古菌氧化硫代硫酸的过程中发挥重要作用。
3.4 亚硫酸的氧化 亚硫酸被氧化为硫酸的过程分为直接氧化和间接氧化两个途径(图 1)。
3.4.1 亚硫酸的直接氧化: 亚硫酸的直接氧化是通过亚硫酸受体氧化还原酶(sulfite:acceptor oxidoreductases,SAOR)或者亚硫酸脱氢酶(sulfite dehydrogenases)来实现的,它们为单核钼酶,属于亚硫酸氧化酶家族,不能利用氧气作为电子受体,参与这一反应的酶在很多微生物体内都有分布,遗传和酶学特性研究得比较清楚的是细菌Starkeya novella中的SorAB[36-37]。
古菌中研究较清楚的亚硫酸氧化主要是在Acidianus ambivalens中,Acidianus ambivalens的细胞膜部分检测到了SAOR的酶活,因此推测SAOR可能将氧化SO32–产生的电子通过同样位于细胞膜的醌(CQ)传递给细胞色素aa3,继而传递给末端氧化酶。由SOR氧化生成的SO32–分布在胞内,而其氧化产物SO42–则在胞外积累,SAOR在具有催化反应能力的同时是否还具有跨膜转运SO42–的能力,或者是否存在另外的蛋白,发挥转运SO42–的功能,目前还不清楚[38]。
M. sedula的基因组中存在两个编码SAOR-like蛋白的基因,一个编码假想的亚硫酸氧化酶(sulfite oxidase,Msed0362),另一个编码假想的亚硫酸还原酶(sulfite reductase,Msed0961)[31]。经过对M. cuprina Ar-4的基因组序列分析发现,该菌中含有覆盖长度较短的SAOR同源蛋白的编码基因[32]。
3.4.2 亚硫酸的间接氧化: 间接氧化SO32–的途径依赖于AMP,通过中间产物APS (adenylylsulfate,adenosine-5?-phosphosulfate)来实现,该过程发生在细胞质内。APS还原酶(APS reductase,EC 1.8.99.2;对应的编码基因为aprMBA或者aprBA)催化SO32–和AMP生成APS,同时释放2个电子。在第二步的反应中,APS中所含的AMP有两种去向,一种是转移给焦磷酸(pyrophosphate,PPi),通过ATP sulfurylase (ATP︰sulfate adenylyltransferase,EC 2.7.7.4;对应的编码基因为sat)催化生成ATP和SO42–;另一种是转移给磷酸(phosphate,Pi),通过APAT (adenylylsulfate︰phosphate adenylyltransferase,也叫作ADP sulfurylase)催化生成ADP和SO42–,ADP能够通过腺苷激酶(adenylate kinase)催化生成ATP,因此该步反应的两种途径都偶联底物水平磷酸化[36]。
在Acidianus ambivalens中检测到了APS还原酶、APAT和腺苷激酶的活性,该菌中存在的SO32–间接氧化途径可能为先生成中间产物APS以及ADP,最终在APAT和腺苷激酶的作用下生成ATP和SO42–[38]。M. sedula的基因组中含有编码APS还原酶和ATP sulfurylase的基因,并未发现腺苷激酶的编码基因,因此推测该菌体内存在的SO32–间接氧化途径可能是通过生成中间产物APS,以及最终生成ATP和SO42–来实现的[31]。M. cuprina Ar-4基因组中不含有APS还原酶和ATP sulfurylase的编码基因,但是存在腺苷激酶的编码基因,该菌中SO32–间接氧化途径还不清楚。
3.5 连四硫酸的水解 连四硫酸的水解由连四硫酸水解酶(tetrathionate hydrolase,TetH)催化。Acidianus ambivalens中的TetH位于细胞的假周质空间(pseudo-periplasmic fraction),为β-propeller结构,与细胞膜外表面相连。在pH低至1、反应温度为95 ℃或以上时,TetH达到最佳反应活性,pH从2升高到5时,反应活性逐渐下降,pH 6时失去反应活性,反应产物可能为S2O32–和SO42–。tetH仅在Acidianus ambivalens以TT为底物生长时表达,在该菌以S0为底物生长时几乎不表达[39]。而在Acidianus hospitalis YS8菌株中发现TetH被分泌至细胞外,为形似拉链的细丝状颗粒(filamentous particles),该蛋白的产生可能是环境胁迫的作用结果。当细胞受到mitomycin C处理、紫外线照射或在液氮中冷冻而后迅速解冻,TetH的产生量增加;当菌株处于适宜的生长环境时,TetH分泌至培养液上清中的量减少,甚至几乎检测不到。序列比对发现,来自于Acidianus ambivalens和Acidianus hospitalis YS8的TetH具有高达99%的同源性[40]。从以上的研究结果可以看出,无论是Acidianus ambivalens还是Acidianus hospitalis YS8中,TetH都非组成型表达,而是在一定外界条件的刺激下才表达。
对TetH进行的序列比对分析发现,其编码基因tetH仅存在于严格自养或者兼性自养菌中,而且它们含有至少2个拷贝。TetH的系统进化树含有2个明显的进化枝,包含TetH1的进化枝即为已经测定酶活和已知功能的TetH,而另一个进化枝包含的旁系同源蛋白TetH2的功能目前还未知[39]。
3.6 硫氧化过程中的硫转移 嗜热古菌的硫代谢除了硫的氧化、水解过程,还存在硫的转移过程。Acidianus ambivalens中TQO的催化活性部位朝向细胞质,因此由TQO催化硫代硫酸氧化产生的TT会释放至细胞质[39]。我们在对Metallosphaera cuprina Ar-4的硫代谢研究中发现,释放至细胞质的TT,可以被同样位于细胞质的硫转移蛋白DsrE3A所结合,DsrE3A的保守半胱氨酸残基(C93和C101)分别结合一个硫代硫酸基团,产生DsrE3A-Cys-S-thiosulfonate,而后其将硫代硫酸基团传递给另一个硫转移蛋白TusA,结合了外源硫代硫酸基团的TusA (TusA-Cys-S-thiosulfonate)则极有可能为Hdr (heterodisulfide reductase)复合体提供含硫基团作为氧化还原反应的底物。TusA结合的sulfonate基团首先被释放,或直接水解为SO42–,或被还原为SO32–。TusA上剩余的外源硫原子再进一步地被氧化,最终被释放[41-42]。
M. cuprina Ar-4的基因组中,dsrE3A、tusA与Hdr复合体的编码基因hdrC1B1A1orf2hdrC2B2,位于同一个基因簇中,即dsrE3A-tusA-hdr基因簇,该基因簇不仅在嗜热硫氧化古菌Sulfolobaceae中存在,在硫氧化细菌Aquificaceae和Acidithiobacillaceae中也存在,Hdr复合体极有可能在不具有Dsr系统的硫氧化菌的硫氧化过程中发挥着重要的作用[41]。我们在对Metallosphaera cuprina Ar-4的蛋白质组研究结果中发现,在该菌以S0作为底物进行自养生长时,组成Hdr复合体的亚基上调表达,表明该复合体确实参与该菌的硫氧化过程[43]。
在嗜热硫氧化细菌Aquifex aeolicus中,已有实验证实Hdr复合体由5个亚基构成(HdrA、HdrB1、HdrB2、HdrC1和HdrC2),该复合体位于细胞膜内侧,可能在硫氧化菌中参与SO32–的形成[44]。
4 展望 硫氧化过程极其复杂多样,即使同为嗜热硫氧化古菌,其所采用的异化型硫氧化途径也不尽相同。尽管近年来的研究工作揭示了嗜热硫氧化古菌中存在的部分异化型硫氧化途径,但是尚存在很多未解决的问题。
起始S0氧化的SOR仅在Sulfolobaceae科Acidianus属成员、Sulfurisphaera tokodaii和Sulfolobus metallicus中存在,而在Metallosphaera属以及其他属成员中未发现,在这些硫氧化古菌中,必然存在其他催化酶类参与S0的氧化,这需要进一步研究证实。尽管有研究揭示了Hdr复合体的构成等化学特征,但是其在硫氧化菌中具体的生物学功能尚未确定[44]。我们的研究对象M. cuprina Ar-4菌株,其基因组中含有不完整的SAOR同源蛋白的编码基因,也不含有APS还原酶和ATP sulfurylase的编码基因,但是存在腺苷激酶的编码基因,该菌氧化SO32–的直接和间接途径都不明确,其异化型硫氧化的终产物SO42–是如何产生的,这些问题都需要进一步的研究来阐明。
硫氧化过程中,不仅有氧化还原酶类的参与,也涉及到硫转移蛋白。尽管我们之前的研究工作已经阐明了M. cuprina Ar-4菌株中硫转移蛋白DsrE3A和TusA转运含硫基团的功能,但是对于其他硫转移蛋白的功能尚不清楚[41]。在紫硫细菌Allochromatium vinosum中,硫转移蛋白Rhodanese与TusA和DsrEFH一同参与硫原子的转移过程[45],而Rhodanese-like蛋白在硫氧化古菌中也存在,其功能尚未确定。
References
| [1] | Canfield DE, Stewart FJ, Thamdrup B, de Brabandere L, Dalsgaard T, Delong EF, Revsbech NP, Ulloa OA. Cryptic sulfur cycle in oxygen-minimum-zone waters off the Chilean coast. Science, 2010, 330(6009): 1375-1378. DOI:10.1126/science.1196889 |
| [2] | Walsh DA, Zaikova E, Howes CG, Song YC, Wright JJ, Tringe SG, Tortell PD, Hallam SJ. Metagenome of a versatile chemolithoautotroph from expanding oceanic dead zones. Science, 2009, 326(5952): 578-582. DOI:10.1126/science.1175309 |
| [3] | Hawley AK, Brewer HM, Norbeck AD, Pa?a-Toli? L, Hallam SJ. Metaproteomics reveals differential modes of metabolic coupling among ubiquitous oxygen minimum zone microbes. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(31): 11395-11400. DOI:10.1073/pnas.1322132111 |
| [4] | Friedrich CG, Bardischewsky F, Rother D, Quentmeier A, Fischer J. Prokaryotic sulfur oxidation. Current Opinion in Microbiology, 2005, 8(3): 253-259. DOI:10.1016/j.mib.2005.04.005 |
| [5] | Kawano Y, Suzuki K, Ohtsu I. Current understanding of sulfur assimilation metabolism to biosynthesize L-cysteine and recent progress of its fermentative overproduction in microorganisms. Applied Microbiology and Biotechnology, 2018, 102(19): 8203-8211. DOI:10.1007/s00253-018-9246-4 |
| [6] | Woese CR, Fox GE. Phylogenetic structure of the prokaryotic domain: the primary kingdoms. Proceedings of the National Academy of Sciences of the United States of America, 1977, 74(11): 5088-5090. DOI:10.1073/pnas.74.11.5088 |
| [7] | Adam PS, Borrel G, Brochier-Armanet C, Gribaldo S. The growing tree of Archaea: new perspectives on their diversity, evolution and ecology. The ISME Journal, 2017, 11(11): 2407-2425. DOI:10.1038/ismej.2017.122 |
| [8] | Urbieta MS, Donati ER, Chan KG, Shahar S, Sin LL, Goh KM. Thermophiles in the genomic era: biodiversity, science, and applications. Biotechnology Advances, 2015, 33(6): 633-647. DOI:10.1016/j.biotechadv.2015.04.007 |
| [9] | Golyshina OV, Yakimov MM, Lunsdorf H, Ferrer M, Nimtz M, Timmis KN, Wray V, Tindall BJ, Golyshin PN. Acidiplasma aeolicum gen. nov., sp. nov., a Euryarchaeon of the family Ferroplasmaceae isolated from a hydrothermal pool, and transfer of Ferroplasma cupricumulans to Acidiplasma cupricumulans comb. nov. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(11): 2815-2823. DOI:10.1099/ijs.0.009639-0 |
| [10] | Segerer A, Neuner A, Kristjansson JK, Stetter KO. Acidianus infernus gen. nov., sp. nov., and Acidianus brierleyi comb. nov.: facultatively aerobic, extremely acidophilic thermophilic sulfur-metabolizing archaebacteria. International Journal of Systematic and Evolutionary Microbiology, 1986, 36(4): 559-564. |
| [11] | Kletzin A. Coupled enzymatic production of sulfite, thiosulfate, and hydrogen sulfide from sulfur: purification and properties of a sulfur oxygenase reductase from the facultatively anaerobic archaebacterium Desulfurolobus ambivalens. Journal of Bacteriology, 1989, 171(3): 1638-1643. DOI:10.1128/jb.171.3.1638-1643.1989 |
| [12] | Yoshida N, Nakasato M, Ohmura N, Ando A, Saiki H, Ishii M, Igarashi Y. Acidianus manzaensis sp. nov., a novel thermoacidophilic Archaeon growing autotrophically by the oxidation of H2 with the reduction of Fe3+. Current Microbiology, 2006, 53(5): 406-411. DOI:10.1007/s00284-006-0151-1 |
| [13] | Plumb JJ, Haddad CM, Gibson JAE, Franzmann PD. Acidianus sulfidivorans sp. nov., an extremely acidophilic, thermophilic archaeon isolated from a solfatara on Lihir Island, Papua New Guinea, and emendation of the genus description. International Journal of Systematic and Evolutionary Microbiology, 2007, 57: 1418-1423. DOI:10.1099/ijs.0.64846-0 |
| [14] | He ZG, Zhong HF, Li YQ. Acidianus tengchongensis sp. nov., a new species of acidothermophilic archaeon isolated from an acidothermal spring. Current Microbiology, 2004, 48(2): 159-163. DOI:10.1007/s00284-003-4155-9 |
| [15] | Tsuboi K, Sakai HD, Nur N, Stedman KM, Kurosawa N, Suwanto A. Sulfurisphaera javensis sp. nov., a hyperthermophilic and acidophilic archaeon isolated from Indonesian hot spring, and reclassification of Sulfolobus tokodaii Suzuki et al. 2002 as Sulfurisphaera tokodaii comb. nov. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(6): 1907-1913. DOI:10.1099/ijsem.0.002765 |
| [16] | Brock TD, Brock KM, Belly RT, Weiss RL. Sulfolobus: a new genus of sulfur-oxidizing bacteria living at low pH and high temperature. Archiv für Mikrobiologie, 1972, 84(1): 54-68. DOI:10.1007/BF00408082 |
| [17] | Huber G, Spinnler C, Gambacorta A, Stetter KO. Metallosphaera sedula gen, and sp. nov. represents a new genus of aerobic, metal-mobilizing, thermoacidophilic archaebacteria. Systematic and Applied Microbiology, 1989, 12(1): 38-47. DOI:10.1016/S0723-2020(89)80038-4 |
| [18] | Liu LJ, You XY, Guo X, Liu SJ, Jiang CY. Metallosphaera cuprina sp. nov., an acidothermophilic, metal-mobilizing archaeon. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(10): 2395-2400. DOI:10.1099/ijs.0.026591-0 |
| [19] | Sun CW, Chen ZW, He ZG, Zhou PJ, Liu SJ. Purification and properties of the sulfur oxygenase/reductase from the acidothermophilic archaeon, Acidianus strain S5. Extremophiles, 2003, 7(2): 131-134. DOI:10.1007/s00792-002-0304-5 |
| [20] | He ZG, Li YQ, Zhou PJ, Liu SJ. Cloning and heterologous expression of a sulfur oxygenase/reductase gene from the thermoacidophilic archaeon Acidianus sp. S5 in Escherichia coli. FEMS Microbiology Letters, 2000, 193(2): 217-221. DOI:10.1111/j.1574-6968.2000.tb09427.x |
| [21] | Urich T, Gomes CM, Kletzin A, Fraz?o C. X-ray structure of a self-compartmentalizing sulfur cycle metalloenzyme. Science, 2006, 311(5763): 996-1000. DOI:10.1126/science.1120306 |
| [22] | Li M, Chen ZW, Zhang PF, Pan XW, Jiang CY, An XM, Liu SJ, Chang WR. Crystal structure studies on sulfur oxygenase reductase from Acidianus tengchongensis. Biochemical and Biophysical Research Communications, 2008, 369(3): 919-923. DOI:10.1016/j.bbrc.2008.02.131 |
| [23] | Veith A, Urich T, Seyfarth K, Protze J, Fraz?o C, Kletzin A. Substrate pathways and mechanisms of inhibition in the sulfur oxygenase reductase of Acidianus ambivalens. Frontiers in Microbiology, 2011, 2: 37. |
| [24] | Chen ZW, Jiang CY, She QX, Liu SJ, Zhou PJ. Key role of cysteine residues in catalysis and subcellular localization of sulfur oxygenase-reductase of Acidianus tengchongensis. Applied and Environmental Microbiology, 2005, 71(2): 621-628. DOI:10.1128/AEM.71.2.621-628.2005 |
| [25] | Chen ZW, Liu YY, Wu JF, She Q, Jiang CY, Liu SJ. Novel bacterial sulfur oxygenase reductases from bioreactors treating gold-bearing concentrates. Applied Microbiology and Biotechnology, 2007, 74(3): 688-698. DOI:10.1007/s00253-006-0691-0 |
| [26] | Hell R, Dahl C, Knaff D, Leustek T. Sulfur metabolism in phototrophic organisms. Dordrecht, Netherlands: Springer, 2008: 319-335. |
| [27] | Marcia M, Ermler U, Peng GH, Michel H. A new structure-based classification of sulfide: quinone oxidoreductases. Proteins, 2010, 78(5): 1073-1083. DOI:10.1002/prot.22665 |
| [28] | Sousa FM, Pereira JG, Marreiros BC, Pereira MM. Taxonomic distribution, structure/function relationship and metabolic context of the two families of sulfide dehydrogenases: SQR and FCSD. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2018, 1859(9): 742-753. DOI:10.1016/j.bbabio.2018.04.004 |
| [29] | Chen J, Ren BW, Liu C, Sun L, Liu LJ. Recent advances in classification of sulfide quinone oxidoreductases. Natural Science, 2019, 1(2): 237-238. (in Chinese) 陈静, 任宝伟, 刘畅, 孙丽, 刘丽君. 硫化物:醌氧化还原酶分类最新研究进展. 自然科学, 2019, 1(2): 237-238. |
| [30] | Brito JA, Sousa FL, Stelter M, Bandeiras TM, Vonrhein C, Teixeira M, Pereira MM, Archer M. Structural and functional insights into sulfide: quinone oxidoreductase. Biochemistry, 2009, 48(24): 5613-5622. DOI:10.1021/bi9003827 |
| [31] | Auernik KS, Maezato Y, Blum PH, Kelly RM. The genome sequence of the metal-mobilizing, extremely thermoacidophilic archaeon Metallosphaera sedula provides insights into bioleaching-associated metabolism. Applied and Environmental Microbiology, 2008, 74(3): 682-692. DOI:10.1128/AEM.02019-07 |
| [32] | Liu LJ, You XY, Zheng HJ, Wang SY, Jiang CY, Liu SJ. Complete genome sequence of Metallosphaera cuprina, a metal sulfide-oxidizing archaeon from a hot spring. Journal of Bacteriology, 2011, 193(13): 3387-3388. DOI:10.1128/JB.05038-11 |
| [33] | Kozubal MA, Dlaki? M, Macur RE, Inskeep WP. Terminal oxidase diversity and function in "Metallosphaera yellowstonensis": gene expression and protein modeling suggest mechanisms of Fe(II) oxidation in the Sulfolobales. Applied and Environmental Microbiology, 2011, 77(5): 1844-1853. DOI:10.1128/AEM.01646-10 |
| [34] | Müller FH, Bandeiras TM, Urich T, Teixeira M, Gomes CM, Kletzin A. Coupling of the pathway of sulphur oxidation to dioxygen reduction: characterization of a novel membrane-bound thiosulphate: quinone oxidoreductase. Molecular Microbiology, 2004, 53(4): 1147-1160. DOI:10.1111/j.1365-2958.2004.04193.x |
| [35] | Liu YC, Beer LL, Whitman WB. Sulfur metabolism in archaea reveals novel processes. Environmental Microbiology, 2012, 14(10): 2632-2644. DOI:10.1111/j.1462-2920.2012.02783.x |
| [36] | Kappler U, Dahl C. Enzymology and molecular biology of prokaryotic sulfite oxidation. FEMS Microbiology Letters, 2001, 203(1): 1-9. DOI:10.1111/j.1574-6968.2001.tb10813.x |
| [37] | Kappler U. Bacterial sulfite-oxidizing enzymes. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2011, 1807(1): 1-10. |
| [38] | Zimmermann P, Laska S, Kletzin A. Two modes of sulfite oxidation in the extremely thermophilic and acidophilic archaeon Acidianus ambivalens. Archives of Microbiology, 1999, 172(2): 76-82. DOI:10.1007/s002030050743 |
| [39] | Protze J, Müller F, Lauber K, Na B, Mentele R, Lottspeich F, Kletzin A. An extracellular tetrathionate hydrolase from the thermoacidophilic archaeon Acidianus ambivalens with an activity optimum at pH 1. Frontiers in Microbiology, 2011, 2: 68. |
| [40] | Krupovic M, Peixeiro N, Bettstetter M, Rachel R, Prangishvili D. Archaeal tetrathionate hydrolase goes viral: secretion of a sulfur metabolism enzyme in the form of virus-like particles. Applied and Environmental Microbiology, 2012, 78(15): 5463-5465. DOI:10.1128/AEM.01186-12 |
| [41] | Liu LJ, Stockdreher Y, Koch T, Sun ST, Fan Z, Josten M, Sahl HG, Wang Q, Luo YM, Liu SJ, Dahl C, Jiang CY. Thiosulfate transfer mediated by DsrE/TusA homologs from acidothermophilic sulfur-oxidizing archaeon Metallosphaera cuprina. Journal of Biological Chemistry, 2014, 289(39): 26949-26959. DOI:10.1074/jbc.M114.591669 |
| [42] | Dahl C. Cytoplasmic sulfur trafficking in sulfur-oxidizing prokaryotes. IUBMB Life, 2015, 67(4): 268-274. DOI:10.1002/iub.1371 |
| [43] | Jiang CY, Liu LJ, Guo X, You XY, Liu SJ, Poetsch A. Resolution of carbon metabolism and sulfur-oxidation pathways of Metallosphaera cuprina Ar-4 via comparative proteomics. Journal of Proteomics, 2014, 109: 276-289. DOI:10.1016/j.jprot.2014.07.004 |
| [44] | Boughanemi S, Lyonnet J, Infossi P, Bauzan M, Kosta A, Lignon S, Giudici-Orticoni MT, Guiral M. Microbial oxidative sulfur metabolism: biochemical evidence of the membrane-bound heterodisulfide reductase-like complex of the bacterium Aquifex aeolicus. FEMS Microbiology Letters, 2016, 363(15): fnw156. DOI:10.1093/femsle/fnw156 |
| [45] | Stockdreher Y, Sturm M, Josten M, Sahl HG, Dobler N, Zigann R, Dahl C. New proteins involved in sulfur trafficking in the cytoplasm of Allochromatium vinosum. Journal of Biological Chemistry, 2014, 289(18): 12390-12403. DOI:10.1074/jbc.M113.536425 |
