高艳侠1,2,3, 张德锋1,3, 可小丽1,3, 刘志刚1,3, 衣萌萌1, 王淼1, 韩雪晴1,2, 卢迈新1,3


1. 中国水产科学研究院珠江水产研究所, 农业部热带亚热带水产资源利用与养殖重点实验室, 广东 广州 510380;
2. 上海海洋大学水产与生命学院, 上海 201306;
3. 广东省水产动物免疫技术重点实验室, 广东 广州 510380
收稿日期:2018-08-22;修回日期:2018-11-02;网络出版日期:2018-11-29
基金项目:现代农业产业技术体系专项资金(CARS-46);广州市科技计划(201804010481);广东省海洋和渔业发展专项资金(20170070000600403);广东省自然科学基金(2016A030313146)
*通信作者:卢迈新, E-mail:mx-lu@163.com.
摘要:[目的] 从健康尼罗罗非鱼(Oreochromis niloticus)肠道中筛选一株对罗非鱼源无乳链球菌等病原菌具有拮抗功能的益生菌。[方法] 取健康尼罗罗非鱼肠道,匀浆后进行10倍系列梯度稀释,然后涂布BHI平板,培养1-2 d,挑取单克隆菌落。采用点种法初步筛选对罗非鱼源无乳链球菌有拮抗作用的菌株,选取其中一株拮抗效果较好的菌株LF01,通过形态学、生理生化特征以及分子生物学分析,对LF01菌株进行鉴定。然后对LF01菌株的生长特性、水解淀粉和酪蛋白能力、药物敏感特性、抗菌谱和生物安全性进行测定和分析。[结果] 根据菌落形态和生长时间的差异,从健康尼罗罗非鱼肠道中筛选出64株细菌,通过拮抗试验筛选出6株具有明显拮抗效果的菌株,其中LF01菌株的拮抗效果最好。根据LF01的形态、生理生化特征和gyrA基因的进化分析,确定该菌株为贝莱斯芽孢杆菌(Bacillus velezensis)。LF01菌株的最适生长温度为30℃,最适pH值为7,最适盐度为5‰,而且该菌株具有水解淀粉和酪蛋白的功能。药敏试验结果显示,LF01菌株对多数抗生素敏感,仅对杆菌肽耐药。拮抗试验结果显示LF01株对无乳链球菌、海豚链球菌、迟缓爱德华氏菌、鮰爱德华氏菌、嗜水气单胞菌、舒氏气单胞菌、维氏气单胞菌、简氏气单胞菌、鰤鱼诺卡氏菌等病原菌均具有拮抗作用,其中对鰤鱼诺卡氏菌的拮抗作用最强,平均抑菌圈直径达28.3 mm。生物安全试验表明,LF01菌株对尼罗罗非鱼、斑马鱼(Danio rerio)和乌鳢(Channa argus)等3种鱼均无致病性,具有良好的安全性。[结论] 本研究筛选了一株贝莱斯芽孢杆菌LF01株,该菌的生物安全性良好,而且可拮抗常见的水产病原菌,具有防控多种水产经济动物疾病的潜力,应用前景十分广阔。
关键词:贝莱斯芽孢杆菌无乳链球菌点种法抑菌药敏试验
Selection and characterization of intestinal Bacillus strain antagonistic against pathogenic Streptococcus agalactiae of tilapia
Yanxia Gao1,2,3, Defeng Zhang1,3, Xiaoli Ke1,3, Zhigang Liu1,3, Mengmeng Yi1, Miao Wang1, Xueqing Han1,2, Maixin Lu1,3


1. Key Laboratory of Tropical & Subtropical Fishery Resource Application & Cultivation, Ministry of Agriculture; Pearl River Fisheries Research Institute, Chinese Academy of Fisheries Sciences, Guangzhou 510380, Guangdong Province, China;
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. Key Laboratory of Aquatic Animal Immune Technology, Guangzhou 510380, Guangdong Province, China
*Corresponding author: Lu Maixin, E-mail:mx-lu@163.com.
Foundation item: Supported by the China Agriculture Research System (CARS-46), by the Guangzhou Science and Technology Plan Project (201804010481), by the Special Project for Marine and Fishery Development (Fish Disease Control) in Guangdong Province (20170070000600403) and by the Natural Science Foundation of Guangdong Province (2016A030313146)
Abstract: [Objective] The aim of this study was to screen a probiotic strain that antagonizes Streptococcus agalactiae isolated from the intestine of healthy Nile tilapia (Oreochromis niloticus). [Methods] The gut of healthy tilapia was collected, homogenized, and diluted by a 10-fold series. Then 0.3mL suspension was streaked on brain heart infusion plates and incubated for 1-2 d at 30℃, and then single colonies were selected for purification. Strains had antagonistic function against S. agalactiae were screened by the dot-inoculating method, and a strain named LF01 with a better antagonistic effect was selected. In this study, the strain LF01 was identified by physiological, biochemical characteristics and molecular biological analysis. In addition, some characteristics and biosafety of the strain LF01 were determined and analyzed. [Results] A total of 64 strains were isolated from the intestine of healthy tilapia and 6 strains with obvious antagonistic effects were obtained, with the antagonism of LF01 strain considered the best. Strain LF01 was identified as Bacillus velezensis. The best growth temperature, pH, and salinities of strain LF01 were 30℃, 7, and 5‰, respectively. Furthermore, the strain LF01 exhibited the ability to hydrolyze starch and casein. Strain LF01 was sensitive to most antibiotics and resistant only to bacitracin, and showed antimicrobial activity against a broad range of fish pathogens including Streptococcus agalactiae, Streptococcus iniae, Edwardsiella tarda, Edwardsiella ictaluri, Aeromonas hydrophila, Aeromonas schubertii, Aeromonas veronii, Aeromonas jandaei and Nocardia seriolae. Biosafety tests suggested that the strain LF01 was not pathogenic to Nile tilapia, Danio rerio, and Channa argus. [Conclusion] In this study, it was found that B. velezensis LF01 strain isolated from the intestine of healthy tilapia has good biosafety and could antagonize the common aquatic pathogens. It has the potential to prevent and control a variety of aquatic animal diseases, and has broad application prospects.
Keywords: Bacillus velezensisStreptococcus agalactiaedot-inoculating methodinhibitionantibiotic sensitivity test
芽孢杆菌在自然界中分布广泛,该菌营养需求简单、繁殖快、抗逆性强,通常可分泌多种抗菌活性物质和胞外酶,如脂肽类、磷脂类、淀粉酶和蛋白酶等,其不仅能够改善养殖水体水质[1],还能够抑制病原菌繁殖,提高宿主免疫力[2]。此外,芽孢杆菌在饲料加工储存及消化道中稳定性较好,具有作为微生态制剂应用的潜在优势[3]。
罗非鱼是热带、亚热带地区的淡水和咸淡水水域的优良养殖鱼类品种,具有生长繁殖快、抗逆性强等优势,于1976年被联合国粮农组织(FAO)向全世界推广养殖[4-5]。当前,广东、广西、海南、福建和云南等地区已成为我国罗非鱼养殖主产区,但是,自2009年以来,链球菌病的连年暴发,已严重制约着我国罗非鱼的健康养殖,并造成了严重的经济损失[6]。无乳链球菌(Streptococcus agalactiae)是罗非鱼链球菌病的主要致病菌,该菌导致养殖罗非鱼在高温季节的感染率和死亡率均较高,并且该病难以控制[7-8]。近年来,嗜水气单胞菌[9]、舒氏气单胞菌[10]、迟缓爱德华氏菌[11]等病原均可造成罗非鱼细菌性病害,增加了罗非鱼细菌性疾病的防控难度。当前,罗非鱼链球菌病的防控主要依赖抗生素等药物,但是抗生素滥用和长期使用不仅干扰和破坏养殖水体中自然微生态系统的平衡,而且易造成病原菌的耐药性和水产品的药物残留等问题,不仅增加了病害的防控难度,其产品还对人类健康造成威胁[12-13]。因此,生态防治显得尤为重要,通过益生菌的使用,抑制病原菌的同时改善养殖生态环境,增强养殖动物免疫力,从而有效避免抗生素等药物带来的耐药性和药物残留等问题[14]。
然而,目前有关水生动物疾病防控的益生菌筛选及应用相关研究基础薄弱,能够用于病害防控的拮抗益生菌十分匮乏,远远不能满足当前水生动物疾病防控的迫切需求。本研究从尼罗罗非鱼肠道中筛选出1株对罗非鱼源无乳链球菌及淡水鱼类常见致病菌具有较强拮抗作用的益生性芽孢杆菌,并对其进行菌种鉴定及生物学特性研究,以期丰富无乳链球菌的生防微生物资源,也为罗非鱼链球菌病的生物防治提供基础。
1 材料和方法 1.1 材料和设备
1.1.1 材料鱼: 健康尼罗罗非鱼(Oreochromis niloticus),购自国家级广东省罗非鱼良种场(广东海洋与水产高科技园)。
1.1.2 菌株: 病原指示菌包括罗非鱼源无乳链球菌(WC1535,Streptococcus agalactiae)、罗非鱼源海豚链球菌(Sn03,Streptococcus iniae)、罗非鱼源迟缓爱德华氏菌(GD1701,Edwardsiella tarda)、鳢源鰤鱼诺卡氏菌(BSL1701,Nocardia seriolae)、鳢源舒氏气单胞菌(WL1707,Aeromonas schubertii)、鲫源嗜水气单胞菌(Ca1701,Aeromonas hydrophila)、黄颡鱼源鮰爱德华氏菌(Pef1401,Edwardsiella ictaluri)、草鱼源维氏气单胞菌(Ci1361,Aeromonas veronii)和斑点叉尾鮰源简氏气单胞菌(Ip121,Aeromonas jandaei)。以上菌株均分离自患病鱼体,并于本实验室保存。
1.1.3 主要仪器与试剂: 脑心浸出液(brain heart infusion,BHI)培养基(BD公司),购自广州市迪景微生物科技有限公司;细菌生化鉴定试剂盒,购自广州环凯微生物科技有限公司;细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;核酸测定仪,购自上海精密仪器科技公司。
1.2 拮抗菌的分离与筛选
1.2.1 细菌分离: 参照Olsson等[15]的方法分别剪取罗非鱼前、中、后肠约2 cm,轻轻挤出肠道内容物,用无菌手术剪刀剪碎,再用无菌水冲洗2–3次,加入1 mL无菌水于振荡仪充分振荡匀浆。70 ℃水浴30 min,1000 r/min离心2 min,取上层液采用10倍稀释法分别稀释10倍、100倍和1000倍,分别取300 μL均匀涂布到脑心浸液固体培养基上,每个样品涂布3个平板,将培养皿置于30 ℃恒温培养箱培养1–2 d。根据不同培养时间和不同菌落形态,挑选单菌落进行反复划线纯化培养,然后加入终体积分数为15%的甘油于–80 ℃冰箱保存备用。菌株编号依次为LF01–64。
1.2.2 拮抗菌的初筛: 采用点种法[16]稍作修改对分离菌株进行初筛。即以无乳链球菌作为指示菌,吸取200 μL菌液均匀涂布到BHI固体培养基上,再分别吸取分离菌液体培养液2.5 μL点种,置于30 ℃恒温培养箱培养24 h,记录出现明显透明圈的菌株。
1.2.3 拮抗菌的复筛: 采用点种法对上述分离菌株进行复筛,方法同上。分别以无乳链球菌、海豚链球菌、鰤鱼诺卡氏菌、迟缓爱德华氏菌、嗜水气单胞菌和舒氏气单胞菌作为指示菌进行复筛,选择抑菌圈大、抑菌谱广的分离菌株。筛选了一株拮抗效果较好的菌株LF01,并以该菌株作为进一步研究对象。
1.3 拮抗菌的鉴定
1.3.1 形态学观察: 将分离纯化的菌株LF01无菌操作划线接种于BHI固体培养基,30 ℃培养24 h,观察菌落的形态、大小、边缘、表面、凹凸度、透明度等。同时,挑取单菌落接种于BHI液体培养基,30 ℃、200 r/min摇床培养至指数生长期,经涂片、固定及革兰氏染色后,显微镜下观察菌体形态。
1.3.2 生理生化特征鉴定: 将纯化培养的待测菌株采用细菌生化鉴定试剂盒(广州环凯微生物科技有限公司)进行生化指标检测,同时参照《伯杰氏细菌鉴定手册》(第八版)[17]以及《常见细菌系统鉴定手册》[18]进行生理生化鉴定。具体操作见试剂盒说明书。
1.3.3 gyrA基因序列克隆及序列分析: 采用北京天根生物细菌基因组DNA提取试剂盒提取待测菌株LF01基因组DNA,以提取的基因组DNA为模板,用gyrA基因引物进行目的基因扩增。gyrA-F:5′-ATTCACGCTATCACTGACTTATTC-3′;gyrA-R:5′-ATGGGAGACAAAGTAGAACCGAG-3′。PCR扩增的反应条件为:95 ℃ 4 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 3 min,35个循环;72 ℃ 10 min。扩增产物用1.0%琼脂糖凝胶电泳进行检测,阳性PCR产物进行测序分析。将所得基因序列通过BLAST在GenBank中进行同源性比较分析,使用MEGA 7.0软件中邻接法(Neighbor joining,NJ)构建系统进化树,并通过自检分析(Boostrap)进行置信度检测,自检数据集为1000次。
1.4 拮抗物质的提取及抑菌效果测定 采用浓盐酸沉淀法[19]提取:于30 ℃、200 r/min振荡培养48 h获得发酵培养液,7500 r/min离心10 min,2次离心获得上清液。上清液中缓慢加入1 mol/L HCl至pH约为2,此时有白色絮状物析出,4 ℃过夜后7500 r/min离心10 min,收集沉淀用磷酸缓冲液复溶并调整至初始pH (约7.0)后,经0.2 μm微孔滤膜过滤即得粗提液,打孔法分别测定其抑菌效果,以未接种的BHI液体培养基与无拮抗作用的分离菌菌液作为空白对照和阴性对照,每个处理3个重复。
1.5 胞外酶活性 参照刘观斌等[1]方法分别接种待测菌株LF01菌液于淀粉酶和蛋白酶定性培养基固体平板点样孔中,设置3个重复,30 ℃培养20 h,向淀粉酶定性培养基中加入0.1 mL的碘液,将碘液均匀涂布覆盖平板,静置10 min,记录碘液染色的蓝紫色平板上出现显色圈情况。测量并记录蛋白酶定性培养基上透明圈的直径。
1.6 拮抗菌的生长特性分析
1.6.1 温度对拮抗菌生长的影响: 采用刘志刚等[20]的方法将终浓度为3.0×108 CFU/mL的拮抗菌LF01培养液以1:100 (V/V)的比例转接至新鲜的BHI液体培养基中,200 r/min,分别在温度为25、30、33、37 ℃恒温摇床中培养。
1.6.2 pH对拮抗菌生长的影响: 按上述方法将LF01培养液分别转接至新鲜的初始pH为3、5、7、9、11的BHI液体培养基中,在最适温度下,200 r/min恒温摇床中培养。
1.6.3 盐度对拮抗菌生长的影响: 按上述方法将LF01培养液分别转接至盐度为5‰、20‰、40‰、60‰、80‰的新鲜BHI液体培养基中,在最适温度、最适初始pH下,200 r/min恒温摇床中培养。
以上试验均设置3个重复,每隔1 h测定其菌液浓度,于核酸测定仪600 nm波长下测定其OD值,并绘制不同条件下的生长曲线。
1.7 拮抗菌抗菌谱 采用打孔平板对峙法[21]测定分离菌LF01对淡水鱼类常见病原致病菌的拮抗活性,主要包括无乳链球菌(WC1535)、海豚链球菌(Sn03)、鰤鱼诺卡氏菌(BSL1701)、迟缓爱德华氏菌(GD1701)、鮰爱德华氏菌(Pef1401)、嗜水气单胞菌(Ca1701)、舒氏气单胞菌(WL1707)、维氏气单胞菌(Ci1361)和简氏气单胞菌(Ip121)。即以其作为指示菌,分别吸取200 μL菌液均匀涂布到BHI固体培养基上,再用无菌打孔器(直径6 mm)均匀打3个孔。每个小孔中加入60 μL拮抗菌LF01菌液,然后将平皿置于30 ℃恒温培养箱培养24 h,观察并测定抑菌圈直径(包括孔径)。数据分析采用SPSS 21.0进行处理。
1.8 药敏试验 依据美国NCCLS颁布的药敏试验要求和标准,采用纸片琼脂扩散法(K-B法)检测拮抗菌株LF01对28种抗菌药物的敏感特性[22]。挑取单菌落接种到BHI液体培养基中,30 ℃、200 r/min摇床过夜培养,用0.75%无菌生理盐水稀释成菌悬液,与浊度管(0.5麦氏单位浓度比浊管)比较,浊度一致。然后吸取200 μL均匀涂布于BHI固体培养基中,待干后,用无菌镊子分别取药敏纸片均匀地贴在培养基表面,将平板倒置,于37 ℃培养20 h,测量抑菌圈直径,结果参照药敏纸片说明书,判断菌株的药物敏感特性。
1.9 安全性试验 试验设置拮抗菌株注射组与阴性对照组,每组2个平行,分别以尼罗罗非鱼(均重为6.0±1.0 g)、斑马鱼(均重为1.5±0.5 g)和乌鳢(均重为10.0±1.0 g)作试验鱼。罗非鱼与斑马鱼每个平行随机选取15尾,乌鳢每个平行随机选取10尾,设置4.5×108 CFU/mL和9.0×108 CFU/mL 2个浓度分别对其进行腹腔注射。实验组每尾腹腔注射LF01菌液100 μL,阴性对照组每尾腹腔注射100 μL生理盐水,试验观察周期为7 d,每天记录试验鱼的感染症状和死亡数量。
2 结果和分析 2.1 细菌的分离与拮抗菌筛选 从健康罗非鱼肠道中共分离出64个单菌落,其中6个单菌落具有无乳链球菌拮抗活性,然后对该6株菌进行复筛,最终筛选出抑菌活性稳定、拮抗性较强、抑菌谱广泛的优势分离菌LF01作为候选菌株。
2.2 拮抗菌的鉴定
2.2.1 形态学观察与染色: 菌株LF01接种于BHI固体培养基,30 ℃培养12 h后,菌落乳白色,圆形或椭圆形,边缘整齐,向上凸起,表面湿润、光滑,不透明,黏液性,直径为4.0–7.0 mm;在液体培养基中静置培养时,表面形成白色菌膜。透射电镜图片显示,LF01菌株为杆状细菌,并且具有较厚的细胞壁。分离菌LF01革兰氏染色呈蓝紫色,短杆状,表明该菌为革兰氏阳性杆菌(图 1)。
 |
| 图 1 LF01在BHI培养的菌落形态(A)、菌膜(B)、透射电镜(C)) (bar=0.5 μm)与革兰氏染色(D) (bar=5 μm) Figure 1 Results of individual morphological characteristics medium (A), membrane (B), transmission electron microscope (C) and Gram staining (D) of strain LF01 in BHI (bar=5 μm) |
| 图选项 |
2.2.2 生理生化特征鉴定: 对菌株LF01的生理生化鉴定结果显示(表 1),菌株LF01的接触酶、氧化酶反应、硝酸盐还原、明胶试验均为阳性,苯丙氨酸、VP、产吲哚试验阴性,能利用葡萄糖、蔗糖、淀粉,不能利用麦芽糖、乳糖、甘露醇、山梨醇、肌醇、柠檬酸盐。参照《伯杰氏细菌鉴定手册》(第八版)[17]和《常见细菌系统鉴定手册》[18]中细菌生理生化指标确认该菌为芽孢杆菌属。
表 1. 菌株LF01的生理生化特征 Table 1. Physiological and biochemical characteristics of strain LF01
| Characteristics | Results | |
| LF01 | Bacillus sp. | |
| Catalase | + | + |
| Oxidase | + | + |
| Phenylalanine | – | – |
| Mannitol | – | – |
| Sorbitol | – | – |
| Inositol | – | – |
| Indole | – | – |
| Starch | + | + |
| Sucrose | + | + |
| Glucose | + | + |
| Lactose | – | – |
| Maltose | – | – |
| Nitrate reduction | + | + |
| Citrate | – | – |
| VP | – | – |
| Gelatin | + | + |
| +: indicate that the strain reaction is positive; –: indicate that the strain reaction is negative. | ||
表选项
2.2.3 gyrA基因序列与系统发育: 菌株LF01的gyrA基因全长为2424 bp,通过同源性检索分析发现该基因序列与GenBank数据库中芽孢杆菌属达99%–100%的同源性,由系统进化树(图 2)可知该菌与已报道的贝莱斯芽孢杆菌(Bacillus velezensis)同源性较高,且与Bacillus velezensis M75同源性最高,并与贝莱斯芽孢杆菌属于同一个分支。综合形态观察、菌落特征、生理生化特性及gyrA的分子鉴定结果,确定分离菌LF01为贝莱斯芽孢杆菌。
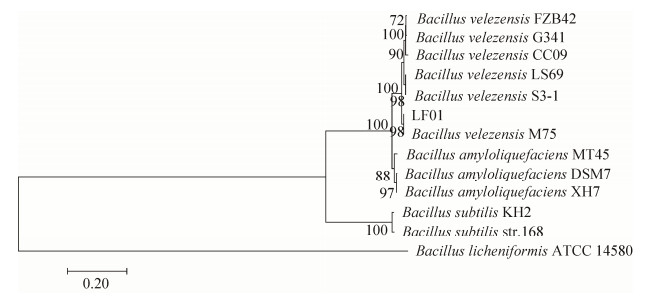 |
| 图 2 菌株LF01基于gyrA基因序列的系统发育树 Figure 2 Phylogenetic tree of strain LF01 based on gyrA gene sequences. Numbers at the nodes indicate the bootstrap values on neighbor-joining analysis. The percentage of replicate trees in which the associated taxa clustered together in the bootstrap test (1000 replicates) is shown next to the branches |
| 图选项 |
2.3 粗提液抑菌效果的测定 酸沉淀结果显示,拮抗菌LF01发酵培养液离心所得上清经浓盐酸沉淀,有白色絮状物析出,复溶后具有较强抑菌活性,且对无乳链球菌等多种病原菌具有拮抗作用;而对照组经相同处理后,无沉淀析出,且无抑菌活性。表明拮抗菌株LF01产生的拮抗物质存在于发酵液中,能于酸性条件下沉淀析出,抗菌物质的产生是该菌具有生防作用的原因之一。
2.4 胞外酶活性的测定 菌株LF01通过胞外酶定性培养基测定,碘液染色的蓝紫色平板上出现明显显色圈(图 3-A),表明该菌能够分泌淀粉酶进而有效水解淀粉;同时,酪素平板上也出现明显透明圈(图 3-B),表明该菌能够分泌蛋白酶进而有效水解酪蛋白。
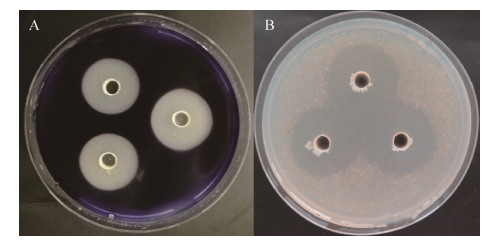 |
| 图 3 菌株LF01水解淀粉(A)及酪蛋白(B)结果 Figure 3 Results of the hydrolysis of starch (A) and casein (B) of the strain LF01 |
| 图选项 |
2.5 拮抗菌的生长特性分析 菌株LF01在不同温度下的生长情况表明,该菌在25–37 ℃均能较好地生长,其最适生长温度为30 ℃。在25 ℃时菌株进入指数期的时间延长,30–37 ℃条件下较早达到稳定期,且达到稳定期时各组菌液的吸光值之间无显著差异(图 4-A)。菌株LF01在不同pH下的生长情况表明,其最适生长初始pH为7。在pH为5和9时,菌株进入指数期的时间延长,且达到稳定期时,其OD600值显著低于初始pH为7时。在pH为3和11时,其生长受到严重抑制,菌株不能生长(图 4-B)。菌株LF01在不同盐度下的生长情况表明,其在盐度5‰–60‰均能生长,其中盐度为5‰时生长最快,达到稳定期时其OD600值最大,且随着盐度的增加,菌株进入指数期的时间延长,但均在14–16 h达到稳定期(图 4-C)。
 |
| 图 4 菌株LF01在不同培养温度(A)、pH (B)和盐度(C)条件下的生长曲线 Figure 4 The growth curves of the strain LF01 in different temperatures (A), pH (B) and salinity (C) |
| 图选项 |
2.6 拮抗菌抗菌谱测定 根拮抗菌LF01株的抗菌谱结果可知,该菌对病原菌的抑菌效果为鰤鱼诺卡氏菌 > 舒氏气单胞菌、简氏气单胞菌和海豚链球菌 > 维氏气单胞菌、迟缓爱德华氏菌和嗜水气单胞菌 > 鮰爱德华氏菌 > 无乳链球菌(图 5)。拮抗菌株LF01对无乳链球菌等9株指示菌抑菌圈直径均大于18 mm,其中对鰤鱼诺卡氏菌的抑菌作用最强,平均抑菌圈直径达28.3 mm,对无乳链球菌的最弱,但是其平均抑菌圈直径也可以达到18.5 mm。抗菌谱结果显示,拮抗菌LF01株对嗜水气单胞菌、维氏气单胞菌和迟缓爱德华氏菌等病原菌的抑菌圈直径无显著差异(P > 0.5);对革兰氏阳性病原菌抑菌效果最好的是鰤鱼诺卡氏菌,对革兰氏阴性病原菌抑菌效果最好的是舒氏气单胞菌。
 |
| 图 5 菌株LF01的抗菌谱(mm) Figure 5 Inhibitory spectrum of the strain LF01 (mm). Values are means±SD. Means sharing a common superscript letter were not significantly different (P > 0.05) |
| 图选项 |
2.7 药敏试验 菌株LF01对28种抗菌药物的敏感试验结果(表 2)表明,该菌对氟苯尼考等24种抗菌药物敏感,对青霉素G、洛美沙星、林可霉素三种抗菌药物中度敏感,对杆菌肽耐药。
表 2. 菌株LF01药物敏感性试验结果 Table 2. Antibiotic sensitivity test of strain LF01
| Antibiotic | Standards/mm | Inhibition circle diameter/mm | Sensitivity | ||
| Insensitivity/R | Moderate sensitivity/I | High sensitivity/S | |||
| Acetylspiramycin | ≤13 | 14–17 | ≥18 | 24 | S |
| Amikacin | ≤13 | 14–17 | ≥18 | 23 | S |
| Midecamycin | ≤13 | 14–17 | ≥18 | 29 | S |
| Erythromycin | ≤15 | 16–20 | ≥21 | 32 | S |
| Florfenicol | ≤17 | 18–20 | ≥21 | 21 | S |
| Ceftriaxone | ≤13 | 14–22 | ≥23 | 32 | S |
| Cefalotin | ≤14 | 15–17 | ≥18 | 39 | S |
| Tobramycin | ≤12 | 13–14 | ≥15 | 37 | S |
| Rifampicin | ≤16 | 17–18 | ≥19 | 25 | S |
| Gentamicin | ≤12 | 13–14 | ≥15 | 18 | S |
| Penicillin G | ≤19 | 20–27 | ≥28 | 24 | I |
| Tetracycline | ≤18 | 19–22 | ≥23 | 27 | S |
| Enoxacin | ≤14 | 15–17 | ≥18 | 30 | S |
| Norfloxacin | ≤12 | 13–16 | ≥17 | 26 | S |
| Lomefloxacin | ≤18 | 19–21 | ≥22 | 21 | I |
| Ofloxacin | ≤12 | 13–15 | ≥16 | 32 | S |
| Streptomycin | ≤11 | 13–14 | ≥15 | 37 | S |
| Doxycycline | ≤12 | 13–15 | ≥16 | 33 | S |
| Enrofloxacin | ≤15 | 16–20 | ≥21 | 36 | S |
| Vancomycin | ≤14 | 15–16 | ≥17 | 22 | S |
| Sulfamethoxazole | ≤12 | 13–16 | ≥17 | 25 | S |
| Lincolmensin | ≤14 | 15–20 | ≥21 | 20 | I |
| Spectinomycin | ≤14 | 15–17 | ≥18 | 20 | S |
| Nalidixic acid | ≤13 | 14–18 | ≥19 | 33 | S |
| Ampicillin | ≤16 | 17–18 | ≥19 | 27 | S |
| Trimethoprim | ≤10 | 11–16 | ≥17 | 26 | S |
| Chloramphenicol | ≤17 | 18–20 | ≥21 | 32 | S |
| Bacitracin | ≤8 | 8–12 | ≥13 | 6 | R |
表选项
2.8 生物安全性试验 通过腹腔注射法检测菌株LF01对罗非鱼、斑马鱼和乌鳢三种鱼的生物安全性,试验结果表明,试验期间内,注射浓度为4.5×108 CFU/mL和9.0×108 CFU/mL时,实验组3种鱼均未出现死亡及其他异常现象,这表明LF01菌株对上述3种鱼类具有良好的生物安全性。
3 讨论 近10年来,随着罗非鱼链球菌病等病害的暴发,抗生素、消毒剂等化学药物的大量使用,造成无乳链球菌耐药性的增加以及养殖水生态环境的破坏,导致罗非鱼链球菌病等病害的防控越来越难[1, 23]。因此,通过生物防控来预防罗非鱼链球菌病等病害是必要的,也是很有意义的。Verschuere等[24]认为,就水产动物病原菌的拮抗效果而言,从水生动物及其生存环境中获得的拮抗菌相对于陆源效果更佳,而且更能适应宿主肠道环境以及有利于黏附定殖。Iehata等[25]报道鲍源乳酸菌在盘大鲍(Haliotis gigantean)肠道中的定殖效果和定殖时间优于陆源乳酸菌。目前,关于罗非鱼肠道拮抗益生菌的筛选及其动物试验的研究鲜有报道。因此,本研究从罗非鱼肠道中筛选罗非鱼源无乳链球菌等病原菌的肠道拮抗益生菌,并获得一株拮抗效果较好的菌株LF01。
贝莱斯芽孢杆菌作为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的后期异型体,由于表型相似,仅从同源性上很难准确区分其分类地位[26]。因此,本试验在细菌常规鉴定的基础上,又进行了gyrA基因特异性序列分析及同源性比对,结合细菌形态学观察、生理生化鉴定及gyrA基因序列的比对和系统发育树的构建,确定分离菌株LF01为贝莱斯芽孢杆菌。研究表明,贝莱斯芽孢杆菌能够分泌产生表面活性剂、伊枯草菌素和β-葡聚糖酶等生物活性物质,具有抗细菌、真菌和促生长等功能[27-28]。目前,对于贝莱斯芽孢杆菌的研究主要集中在拮抗真菌,用于植物病害生物防治上,如小麦赤霉病致病菌禾谷镰刀菌(Fusarium graminearum)[29]、棉花黄萎病病原菌大丽轮枝菌(Verticillium dahliae Kleb)[30]、番茄灰霉病灰葡萄孢菌(Botrytis cinerea Pers)[31]等,而其在水产养殖上的应用比较少见。本研究发现,拮抗菌LF01的发酵上清液经过处理后对无乳链球菌等多种病原菌具有拮抗作用,这表明LF01株是通过产生拮抗物质抑制或杀灭病原菌,这也表明该菌株不仅可以作为微生态制剂直接使用,其发酵液还具有作为饲料添加剂的潜力。本研究结果显示LF01菌株具有较强的广谱拮抗水产常见病原菌功能,能有效抑制水产养殖鱼类常见病原菌如无乳链球菌、海豚链球菌、鰤鱼诺卡氏菌、嗜水气单胞菌、舒氏气单胞菌、维氏气单胞菌、简氏气单胞菌、鮰爱德华氏菌和迟缓爱德华氏菌等病原菌的生长,这表明拮抗菌LF01具有防控多种水产养殖动物疾病的潜力。
拮抗菌LF01在pH 5–9、温度25–37 ℃和盐度5‰–20‰范围内生长迅速,12 h达到生长高峰,在盐度60‰仍能生长,表现出广温和广盐的特性,且较指示菌更具生长优势,可以利用较短的时间快速大量繁殖,有利于拮抗菌在养殖水体中生长繁殖、在宿主肠道以及肠黏液的黏附、定殖,进而产生抗菌物质发挥作用。益生菌作用于宿主机体通常可以通过分泌胞外酶参与宿主的消化、吸收及免疫过程,如Ziaei-Nijad等[32]在对虾养殖池塘中直接施用芽孢杆菌或者投喂芽孢杆菌强化的卤虫,对虾肠道中淀粉酶、总蛋白酶、脂肪酶均显著提高;Wang等[33]直接添加蜡样芽孢杆菌NY5或拌料投喂罗非鱼,42 d后血清中免疫酶和抗氧化酶活性均显著提高,而且随着添加浓度的增加而增加。此外,水产养殖中水质的污染主要来自大量的残饵、粪便,其中以蛋白质和淀粉为主[34]。本研究所筛选的贝莱斯芽孢杆菌LF01具有较强的水解淀粉和酪蛋白的能力,表明该菌不仅具有改善养殖生态环境的潜能,而且能够提高罗非鱼免疫酶和消化酶活性的潜力,有利于促进罗非鱼对营养物质的消化吸收,增强机体免疫力。
在拮抗菌的应用中,不仅要考虑拮抗菌对相关病原菌的拮抗效果,还需要考虑拮抗菌对养殖生物的安全性。因此,筛选的益生菌应具备不含有毒力基因和抗性基因,且对宿主无害,能够被宿主通过摄食等方法获取[24]。虽然芽孢杆菌为常用的益生菌菌源,但仍存有安全隐患,如杨移斌等[35]从患病罗非鱼体内分离出一株致病性蜡样芽孢杆菌。本试验对拮抗菌LF01进行了生物安全性检测,结果表明该菌对罗非鱼等三种鱼类均具有良好的安全性,即使在高浓度剂量的感染条件下也不致病,且无任何临床症状。同时药敏试验结果显示该菌对绝大多数抗生素药物敏感,仅对杆菌肽耐药,这也提示该菌不携带相关耐药基因,在应用过程中不会向其他菌种传播耐药因子,有利于该益生菌的推广应用。该益生菌的应用将有助于减少农药环境污染、降低药物残留以及避免病原菌抗药性产生,该菌在水产养殖动物疾病防控方面将具有广阔的应用前景。
References
| [1] | Liu GB, Wang M, Lu MX, Ke XL, Liu ZG, Zhu HP, Gao FY, Cao JM. Identification of a denitrifying bacillus strain with an antagonistic effect on Streptococcus agalactiae isolated from tilapia. Journal of Fishery Sciences of China, 2016, 23(1): 207-217. (in Chinese) 刘观斌, 王淼, 卢迈新, 可小丽, 刘志刚, 朱华平, 高风英, 曹建萌. 一株能抑制罗非鱼源无乳链球菌的反硝化芽孢杆菌的筛选鉴定. 中国水产科学, 2016, 23(1): 207-217. |
| [2] | Geraylou Z, Souffreau C, Rurangwa E, de Meester L, Courtin CM, Delcour JA, Buyse J, Ollevier F. Effects of dietary arabinoxylan-oligosaccharides (AXOS) and endogenous probiotics on the growth performance, non-specific immunity and gut microbiota of juvenile Siberian sturgeon (Acipenser baerii). Fish & Shellfish Immunology, 2013, 35(3): 766-775. |
| [3] | Zhou JM, Wu ZX, Zeng LB, Chen XX, Yang L, Zhao Y. Selection and characterization of pathogen antagonised probiotics from intestinal tract of Yellow catfish (Pelteobagrus fulvidraco). Acta Hydrobiologica Sinica, 2012, 36(1): 78-84. (in Chinese) 周金敏, 吴志新, 曾令兵, 陈孝煊, 杨丽, 赵杨. 黄颡鱼肠道病原拮抗性芽孢杆菌的筛选与特性研究. 水生生物学报, 2012, 36(1): 78-84. |
| [4] | Lee BY, Coutanceau JP, Ozouf-Costaz C, D'Cotta, H, Baroiller, J F, Kocher, T. Genetic and physical mapping of sex-linked AFLP markers in Nile tilapia (Oreochromis niloticus). Marine Biotechnology, 2011, 13(3): 557-562. DOI:10.1007/s10126-010-9326-7 |
| [5] | 张宗锋.以湛江、茂名海南为例探究我国凡纳滨对虾、罗非鱼养殖现状及面临的问题.上海海洋大学硕士学位论文, 2012. |
| [6] | 彭民毅.广西罗非鱼无乳链球菌病病原分离、鉴定及毒力基因检测分析.广西大学硕士学位论文, 2014. |
| [7] | Lu MX, Li J, Ye X, Deng GC, Jiang XY, Tian YY, Lai CL. Identification and characterizations of Streptococcus agalactiae isolated from tilapia cultured in Guangdong and Hainan provinces. Microbiology China, 2010, 37(5): 766-774. (in Chinese) 卢迈新, 黎炯, 叶星, 邓国成, 江小燕, 田园园, 赖翠玲. 广东与海南养殖罗非鱼无乳链球菌的分离、鉴定与特性分析. 微生物学通报, 2010, 37(5): 766-774. |
| [8] | Fang W, Ke BX, Liang HY, He DM, Tan HL, Ke CW, Deng XL, Peng HL, Sun JF, Wang YX. Isolation, identification and characterization of Streptococcus agalactiae isolated from tilapia fish farms in five districts of Guangdong. Journal of Tropical Medicine, 2016, 16(2): 175-178, 185, 274. (in Chinese) 方伟, 柯碧霞, 梁恒宇, 何冬梅, 谭海玲, 柯昌文, 邓小玲, 彭华林, 孙九峰, 王云新. 广东五地区养殖罗非鱼无乳链球菌的分离、鉴定与特性分析. 热带医学杂志, 2016, 16(2): 175-178, 185, 274. |
| [9] | Younes AM, Gaafar AY, Awad ES. Virulence determinants and plasmid profile of Aeromonas hydrophila strains isolated from Oreochromis niloticus. Global Veterinaria, 2015, 15(6): 613-617. |
| [10] | Liu C, Chang QQ, Zhang DF, Li KB, Wang F, Lin MH, Shi CB, Jiang L, Wang Q, Bergmann SM. Aeromonas shuberti as a cause of multi-organ necrosis in internal organs of Nile tilapia, Oreochromis niloticus. Journal of Fish Diseases, 2018, 41(10): 1529-1538. DOI:10.1111/jfd.2018.41.issue-10 |
| [11] | Nagy E, Fadel A, Al-Moghny FA, Ibrahim MS. Isolation, Identification and pathogenicity characterization of Edwardsiella tarda isolated from Oreochromis niloticus fish farms in Kafr-Elshiekh, Egypt. Alexandria Journal of Veterinary Sciences, 2018, 57(1): 171-179. |
| [12] | Currie J, Lin WC, Meng JJ. Addressing antibiotic abuse in China: an experimental audit study. Journal of Development Economics, 2014, 110: 39-51. DOI:10.1016/j.jdeveco.2014.05.006 |
| [13] | Dunstan RA, Heinz E, Wijeyewickrema LC, Pike RN, Purcell AW, Evans TJ, Praszkier J, Robins-Browne RM, Strugnell RA, Korotkov KV, Lithgow T. Assembly of the type II secretion system such as found in Vibrio cholerae depends on the novel Pilotin AspS. PLoS Pathogens, 2013, 9(1): e1003117. DOI:10.1371/journal.ppat.1003117 |
| [14] | Li HB, Song XL, Li Y, Wei S. Progress on probiotic bacteria in aquiculture. Progress in Veterinary Medicine, 2008, 29(5): 94-99. (in Chinese) 李海兵, 宋晓玲, 李赟, 韦嵩. 水产动物益生菌研究进展. 动物医学进展, 2008, 29(5): 94-99. DOI:10.3969/j.issn.1007-5038.2008.05.025 |
| [15] | Olsson JC, Westerdahl A, Conway PL, Kjelleberg S. Intestinal colonization potential of turbot (Scophthalmus maximus)- and dab (Limanda limanda)- associated bacteria with inhibitory effects against Vibrio anguillarum. Applied and Environmental Microbiology, 1992, 58(2): 551-556. |
| [16] | Zhang XM, Li J, Liu Q. Selection and effect of vibrios-antagnism bacteria. Journal of Fishery Sciences of China, 2004, 11(4): 325-332. (in Chinese) 张新明, 李健, 刘淇. 弧菌拮抗菌的筛选及其效果. 中国水产科学, 2004, 11(4): 325-332. DOI:10.3321/j.issn:1005-8737.2004.04.009 |
| [17] | 布坎南RE, 吉本斯NE.伯杰细菌鉴定手册.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译.北京: 科学出版社, 1984. |
| [18] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001. |
| [19] | 侯宝宏.解淀粉芽孢杆菌TS-1203抑菌活性物质分析及制剂研制.甘肃农业大学硕士学位论文, 2016. |
| [20] | Liu ZG, Ke XL, Lu MX, Zhu HP, Gao FY. Effect of temperature on the virulence of Streptococcus agalactiae from Nile tilapia (Oreochromis niloticus). Journal of Fisheries of China, 2013, 37(11): 1733-1741. (in Chinese) 刘志刚, 可小丽, 卢迈新, 朱华平, 高风英. 温度对尼罗罗非鱼无乳链球菌毒力的影响. 水产学报, 2013, 37(11): 1733-1741. |
| [21] | 张少博.抗水稻黄单胞菌深海独岛枝芽胞杆菌A493及其活性物质研究.华中农业大学硕士学位论文, 2011. |
| [22] | Wikler MA, Hindler JF, Cockerill III FR, Patel JB, Bush K, Powell M, Dudley MN, Turnidge JD, Eliopoulos GM, Weinstein MP, Hardy DJ, Zimmer BL, Hecht DW, Ferraro MJ, Swenson JM. M02-A10 Performance standards for antimicrobial disk susceptibility tests. Wayne, Pennsylvania: Clinical Laboratory Standards Institute, 2009. |
| [23] | Huang YH, Ma S, Han SY, Huang WD, Wei ML, Meng LL, Lü XL, Qin HM, Li DZ, Liang JZ, Huang J. Antibiogram types of Streptococcus agalactiae strains isolated from Oreochromis spp. in Guangxi during 2011-2016. Journal of Southern Agriculture, 2018, 49(5): 1023-1031. (in Chinese) 黄艳华, 马沙, 韩书煜, 黄伟德, 韦慕兰, 蒙兰丽, 吕小丽, 覃惠明, 李德壮, 梁静真, 黄钧. 2011-2016年广西罗非鱼源无乳链球菌的耐药谱型分析. 南方农业学报, 2018, 49(5): 1023-1031. DOI:10.3969/j.issn.2095-1191.2018.05.28 |
| [24] | Verschuere L, Rombaut G, Sorgeloos P, Verstraete W. Probiotic bacteria as biological control agents in aquaculture. Microbiology and Molecular Biology Reviews, 2000, 64(4): 655-671. DOI:10.1128/MMBR.64.4.655-671.2000 |
| [25] | Iehata S, Inagaki T, Okunishi S, Nakano M, Tanaka R, Maeda H. Improved gut environment of abalone Haliotis gigantea through Pediococcus sp. Ab1 treatment. Aquaculture, 2010, 305(1/4): 59-65. |
| [26] | Wang LT, Lee FL, Tai CJ, Kuo HP. Bacillus velezensis is a later heterotypic synonym of Bacillus amyloliquefaciens. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(3): 671-675. DOI:10.1099/ijs.0.65191-0 |
| [27] | Ruiz-García C, Béjar V, Martínez-Checa F, Llamas I, Quesada E. Bacillus velezensis sp. nov., a surfactant-producing bacterium isolated from the river Vélez in Málaga, southern Spain. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(1): 191-195. DOI:10.1099/ijs.0.63310-0 |
| [28] | Xu T, Zhu TH, Li SJ. β-1, 3-1, 4-glucanase gene from Bacillus velezensis ZJ20 exerts antifungal effect on plant pathogenic fungi. World Journal of Microbiology and Biotechnology, 2016, 32(2): 26. DOI:10.1007/s11274-015-1985-0 |
| [29] | Zong Y, Zhao YJ, Liu Y, Yang QL. Study on the inhibitory effect of Bacillus velezensis on Fusarium graminearum. Journal of Nuclear Agricultural Sciences, 2018, 32(2): 310-317. (in Chinese) 宗英, 赵月菊, 刘阳, 杨庆利. 一株贝莱斯芽孢杆菌抑制禾谷镰刀菌的研究. 核农学报, 2018, 32(2): 310-317. |
| [30] | Wang W, Li SN, Li HY, Wang Q, Zhu BC. Screening, identification of the antagonistic bacteria against Verticillium dahliae Kleb and characteristic analyses of antagonistic substance. Chinese Agricultural Science Bulletin, 2009, 25(19): 14-19. (in Chinese) 王伟, 李术娜, 李红亚, 王全, 朱宝成. 大丽轮枝菌拮抗细菌菌株12-51的筛选鉴定与抗菌物性质分析. 中国农学通报, 2009, 25(19): 14-19. |
| [31] | Wang W, Li SN, Li HY, Hao ZM, Wang Q, Wang SX, Zhu BC. Screening of antagonistic bacteria against Botrytis cinerea and identification of strain X-75. Acta Horticulturae Sinica, 2010, 37(2): 307-312. (in Chinese) 王伟, 李术娜, 李红亚, 郝志敏, 王全, 王树香, 朱宝成. 番茄灰霉病拮抗细菌的筛选与X-75菌株鉴定. 园艺学报, 2010, 37(2): 307-312. |
| [32] | Ziaei-Nejad S, Rezaei MH, Takami GA, Lovett DL, Mirvaghefi AR, Shakouri M. The effect of Bacillus spp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus. Aquaculture, 2006, 252(2/4): 516-524. |
| [33] | Wang M, Liu GB, Lu MX, Ke XL, Liu ZG, Gao FY, Cao JM, Zhu HP, Yi MM, Yu DG. Effect of Bacillus cereus as a water or feed additive on the gut microbiota and immunological parameters of Nile tilapia. Aquaculture Research, 2017, 48(6): 3163-3173. DOI:10.1111/are.2017.48.issue-6 |
| [34] | Xie H, Qiu HD, Wang XB, Chen DH. Studies on the characteristics of degrading survival feeds in the aquaculture by Bacillus licheniformis. Journal of Fujian Fisheries, 2008(3): 31-35. (in Chinese) 谢航, 邱宏端, 王秀彬, 陈冬花. 地衣芽孢杆菌降解水产养殖中残余饵料的特性研究. 福建水产, 2008(3): 31-35. DOI:10.3969/j.issn.1006-5601.2008.03.008 |
| [35] | Yang YB, Yu LX, Liu YT, Yang QH, Su ZJ, Song Y, Ai XH. Isolation, identification and antibiotic sensitivity of Bacillus cereus from tilapia. Freshwater Fisheries, 2017, 47(4): 51-56. (in Chinese) 杨移斌, 余琳雪, 刘永涛, 杨秋红, 苏志俊, 宋怿, 艾晓辉. 罗非鱼源蜡样芽孢杆菌分离、鉴定及药敏特性研究. 淡水渔业, 2017, 47(4): 51-56. DOI:10.3969/j.issn.1000-6907.2017.04.009 |
