穆丽丽1, 牛犇1, 赵勇1,2,3


1. 上海海洋大学食品学院, 上海 201306;
2. 农业部水产品贮藏保鲜质量安全风险评估实验室(上海), 上海 201306;
3. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
收稿日期:2018-06-11;修回日期:2018-07-13;网络出版日期:2018-08-29
基金项目:国家自然科学基金(31571917);上海市教育委员会科研创新计划资助(2017-01-07-00-10-E00056);上海市教委曙光计划(15SG48)
*通信作者:赵勇, Tel:+86-21-61900503, E-mail:yzhao@shou.edu.cn.
摘要:致病菌借助分泌系统将特异蛋白直接注入宿主细胞内,破坏宿主细胞内的多种信号通路,是导致细菌定殖和感染的有效途径。作为一种重要的食源性致病菌,副溶血性弧菌(Vibrio parahaemolyticus)的Ⅲ型分泌系统(Type Ⅲ secretion system,T3SS)和Ⅵ型分泌系统(TypeⅥ secretion system,T6SS)是其对宿主细胞产生致病性的重要因素。本文综述了副溶血性弧菌T3SS和T6SS效应物在致病力中的具体作用,以及相关调控机理,为进一步了解由副溶血性弧菌导致的病症,研究其致病机理以及寻找致病性靶标提供参考。
关键词:副溶血性弧菌T3SST6SS致病力效应物
Role of Vibrio parahaemolyticus secretion system in pathogenicity
Lili Mu1, Ben Niu1, Yong Zhao1,2,3


1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;
2. Quality & Safety Risk Assessment for Aquatic Products on Storage and Preservation(Shanghai), Ministry of Agriculture, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China
*Corresponding author: Yong Zhao, Tel:+86-21-61900503, E-mail: yzhao@shou.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31571917), by Innovation Program of Shanghai Municipal Education Commission (2017-01-07-00-10-E00056) and by the"Dawn"Program of Shanghai Education Commission (15SG48)
Abstract: Specialized substrates are injected into a host cell through secretion system, to destroy various signal pathways, which is an effective way for bacterial colonization and infection. Vibrio parahaemolyticus being an important foodborne pathogen, its Type Ⅲ Secretion System (T3SS) and Type Ⅵ Secretion System (T6SS) are important virulence factors to the hosts. In this review, we summarize the specific roles of T3SS and T6SS effectors in pathogenicity and the related regulatory mechanisms. This paper provides a reference to further understand the diseases caused by Vibrio parahaemolyticus, to investigate its pathogenesis and find the pathogenic targets.
Keywords: Vibrio parahaemolyticusT3SST6SSpathogenicityeffectors
副溶血性弧菌是一种革兰氏阴性嗜盐菌,广泛分布在近海水域及海底沉积物中,是水产品弧菌病的主要病原菌之一,也是目前我国海产品中受污染程度最严重的病原菌之一[1-2]。食用未煮熟或被该菌污染的海产品后,可能引起恶心、呕吐、腹泻等肠胃炎症状[3],其引起的食源性疾病已成为世界范围内的公共卫生问题。因此,其毒力因子和致病机理的研究越来越受到人们的重视。
副溶血性弧菌具有多种致病因子,包括黏附因子、侵袭因子、溶血性毒素、尿素酶、分泌系统等[4]。耐热直接溶血毒素(Thermostable direct hemolysin,TDH)和耐热直接溶血相关毒素(TDH-related hemolysin,TRH)被认为是副溶血性弧菌引起腹泻的主要致病因子[5],研究发现Ⅲ型分泌系统对于TDH和TRH协同致病过程中具有重要作用[6]。近年来,Ⅵ型分泌系统的致病机理也逐步被揭示。本文围绕副溶血性弧菌中的分泌系统及其效应物在感染和致病过程的作用机理进行综述,旨在进一步了解由副溶血性弧菌导致的病症,以期为疾病的预防和治疗提供全面理论支撑。
1 分泌系统概述 目前在革兰氏阴性菌中已经发现并命名9种蛋白分泌系统,分别为Ⅰ–Ⅸ型分泌系统。通过不同的蛋白分泌系统,细菌可以向胞外分泌多种蛋白质,这些分泌蛋白的多样性,不仅与细菌地理分布的多样性密切相关,并且还参与病原菌对宿主的选择特异性以及诱导宿主的致病反应。
根据分泌系统跨越内膜和外膜方式,它们被分为两种跨膜分泌系统:单膜镶嵌分泌系统(Single-membrane-spanning transporters)和双膜镶嵌分泌系统(Double-membrane-spanning secretion systems)。依据效应物的释放方式,分泌系统的分泌机制可以分为一步分泌机制(One-step secretion mechanism)和两步分泌机制(Two-step secretion mechanism)。副溶血性弧菌的T3SS和T6SS同属于双膜镶嵌分泌系统,其效应物通过一步分泌机制直接从细胞质被靶定至胞外或宿主细胞内,进而导致宿主感染。
2 副溶血性弧菌分泌系统在致病力中的作用 副溶血性弧菌作为一个机会性致病菌,至今其致病机理还未被完全揭示,但已知多种毒力因子:溶血素、粘附因子、鞭毛及蛋白酶、脂多糖、外膜蛋白以及分泌系统等[4],都对副溶血性弧菌的致病性有着不同的作用。而在副溶血性弧菌分泌系统中只有T3SS和T6SS被研究,其他分泌系统均未见详细报道,下面将详细阐述T3SS和T6SS在副溶血性弧菌致病力中的作用。
2.1 副溶血性弧菌T3SS T3SS是一种多亚基的针状结构,可将效应物直接递送到宿主细胞中,发挥毒力作用。T3SS存在于大多数革兰氏阴性菌中,副溶血性弧菌含有2套Ⅲ型分泌系统(T3SS),分别为T3SS1 (vp 1656-1702)和T3SS2 (vpa 1321-1731),后者可以细分为T3SS2α和T3SS2β,其效应物在致病力中的作用如图 1所示。
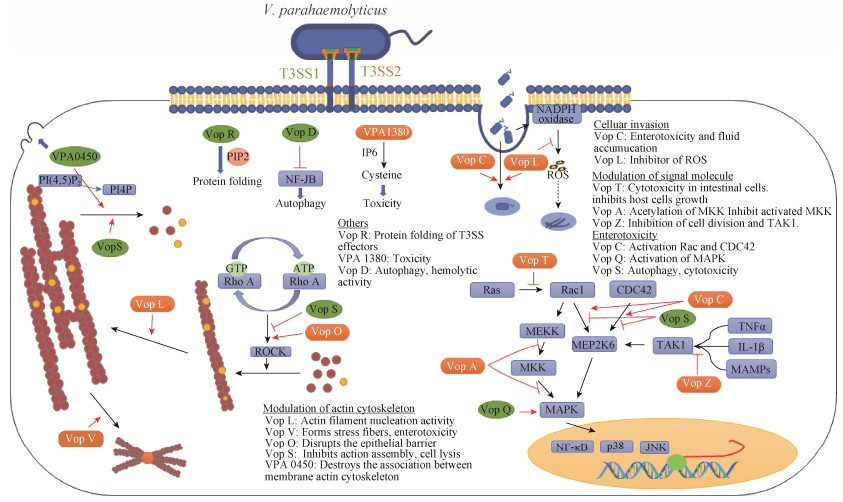 |
| 图 1 副溶血性弧菌T3SS效应物在感染宿主细胞中的作用 Figure 1 Activities of the T3SS effectors in host cells during infection. |
| 图选项 |
2.1.1 T3SS1效应物在致病力中的作用: T3SS1位于副溶血性弧菌的大染色体1上,有30个开放阅读框,近年研究显示该基因簇广泛存在于副溶血性弧菌中[6]。在宿主感染副溶血性弧菌后,其T3SS1效应物通过攻击高度保守的细胞生理过程来编排非凋亡性细胞死亡,引起细胞毒性。目前,副溶血性弧菌T3SS1主要有4种效应物被研究,分别是Vop Q、Vop R、Vop S和VPA 0450。
副溶血性弧菌的效应蛋白Vop Q (vp 1680)对T3SS1介导宿主细胞裂解是必需的,同时具有对Hela细胞的细胞毒性。研究表明,Vop Q具有3种功能:(1) Vop Q可激活肠上皮细胞内MAPK信号通路,并通过MAPK激活其下游的JNK、p38和ERK,刺激细胞蛋白表达,导致细胞毒性[7];(2) Vop Q能与宿主细胞溶酶体膜上的V-ATPase区竞争性结合,在溶酶体膜上形成一个小孔,破坏宿主细胞内的离子稳态和自噬流,促使宿主细胞发生自噬[8];(3) Vop Q可以抵抗巨噬细胞对副溶血性弧菌的吞噬作用,有利于在体内的存活[9]。
效应物Vop R (vp 1683)可以通过特定的N-末端结构域,特异性结合宿主的二磷酸磷脂酰肌醇(PIP2),定位在宿主细胞的细胞质膜(PM)上。值得注意的是,这种特异性宿主配体的结合诱导了其他效应物结构域的折叠,靶向易位后宿主细胞中整合效应子的重折叠机制。另外,Vop R还可以诱导细胞变圆[10]。
效应物Vop S (vp 1686),在宿主识别入侵病原体的先天免疫系统中,通过抑制NF-κB的活性介导巨噬细胞死亡[11];它还能通过直接修饰Rho、Rac和CDC42,来抑制下游GTPase信号传导,在被感染细胞中阻止肌动蛋白聚集,触发炎症反应[12];在巨噬细胞中抑制肌动蛋白快速重排,有助于抵抗巨噬细胞对病原菌的吞噬作用[13]。
VPA 0450是一种典型的磷脂酰化磷酸酶,和Vop S一样均可通过抑制或破坏肌动蛋白来发挥作用。在细胞质膜中有一种含量很少但功能强大的磷脂——磷脂酰环己六醇(4, 5)-二磷酸[PI(4, 5)P2],VPA 0450可以水解PI(4, 5)P2成为磷酸肌醇-4-磷酸(PI4P),这会破坏细胞膜内表面与肌动蛋白骨架之间的脂质位点,导致细胞膜起泡,破坏膜完整性,并可能通过促进裂解导致细胞死亡,在感染过程中可能与其他效应物发挥互补作用[14]。
在T3SS1中另外一些蛋白也被表征,其作用也逐渐被人认识,例如VP 1659、Vop D1、Vop B1等。VP 1659是一种T3SS1相关蛋白,它是分泌装置的一个组成部分,VP 1659的缺失可以有限降低细胞毒性,也是肌动蛋白重排和诱导自噬所必需的;同时也是一个转位蛋白,有助于导致HeLa细胞中细胞溶解,自噬和破坏肌动蛋白结构所需的效应蛋白的转位[15]。Vop D1 (vp 1656)和Vop B1 (vp 1657)在Vop Q (vp 1680)易位至宿主细胞时起充当T3SS1依赖性转座子的作用,在Vop Q发挥细胞毒性中必不可少[16]。
2.1.2 T3SS2效应物在致病力中的作用: 副溶血性弧菌T3SS2位于染色体2的毒力岛(PAI)上,其基因簇广泛存在于致病菌株中。目前研究的副溶血性弧菌T3SS2效应蛋白主要有8种,分别是Vop V、Vop L、Vop C、Vop O、Vop A/P、Vop T、Vop Z、VPA 1380。
Vop V (vpa 1357)是副溶血性弧菌中发现的第一个T3SS效应物[17],Vop V的目标是丝状肌动蛋白(F-action),肌动蛋白骨架是真核细胞形状的主要决定因素,它具有很强的动态功能,可连续装配和分解肌动蛋白丝,从而使细胞能够快速改变形态以响应外部信号。由病原体对肌动蛋白动力学和肌动蛋白结构的控制可以导致细胞结构和组织结构的剧烈变化,从而导致细胞和组织的异常行为。Vop V通过直接结合丝状肌动蛋白,将转染细胞内的肌动蛋白动力学破坏,并将其捆绑在集中的一点上,导致丝状肌动蛋白成束[17],Vop V的肌动蛋白结合功能是肠毒性的原因。
Vop L (vpa 1370)能诱导肌动蛋白应激纤维的形成,并促进肌动蛋白成束,介导副溶血性弧菌在细胞内的存活[18]。当病原菌入侵宿主细胞时,宿主细胞通过烟酰胺二核苷酸磷酸(NADPH)氧化酶复合物生产抗菌活性氧(ROS),以达到消灭病原体的目的。近来发现,副溶血性弧菌使用T3SS2效应物Vop L将肌动蛋白组装成非功能细丝,导致功能失调的肌动蛋白细胞骨架不再能够介导细胞膜上NADPH氧化酶的组装,限制ROS的产生,从而使副溶血性弧菌在宿主细胞内保持相对无压力的环境,有利于在宿主细胞内的存活和复制[19]。
Vop C (vpa 1321)介导细菌从宿主细胞液泡内的逃逸现象,进而得以在宿主细胞内复制,并且参与应激纤维的形成。在一般的病原体入侵过程中,宿主细胞会启动自动防御机制,病原菌首先被液泡包裹,然后与溶酶体融合,最终降解液泡内容物[20]。但是在近来研究发现,副溶血性弧菌破坏了这种机制,T3SS2效应蛋白Vop C通过脱酰胺反应组成型激活CDC42,使副溶血性弧菌在溶酶体融合之前,逃逸到细胞质中,并且在细胞质中大量复制[21]。并且Vop C通过激活Rac1有助于在感染细胞中形成肌动蛋白应激纤维,但是,副溶血性弧菌似乎不依赖于Vop C介导入侵,Vop C的基因失活不影响肠道的定殖,也不会减少疾病的症状,包括积液、腹泻和组织破坏[22]。因此,虽然Vop C可以促进宿主细胞的入侵,但这种途径并不是导致疾病过程的关键步骤。
Vop O (vpa 1329)被鉴定为激活Rho A-ROCK通路的关键T3SS2效应蛋白,这是诱导T3SS2依赖的应激纤维形成的重要途径。GEF-H1,一种Rho A鸟嘌呤核苷酸交换因子,可以直接与Vop O结合,激活Rho A-ROCK途径,通过诱导应激纤维形成参与破坏宿主上皮屏障;此外,Vop O对T3SS2依赖性侵袭也具有作用,但与GEF-H1介导的Rho A-ROCK途径的激活无关[23]。
事实上,操纵宿主细胞的肌动蛋白细胞骨架是致病细菌最常用的毒力策略之一。上述4种T3SS2效应物即Vop C、Vop L、Vop V和Vop O,都直接或间接靶向肌动蛋白细胞骨架,与T3SS1效应物VPA 0450和Vop S不同的是,T3SS1效应物抑制肌动蛋白的形成,T3SS2效应物则促进形成。组织培养分析表明,副溶血性弧菌中的T3SS2引起肌动蛋白细胞骨架的3个显著变化,即细菌微菌落下的F-肌动蛋白积累、细菌进入部位的肌动蛋白应激纤维的诱导和膜褶皱的形成[17, 24]。Vop V直接与F-肌动蛋白结合,并且负责F-肌动蛋白的积累表型[17]。Vop L、Vop C和Vop O都诱导应激纤维的形成。Vop L在转染的细胞中具有肌动蛋白丝成核活性,促进应激纤维成束[24],Vop C也有助于诱导应激纤维形成,但是这两个都不是这个过程所必需的。而Vop O激活Rho A-ROCK途径才是诱导应激纤维形成的必要第一步,Vop L的活性似乎可以提高应激纤维形成的效率。
操控细胞信号蛋白,是效应物发挥作用的另一有效途径。Vop A/P (vpa 1346)通过靶向激酶上的不同位点有效抑制MKKs的两种途径。一是抑制MKK活化,Vop A/P可以将活化激酶催化环结构中保守的赖氨酸乙酰化,阻止ATP的结合,乙酰化的MKK被共价锁定在无活性状态,不再能够修饰它们的底物;二是抑制活化的MKK,这种途径主要是通过乙酰化丝氨酸和苏氨酸残基上的激活环磷酸化,导致激酶无法激活,从而靶向激活的MKKs[25]。
Vop T (vpa 1327)是一种ADP-核糖基转移酶(ADPRT),在体内和体外都具有针对Ras的ADP核糖基活化活性,而Ras蛋白在真核细胞中是许多信号通路的关键组分,其活性状态对细胞的生长和分化、细胞骨架形成、蛋白质的运输和分泌等都具有影响[26]。Vop T是负责T3SS2依赖性细胞毒性的必需基因,具有抑制宿主细胞生长的作用,并对小肠细胞具有细胞毒性[27]。
有研究表明,T3SS2的效应物Vop Z (vpa 1336)在肠道定殖和腹泻方面起着不同的作用。实验表明,Vop Z的表达缺失可以影响副溶血性弧菌在肠道内的定殖,而Vop Z氨基酸的部分缺失会消除副溶血性弧菌引起的腹泻和肠道病变,但不会影响定殖[28]。肠上皮中TAK1的缺失导致炎症、细胞死亡、上皮结构扭曲和屏障功能降低表明TAK1对维持肠道完整性的重要性[28]。Vop Z抑制丝裂源活化蛋白激酶TAK1的启动,从而阻止下游的MAPK信号通路的活化,抑制宿主细胞分裂,并且能够在Hela细胞表面形成小孔,引人注目的是,Vop Z的缺失导致的腹泻和肠积液,几乎与整个T3SS2的失活程度相同[29]。因此,Vop Z对副溶血性弧菌在肠道内的增殖作用可能并非决定性因素,但对于该菌在肠道内引起腹泻和组织破坏等疾病至关重要。
VPA 1380 (vpa 1380)具有六磷酸肌醇(IP6)依赖性催化活性[30],是一种半胱氨酸蛋白酶[31],有可能与宿主细胞侵袭有关。
除了上述列举的常见效应物之外,其他的T3SS2效应物也逐渐被研究。例如VPA 1324 (vpa 1324)具有磷酸二酯酶活性,磷酸二酯酶可以影响多个途径的生理学过程,包括离子通道、细胞凋亡等,VPA 1324基因缺失株可以使宿主细胞变圆、皱缩,具有细胞毒性,并且可能会导致细胞凋亡[32]。T3SS2的两个分泌蛋白Vop D2 (vpa 1361)和Vop B2 (vpa 1362),不但可以发挥肠毒性,而且也是转位蛋白,在Vop B2或Vop D2的基因缺失株中,Vop T也无法分泌[33]。
2.1.3 副溶血性弧菌T3SS的调控机制: 副溶血性弧菌调控因子有很多,例如Exs C、Exs D、Aph A、Opa R、Tox R和Cal R等。Exs C与Exs D能够调控T3SS1基因簇的转录表达,Exs A和Exs C为正向转录调控,Exs D为负向转录调控。Exs A与T3SS1基因启动区结合才可以使T3SS1表达,Exs D结合Exs A阻止T3SS1的表达,Exs C结合Exs D释放Exs A,从而允许T3SS1的表达[34]。
Aph A通过激活Exs C、Exs B和Exs D基因的转录来促进T3SS1 (vp 1687)的转录,继而促进细菌对宿主细胞的细胞毒性;Opa R则通过抑制Exs C、Exs B和Exs D基因的转录来抑制T3SS1 (vp 1687)的转录,继而抑制细菌对宿主细胞的细胞毒性[35]。其中Aph A和Opa R结合Exs B基因启动子区序列直接调控其转录表达,对Exs C和Exs D的作用则是间接的。这个结果表明在菌密度较低时Aph A大量表达可以促进T3SS1表达,致使微量的细菌就可以引起感染;在菌密度较高时Opa R抑制T3SS1的表达,使细菌对宿主的致病力下降,进而促进其排出宿主体外,利于细菌的传播。
Cal R是一个转录调节因子,可以抑制T3SS1的表达。Tox R是一种跨膜调节蛋白,其作用于致病性弧菌的DNA结合和转录调控,也通过激活Cal R间接抑制T3SS1基因的转录,也是T3SS1基因的抑制因子,而Cal R对Tox R又具有负调控作用[36]。
除了转录调控因子之外,像胆汁这样的特殊环境因素也会对T3SS产生调控作用。胆汁是人类胃肠道的重要组成部分,在食物吸收和抗菌活性中起重要作用,但是肠道细菌病原体已经开发了将胆汁作为环境指示剂来调控毒力基因的策略。副溶血性弧菌Vtr C,以及Vtr A和Vtr B是激活Ⅲ型分泌系统毒力响应胆汁盐所必需的。胆汁盐不仅诱导T3SS2效应物的表达,如Vop A和Vop C,还可诱导针状分泌装置,如Vop D2,使其产生毒力因子,进而导致宿主感染[37]。
2.2 副溶血性弧菌T6SS
2.2.1 T6SS效应物在致病力中的作用: 细菌Ⅵ型分泌系统(T6SS)是一种接触依赖性蛋白分泌装置,正在成为环境中细菌间竞争的主要武器[38]。2006年,在铜绿假单胞菌和霍乱弧菌中第一次被发现[39-40]。在多种环境中介导细菌拮抗,包括真核生物,例如肠道。其直接将致命毒素注射到目标细胞中,为病原菌提供一种优势,阻碍宿主细胞功能,促进免疫逃避,直接或间接促进了菌落形成与持久性。还可以分泌效应因子到竞争群落中,同时可以分泌相应的同源免疫蛋白来保护自己,从而使自身获得竞争优势,这种优势不仅在种群中起作用,并且在种内的不同亚类间也具有相同的作用。
副溶血性弧菌中有两种不同T6SS,其中T6SS1 (vp 1386-1420)主要在临床分离株中发现,而T6SS2 (vpa 1025-1046)在临床和环境分离株中都有发现[41]。目前,所提出的T6SS的结构模型是由Vgr G蛋白、Hcp蛋白和Gp25基质蛋白同族物组装而成,还可能包括一些被分泌到胞质中的未被鉴定的蛋白质。
(1) 介导细胞黏附:Icm F1和Icm F2是副溶血性弧菌T6SS簇中的两个Icm F家族基因。而Icm F1 (主要分泌管蛋白)或Hcp1 (T6SS末端位于移位体)的缺失可显著降低细菌对Caco-2细胞或HeLa细胞的粘附,所以T6SS1可能有助于细胞在肠道内的粘附[42]。但是T6SS1与T6SS2对于不同宿主细胞具有粘附力差异。例如,T6SS1的缺失可以影响对于小肠上皮细胞和HeLa细胞的粘附,但是T6SS2的缺失仅影响对HeLa细胞的粘附[42],但具体是哪个效应物起作用还未见报道。(2)具有细胞毒性,诱导巨噬细胞自噬:有研究通过删除编码Hcp2和Vgr G2的两个推定的副溶血性弧菌T6SS2转座子来研究可能负责直接诱导自噬的效应蛋白,结果表明,Vgr G2的缺失导致细胞内cAMP水平降低,表明cAMP信号传导在细菌自噬反应中的可能作用,从而得出结论,副溶血性弧菌中Vgr G2诱导巨噬细胞自噬[43];Hcp2可能形成T6SS的管状结构,用于包括Vgr G在内的效应蛋白转运穿过细菌细胞壁,删除hcp2显然可以防止Vgr G2易位,导致LC3-Ⅱ减少[44]。副溶血性弧菌明显配备有两个自噬诱导剂臂T3SS1和T6SS2。然而,T6SS2诱导自噬而不涉及T3SS1中所见的细胞毒性效应。(3)介导虾急性肝胰腺坏死:急性肝胰腺坏死病(AHPND)是一种严重的疾病,对全球虾业造成严重损害和重大经济损失。有研究发现所有的AHPND菌株都含有以前在临床分离株RIMD2210633中鉴定和表征的抗菌型T6SS1,但是没有一个非AHPND菌株含有该基因簇[45]。有发现表明,T6SS1的获得可能会导致引起AHPND的副溶血性弧菌比其他细菌具有更强的竞争优势,更有利于对虾的感染。这一发现提供了对导致AHPND的病原体的新见解,并揭示了疾病控制的潜在目标。
2.2.2 副溶血性弧菌T6SS的调控机制: 环境信号,如温度、盐度、细胞密度和表面传感,以及一些调控因子等都会调节T6SS活性和表达。副溶血性弧菌T6SS1在高盐(3%)高温(37 ℃)条件下有活性,T6SS2在该条件下并无活性,但在1%盐度和30 ℃条件下显示抗菌活性。这表明副溶血性弧菌T6SS1在类似海洋的条件下是活跃的,而T6SS2在低盐条件下是有活性的[41]。
目前也有一些调控因子逐渐被人们认知,VP1391和VP1407是T6SS1的正调控因子,而Tox R与Aph A和Opa R (vp 2516)配合抑制副溶血性弧菌中的T6SS1表达[46]。Opa R与VP1388-1390,VP1400-1406和VP1409-1407的启动子结合以抑制其转录,但它似乎以间接方式负向调节VP1393-1406转录。相反,Aph A以间接方式负面调节上述四种T6SS1操纵子。另外,Tox R与VP1400-1406和VP1409-1407的启动子结合以抑制它们的转录,但它与VP1388-1390和VP1393-1406启动子呈现间接相互作用。另外也有一些蛋白参与T6SS的调控,H-NS是一种核结构蛋白,也是T6SS1的阻遏物,可以通过调节Opa R间接调控T6SS[47]。
副溶血性弧菌T6SS2也受Opa R蛋白的转录调控,Opa R蛋白促进其表达,Opa R结合于VPA1027、VPA1043和VPA10443这三个靶基因的启动子区直接正向调控T6SS2的转录,而Aph A间接负向调控VPA1027、VPA1043和VPA1044的转录,从而抑制T6SS2的表达[48]。
值得注意的是,Tox R与Aph A和Opa R的表达也以群体感应(QS)依赖性方式表现。QS是细菌密度变化来诱导的基因表达的过程,在细胞密度低时,Opa R被抑制,Aph A被诱导;而细胞密度高时则情况相反,Opa R被诱导而Aph A被抑制[49, 46]。QS对T6SS1具有负调控作用,对T6SS2具有正调控作用,这表明T6SS1功能仅在对数生长中期阶段发挥作用,而T6SS2可能在细菌感染的后期起主要作用,维持细菌的毒力[50]。
3 结论和展望 分泌系统分泌的蛋白质及毒素与宿主之间的相互作用,是它能在宿主体内存活并发挥致病性的重要因素之一。随着科技的发展,对于副溶血性弧菌毒力因子的研究越发深入,但是大都局限于某一因子的单独机制,而对于细菌总效应物共同作用的详细致病机制研究尚处于起步阶段。在这一方面,仍然有很多问题有待深入探索,如其他分泌系统在副溶血性弧菌中的相关作用,效应蛋白的输出机制,环境因素对分泌系统的影响,效应蛋白与宿主细胞的相互作用、相关调控基因及其调控机制等,这些研究对于探明副溶血性弧菌及分泌系统的致病机理具有重要意义。
我们对于临床和环境分离的副溶血性弧菌T3SS效应物基因的普查,发现并不是所有的菌株都含有完全的分泌系统效应物基因,不同菌株之间具有差异性,并且临床分离株相关基因数量普遍比环境分离株多[51],同时T6SS也具有相同的特征。并且我们还发现不同副溶血性弧菌之间存在种内竞争关系[52],虽然这个问题还未有明确解释,但T6SS介导种内竞争[53]的相关功能给了我们新的思路,对这一部分的研究可能对揭示同种菌株在致病力中的差异具有重要意义。
细菌分泌系统是允许细菌致病性蛋白质直接递送到真核宿主细胞的细胞质中的必要组件,被认为是抗毒力类抗感染药物设计的理想靶标。而对于分泌系统效应物的研究则给人们在研究和开发新型靶向药物带来更多启示,目前的抗生素主要以细菌代谢、生长及细胞壁为目标,对这些基本功能施加的选择性压力易导致耐药菌出现。我们认为与抗生素相比,针对菌株之间保守的依赖接触杀伤机制的抗菌策略应用的选择性压力更小,这有利于解决细菌耐药性问题。对于致病菌的研究,疾病的预防和治疗仍然是未来研究的关键,关于人类宿主疾病与分泌系统致病性之间具体关系的解析,对开发研究新药和靶向治疗,制定有效防控措施,以消除疾病对人类健康造成的风险极具意义。
References
| [1] | Mao XD, Hu JF, Liu XM. Study on incidence of foodborne disease caused by Vibrio parahaemolyticus by literature review method. Chinese Journal of Disease Control & Prevention, 2013, 17(3): 265-267. (in Chinese) 毛雪丹, 胡俊峰, 刘秀梅. 用文献综述法估计我国食源性副溶血性弧菌病发病率. 中华疾病控制杂志, 2013, 17(3): 265-267. |
| [2] | Liu HQ, Liu BX, Lv LQ, Pan YJ, Xie J, Zhao Y. Risk analysis of Vibrio parahaemolyticus in edible raw salmon marketed in Shanghai. Food Science, 2015, 36(24): 195-199. (in Chinese) 刘海泉, 刘冰宣, 吕利群, 潘迎捷, 谢晶, 赵勇. 上海市生食三文鱼中副溶血性弧菌污染的风险分析. 食品科学, 2015, 36(24): 195-199. DOI:10.7506/spkx1002-6630-201524036 |
| [3] | Wang JJ, Sun WS, Jin MT, Liu H, Zhang WJ, Sun XH, Pan YJ, Zhao Y. Fate of Vibrio parahaemolyticus on shrimp after acidic electrolyzed water treatment. International Journal of Food Microbiology, 2014, 179: 50-56. DOI:10.1016/j.ijfoodmicro.2014.03.016 |
| [4] | Ceccarelli D, Hasan NA, Huq A, Colwell RR. Distribution and dynamics of epidemic and pandemic Vibrio parahaemolyticus virulence factors. Frontiers in Cellular & Infection Microbiology, 2013, 3: 97. |
| [5] | Park KS, Ono T, Rokuda M, Jang MH, Iida T, Honda T. Cytotoxicity and enterotoxicity of the thermostable direct hemolysin-deletion mutants of Vibrio parahaemolyticus. Microbiology & Immunology, 2004, 48(4): 313-318. |
| [6] | de Nisco NJ, Kanchwala M, Li P, Fernandez J, Xing C, Orth K. The cytotoxic type 3 secretion system 1 of Vibrio rewires host gene expression to subvert cell death and activate cell survival pathways. Science Signaling, 2017, 10(479): eaal4501. DOI:10.1126/scisignal.aal4501 |
| [7] | Ono T, Park KS, Ueta M, Iida T, Honda T. Identification of proteins secreted via Vibrio parahaemolyticus type Ⅲ secretion system 1. Infection and Immunity, 2006, 74(2): 1032-1042. DOI:10.1128/IAI.74.2.1032-1042.2006 |
| [8] | Sreelatha A, Bennett TL, Zheng H, Jiang QX, Orth K, Starai VJ. Vibrio effector protein, VopQ, forms a lysosomal gated channel that disrupts host ion homeostasis and autophagic flux. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(28): 11559-11564. DOI:10.1073/pnas.1307032110 |
| [9] | Burdette DL, Seemann J, Orth K. Vibrio VopQ induces PI3-kinase-independent autophagy and antagonizes phagocytosis. Molecular Microbiology, 2009, 73(4): 639-649. DOI:10.1111/mmi.2009.73.issue-4 |
| [10] | Salomon D, Guo YR, Kinch LN, Grishin NV, Gardner KH, Orth K. Effectors of animal and plant pathogens use a common domain to bind host phosphoinositides. Nature Communications, 2013, 4: 2973. DOI:10.1038/ncomms3973 |
| [11] | Bhattacharjee RN, Park KS, Kumagai Y, Okada K, Yamamoto M, Uematsu S, Matsui K, Kumar H, Kawai T, Ii da, T, Honda T, Takeuchi O, Akira S. VP1686, a Vibrio type Ⅲ secretion protein, induces toll-like receptor-independent apoptosis in macrophage through NF-κB inhibition. Journal of Biological Chemistry, 2006, 281(48): 36897-36904. DOI:10.1074/jbc.M605493200 |
| [12] | Creech C, Kanauja M, Causey CP. Synthesis and evaluation of 2-ethynyl-adenosine-5′-triphosphate as a chemical reporter for protein AMPylation. Organic & Biomolecular Chemistry, 2015, 13(31): 8550-8555. |
| [13] | Yarbrough ML, Li Y, Kinch LN, Grishin NV, Ball HL, Orth K. AMPylation of Rho GTPases by Vibrio VopS disrupts effector binding and downstream signaling. Science, 2009, 323(5911): 269-272. DOI:10.1126/science.1166382 |
| [14] | Broberg CA, Zhang L, Gonzalez H, Laskowski-Arce MA, Orth K. A Vibrio effector protein is an inositol phosphatase and disrupts host cell membrane integrity. Science, 2010, 329(5999): 1660-1662. DOI:10.1126/science.1192850 |
| [15] | Zhou XH, Konkel ME, Call DR. Vp1659 is a Vibrio parahaemolyticus type Ⅲ secretion system 1 protein that contributes to translocation of effector proteins needed to induce cytolysis, autophagy, and disruption of actin structure in HeLa cells. Journal of Bacteriology, 2010, 192(13): 3491-3502. DOI:10.1128/JB.01493-09 |
| [16] | Shimohata T, Mawatari K, Iba H, Hamano M, Negoro S, Asada S, Aihara M, Hirata A, Su ZH, Takahashi A. VopB1 and VopD1 are essential for translocation of type Ⅲ secretion system 1 effectors of Vibrio parahaemolyticus. Canadian Journal of Microbiology, 2012, 58(8): 1002-1007. DOI:10.1139/w2012-081 |
| [17] | Hiyoshi H, Kodama T, Saito K, Gotoh K, Matsuda S, Akeda Y, Honda T, Iida T. VopV, an F-actin-binding type Ⅲ secretion effector, is required for Vibrio parahaemolyticus-induced enterotoxicity. Cell Host & Microbe, 2011, 10(4): 401-409. |
| [18] | Yu BK, Cheng HC, Brautigam CA, Tomchick DR, Rosen MK. Mechanism of actin filament nucleation by the bacterial effector VopL. Nature Structural & Molecular Biology, 2011, 18(9): 1068-1074. |
| [19] | de Souza Santos M, Salomon D, Orth K. T3SS effector VopL inhibits the host ROS response, promoting the intracellular survival of Vibrio parahaemolyticus. PLoS Pathogens, 2017, 13(6): e1006438. DOI:10.1371/journal.ppat.1006438 |
| [20] | Ray K, Marteyn B, Sansonetti PJ, Tang CM. Life on the inside:the intracellular lifestyle of cytosolic bacteria. Nature Reviews Microbiology, 2009, 7(5): 333-340. DOI:10.1038/nrmicro2112 |
| [21] | de Souza Santos M, Orth K. Intracellular Vibrio parahaemolyticus escapes the vacuole and establishes a replicative niche in the cytosol of epithelial cells. mBio, 2014, 5(5): e01506-14. |
| [22] | Okada R, Zhou XH, Hiyoshi H, Matsuda S, Chen X, Akeda Y, Kashimoto T, Davis BM, Iida T, Waldor MK, Kodama T. The Vibrio parahaemolyticus effector VopC mediates Cdc42-dependent invasion of cultured cells but is not required for pathogenicity in an animal model of infection. Cellular Microbiology, 2014, 16(6): 938-947. DOI:10.1111/cmi.2014.16.issue-6 |
| [23] | Hiyoshi H, Okada R, Matsuda S, Gotoh K, Akeda Y, Iida T, Kodama T. Interaction between the type Ⅲ effector VopO and GEF-H1 activates the RhoA-ROCK pathway. PLoS Pathogens, 2015, 11(3): e1004694. DOI:10.1371/journal.ppat.1004694 |
| [24] | Liverman ADB, Cheng HC, Trosky JE, Leung DW, Yarbrough ML, Burdette DL, Rosen MK, Orth K. Arp2/3-independent assembly of actin by Vibrio type Ⅲ effector VopL. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(43): 17117-17122. DOI:10.1073/pnas.0703196104 |
| [25] | Trosky JE, Li Y, Mukherjee S, Keitany G, Ball H, Orth K. VopA inhibits ATP binding by acetylating the catalytic loop of MAPK kinases. Journal of Biological Chemistry, 2007, 282(47): 34299-34305. DOI:10.1074/jbc.M706970200 |
| [26] | Caburlotto G, Lleò MM, Hilton T, Huq A, Colwell RR, Kaper JB. Effect on human cells of environmental Vibrio parahaemolyticus strains carrying type Ⅲ secretion system 2. Infection & Immunity, 2010, 78(7): 3280-3287. |
| [27] | Kodama T, Rokuda M, Park KS, Cantarelli VV, Matsuda S, Iida T, Honda T. Identification and characterization of VopT, a novel ADP-ribosyltransferase effector protein secreted via the Vibrio parahaemolyticus type Ⅲ secretion system 2. Cellular Microbiology, 2007, 9(11): 2598-2609. DOI:10.1111/cmi.2007.9.issue-11 |
| [28] | Casselli T, Lynch T, Southward CM, Jones BW, de Vinney R. Vibrio parahaemolyticus inhibition of Rho family GTPase activation requires a functional chromosome Ⅰ type Ⅲ secretion system. Infection & Immunity, 2008, 76(5): 2202-2211. |
| [29] | Zhou XH, Gewurz BE, Ritchie JM, Takasaki K, Greenfeld H, Kieff E, Davis BM, Waldor MK. A Vibrio parahaemolyticus T3SS effector mediates pathogenesis by independently enabling intestinal colonization and inhibiting TAK1 activation. Cell Reports, 2013, 3(5): 1690-1702. DOI:10.1016/j.celrep.2013.03.039 |
| [30] | Tsai SE, Jong KJ, Tey YH, Yu WT, Chiou CS, Lee YS, Wong HC. Molecular characterization of clinical and environmental Vibrio parahaemolyticus isolates in Taiwan. International Journal of Food Microbiology, 2013, 165(1): 18-26. DOI:10.1016/j.ijfoodmicro.2013.04.017 |
| [31] | Calder T, Kinch LN, Fernandez J, Salomon D, Grishin NV, Orth K. Vibrio type Ⅲ effector VPA1380 is related to the cysteine protease domain of large bacterial toxins. PLoS ONE, 2014, 9(8): e104387. DOI:10.1371/journal.pone.0104387 |
| [32] | 李楚楚.副溶血弧菌T3SS2新效应蛋白的鉴定及其功能的初步研究.浙江理工大学硕士学位论文, 2016. |
| [33] | Kodama T, Hiyoshi H, Gotoh K, Akeda Y, Matsuda S, Park KS, Cantarelli VV, Iida T, Honda T. Identification of two translocon proteins of Vibrio parahaemolyticus type Ⅲ secretion system 2. Infection & Immunity, 2008, 76(9): 4282-4289. |
| [34] | Zhou XH, Konkel ME, Call DR. Regulation of type Ⅲ secretion system 1 gene expression in Vibrio parahaemolyticus is dependent on interactions between ExsA, ExsC, and ExsD. Virulence, 2010, 1(4): 260-272. DOI:10.4161/viru.1.4.12318 |
| [35] | Liu AC, Thomas NA. Transcriptional profiling of Vibrio parahaemolyticus exsA reveals a complex activation network for type Ⅲ secretion. Frontiers in Microbiology, 2015, 6: 1089. |
| [36] | Osei-Adjei G, Gao H, Zhang Y, Zhang LY, Yang WH, Yang HY, Yin Z, Huang XX, Zhang YQ, Zhou DS. Regulatory actions of ToxR and CalR on their own genes and type Ⅲ secretion system 1 in Vibrio parahaemolyticus. Oncotarget, 2017, 8: 65809-65822. |
| [37] | Li P, Rivera-Cancel G, Kinch LN, Salomon D, Tomchick DR, Grishin NV, Orth K. Bile salt receptor complex activates a pathogenic type Ⅲ secretion system. eLife, 2016, 5: e15718. DOI:10.7554/eLife.15718 |
| [38] | Pukatzki S, Ma AT, Revel AT, Sturtevant D, Mekalanos JJ. Type Ⅵ secretion system translocates a phage tail spike-like protein into target cells where it cross-links actin. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(39): 15508-15513. DOI:10.1073/pnas.0706532104 |
| [39] | Mougous JD, Cuff ME, Raunser S, Shen A, Zhou M, Gifford CA, Goodman AL, Joachimiak G, Ordo ez CL, Lory S, Walz T, Joachimiak A, Mekalanos JJ. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus. Science, 2006, 312(5779): 1526-1530. DOI:10.1126/science.1128393 |
| [40] | Pukatzki S, Ma A T, Sturtevant D, Krastins B, Sarracino D, Nelson WC, Heidelberg JF, Mekalanos JJ. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(5): 1528-1533. DOI:10.1073/pnas.0510322103 |
| [41] | Salomon D, Gonzalez H, Updegraff BL, Orth K. Vibrio parahaemolyticus type Ⅵ secretion system 1 is activated in marine conditions to target bacteria, and is differentially regulated from system 2. PLoS One, 2013, 8(4): e61086. DOI:10.1371/journal.pone.0061086 |
| [42] | Yu Y, Yang H, Li J, Zhang PP, Wu BB, Zhu BL, Zhang Y, Fang WH. Putative type Ⅵ secretion systems of Vibrio parahaemolyticus contribute to adhesion to cultured cell monolayers. Archives of Microbiology, 2012, 194(10): 827-835. DOI:10.1007/s00203-012-0816-z |
| [43] | Mestre MB, Colombo MI. cAMP and EPAC are key players in the regulation of the signal transduction pathway involved in the α-Hemolysin autophagic response. PLoS Pathogens, 2012, 8(5): e1002664. DOI:10.1371/journal.ppat.1002664 |
| [44] | Yu Y, Fang LH, Zhang Y, Sheng HX, Fang WH. VgrG2 of type Ⅵ secretion system 2 of Vibrio parahaemolyticus induces autophagy in macrophages. Frontiers in Microbiology, 2015, 6: 168. |
| [45] | Li P, Kinch LN, Ray A, Dalia AB, Cong Q, Nunan LM, Camilli A, Grishin NV, Salomon D, Orth K. Acute hepatopancreatic necrosis disease-causing Vibrio parahaemolyticus strains maintain an antibacterial type Ⅵ secretion system with versatile effector repertoires. Applied & Environmental Microbiology, 2017, 83(13): e00737-17. |
| [46] | Zhang YQ, Gao H, Osei-Adjei G, Zhang Y, Yang WH, Yang HY, Yin Z, Huang XX, Zhou DS. Transcriptional regulation of the type Ⅵ secretion system 1 genes by quorum sensing and ToxR in Vibrio parahaemolyticus. Frontiers in Microbiology, 2017, 8: 2005. DOI:10.3389/fmicb.2017.02005 |
| [47] | Salomon D, Klimko JA, Orth K. H-NS regulates the Vibrio parahaemolyticus type Ⅵ secretion system 1. Microbiology, 2014, 160(9): 1867-1873. |
| [48] | Wang L, Zhou DS, Mao PY, Zhang YQ, Hou J, Hu Y, Li J, Hou SJ, Yang RF, Wang RH, Qiu JF. Cell density-and quorum sensing-dependent expression of type Ⅵ secretion system 2 in Vibrio parahaemolyticus. PLoS ONE, 2013, 8(8): e73363. DOI:10.1371/journal.pone.0073363 |
| [49] | Zhang YQ, Zhang LY, Hou SN, Huang XX, Sun FJ, Gao H. The master quorum-sensing regulator OpaR is activated indirectly by H-NS in Vibrio parahaemolyticus. Current Microbiology, 2016, 73(1): 71-76. DOI:10.1007/s00284-016-1018-8 |
| [50] | Ma LZ, Zhang YQ, Yan XJ, Guo LP, Wang L, Qiu JF, Yang RF, Zhou DS.Expression of the type Ⅵ secretion system 1 component Hcp1 is indirectly repressed by OpaR in Vibrio parahaemolyticus.The Scientific World Journal, 2012, 2012: Article ID 982140. |
| [51] | Li H, Tang R, Lou Y, Cui ZL, Chen WJ, Hong Q, Zhang ZH, Malakar PK, Pan YJ, Zhao Y. A comprehensive epidemiological research for clinical Vibrio parahaemolyticus in Shanghai. Frontiers in Microbiology, 2017, 8: 1043. DOI:10.3389/fmicb.2017.01043 |
| [52] | Xu MJK, Feng B, Zhang ZH, Sun XH, Pan YJ, Zhao Y. Effects of mixed culture on the growth of pathogenic and nonpathogenic V.parahaemolyticus.Journal of Shanghai Ocean University, 2017, 26(5):776-783.(in Chinese) 徐马俊坤, 冯博, 张昭寰, 孙晓红, 潘迎捷, 赵勇.混合培养对副溶血性弧菌致病株和非致病株生长的影响.上海海洋大学学报, 2017, 26(5):776-783. |
| [53] | Unterweger D, Miyata ST, Bachmann V, Brooks TM, Mullins T, Kostiuk B, Provenzano D, Pukatzki S.The Vibrio cholerae type Ⅵ secretion system employs diverse effector modules for intraspecific competition.Nature Communications, 2014, 5: 3549. |
