黄颖1, 姚雪妍1, 刘腾飞2, 米硕甫3, 孙丽超1

 , 辛凤姣1
, 辛凤姣1

1. 中国农业科学院农产品加工研究所, 北京 100193;
2. 北京中医药大学, 北京 102488;
3. 中国科学院过程工程研究所, 北京 100190
收稿日期:2018-06-07;修回日期:2018-09-14;网络出版日期:2018-11-28
基金项目:国家重点研发计划(2017YFD0400204);国家自然科学基金(31571963,31700701)
*通信作者:孙丽超, Tel/Fax:+86-10-62893472, E-mail:sun2004go@163.com;
辛凤姣, Tel/Fax:+86-10-62815873, E-mail:xinfengjiao@caas.cn.
摘要:[目的] 拟对来源于热解纤维素果汁杆菌的新型β-木糖苷酶基因(CoXyl B)进行重组表达和酶学性质研究。[方法] 在大肠杆菌系统中成功表达CoXyl B基因,并通过镍柱亲和层析、强阴离子交换和凝胶层析等纯化方法获得纯酶。[结果] 对CoXyl B酶学性质的研究结果显示,在以4-对硝基苯酚-β-D-木糖苷为底物时,该酶的最适反应温度为90℃,最适反应pH为6.0。在40-70℃范围内CoXyl B酶活较高且比较稳定。在pH 5.0-6.0之间,70℃孵育1 h后,CoXyl B的相对酶活仍保留80%以上。Ag+、高浓度的SDS和PMSF对酶活力的抑制作用较显著,而高浓度Mg2+、Li+和EDTA对酶活力的激活作用较为明显。CoXyl B的kcat和Km值分别为5.0×10-3 s-1和1.9 mmol/L。薄层层析色谱显示CoXyl B具有降解木二糖、木三糖和木四糖的能力。[结论] 本研究鉴定出CoXyl B为一种新型的极端耐热木糖苷酶,CoXyl B的酶学性质研究将为其在食品热加工以及生物降解领域中的应用提供参考。
关键词:热解纤维素果汁杆菌属极端耐热β-木糖苷酶重组表达酶学性质
Biochemical characterization of a novel thermostable β-1, 4-xylosidase from Caldicellulosiruptor owensensis OL
Ying Huang1, Xueyan Yao1, Tengfei Liu2, Shuofu Mi3, Lichao Sun1

 , Fengjiao Xin1
, Fengjiao Xin1

1. Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
2. Beijing University of Chinese Medicine, Beijing 102488, China;
3. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China
*Corresponding author: Lichao Sun, Tel/Fax: +86-10-62893472, E-mail: sun2004go@163.com;
Fengjiao Xin, Tel/Fax: +86-10-62815873, E-mail: xinfengjiao@caas.cn.
Foundation item: Supported by the National Key Research and Development Plan (2017YFD0400204) and by the National Natural Science Foundation of China (31571963, 31700701)
Abstract: [Objective] A thermostable β-xylosidase from the thermophile Caldicellulosiruptor owensensis OL (CoXyl B) was characterized. [Methods] Recombinant CoXyl B was heterogeneously expressed in Escherichia coli and then purified using Ni-NTA, anion exchange and Superdex 200 chromatography. Further, the hydrolysis activity of CoXyl B was studied using p-nitrophenyl-D-xyloside (pNPX) and xylooligosaccharide as substrates. [Results] The optimum temperature and pH of CoXyl B was 90℃ and pH 6.0, respectively. CoXyl B maintained stable at temperature between 40℃ and 70℃. After incubation at 70℃ for 1 h, CoXyl B retained more than 80% of its initial activity at both pH 5.0 and 6.0. Significantly, Ag+, SDS and PMSF exhibited negative effect on the activity of CoXyl B, whereas Mg2+, Li+ and EDTA significantly enhanced the activity of CoXyl B. The kinetic parameters of CoXyl B towards pNPX were kcat of 5.0×10-3 s-1 and Km of 1.9 mmol/L. Moreover, CoXyl B exhibited efficient hydrolysis activity towards xylobiose, xylotriose and xylotetraose. [Conclusion] Our work suggested the application potential of a new thermostable β-xylosidase (CoXyl B) in the area of xylan degradation at high temperature.
Keywords: Caldicellulosiruptor owensensisthermostabilityβ-xylosidaserecombinant expressionenzyme activity
木聚糖类半纤维素是植物细胞壁的主要构成组分,是一类丰富的自然资源。木聚糖作为一种异质多糖,主链由β-1, 4-糖苷键连接的D-吡喃木糖组成,侧链则连接阿拉伯糖等不同的残基。在木聚糖水解酶系的作用下,木聚糖可被彻底水解产生低聚木糖,如木三糖、木二糖和木糖。木聚糖水解酶系主要包括β-1, 4-木聚糖酶、β-木糖苷酶、α-L-阿拉伯糖苷酶、葡萄糖苷酸酶、乙酰酯酶等。这些酶被广泛应用到医药、饲料工业、造纸业和食品工业等众多领域[1-5]。其中,木聚糖酶因其可直接作用于木聚糖并产生低聚木糖而广受关注[6-8]。而β-木糖苷酶作为该酶系的主要成员之一,负责将可溶性低聚木糖的非还原端水解并释放木糖单体,对于低聚木糖的降解起着关键性的作用[9-10]。虽然近年来β-木糖苷酶逐渐被重视起来,但是相关研究还没有达到类似木聚糖酶工业化应用的程度,亟需进一步深入探讨。β-木糖苷酶来源广泛,包括细菌、放线菌、真菌以及高等植物[11-15]。目前只有少部分β-木糖苷酶具有热稳定性特征,大部分已报道的β-木糖苷酶的最适温度都在40–60 ℃之间[16]。然而有些工业生产过程需在特殊的温度下进行,例如食品烘培工艺要求生物催化剂对于温度具有较高的耐受性。因此,为了改善工业生产工艺和降低生产成本,我们亟待挖掘热稳定性更高的β-木糖苷酶[17]。热解纤维素果汁杆菌属(Caldicellulosiruptor)属于极端嗜热厌氧菌,能够生产热稳定的胞外木聚糖水解酶系,有报道称这些酶对天然半纤维素材料具有高效的降解作用[18]。目前,Caldicellulosiruptor属来源的木聚糖水解酶系已有一些被分离并表征了酶学特性,但其中有关β-木糖苷酶的报道却相对较少[19-21]。本文研究的β-木糖苷酶(CoXyl B)属于糖苷水解酶39家族,来源于Caldicellulosiruptor owensensis OL (ATCC700167T),该菌可在pH 5.5–9.0及50–80 ℃的条件下生长,最适生长条件是pH 7.5和75℃ [21]。据报道,来自该菌的一种木聚糖酶和木糖苷酶可以通过协同作用将木聚糖水解成木糖,并被认为具有一定的工业应用潜力[19]。本研究拟从热解纤维素果汁杆菌属中挖掘新型的耐热木糖苷酶。热解纤维素果汁杆菌具有极端耐热的特性,且含有木糖苷酶等酶类,因此具有挖掘新型耐热木糖苷酶的巨大潜力。本文拟对热解纤维素果汁杆菌属C. owensensis OL菌中的新型木糖苷酶CoXyl B进行重组表达与纯化,通过表征其酶学性质,为该酶的分子改造及应用研究提供理论依据。
1 材料和方法 1.1 材料
1.1.1 质粒和菌株: CoXyl B基因来源于热解纤维素果汁杆菌属Caldicellulosiruptor owensensis,由中科院过程所韩业君课题组挖掘得到,文章中重组质粒pET28b-CoXyl B由韩业君课题组馈赠所得。大肠杆菌(Escherichia coli) trans10和transetta购于全式金公司。
1.1.2 试剂: 异丙基硫代-β-D-半乳糖苷(IPTG)和卡那霉素(KANA)购自北京索莱宝公司,质粒小提试剂盒购自天根公司。BSA蛋白等化学试剂购于北京国药有限公司,底物对硝基苯基-β-D-吡喃木糖苷(pNPX)购于Sigma公司,均为分析纯。Ni-NTA亲和柱和source 15Q阴离子交换柱的柱材购于QIAGEN公司,葡聚糖凝胶层析柱superdex 200购自GE公司,3种纯化柱的柱材体积分别为4、25、25 mL。
1.2 重组酶的异源表达 将CoXyl B基因通过限制性酶切位点Nde Ⅰ和XhoⅠ插入pET-28b载体中,且位于一段His6-tag序列的后端。构建的重组质粒pET28b-CoXyl B通过热激法转化至大肠杆菌transetta感受态细胞中,涂布于含KANA抗生素的LB平板,37 ℃培养过夜。待长出菌落后,挑取单克隆到3 mL LB培养基中,振荡培养6–7 h (37 ℃,220 r/min)。然后将其转接到15 mL LB培养基中,振荡培养4–6 h (37 ℃,220 r/min)。随后,以1%接种量接入1 L LB培养基中,相同条件振荡培养,待OD600为0.6–0.8时,加入终浓度为0.2 mmol/L的IPTG进行低温诱导14 h (16 ℃,220 r/min)。
1.3 重组酶的纯化 将离心收集的菌体用缓冲液(50 mmol/L Tris-HCl,pH 8.0,300 mmol/L NaCl)重悬,采用高压均质仪破碎菌体细胞后,4 ℃条件下12000 r/min离心40 min收集上清。利用重组酶CoXyl B N端的组氨酸标签,采用镍亲和层析柱对重组蛋白CoXyl B进行纯化。使用高浓度的咪唑缓冲液(50 mmol/L Tris-HCl,250 mmol/L咪唑,pH 8.0)洗脱重组蛋白并收集洗脱液。将收集到的洗脱液稀释3倍后,用pure AKTA仪器纯化蛋白:首先根据蛋白的带电性,利用阴离子交换法(source 15Q)纯化蛋白,通过不同浓度的缓冲液(50 mmol/L Tris-HCl,1 mol/L NaCl,pH 8.0)梯度洗脱目的蛋白并除去高浓度咪唑,出现波峰时分管收集蛋白,然后将收集液超滤浓缩(4500 r/min)到1–2 mL;接着,根据蛋白的分子量,采用葡聚糖凝胶层析柱(GE superdex 200)纯化分离蛋白,出现波峰时分管收集蛋白溶液,用SDS-PAGE电泳检测蛋白纯度,并通过BSA法进行蛋白浓度的测定。
1.4 重组酶的酶活测定方法 100 μL反应体系中,以pNPX作为底物,加稀释10倍的酶液2 μL,反应5 min后加入2 mL 20%碳酸钠终止反应,采用分光光度法在403 nm处检测产物对硝基苯酚(pNP)的量,从而测定木糖苷酶的活性[22]。1个酶活性单位(U):在一定反应条件下,1 min内催化产生1 μmol pNP的酶量。
1.5 重组酶的最适温度、热稳定性、最适pH和pH稳定性测定
1.5.1 最适温度测定: 将底物溶解于pH 6.0的缓冲液中,在不同温度下(20–100 ℃,间隔10 ℃)分别反应5 min后测定酶活。以最高酶活性为100%,计算酶的相对活性。
1.5.2 最适pH测定: 在pH 3.0–9.0条件下,90℃反应5 min后分别测定酶活。以最高酶活性为100%,计算酶的相对活性。缓冲液配置如下:0.1 mol/L柠檬酸钠-柠檬酸(pH 3.0,4.0,5.0,6.0),0.1 mol/L Tris-HCl (pH 7.0,8.0,9.0)。
1.5.3 热稳定性测定: 将酶分别在40、50、60、70、80、90 ℃孵育3 h,然后在不同时间点取样终止反应(0、30、60、90、120、150、180 min),并在最适条件下测定剩余酶活。
1.5.4 pH稳定性测定: 将酶用不同pH的缓冲液稀释10倍,70 ℃处理1 h,然后在最适pH的缓冲液下90 ℃反应5 min,测定剩余酶活。每个实验重复测定3次。
1.6 金属离子和化学试剂对酶活的影响测定 向反应体系中加入不同的金属离子或化学试剂(终浓度为1 mmol/L和10 mmol/L),在最适条件下测定酶活。以只加对应的金属离子或化学试剂而不加入酶液的反应作为阴性对照。以不加金属离子和化学试剂的酶活作为100%,计算酶的相对活性。
1.7 动力学参数测定 用最适pH的缓冲液配置不同浓度的pNPX (0、0.20、0.50、0.75、1.00、3.00、5.00、6.00 mg/mL)作为底物,分别在最适条件下测定重组酶CoXyl B的活性。每个实验重复测定3次。采用非线性曲线拟合法作图,通过GraphPad Prism软件计算出CoXyl B的米氏常数(Km)和最大反应速度(Vmax),并换算出催化常数kcat[19]。
1.8 薄层层析色谱(TLC)水解产物分析 向445 μL柠檬酸/柠檬酸钠溶液(0.1 mol/L,pH 6.0)中分别加入终浓度为2 mg/mL的木二糖、木三糖和木四糖,然后加入5 μL酶液(1.48 mg/mL)起始反应,70 ℃条件下反应0、1、3 h后,于100 ℃金属浴中孵育10 min后终止反应,取上清液(12000 r/min,5 min)用于薄层层析色谱鉴定。将1 μL反应上清液和2 μL各种低聚木糖的混合标品[木一糖、木二糖、木三糖和木四糖(0.5 mg/mL)]点样于硅胶板上,在展开剂(正丁醇:乙酸:水= 2:1:1)中展开,晾干后均匀喷洒显色剂(V甲醇:V硫酸= 9:1,每100 mL显色剂加入100 mg 3, 5-二羟基甲苯),置于90 ℃烘箱烘干显色。
1.9 重组CoXyl B生物学信息分析 利用BLAST搜索软件比对CoXyl B的同源序列,采用Neighbor-Joining (NJ)(MEGA 7.0)算法构建系统进化树。
2 结果和分析 2.1 β-木糖苷酶CoXyl B的同源比对分析 经Uniprot分析,来源C. owensensis OL的CoXyl B属于糖苷水解酶第39家族(GH39),基因全长1503个碱基,编码501个氨基酸,理论分子量约为58.4 kDa。通过与其他来源的β-木糖苷酶序列进行同源性比对,结果发现,CoXyl B与来源于同属不同种的C. Bescii以及C. Kronotskyensis分别具有86%的相似度,与其他不同支的嗜热来源的β-木糖苷酶则有70%左右的相似度(图 1)。
 |
| 图 1 基于MEGA 7.0构建CoXyl B氨基酸序列进化树 Figure 1 The phylogenetic tree of Co Xyl B with homologous enzymes. Accession number for each enzyme is showed in bracket behind the bacterial name. CoXyl B is indicated with a solid circle. The homology is displayed on the right. The scale bar at the bottom indicates the average number of site substitutions over the indicated distance |
| 图选项 |
2.2 重组CoXyl B的异源表达与纯化 通过对含有重组质粒pET28b-CoXyl B的大肠杆菌进行诱导表达,并经Ni-NTA亲和柱、阴离子交换柱、葡聚糖凝胶层析柱(superdex 200)纯化后,成功表达并纯化出CoXyl B,结果如图 2所示。纯化后的重组酶CoXyl B大小约为55 kDa,与预期的蛋白质分子质量一致。2 L大肠杆菌中共纯化得到5.92 mg CoXyl B蛋白,浓度为1.48 mg/mL。
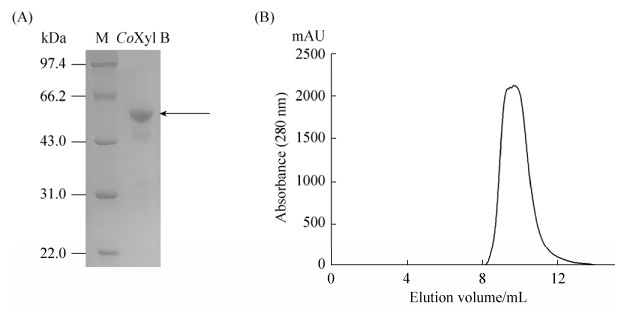 |
| 图 2 CoXyl B重组蛋白纯化 Figure 2 Purification of recombinant CoXyl B. A: SDS-PAGE analysis of CoXyl B; M: protein marker; CoXyl B: purified protein; B: Superdex 200 analysis of CoXyl B |
| 图选项 |
2.3 重组CoXyl B酶学性质分析
2.3.1 温度和pH对酶活的影响: 由图 3-A可知,CoXyl B的酶活随着温度的升高而逐渐增强,90 ℃时酶活达到最高,100 ℃时酶活迅速降低到最高酶活的20%左右。因此,该酶的最适反应温度为90 ℃。由图 3-B可知,温度在40–70 ℃之间时,对酶的稳定性影响较小,孵育2.5 h后CoXyl B残余酶活均能保持在最大酶活的80%以上。即便在80 ℃孵育2 h,CoXyl B残余酶仍能保持最大酶活的60%。该结果表明,CoXyl B是一种极端耐热酶,温度稳定性极佳。
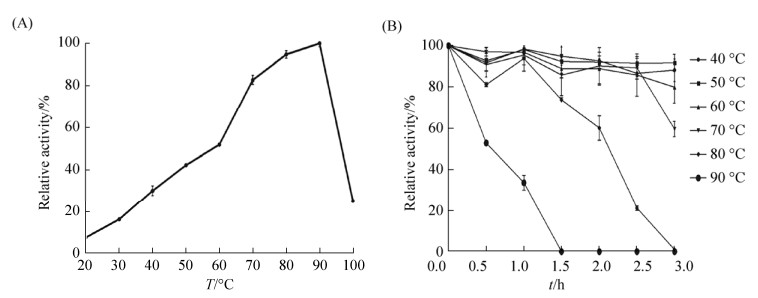 |
| 图 3 温度对CoXyl B相对酶活的影响 Figure 3 Effect of tiperature on the activity of CoXyl B. A: The optimal tiperature of CoXyl B. The activity of CoXyl B at optimal tiperature was considered to be 100%; B: Thermostability of CoXyl B at 40, 50, 60, 70, 80, 90 ℃. The activity without heat treatment was considered to be 100%. X±SD (n=3) |
| 图选项 |
由图 4-A可知,CoXyl B相对酶活在pH 3.0–9.0范围内先升高后降低,在pH为6.0时达到最大值,之后相对酶活逐渐下降,因此,CoXyl B的最适pH值为6.0。在70 ℃条件下,分别采用不同的pH缓冲液孵育CoXyl B 1 h,结果发现,酶在pH 5.0–6.0之间的稳定性较高,相对酶活维持在80%以上。其中,酶在pH为5.0时最稳定(图 4-B)。
 |
| 图 4 pH对CoXyl B相对酶活的影响 Figure 4 Effect of pH on the activity of CoXyl B. A: The optimal pH of CoXyl B. The activity of CoXyl B at optimal pH was considered to be 100%; B: pH stability of CoXyl B. The activity without preincubation was considered to be 100%.X±SD (n=3) |
| 图选项 |
2.3.2 金属离子与化学试剂对CoXyl B的影响: 由表 1可知,金属离子中,Ag+直接使酶失活。高浓度(10 mmol/L)的Mn2+、Zn2+、Sn2+、SDS和PMSF对酶活力均有较强的抑制作用。相反地,高浓度的Mg2+、Li+和EDTA能够显著提高CoXyl B的酶活。其中,EDTA的激活作用最为显著。而高浓度的Fe3+、Ni2+、Fe2+、K+、Pb2+、β-巯基乙醇对酶活的激活作用则较为微弱。此外,1 mmol/L和10 mmol/L的Co2+、Ca2+和Na+对CoXyl B酶活的影响均不显著。
表 1. 不同化学试剂对CoXyl B酶活的影响 Table 1. Effect of chiicals on the activity of CoXyl B
| Chiicals | Relative activity/% | |
| 1 mmol/L | 10 mmol/L | |
| Control | 100.00±0.13 | 100.00±0.15 |
| Co2+ | 88.00±5.75 | 97.00±5.38 |
| Mn2+ | 93.00±.45 | 67.00±5.29 |
| Zn2+ | 93.00±3.31 | 62.00±2.13 |
| Fe3+ | 95.00±3.03 | 115.00±7.93 |
| Ni2+ | 95.00±2.59 | 123.00±7.83 |
| Fe2+ | 96.00±3.56 | 113.00±4.86 |
| K+ | 97.00±3.95 | 114.00±6.86 |
| Ca2+ | 100.00±1.84 | 103.00±3.31 |
| Sn2+ | 106.00±6.70 | 72.00±2.78 |
| Pb2+ | 108.00±2.39 | 125.00±2.02 |
| Mg2+ | 108.00±3.46 | 146.00±5.29 |
| Li+ | 111.00±6.70 | 153.00±0.62 |
| Na+ | 115.00±3.84 | 92.00±6.79 |
| Ag+ | 0±0.09 | 0±0.12 |
| SDS | 91.00±0.60 | 23.00±1.47 |
| PMSF | 93.00±3.94 | 20.00±0.98 |
| EDTA | 97.00±5.34 | 162.00±4.74 |
| β-mercaptoethanol | 113.00±3.77 | 129.00±2.00 |
表选项
2.3.3 CoXyl B动力学参数的测定: 对CoXyl B进行动力学参数的测定,结果如图 5所示。当底物浓度低于7.5 mmol/L时,反应速率随着底物浓度的增加而增加;相反地,底物浓度高于7.5 mmol/L时,反应速率随着底物浓度增加而趋于饱和。采用GraphPad prism软件进行非线性拟合法作图,并计算出CoXyl B的动力学参数分别为:kcat=5.0×10–3s–1,Km=1.9 mmol/L。
 |
| 图 5 CoXyl B反应速率曲线 Figure 5 V curve of CoXyl B |
| 图选项 |
2.3.4 CoXyl B水解产物分析: 以2 mg/mL的木二糖、木三糖和木四糖作为反应底物,在pH 6.0、70 ℃条件下进行水解反应,分别选取0、1、3 h的样品进行薄层层析色谱(TLC)分析。由图 6可知,CoXyl B能够有效降解木二糖、木三糖和木四糖,反应1 h后已经有部分水解产物产生。随着时间的推移,水解产物中木糖的含量逐渐增加。其中,CoXyl B对木三糖和木四糖的降解效率高于木二糖。
 |
| 图 6 CoXyl B降解木二糖、木三糖和木四糖分析 Figure 6 Hydrolysis of xylobiose, xylotriose and xylotetraose by CoXyl B. M: the standard of xylooligosaccharide |
| 图选项 |
3 讨论 嗜热酶在高温条件下具有较高的催化活性,且半衰期长,在食品热加工以及生物降解领域具有较大的应用潜力和广阔的市场前景。相对木聚糖水解酶系中的其他水解酶而言,β-木糖苷酶的研究仍比较薄弱。我国目前关于重组β-木糖苷酶的研究还比较有限,国外的研究则相对较多。研究发现,β-木糖苷酶的最适反应温度范围一般为40–60 ℃,而从一些嗜热细菌和耐热真菌中鉴定到的β-木糖苷酶通常具有较高的热稳定性。目前,已从细菌和真菌等不同来源的嗜热菌中克隆到β-木糖苷酶,这些嗜热菌包括Aureobasidium pullulans、Paecilomyces thermophila、Thermoanaerobacterium saccharolyticum、Geobacillus thermodenitrificans、Geobacillus stearothermophilus、Bacillus stearothermophilus、Thermotoga thermarum等[23-34]。但这些嗜热菌属β-木糖苷酶的最适温度均在60–70 ℃之间。如来自嗜热菌Geobacillus thermodenitrificans TSAA1和Geobacillus thermoleovorans IT-08的2个β-木糖苷酶的最适温度均为60 ℃[26, 31]。而来自于同一菌属的另一个菌种Geobacillus sp. WSUCF1的β-木糖苷酶的最适温度能达到70 ℃[32]。由此看来,来源于同属不同种、甚至同种嗜热菌的β-木糖苷酶的性质仍有可能不同,这暗示了这些嗜热菌仍具有新酶的挖掘潜力。截止目前,仅有少部分β-木糖苷酶具有极强的热稳定性特征,如来源于Thermotoga Maritima (T. Maritima)和C. Bescii的2个β-木糖苷酶的最适温度均可达到90 ℃[8, 20]。本研究发现C. owensensis OL来源的CoXyl B的热稳定性极佳,其最适温度同样高达90 ℃,且在70 ℃条件下保温2.5 h后仍可保持其相对酶活的80%。相比之下,来自C. owensensis OL的另一个木糖苷酶Coxyl A最适温度仅为75 ℃[19]。来源于同属不同种C. saccharolyticus DM8903的重组木糖苷酶XYL39B与本研究中的CoXyl B具有82%的相似度,但XYL39B的最适温度仅为70 ℃[21],推测可能是由于二者的结构有细微差别等因素所致。
金属离子和化学试剂对CoXyl B的酶活有一定影响。与XYL39B较为相似,CoXyl B受到10 mmol/L的金属离子Ag+、Mn2+、Zn2+、Sn2+和化学试剂SDS、PMSF的显著抑制,同时能被10 mmol/L Mg2+、Li+和EDTA所激活[21]。化学试剂对CoXyl B酶活的影响效果与同菌株来源的Coxyl A基本一致,但是金属离子的影响程度则不尽相同,如Coxyl A的酶活几乎不受Mn2+的影响,只受高浓度Fe2+的抑制,推测可能由于两种酶的结构不同所致[19]。因此,CoXyl B在使用的过程中应严格控制这些金属离子和化学试剂的添加。
以pNPX为底物测定酶动力学参数,结果发现,CoXyl B对pNPX的Km值较大,即对pNPX的亲和力比较弱。进一步地,本研究发现CoXyl B对木二糖、木三糖和木四糖均具有明显的降解能力,能将这3种低聚木糖有效地降解为木糖。其中,CoXyl B对木三糖和木四糖的降解效率显著高于木二糖,表明其对长链低聚木糖的降解效果更好。因此,未来可尝试对CoXyl B进行分子改造,有针对性地改善其对底物的特异性和亲和力,以拓展其应用范围。
4 结论 本研究成功地对嗜热菌C. owensensis OL中的木糖苷酶CoXyl B进行了异源表达、纯化及酶学性质分析。研究结果显示,重组CoXyl B的最适温度为90 ℃,在70 ℃孵育3 h后CoXyl B残余酶活仍能保持60%。即便在80 ℃孵育2 h,CoXyl B残余酶仍能保持最大酶活的60%,展示了较好的热稳定性。CoXyl B的最适pH为6.0,在pH 6.0–7.0范围内均具有较高的催化活力,且同时具有降解木二糖、木三糖和木四糖的能力,符合半纤维素的降解需求。综上所述,本文研究的β-木糖苷酶CoXyl B具有在食品热加工、半纤维素降解等领域的应用潜力。
References
| [1] | Zhang L, Ding CH, Ruan WB. Study on application and product development progress of xylo-oligosaccharides. Cereals & Oils, 2015, 28(2): 9-12. (in Chinese) 张玲, 丁长河, 阮文彬. 低聚木糖的应用研究和产品开发进展. 粮食与油脂, 2015, 28(2): 9-12. DOI:10.3969/j.issn.1008-9578.2015.02.003 |
| [2] | Ye SC, Xue T, He WJ, Ye BY, Wei F, Chen YQ. Applications of xylanases and its research progress. China Brewing, 2013, 32(7): 8-10. (in Chinese) 叶世超, 薛婷, 何文锦, 叶冰莹, 魏芳, 陈由强. 木聚糖酶的应用及其研究进展. 中国酿造, 2013, 32(7): 8-10. DOI:10.3969/j.issn.0254-5071.2013.07.003 |
| [3] | Chen HY, Cai J, Lin JG, Wang CG, Du X. Research progress of xylanase. China Brewing, 2016, 35(11): 1-6. (in Chinese) 陈洪洋, 蔡俊, 林建国, 王常高, 杜馨. 木聚糖酶的研究进展. 中国酿造, 2016, 35(11): 1-6. DOI:10.11882/j.issn.0254-5071.2016.11.001 |
| [4] | Gao YJ, Ding CH. Research progress on the application of xylanase in food industry. Cereal & Food Industry, 2017, 24(2): 32-36. (in Chinese) 高雅君, 丁长河. 木聚糖酶在食品工业中的应用研究进展. 粮食与食品工业, 2017, 24(2): 32-36. DOI:10.3969/j.issn.1672-5026.2017.02.008 |
| [5] | Nie H, Li XJ, Li JB. The research development on bioactivity, preparation and application of xylooligosaccharides. Food Research and Development, 2016, 37(14): 210-213. (in Chinese) 聂卉, 李晓静, 李坚斌. 低聚木糖的生物活性、制备及应用研究进展. 食品研究与开发, 2016, 37(14): 210-213. DOI:10.3969/j.issn.1005-6521.2016.14.051 |
| [6] | Jia XJ, Mi SF, Wang JZ, Qiao WB, Peng XW, Han YJ. Insight into glycoside hydrolases for debranched xylan degradation from extremely thermophilic bacterium Caldicellulosiruptor lactoaceticus. PLoS ONE, 2014, 9(9): e106482. DOI:10.1371/journal.pone.0106482 |
| [7] | Goswami GK, Krishnamohan M, Nain V, Aggarwal C, Ramesh B. Cloning and heterologous expression of cellulose free thermostable xylanase from Bacillus brevis. SpringerPlus, 2014, 3(1): 20. DOI:10.1186/2193-1801-3-20 |
| [8] | Su XY, Han YJ, Dodd D, Moon YH, Yoshida S, Mackie RI, Cann IKO. Reconstitution of a thermostable xylan-degrading enzyme mixture from the bacterium Caldicellulosiruptor bescii. Applied and Environmental Microbiology, 2013, 79(5): 1481-1490. DOI:10.1128/AEM.03265-12 |
| [9] | Jia XJ, Qiao WB, Tian WL, Peng XW, Mi SF, Su H, Han YJ. Biochemical characterization of extra-and intracellular endoxylanse from thermophilic bacterium Caldicellulosiruptor kronotskyensis. Scientific Reports, 2016, 6: 21672. DOI:10.1038/srep21672 |
| [10] | Xu JF, Zhang JZ. Research advances in microbial endo-1, 4-β-xylanase. China Brewing, 2014, 33(5): 15-17. (in Chinese) 徐君飞, 张居作. 微生物β-1, 4-内切木聚糖酶研究进展. 中国酿造, 2014, 33(5): 15-17. |
| [11] | Knob A, Terrasan CRF, Carmona EC. β-xylosidases from filamentous fungi:an overview. World Journal of Microbiology and Biotechnology, 2010, 26(3): 389-407. DOI:10.1007/s11274-009-0190-4 |
| [12] | Tsujibo H, Miyamoto K, Kuda T, Minami K, Sakamoto T, Hasegawa T, Inamori Y. Purification, properties, and partial amino acid sequences of thermostable xylanases from Streptomyces thermoviolaceus OPC-520. Applied and Environmental Microbiology, 1992, 58(1): 371-375. |
| [13] | Lorenz WW, Wiegel J. Isolation, analysis, and expression of two genes from Thermoanaerobacterium sp. Strain JW/SL YS485:a β-xylosidase and a novel acetyl xylan esterase with cephalosporin C deacetylase activity. Journal of Bacteriology, 1997, 179(17): 5436-5441. DOI:10.1128/jb.179.17.5436-5441.1997 |
| [14] | Lasrado LD, Gudipati M. Purification and characterization of β-D-xylosidase from Lactobacillus brevis grown on xylo-oligosaccharides. Carbohydrate Polymers, 2013, 92(2): 1978-1983. DOI:10.1016/j.carbpol.2012.11.081 |
| [15] | Espina G, Eley K, Pompidor G, Schneider TR, Crennell SJ, Danson MJ. A novel β-xylosidase structure from Geobacillus thermoglucosidasius:the first crystal structure of a glycoside hydrolase family GH52 enzyme reveals unpredicted similarity to other glycoside hydrolase folds. Acta Crystallographica Section D:Biological Crystallography, 2014, 70(5): 1366-1374. DOI:10.1107/S1399004714002788 |
| [16] | Peng X, Su H, Mi S, Han Y. A multifunctional thermophilic glycoside hydrolase from Caldicellulosiruptor Owensensis with potential applications in production of biofuels and biochemicals. Biotechnology for Biofuels, 2016, 9(1): 98. |
| [17] | Blumer-Schuette SE, Kataeva I, Westpheling J, Adams MW, Kelly RM. Extremely thermophilic microorganisms for biomass conversion:status and prospects. Current Opinion in Biotechnology, 2008, 19(3): 210-217. DOI:10.1016/j.copbio.2008.04.007 |
| [18] | Meng DD, Zhang KD, Ying Y, Chen XH, Li FL. Research progress in lignocellulose degradation by genus Caldicellulosiruptor. Chinese Journal of Bioprocess Engineering, 2014, 12(1): 37-45. (in Chinese) 孟冬冬, 张坤迪, 英瑜, 陈晓华, 李福利. 极端嗜热厌氧菌Caldicellulosiruptor木质纤维素降解研究. 生物加工过程, 2014, 12(1): 37-45. |
| [19] | Mi SF, Jia XJ, Wang JZ, Qiao WB, Peng XW, Han YJ. Biochemical characterization of two thermostable xylanolytic enzymes encoded by a gene cluster of Caldicellulosiruptor owensensis. PLoS ONE, 2014, 9(8): e105264. DOI:10.1371/journal.pone.0105264 |
| [20] | Xue YM, Shao WL. Expression and characterization of a thermostable β-xylosidase from the hyperthermophile, Thermotoga maritima. Biotechnology Letters, 2004, 26(19): 1511-1515. DOI:10.1023/B:BILE.0000044454.70768.81 |
| [21] | Wang YJ, Xia QJ, Zhou P, Zhang Y, Wang F, Li X. Purification and characterization of a thermostable β-xylosidase from Caldicellulosiruptor saccharolyticus. Chemical Industry and Engineering Progress, 2017, 36(3): 1041-1046. (in Chinese) 王月皎, 夏乾竣, 周佩, 张瑜, 王飞, 李迅. 解糖热纤维菌木糖苷酶的分离纯化及其酶学性质. 化工进展, 2017, 36(3): 1041-1046. |
| [22] | Huang CY, Patel BK, Mah RA, Baresi L. Caldicellulosiruptor owensensis sp. nov., an anaerobic, extremely thermophilic, xylanolytic bacterium. International Journal of Systematic Bacteriology, 1998, 48(1): 91-97. DOI:10.1099/00207713-48-1-91 |
| [23] | Zhang SY, Wang HM, Shi PJ, Xu B, Bai YG, Luo HY, Yao B. Cloning, expression, and characterization of a thermostable β-xylosidase from thermoacidophilic Alicyclobacillus sp. A4. Process Biochemistry, 2014, 49(9): 1422-1428. DOI:10.1016/j.procbio.2014.05.020 |
| [24] | Teng C, Jia HY, Yan QJ, Zhou P, Jiang ZQ. High-level expression of extracellular secretion of a β-xylosidase gene from Paecilomycesthermophila in Escherichia coli. Bioresource Technology, 2011, 102(2): 1822-1830. DOI:10.1016/j.biortech.2010.09.055 |
| [25] | Shao WL, Xue YM, Wu AL, Kataeva I, Pei JJ, Wu HW, Wiegel J. Characterization of a novel β-xylosidase, XylC, from Thermoanaerobacterium saccharolyticum JW/SL-YS485. Applied and Environmental Microbiology, 2011, 77(3): 719-726. DOI:10.1128/AEM.01511-10 |
| [26] | Anand A, Kumar V, Satyanarayana T. Characteristics of thermostable endoxylanase and β-xylosidase of the extremely thermophilic bacterium Geobacillus thermodenitrificans tsaa1 and its applicability in generating xylooligosaccharides and xylose from agro-residues. Extremophiles Life under Extreme Conditions, 2013, 17(3): 357-366. DOI:10.1007/s00792-013-0524-x |
| [27] | Bravman T, Mechaly A, Shulami S, Belakhov V, Baasov T, Shoham G, Shoham Y. Glutamic acid 160 is the acid-base catalyst of β-xylosidase from Bacillus stearothermophilus T-6:a family 39 glycoside hydrolase. FEBS Letters, 2001, 495(1/2): 115-119. |
| [28] | Huang ZP, Liu XS, Zhang SW, Liu ZD. GH52 xylosidase from Geobacillus stearothermophilus:characterization and introduction of xylanase activity by site directed mutagenesis of Tyr509. Journal of Industrial Microbiology & Biotechnology, 2014, 41(1): 65-74. |
| [29] | Nanmori T, Watanabe T, Shinke R, Kohno A, Kawamura Y. Purification and properties of thermostable xylanase and β-xylosidase produced by a newly isolated Bacillus stearothermophilus strain. Journal of Bacteriology, 1990, 172(12): 6669-6672. DOI:10.1128/jb.172.12.6669-6672.1990 |
| [30] | Shi H, Li X, Gu HX, Zhang Y, Huang YJ, Wang LL, Wang F. Biochemical properties of a novel thermostable and highly xylose-tolerant β-xylosidase/α-arabinosidase from Thermotoga thermarum. Biotechnology for Biofuels, 2013, 6(1): 27. |
| [31] | Ratnadewi AAI, Fanani M, Kurniasih SD, Sakka M, Wasito EB, Sakka K, Nurachman Z, Puspaningsih NNT. β-D-xylosidase from Geobacillus thermoleovorans IT-08:biochemical characterization and bioinformatics of the enzyme. Applied Biochemistry and Biotechnology, 2013, 170(8): 1950-1964. DOI:10.1007/s12010-013-0329-5 |
| [32] | Bhalla A, Bischoff KM, Sani RK. Highly thermostable GH39β-xylosidase from a Geobacillus sp. strain WSUCF1. BMC Biotechnology, 2014, 14(1): 963. DOI:10.1186/s12896-014-0106-8 |
| [33] | Bankeeree W, Akada R, Lotrakul P, Punnapayak H, Prasongsuk S. Enzymatic hydrolysis of black liquor xylan by a novel xylose-tolerant, thermostable β-xylosidase from a tropical strain of Aureobasidium pullulans CBS 135684. Applied Biochemistry and Biotechnology, 2018, 184(3): 919-934. DOI:10.1007/s12010-017-2598-x |
| [34] | Fan YY, Li XT, Teng C. Research progress on β-xylosidases from microorganism. Food Research and Development, 2013, 34(12): 116-121. (in Chinese) 范园园, 李秀婷, 滕超. 微生物产β-木糖苷酶的研究进展. 食品研究与开发, 2013, 34(12): 116-121. DOI:10.3969/j.issn.1005-6521.2013.12.033 |
