周洪1, 张勤1, 何聿2, 杨黄浩1,2, 田永奇1


1.福州大学生命科学与工程学院, 福建 福州 350116;
2.福州大学化学学院, 国家食品安全与生物分析科学实验室, 国家能源与环境光催化重点实验室, 福建 福州 350116
收稿日期:2018-04-04;修回日期:2018-07-08;网络出版日期:2018-07-19
基金项目:福州大学科研启动基金(XRC-1672,2017T022);福州市科技局项目(2017-N-39);福建省教育厅项目(JAT170077);中科院热带海洋生物资源和生态学重点实验室开放课题(2018011009);广东省海洋药物重点实验室(LMM2018-3)
*通信作者:田永奇, Tel:+86-591-22866375;E-mail:tian.yongqi@163.com
摘要:[目的] 对一株来源于深海热液口嗜热芽孢杆菌的次生代谢产物进行抑菌活性和抗肿瘤活性的初步研究。[方法] 采用纸片法和微量肉汤稀释法检测嗜热芽孢杆菌SY27F次生代谢产物的抑菌活性,采用CCK-8法测定其次生代谢产物的抗肿瘤活性。[结果] 抑菌实验表明,嗜热芽孢杆菌代谢产物对大肠杆菌、金黄色葡萄球菌均有抑菌作用,其最低抑菌浓度分别为1.56 mg/mL和3.13 mg/mL;细胞实验表明,其代谢产物对肿瘤细胞A549、HepG2、HeLa、MCF-7均有一定的抑制作用,其半致死浓度分别为0.390、0.451、0.704、1.105 mg/mL;与人肝肿瘤细胞(HepG2)相比,其对人正常肝细胞(L02)表现出良好的生物相容性。[结论] 嗜热芽孢杆菌SY27F次生代谢产物具有一定的抑菌和抗肿瘤活性,可为寻找新型抑菌抗肿瘤活性物质提供优质资源。
关键词:深海热液口嗜热芽孢杆菌代谢产物抑菌活性抗肿瘤活性
Evaluating bioactivity of metabolites of a hydrothermal Bacillus sp. SY27F from the deep-sea hydrothermal vent
Hong Zhou1, Qin Zhang1, Yu He2, Huanghao Yang1,2, Yongqi Tian1


1.College of Biological Science and Engineering, Fuzhou University, Fuzhou 350116, Fujian Province, China;
2.MOE Key Laboratory for Analytical Science of Food Safety and Biology, State Key Laboratory of Photocatalysis on Energy and Environment, College of Chemistry, Fuzhou University, Fuzhou 350116, Fujian Province, China
Received 4 April 2018; Revised 8 July 2018; Published online 19 July 2018
*Corresponding author: Yongqi Tian, Tel: +86-591-22866375; E-mail: tian.yongqi@163.com
Supported by the the Foundation for Scholars of Fuzhou University (XRC-1672, 2017T022), by the Scientific and Technological Project of Fuzhou City of Fujian Province (2017-N-39), by the Natural Science Foundation of Fujian Provincial Department of Education (JAT170077), by the Open Projects of CAS Key Laboratory of Tropical Marine Bioresources and Ecology (2018011009) and by the Guangdong Key Laboratory of Marine Materia Medica (LMM2018-3)
Abstract: [Objective] Extracting the metabolites of hydrothermal Bacillus sp. SY27F from deep-sea hydrothermal vents, the antibacterial and antitumor activity of metabolites were assayed. [Methods] The antibacterial activity of the secondary metabolites was determined by the method of paper disk and microbroth dilution method, and the anti-tumor activity of the secondary metabolites was evaluated by CCK-8 method. [Results] The bacteriostatic experiments showed that the metabolites of thermophilic Bacillus sp. SY27F have antibacterial effect on Escherichia coli and Staphylococcus aureus, with MICs of 1.56 mg/mL and 3.13 mg/mL, respectively. Cell cytotoxicity assay showed that the metabolites have the effect of inhibiting cell growth in tumor cells (A549, HepG2, HeLa and MCF-7), with IC50 values of 0.390 mg/mL, 0.451 mg/mL, 0.704 mg/mL and 1.105 mg/mL, respectively. Compared with HepG2, the normal liver cells (L02) showed good biocompatibility. [Conclusion] The metabolites of thermophilic Bacillus sp. SY27F have antibacterial and antitumor activity, and can provide resources for the search of novel compound of antibacterial and antitumor activity.
Keywords: deep-sea hydrothermal ventthermophilic Bacillusmetabolitesantibacterial activityantitumor activity
深海热液口是海洋生境中十分重要的组成部分,具有缺氧、高温、高压、无光照、低营养、高盐度等特点[1]。自1979年科学家首次在加纳帕格斯群岛附近的海域中发现海底热液口后,便引起整个科学界对热液系统的高度重视[2]。在这种独特的生境下,许多特殊生物群落被孕育出来[3]。近40年的研究中,大量生物群落被发现,从中分离和鉴定出许多新物种,绝大多数是各类微生物。为了适应这种极端环境,热液口微生物已经形成了一套独特的防御机制和代谢途径,往往能够产生结构新颖且活性显著的化合物[4-8]。
芽孢杆菌广泛存在于海洋生境中,能够适应多种不利环境,如高温、高压、高盐等[9]。近些年,从海洋来源芽孢杆菌的次生代谢产物分离出多种结构类型物质,包括脂肽、多肽、脂肪酸、乳糖聚合物、聚酮化合物、异香豆素类[10-15],这些结构多样的化合物具有抑菌、抗癌、抗藻等诸多生物活性[10-15]。此外,芽孢杆菌基因组序列研究也表明约8%的基因组用于合成抗生素[16-17]。本研究以一株深海热液口来源的嗜热芽孢杆菌进行扩大培养,并研究其乙酸乙酯提取物的抑菌和抗肿瘤活性,以期获得具有活性的代谢产物,为进一步开发该菌株活性代谢产物提供前期研究基础。
1 材料和方法 1.1 材料
1.1.1 菌株来源: 一株深海热液口来源的嗜热芽孢杆菌;采样区域:印度洋深海热液区;采样坐标:E 70°02′25.47″,S 25°19′13.66″;样品性质:沉积物;采样深度:2430 m;样品描述:玄武岩和黑烟囱的混合样,外观呈红色、表面湿润。
1.1.2 培养基: (1) LB培养基(g/L):Tryptone 10.0,Yeast Extract 5.0,NaCl 10.0,pH 7.0;(2) 2216E培养基(g/L):Yeast Extract 1.0,Tryptone 5.0,FePO4 0.01,ASW (人工海水) 1.0 L,pH 7.6;(3) ASW (人工海水g/L):NaCl 20.0,MgCl2·6H2O 3.0,MgSO4·6H2O 6.0,(NH4)2SO4 1.0,NaHCO3 0.2,CaCl2·2H2O 0.3,KCl 0.5,KH2CO3 0.42,NaBr 0.05,SrCL2·6H2O 0.02,C6H10FeNO8 0.01;固体培养基添加15.0-20.0 g/L琼脂。
1.1.3 指示菌株: 革兰氏阳性菌:金黄色葡萄球菌(Staphylococcus aureus ATCC 25923);革兰氏阴性菌:大肠杆菌(Escherichia coli ATCC 25922);真菌:白色念珠菌(Monilia albican ATCC 753)。以上菌株均为实验室保藏菌种。
1.1.4 指示细胞株: 人宫颈癌细胞(HeLa)、人非小细胞肺癌细胞(A549)和人乳腺癌细胞(MCF-7)购于上海齐氏生物公司,人肝癌细胞(HepG2)和人肝细胞(L02)购于南京科佰生物科技有限公司。
1.1.5 主要试剂和仪器: 甲醇、乙酸乙酯均购自德国Merk公司,Penicillin-Streptomycin Solution、Phosphate Bufferde SaLine(1X).0067M(PO4)、RI Medium Modified均购自HyCLone,PlasmocinTM treatment购自InvivoGen,Cell Counting Kit-8购自日本株式会社同仁化学研究所,PANsera ES购自PAN-Biotech,DMSO购自美国Sigma公司,96孔细胞培养板、荧光共聚焦培养皿、微孔滤膜(孔径0.22 μm)购自无锡耐思生物科技有限公司,Hoechst 33342购自北京索莱宝科技有限公司,Lyso-TrackerTM Red DND-99购自Thermo公司,其他试剂均为国产分析纯试剂。
循环水式真空泵SHB-Ⅲ、磁力搅拌器HJ-4,巩义市予华仪器有限责任公司;高速冷冻离心机KDC-160HR,安徽中科中佳科学仪器有限公司;立式压力蒸汽灭菌器YXQ-LS-50A,上海博讯实业有限公司;恒温摇床TS-2102C,上海天呈实验仪器制造有限公司;旋转蒸发仪RV10,广州仪科实验室技术有限公司(德国IKA);紫外/可见全波长酶标仪SH-1000,天美(中国)科学仪器有限公司;Milli-Q超纯水系统系列Milli-Q Advantage A10系统,德国Merk公司;数控超声波清洗器KQ5200DE,昆山市超声仪器有限公司;电导率仪S230,梅特勒-托利多国际贸易有限公司;生物安全柜MSC-Advantage、液氮罐Locator PLUS系列、CO2培养箱HERAcell?150i,美国Thermo公司;透射电子显微镜HT7700,日历高新技术公司;激光共聚焦显微镜A1,株式会社尼康。
1.2 菌种的初活化、活化、再活化及保藏 从-80 ℃超低温保存箱中将30%甘油冻存的SY27F菌快速取出,于37 ℃恒温水浴锅中解冻,完全解冻后,将SY27F菌置于50 ℃恒温摇床30 min,进行初活化;用接种环接种半环初活化菌液,划线到2216E固体培养基上,倒置于50 ℃静止的恒温摇床中,培养12-18 h,进行活化,直至有长势良好的单个菌落长出;用接种环挑取单个菌落于装有50 mL已灭菌的2216E液体培养基的锥形瓶(容积100 mL)中,置于50 ℃恒温摇床中,180 r/min振荡培养12-18 h,进行再活化;吸取200 μL再活化菌液到冻存管中,再加入200 μL 30%甘油,振荡均匀,放置于-20 ℃冰箱24 h后,再转移到-80 ℃冰箱中保藏。
1.3 种子液的制备和扩培发酵 用接种环挑取培养基表面单个菌落,接种到装有50 mL 2216E液体培养基的250 mL锥形瓶中,转速180 r/min,50 ℃恒温培养12-18 h,用作种子液。按照10%体积比接种种子液到盛有250 mL液体培养基的500 mL锥形瓶中,置于50 ℃、180 r/min的恒温摇床中培养120 h。分批次发酵,每次发酵4-8 L,共需培养发酵60 L。
1.4 代谢产物的提取 取发酵液离心(10000 r/min、15 min),得上清液和菌体沉淀;收集合并上清液,将上清液用0.22 μm滤膜减压抽滤除去菌体,再将其旋转蒸发浓缩为原体积的1/4,得浓缩液甲;将菌体用1.5倍甲醇溶液浸泡,超声搅拌约6 h后取出,使菌体充分破碎,然后再将浸泡液高速离心(10000 r/min,15 min),取上清甲醇溶液减压浓缩至干,加入少量二次水溶解得浓缩液乙;将浓缩液甲和浓缩液乙合并,加入2倍体积乙酸乙酯,用磁力搅拌器搅拌萃取3-5次,直至乙酸乙酯层无色停止萃取;收集乙酸乙酯层,将其旋转蒸干,得到乙酸乙酯层提取物(以下简称粗提物),并称其质量。
1.5 粗提物抑菌效果
1.5.1 粗提物抑菌效果检测: 采用纸片扩散法[18]检测粗提物对大肠杆菌、金黄色葡萄球菌、白色念珠菌的抑菌效果。简述之,取少量指示菌保存液划线LB平板,挑取单个菌落到LB肉汤中,置摇床(37 ℃,180 r/min)中培养12-18 h左右;利用酶标仪测定OD值,用LB肉汤调整菌液浓度使其OD600值为0.08-0.10,此时菌液浓度约108 CFU/mL;取200 μL稀释菌液到LB固体培养基上,用涂布棒涂布均匀;待平板上的水分被琼脂完全吸收,取无菌滤纸片,滴加5 μL 50 mg/mL被甲醇溶解粗提物,待纸片风干后将其贴在平板表面;置于恒温培养箱中37 ℃培养24 h (大肠杆菌、金黄色葡萄球菌)或48 h (白色念珠菌),测量抑菌圈直径,实验重复3次,计算平均值。
1.5.2 粗提物最低抑菌浓度测定: 采用微量肉汤稀释法[19]检测粗提物最低抑菌浓度。简述之,将OD600值落在0.08-0.10的LB稀释菌液用MH肉汤再度稀释1000倍,此时菌液浓度约105 CFU/mL,此时的菌液即上样菌悬液;取粗提物甲醇液加入到无菌MH肉汤中(稀释到粗提物浓度为100 mg/mL,甲醇占2%)作为样品母液,并将其过滤0.22 μm滤膜除菌;取在无菌96孔板前7排的第1-12列加灭菌MH肉汤100 μL;在96孔板第1列前三孔样品母液100 μL,第1列第4、5、6孔加甲醇占2%的MH肉汤100 μL,无菌逐次倍比稀释至第12列(每孔液体终体积是100 μL);在96孔板的前3排每排分别加入大肠杆菌上样菌悬液、金黄色葡萄球菌上样菌悬液和白色念珠菌上样菌悬液100 μL,第4、5、6排重复前面操作,第7排加100 μL无菌MH肉汤,每孔最终体积是200 μL;药物和菌液上样完毕后,盖好盖板,置37 ℃恒温箱中培养18-22 h,用酶标仪测定OD600值,观察结果。
1.5.3 粗提物对细菌形态影响: 从96孔板找到最低抑菌浓度的对应孔,取出其中的菌液到离心管中,3000 r/min离心5 min,弃去上清液;加入等量2.5%戊二醛固定液,振荡均匀后,3000 r/min离心5 min,弃去上清液;之后加入等量无菌水,清洗5次,操作与前面相同,最后使菌体均匀分散在无菌水中;取5 μL菌液滴加到铜网正面,置于室温下过夜风干,透射电镜观察拍片。
1.5.4 胞外物质紫外吸收的测定: 将粗提物分别加入大肠杆菌和金黄色葡萄球菌过夜培养物中至终浓度为2 mg/mL,37 ℃、80 r/min振荡孵育,分别于0、1、2、3、4、5、6 h各取200 μL菌液,于4 ℃、8000×g离心10 min,取100 μL上清液,用酶标仪测定260 nm处吸光值,实验以未被粗提物处理的菌体细胞作为对照。
1.6 菌液电导率的测定 取少量金黄色葡萄球菌过夜培养至稳定期,加入粗提物使其终含量为3.13 mg/mL,置于37 ℃、80 r/min摇床振荡孵育。实验以未加粗提物的菌液为对照,以仅加粗提物的培养液为空白,参考Lee等[20]的方法,分别于0、1、2、3、4、5、6 h分别取样测定培养液的电导率,确定粗提物对金黄色葡萄球菌细胞膜渗透性的影响。
1.7 粗提物抗肿瘤活性
1.7.1 细胞的复苏、传代和冻存: 从液氮中取出冻存管,在37 ℃的水浴锅中解冻,之后离心(1000 r/min,3 min),去除冻存液;加入培养液到冻存管中,将细胞吹打均匀后,转入到装有培养液的培养瓶中;待细胞贴壁长至70%-80%,倒掉原培养液,用PBS缓冲液清洗2次,清洗过后加入1 mL胰酶消化液消化细胞至细胞变圆,弃去胰酶;加入适量培养液终止消化,再将壁上的细胞吹洗下来并吹散,此为细胞原液,吸弃瓶中细胞悬液的3/4,只留1/4,再加培养液十字摇匀,使细胞均匀分散。在培养瓶上作好标记,置于培养箱中培养。消化后吹打得到的细胞原液转移至1.5 mL EP管中,1000 r/min离心3 min,吸弃培养液,加入1 mL冻存液,吹打均匀后转移到冻存管中,先于4 ℃放置10 min,再于-20 ℃放置20 min,最后尽快放置于-80 ℃或液氮中。
1.7.2 粗提物抗肿瘤活性测定: 将粗提物溶解在DMSO中,过滤0.22 μm无菌滤膜,再将其加入到细胞培养液中,振荡摇匀,制成8.0 mg/mL母液(DMSO占母液体积2%),并用培养液稀释母液至6.0、4.0、2.0、1.0、0.5 mg/mL;稀释细胞原液,将其接种到96孔板中,每孔接种100 μL,放置于37 ℃ CO2培养箱中,培养24 h (以细胞长至每孔80%左右);取出其中细胞培养液,用PBS清洗2次,再将制备好各浓度样品培养液加入其中,留下两空分别做2% DMSO培养液对照,放置于37 ℃ CO2培养箱中,培养24 h,每种细胞做3组重复实验;再次取出其中样品培养液,用PBS清洗2次,每孔加入100 μL 10% CCK-8细胞培养液(10 μL CCK-8+90 μL新鲜培养液/每孔),另加两空白孔测板的吸收,放置于37 ℃ CO2培养箱中反应0.5-1.0 h后,用酶标仪测定OD450值,若空白值为1-2,则反应时间充分,若不在则放置于培养箱中继续反应。
1.7.3 粗提物对细胞形态影响: 将细胞原液稀释10倍,取0.5 mL悬空缓慢滴入荧光皿中央,放置于37 ℃ CO2培养箱中培养;24 h后,吸去细胞培养液,用PBS清洗2次后,实验组再加入0.5 mL样品培养液(培养液+DMSO+粗提物,浓度为2 mg/mL,DMSO占细胞培养液体积2%,称作DMSO@ Crude Extract,简称DMSO@ CE),对照组加入0.5 mL细胞培养液(培养液+DMSO,DMSO占细胞培养液体积2%,称作DMSO),置于37 ℃ CO2培养箱中培养;24 h后,吸去细胞培养液,用PBS清洗2次后,加入细胞培养液,置于激光扫描共聚焦显微镜下观察并拍照。将实验组和对照组分别加入核染料Hoechst 33342 (10 mg/mL),染色15 min后于共聚焦显微镜下观察;再分别加入溶酶体染料Lyso-TrackerTM Red DND-99 (1 mmol/mL),染色30 min后于共聚焦显微镜下观察。
2 结果和分析 2.1 粗提物抑菌效果及其最低抑菌浓度的测定 通过纸片法初步检测粗提物抑菌效果,由表 1可知,粗提物对大肠杆菌的抑菌圈直径达12.9±0.7 mm,对金黄色葡萄球菌的抑菌直径达10.3±0.3 mm,对白色念珠菌的抑菌直径为滤纸片直径。由此表明,粗提物对大肠杆菌和金黄色葡萄球菌均有抑菌作用,且对大肠杆菌的抑菌效果强于金黄色葡萄球菌,但对白色念珠菌没有抑制作用。通过微量肉汤稀释法测定粗提物最低抑菌浓度,结果显示粗提物对大肠杆菌的最低抑菌浓度为1.56±0.10 mg/mL,对金黄色葡萄球菌的最低抑菌浓度为3.13±0.06 mg/mL,对白色念珠菌的最低抑菌浓度大于50.00 mg/mL,即比最大测试浓度要高。粗提物对3种菌的最低抑菌浓度也佐证了抑菌活性的结果,增加实验的可信性,有助于评估粗提物的活性。
表 1. 粗提物抑菌活性检测及最低抑菌浓度 Table 1. The antibacterial activity and minimum inhibitory concentration of crude extract.
| Strains | Zone of inhibition/mm | MIC/(mg/mL) |
| Escherichia coli ATCC 25922 | 12.9±0.7 | 1.56±0.10 |
| Staphylococcus aureus ATCC 25923 | 10.3±0.3 | 3.13±0.06 |
| Monilia albican ATCC 753 | 6.0 | >50.00 |
表选项
2.2 粗提物抗菌机理的研究 在明确粗提物具有抗菌活性的基础上,我们进一步通过透射电镜来探究粗提物对大肠杆菌和金黄色葡萄球菌的抑菌途径,期望初步阐明其抗菌作用机制。透射电镜观察显示,未经粗提物处理的大肠杆菌呈杆状,大小为0.5-1.5 μm,细胞完整,表面光滑(图 1-A,1-B),在1.56±0.10 mg/mL粗提物处理下,大肠杆菌在形状上发生明显变化,由原来的短杆状变成球状,但其细胞完整性和表面光滑度无明显变化(图 1-C,1-D);未经粗提物处理的金黄色葡萄球菌呈球状,直径在0.8 μm左右,排列成葡萄串状,细胞完整,表面光滑(图 2-A,2-B),经3.13±0.06 mg/mL粗提物处理下,金黄色葡萄球菌在形态上发生巨大变化,体积膨胀,直径在1.1 μm左右,细胞膜表面粗糙,且厚度不一。结果表明,粗提物对大肠杆菌和金黄色葡萄球菌均有抑制作用,对大肠杆菌抑菌方式尚不明确,对金黄色葡萄球菌的抑菌方式有可能是破坏细胞膜致使胞内物质外泄,从而抑制细菌繁殖[21]。
 |
| 图 1 大肠杆菌及其被粗提物处理后TEM图 Figure 1 TEM image of morphological changes of E. coli treated by crude extract. The strains of E. coli were seeded in 96-well plates and then incubated with 200 μL of varying concentrations of crude extract for 24 h. The strains of E. coli were obtained from 96-well plates with concentration of crude extract of 0 mg/mL (A, B) and 1.56 mg/mL (C, D) and were treated with 2.5% glutaraldehyde. |
| 图选项 |
 |
| 图 2 金黄色葡萄球菌及其被粗提物处理后TEM图 Figure 2 TEM image of morphological changes of S. aureus treated by crude extract. The strains of S. aureus were seeded in 96-well plates and then incubated with 200 μL of varying concentrations of crude extract for 24 h. The strains of S. aureus were obtained from 96-well plates with concentration of crude extract of 0 mg/mL (A) and 3.13 mg/mL (B), and were treated with 2.5% glutaraldehyde. |
| 图选项 |
细菌细胞膜损伤时,胞内物质会渗透到胞外,首先K+和PO43-等电解质小分子渗透至胞外,随后核酸等大分子物质和其他物质向外渗透[22]。由于核酸在260 nm波长有强的紫外吸收,因此OD260值可用作评价细胞膜完整性的指标[23]。由图 3显示,经粗提物处理后,大肠杆菌胞外物质紫外吸收无明显变化,而金黄色葡萄球菌胞外物质紫外吸收随时间的延长明显上升,4 h时胞外物质紫外吸收达到0.49,之后缓慢上升并逐渐趋于平稳。这说明粗提物改变了金黄色葡萄球菌细胞膜的通透性,使核酸类物质大量外渗,且随时间的增长,其渗漏更加明显。此外,电解质渗透到胞外培养液中会导致培养液电导率上升,因此也可用菌液电导率的变化来反映细菌细胞膜渗透性的改变[24]。图 4是粗提物对金黄色葡萄球菌培养液电导率的影响曲线。从图 4可以看出,向培养液中加入粗提物培养2 h后,培养基的电导率明显增加,4 h后缓慢上升并逐渐趋于平稳,说明菌体细胞内有电解质渗漏。由此也表明,粗提物对金黄色葡萄球菌细胞膜的通透性造成一定的影响,从而抑制其生长繁殖。培养基的电导率变化趋势与胞外物质紫外吸收的变化在时间上是一致的,进一步印证了此结果。
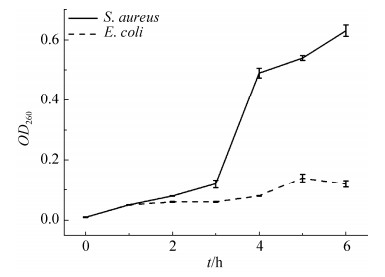 |
| 图 3 粗提物处理后胞外物质紫外吸收 Figure 3 The spectra of UV absorption of extracellular material of bacteria treated by crude extract. |
| 图选项 |
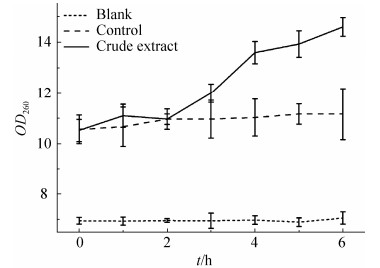 |
| 图 4 粗提物对金黄色葡萄球菌培养液电导率的影响 Figure 4 Effects of the crude extract on the conductivity of S. aureus. |
| 图选项 |
2.3 粗提物抗肿瘤活性的测定 采用CCK-8法[25]测定粗提物对肿瘤细胞的抑制活性,结果表明,粗提物具有抗肿瘤活性,能抑制肿瘤细胞(A549、HepG2、HeLa、MCF-7)生长,且对HeLa、MCF-7抑制程度较强,HepG2次之,A549最弱;与人肝肿瘤细胞株(HepG2)相比,粗提物对人正常肝细胞(L02)表现出较低细胞毒性(表 2)。此外,通过激光共聚焦显微镜对比肿瘤细胞形态和经粗提物作用后的肿瘤细胞形态,从肿瘤细胞的表观上证明粗提物的抗肿瘤活性。我们发现,经粗提物培养后,肿瘤细胞数量减少、体积变小变圆,细胞分散不相连(图 5),由此表明肿瘤细胞经粗提物培养后形态和数量均发生显著变化,即粗提物对肿瘤细胞有抑制作用。
表 2. 粗提物抗肿瘤活性 Table 2. The antitumor activity of crude extract
| Cell | IC50/(mg/mL) |
| HeLa | 0.390±0.015 |
| MCF-7 | 0.451±0.011 |
| HepG2 | 0.704±0.023 |
| A549 | 1.105±0.039 |
| L02 | 3.111±0.107 |
表选项
 |
| 图 5 粗提物作用前后的肿瘤细胞形态 Figure 5 The morphology of tumor cells (A549, HeLa, HepG2 and MCF-7) after incubated with DMSO and DMSO@CE. DMSO@CE: DMSO@ Crude Extract. |
| 图选项 |
2.4 粗提物抗肿瘤机理 为了探究粗提物对肿瘤细胞的作用机制,以肿瘤细胞正常形态为对照,在激光共聚焦显微镜下观察经粗提物作用后的肿瘤细胞形态,以MCF-7为例。由图 6可知,经粗提物作用后,MCF-7细胞由原来的梭形或者有张开的“爪牙”变成了球形,细胞的体积也明显缩小;且MCF-7细胞(非人为染色)在不同波长激光照射下呈现出蓝色、绿色和红色荧光(图 6-Alexa 405/FITC/Alx 546),因此可以通过荧光大致判断粗提物所处位置。对经粗提物作用后的肿瘤细胞MCF-7(图 7-E)进行核定位染色(图 7-D),可以清楚地看到粗提物进入细胞后主要集中于细胞质区域(图 7-F)而未进入细胞核区域。对核染色肿瘤细胞MCF-7 (图 7-G)细胞质中的溶酶体定位染色(图 7-H),由图 7-E和图 7-H箭头处对比,红色荧光更亮,表明粗提物富集在溶酶体中,有可能通过溶酶体途径诱导肿瘤细胞凋亡[26]。
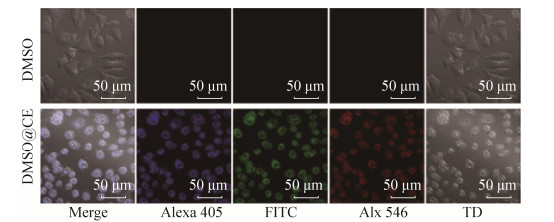 |
| 图 6 粗提物作用前后肿瘤细胞MCF-7的荧光共聚焦图 Figure 6 Confocal fluorescence microscope images of MCF-7 after incubated with DMSO and DMSO@CE. |
| 图选项 |
 |
| 图 7 肿瘤细胞MCF-7染色后的荧光共聚焦图 Figure 7 Confocal fluorescence microscope images of staining MCF-7 after incubated with DMSO and DMSO@CE. (A, D, C) The nucleus of cells was stained with Hoechst 33342 (blue). (B, H) The lysosomes were loaded with Lyso-TrackerTM Red DND-99 (red). (E) MCF-7 cells were cultured with DMSO@CE (red). |
| 图选项 |
3 结论和讨论 深海热液口是世界上最极端和动态的环境之一,然而在其周围却存在大量生物群落。与陆生生物和浅水热带环境生物相比,这些生物群落必定有不同的代谢途径和防御机制,是发现具有生物活性的天然产物的重要资源。有数据显示[27],研究者已从热液口真菌、细菌和古生菌的代谢产物中分离出具有多种生物活性的天然产物。目前,对深海热液口芽孢杆菌的研究还比较少。本研究以深海热液口发现的一株嗜热芽孢杆菌SY27F为研究对象,研究其粗提物的抑菌和抗肿瘤活性及机制。该粗提物对大肠杆菌和金黄色葡萄球菌有抑菌活性,且对大肠杆菌抑菌效果较好,但对白色念珠菌无抑菌活性。此外,该粗提物还对4种肿瘤细胞(A549、HepG2、HeLa、MCF-7)具有一定的抑制作用,但对人正常肝细胞表现出较低毒性。本研究还通过TEM图、LSCM图、荧光共定位等多种手段对粗提物抑菌和抗肿瘤机理进行了探索,来进一步验证其活性。经粗提物处理后的大肠杆菌由短杆状变成球状,我们推断是维持细胞形状的骨架被破坏,导致最初的形态发生改变。有研究报道,原核生物中的类肌动蛋白(如MreB)参与细胞形状的维持,所有非球状的细菌拥有表达类肌动蛋白的基因,如大肠杆菌存在MreB基因,当大肠杆菌MreB蛋白存在缺陷时,该细菌就从杆状变成球状[28]。粗提物处理后的金黄色葡萄球菌的细胞膜表面粗糙、厚度不一,且胞外物质紫外吸收和培养液电导率明显增加,推测可能是通过膜结构损伤来达到抑菌效果,李婷婷等[29]有类似的结果。有意思的是,粗提物处理后的肿瘤细胞在激光共聚焦显微镜下显示出荧光,能清楚地观察到细胞的形态和内部状态:肿瘤细胞体积减小、形状变为球状、细胞质区域有明显荧光。对细胞核和溶酶体共定位染色后,确定粗提物进入细胞主要分布在细胞质区域并富集在溶酶体中,我们推断有可能通过溶酶体途径诱导肿瘤细胞凋亡。有研究显示,具有疏水结构的药物易在溶酶体内富集,并扰乱溶酶体膜上蛋白的正常功能,使得脂质和某些磷脂在溶酶体内聚集,导致溶酶体的脂质环境紊乱,最终使得细胞凋亡[30-31]。
综上,本实验以深海热液口嗜热芽孢杆菌为研究对象,采用纸片法、微量肉汤稀释法、CCK-8法等研究其粗提物的活性。我们发现嗜热芽孢杆菌SY27F的粗提物具有抑菌和抗肿瘤的活性;并通过观察TEM图和CLSM图,初步分析了粗提物的抑菌和抗肿瘤的机理,为我们进一步开发该菌株奠定了坚实的基础。
References
| [1] | Lutz RA, Bell EM. Deep-sea hydrothermal vents. Life at Extremes Environments Organisms & Strategies for Survival, 2012, 73(1): 80-90. |
| [2] | Sobolevskaya MP, Kuznetsova TA. Biologically active metabolites of marine actinobacteria. Russian Journal of Bioorganic Chemistry, 2010, 36(5): 560-573. DOI:10.1134/S1068162010050031 |
| [3] | Chen C, Watanabe HK, Araya JF. First columbellid species (Gastropoda:Buccinoidea) from deep-sea hydrothermal vents, discovered in Okinawa Trough, Japan. Zootaxa, 2017, 4363(4): 592-596. DOI:10.11646/zootaxa.4363.4 |
| [4] | Kelecom A. Secondary metabolites from marine microorganisms. Anais da Academia Brasileira de Ciências, 2002, 74(1): 151-170. DOI:10.1590/S0001-37652002000100012 |
| [5] | Eldehna WM, El-Naggar DH, Hamed AR, Ibrahim HS, Ghabbour HA, Abdel-Aziz HA. One-pot three-component synthesis of novel spirooxindoles with potential cytotoxic activity against triple-negative breast cancer MDA-MB-231 cells. Journal of Enzyme Inhibition and Medicinal Chemistry, 2018, 33(1): 309-318. DOI:10.1080/14756366.2017.1417276 |
| [6] | Liu WZ, Gu QQ, Zhu WM, Cui CB, Fan GT, Zhu TJ, Liu HB, Fang YC. Penicillones A and B, two novel polyketides with tricyclo [5.3.1.03, 8] undecane skeleton, from a marine-derived fungus Penicillium terrestre. Tetrahedron Letters, 2005, 46(30): 4993-4996. DOI:10.1016/j.tetlet.2005.05.087 |
| [7] | Liu R, Cui CB, Duan L, Gu QQ, Zhu WM. Potent in vitro anticancer activity of metacycloprodigiosin and undecylprodigiosin from a sponge-derived actinomycete Sac-charopolyspora sp. nov. Archives of Pharmacal Research, 2005, 28(12): 1341-1344. DOI:10.1007/BF02977899 |
| [8] | Dahms HU, Dobretsov S. Antifouling compounds from marine macroalgae. Marine Drugs, 2017, 15(9): 265. DOI:10.3390/md15090265 |
| [9] | Rampelotto PH. Resistance of microorganisms to extreme environmental conditions and its contribution to astrobiology. Sustainability, 2010, 2(6): 1602-1623. DOI:10.3390/su2061602 |
| [10] | Xing XY, Zhao XY, Ding J, Liu DM, Qi GF. Enteric-coated insulin microparticles delivered by lipopeptides of iturin and surfactin. Drug Delivery, 2018, 25(1): 23-34. DOI:10.1080/10717544.2017.1413443 |
| [11] | Li DH, Carr G, Zhang YH, Williams DE, Amlani A, Bottriell H, Mui ALF, Andersen RJ. Turnagainolides A and B, cyclic depsipeptides produced in culture by a Bacillus sp.:isolation, structure elucidation, and synthesis. Journal of Natural Products, 2011, 74(5): 1093-1099. DOI:10.1021/np200033y |
| [12] | Carballeira NM, Miranda C, Lozano CM, Nechev JT, Ivanova A, Stefanov K, Ilieva M, Tzvetkova I. Characterization of novel methyl-branched chain fatty acids from a halophilic Bacillus species. Journal of Natural Products, 2001, 64(2): 256-259. DOI:10.1021/np000494d |
| [13] | Idris EES, Bochow H, Ross H, Borriss R. Use of Bacillus subtilis as biocontrol agent. Ⅵ. Phytohormone-like action of culture filtrates prepared from plant growth-promoting Bacillus amyloliquefaciens FZB24, FZB42, FZB45 and Bacillus subtilis FZB37. Journal of Plant Diseases and Protection, 2004, 111(6): 583-597. |
| [14] | Yu LL, Li ZY, Peng CS, Li ZY, Guo YW. Neobacillamide A, a novel thiazole-containing alkaloid from the marine Bacterium Bacillus vallismortis C89, associated with South China Sea Sponge Dysidea avara. Helvetica Chimica Acta, 2009, 92(3): 607-612. DOI:10.1002/hlca.v92:3 |
| [15] | Li YX, Xu Y, Liu LL, Han Z, Lai PY, Guo XG, Zhang XX, Lin WH, Qian PY. Five new amicoumacins isolated from a marine-derived bacterium Bacillus subtilis. Marine Drugs, 2012, 10(2): 319-328. |
| [16] | Chen XH, Koumoutsi A, Scholz R, Eisenreich A, Schneider K, Heinemeyer I, Morgenstern B, Voss B, Hess WR, Reva O, Junge H, Voigt B, Jungblut PR, Vater J, Süssmuth R, Liesegang H, Strittmatter A, Gottschalk G, Borriss R. Comparative analysis of the complete genome sequence of the plant growth-promoting bacterium Bacillus amyloliquefaciens FZB42. Nature Biotechnology, 2007, 25(9): 1007-1014. DOI:10.1038/nbt1325 |
| [17] | Kunst F, Ogasawara N, Moszer I, Albertini AM, Alloni G, Azevedo V, Bertero MG, Bessières P, Bolotin A, Borchert S, Borriss R, Boursier L, Brans A, Braun M, Brignell SC, Bron S, Brouillet S, Bruschi CV, Caldwell B, Capuano V, Carter NM, Choi SK, Codani JJ, Connerton IF, Cummings NJ, Daniel RA, Denizot F, Devine KM, Düsterh?ft A, Ehrlich SD, Emmerson PT, Entian KD, Errington J, Fabret C, Ferrari E, Foulger D, Fritz C, Fujita M, Fujita Y, Fuma S, Galizzi A, Galleron N, Ghim SY, Glaser P, Goffeau A, Golightly EJ, Grandi G, Guiseppi G, Guy BJ, Haga K, Haiech J, Harwood CR, Hénaut A, Hilbert H, Holsappel S, Hosono S, Hullo MF, Itaya M, Jones L, Joris B, Karamata D, Kasahara Y, Klaerr-Blanchard M, Klein C, Kobayashi Y, Koetter P, Koningstein G, Krogh S, Kumano M, Kurita K, Lapidus A, Lardinois S, Lauber J, Lazarevic V, Lee SM, Levine A, Liu H, Masuda S, Mau?l C, Médigue C, Medina N, Mellado RP, Mizuno M, Moestl D, Nakai S, Noback M, Noone D, O'Reilly M, Ogawa K, Ogiwara A, Oudega B, Park SH, Parro V, Pohl TM, Portelle D, Porwollik S, Prescott AM, Presecan E, Pujic P, Purnelle B, Rapoport G, Rey M, Reynolds S, Rieger M, Rivolta C, Rocha E, Roche B, Rose M, Sadaie Y, Sato T, Scanlan E, Schleich S, Schroeter R, Scoffone F, Sekiguchi J, Sekowska A, Seror SJ, Serror P, Shin BS, Soldo B, Sorokin A, Tacconi E, Takagi T, Takahashi H, Takemaru K, Takeuchi M, Tamakoshi A, Tanaka T, Terpstra P, Togoni A, Tosato V, Uchiyama S, Vandenbol M, Vannier F, Vassarotti A, Viari A, Wambutt R, Wedler H, Weitzenegger T, Winters P, Wipat A, Yamamoto H, Yamane K, Yasumoto K, Yata K, Yoshida K, Yoshikawa HF, Zumstein E, Yoshikawa H, Danchin A. The complete genome sequence of the Gram-positive bacterium Bacillus subtilis. Nature, 1997, 390(6657): 249-256. DOI:10.1038/36786 |
| [18] | Bauer AW, Kirby WM, Sherris JC, Turck M. Antibiotic susceptibility testing by a standardized single disk method. Technical Bulletin of the Registry of Medical Technologists, 1966, 36(3): 49-52. |
| [19] | Lund ME, Hawkinson RW. Evaluation of the prompt inoculation system for preparation of standardized bacterial inocula. Journal of Clinical Microbiology, 1983, 18(1): 84-91. |
| [20] | Lee HJ, Choi GJ, Cho KY. Correlation of lipid peroxidation in Botrytis cinerea caused by dicarboximide fungicides with their fungicidal activity. Journal of Agricultural and Food Chemistry, 1998, 46(2): 737-741. DOI:10.1021/jf970501c |
| [21] | Zhang XM, Xue QL, Xiao R, Zhao LZ, Lin Q, Hu YJ. Antimicrobial mechanisms of mistletoe (Viscum articulatum) extracts against Staphylococcus aureus. Modern Food Science and Technology, 2016, 32(1): 82-88. (in Chinese) 张兴梅, 薛桥丽, 肖蓉, 赵灵芝, 林奇, 胡永金. 扁枝槲寄生提取物对金黄色葡萄球菌抑菌机理的研究. 现代食品科技, 2016, 32(1): 82-88. |
| [22] | Tang YL, Shi YH, Zhao W, Hao G, Le GW. Discovery of a novel antimicrobial peptide using membrane binding-based approach. Food Control, 2009, 20(2): 149-156. DOI:10.1016/j.foodcont.2008.03.006 |
| [23] | Chen CZ, Cooper SL. Interactions between dendrimer biocides and bacterial membranes. Biomaterials, 2002, 23(16): 3359-3368. DOI:10.1016/S0142-9612(02)00036-4 |
| [24] | Madigan MT, Martinko JM, Stahl DA, Clark DP, Brock TD. Brock biology of microorganisms. 13th ed. New York: Pearson Education, 2012. |
| [25] | Zhang KL, Zhou J, Zhou H, Wu Y, Liu R, Wang LL, Lin WW, Huang GM, Yang HH. Bioinspired "active" stealth magneto-nanomicelles for theranostics combining efficient MRI and enhanced drug delivery. ACS Applied Materials & Interfaces, 2017, 9(36): 30502-30509. |
| [26] | Johansson AC, Appelqvist H, Nilsson C, K?gedal K, Roberg K, ?llinger K. Regulation of apoptosis-associated lysosomal membrane permeabilization. Apoptosis, 2010, 15(5): 527-540. DOI:10.1007/s10495-009-0452-5 |
| [27] | Thornburg CC, Zabriskie TM, Mcphail KL. Deep-sea hydrothermal vents:potential hot spots for natural products discovery?. Journal of Natural Products, 2010, 73(3): 489-499. DOI:10.1021/np900662k |
| [28] | Wang SY, Furchtgott L, Huang KC, Shaevitz JW. Helical insertion of peptidoglycan produces chiral ordering of the bacterial cell wall. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(10): 3611. |
| [29] | Li TT, Yang B, Zhang HF, Chen Y, Li JR. The antimicrobial effect and the action mechanism of catfish epidermal mucus extracts. Journal of Chinese Institute of Food Science and Technology, 2017, 17(4): 21-29. (in Chinese) 李婷婷, 杨兵, 张慧芳, 陈颖, 励建荣. 鲶鱼体表黏液粗提物抗菌作用活性及抑菌机理. 中国食品学报, 2017, 17(4): 21-29. |
| [30] | Abe A, Hiraoka M, Shayman JA. A role for lysosomal phospholipase A2 in drug induced phospholipidosis. Drug Metabolism Letters, 2007, 1(1): 49-53. DOI:10.2174/187231207779814292 |
| [31] | Morissette G, Lodge R, Marceau F. Intense pseudotransport of a cationic drug mediated by vacuolar ATPase:procainamide-induced autophagic cell vacuolization. Toxicology and Applied Pharmacology, 2008, 228(3): 364-377. DOI:10.1016/j.taap.2007.12.031 |
