向立刚1,2#, 周浩1,2#, 汪汉成2

 , 李震3
, 李震3
 , 陈乾丽4, 余知和1
, 陈乾丽4, 余知和1

1. 长江大学生命科学学院, 湖北 荆州 434025;
2. 贵州省烟草科学研究院, 贵州 贵阳 550081;
3. 贵州省烟草公司黔西南州公司, 贵州 兴义 562400;
4. 贵州大学农学院, 贵州 贵阳 550025
收稿日期:2018-11-22;修回日期:2019-03-03;网络出版日期:2019-03-13
基金项目:中国博士后科学基金(2017M610585);中国烟草总公司科技项目(110201601025(LS-05),110201502003);贵州省科技厅优秀青年人才培养计划(黔科合平台人才[2017]5619);中国烟草总公司贵州省公司科技项目(201705,201714,201914)
*通信作者:汪汉成, E-mail:xiaobaiyang126@hotmail.com;
李震, E-mail:187233713@qq.com;
余知和, E-mail:zhiheyu@hotmail.com.
#并列第一作者
摘要:[目的] 了解健康烟株与感染青枯病烟株在根际土壤、茎杆发病部位、茎杆病健交界部位以及未发病茎杆的细菌群落结构与多样性。[方法] 分别对土壤与茎杆样品中细菌的16S rRNA基因V3-V4区进行扩增,采用Illumina MiSeq测序技术对扩增片段进行高通量测序,然后对健康烟株与感染青枯病烟株不同部位细菌群落结构与多样性进行分析。[结果] 感染青枯病烟株发病茎杆及根际土壤的细菌群落多样性高于健康烟株茎杆及其根际土壤样品,病健交界茎杆样品细菌群落多样性低于健康烟株。变形菌门(Proteobacteria)在所有样品中均为优势菌门;所有烟株根际土壤的优势菌门为拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi);健康烟株茎杆部位的优势菌门为蓝细菌门(Cyanobacteria);感染青枯病烟株发病茎杆和病健交界茎杆部位的优势菌门为蓝细菌门(Cyanobacteria)和厚壁菌门(Firmicutes)。所有根际土壤样品的优势菌属为劳尔氏菌属(Ralstonia)、假单胞菌属(Pseudomonas)、鞘脂单胞菌属(Sphingomonas)、黄杆菌属(Flavobacterium)和代尔夫特菌属(Delftia),而感染青枯病烟株根际土壤的劳尔氏菌属(Ralstonia)和假单胞菌属(Pseudomonas)相对丰度显著高于健康烟株根际土壤,鞘脂单胞菌属相对丰度显著低于健康烟株根际土壤。烟株茎杆的优势菌属为劳尔氏菌属和假单胞菌属等。感染青枯病烟株病健交界茎杆中劳尔氏菌属、肠杆菌属(Enterobacter)和泛菌属(Pantoea)相对丰度显著低于健康烟株样品。[结论] 健康与感染青枯病烟株茎杆样品细菌群落的丰富度和多样性明显低于相应的根际土壤样品。较健康烟株而言,感染青枯病烟株根际土壤和茎杆样品细菌群落丰富度和多样性均表现出不同程度地增加,且根际土壤细菌群落结构变化较茎杆样品明显,而病健交界茎杆样品细菌群落丰富度和多样性降低。烟草青枯病为典型土传病害,其病原茄科劳尔氏菌尽管能在烟株维管束中蔓延扩增,但主要还是分布于土壤中;它的存在似乎对土壤细菌群落的影响大于茎杆样品的。该研究结果提示对于青枯病的防治不能局限于烟株本身,田间土壤也应加大防治力度。
关键词:Illumina高通量测序细菌多样性群落结构烟草青枯病茄科劳尔氏菌
Bacterial community structure and diversity of rhizosphere soil and stem of healthy and bacterial wilt tobacco plants
Ligang Xiang1,2#, Hao Zhou1,2#, Hancheng Wang2

 , Zhen Li3
, Zhen Li3
 , Qianli Chen4, Zhihe Yu1
, Qianli Chen4, Zhihe Yu1

1. College of Life Sciences, Yangtze University, Jingzhou 434025, Hubei Province, China;
2. Guizhou Academy of Tobacco Science, Guiyang 550081, Guizhou Province, China;
3. Qianxinan Zhou Company, Guizhou Tobacco Companies, Xingyi 562400, Guizhou Province, China;
4. College of Agriculture, Guizhou University, Guiyang 550025, Guizhou Province, China
Received: 22 November 2018; Revised: 3 March 2019; Published online: 13 March 2019
*Corresponding author: Hancheng Wang, E-mail:xiaobaiyang126@hotmail.com;
Zhen Li, E-mail:187233713@qq.com;
Zhihe Yu, E-mail:zhiheyu@hotmail.com.
Foundation item: Supported by the China Postdoctoral Science Foundation (2017M610585), by the China National Tobacco Corporation Science and Technology Project (110201601025 (LS-05), 110201502003), by the Guizhou Provincial Science and Technology Department Outstanding Young Talent Training Program (Qian Kehe Platform Talents [2017] 5619) and by the China National Tobacco Corporation Guizhou Provincial Company Science and Technology Project (201705, 201714, 201914)
#Those authors contributed equally to this work
Abstract: [Objective] To understand the bacterial community structure and diversity of healthy and bacterial wilt tobacco plants in rhizosphere soil, diseased stem tissue, symptomatic-asymptomatic junction stem tissue, and non-infected stem tissue. [Methods] The V3-V4 region of the bacterial 16S rRNA gene in soil and stem tissue was amplified, and the amplified fragments were sequenced using Illumina MiSeq high-throughput sequencing technology. [Results] Proteobacteria were the dominant phylum in all samples. Bacteroidetes and Acidobacteria were the dominant phyla in all rhizosphere soil. Cyanobacteria was the dominant phylum in non-infected stem tissue; and Cyanobacteria and Firmicutes were dominant in diseased stem tissue and symptomatic-asymptomatic junction stemtissue. The dominant genera in all rhizosphere soil were Ralstonia, Pseudomonas and Sphingomonas. The dominant genera of tobacco stem were Ralstonia and Pseudomonas. [Conclusion] Compared with non-infected tobacco plants, the richness and diversity of bacterial community in rhizosphere soil and stem tissue of bacterial wilt tobacco plants were generally greater. Bacterial wilt is a typical soil-borne disease, although the pathogen Ralstonia solanacearum can spread and expand in the vascular bundles, it mainly distributes in the soil. Therefore, the control of bacterial wilt should not be limited to the tobacco plant itself, but targeting the pathogen in field soil may strengthen the control efforts.
Keywords: Illumina high-throughput sequencingbacterial diversitycommunity structuretobacco bacterial wiltRalstonia solanacearum
烟草青枯病是一种典型的细菌性土传维管束病害,其病原菌为茄科劳尔氏菌(Ralstonia solanacearum)[1]。该病原细菌能够侵染如烟草、桑树、番茄、土豆等50多个科450余种植物[2],主要在土壤和遗落在土壤中的植物残体上越冬,也可在杂草根部或根际土壤中存活,通过根茎的伤口或次生根的根冠进入木质部,然后迁移至维管束中蔓延,最终导致烟株萎蔫、枯萎和死亡[3-5]。已有报道表明,茄科劳尔氏菌在侵染植物过程中,能够引起侵染植物感病部位微生物群落结构和多样性变化。郑雪芳等[6]研究发现,茄科劳尔氏菌的侵染能够促进番茄根际土壤微生物(细菌和真菌)总量的增加。方树民等[7]发现烟草青枯病在植株根部定殖后能够导致根部腐烂,加剧腐生菌在植物根部定殖。罗路云[8]调查不同病情等级南瓜白粉病叶际细菌群落结构和多样性后发现,南瓜白粉病菌可改变南瓜叶际细菌群落结构,影响细菌群落多样性,随着病情等级提高,α多样性呈现先降后升的趋势。曹毅等[9]对烟草青枯病病圃土壤的细菌分析表明,变形菌门、绿弯菌门、酸杆菌门、浮霉菌门、放线菌门、芽单胞菌门为病圃土壤的优势菌群。王宁等[10]发现,草莓苗期施用木霉菌可湿性粉剂后,假单胞菌属(Pseudomonas)和四枝孢属(Tetracladium)数量明显增多,而头梗霉属(Cephaliophora)、赤霉菌属(Gibberella)和毛壳菌属(Chaetomium)数量明显减少。
烟草青枯病相关的环境微生物群落结构与多样性研究主要集中于根际土壤。施河丽等[11]运用高通量测序技术分析青枯病发病烟株根际土壤细菌群落,发现感病烟株根际土壤中芽孢杆菌属和链霉菌属等益生菌减少,而劳尔氏菌属和Rudaea等病原菌增加。李想等[12]研究发现,生物防控措施能有效防控重病区青枯病,并能改良土壤微生物区系。伍朝荣等[13]通过对土壤进行厌氧消毒处理,显著地提高土壤中梭菌科等厌氧细菌含量,对青枯病起到了较好的防控效果。作者发现茄科劳尔氏菌除能在烟株根际土壤中大量定殖外,还能迅速扩展至包括茎杆在内的地上部位,从而引起烟株微生态环境变化,进而加快烟株的衰老与死亡。有关烟株感染青枯病后,地上茎杆部位细菌群落结构和多样性的变化却鲜有报道。为此,本研究采用Illumina MiSeq高通量测序技术,对感染青枯病烟株与健康烟株的根际土壤、茎杆发病部位、茎杆病健交界部位以及未发病茎杆的细菌群落结构与多样性进行系统性分析,该技术已广泛应用于土壤[14-15]、水体[16-17]、肠道[18-19]、空气[20-21]等微生态系统的微生物多样性研究。本文研究结果对进一步了解青枯病的发生与植株局部微生态环境微生物多样性的变化具有重要意义。
1 材料和方法 1.1 样品采集 2016年8月于贵州省黔西南州兴义市烟草公司白瓦窑基地(24° 57' 8" N,104° 53' 9" E),选取烟草青枯病爆发严重的烟田(种植品种K326)进行样品采集。随机选取3株青枯病发病严重的烟株,去除地表土壤后,将烟株连同根部土壤一同拔出,去掉烟株主体土,抖落并收集须根2 mm范围的根际土壤样品,感染青枯病烟株根际土壤组(GBTU)样本编号为RAT、RBT和RCT。用剪刀(经酒精消毒)分别剪取烟株茎杆发病部位和茎杆病健交界部位5 cm样品,感染青枯病烟株发病茎杆组(GBJ)样本编号为RAJF、RBJF和RCJF,感染青枯病烟株病健交界茎杆组(GBJ2)样本编号为RABJ、RBBJ和RCBJ。同样,在该田块中随机选取3株未发病健康烟株,参照上述方法分别采集根际土壤、与感病烟株茎杆高度相同的茎杆样品。健康烟株根际土壤组(ZCTU)样本编号为ART、BRT和DRT;健康烟株茎杆组(ZCJ)样本编号为ARJ、BRJ和DRJ;与病健交界茎杆样品等高的健康烟株茎杆组(ZCJ2)样本编号为ARBJ、BRBJ和DRBJ。所有样品置入低温保藏箱,并迅速带回实验室,-80 ℃冰箱保存、备用。
1.2 样品DNA提取、扩增及测序 取充分混匀的土壤样品0.50 g,采用E.Z.N.A.? Soil DNA Kit(OMEGA)提取样品DNA,烟株茎杆样品DNA采用DNeasy Plant miniKit (Qiagen)提取,具体步骤按照其操作说明进行。利用NanoDrop 2000检测抽提DNA浓度和纯度,A260/A280值要求在1.8-2.0之间。
1.3 16S rDNA文库构建及高通量测序 以样品DNA为模板,采用引物338F (5′-ACT CCTACGGGAGGCAGCAG-3′)和806R (5′-GGAC TACHVGGGTWTCTAAT-3′)扩增目标片段的V3-V4可变区。PCR扩增体系为20 μL:5×FastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,引物338F、806R (5 μmol/L)各0.8 μL,FastPfu聚合酶0.4 μL,DNA模板(20 ng/μL) 1 μL,最后用灭菌的ddH2O将反应体系补至20 μL。PCR反应程序参数:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。PCR扩增产物经2%琼脂糖凝胶电泳检测,纯化后送至上海美吉生物医药科技有限公司利用Illumina公司Miseq PE300平台进行高通量测序。
1.4 测序数据处理与统计分析 原始测序序列使用Trimmomatic软件进行质控:首先过滤reads尾部质量值在20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的reads,去除含N碱基的reads;然后根据PE reads之间的overlap关系,将成对reads拼接成一条序列,最小overlap长度为10 bp;拼接序列的overlap区允许最大错配比率为0.2,筛选不符合序列;最后根据序列首尾两端的barcode和引物区分样品,并调整序列方向,barcode允许错配数为0,最大引物错配数为2。使用FLASH软件进行拼接。使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%相似度对序列进行OTU (operational taxonomic units)聚类,并在聚类过程去除单序列和嵌合体。利用RDP classifier (http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置置信度阈值为70%。通过对样品进行Alpha多样性分析、物种组成及差异等分析,评估青枯病发生对烟株根际土壤及茎杆细菌群落结构和多样性的影响。以上分析均在上海美吉生物医药科技有限公司I-Sanger生信云网站平台(http://www.i-sanger.com/project/index.html)完成。
2 结果和分析 2.1 16S rRNA基因序列测序深度分析 按照通常对未培养细菌16S rRNA基因序列同源性大于97%定义为一个OTU,即相当于培养细菌种的水平基础上,分析测序深度是否包括样品中多数细菌的物种。稀释曲线(rarefaction curve)分析显示,本研究6组18个样品在测序深度为20000时曲线达到平台,说明测序深度已反映了样品中95%以上的细菌种,可满足样品间细菌群落结构的对比分析。
2.2 数据质控 原始序列经优化处理后,感染青枯病组9个样本共得到327706条高质量序列片段,144420183个碱基,单一样本序列数为30022-44947条,序列平均长度为439 bp;健康烟株组9个样品共得到340839条高质量序列片段,149527400个碱基,单一样品序列数为30705-43719条,序列平均长度为441 bp。
2.3 OTU聚类分析 在97%相似度水平对样品序列进行OTU聚类,健康烟株3个不同部位样品共鉴定得出细菌28个门、58个纲、114个目、218个科、399个属、757个种、1498个OTU;感染青枯病烟株3个不同部位样品共鉴定得出细菌27个门、58个纲、121个目、227个科、395个属、751个种、1483个OUT (表 1)。
表 1. 健康烟株与青枯病感病烟株各部位细菌群落不同分类水平数量 Table 1. The total amount of bacterial communities in different parts of healthy and infected with bacterial wilt plants at different taxonomic levels
| Group | Domain | Kingdom | Phylum | Class | Order | Family | Genus | Species | OTU |
| ZCTU | 1 | 1 | 28 | 58 | 113 | 210 | 379 | 721 | 1435 |
| ZCJ | 1 | 1 | 11 | 21 | 33 | 56 | 76 | 97 | 119 |
| ZCJ2 | 1 | 1 | 9 | 17 | 31 | 52 | 77 | 106 | 140 |
| Total | 1 | 1 | 28 | 58 | 114 | 218 | 399 | 757 | 1498 |
| GBTU | 1 | 1 | 26 | 56 | 116 | 215 | 372 | 717 | 1416 |
| GBJ | 1 | 1 | 20 | 37 | 70 | 121 | 205 | 293 | 395 |
| GBJ2 | 1 | 1 | 18 | 36 | 67 | 114 | 174 | 248 | 328 |
| Total | 1 | 1 | 27 | 58 | 121 | 227 | 395 | 751 | 1483 |
| GBTU: Rhizosphere soil of bacterial wilt tobacco plants; GBJ: Stem tissue of bacterial wilt tobacco plants; GBJ2: Symptomatic-asymptomatic junction stem tissue; ZCTU: Rhizosphere soil of healthy tobacco plants; ZCJ: Stem tissue of healthy tobacco plants; ZCJ2: Stem tissue of healthy tobacco plants (corresponding to the stem group at the symptomatic-asymptomatic junction stem tissue). | |||||||||
表选项
Venn图分析结果表明(图 1),在属和OTU水平,感染青枯病组与健康烟株组的根际土壤之间细菌种类较为接近,共有的属和OTU种类远高于两组样品独有的种类。ZCTU与GBTU两组样品之间共有属主要包括:劳尔氏菌属(Ralstonia)、鞘脂单胞菌属(Sphingomonas)、假单胞菌属(Pseudomonas)、黄杆菌属(Flavobacterium)、芽单胞菌属(Gemmatimonas)、金黄杆菌属(Chryseobacterium)、代尔夫特菌属(Delftia)、鞘脂菌属(Sphingobium)等;ZCTU样品中独有属包括:Phascolarctobacterium、Moryella、Nannocystis、Lachnospira、Luteibacter、Sinomonas、Blautia、Skermanella、罗氏菌属(Roseburia)等;GBTU样品中独有的属包括:Siphonobacter、Parafilimonas、Brevifollis、Lactococcus、Streptococcus、Candidatus_Profftella、Exiguobacterium、鞘藻属(Microcoleus)、Polycyclovorans。发病茎杆部位与健康茎杆、感染青枯病烟株病健交界部位与健康烟株等高对照部位茎杆之间细菌的种类存在较大差异,其中感染青枯病组样品独有的属和OTU种类远高于两组共有的和健康烟株组样品独有的细菌种类。ZCJ与GBJ两组样品之间共有的属主要包括:劳尔氏菌属、假单胞菌属、拉克氏梭状芽胞杆菌属(Lachnocloatridium)、肠杆菌属(Enterobacter)等;ZCJ样品独有的属包括:Moryella、Romboutsia、Blautia、乳酸杆菌属(Lactobacillus)、Akkermansia、毛螺菌属(Lachnospira)、拟杆菌属(Bacteroides)、肠球菌属(Enterococcus)、罗氏菌属等;GBJ样品独有的属包括:Devosia、Herminiimonas、Mitsuaria、假诺卡氏菌属(Pseudonocardia)、Opitutus、Holophaga、Siphonobacte、噬细胞菌属(Cytophaga)、Skermanella等。ZCJ2与GBJ2两组样品之间共有的属主要包括:罗氏菌属、肠杆菌属、泛菌属(Pantoea)等;ZCJ2样品独有的属包括:假丁酸弧菌属(Pseudobutyrivibrio)、Paraprevotella、Parabacteroides、Moryella、Dietzia、罗氏菌属、短状杆菌属(Brachybacterium)、普罗威登斯菌属(Providencia)、毛螺菌属等;GBJ2样品独有的属包括:Devosia、Herminiimonas、Massilia、Romboutsia、Candidatus_Solibacter、假诺卡氏菌属、Holophaga、Skermanella、诺卡氏菌(Nocardioides)等。感染青枯病烟株根际土壤细菌种类最多,其次为茎杆发病部位,病健交界部位茎杆的细菌种类最少。GBTU、GBJ和GBJ2三组样品共有的属主要包括:罗氏菌属、假单胞菌属、Lachnocloatridium、肠杆菌属、代尔夫特菌、黄杆菌属等;GBJ样品独有的属包括:无色杆菌属(Achromobacter)、Nannocystis、Salana、诺卡菌属(Nocardia)、Aliihoeflea、Collinsella;GBJ2样品中独有的属包括:Blautia、双歧杆菌属(Bifidobacterium)、螺杆菌属(Helicobacter)、Allobaculum、Alistipes、发光杆菌属(Photobacterium)、拟杆菌属、丙酸杆菌属(Propionibacterium)、脲原体属(Ureaplasma)等。健康烟株组同样为根际土壤细菌种类最多,但与发病烟株病健交界等高的健康烟株茎杆部位样品(ZCJ2)细菌种类高于感病茎杆对照部位样品(ZCJ)。ZCTU、ZCJ和ZCJ2三组样品共有的属主要包括:劳尔氏菌属、肠杆菌属、泛菌属、鞘脂单胞菌属等;ZCJ中独有的属包括:Ruminiclostridium_6、Akkermansia、Coriobacteriaceae_UCG-002、Rothia、Prevotella_9、Subdoligranulum。ZCJ2中独有的属包括:假丁酸弧菌属(Pseudobutyrivibrio)、Paraprevotella、Parabacteroides、Dietzia、产碱杆菌属(Alcaligenes)。
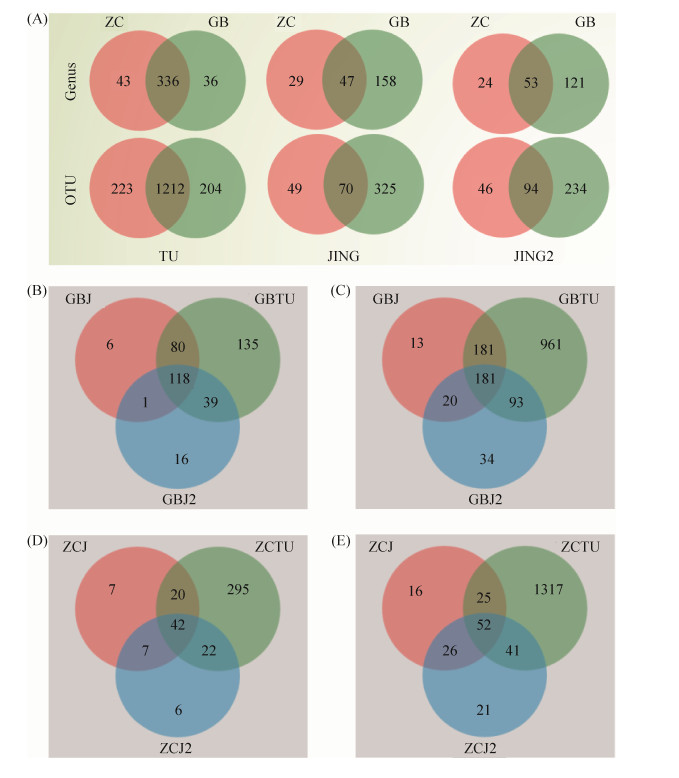 |
| 图 1 感染青枯病烟株与健康烟株不同部位细菌群落Venn图 Figure 1 Venn diagram of bacterial communities in different parts of tobacco bacterial wilt and healthy tobacco plants. A: Venn maps of different plant parts in two groups at the level of genus and OTU; B: Venn map of different parts of bacterial wilt tobacco plants at the level of genus; C: Venn map of different parts of bacterial wilt tobacco plants at the level of OTU; D: Venn map of different parts of healthy tobacco plants at the level of genus; E: Venn map of different parts of healthy tobacco plants at the level of OTU. ZC: Healthy tobacco plants; GB: Infected tobacco plants with bacterial wilt; TU; Rhizosphere soil; JING: Stem; JING2: Junctional stem tissue; GBTU: Rhizosphere soil of bacterial wilt tobacco plants; GBJ: Stem tissue of bacterial wilt tobacco plants; GBJ2: Symptomatic-asymptomatic junction stem tissue; ZCTU: Rhizosphere soil of healthy tobacco plants; ZCJ: Stem tissue of healthy tobacco plants; ZCJ2: Stem tissue of healthy tobacco plants (corresponding to the stem group at the symptomatic-asymptomatic junction stem tissue). |
| 图选项 |
2.4 细菌多样性指数分析 Sobs、Ace、Chao指数用于表示样品细菌群落丰富度;Smithwilson、Shannoneven、Simpsoneven指数用于表示样品细菌群落均匀度;Shannon、Simpson指数用于表示样品细菌群落多样性;Coverage指数用于表示样品测序的覆盖度。其中,Simpson指数值越大,说明群落多样性越低;其余指数值越大,说明相应的群落丰富度、均匀度和多样性越高(表 2)。
表 2. 不同组别细菌群落Alpha多样性指数(OTU level) Table 2. Alpha diversity index between different groups (OTU level)
| Groups | Richness index | Evenness index | Diversity index | Coverage index | |||||||
| Sobs | Ace | Chao | Shannoneven | Simpsoneven | Smithwilson | Shannon | Simpson | ||||
| ZCTU | 1101±43 | 1307±26 | 1334±48 | 0.81±0.01 | 0.105±0.018 | 0.43±0.01 | 5.67±0.12 | 0.009±0.002 | 0.998±0.001 | ||
| ZCJ | 62±14 | 168±96 | 110±51 | 0.20±0.02 | 0.033±0.011 | 0.53±0.01 | 0.80±0.03 | 0.517±0.043 | 0.999±0.000 | ||
| ZCJ2 | 80±12 | 121±12 | 154±63 | 0.30±0.08 | 0.037±0.006 | 0.53±0.02 | 1.32±0.37 | 0.358±0.102 | 0.999±0.000 | ||
| GBTU | 998±374 | 1182±331 | 1202±361 | 0.74±0.14 | 0.074±0.048 | 0.43±0.03 | 5.14±1.24 | 0.036±0.048 | 0.990±0.002 | ||
| GBJ | 205±102 | 433±279 | 343±195 | 0.33±0.09 | 0.019±0.008 | 0.49±0.04 | 1.71±0.57 | 0.348±0.160 | 0.997±0.002 | ||
| GBJ2 | 166±84 | 375±182 | 267±125 | 0.24±0.08 | 0.018±0.017 | 0.48±0.06 | 1.16±0.25 | 0.506±0.179 | 0.998±0.001 | ||
| GBTU: Rhizosphere soil of bacterial wilt tobacco plants; GBJ: Stem tissue of bacterial wilt tobacco plants; GBJ2: Symptomatic-asymptomatic junction stem tissue; ZCTU: Rhizosphere soil of healthy tobacco plants; ZCJ: Stem tissue of healthy tobacco plants; ZCJ2: Stem tissue of healthy tobacco plants (corresponding to the stem group at the symptomatic-asymptomatic junction stem tissue). | |||||||||||
表选项
图 2为OTU水平的Sobs指数图,结果表明感染青枯病烟株根际土壤样品(除RAT)、茎杆发病部位样品(除RAJF)以及病健交界茎杆样品(除RABJ)检测到的细菌OTU数量均高于健康烟株对应的3个部位,但无显著性差异。由表 2看出,两组烟株各部位样品覆盖度指数(Coverage index)均到达0.99,表明测序结果合理。感染青枯病组各部位样品丰富度高于健康烟株组样品。感染青枯病组烟株根际土壤样品和茎杆发病部位样品细菌群落均匀度和多样性高于健康烟株组烟株相同部位,而感染青枯病组烟株病健交界茎杆样品的细菌群落均匀度和多样性低于健康烟株组烟株等高茎杆样品。
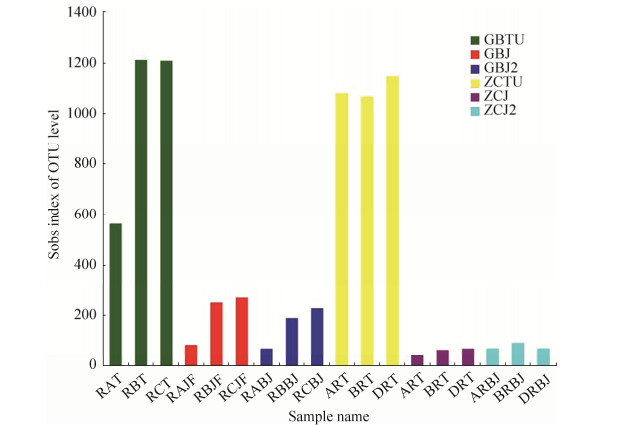 |
| 图 2 Alpha多样性指数(OTU水平Sobs指数) Figure 2 Alpha diversity index (Sobs index of OTU level). GBTU: Rhizosphere soil of bacterial wilt tobacco plants (Three samples of RAT, RBT and RCT were included); GBJ: Stem tissue of bacterial wilt tobacco plants (Three samples of RAJF, RBJF and RCJF were included); GBJ2: Symptomatic-asymptomatic junction stem tissue (Three samples of RABJ, RBBJ and RCBJ were included); ZCTU: Rhizosphere soil of healthy tobacco plants (Three samples of ART, BRT and DRT were included); ZCJ: Stem tissue of healthy tobacco plants (Three samples of ARJ, BRJ and DRJ were included); ZCJ2: Stem tissue of healthy tobacco plants (corresponding to the stem group at the symptomatic-asymptomatic junction stem tissue) (Three samples of ARBJ, BRBJ and DRBJ were included). |
| 图选项 |
2.5 细菌群落基本组成和结构分析 在门水平,感染青枯病组烟株根际土壤的主要细菌为变形菌门(Proteobacteria) (53.62%)、拟杆菌门(Bacteroidetes) (14.59%)、酸杆菌门(Acidobacteria) (10.32%)、放线菌门(Actinobacteria) (5.15%)、绿弯菌门(Chloroflexi) (5.12%)、芽单胞菌门(Gemmatimonadetes) (3.74%)、糖化菌门(Saccharibacteria) (2.84%)、厚壁菌门(Firmicutes) (1.10%)和疣微菌门(Verrucomicrobia) (1.09%);感染青枯病组烟株茎杆发病部位样品的主要细菌为变形菌门(75.95%)、蓝细菌门(Cyanobacteria) (17.89%)、厚壁菌门(4.37%)和拟杆菌门(1.16%);感染青枯病组病健交界部位的主要细菌为蓝细菌门(54.86%)、变形菌门(41.86%)和厚壁菌门(2.27%)。健康烟株组烟株根际土壤的主要细菌为变形菌门(49.15%)、拟杆菌门(11.58%)、放线菌门(11.57%)、酸杆菌门(8.84%)、绿弯菌门(5.89%)、芽单胞菌门(4.74%)和糖化菌门(4.19%);健康烟株组烟株茎杆样品的主要细菌为蓝细菌门(52.38%)和变形菌门(47.35%);与感染青枯病烟株交界部位等高的健康烟株茎杆样品的主要细菌为变形菌门(60.56%)和蓝细菌门(38.83%)(图 3)。
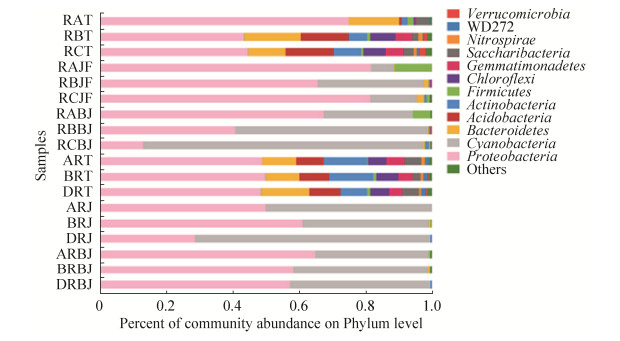 |
| 图 3 不同组别样品门水平上的相对丰度 Figure 3 The relative abundance of different samples at Phylum level. RAT, RBT and RCT were the rhizosphere soil samples of bacterial wilt tobacco plants; RAJF, RBJF and RCJF were the stem tissue of bacterial wilt tobacco plants; RABJ, RBBJ and RCBJ were the symptomatic-asymptomatic junction stem tissue; ART, BRT and DRT were the rhizosphere soil samples of healthy tobacco plants; ARJ, BRJ and DRJ were the stem tissue of healthy tobacco plant; ARBJ, BRBJ and DRBJ were the stem tissue of healthy tobacco plants (corresponding to the stem group at the symptomatic-asymptomatic junction stem tissue). |
| 图选项 |
在属水平,感染青枯病组烟株根际土壤的主要菌属为劳尔氏菌属(11.81%)、假单胞菌属(5.79%)、黄杆菌属(4.32%)、代尔夫特菌属(3.72%)和金黄杆菌属(2.7%);感染青枯病组烟株茎杆发病部位样品的主要菌属为劳尔氏菌属(48.51%)、假单胞菌属(13.34%)、拉克氏梭状芽胞杆菌属(2.96%)和肠杆菌属(2.45%);感染青枯病组病健交界茎杆的主要菌属为劳尔氏菌属(31.37%)和肠杆菌属(1.01%)。健康烟株组烟株根际土壤的主要菌属为鞘脂单胞菌属(6.64%)、芽单胞菌属(3.18%)、劳尔氏菌属(3.01%)、Candidatus_Solibacter (2.81%)、罗丹菌属(Rhodanobacter) (2.44%)和黄杆菌属(2.36%);健康烟株组烟株茎杆样品的主要菌属为劳尔氏菌属(46.01%);与感病烟株病健交界部位等高的健康烟株茎杆样品的主要菌属为劳尔氏菌属(40.61%)、肠杆菌属(7.11%)和泛菌属(6.02%)(图 4)。
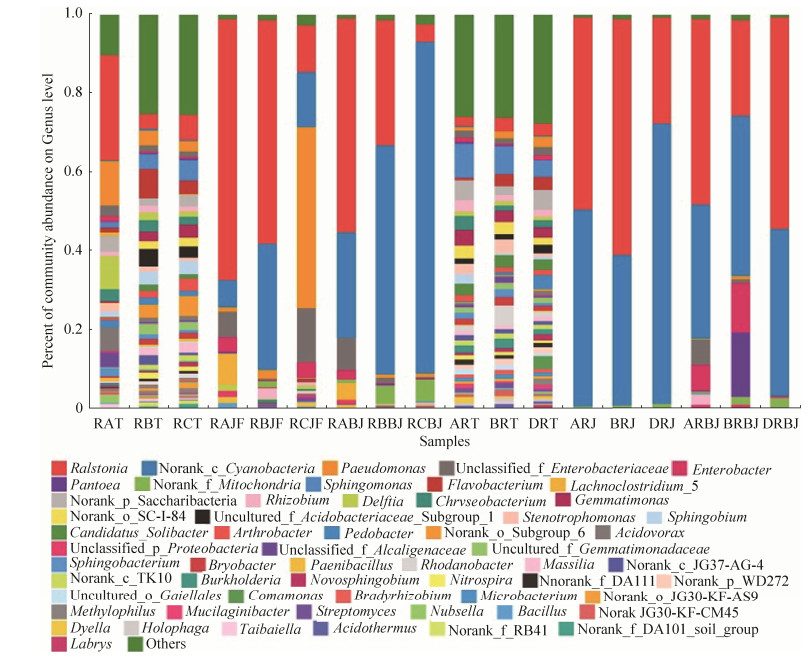 |
| 图 4 不同组别样品属水平上的相对丰度 Figure 4 The relative abundance of different samples at Genus level. RAT, RBT and RCT were the rhizosphere soil samples of bacterial wilt tobacco plants; RAJF, RBJF and RCJF were the stem tissue of bacterial wilt tobacco plants; RABJ, RBBJ and RCBJ were the symptomatic-asymptomatic junction stem tissue; ART, BRT and DRT were the rhizosphere soil samples of healthy tobacco plants; ARJ, BRJ and DRJ were the stem tissue of healthy tobacco plant; ARBJ, BRBJ and DRBJ were the stem tissue of healthy tobacco plants (corresponding to the stem group at the symptomatic-asymptomatic junction stem tissue). |
| 图选项 |
各样品前30个属的相对丰度热图如图 5所示,通过颜色的变化直观表示出属相对丰度的高低。热图上部样品层级聚类树表明,土壤样品与茎杆样品的细菌群落结构存在显著性差异,因而聚集为两大类,其中,土壤样品ART、BRT和DRT 3个样品群落结构较相似聚为一类,RBT和RCT 2样品聚为一类,而RAT样品与其余5类土壤样品细菌群落结果差异较大因而单独归为一类;茎杆样品健康烟株茎杆样品ARJ、BRJ、ARBJ、DRBJ以及感染青枯病烟株茎杆样品RABJ、RBJF、RAJF聚集为一大类,健康烟株茎杆样品DRJ、BRBJ以及感病烟株茎杆样品RBBJ、RCBJ样品聚集为一类,RCJF样品的细菌群落结果差异较大单独归为一类。
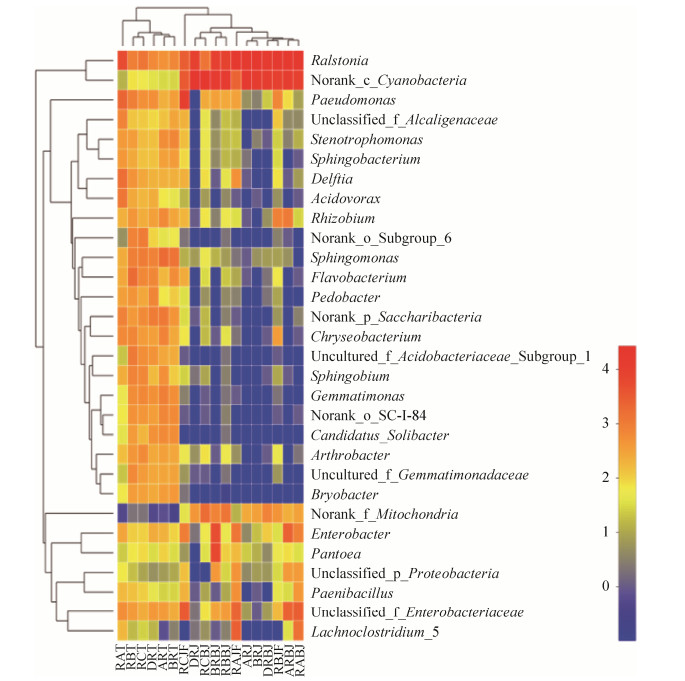 |
| 图 5 样品属水平的相对丰度热图 Figure 5 Heatmap of the relative abundance of genera identified in each sample. RAT, RBT and RCT were the rhizosphere soil samples of bacterial wilt tobacco plants; RAJF, RBJF and RCJF were the stem tissue of bacterial wilt tobacco plants; RABJ, RBBJ and RCBJ were the symptomatic-asymptomatic junction stem tissue; ART, BRT and DRT were the rhizosphere soil samples of healthy tobacco plants; ARJ, BRJ and DRJ were the stem tissue of healthy tobacco plant; ARBJ, BRBJ and DRBJ were the stem tissue of healthy tobacco plants (corresponding to the stem group at the symptomatic-asymptomatic junction stem tissue). |
| 图选项 |
2.6 样本比较分析 样本距离heatmap图反映样本间细菌群落组成的差异。图 6显示,根际土壤样品与茎杆样品的样本距离最远,表明茎杆与土壤样品细菌群落组成差异大。感染青枯病烟株的根际土壤与健康烟株的根际土壤样品间差异较大,而感染青枯病烟株发病茎杆与病健交界茎杆以及健康烟株茎杆样品细菌群落组成差异较小。该结果表明,感染青枯病烟株与健康烟株的茎杆样品间细菌群落结构差异较根际土壤小,二者的主要差异存在于根际土壤。
 |
| 图 6 OTU水平样本距离heatmap图 Figure 6 Samples distances heatmap on OTU. RAT, RBT and RCT were the rhizosphere soil samples of bacterial wilt tobacco plants; RAJF, RBJF and RCJF were the stem tissue of bacterial wilt tobacco plants; RABJ, RBBJ and RCBJ were the symptomatic-asymptomatic junction stem tissue; ART, BRT and DRT were the rhizosphere soil samples of healthy tobacco plants; ARJ, BRJ and DRJ were the stem tissue of healthy tobacco plant; ARBJ, BRBJ and DRBJ were the stem tissue of healthy tobacco plants (corresponding to the stem group at the symptomatic-asymptomatic junction stem tissue). |
| 图选项 |
图 7表明,试验样本前3个主成分PC1、PC2、PC3所占比例分别为41.57%,20.97%和9.25%,说明这三者是导致样本群落差异的主要因素。感染青枯病后,烟株根际土壤的细菌群落产生明显的差异,在PC2作用下能够明显地区分出感染青枯病烟株根际土壤与健康烟株根际土壤,说明主成分2是使烟株根际土壤产生差异的主要因素。主成分1能够将根际土壤样品与茎杆样品明显区分开,说明主成分1是造成根际土壤与茎杆样品细菌群落结构与多样性差异的主要因素。健康烟株茎杆与感染青枯病烟株茎杆样品之间细菌群落结构差异小,说明青枯病发生对于烟株茎杆细菌群落结构的影响较小。
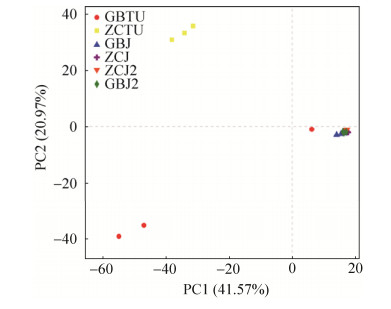 |
| 图 7 OTU水平主成分分析 Figure 7 Principal component analysis on OTU level. GBTU: Rhizosphere soil of bacterial wilt tobacco plants (Three samples of RAT, RBT and RCT were included); GBJ: Stem tissue of bacterial wilt tobacco plants (Three samples of RAJF, RBJF and RCJF were included); GBJ2: Symptomatic- asymptomatic junction stem tissue (Three samples of RABJ, RBBJ and RCBJ were included); ZCTU: Rhizosphere soil of healthy tobacco plants (Three samples of ART, BRT and DRT were included); ZCJ: Stem tissue of healthy tobacco plants (Three samples of ARJ, BRJ and DRJ were included); ZCJ2: Stem tissue of healthy tobacco plants (corresponding to the stem group at the symptomatic-asymptomatic junction stem tissue) (Three samples of ARBJ, BRBJ and DRBJ were included). |
| 图选项 |
3 讨论 本研究感染青枯病组9个样品获得的高质量序列片段数目低于健康烟株组的9个样品。所有样品扩增的16S rRNA基因V3-V4区域的长度均为440 bp,与实际V3-V4区域的长度大致吻合。研究结果证实,Illumina高通量测序技术在研究感染青枯病烟株不同部位微生物多样性上具有可行性。生态系统中微生物多样性往往决定生态系统的稳定性,一般来说生态系统微生物多样性越高,系统的结构组成越复杂,稳定性也相对较高[22]。Kennedy[23]、Wagg等[24]研究发现,土壤细菌群落结构的稳定性和多样性与植物正常生长发育及病害防治有着紧密联系。本研究OTU聚类分析表明,感染青枯病烟株根际土壤细菌的属与OTU种类略微降低,而发病茎杆中细菌的属与OTU种类则显著升高。感染青枯病烟株的根际土壤与茎杆中共有的细菌种类较健康烟株多,其原因可能是烟草青枯病侵染破坏了烟株根茎组织,降低烟株自身的防御能力,以致根际土壤细菌大量地向地表以上的茎杆中迁移。相关假说有待进一步研究。
Alpha多样性分析表明,感染青枯病组各部位样品丰富度指数均高于健康烟株组样品。结果与前人类似的研究存在差异[11]。其可能原因为:一方面本研究感病烟株各部位在样品采集时烟株已严重萎蔫甚至枯萎,烟株根系分泌物减少,而根系分泌物中存在许多可以抑制土传病害发生的抗菌物质[25]。陈娜等[26]研究发现烟草根系酚酸的释放对于烟草青枯病防治有着显著影响;冯超等[27]研究发现烟草根系分泌物对烟草疫霉有抑制作用。缺少了根系分泌物的调控,部分微生物可能会在土壤中大量增殖,从而增加了感染青枯病烟株根际土壤的细菌群落多样性与丰富度。另一方面,感病烟株由于受到青枯病菌侵染,发病茎杆部位组织被破坏,出现腐烂变黑症状,使得茎杆表面防御体系瓦解,进一步导致烟株内部的各种营养物质直接与环境相接触,丰富的营养物质加快了其他细菌在发病茎杆中的定殖。
细菌群落结构组成分析发现,感病烟株不同部位与健康烟株对应部位细菌的门类和属类组成基本相似。其中,变形菌门、拟杆菌门、酸杆菌门、放线菌门和绿弯菌门为根际土壤的优势菌门。结果与韩腾等[28]测定的烟草根围细菌多样性结果一致。感染青枯病烟株根际土壤较健康烟株根际土壤变形菌门增加4.47%、拟杆菌门增加3.01%、酸杆菌门增加1.48%、放线菌门降低6.42%、绿弯菌门降低0.77%。变形菌门细菌是最为普遍的细菌种类[29],存在感染青枯病组与健康烟株组的根际土壤中,劳尔氏菌是其中重要的病原菌之一,本文感染青枯病烟株根际土壤的变形菌门相对丰度增加可能与青枯菌的侵染有关。放线菌门细菌含量通常代表土壤的健康状况[30-31],本文感染青枯病组根际土壤样本放线菌门含量显著减少,这可能与本研究测定土壤为烟草青枯病病土有关。茎杆样品的优势菌门为变形菌门和蓝细菌门。本研究表明,感染青枯病茎杆较健康烟株组茎杆中变形菌门增加28.60%,蓝细菌门降低34.49%;感染青枯病组病健交界茎杆较健康烟株组对应茎杆中变形菌门降低18.70%,蓝细菌门增加16.03%。为此,烟草茎杆中变形菌门与蓝细菌门之间可能存在竞争关系,相关推测有待下一步研究。
属水平上,感染青枯病烟株与健康烟株根际土壤样品之间存在较大差异,感染青枯病组根际土壤中茄科劳尔氏菌属为优势菌属,而健康烟株根际土壤同样存在劳尔氏菌,但其相对含量较小。两组烟株茎杆样品的优势菌属均为劳尔氏菌属。为此,在烟草生产中后期,茄科劳尔氏菌属可能广泛分布于植烟土壤,并会随着烟株的生长而定殖在烟草的茎杆中,肉眼观察到没有发病的烟株也可能携带有大量的青枯病菌。携带病原菌的烟株而未表现出典型病症,这可能与病害发生通常是病原菌、环境、寄主等多因素互作的结果有关。下一步有待对未感病烟株青枯病菌的数量、分布与移动规律、致病性等方面开展研究。
本研究利用Illumina高通量测序技术对健康与感染青枯病烟株的根际土壤以及不同茎杆样品进行了测序分析,结果有助于人们了解感染青枯病后烟株根际土壤细菌和烟株茎杆内生细菌的群落结构以及多样性的变化情况,可为进一步研究烟草青枯病的防治奠定基础。但本文尚未分析pH、有机质、有机碳等土壤环境因子对感染青枯病烟株各部位的细菌群落结构的影响,有待在今后研究中检测各种环境因子,并将其与细菌群落结构进行典范对应分析(CCA分析),从而探讨环境因子对细菌群落结构的影响效果。考虑到烟草青枯菌为细菌型病害,对环境中细菌群落结构及多样性影响较大,本文仅分析了细菌群落结构及多样性,并未分析烟株各部位样品的真菌群落结构与多样性。有关健康及发病烟株各部位真菌群落结构与多样性将在下一步研究中陆续开展。
References
| [1] | Huo QJ, Zhang S, Wang RY. Advance and control of tobacco bacterial wilt disease. Chinese Agricultural Science Bulletin, 2007, 23(8): 364-368. (in Chinese) 霍沁建, 张深, 王若焱. 烟草青枯病研究进展. 中国农学通报, 2007, 23(8): 364-368. DOI:10.3969/j.issn.1000-6850.2007.08.079 |
| [2] | Wicker E, Grassart L, Coranson-Beaudu R, Mian D, Guilbaud C, Fegan M, Prior P. Ralstonia solanacearum strains from Martinique (French west indies) exhibiting a new pathogenic potential. Applied and Environmental Microbiology, 2007, 73(21): 6790-6801. DOI:10.1128/AEM.00841-07 |
| [3] | 浙江农业大学. 农业植物病理学. 上海: 上海科学技术出版社, 1978. |
| [4] | Sikirou R, Beed F, Ezin V, Hoteigni J, Miller SA. Distribution, pathological and biochemical characterization of Ralstonia solanacearum in Benin. Annals of Agricultural Sciences, 2017, 62(1): 83-88. DOI:10.1016/j.aoas.2017.05.003 |
| [5] | Wang HC, Wang MS, Xia HQ, Yang SJ, Guo YS, Xu DQ, Li WH, Xiang Y, Shang SH, Shi JX. First report of fusarium wilt of tobacco caused by Fusarium kyushuense in China. Plant Disease, 2013, 97(3): 424. |
| [6] | Zheng XF, Liu B, Zhu YJ. Effects of avirulent Ralstonia solanacearum strain as plant vaccine on microbial community in rhizosphere soil of tomato. Chinese Journal of Biological Control, 2017, 33(3): 385-393. (in Chinese) 郑雪芳, 刘波, 朱育菁. 青枯病植物疫苗对番茄根系土壤微生物群落结构的影响. 中国生物防治学报, 2017, 33(3): 385-393. |
| [7] | Fang SM, Gu G, Chen YS, Huang CM, Chen SH. Colonization and infection of Ralstonia Solanacearum in weed roots. Acta Tabacaria Sinica, 2013, 19(5): 72-81, 88. (in Chinese) 方树民, 顾钢, 陈玉森, 黄春梅, 陈顺辉. 烟草青枯菌在杂草根部的定殖和传病作用. 中国烟草学报, 2013, 19(5): 72-81, 88. DOI:10.3969/j.issn.1004-5708.2013.05.013 |
| [8] | Luo LY, Zhang Z, Jin DC, Tan XQ, Zhang DY, Tian Y, Lu XY, Liu Y. Phyllosphere bacterial diversities and community structures on pumkin with different severities of powdery mildew. Acta Phytopathologica Sinica, 2017, 47(5): 688-695. (in Chinese) 罗路云, 张卓, 金德才, 谭新球, 张德咏, 田云, 卢向阳, 刘勇. 南瓜白粉病不同病情等级下叶际细菌群落结构和多样性. 植物病理学报, 2017, 47(5): 688-695. |
| [9] | Cao Y, Lu N, Chen XJ, Meng JY, Shang SH. Pyrosequencing analysis of soil bacteria composition in tobacco bacterial wilt disease nursery. Journal of Henan Agricultural Sciences, 2017, 46(3): 81-85. (in Chinese) 曹毅, 陆宁, 陈兴江, 孟建玉, 商胜华. 烟草青枯病病圃土壤细菌组成的高通量测序分析. 河南农业科学, 2017, 46(3): 81-85. |
| [10] | Wang N, Liu T, Jin YZ, Xian HQ. Effects of Trichoderma spp. on soil microbial diversity and growth and morbidity of strawberry. Jiangsu Agricultural Sciences, 2018, 46(18): 108-112. (in Chinese) 王宁, 刘铜, 靳亚忠, 咸洪泉. 木霉菌对土壤微生物多样性及草莓生长和发病的影响. 江苏农业科学, 2018, 46(18): 108-112. |
| [11] | Shi HL, Xiang BK, Tan J, Peng WX, Sun YX, Wang R, Wu WH, Wei GS, Ding CF. Analysis of bacterial community in rhizosphere soil of tobacco plant infected by bacterial wilt disease. Acta Tabacaria Sinica, 2018, 24(5): 57-65. (in Chinese) 施河丽, 向必坤, 谭军, 彭五星, 孙玉晓, 王瑞, 吴文昊, 魏国胜, 丁才夫. 烟草青枯病发病烟株根际土壤细菌群落分析. 中国烟草学报, 2018, 24(5): 57-65. |
| [12] | Li X, Liu YX, Lu N, Cai LT, Yuan YB, Shi JX. Integrated bio-control of tobacco bacterial wilt and its effect on soil microobial community structure. Acta Pedologica Sinica, 2017, 54(1): 216-226. (in Chinese) 李想, 刘艳霞, 陆宁, 蔡刘体, 袁有波, 石俊雄. 综合生物防控烟草青枯病及其对土壤微生物群落结构的影响. 土壤学报, 2017, 54(1): 216-226. |
| [13] | Wu CR, Lin WP, Huang F, Cai YX, Tian JH, Lü S, Muramoto J, Shennan C, Cai KZ. Effects of anaerobic soil disinfestation on bacterial wilt and soil bacterial community. Acta Pedologica Sinica, 2018, 55(4): 987-998. (in Chinese) 伍朝荣, 林威鹏, 黄飞, 蔡一霞, 田纪辉, 吕顺, Muramoto J, Shennan C, 蔡昆争. 土壤厌氧消毒对青枯病的控制及土壤细菌群落结构的影响. 土壤学报, 2018, 55(4): 987-998. |
| [14] | 马骢毓.民勤退耕区次生草地土壤微生物多样性研究及优势植物根际促生菌资源筛选.甘肃农业大学博士学位论文, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10733-1017824821.htm |
| [15] | Xu YR, Fang ZJ, Lu XP, Hao LJ. Effects of starane on maize soil bacterial diversity analyzed by high-throughput sequencing technology. Acta Microbiologica Sinica, 2017, 57(7): 985-993. (in Chinese) 许艳蕊, 方志军, 卢晓平, 郝鲁江. 基于高通量测序技术分析使它隆对玉米土壤细菌多样性的影响. 微生物学报, 2017, 57(7): 985-993. |
| [16] | Zhang X, Liu J, Shen GP, Long QF, Han R, Zhu DR. Illumina-based sequencing analysis of microbial community composition in Chaka Salt Lake in Qinghai-Tibet Plateau. Microbiology China, 2017, 44(8): 1834-1846. (in Chinese) 张欣, 刘静, 沈国平, 龙启福, 韩睿, 朱德锐. 基于高通量测序研究青藏高原茶卡盐湖微生物多样性. 微生物学通报, 2017, 44(8): 1834-1846. |
| [17] | Liu Q, Zhao BX, Li RW, Wu DM, Xu DP, Cheng CD, Zhao SJ. Bacterial community structure in different functional sea areas of Zhoushan archipelago. Acta Microbiologica Sinica, 2018, 58(2): 247-263. (in Chinese) 刘强, 赵本宣, 李汝伟, 吴冬梅, 徐大鹏, 程传东, 赵淑江. 舟山群岛不同功能区划海域细菌群落结构分析. 微生物学报, 2018, 58(2): 247-263. |
| [18] | Huang LL, Zhang Y, Zhou H, Ni YQ. Comparison of intestinal microbial diversity in cold-water fishes in Xinjiang by 16S rRNA high-throughput sequencing. Food Science, 2018, 39(10): 138-144. (in Chinese) 黄丽丽, 张艳, 周红, 倪永清. 基于16S rRNA高通量测序方法比较新疆冷水鱼肠道中微生物多样性. 食品科学, 2018, 39(10): 138-144. DOI:10.7506/spkx1002-6630-201810022 |
| [19] | 张超.基于高通量测序研究肉桂精油对肠炎小鼠肠道菌群的影响.东北农业大学硕士学位论文, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10224-1017149902.htm |
| [20] | Wang DD, Lin Q, Otkur M, Yang HM, Lou K. Diversity of airborne bacterial communities in sandstorm area of Taklimakan. Acta Microbiologica Sinica, 2018, 58(8): 1420-1430. (in Chinese) 王丹丹, 林青, 欧提库尔·玛合木提, 杨红梅, 娄恺. 塔克拉玛干沙尘暴源区空气细菌群落多样性. 微生物学报, 2018, 58(8): 1420-1430. |
| [21] | Zhen Q, Wang YQ, Xian CF, Guo WJ, Ouyang ZY. Effects of sandstorms on the diversity characteristics of airborne bacteria in Beijing. Acta Ecologica Sinica, 2019, 39(2): 717-725. (in Chinese) 甄泉, 王雅晴, 冼超凡, 郭卫俊, 欧阳志云. 沙尘暴对北京市空气细菌多样性特征的影响. 生态学报, 2019, 39(2): 717-725. |
| [22] | He JZ, Li J, Zheng YM. Thoughts on the microbial diversity-stability relationship in soil ecosystems. Biodiversity Science, 2013, 21(4): 411-420. (in Chinese) 贺纪正, 李晶, 郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考. 生物多样性, 2013, 21(4): 411-420. |
| [23] | Kennedy AC. Bacterial diversity in agroecosystems. Agriculture, Ecosystems & Environment, 1999, 74(1/3): 65-76. |
| [24] | Wagg C, Dudenh?ffer JH, Widmer F, van der Heijden MGA. Linking diversity, synchrony and stability in soil microbial communities. Functional Ecology, 2018, 32(5): 1280-1292. DOI:10.1111/1365-2435.13056 |
| [25] | 李石力.有机酸类根系分泌物影响烟草青枯病发生的机制研究.西南大学博士学位论文, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10635-1018807247.htm |
| [26] | Chen N, Gao X, Tu PF, Deng LS. Regulation on control of tobacco bacterial wilt and phenolic acid release from tobacco roots by application of potassium fertilizer. Journal of Anhui Agricultural Sciences, 2018, 46(23): 118-120, 135. (in Chinese) 陈娜, 高翔, 涂攀峰, 邓兰生. 施钾调控烟草根系酚酸的释放及其防控青枯病研究. 安徽农业科学, 2018, 46(23): 118-120, 135. DOI:10.3969/j.issn.0517-6611.2018.23.038 |
| [27] | Feng C, Zhan HX, Cui MM, Xu CT, Wang J, Wang WJ, Wang XQ, Chen DX. Inhibition effects of tobacco root exudates on Phytophthora parasitica var. nicotianae. Tobacco Science, 2018, 51(9): 7-13. (in Chinese) 冯超, 战徊旭, 崔萌萌, 徐传涛, 王静, 王文静, 王晓强, 陈德鑫. 烟草根系分泌物对烟草疫霉菌的抑制作用. 烟草科技, 2018, 51(9): 7-13. |
| [28] | Han T, Zhang LM, Gao JM, Kong FY, Feng C, Wang J, Zhang CS. Correlation between root irrigation of Bacillus subtilis Tpb55 and variation of bacterial diversity in tobacco rhizosphere. Acta Microbiologica Sinica, 2016, 56(5): 835-845. (in Chinese) 韩腾, 张立猛, 高加明, 孔凡玉, 冯超, 王静, 张成省. 枯草芽孢杆菌(Bacillus subtilis)Tpb55灌根与烟草根围细菌多样性变化的相关性. 微生物学报, 2016, 56(5): 835-845. |
| [29] | Spain AM, Krumholz LR, Elshahed MS. Abundance, composition, diversity and novelty of soil Proteobacteria. The ISME Journal, 2009, 3(8): 992-1000. DOI:10.1038/ismej.2009.43 |
| [30] | 许永利.生姜连作土壤生态系统调控研究.中国农业大学博士学位论文, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10019-1014221417.htm |
| [31] | Bhatti AA, Haq S, Bhat RA. Actinomycetes benefaction role in soil and plant health. Microbial Pathogenesis, 2017, 111: 458-467. DOI:10.1016/j.micpath.2017.09.036 |
