郭小芳, 德吉

 , 龙琦炜, 白斌锦, 王豪杰, 曹亚璞
, 龙琦炜, 白斌锦, 王豪杰, 曹亚璞 西藏大学理学院, 西藏 拉萨 850000
收稿日期:2017-06-22;修回日期:2017-09-15;网络出版日期:2017-11-10
基金项目:西藏自治区自然科学基金(2016ZR-15-11);2016年度西藏大学珠峰****人才发展支持计划(藏大字[2016]141号)
*通信作者:德吉, Tel:+86-891-6405210, E-mail:shwdj2004@qq.com
摘要:[目的]开展拉鲁湿地水体酵母菌多样性研究,探究理化因子与酵母菌群落结构的相互关系。[方法]采用原位培养法从拉鲁湿地11个水样中分离酵母菌,应用26S rRNA D1/D2区域序列分析,并结合经典分类法对获得的菌株进行分类鉴定,运用SPSS和CANOCO软件分析酵母菌多样性及其与环境因子相关性。[结果]从拉鲁湿地水体中分离得到169株酵母菌,鉴定分属为15个属31个种。优势种为Ustilentyloma graminis和Filobasidium magnum,优势属为Naganishia、Ustilentyloma、Filobasidium和Cystofibasidium。统计分析结果表明,化学需氧量(COD)是影响拉鲁湿地水体酵母菌数量的显著因素,另外,此理化因子是影响Ustilentyloma分布的重要环境条件。[结论]西藏拉鲁湿地酵母菌资源比较丰富,且存在明显的空间异质性。
关键词: 青藏高原 拉鲁湿地 酵母菌 多样性 理化因子
Spatial dynamics of yeast community and its relationship with environmental factors in Lhalu Wetland, Tibet
Xiaofang Guo, Ji De

 , Qiwei Long, Binjin Bai, Haojie Wang, Yapu Cao
, Qiwei Long, Binjin Bai, Haojie Wang, Yapu Cao School of Sciences, Tibet University, Lhasa 850000, Tibet Autonomous Region, China
Received 22 June 2017; Revised 15 September 2017; Published online 10 November 2017
*Corresponding author: De Ji, Tel: +86-891-6405210; E-mail: shwdj2004@qq.com
Supported by Natural Science Foundation of Tibet Autonomous Region (2016ZR-15-11) and by the Tibet University Mount Everest Scholars Talent Development Project ([2016]141)
Abstract: [Objective]We studied the yeast diversity in Lhalu Wetland and analyzed the influence of environmental factors on yeast community.[Methods]Yeasts were isolated by in-situ cultivation and analyzed by the D1/D2 domain of large subunit (26S) ribosomal RNA and morphological characterization.[Results]In total 169 yeast isolates were identified to 15 genera and 31 species. Ustilentyloma graminis and Filobasidium magnumgenus were the dominating species in the wetland. Moreover, Naganishia, Ustilentyloma, Filobasidium and Cystofibasidium were the dominating genera. COD was significantly positive related to yeast abundance, and it had significant influence on Ustilentyloma.[Conclusion]Yeasts were abundant and diverse among various sites in Lhalu Wetland.
Key words: Qinghai-Tibet plateau Lhalu Wetland yeast diversity environmental factors
酵母菌存在于许多类型的淡水系统中,如湖泊、河流、地下水、冰川融水等,酵母菌及其他微生物在水生生态系统的物质循环和能量流动中起着重要的作用[1]。目前,国内水体酵母菌的研究主要侧重于湖泊,尤其是高原湖泊。严亚萍等[2]研究了云南阳宗海酵母菌种群结构,并简单分析了环境因子对该区域酵母菌种群分布的影响。董明华等[1]探究了云南杞麓湖酵母菌群落结构及其与环境因子的相互关系。郭小芳等[3]采用多元统计方法定量分析了云南抚仙湖酵母菌空间分布特征及其与理化因子之间的关系,发现抚仙湖湖水总有机碳含量与酵母菌丰度显著正相关。云南大学微生物研究所****对云南程海湖湖水酵母菌进行了分离及鉴定[4-5]。
湿地是地球上特殊过渡类型生态系统,具有多种生态功能和社会经济价值[6]。微生物在湿地生态系统物质循环、能量流动和系统稳定性维持等方面具有重要作用[7]。拉鲁湿地是目前我国城市范围内面积最大的天然湿地,在保持地区生物多样性、维持城市生态平衡、改善城市环境质量等方面起着重要的作用[8]。然而由于受地域等条件的限制,该区域微生物多样性的研究起步较晚,先前的几篇文献也仅局限于对拉鲁湿地土壤微生物的研究[9-11],对于拉鲁湿地水体微生物尤其是酵母菌的研究尚未见报道。开展高原湿地水体酵母菌多样性分析,能够为青藏高原微生物多样性研究提供理论依据,并为其特殊酵母菌资源的开发和利用提供有价值的资源和参考。
拉鲁湿地(91°03′48.5″–91°06′51.4″E,29°39′46.3″– 29°41′05.5″N)位于拉萨市西北角,是世界海拔最高的位于城市内面积最大的天然湿地,海拔3645 m,湿地总面积620 hm2,占拉萨市总面积的11.7%[12]。拉鲁湿地属于芦苇泥炭沼泽,湿地内野生植物以芦苇群落和中生型莎草科植物为主,主要土壤类型为泥炭沼泽土和泥炭土[13]。来自夺底、娘热两大沟的河流(流沙河)、大气降水和纳金电站的尾水为该湿地的主要补给水源[12]。
拉鲁湿地水体采集样点分布如图 1所示。
 |
| 图 1 拉鲁湿地水体采样点分布图 Figure 1 Distribution of water samples in Lhalu Wetland. |
| 图选项 |
1 材料和方法 1.1 水样采集 2016年冬季根据湿地水体分布情况,结合地理位置和生境差异,在拉鲁湿地选择11个样点进行水样采集。用无菌采集器在水表面约100 cm进行水样采集。每个样点共采集5 L水样,分别装入2个无菌塑料桶中。1份水样立刻送至拉萨净源科技有限公司测定水体理化因子(总氮、总磷、氨氮、溶解氧和化学需氧量),另1份带回实验室立即进行酵母菌分离。pH、温度、总溶解固体量、电导率和盐度的测定则直接在采样地进行。
1.2 水体酵母菌的分离及纯化 采用原位培养法分离拉鲁湿地水体酵母菌。将0.45 μm醋酸纤维素滤膜放置于抽滤瓶上,取30 mL水样进行抽滤,然后将滤膜正置于培养基平板上进行培养。分离培养基为酸性PDA培养基、酸性YM培养基以及RBCH培养基,培养基组成成分等见文献[2]。每个处理设3个重复。
1.3 酵母菌形态观察 观察并记录酵母菌在YM固体培养基上的菌落颜色、形状、质地等,并用光学显微镜观察酵母菌的细胞形状和大小等。
1.4 酵母菌的分子鉴定 采用26S rRNA D1/D2区域序列分析进行酵母菌鉴定。
1.4.1 DNA提取及扩增: DNA提取参照文献[14]进行。26S rRNA D1/D2区域序列的PCR扩增和测序参照文献[15]进行。引物NL1 (5′-GCATATCA ATAAGCGGAGGAAAAG-3′),NL4 (5′-GGTCCGT GTTTCAAGACGG-3′)。PCR扩增程序为:94 ℃ 5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 1.5 min,35个循环;72 ℃ 10 min。1%琼脂糖凝胶检测扩增目标产物后送生工生物工程(上海)股份有限公司测序。
1.4.2 序列分析: 供试菌株26S rRNA D1/D2测序结果人工校对后在GenBank核酸序列数据库中进行同源性搜索,与已知酵母菌菌株序列相似度为99%以上的,确定为同一种。供试菌株的序列上传至NCBI的GenBank核酸序列数据库,登录号为MF446404-MF446408、MF448255-MF448336、MF462732-MF462813。
1.5 拉鲁湿地水体理化因子测定 pH、温度(Temp)、总溶解固体量(TDS)、电导率(EC)和盐度(Salt)测定仪器为多功能参数仪(Multi-Parameter PCSTestrTM35)。总氮、总磷等6个理化指标交由拉萨净源科技有限公司进行测定,其中氨氮(NH4+-N)、总磷(TP)和总氮(TN)均使用TU-1901紫外可见分光光度计进行测定,方法分别为纳氏试剂分光光度法、钼酸铵分光光度法和碱性过硫酸钾消解紫外分光光度法;溶解氧(DO)采用电化学探头法测定;重铬酸盐法用于测定化学需氧量(COD)。
1.6 数据处理与分析 采用Excel、SPSS等软件进行数据分析与处理。Shannon-Wiener多样性指数、Simpson多样性指数和Pielou均匀度指数的计算采用Excel进行,差异性分析采用SPSS 19.0软件的Duncan检验法进行,相关性分析采用Pearson相关性系数法和PCA分析。
2 结果和分析 2.1 拉鲁湿地水体酵母菌多样性分析
2.1.1 拉鲁湿地水体酵母菌群落组成特征: (1) 拉鲁湿地水体不同种酵母菌分布状况。
表 1结果显示,拉鲁湿地水体中共分离到15个属31个种的酵母菌,其中7种酵母菌属子囊菌纲,24种酵母菌属担子菌纲。出现频率和相对丰度表明,担子菌纲酵母菌为拉鲁湿地水体主要酵母菌,这类酵母菌的出现频率为100%,相对丰度超过80%。
表 1. 拉鲁湿地水体不同种酵母菌分布状况 Table 1. Distribution of yeasts isolated from water samples in Lhalu Wetland
| Species | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | Occurrence frequency/% | Relative abundance/% |
| Ascomycetes | 2 | 6 | 7 | 5 | 7 | 45.45 | 16.0 | ||||||
| Candida oleophilla | 1 | 9.09 | 0.6 | ||||||||||
| Candida Zeylanoides | 2 | 2 | 18.18 | 2.4 | |||||||||
| Candida sake | 1 | 1 | 3 | 4 | 36.36 | 5.3 | |||||||
| Hanseniaspora uvarum | 1 | 1 | 18.18 | 1.2 | |||||||||
| Hanseniaspora meyeri | 1 | 9.09 | 0.6 | ||||||||||
| Pichia nakasel | 1 | 9.09 | 0.6 | ||||||||||
| Pichia fermentans | 1 | 7 | 1 | 27.27 | 5.3 | ||||||||
| Basidiomycetous | 18 | 12 | 4 | 7 | 26 | 6 | 11 | 14 | 21 | 9 | 14 | 100.00 | 84.0 |
| Cryptococcus oeirensis | 1 | 9.09 | 0.6 | ||||||||||
| Cryptococcus victoriae | 1 | 9.09 | 0.6 | ||||||||||
| Cystofibasidium infirmominiatum | 2 | 1 | 1 | 27.27 | 2.4 | ||||||||
| Cystofibasidium macerans | 1 | 4 | 1 | 1 | 1 | 2 | 3 | 2 | 72.72 | 8.9 | |||
| Filobasidium elegans | 1 | 9.09 | 0.6 | ||||||||||
| Filobasidium magnum | 1 | 1 | 1 | 1 | 8 | 1 | 3 | 2 | 72.72 | 10.7 | |||
| Filobasidium stepposum | 1 | 9.09 | 0.6 | ||||||||||
| Filobasidium wieringae | 1 | 9.09 | 0.6 | ||||||||||
| Holtermanniella takashimae | 1 | 1 | 1 | 3 | 36.36 | 3.6 | |||||||
| Naganishia adeliensis | 2 | 9.09 | 1.2 | ||||||||||
| Naganishia albida | 1 | 9.09 | 0.6 | ||||||||||
| Naganishia albidosimillis | 1 | 9.09 | 0.6 | ||||||||||
| Naganishia friendimannii | 4 | 4 | 1 | 1 | 1 | 4 | 54.54 | 8.9 | |||||
| Naganishia globosa | 6 | 1 | 1 | 1 | 2 | 1 | 54.54 | 7.1 | |||||
| Papiliotrema flavescens | 1 | 9.09 | 0.6 | ||||||||||
| Rhodosporidiobolus colostri | 1 | 9.09 | 0.6 | ||||||||||
| Rhodotorula graminis | 1 | 1 | 1 | 1 | 1 | 45.45 | 3.0 | ||||||
| Rhodotorula kratochvilovae | 1 | 9.09 | 0.6 | ||||||||||
| Rhodotorula mucilaginosa | 1 | 1 | 1 | 1 | 2 | 45.45 | 3.6 | ||||||
| Sporidiobolus metaroseus | 1 | 3 | 18.18 | 2.4 | |||||||||
| Udeniomyces puniceas | 1 | 9.09 | 0.6 | ||||||||||
| Udeniomyces pyricola | 1 | 9.09 | 0.6 | ||||||||||
| Ustilentyloma graminis | 5 | 4 | 12 | 1 | 4 | 4 | 2 | 10 | 72.72 | 24.9 | |||
| Vishniacozyma tephrensis | 1 | 9.09 | 0.6 |
表选项
15个属酵母菌种群结构显示(表 1):Naganishia、Filobasidium、Candida及Rhodotorula等4个属的酵母菌分离到3个以上种,Hanseniaspora、Pichia、Cryptococcus、Cystofibasidium及Udeniomyces等5个属均分离到2种,其他6个属的酵母菌则均仅分离到1种。
分析不同种酵母菌出现频率可知,Cystofibasidium macerans、Filobasidium magnum及Ustilentyloma graminis出现频率最高,在8个水样中被分离到,其次为Naganishia globosa和Naganishia friendimannii,出现频率为54.54%。Candida oleophilla、Hanseniaspora meyeri等17个种的酵母菌仅分离到1株。相对丰度表明,31种酵母菌中,Ustilentyloma graminis相对丰度最高(24.9%),其次为Filobasidium magnum (10.7%),Cystofibasidium macerans、Naganishia friendimannii和Naganishia globosa相对丰度也比较高,均超过5%,Candida oleophilla、Hanseniaspora meyeri等16种酵母菌均仅分离到1株。综合分析相对丰度与出现频率可知,拉鲁湿地水体酵母菌优势种主要为Ustilentyloma graminis和Filobasidium magnum。
(2) 拉鲁湿地水体不同属酵母菌分布状况。
为更深入分析酵母菌群落组成特征,整理结果见表 2。数据显示,从拉鲁湿地水体中分离的酵母菌经分子鉴定后被归为15个属,其中Naganishia出现频率最高,超过90%,其次为Filobasidium (分布于9个样点),Cystofibasidium和Ustilentyloma这2个属在拉鲁湿地水体中分布也比较广泛,出现频率达72.72%。相对丰度显示,Ustilentyloma数量最多,其次为Naganishia,Filobasidium和Cystofibasidium 2个属酵母菌相对丰度也较高,均超过10%;Papiliotrema、Rhodosporidiobolus和Vishniacozyma这3个属酵母菌仅分离到1株,相对丰度仅为0.6%。本研究实验结果表明,拉鲁湿地水体中酵母菌优势属为Naganishia、Ustilentyloma、Filobasidium和Cystofibasidium。
表 2. 拉鲁湿地水体不同属酵母菌分布状况 Table 2. Distribution of yeasts of different genera isolated from water samples in Lhalu Wetland
| Genera | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | Occurrence frequency/% | Relative abundance/% |
| Candida | 1 | 3 | 3 | 7 | 36.36 | 8.3 | |||||||
| Hanseniaspora | 2 | 1 | 18.18 | 1.8 | |||||||||
| Pichia | 1 | 1 | 7 | 1 | 36.36 | 5.9 | |||||||
| Cryptococcus | 1 | 1 | 18.18 | 1.2 | |||||||||
| Cystofibasidium | 1 | 4 | 1 | 1 | 3 | 3 | 3 | 3 | 72.72 | 11.2 | |||
| Holtermanniella | 1 | 1 | 1 | 3 | 36.36 | 3.6 | |||||||
| Filobasidium | 1 | 2 | 1 | 1 | 9 | 1 | 3 | 1 | 2 | 81.81 | 12.4 | ||
| Naganishia | 10 | 4 | 1 | 2 | 2 | 2 | 2 | 6 | 1 | 1 | 90.90 | 18.3 | |
| Papiliotrema | 1 | 9.09 | 0.6 | ||||||||||
| Rhodosporidiobolus | 1 | 9.09 | 0.6 | ||||||||||
| Rhodotorula | 2 | 1 | 3 | 1 | 2 | 3 | 54.54 | 7.1 | |||||
| Sporidiobolus | 1 | 3 | 18.18 | 2.4 | |||||||||
| Udeniomyces | 1 | 1 | 18.18 | 1.2 | |||||||||
| Ustilentyloma | 5 | 4 | 12 | 1 | 4 | 4 | 2 | 10 | 72.72 | 24.9 | |||
| Vishniacozyma | 1 | 9.09 | 0.6 |
表选项
2.1.2 拉鲁湿地各样点水体酵母菌组成相似性分析: (1) 拉鲁湿地各样点水体酵母菌种水平组成相似性分析。
为了解拉鲁湿地不同样点水体酵母菌群落组成相似性,分别计算了各样点酵母菌种水平和属水平Jaccard相似度系数。表 3数据表明,拉鲁湿地各样点水体酵母菌种类相似度系数范围为0.06–0.62;1号样点与7号样点间、5号样点与7号样点间、6号样点与11号样点间达中等相似(0.50–0.75),中等相似度比例为5%;22组样点间相似度系数为0.25–0.50,为中度不相似,比例为40%;30组样点间酵母菌种类相似度系数为0–0.25,为极度不相似,比例为55%,其中6号和8号、5号和11号、4号和6号、3号和5、8、10号样点间Jaccard相似度系数不到0.10。总体而言,拉鲁湿地水体各样点间酵母菌种类存在较大差异。
表 3. 拉鲁湿地各样点水体酵母菌种类Jaccard相似度系数 Table 3. Jaccard coefficient of yeasts among different sites in Lhalu Wetland
| Sites | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 1 | 1 | ||||||||||
| 2 | 0.27 | 1 | |||||||||
| 3 | 0.25 | 0.20 | 1 | ||||||||
| 4 | 0.38 | 0.20 | 0.14 | 1 | |||||||
| 5 | 0.40 | 0.23 | 0.09 | 0.33 | 1 | ||||||
| 6 | 0.21 | 0.27 | 0.15 | 0.07 | 0.12 | 1 | |||||
| 7 | 0.62 | 0.25 | 0.22 | 0.38 | 0.50 | 0.20 | 1 | ||||
| 8 | 0.27 | 0.23 | 0.09 | 0.20 | 0.23 | 0.06 | 0.36 | 1 | |||
| 9 | 0.31 | 0.29 | 0.15 | 0.15 | 0.27 | 0.31 | 0.38 | 0.19 | 1 | ||
| 10 | 0.25 | 0.29 | 0.08 | 0.30 | 0.21 | 0.25 | 0.33 | 0.21 | 0.18 | 1 | |
| 11 | 0.18 | 0.25 | 0.22 | 0.10 | 0.07 | 0.50 | 0.17 | 0.07 | 0.29 | 0.14 | 1 |
表选项
(2) 拉鲁湿地各样点水体酵母菌属水平群落组成相似性分析。
表 4为拉鲁湿地各样点水体酵母菌属水平相似度系数。数据显示,研究区域酵母菌属Jaccard相似性系数为0.14–0.83;5号和7号样点间达极度相似(0.83),11组样点间相似度系数介于0.50和0.75之间,中等相似比例为20%;31组样点间相似度系数为0.20–50.50,中等不相似比例为56%;12组样点间为极度不相似,比例为22%。可以算出,拉鲁湿地各样点水体酵母菌属水平不相似度高达78%,由此可知拉鲁湿地各样点水体间酵母菌属水平也存在较大差异。
表 4. 拉鲁湿地各样点水体酵母菌属类Jaccard相似度系数 Table 4. Jaccard coefficient of yeasts of different genera among different sites in Lhalu Wetland
| Sites | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 1 | 1 | ||||||||||
| 2 | 0.38 | 1 | |||||||||
| 3 | 0.14 | 0.43 | 1 | ||||||||
| 4 | 0.50 | 0.22 | 0.14 | 1 | |||||||
| 5 | 0.43 | 0.33 | 0.25 | 0.43 | 1 | ||||||
| 6 | 0.22 | 0.50 | 0.25 | 0.11 | 0.20 | 1 | |||||
| 7 | 0.67 | 0.38 | 0.29 | 0.50 | 0.83 | 0.18 | 1 | ||||
| 8 | 0.38 | 0.44 | 0.38 | 0.22 | 0.50 | 0.18 | 0.50 | 1 | |||
| 9 | 0.40 | 0.50 | 0.30 | 0.30 | 0.56 | 0.36 | 0.56 | 0.60 | 1 | ||
| 10 | 0.44 | 0.44 | 0.20 | 0.33 | 0.40 | 0.45 | 0.44 | 0.25 | 0.42 | 1 | |
| 11 | 0.29 | 0.29 | 0.33 | 0.14 | 0.25 | 0.67 | 0.29 | 0.22 | 0.30 | 0.33 | 1 |
表选项
2.1.3 拉鲁湿地水体酵母菌多样性指数计算: 表 5数据为拉鲁湿地水体酵母菌多样性指数。从表 5可以看出,拉鲁湿地6号、9号水样酵母菌种数最多,其次为10号,2号、5号和8号水样酵母菌种数也较多,相对而言,3号和4号水样酵母菌种类最少,仅为4种。数据表明,9号水样酵母菌属数最多,其次为10号、8号,3号、4号和11号水样属数相对比较少,均为4个属。
表 5. 拉鲁湿地水体酵母菌多样性指数 Table 5. Diversity index of yeasts isolated from water samples in Lhalu Wetland
| Sites | Species number | Genera number | Yeast counts/ (CFU/L) | Pigmented yeast counts/ (CFU/L) | Non-pigmented yeast counts/ (CFU/L) | Pigmented yeasts/% | Simpson index (D) | Shannon index (H′) | Pielou evenness index (J′) |
| 1 | 6 | 5 | 4609de | 759ef | 3850d | 16.47 | 0.63 | 0.98 | 0.20 |
| 2 | 8 | 6 | 4125ef | 1078e | 3047de | 26.13 | 0.77 | 1.69 | 0.35 |
| 3 | 4 | 4 | 1474h | 561fg | 913g | 38.06 | 0.73 | 1.19 | 0.32 |
| 4 | 4 | 4 | 26730a | 8580a | 18150a | 32.10 | 0.68 | 1.35 | 0.20 |
| 5 | 8 | 6 | 10329b | 3531b | 6798b | 34.19 | 0.59 | 0.69 | 0.13 |
| 6 | 11 | 6 | 6314c | 3113c | 3201de | 49.30 | 0.87 | 2.11 | 0.40 |
| 7 | 7 | 5 | 9350b | 1980d | 7370b | 21.18 | 0.83 | 1.83 | 0.33 |
| 8 | 8 | 7 | 5632cd | 682efg | 4950c | 12.11 | 0.83 | 1.55 | 0.30 |
| 9 | 11 | 9 | 2651gh | 495fg | 2156ef | 18.67 | 0.86 | 2.07 | 0.48 |
| 10 | 9 | 8 | 2013gh | 308g | 1705fg | 15.30 | 0.87 | 2.11 | 0.51 |
| 11 | 7 | 4 | 3168fg | 748ef | 2420ef | 23.61 | 0.69 | 1.27 | 0.28 |
| The data marked with different alphabets indicated that difference between sites was significant (P<0.05). | |||||||||
表选项
为对拉鲁湿地酵母菌多样性进行深入分析,记录并计算了红色酵母、非红色酵母以及酵母菌总丰度,并采用SPSS 19.0软件进行了不同样点微生物总丰度差异性分析。从表 5可见,4号水样酵母菌总丰度最高,其次为5号和7号水样,3号水样酵母菌总丰度除与9号和10号水样没有显著性差异,明显低于其他8个样点(P<0.05);红色酵母菌总丰度数据表明,4号水样总丰度最高,其次为5号、6号、7号水样,10号水样红色酵母菌总丰度最低,且明显低于除3号、8号及9号以外的其他水样(P<0.05);非红色酵母菌在不同水样中数量的分布趋势与红色酵母菌基本一致,4号水样仍最高,其次为5号和7号样点,3号水样中该值则最低(P<0.05)。红色酵母菌所占比例显示(表 6),6号样点红色酵母菌比例最高,其次为3号样点,8号样点红色酵母菌比例最低(12.11%)。
表 6. 拉鲁湿地水体理化因子差异性分析 Table 6. Difference analysis of environmental factors of water samples in Lhalu Wetland
| No. | pH | EC/ (μs/cm) | TDS/ (mg/L) | Salt/ (mg/L) | Temp/ ℃ | TN/ (mg/L) | NH4+-N/ (mg/L) | TP/ (mg/L) | TSP/ (mg/L) | DO/ (mg/L) | COD/ (mg/L) |
| 1 | 9.12a | 272.00cd | 193.33cd | 125.67cd | 11.20c | 4.60d | 3.50def | 0.20b | 4.67c | 6.97c | 85.24g |
| 2 | 8.65b | 246.00de | 174.67de | 113.33cde | 11.33c | 4.00f | 2.70g | 0.10cd | 4.33c | 7.09c | 82.38i |
| 3 | 8.27e | 236.33ef | 168.00ef | 109.33ef | 11.60b | 4.00f | 3.40ef | 0.00e | 2.67c | 7.02c | 88.10e |
| 4 | 8.20e | 241.00def | 171.33def | 111.67def | 11.83a | 4.60d | 8.50b | 0.20b | 19.33b | 5.91g | 95.28a |
| 5 | 8.45d | 231.00ef | 164.33ef | 107.17ef | 11.67ab | 3.80g | 4.93c | 0.07d | 4.67c | 6.53f | 88.73c |
| 6 | 8.56c | 213.67f | 151.67f | 98.53f | 11.00d | 6.70a | 19.40a | 0.13c | 3.00c | 7.42b | 93.37b |
| 7 | 7.42j | 289.33c | 205.67c | 132.67c | 10.07g | 4.10e | 4.00d | 0.00e | 103.67a | 4.45h | 85.75f |
| 8 | 7.69i | 271.33cd | 193.33cd | 125.00cd | 9.70h | 2.30i | 3.70de | 0.00e | 2.00c | 7.75a | 82.73h |
| 9 | 7.78h | 258.33cde | 183.33de | 118.33cde | 10.37f | 3.33h | 3.03fg | 0.00e | 6.00c | 6.82e | 76.84k |
| 10 | 8.06f | 323.00b | 229.33b | 148.67b | 10.57e | 5.80b | 1.57h | 0.23b | 10.33c | 7.45b | 78.41j |
| 11 | 7.96g | 362.33a | 257.00a | 168.00a | 10.97d | 5.30c | 3.50def | 0.30a | 5.00c | 7.03c | 76.75k |
| EC: electric conductivity; TDS: total dissovled salt; Temp: temperature; TN: total nitrogen; NH4+-N: ammonia nitrogen; TP: total phosphorus; TSP: total suspended solids; DO: dissolved oxygen; COD: chemical oxygen demand. The data marked with different alphabets indicated that difference was significant (P<0.05). | |||||||||||
表选项
Simpson多样性指数、Shannon-Wiener多样性指数和Pielou均匀度指数显示(表 5),6号和10号水样D值最高,其次为9号水样,7号和8号水样D值也比较高,5号水样D值则最低;6号和10号2个水样H'值最高,其次为9号水样,5号水样H′值则最低。可以看出,Simpson多样性指数和Shannon-Wiener多样性指数基本一致,这2个指数综合表明,6号和10号2个水样酵母菌丰富度和多样性较高。均匀度指数变化趋势则不同,从表 5可以看出,10号样点酵母菌分布最均匀,其次为9号水样,相对而言1号和4号水样中酵母菌分布最不均匀。
2.2 拉鲁湿地水体理化因子与酵母菌多样性相关性分析
2.2.1 拉鲁湿地水体理化因子差异性分析: 为了探讨理化因子与酵母菌多样性的关系,测定了拉鲁湿地水体11个理化指标数据,如表 6所示。可见拉鲁湿地11个水样间理化指标存在不同程度的差异。就pH而言,数据显示采集的水样均呈偏碱性(7.42–9.12),其中1号样点pH最高,7号样点pH值最低,11个水样间pH值基本都存在显著差异(P<0.05);就EC、TDC和Salt而言,11个水样值变化趋势一致,11和10号水样明显高于其他水样,6号水样值最低(与除3、4、5号水样以外的水样间均存在显著差异),其中EC为(213–362) μs/cm,TDS为(151–257) mg/L,Salt为(98–168) mg/L;总氮和氨氮测定结果表明,拉鲁湿地水体总氮范围为(2.30–6.70) mg/L,氨氮范围为(1.57–19.40) mg/L,其中6号样点这2个值最高(P<0.05),8号样点总氮值最低,10号样点氨氮值最低;11号样点总磷值最高,3、7、8、9号样点则最低,总体范围为(0–0.23) mg/L;悬浮物值分析表明,7号样点悬浮物值最高,其次为4号样点,其他样点间则没有明显差异;拉鲁湿地水体溶解氧范围为(4.45–7.75) mg/L,8号样点溶解氧最高,7号则最低;化学需氧量测定范围为(76.75–95.28) mg/L,4号样点该值最高,10号水样的化学需氧量最低。
2.2.2 拉鲁湿地各样点水体理化因子间相关性分析: 从表 7可以看出,EC、TDS以及Salt 3个理化因子两两间呈极显著正相关(相关性系数为1) (P<0.01);TN与TP间呈显著正相关(P<0.05);TSP与DO间呈极显著负相关(P<0.01);COD与EC、TDS以及Salt 3个理化因子间呈显著负相关(P<–0.05),而与水体NH4+-N间呈显著正相关(P<0.05);pH与Temp间呈显著正相关(P<0.05);其他理化因子两两间则没有显著相关性。
表 7. 拉鲁湿地水体理化因子间Pearson相关性系数 Table 7. Pearson correlation coefficience of environmental factors of water samples in Lhalu Wetland
| Factors | pH | EC | TDS | Salt | Temp | TN | NH4+-N | TP | TSP | DO | COD |
| pH | 1 | ||||||||||
| EC | –0.386 | 1 | |||||||||
| TDS | –0.388 | 1.000** | 1 | ||||||||
| Salt | –0.373 | 1.000** | 1.000** | 1 | |||||||
| Temp | 0.674* | –0.391 | –0.394 | –0.371 | 1 | ||||||
| TN | 0.341 | 0.139 | 0.134 | 0.145 | 0.301 | 1 | |||||
| NH4+-N | 0.237 | –0.512 | –0.514 | –0.508 | 0.187 | 0.567 | 1 | ||||
| TP | 0.366 | 0.527 | 0.525 | 0.541 | 0.337 | 0.678* | 0.086 | 1 | |||
| TSP | –0.536 | 0.172 | 0.174 | 0.159 | –0.360 | –0.052 | –0.081 | –0.269 | 1 | ||
| DO | 0.372 | –0.005 | –0.006 | 0.001 | –0.005 | 0.096 | 0.070 | 0.212 | –0.893** | 1 | |
| COD | 0.333 | –0.721* | –0.720* | –0.711* | 0.522 | 0.207 | 0.676* | –0.095 | 0.094 | –0.269 | 1 |
| EC: electric conductivity; TDS: total dissovled salt; Temp: temperature; TN: total nitroge; NH4+-N: ammonia nitrogen; TP: total phosphorus; TSP: total suspended solids; DO: dissolved oxygen; COD: chemical oxygen demand; *: There was a significant correlation at the 0.05 level; **: There was a significant correlation at the 0.01 level. | |||||||||||
表选项
2.2.3 拉鲁湿地各样点水体酵母菌多样性指数间相关性分析: 表 8数据表明,拉鲁湿地水体酵母菌种数与D、H'以及J'间呈显著正相关(P<0.05),与属数间呈极显著正相关(P<0.01),酵母菌属数与J′间也呈现显著正相关(P<0.05);酵母菌总丰度、红色酵母菌总丰度以及非红色酵母菌总丰度两两间呈极显著正相关(P<0.01);D、H′以及J′两两间也呈极显著相关性(P<0.01)。
表 8. 拉鲁湿地水体酵母菌多样性指数间Pearson相关性系数 Table 8. Pearson correlation coefficient of yeast diversity index of water samples in Lhalu Wetland
| Index | Species number | Genera number | Yeast counts | Pigmented yeast counts | Non-pigmented yeast counts | Simpson index (D) | Shannon index (H′) | Pielou evenness index (J′) |
| Species number | 1 | |||||||
| Genera number | 0.799** | 1 | ||||||
| Yeast counts | –0.424 | –0.380 | 1 | |||||
| Pigmented yeast counts | –0.345 | –0.388 | 0.968** | 1 | ||||
| Non-pigmented yeast counts | –0.454 | –0.367 | 0.992** | 0.929** | 1 | |||
| Simpson index (D) | 0.607* | 0.600 | –0.335 | –0.329 | –0.330 | 1 | ||
| Shannon index (H') | 0.631* | 0.578 | –0.221 | –0.196 | –0.228 | 0.954** | 1 | |
| Pielou evenness index (J') | 0.605* | 0.653* | –0.515 | –0.476 | –0.523 | 0.896** | 0.908** | 1 |
| *: There was a significant correlation at the 0.05 level; **: There was a significant correlation at the 0.01 level. | ||||||||
表选项
2.2.4 拉鲁湿地各样点水体理化因子与酵母菌多样性指数间相关性分析: 从表 9可以看出,化学需氧量与酵母菌总丰度以及非红色酵母菌总丰度间呈显著正相关(P<0.05),相关性系数分别为0.681和0.621,与红色酵母菌总丰度呈极显著正相关(P<0.01);Simpson多样性指数D与Temp间呈显著负相关性(P<–0.05);红色酵母菌比例与EC、TDS以及Salt间呈显著负相关(P<–0.05),而与氨氮和化学需氧量间呈显著正相关(P<0.05);其他参数间则没有明显相关性。
表 9. 拉鲁湿地水体理化因子与酵母菌多样性指数间Pearson相关性系数 Table 9. Pearson correlation coefficient between yeast diversity index and environmental factors of water samples in Lhalu Wetland
| Factors | Species number | Genera number | Yeast counts | Pigmented yeast counts | Non-pigmented yeast counts | Pigmented yeasts/% | Simpson index (D) | Shannon index (H′) | Pielou evenness index (J′) |
| pH | –0.126 | –0.230 | –0.028 | 0.083 | –0.084 | 0.338 | –0.511 | –0.406 | –0.348 |
| EC | –0.027 | –0.018 | –0.301 | –0.408 | –0.239 | –0.619* | 0.065 | 0.086 | 0.198 |
| TDS | –0.030 | –0.018 | –0.299 | –0.408 | –0.237 | –0.623* | 0.065 | 0.084 | 0.195 |
| Salt | –0.041 | –0.036 | –0.293 | –0.398 | –0.233 | –0.608* | 0.044 | 0.066 | 0.178 |
| Temp | –0.484 | –0.546 | 0.374 | 0.505 | 0.299 | 0.615* | –0.698* | –0.563 | –0.507 |
| TN | 0.176 | –0.189 | –0.004 | 0.155 | –0.084 | 0.475 | 0.113 | 0.283 | 0.240 |
| NH4+-N | 0.285 | –0.142 | 0.305 | 0.472 | 0.213 | 0.760** | 0.18 | 0.241 | –0.005 |
| TP | –0.121 | –0.282 | 0.137 | 0.179 | 0.113 | –0.029 | –0.291 | –0.102 | –0.099 |
| TSP | –0.134 | –0.185 | 0.239 | 0.122 | 0.293 | –0.148 | 0.209 | 0.213 | 0.018 |
| DO | 0.322 | 0.35 | –0.497 | –0.404 | –0.533 | –0.016 | 0.129 | 0.061 | 0.254 |
| COD | –0.364 | –0.496 | 0.681* | 0.767** | 0.621* | 0.711* | –0.279 | –0.255 | –0.489 |
| EC: electric conductivity; TDS: total dissovled salt; Temp: temperature; TN: total nitrogen; NH4+-N: ammonia nitrogen; TP: total phosphorus; TSP: total suspended solids; DO: dissolved oxygen; COD: chemical oxygen demand; *: There was a significant correlation at the 0.05 level; **: There was a significant correlation at the 0.01 level. | |||||||||
表选项
2.2.5 拉鲁湿地水体酵母菌群落排序: 上述分析尽管能够说明理化因子与酵母菌多样性指数间的关系,然而酵母菌与环境因子、酵母菌间以及不同样点酵母菌群落差异等尚未得到直观反映。为此,本文采用CANOCO软件对不同属酵母菌与环境因子间的关系进行了排序。为确定合理的排序模型,先进行去趋势对应分析。DCA分析结果显示第1排序轴的梯度长度值为2.264,因此选择线性模型中的主成分分析进行排序。PCA结果表明,第一排序轴对响应变量的解释比例为41%,第二排序轴为19%,二者总和达到60%,表明该排序结果能够有效反映拉鲁湿地水体环境因子与酵母菌间的关系。
样点分布状况显示(图 2),2号、3号、9号以及10号样点排序距离较近,4号、5号和7号样点聚在一起,另外,1号、6号和11号样点间排序距离也较近,而8号样点与其他样点间差异较大。
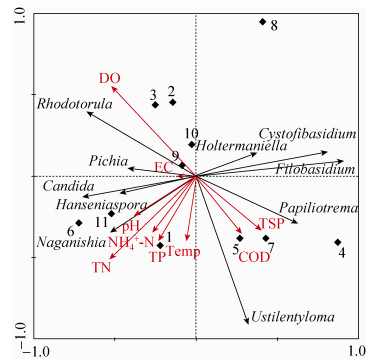 |
| 图 2 拉鲁湿地水体酵母菌群落与理化因子PCA分析排序图 Figure 2 PCA ordination diagram of yeast community associated with environmental factors in Lhalu Wetland. EC: electric conductivity; Temp: temperature; TN: total nitroge; NH4+-N: ammonia nitrogen; TP: total phosphorus; TSP: total suspended solids; DO: dissolved oxygen; COD: chemical oxygen demand. |
| 图选项 |
从图 2可以看出,通过设定物种适合度排除与排序图的解释参考价值不高的种群后,10个属的酵母菌在排序图中被展示出来。拉鲁湿地水体优势酵母菌属在图中的分布显示,Filobasidium和Cystofibasidium间呈正相关性,Ustilentyloma与其他3个属酵母菌基本没有相关性。另外,3个子囊菌纲酵母菌属(Hanseniaspora, Candida, Pichia)间相关性较强。
环境因子间相关性在排序图中得到有效的展现。从图中可以看出COD与TSP相关性系数较高,而这两者与DO呈现负相关。TN、TP以及NH4+-N间呈现正相关性,它们与pH和Temp间的相关性系数也较高。
与Pearson相关性分析比较而言,主成分分析排序图中直观地展现了理化因子与酵母菌多样性间的对应相关性。从图中可以看出,COD、TSP、Temp与Ustilentyloma呈正相关性,而Naganishia与pH、TN、NH4+-N、TP存在正相关,另外,Rhodotorula与DO间则呈现较强的正相关性。
3 讨论和结论 结果显示,Ustilentyloma graminis在拉鲁湿地水体中的分布和数量都呈明显优势,一方面可能由于Ustilentyloma graminis耐低温性能比较强,杨昭杰等[16]研究表明,Ustilentyloma graminis (Rhodotorula glutinis)的低温生长适应性可能是通过提高多不饱和脂肪酸合成相关基因的表达水平,增加膜脂中多不饱和脂肪酸含量,维持低温条件下细胞膜的流动性来形成的。Ustilentyloma graminis (Rhodotorula glutinis)可能具有的耐低温特性使其在冬季拉鲁湿地水体环境中广泛分布。樊竹青等[17]研究发现担子菌酵母产类胡萝卜素的能力高于子囊菌酵母,并筛选出1株产类胡萝卜素活性较强的Ustilentyloma graminis (Rhodotorula glutinis)。类胡萝卜素是重要的光合色素,能够帮助菌体抵抗紫外辐射等,由此推测,Ustilentyloma graminis (Rhodotorula glutinis)对紫外线的抗性可能是其广泛分布于高海拔环境的另一原因。然而,为了准确解答以上问题,还需要对该实验分离的菌株进行产类胡萝卜素能力、抗紫外能力以及耐低温生长特性的系统研究。文献[18]表明利用Ustilentyloma graminis (Rhodotorula glutinis)处理高COD淀粉废水,生产微生物油脂的同时降低淀粉废水的COD,可实现废水的资源化利用,并且解决生物油脂生产原料问题,钟娜等[19]经多次驯化筛选出1株耐高浓度COD、高产油脂的粘红酵母菌株,而本实验结果也表明COD与Ustilentyloma graminis之间存在正相关性,因而,该环境中高COD含量可能也是导致Ustilentyloma graminis优势存在的原因之一。
拉鲁湿地水体与土壤酵母菌种类[11]比较结果表明,水体中分离的酵母菌属数为16,种数为31,土壤中分离的酵母菌属数为5,种数为16,共同分布的酵母菌有8种,分别为Candida sake、Cryptococcus victoriae、Cystofibasidium infirmominiatum、Cystofibasidium macerans、Filobasidium magnum、Naganishia friendimannii、Rhodotorula mucilaginosa和Ustilentyloma graminis,两者之间酵母菌Jaccard相似性系数为21%。分析酵母菌数量可知,拉鲁湿地土壤酵母菌总丰度平均值为2.32×104 CFU/g,水体酵母菌总丰度平均值为6.95×103 CFU/L,可以看出湿地水体酵母菌总丰度虽然略低于土壤,然而也是酵母菌生存的主要生境,而且水体中酵母菌丰富度胜于土壤。因此,开发和利用水环境尤其是青藏高原水环境酵母菌资源具有广阔的前景。
由于未查阅到国内湿地水体酵母菌多样性研究相关文献,因而分析了国内其他淡水环境(高原湖泊)中酵母菌群落组成特征,并与本实验结果进行简单比较。结果显示(表 10),拉鲁湿地水体酵母菌属数为15,仅次于抚仙湖,种数相对居中;拉鲁湿地水体中酵母菌数量远远多于高原湖泊;4个云南高原湖泊与拉鲁湿地水体间酵母菌Jaccard相似度系数为0.10–0.13,均为极度不相似;高原湖泊与拉鲁湿地水体共有酵母菌为Naganishia albida (Cryptococcus albidus)、Ustilentyloma graminis (Rhodotorula glutinis)和Rhodotorula mucilaginosa;相对于4个高原湖泊,拉鲁湿地水体特有酵母菌有17个种,其中Holtermanniella takashimae、Papiliotrema flavescens、Rhodosporidiobolus colostri和Vishniacozyma tephrensis所在属为特有属。总之,拉鲁湿地水体与4个高原湖泊酵母菌群落组成存在较大差异,一方面可能由于湿地和湖泊生境的差异,另一方面,也与拉鲁湿地自身特殊的地理位置和生态环境密切相关。
表 10. 拉鲁湿地水体与云南高原湖泊酵母菌比较 Table 10. Comparison of yeast community between Lhalu Wetland and plateau lakes in Yunnan province
| Places | Specis number | Genera number | Yeast counts/ (CFU/L) | Jaccard coefficient with Lhalu Wetland | Common yeast species with Lhalu Wetland |
| Yangzonghai Lake[1] | 48 | 15 | 124 | 0.13 | Cryptococcus victoriae、Filobasidium magnum、Naganishia albida、Naganishia friendimannii、Hanseniaspora uvarum、Pichia fermentans、Rhodotorula graminis、Rhodotorula mucilaginosa、Ustilentyloma graminis (Rhodotorula glutinis) |
| Qilu Lake[2] | 27 | 14 | 551 | 0.12 | Cryptococcus victoriae、Hanseniaspora uvarum、Naganishia albida、Rhodotorula graminis、Rhodotorula mucilaginosa、Ustilentyloma graminis |
| Fuxian Lake[3] | 52 | 22 | 259 | 0.12 | Cystofibasidium macerans、Filobasidium elegans、Naganishia albida、Naganishia friendimannii、Naganishia globosa、Rhodotorula graminis、Rhodotorula mucilaginosa、Udeniomyces pyricola、Ustilentyloma graminis(Rhodotorula glutinis) |
| Chenghai Lake[5] | 22 | 14 | 189 | 0.10 | Cryptococcus oeirensis、Filobasidium magnum、Naganishia albida、Rhodotorula mucilaginosa、Ustilentyloma graminis(Rhodotorula glutinis) |
| Lhalu wetland | 31 | 15 | 6950 | – | – |
表选项
Pearson分析表明,抚仙湖湖水总有机碳浓度与酵母菌丰度呈显著正相关[3],本研究没有测定拉鲁湿地水体中总有机碳,而测定了能够反映水体总有机质含量的化学需氧量,结果显示COD与酵母菌总丰度、红色酵母菌总丰度以及非红色酵母菌总丰度间均存在显著相关性,另外,文献[20-21]表明水体COD与TOC之间存在显著或极显著正相关性,因此可知水体中有机质含量水平是影响酵母菌数量的主要因素之一。为更深入探究COD对酵母菌群落组成的影响,进行了主成分分析。分析结果可以看出,COD与拉鲁湿地水体中相对丰度最高的酵母菌属Ustilentyloma呈明显的正相关性。此结果从一定程度上解释了COD与酵母菌总丰度尤其是红色酵母菌总丰度呈显著正相关的原因,而拉鲁湿地水体酵母菌总丰度最高的3个样点(4号、5号和7号)与排序图中表示COD的射线的近距离又进一步说明COD是影响拉鲁湿地水体酵母菌数量的主要因素。
理化因子差异性分析结果表明,不同样点理化因子差异比较明显,如pH、DO以及COD等。造成差异的原因一方面由于湿地生境中的水体几乎不流动,另外,水体在湿地中的分布呈现不规则的区域分隔状态,再则湿地不同区域植被类型和土壤类型的差异很大程度上影响了该区域水体的理化因子,并进一步导致酵母菌群落组成的差异。
地表水环境质量标准基本项目标准限值显示,Ⅰ–Ⅴ类水质化学需氧量标准限值为(15–40) mg/L,氨氮、总氮标准限值分别为(0.15–2.00) mg/L、(0.2–2.0) mg/L,本实验测得的这3种理化因子数据均超过限值,而溶解氧、总磷等数据却显示拉鲁湿地水质为较清洁或清洁程度。分析数据矛盾的原因,可能由于冬季拉鲁湿地很多样点水体缺乏补给,水位偏低,用采样器进行取样时无法仅采集到表层水,往往将底泥混入水体,所以导致一些理化因子数据受到影响而不符合地表水环境质量标准限值,因此本实验理化因子数据无法真实反映拉鲁湿地水体清洁程度。但是作为酵母菌多样性的影响指标而言,这些数据具有评价和分析意义。
采用原位培养法分离了采自拉鲁湿地的11份水样中的酵母菌,并对获得的酵母菌菌株进行了分子鉴定。结果显示,拉鲁湿地水体169株酵母菌归为15个属31个种,其中24个种为担子菌纲酵母菌,7个种为子囊菌纲酵母菌;出现频率和相对丰度表明,拉鲁湿地水体酵母菌优势种为Ustilentyloma graminis和Filobasidium magnum,优势属为Naganishia、Ustilentyloma、Filobasidium和Cystofibasidium;拉鲁湿地水体理化因子和酵母菌多样性指数相关性分析结果显示,化学需氧量与酵母菌总丰度以及非红色酵母菌总丰度间呈显著正相关,与红色酵母菌总丰度呈极显著正相关,Jaccard系数表明拉鲁湿地水体酵母菌种群结构存在明显的空间异质性。
References
| [1] | Dong MH, Li ZY, Zhou B, Zhou Q, Yan YP, Jin FY, Li YX, Yang LY, Li SL. Diversity of cultivable yeast in Qilu Lake in winter. Acta Microbiologica Sinica, 2016, 56(4): 603-613. (in Chinese) 董明华, 李治滢, 周斌, 周巧, 严亚萍, 晋方佑, 李云霄, 杨丽源, 李绍兰. 云南高原湖泊杞麓湖冬季可培养酵母菌多样性分析. 微生物学报, 2016, 56(4): 603-613. |
| [2] | Yan YP, Li ZY, Dong MH, Zhou Q, Jin FY, Yang LY, Li SL. Yeasts from Yangzonghai Lake in Yunnan (China):diversity and extracellular enzymes. Acta Microbiologica Sinica, 2013, 53(11): 1205-1212. (in Chinese) 严亚萍, 李治滢, 董明华, 周巧, 晋方佑, 杨丽源, 李绍兰. 云南阳宗海酵母菌种群结构及产胞外酶测试. 微生物学报, 2013, 53(11): 1205-1212. |
| [3] | Guo XF, Li ZY, Dong MH, Zhou B, Yang LY, Li SL. Spatial dynamics of yeast community and its relationship to environmental factors in Lake Fuxian, Yunnan province. Journal of Lake Sciences, 2016, 28(2): 358-369. (in Chinese) 郭小芳, 李治滢, 董明华, 周斌, 杨丽源, 李绍兰. 云南高原湖泊抚仙湖酵母菌空间分布及其与环境因子的关系. 湖泊科学, 2016, 28(2): 358-369. DOI:10.18307/2016.0216 |
| [4] | Zhou XL, Li ZY, Yang LY, Dong MH, Li SL. Identification of yeasts isolated from Chenghai Lake, a plateau lake in Yunnan province. Acta Microbiologica Sinica, 2011, 51(4): 547-553. (in Chinese) 周新丽, 李治滢, 杨丽源, 董明华, 李绍兰. 云南程海湖酵母菌多样性及应用. 微生物学报, 2011, 51(4): 547-553. |
| [5] | Li ZY, Zhou XL, Zhou B, Dong MH, Wang YX, Yang LY, Li SL. Diversity and extracellular enzymes of yeasts from Chenghai Lake in winter. Mycosystema, 2017, 36(2): 177-185. (in Chinese) 李治滢, 周新丽, 周斌, 董明华, 王永霞, 杨丽源, 李绍兰. 云南程海湖冬季酵母菌多样性及胞外酶活性研究. 菌物学报, 2017, 36(2): 177-185. |
| [6] | Zhang YL, Wang CL, Bai WQ, Wang ZF, Tu YL, YangJaen DG. Alpine wetlands in the Lhasa River Basin, China. Journal of Geographical Sciences, 2010, 20(3): 375-388. DOI:10.1007/s11442-010-0375-7 |
| [7] | Liu YY, Li F, Sun QY, Xie YH. Review on the study of soil microorganisms in wetland ecosystems. Chinese Journal of Applied & Environmental Biology, 2013, 19(3): 547-552. (in Chinese) 刘银银, 李峰, 孙庆业, 谢永宏. 湿地生态系统土壤微生物研究进展. 应用与环境生物学报, 2013, 19(3): 547-552. |
| [8] | Huang W, Chen XT. Ecological service function and degradation reason analysis of Lhalu Wetland. Journal of West China Forestry Science, 2008, 37(3): 41-45. (in Chinese) 黄薇, 陈叙图. 拉鲁湿地的生态服务功能及其退化原由的分析. 西部林业科学, 2008, 37(3): 41-45. |
| [9] | He JQ, Zhang GJ, Yue HM. Diversity and bioactivity analysis of actinomycetes isolated from Lhalu Wetland nature reserve. Journal of Microbiology, 2009(4): 6-10. (in Chinese) 何建清, 张格杰, 岳海梅. 拉鲁湿地自然保护区放线菌组成分析及生物活性测定. 微生物学杂志, 2009(4): 6-10. |
| [10] | De J, Wu XN, Suolang DQ, Duoji ZM, Wei EX. Study on diversity of soil bacteria in Lhalu Wetland. Journal of Tibet University (Natural Science), 2014, 29(2): 44-50. (in Chinese) 德吉, 吴小妮, 索朗德庆, 多吉卓玛, 韦恩喜. 拉鲁湿地土壤细菌多样性初探. 西藏大学学报(自然科学版), 2014, 29(2): 44-50. |
| [11] | Guo XF, Xiong N, Hao Z, Liang ZP, La B. Analysis on the correlations between yeast diversity, extracellular enzyme activity and physicochemical factors of soil in Lhalu Wetland, Lhasa. Journal of Tibet University (Natural Science), 2016, 31(2): 1-9. (in Chinese) 郭小芳, 熊宁, 郝兆, 梁泽鹏, 拉巴. 拉鲁湿地土壤理化因子与酵母菌多样性及产胞外酶活性相关性分析. 西藏大学学报(自然科学版), 2016, 31(2): 1-9. |
| [12] | Ba S, Huang X, Pu B, Ma ZX. Community characteristics of sarcodines and flagellates and water environment evaluation in Lhalu Wetlands. Wetland Science, 2014, 12(2): 182-191. (in Chinese) 巴桑, 黄香, 普布, 马正学. 拉鲁湿地肉鞭虫群落特征及其水环境评价. 湿地科学, 2014, 12(2): 182-191. |
| [13] | Liu XM, Zhuang DF, Qu R, Wan HW, Li J, Gao YH, Xiao T. Change of Lalu Wetlands from 1989 to 2009 based on remote sensing data. Wetland Science, 2013, 11(4): 433-437. (in Chinese) 刘晓曼, 庄大方, 屈冉, 万华伟, 李静, 高彦华, 肖桐. 基于遥感数据的1989-2009年拉鲁湿地变化研究. 湿地科学, 2013, 11(4): 433-437. |
| [14] | Nisiotou AA, Spiropoulos AE, Nychas G-JE. Yeast community structures and dynamics in healthy and Botrytis-affected grape must fermentations. Applied and Environmental Microbiology, 2007, 73(21): 6705-6713. DOI:10.1128/AEM.01279-07 |
| [15] | Kurtzman CP, Robnett CJ. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S) ribosomal DNA partial sequences. Antonie van Leeuwenhoek, 1998, 73(4): 331-371. DOI:10.1023/A:1001761008817 |
| [16] | Yang ZJ, Li LY, Hu BB, Lin LB, Wei YL, Ji XL, Zhang Q. Correlation between polyunsaturated fatty acids and cold adaptation of Rhodotorula glutinis. Chinese Journal of Applied & Environmental Biology, 2014, 20(2): 233-237. (in Chinese) 杨昭杰, 李凌彦, 胡彬彬, 林连兵, 魏云林, 季秀玲, 张琦. 多不饱和脂肪酸与粘红酵母低温适应性的关系. 应用与环境生物学报, 2014, 20(2): 233-237. |
| [17] | Fan ZQ, Li ZY, Dong MH, Zhou B, Ouyang YX, Yang LY, Li SL. Carotenoid-producing yeasts resources in Fuxian Lake, Yunnan. Microbiology China, 2017, 44(2): 296-304. (in Chinese) 樊竹青, 李治滢, 董明华, 周斌, 欧阳一星, 杨丽源, 李绍兰. 云南抚仙湖产类胡萝卜素酵母菌的资源调查. 微生物学通报, 2017, 44(2): 296-304. |
| [18] | Qiao FJ, Li JS, Ouyang YX, Li YY, Huang YH, Sun YJ, Chang R, Li BS. Progress in microbial oils produced by Rhodotorula glutinis. Science and Technology of Food Industry, 2014, 35(11): 391-395. (in Chinese) 乔凤杰, 李炯书, 欧阳亚旭, 李意颖, 黄永虹, 孙宜君, 常蓉, 李博生. 利用粘红酵母生产微生物油脂研究进展. 食品工业科技, 2014, 35(11): 391-395. |
| [19] | Zhong N, Zhang ZP, Zhang H, Zhang X, Tan TW. Domestication and screening of Rhodotorula glutinis with resistance to high chemical oxygen demand (COD) starch wastewater for lipid production. Journal of Beijing University of Chemical Technology (Natural Science Edition), 2013, 40(1): 84-88. (in Chinese) 钟娜, 张志平, 张华, 张栩, 谭天伟. 耐高COD淀粉废水的高产油脂粘红酵母的驯化和筛选. 北京化工大学学报(自然科学版), 2013, 40(1): 84-88. |
| [20] | Yuan M, Dong DM, Hua XY, Zhang LH. Comparison of Correlations between COD and TOC, PV and TOC, COD and PV of different river systems in Jilin province. Scientia Geographic Sanica, 2008, 28(2): 286-290. (in Chinese) 袁懋, 董德明, 花修艺, 张立辉. 吉林省不同水系的高锰酸盐指数、化学需氧量和总有机碳的相关关系比较. 地理科学, 2008, 28(2): 286-290. |
| [21] | Dong DM, Song X, Hua XY, Yuan M, Liang JH, Guo ZY, Liang DP. Relationship between COD and TOC of typical wasterwaters in Jilin province and mechanism and main influencing factors. Journal of Jilin University (Earth Science Edition), 2012, 42(5): 1446-1455. (in Chinese) 董德明, 宋兴, 花修艺, 袁懋, 梁建海, 郭志勇, 梁大鹏. 吉林省典型废水COD与TOC的相关关系及其形成机制和影响因素. 吉林大学学报(地球科学版), 2012, 42(5): 1446-1455. |
