胡晓辉, 汪琨, 朱廷恒


浙江工业大学生物工程学院, 浙江 杭州 310014
收稿日期:2017-07-26;修回日期:2017-10-18;网络出版日期:2017-10-23
基金项目:浙江省自然科学基金(Y18C140022)
*通信作者:朱廷恒, Tel:+86-571-88320741;E-mail:610292673@qq.com
摘要:胞吐体(Exocyst)是真核生物细胞内由8个亚基组成的复合体,在后高尔基体产生的分泌囊泡与细胞膜特定位置的定向与拴系过程中发挥重要作用。一些小G蛋白通过直接与胞吐体的亚基相互作用,对极性胞外分泌进行精确的时空调节。丝状真菌的生长是通过菌丝顶端的极性生长来完成的,并且具有极强的分泌蛋白质能力,是研究胞吐体的理想系统。胞吐体对丝状真菌的形态发生和致病性都有极大的影响。本文综述了当前在丝状真菌中胞吐体的研究进展,包括它的组成、亚基定位、相关功能和调控。
关键词: 丝状真菌 胞吐体 极性生长 致病性
Advances in exocyst complex in filamentous fungi
Xiaohui Hu, Kun Wang, Tingheng Zhu


College of Biological Engineering, Zhejiang University of Technology, Hangzhou 310014, Zhejiang Province, China
Received 26 July 2017; Revised 18 October 2017; Published online 23 October 2017
*Corresponding author: Tingheng Zhu, Tel:+86-571-88320741;E-mail:610292673@qq.com
Supported by the Zhejiang Provincial Natural Science Foundation of China (Y18C140022)
Abstract: Exocyst is an octameric protein complex that plays a crucial role in the docking and tethering of post-Golgi secretory vesicles to the plasma membrane in eukaryotic cell. The subunit of exocyst complex directly interacts with small GTPases and provides precise spatiotemporal regulation in polarized exocytosis. The growth of filamentous fungi is accomplished by polarized growth in hypha tip, and it possess strong ability of protein secretion. Filamentous fungi are ideal experimental system in study exocyst complex. Exocyst affects morphogenesis and pathogenesis in filamentous fungi. This review summarized current research on exocyst complex in filamentous fungi, including its composition, localization of subunit, function and regulation.
Key words: filamentous fungi exocyst polarized growth pathogenesis
丝状真菌分布广泛,而且与人类的关系密切。例如在工业上,利用丝状真菌极强的分泌能力生产酶、有机酸等物质。另一方面,丝状真菌也能引发农作物病害和人类疾病。丝状真菌的显著形态特征是产生丰富的营养菌丝,菌丝的延伸依赖于顶端的Spitzenk?rper (顶体)等结构进行的极性生长。极性生长需要将生长相关的物质不断向菌丝顶端的生长点运输。此外,丝状真菌具有极强的胞外分泌能力,已经开发成为高效的基因工程表达和分泌系统[1]。丝状真菌的极性生长和极性胞外分泌都与高效囊泡的转运系统有密切的联系,已经成为研究分泌囊泡转运机制的理想模式系统。随着丝状真菌功能基因组学和基因工程研究的迅速发展,对囊泡转运的认识也不断深入。
分泌囊泡的转运和分泌过程普遍存在于真核生物细胞中,是一个极其复杂的动态过程。这个过程依赖于分泌囊泡的出芽、转运、定向、拴系、锚定和融合等步骤,并直接参与细胞极性生长、激素分泌、神经信号传导和极性胞外分泌等生理过程[2]。同时,囊泡转运和分泌过程受到一系列蛋白质的调控,这些蛋白质相互作用形成了精密的调控网络,使得结合在粗面内质网上核糖体内合成的蛋白质,能在特定的时间被运输到特定的位置发挥功能。
在对分泌囊泡的转运进行了大量的研究后,发现在分泌囊泡与细胞膜的融合之前,会发生分泌囊泡与细胞膜的对接和拴系过程,这也是融合的基础[3]。目前发现有八类多亚基拴系复合体参与囊泡的拴系过程,其中研究最多也最为清楚的是胞吐体。胞吐体在进化上具有保守性,普遍存在于真核生物细胞中。目前国内外对丝状真菌中胞吐体的研究还处于起步阶段,相关的分子机制正在探索中。我们对丝状真菌中胞吐体的组成、各亚基的定位、相关功能以及调控等相关的研究进展进行了综述,希望对今后这个方向的研究有所帮助。
1 胞吐体的组成和定位 1.1 胞吐体的发现、组成和结构 1979年,Novick & Schekman分离出1株对温度敏感的酿酒酵母Saccharomyces cerevisiae突变菌株,电镜下观察发现细胞内积累大量分泌囊泡,表明细胞内有控制分泌囊泡介导的胞外分泌相关基因[4]。后又发现酵母细胞内有10个基因(sec1、sec2、sec3、sec4、sec5、sec6、sec8、sec9、sec10和sec15)编码的蛋白质,在分泌囊泡与细胞膜融合之前的定向和拴系过程中发挥作用[5]。在酵母细胞质中发现1种19.5 S的颗粒,从其中分离出2种蛋白质SEC8和SEC15,它们都能调控分泌囊泡与细胞膜的拴系[6]。免疫沉淀技术发现SEC6能与SEC8/SEC15一起沉淀,分析这3个蛋白质能够形成稳定结构的复合体。这个复合体至少是八肽[7]。对这个复合体的组成成分进行进一步的分离和纯化,发现了另外4个蛋白质SEC3、SEC5、SEC10和EXO70。于是将这个复合体命名为Exocyst (胞吐体)[8]。最后,在研究酵母细胞的有丝分裂过程中,发现EXO84也是胞吐体的组成成分,这个蛋白质对酵母的胞外分泌是必需的[9]。至此确定胞吐体是1个八聚体复合体。利用电子显微镜观察发现胞吐体任何亚基的突变都将引起细胞内积累大量分泌囊泡并阻断极性胞外分泌过程。
胞吐体的8个亚基都是亲水性的细胞溶质蛋白,晶体结构分析显示每个亚基都含有由多个α-螺旋串联形成的棒状结构区域。也有一部分亚基含有与调控蛋白结合的区域。SEC3的N末端还能与细胞膜上的PI(4, 5)P2结合。各亚基通过面对面(Side to side)的方式组装成八聚体,整个复合体的三维结构呈现出“Y”形,这与它的拴系功能有一定的联系[10]。
胞吐体在进化上具有保守性,在丝状真菌中也鉴定出了这个复合体,并且各亚基在全基因组中以单基因存在。在粗糙脉孢霉Neurospora crassa中,运用基因组数据库分析筛选出8个基因,将它们与GFP (绿色荧光蛋白)融合后,结合GFP亲和纯化和质谱分析实验,发现这8个亚基与酵母中胞吐体的8个亚基是同源蛋白,并且各亚基都含有由连续的螺旋卷曲形成的棒状结构[11]。表明丝状真菌中确实存在胞吐体。目前在多种丝状真菌中都已鉴定出含有胞吐体。丝状真菌中胞吐体的组成和结构与酵母是相似的。
1.2 胞吐体亚基的定位 胞吐体的亚基先分别在分泌囊泡和细胞膜上组合形成子复合体,当分泌囊泡到达细胞膜的时候再组装成完整的八聚体。在酿酒酵母中发现SEC5、SEC6、SEC8、SEC10、SEC15和EXO84一起结合在分泌囊泡的膜上,而SEC3和EXO70定位于酵母芽尖的细胞膜上。分泌囊泡由肌球蛋白Myo2p提供动力,沿着肌动蛋白束向细胞膜移动,到达后组装成完整的胞吐体,发挥拴系功能[12]。随后胞吐体促进存在于分泌囊泡上的V-SNARE和存在于细胞膜上的T-SNARE组装成SNARE(可溶性N-乙基马来酰亚胺敏感的融合蛋白附着蛋白受体)复合体,使得囊泡与细胞膜发生融合。SEC3被认为是胞吐体的空间标志,用胞松弛素A处理将肌动蛋白解聚后会阻断分泌囊泡的转运,使其他亚基无法定位,但是SEC3依然定位在细胞膜上[13]。
丝状真菌中胞吐体各亚基的定位与酵母相比有很大的不同。在稻瘟菌中,将GFP和EXO70进行融合,发现EXO70定位在营养菌丝和初生菌丝的顶端[14]。将GFP和EXO15融合后,用FM4-64染色进行共定位,发现EXO15定位在内质网上[15]。在粗糙脉孢霉中,通过将胞吐体各亚基基因和荧光蛋白基因融合,发现EXO70和EXO84定位于Spitzenk?rper外层靠近顶端一侧的囊泡上,先与定位于Spitzenk?rper和顶端细胞膜之间的SEC3结合,再与定位于细胞膜上的SEC5、SEC6、SEC8和SEC15结合,组装成完整的胞吐体[11],其模型如图 1所示。Spitzenk?rper是一个动态的球状结构,存在于快速生长的菌丝顶端位置,是分泌囊泡聚集和发送中心[16]。棉病囊霉的基因组与酿酒酵母的基因组相似性达到了92%,在其缓慢生长的菌丝中,观察到胞吐体和极体(Polarisome)一同定位在菌丝顶端呈现新月状。随着菌丝生长速度的增加,分泌囊泡在菌丝顶端积累,胞吐体转变成球状,并伴随Spitzenk?rper的形成[17]。运用光漂白荧光恢复和消失实验,在快速生长的白色念珠菌菌丝顶端,观察到分泌囊泡沿着肌动蛋白束向菌丝顶端转运,在菌丝顶端下部聚集,随后由Spitzenk?rper将囊泡发送出去。极体和胞吐体定位在菌丝顶端细胞膜上并形成新月状,极体具有使肌动蛋白成核的作用。用细胞松弛素A处理,将肌动蛋白解聚后,Spitzenk?rper消失,但是极体和胞吐体依然存在[18]。胞吐体定位于Spitzenk?rper和极体之间,这3个结构的位置和它们的功能是紧密联系的。Spitzenk?rper聚集和发出囊泡,胞吐体对囊泡进行定向和拴系,极体参与囊泡的定向和转运,三者分工合作,协同完成囊泡的运输过程。这些实验表明,在丝状真菌中胞吐体各亚基的定位与酵母相比是有区别的,各亚基的定位会随着生长速率的改变而发生变化。
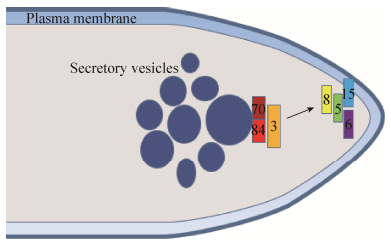 |
| 图 1 粗糙脉孢霉菌丝顶端胞吐体亚基的定位模型 Figure 1 The model for localization of exocyst subunit in Neurospora crassa hypha tip. |
| 图选项 |
2 胞吐体的功能 胞吐体的功能主要是在囊泡转运过程中将分泌囊泡和细胞膜进行拴系,这与极性胞外分泌有直接联系。极性胞外分泌过程可分成3个步骤:第一步,后高尔基体释放分泌囊泡,经由微管或肌动蛋白组成的运输系统,向细胞膜特定的位置转运。第二步,分泌囊泡与细胞膜特定位置发生拴系和锚定。第三步,在蛋白复合体SNARE的介导下,发生分泌囊泡和细胞膜的融合[19]。融合之后,分泌囊泡中的内含物有2个去向,一是加入到细胞膜上,二是分泌到细胞外环境中。丝状真菌中,胞吐体介导囊泡转运,参与的功能有很多,在这里主要涉及在极性生长和致病性中的作用。
2.1 胞吐体和丝状真菌的极性生长 丝状真菌的菌丝是由细长的细胞连接成链状形成,菌丝的生长是由菌丝顶端细胞的延伸完成的。在菌丝顶端的细胞中,生长位点只存在于顶端,在微管和动力蛋白的作用下,分泌囊泡将细胞生长所需要的物质运送到生长位点,最终形成细长的细胞,这是典型的极性生长。极性生长需要Spitzenk?rper、极体、胞吐体、微管、肌动蛋白和肌球蛋白等的参与。胞吐体能介导从后高尔基体发出的分泌囊泡与细胞膜的拴系,对丝状真菌的生长发育和形态发生有重要的影响。菌丝生长的速率越快,胞吐体就越活跃。在对构巢曲霉的研究中,运用荧光融合蛋白的时间推移成像技术,得到了一个菌丝顶端生长的模型。包含着细胞壁合成酶等物质的分泌囊泡,从后高尔基体释放,由驱动蛋白提供动力,沿着微管向菌丝顶端移动。先在菌丝顶端下部聚集形成Spitzenk?rper,再由肌球蛋白提供动力,沿着肌动蛋白束运输到菌丝顶端细胞膜特定位置。与细胞膜融合后,释放其内含物。最后,分泌囊泡由内吞过程返回到后高尔基体形成循环。Spitzenk?rper、微管和肌动蛋白束等结构是动态的,会随着菌丝的延伸而一同移动[20]。丝状真菌菌丝顶端由胞吐体等参与的极性生长模型如图 2所示。
 |
| 图 2 丝状真菌菌丝顶端的极性生长模型 Figure 2 The model for polarized growth in filamentous fungi hypha tip |
| 图选项 |
对丝状真菌胞吐体各亚基参与的生长发育调控研究也取得了一些进展。敲除白色念珠菌的Sec3基因后,发现分泌囊泡无法与菌丝顶端细胞膜特定位置拴系,菌丝生长速率大大减慢,形态异常。虽然萌发管能正常形成,但是在隔膜蛋白环形成后,菌丝顶端由原来的向一个方向的生长转变成向各个方向的生长,菌丝顶端膨胀成球形[21]。通过构建黑曲霉的GFP-v-SNARE报告菌株,发现敲除Sec3基因后生长速率减慢,菌丝顶端会出现膨胀。而在酵母中敲除Sec3基因会导致酵母的死亡,表明胞吐体介导的囊泡转运在酵母和丝状真菌中是不同的[22]。将白色念珠菌的Sec6基因放在四环素调控的启动子之下,条件性地控制Sec6基因的表达。发现在抑制Sec6基因表达的条件下,白色念珠菌在生存72 h后死亡。在培养到24 h后进行试验发现,细胞内积累分泌囊泡,菌丝侧向分枝生长大大减少,细胞壁结构异常[23]。相同的方法抑制Sec15基因的表达,发现白色念珠菌在5 h后死亡,对几丁质酶敏感,菌丝的分支增加,胞吐体定位异常[24]。丝状真菌的极性生长需要分泌囊泡运输相关的物质,胞吐体的异常会导致生长的减慢,并且由于定位错误会导致菌丝形态的异常。
2.2 胞吐体和丝状真菌的致病性 丝状真菌通常会向细胞外环境或者宿主细胞中分泌一些酶、毒素或者效应分子等物质,这些物质能帮助丝状真菌侵染宿主细胞,或者降低宿主的防御力,甚至是杀死宿主。在稻瘟菌中发现,胞吐体能调控细胞质效应分子的分泌,这种分子在BIC (活体营养界面复合体)中积累后释放到宿主细胞。无论是敲除Sec5基因还是Exo70基因都将阻断细胞质效应分子的分泌,极大的降低了它对水稻的致病性[14]。在新型隐球菌中运用RNA干扰技术敲低Sec6基因,会导致分泌囊泡无法转运,分泌到细胞外的毒力因子(例如漆酶、脲酶和水溶性多糖)大大减少,对小鼠的毒性也大大降低[25]。一般来说,带有信号肽的分泌蛋白,是通过内质网-高尔基体-细胞膜这条分泌途径分泌到细胞外,这是常规分泌途径。然而,在细胞内存在一些没有信号肽的分泌蛋白,它们的分泌需要另外一条非常规的分泌途径。大豆疫霉菌Phytophthora sojae的PsIsc1蛋白和棉花黄萎病菌Verticillium dahliae的VdIsc1蛋白都是是缺乏信号肽的蛋白质,这两种蛋白都是异分支酸酶效应分子,能破坏植物水杨酸的合成代谢途径,降低植物的免疫防御。实验表明胞吐体能调控非常规分泌途径,影响这两种蛋白分泌到宿主细胞中[26]。我们实验室利用根癌农杆菌Agrobacterium tumefaciens介导的T-DNA随机插入技术,获得了灰葡萄孢Sec5基因突变菌株,发现它的生长速率减慢,对番茄叶片的侵染下降,细胞内部积累分泌囊泡。其他亚基的功能研究正在进行中。以上实验表明丝状真菌极性胞外分泌是受胞吐体介导的,酶和毒素等的分泌直接与囊泡转运相联系,胞吐体对丝状真菌的致病性产生极大的影响。
3 胞吐体的调控 在真核生物细胞中对胞吐体的调控主要依靠小G蛋白,这是一类通过结合GTP激活和结合GDP失活的蛋白质,包括SEC4、RHO1、CDC42和RHO3等[27]。小G蛋白对胞吐体的调控可分为3个步骤:第一步,Rab和Ral直接与胞吐体的亚基结合,促进胞吐体的组装,使得分泌囊泡与细胞膜发生对接和拴系;第二步,Rho3、Cdc42激活胞吐体从而促进t-SNARE二聚体的组装和活化;第三步,活化的t-SNARE二聚体与囊泡上的v-SNARE结合,使得囊泡与膜发生融合[19]。胞吐体的SEC6亚基能直接与SNARE复合物结合,促进它的组装和活化,SNARE复合物使得分泌囊泡和细胞膜融合[28]。在灰葡萄孢Botrytis cinerea中,敲除Sec4基因后,灰葡萄孢的生长速率下降,孢子产生减少,对苹果和葡萄的毒力下降。细胞内部发现分泌囊泡在顶端的聚集,胞外蛋白的分泌大大减少。培养基中的细胞壁降解酶(多聚半乳糖醛酸酶和木聚糖酶)含量也下降[29]。在烟曲霉Aspergillus fumigatus中的Sec4同源基因敲除后,生长速率减慢,菌落形态出现多样化,分生孢子形态不规则,对环境刺激更加敏感[30]。新型隐球菌Cryptococcus neoformans中Sec4同源基因敲除后,发现细胞内积累分泌囊泡,生长减慢,蛋白质分泌减慢,荚膜多糖的分泌减少[31]。
此外,胞吐体也受到磷酸激酶的调控。在白色念珠菌中,EXO84能被Cdk1磷酸化,虽然这对EXO84的定位以及胞吐体的组装没有影响,但对其高效的菌丝延伸和正常的菌丝形态是必需的,同时会降低EXO84与磷脂的结合,促进它从细胞膜上分离而进入循环[32]。丝状真菌中存在着大量的对胞吐体调控的蛋白,这些蛋白分工合作形成复杂的调控网络,目前我们对这个网络如何精确调控胞吐体还不是很清楚。
4 展望 胞吐体是在酵母中发现的,目前的研究已经延伸到大多数真核生物中。但丝状真菌胞吐体的研究还不是很多,初步研究显示有比酵母更复杂的细胞定位、调控机制和功能。除了负责物质的胞外分泌外,也参与其他的一些细胞生理、生化过程。我们实验室正在进行灰葡萄孢的胞吐体亚基功能的研究,初步实验结果表明胞吐体参与了致病性。有研究表明胞吐体除了能调控囊泡分泌到细胞外,也能调控囊泡在细胞内部的转运,例如囊泡向液泡转运导致的自噬。以后可进一步研究胞吐体的整体结构、灰葡萄孢的自噬和胞吐体的关系等。
在丝状真菌中胞吐体各亚基的分子鉴定、亚基相互作用、复合体组装和解离及其调控、复合体与胞内膜系统的关系等相关的问题,是了解其结构及其功能的分子基础。在此基础上,对胞吐体参与真菌生长发育、分泌囊泡拴系、物质及致病因子运输和呈递、对宿主的识别和致病性、细胞自噬和程序性死亡等过程进行深入研究也是很有意义的。这些都是进一步深入解析胞吐体的作用及机制必需要回答的问题。
References
| [1] | Weld RJ, Plummer KM, Carpenter MA, Ridgway HJ. Approaches to functional genomics in filamentous fungi. Cell Research, 2006, 16(1): 31-44. DOI:10.1038/sj.cr.7310006 |
| [2] | Li L, Chin LS. The molecular machinery of synaptic vesicle exocytosis. Cellular and Molecular Life Sciences, 2003, 60(5): 942-960. DOI:10.1007/s00018-003-2240-7 |
| [3] | Whyte JR, Munro S. Vesicle tethering complexes in membrane traffic. Journal of Cell Science, 2002, 115(Pt 13): 2627-2637. |
| [4] | Novick P, Schekman R. Secretion and cell-surface growth are blocked in a temperature-sensitive mutant of Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences of the United States of America, 1979, 76(4): 1858-1862. DOI:10.1073/pnas.76.4.1858 |
| [5] | Novick P, Ferro S, Schekman R. Order of events in the yeast secretory pathway. Cell, 1981, 25(2): 461-469. DOI:10.1016/0092-8674(81)90064-7 |
| [6] | Bowser R, Müller H, Govindan B, Novick P. Sec8p and Sec15p are components of a plasma membrane-associated 19.5S particle that may function downstream of Sec4p to control exocytosis. The Journal of Cell Biology, 1992, 118(5): 1041-1056. DOI:10.1083/jcb.118.5.1041 |
| [7] | Terbush DR, Novick P. Sec6, Sec8, and Sec15 are components of a multisubunit complex which localizes to small bud tips in Saccharomyces cerevisiae. The Journal of Cell Biology, 1995, 130(2): 299-312. DOI:10.1083/jcb.130.2.299 |
| [8] | TerBush DR, Maurice T, Roth D, Novick P. The exocyst is a multiprotein complex required for exocytosis in Saccharomyces cerevisiae. The EMBO Journal, 1996, 15(23): 6483-6494. |
| [9] | Luo GZ, Zhang J, Luca FC, Guo W. Mitotic phosphorylation of Exo84 disrupts exocyst assembly and arrests cell growth. The Journal of Cell Biology, 2013, 202(1): 97-111. DOI:10.1083/jcb.201211093 |
| [10] | Heider MR, Munson M. Exorcising the exocyst complex. Traffic, 2012, 13(7): 898-907. DOI:10.1111/j.1600-0854.2012.01353.x |
| [11] | Riquelme M, Bredeweg EL, Callejas-Negrete O, Roberson RW, Ludwig S, Beltran-Aguilar A, Seiler S, Novick P, Freitag M. The Neurospora crassa exocyst complex tethers Spitzenk?rper vesicles to the apical plasma membrane during polarized growth. Molecular Biology of the Cell, 2014, 25(8): 1312-1326. DOI:10.1091/mbc.E13-06-0299 |
| [12] | Boyd C, Hughes T, Pypaert M, Novick P. Vesicles carry most exocyst subunits to exocytic sites marked by the remaining two subunits, Sec3p and Exo70p. The Journal of Cell Biology, 2004, 167(5): 889-901. DOI:10.1083/jcb.200408124 |
| [13] | Finger FP, Hughes TE, Novick P. Sec3p is a spatial landmark for polarized secretion in budding yeast. Cell, 1998, 92(4): 559-571. DOI:10.1016/S0092-8674(00)80948-4 |
| [14] | Giraldo MC, Dagdas YF, Gupta YK, Mentlak TA, Yi M, Martinez-Rocha AL, Saitoh H, Terauchi R, Talbot NJ, Valent B. Two distinct secretion systems facilitate tissue invasion by the rice blast fungus Magnaporthe oryzae. Nature Communications, 2013, 4: 1996. |
| [15] | Chen SM, Chen XF, Yang CD, Wang ZH, Zhou J. Bioinformatics analysis of exocyst complex and the subcellular localization of MoSec15 in Magnaporthe oryzae. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2014, 43(3): 282-288. (in Chinese) 陈四妙, 陈晓峰, 杨成东, 王宗华, 周洁. 稻瘟病菌分泌复合物的生物信息学分析及MoSec15定位研究. 福建农林大学学报(自然科学版), 2014, 43(3): 282-288. |
| [16] | Virag A, Harris SD. The Spitzenk?rper:a molecular perspective. Mycological Research, 2006, 110(Pt 1): 4-13. |
| [17] | K?hli M, Galati V, Boudier K, Roberson RW, Philippsen P. Growth-speed-correlated localization of exocyst and polarisome components in growth zones of Ashbya gossypii hyphal tips. Journal of Cell Science, 2008, 121(Pt23): 3878-3889. |
| [18] | Jones LA, Sudbery PE. Spitzenkorper, exocyst, and polarisome components in Candida albicans hyphae show different patterns of localization and have distinct dynamic properties. Eukaryotic Cell, 2010, 9(10): 1455-1465. DOI:10.1128/EC.00109-10 |
| [19] | Wu H, Rossi G, Brennwald P. The ghost in the machine:small GTPases as spatial regulators of exocytosis. Trends in Cell Biology, 2008, 18(9): 397-404. DOI:10.1016/j.tcb.2008.06.007 |
| [20] | Taheri-Talesh N, Horio T, Araujo-Bazán L, Dou XW, Espeso EA, Pe?alva MA, Osmani SA, Oakley BR. The tip growth apparatus of Aspergillus nidulans. Molecular Biology of the Cell, 2008, 19(4): 1439-1449. DOI:10.1091/mbc.E07-05-0464 |
| [21] | Li CR, Lee RT, Wang YM, Zheng XD, Wang Y. Candida albicans hyphal morphogenesis occurs in Sec3p-independent and Sec3p-dependent phases separated by septin ring formation. Journal of Cell Science, 2007, 120(Pt 11): 1898-1907. |
| [22] | Kwon MJ, Arentshorst M, Fiedler M, de Groen FL, Punt PJ, Meyer V, Ram AF. Molecular genetic analysis of vesicular transport in Aspergillus niger reveals partial conservation of the molecular mechanism of exocytosis in fungi. Microbiology, 2014, 160(Pt 2): 316-329. |
| [23] | Chavez-Dozal AA, Bernardo SM, Rane HS, Herrera G, Kulkarny V, Wagener J, Cunningham I, Brand AC, Gow NA, Lee SA. The Candida albicans exocyst subunit Sec6 contributes to cell wall integrity and is a determinant of hyphal branching. Eukaryotic Cell, 2015, 14(7): 769-771. |
| [24] | Chavez-Dozal AA, Bernardo SM, Rane HS, Lee SA. Functional analysis of the exocyst subunit Sec15 in Candida albicans. Eukaryotic Cell, 2015, 14(12): 1228-1239. DOI:10.1128/EC.00147-15 |
| [25] | Panepinto J, Komperda K, Frases S, Park Y-D, Djordjevic JT, Casadevall A, Williamson PR. Sec6-dependent sorting of fungal extracellular exosomes and laccase of Cryptococcus neoformans. Molecular Microbiology, 2009, 71(5): 1165-1176. DOI:10.1111/mmi.2009.71.issue-5 |
| [26] | Liu TL, Song TQ, Zhang X, Yuan HB, Su LM, Li WL, Xu J, Liu SH, Chen LL, Chen TZ, Zhang MX, Gu LC, Zhang BL, Dou DL. Unconventionally secreted effectors of two filamentous pathogens target plant salicylate biosynthesis. Nature Communications, 2014, 5: 4686. DOI:10.1038/ncomms5686 |
| [27] | Wu B, Guo W. The exocyst at a glance. Journal of Cell Science, 2015, 128(16): 2957-2964. DOI:10.1242/jcs.156398 |
| [28] | Dubuke ML, Maniatis S, Shaffer SA, Munson M. The exocyst subunit Sec6 interacts with assembled exocytic SNARE complexes. Journal of Biological Chemistry, 2015, 290(47): 28245-28256. DOI:10.1074/jbc.M115.673806 |
| [29] | Zhang ZQ, Qin GZ, Li BQ, Tian SP. Knocking out Bcsas1 in Botrytis cinerea impacts growth, development, and secretion of extracellular proteins, which decreases virulence. Molecular Plant-Microbe Interactions, 2014, 27(6): 590-600. DOI:10.1094/MPMI-10-13-0314-R |
| [30] | Powers-Fletcher MV, Feng XZ, Krishnan K, Askew DS. Deletion of the sec4 homolog srgA from Aspergillus fumigatus is associated with an impaired stress response, attenuated virulence and phenotypic heterogeneity. PLoS ONE, 2013, 8(6): e66741. DOI:10.1371/journal.pone.0066741 |
| [31] | Yoneda A, Doering TL. A eukaryotic capsular polysaccharide is synthesized intracellularly and secreted via exocytosis. Molecular Biology of the Cell, 2006, 17(12): 5131-5140. DOI:10.1091/mbc.E06-08-0701 |
| [32] | Caballero-Lima D, Sudbery PE. In Candida albicans, phosphorylation of Exo84 by Cdk1-Hgc1 is necessary for efficient hyphal extension. Molecular Biology of the Cell, 2014, 25(7): 1097-1110. DOI:10.1091/mbc.E13-11-0688 |
