邓曌曦1, 音建华2, 汪海峰1


1.浙江大学动物科学学院, 动物分子营养学教育部重点实验室, 浙江 杭州 310058;
2.浙江工业大学生物工程学院, 浙江 杭州 310014
收稿日期:2018-04-05;修回日期:2018-06-07;网络出版日期:2018-07-19
基金项目:国家自然科学基金(31672430);中央高校基本科研业务费专项(2017QNA6023)
作者简介:汪海峰, 浙江大学动物科学学院研究员。主要从事动物消化道微生物与营养代谢调控、饲用益生菌开发与作用机制研究。先后主持国家自然科学基金、国家星火计划重大项目、国家科技支撑计划子课题、浙江省农业重大专项、浙江省自然科学基金重点项目等研究。获浙江省科学技术奖1项,发表论文60余篇、著作4部、授权发明专利5项。任全国动物营养学会理事,入选科技部中青年科技创新领军人才、国家“****”领军人才。
*通信作者:汪海峰, Tel/Fax:+86-571-88982251, E-mail:haifengwang@zju.edu.cn
摘要:肠道内栖息着数量庞大且复杂的微生物菌群,是一个具有生物多样性的微环境,菌群在调节宿主肠道健康中发挥着重要作用。群体感应(quorum sensing,QS)是细菌间通过化学信号分子进行信息传递的重要方式。本文综述了QS系统组成、信号转导机制及AI-2/LuxS系统对肠道生物膜形成的调控,介绍了乳酸菌AI-2/LuxS QS系统及其在调控生物膜形成上的作用。通过肠道乳酸菌QS与生物膜形成综述分析,旨在为肠道屏障功能和健康调控提供新思路。
关键词: 肠道 群体感应 生物膜 乳酸菌
Progress in research on quorum sensing and intestinal biofilm formation of Lactobacillus
Zhaoxi Deng1, Jianhua Yin2, Haifeng Wang1


1.Key Laboratory of Animal Molecular Nutrition, Ministry of Education, College of Animal Science, Zhejiang University, Hangzhou 310058, Zhejiang Province, China;
2.College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, Zhejiang Province, China
Received 5 April 2018; Revised 7 June 2018; Published online 19 July 2018
*Corresponding author: Wang Haifeng, Tel/Fax:+86-571-88982251, E-mail:haifengwang@zju.edu.cn
Supported by the National Natural Science Foundation of China (31672430) and by the Fundamental Research Funds for the Central Universities (2017QNA6023)
Abstract: The intestine is a complicated microenvironment and hosts a large and complex flora of microorganisms, which plays an important role in host gut health. Quorum sensing is an important mechanism of information transmission among bacteria through chemical signal molecules. This article reviews the composition of quorum sensing system, signal transduction mechanism and the regulation of intestinal biofilm formation by AI-2/LuxS quorum sensing system. This review introduces the lactic acid bacteria AI-2/LuxS quorum sensing system and its role in the regulation of biofilm formation in intestine. The review will evoke new ideas for renovation of intestinal barrier function and intestinal health regulation.
Keywords: intestine quorum sensing biofilm Lactobacillus
肠道是一个具有生物多样性的微环境,栖息着数量庞大且复杂的微生物菌群,菌群对宿主健康有着重要作用,既影响食物消化、营养吸收和能量供应,又调控宿主正常生理和免疫功能。在肠道微生态环境中生存着100万亿个微生物,包括细菌、真菌、病毒、原虫等,其中超99%的都是细菌[1],许多研究将肠道微生物称为体内移动的器官。肠粘膜上皮屏障、肠道免疫细胞及其分泌物形成的免疫屏障和肠道微生物菌群共同形成的生物屏障保证肠道健康[2]。益生菌通过竞争性黏附与肠上皮细胞结合并形成生物膜,以增强肠道屏障免疫功能[3]。群体感应(quorum sensing,QS)是细菌利用信号分子进行信息交流的一种方式,通过释放、感知和响应小分子信号物质调控细菌的生理生化功能[4],包括生物膜的形成、毒力因子和细菌素的产生等。研究表明,大多数细菌生物膜的形成、发育及功能调节需要QS信号分子的参与,因此通过干扰细菌QS信号来促进或抑制细菌生物膜的形成,对调控肠道免疫、促进机体健康有着重要意义。本文立足肠道内细菌QS,结合本课题组的阶段性研究工作,系统综述乳酸菌QS与肠道生物膜形成间的关系。
1 QS系统及其机制 QS是细菌间通过化学信号分子进行信息传递的重要方式,由一定的信号分子、感应分子以及下游调控蛋白组成。当细菌感受到自身或周围菌体密度或环境发生改变时,细菌会分泌一种被称为自体诱导物(autoinducers,AIs)的信号分子到胞外。当AIs信号分子达到一定阈值后,被细菌特定的受体识别,最终激活靶基因表达,从而表现出单个细胞无法独立完成的某些生理功能,这一过程被称为QS[5]。本课题组采用生物发光方法检测乳酸菌呋喃酮酰硼酸二酯(AI-2)信号分子,将乳酸菌的培养上清液添加至只能感应AI-2信号分子引起生物发光现象的哈氏弧菌突变株BB170中,根据该菌的发光能力判断乳酸菌培养上清液中AI-2活性(未发表)。
QS系统根据信号分子主要分为三种类型(图 1):(1)革兰氏阴性菌由LuxI型蛋白编码产生的酰基高丝氨酸内酯(N-acyl-l-homoserine lactones,AHLs)信号分子,与胞内DNA受体蛋白LuxR结合后,调控基因表达。(2)革兰氏阳性菌一般以自诱导肽(autoinducing peptides,AIPs)作为信号分子,借助ABC转运系统(ATP-binding cassette)或其他膜通道蛋白协助跨膜,实现种内的细胞交流。(3) AI-2/LuxS系统介导的种内和种间通讯,AI-2信号分子由LuxS蛋白催化合成,luxS基因广泛存在于G+和G–细菌中,具有较高的同源保守性[6]。除此以外,近年来在某些细菌中相继发现了新的信号分子,例如肠出血性大肠杆菌(EHEC)能产生一种自体诱导物3 (AI-3),通过QS系统调控该菌的运动、黏附及致病性。研究发现肾上腺素/去甲肾上腺素能诱导产生与肠出血性大肠杆菌相似的毒力基因,肾上腺素受体阻断剂也能够抑制AI-3的表达[7-8]。因此,推断AI-3在结构上可能类似于肾上腺素/去甲肾上腺素[9]。另外,信号分子N-(3-氧代十二烷酰)-1-高丝氨酸内酯(ODHL)能对哺乳动物宿主细胞产生不利影响,并证实ODHL可能通过改变膜电位,引起哺乳动物宿主细胞超极化,进而干扰淋巴细胞功能[10-11]。
 |
| 图 1 不同类别的自体诱导物[12] Figure 1 Different classes of autoinducers[12]. The figure shows three classes of molecules used as autoinducers. A: Representative acyl-homoserine lactone autoinducers used by Gram-negative bacteria; B: Representative oligopeptide autoinducers used by Gram-positive bacteria; C: The general structure of the 3(2H) class of furanones. A 3(2H)-furanone is suspected to be the LuxS-dependent autoinducer called AI-2. ★ Sign on the Bacillus subtilis ComX oligopeptide autoinducer represents a modification of unknown structure. |
| 图选项 |
2 乳酸菌QS 乳酸菌是一类能利用可发酵碳水化合物产生乳酸的革兰氏阳性菌,具有耐酸、产酸[13]、抑制病原微生物生长[14]和调节机体胃肠道微生态平衡[15]等作用。乳酸菌作为G+菌,其QS系统由自诱导信号感知细胞间讯息。近年来研究发现,乳酸菌生物膜形成能力、肠道定殖能力等重要特性均受QS系统的影响和调控[16]。
2.1 乳酸菌QS信号分子 乳酸菌QS系统以细胞密度依赖方式进行交流,大体分为种内信息交流和种间信息交流两种。种内信息交流以AIPs作为信号分子,前体AIPs转录后经修饰加工形成特异性AIPs,其不能自由穿过细胞壁,需经ABC转运系统或其他膜通道蛋白到达胞外,当达到一定浓度时,AIPs激活TCS系统,进而调控目标基因的表达。
种间信号交流是不同种细菌细胞间的信号通讯方式,以AI-2作为信号分子,大量研究显示G-和G+中都存在着以AI-2信号分子感知环境变化的AI-2/LuxS QS调节机制[17],其在多种细菌的种内和种间信息交流中发挥重要作用,现已证明参与QS的luxS基因调控乳酸菌的多种生理活动[18]。根据现有报道,AI-2的合成有两条途径,一是通常途径,以甲硫氨酸作为起始物,经四步酶促反应产生。甲硫氨酸在S-腺苷甲硫氨酸合成酶(MetK)的催化作用下产生S-腺苷甲硫氨酸(S-adenosylmethionine,SAM),以SAM作为甲基供体在甲基转移酶(MT)作用下生成S-腺苷高半胱氨酸(S-adenosylhomocysteine,SAH),SAH被S-腺苷高半胱氨酸核苷酸酶(Pfs)水解成S-核苷高半胱氨酸(SRH)和腺嘌呤,SRH在LuxS蛋白作用下生成高半胱氨酸和4, 5二羟基-2, 3-戊二酮(DPD),前者进一步生成甲硫氨酸进入甲基循环,而DPD经重排合成AI-2[19]。在这条路线中,Pfs可能比LuxS对于AI-2的产生贡献更大[20]。另一种是从极端嗜热菌推导出的半生物合成途径。在无LuxS只有Pfs条件下,极端嗜热菌利用SAH水解酶将SAH切割成腺苷和高半胱氨酸,腺苷被核苷磷酸化酶转化为核糖-1-磷酸,磷酸糖变位酶将其异构化为核糖-5-磷酸,通过热诱导进一步将核糖-5-磷酸转化为DPD和AI-2。但也有研究提出,以核酮糖-5-磷酸代替核糖-5-磷酸,也能在缺少LuxS的条件下转化为AI-2[21](图 2)。
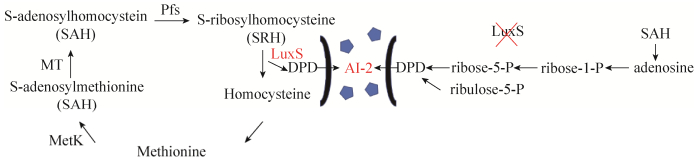 |
| 图 2 AI-2信号分子合成途径[21-22] Figure 2 AI-2 synthesis pathway[21-22]. |
| 图选项 |
2.2 AI-2/LuxS QS系统 目前,哈氏弧菌中的AI-2/LuxS QS系统研究较为清楚,因此,以此为例进行叙述。哈氏弧菌能产生两种自体诱导物,分别为AI-1和AI-2。AI-1由luxLM基因编码产物催化产生,其本质是一种AHLs[23],感应分子为LuxN。AI-2由LuxS蛋白催化合成,之后被感应分子LuxP和LuxQ识别,LuxQ通过LuxU来实现信号传递。LuxU是一种磷酸转移酶,活化后将信号传递至调节蛋白LuxO。LuxO是一种依赖σ54的转录活化子,它的功能可能是诱导荧光素酶结构操纵子(luxCDABE)抑制物的表达。在低细胞密度下(图 3-A),不存在AI-1或AI-2,LuxQ为自主磷酸化激酶,将磷酸传给LuxU后再传递给LuxO。LuxO磷酸化后被激活与σ54结合,抑制luxCDABE的表达,细菌不发光。在高细胞密度下(图 3-B),AI-1和AI-2含量增加,LuxQ从激酶转化为磷酸酶。在磷酸酶作用下,LuxQ通过LuxU从LuxO处得到一个磷酸导致脱磷酸的LuxO失活,失活的LuxO不再催化luxCDABE操纵子的抑制子产生。同时,在另一个基因产物LuxR共同作用下,luxCDABE操纵子转录,细菌发光[24]。最近报道称,在肠道中AI-2信号传导促进了抗生素处理后厚壁菌体的增殖,这表明群体感应在一定程度上促进微生物菌群的形成[25]。
 |
| 图 3 AI-2/LuxS群体感应系统[24] Figure 3 The AI-2/LuxS quorum sensing system[24]. Quorum sensing system of V. harveyi in low (A) and high cell density (B), respectively. H, D and HTH denote histidine, aspartate and helix-turn-helix, respectively. The "P" in the circle indicates phosphorylation in signal transduction. Phosphate flow in the forward direction goes from histidine (H1) to aspartate (D1) to histidine (H2) to aspartate (D2). AI-1 and AI-2 are depicted as triangles and pentagons, respectively. |
| 图选项 |
3 QS介导乳酸菌生物膜的形成 乳酸菌生物膜的形成是菌体在肠道内逐渐由可逆的粘附转变为不可逆的积累,其通过QS系统和菌体间的相互作用进行控制,使得这部分菌体与浮游状态下的菌体相比,生物膜表层细菌会分泌更多有机基质到胞外,以提高菌体的粘附性,进一步提高乳酸菌定殖于肠道内形成生物膜的能力[26]。对于乳酸菌,QS系统主要在生物膜形成的生长期和扩散期发挥作用[27]。目前研究发现,80%以上的人类细菌感染疾病都与细菌生物膜的形成有关。因此,通过QS系统抑制致病细菌或促进益生菌生物膜的形成,有利于增强机体肠道内的免疫与健康[28]。研究证明生物膜形成的关键在于细胞粘附性的提高,在没有葡萄糖的MRS培养基中添加粘蛋白使鼠李糖乳酸杆菌(Lactobacillus rhamnosus GG,LGG)生物膜形成能力提高了20%[29]。同时,研究通过获得含胞外多糖合成相关基因的鼠李糖乳酸杆菌突变株与野生型相比,其生物膜形成能力也相应提高[30]。因此,粘附性的提高在一定程度上有助于菌体的积累,进而促进生物膜的形成与成熟。
在植物乳杆菌(Lactobacillus plantarum) WCFS1中发现了与金黄色葡萄球菌中调控生物膜形成相似的QS系统,即lamBDCA系统。lamBDCA系统通常可自动调节,并且通过lamA基因参与调节编码表面多糖、细胞膜蛋白和糖利用蛋白基因的表达,暗示QS可能介导乳酸菌生物膜的形成[31]。研究通过位点特异性整合,在嗜酸乳酸杆菌luxS基因位点处产生相同基因突变,其粘附于肠表皮细胞的能力下降了58%,同时,所得LuxS突变菌株不产生AI-2信号分子[32]。因此,推测luxS基因在增强细胞粘附性和AI-2信号分子产生中发挥了一定作用。研究显示,在鼠李糖乳酸杆菌中,luxS基因缺失突变株生物膜形成能力下降,外源添加AI-2前体分子或野生型菌株在一定程度上能协助突变株生物膜的形成[30],这为QS介导乳酸菌生物膜形成提供了一定证据。随后,研究发现luxS基因缺失的鼠李糖乳酸杆菌CMPG5412和CMPG5413突变株在介质中形成生物膜的能力均下降[33]。但罗伊氏乳酸杆菌(L. reuteri) 100-23C luxS基因缺失株形成的生物膜却比野生型菌株厚,添加外源AI-2也不能恢复到野生型菌株生物膜的厚度[34]。
近年来,国内外对AI-2/LuxS QS系统介导生物膜形成进行了广泛的研究,相关报道较多。表皮葡萄球菌RP62A (Staphylococcus epidermidis RP62A)中生物膜形成随着外源AI-2信号分子的增加而显著加厚,并且AI-2信号分子是通过促进生物膜相关基因icaR的表达来促进生物膜的形成[35]。鸭疫里默氏杆菌(Riemerella anatipestifer,RA)含pfs基因而不含luxS基因,利用V. harveyi BB170报告菌株法证实RA本身不产生AI-2信号分子,但可利用外源AI-2抑制生物膜的形成;当在RA培养基中添加外源AI-2信号分子时,与生物膜形成相关的13个基因的表达量均显著降低,生物膜生成量也显著降低,显示外源AI-2信号分子抑制了RA生物膜的形成[36]。可见,AI-2/LuxS QS系统对不同微生物生物膜形成调控是不尽相同的,有待针对性地进行深入研究。本课题组拟利用同源重组法获得luxS基因缺失株,实现AI-2信号分子缺失,将进一步用于研究乳酸菌AI-2/LuxS QS系统在其生物膜形成及与肠道粘附中的作用(未发表)。
最新的研究发现,AphA是致病性弧菌在低细胞密度下的主要QS调节子,作为生物膜形成的激活剂,也能直接抑制假定的膜融合转运蛋白(MfpABC)的表达。MfpABC在副溶血性弧菌生物膜发育中起主要作用。另外,MfpABC在高细胞密度中大量产生,这表明MfpABC不仅促进生物膜的发育,而且在生长和发病的中期或后期阶段发挥作用[37]。研究发现,金黄色葡萄球菌中编码AI-2合酶的LuxS失活会导致生物膜增厚,多糖细胞间粘附性增强[38]。LuxS突变体中控制生物膜形成的正调控因子rbf的转录水平显著增加。同时,所有的亲本表型可以通过遗传互补和化学合成的AI-2前体分子来恢复,这表明AI-2通过信号传导来调节rbf转录和生物膜的形成。研究也证实利血平能通过下调QS基因和阻断QS调节因子来抑制生物膜的形成,从而减少毒力因子的产生,可成为改进药理学应用的药物[39]。因此,QS系统对生物膜形成的调控在新的抗菌药物开发领域中具有广泛应用前景。
4 结语与展望 目前对生物膜的研究己深入到细菌间的信号传递、致病基因的转移及干扰和破坏生物膜形成等方面[40]。近年来,细菌QS系统更是成为研究热点,大量研究已证实QS系统能对包括细菌生物膜形成在内的各种生理生化行为进行调控,但大部分研究集中在QS系统如何控制致病菌生物膜的形成,对于如何调控益生菌生物膜形成研究甚少。因此,聚焦QS系统调控益生菌生物膜形成的分子机制,对益生菌在肠道内发挥最大效益具有重要作用。本课题组致力于乳酸菌群体感应与肠道生物膜形成及其机制的研究,借助luxS基因敲除实现AI-2信号分子缺失,研究乳酸菌AI-2/LuxS QS系统在调控生物膜形成上的功能作用,为肠道屏障功能和肠道健康调控提供新思路。以期通过控制QS靶向调控肠道菌群与生物膜提供理论基础,提出更为合理有效的调控措施,这对促进肠道健康、减少肠道疾病具有实际意义,对创新动物健康调控技术具有重要启示意义。
References
| [1] | Zhou DY, Pan LJ. Intestinal flora disorders and treatment progress. Gastroenterology, 2001, 6(4): 附2-附4. (in Chinese) 周殿元, 潘令嘉. 肠道菌群失调及治疗进展. 胃肠病学, 2001, 6(4): 附2-附4. DOI:10.3969/j.issn.1008-7125.2001.04.037 |
| [2] | Turner JR. Intestinal mucosal barrier function in health and disease. Nature Reviews Immunology, 2009, 9(11): 799-809. DOI:10.1038/nri2653 |
| [3] | Ohland CL, Macnaughton WK. Probiotic bacteria and intestinal epithelial barrier function. American Journal of Physiology Gastrointestinal and Liver Physiology, 2010, 298(6): G807-G819. DOI:10.1152/ajpgi.00243.2009 |
| [4] | Papenfort K, Bassler BL. Quorum sensing signal-response systems in Gram-negative bacteria. Nature Reviews Microbiology, 2016, 14(9): 576-588. DOI:10.1038/nrmicro.2016.89 |
| [5] | Waters CM, Bassler BL. Quorum sensing: cell-to-cell communication in bacteria. Annual Review of Cell and Developmental Biology, 2005, 21: 319-346. DOI:10.1146/annurev.cellbio.21.012704.131001 |
| [6] | Chen X, Schauder S, Potier N, Van Dorsselaer A, Pelczer I, Bassler BL, Hughson FM. Structural identification of a bacterial quorum-sensing signal containing boron. Nature, 2002, 415(6871): 545-549. DOI:10.1038/415545a |
| [7] | Zhang Y, Wang Y, Chen SY. Advances on quorum sensing AI-2 signal molecular. China Biotechnology, 2005, 25(9): 14-18. (in Chinese) 张勇, 王瑶, 陈士云. 群体感应信号分子AI-2研究进展. 中国生物工程杂志, 2005, 25(9): 14-18. |
| [8] | Henke JM, Bassler BL. Bacterial social engagements. Trends in Cell Biology, 2004, 14(11): 648-656. DOI:10.1016/j.tcb.2004.09.012 |
| [9] | Guo J, Li MY, Sun P. Bacterial quorum sensing and its research progress. International Journal of Laboratory Medicine, 2012, 33(1): 58-60. (in Chinese) 郭静, 李慕岩, 孙朋. 细菌群体感应及其研究进展. 国际检验医学杂志, 2012, 33(1): 58-60. DOI:10.3969/j.issn.1673-4130.2012.01.025 |
| [10] | Vikstr?m M, Tafazoli F, Magnusson KE. Pseudomonas aeruginosa quorum sensing molecule N-(3 oxododecanoyl)- L-homoserine lactone disrupts epithelial barrier integrity of Caco-2 cells. FEBS Letters, 2006, 580(30): 6921-6928. DOI:10.1016/j.febslet.2006.11.057 |
| [11] | Nishimura-Danjobara Y, Oyama K, Kanemaru K, Takahashi K, Yokoigawa K, Oyama Y. N-(3-oxododecanoyl)-L- homoserine-lactone, a quorum sensing molecule, affects cellular content of nonprotein thiol content in rat lymphocytes: Its relation with intracellular Zn2+. Chemico-Biological Interactions, 2017, 280: 28-32. |
| [12] | Bassler BL. Small talk: cell-to-cell communication in bacteria. Cell, 2002, 109(4): 421-424. DOI:10.1016/S0092-8674(02)00749-3 |
| [13] | Kaavessina M, Khanifatun F, Alzahrani SM. Lactic acid production from date juice using Lactobacillus casei ATCC 393 in batch fermentation. MATEC Web of Conferences, 2017, 101: 02002. DOI:10.1051/matecconf/201710102002 |
| [14] | Montiel R, Martin-Cabrejas I, Langa S, El Aouad N, Arqués JL, Reyes F, Medina M. Antimicrobial activity of reuterin produced by Lactobacillus reuteri on Listeria monocytogenes in cold-smoked salmon. Food Microbiology, 2014, 44: 1-5. DOI:10.1016/j.fm.2014.05.006 |
| [15] | Endo A, Nakamura S, Konishi K, Nakagawa J, Tochio T. Variations in prebiotic oligosaccharide fermentation by intestinal lactic acid bacteria. International Journal of Food Sciences and Nutrition, 2016, 67(2): 125-132. DOI:10.3109/09637486.2016.1147019 |
| [16] | Cui YH, Qu XJ. Cross-talk between lactic acid bacteria. Chemistry of Life, 2009, 29(3): 447-450. (in Chinese) 崔艳华, 曲晓军. 乳酸菌的群体交流. 生命的化学, 2009, 29(3): 447-450. |
| [17] | Jiang LM, Kang ZT, Liu CJ, Li XR, Luo YY. The research advances of AI-2/LuxS quorum sensing system mediating Lactobacillus probiotic properties. Chinese Bulletin of Life Sciences, 2014, 26(4): 414-418. (in Chinese) 姜黎明, 康子腾, 柳陈坚, 李晓然, 罗义勇. AI-2/LuxS群体感应系统介导乳酸杆菌益生特性研究进展. 生命科学, 2014, 26(4): 414-418. |
| [18] | Jiang LM, Song XD, Liu CJ, Luo YY. Cloning and expression characteristics of Lactobacillus plantarum LuxS gene and its relationship with antibacterial activity. In: Proceedings of the International Symposium on Lactic Acid Bacteria and Health.Shanghai: China Food Science and Technology Society, 2015. (in Chinese) 姜黎明, 宋晓东, 柳陈坚, 罗义勇.植物乳杆菌LuxS基因的克隆、表达特性及其与抑菌的关联性研究//2015年第十届乳酸菌与健康国际研讨会论文集.上海: 中国食品科学技术学会, 2015. |
| [19] | de Keersmaecker SCJ, Varszegi C, Van Boxel N, Habel LW, Metzger K, Daniels R, Marchal K, de Vos D, Vanderleyden J. Chemical synthesis of (S)-4, 5-dihydroxy-2, 3-pentanedione, a bacterial signal molecule precursor, and validation of its activity in Salmonella typhimurium. Journal of Biological Chemistry, 2005, 280(20): 19563-19568. DOI:10.1074/jbc.M412660200 |
| [20] | Wang Y, Li Y, Zhang ZC, Fan HJ, Cheng XC, Lu CP. Overexpression of luxS cannot increase autoinducer-2 production, only affect the growth and biofilm formation in Streptococcus suis. Scientific World Journal, 2013, 2013: 924276. |
| [21] | Zhao J, Quan CS, Jin LM, Chen M. Production, detection and application perspectives of quorum sensing autoinducer-2 in bacteria. Journal of Biotechnology, 2018, 268: 53-60. DOI:10.1016/j.jbiotec.2018.01.009 |
| [22] | Di Cagno R, De Angelis M, Calasso M, Gobbetti M. Proteomics of the bacterial cross-talk by quorum sensing. Journal of Proteomics, 2011, 74(1): 19-34. DOI:10.1016/j.jprot.2010.09.003 |
| [23] | Bassler BL, Wright M, Showalter RE, Silverman MS. Intercellular signalling in Vibrio harveyi: sequence and function of genes regulating expression of luminescence. Molecular Microbiology, 1993, 9(4): 773-786. DOI:10.1111/mmi.1993.9.issue-4 |
| [24] | Mok KC, Wingreen NS, Bassler BL. Vibrio harveyi quorum sensing: a coincidence detector for two autoinducers controls gene expression. The Embo Journal, 2014, 22(4): 870-881. |
| [25] | Thompson JA, Oliveira RA, Djukovic A, Ubeda C, Xavier KB. Manipulation of the quorum sensing signal AI-2 affects the antibiotic-treated gut microbiota. Cell Reports, 2015, 10(11): 1861-1871. DOI:10.1016/j.celrep.2015.02.049 |
| [26] | Li YH, Tian XL. Quorum sensing and bacterial social interactions in biofilms. Sensors, 2012, 12(3): 2519-2538. DOI:10.3390/s120302519 |
| [27] | Gan XF, Li MY. Research progress on biofilm and biofilm-forming bacterium. Journal of Anhui University Natural Science Edition, 2007, 31(6): 91-94. (in Chinese) 干霞芳, 李蒙英. 生物膜和生物膜形成菌的研究. 安徽大学学报(自然科学版), 2007, 31(6): 91-94. DOI:10.3969/j.issn.1000-2162.2007.06.024 |
| [28] | Romero R, Schaudinn C, Kusanovic JP, Gorur A, Gotsch F, Webster P, Nhan-Chang CL, Erez O, Kim CJ, Espinoza J, Gon alves LF, Vaisbuch E, Mazaki-Tovi S, Hassan SS, Costerton JW. Detection of a microbial biofilm in intraamniotic infection. American Journal of Obstetrics and Gynecology, 2008, 198(1): 135.e1-135.e5. DOI:10.1016/j.ajog.2007.11.026 |
| [29] | Lebeer S, Verhoeven TLA, Vélez MP, Vanderleyden J, de Keersmaecker SCJ. Impact of environmental and genetic factors on biofilm formation by the probiotic strain Lactobacillus rhamnosus GG. Applied and Environmental Microbiology, 2007, 73(21): 6768-6775. DOI:10.1128/AEM.01393-07 |
| [30] | Lebeer S, Verhoeven TLA, Francius G, Schoofs G, Lambrichts I, Dufrêne Y, Vanderleyden J, de Keersmaecker SCJ. Identification of a gene cluster for the biosynthesis of a long, galactose-rich exopolysaccharide in Lactobacillus rhamnosus GG and functional analysis of the priming glycosyltransferase. Applied and Environmental Microbiology, 2009, 75(11): 3554-3563. DOI:10.1128/AEM.02919-08 |
| [31] | Sturme MHJ, Nakayama J, Molenaar D, Murakami Y, Kunugi R, Fujii T, Vaughan EE, Kleerebezem M, de Vos WM. An agr-like two-component regulatory system in Lactobacillus plantarum is involved in production of a novel cyclic peptide and regulation of adherence. Journal of Bacteriology, 2005, 187(15): 5224-5235. DOI:10.1128/JB.187.15.5224-5235.2005 |
| [32] | Buck BL, Azcarate-Peril MA, Klaenhammer TR. Role of autoinducer-2 on the adhesion ability of Lactobacillus acidophilus. Journal of Applied Microbiology, 2009, 107(1): 269-279. DOI:10.1111/jam.2009.107.issue-1 |
| [33] | Lebeer S, de Keersmaecker SCJ, Verhoeven TLA, Fadda AA, Marchal K, Vanderleyden J. Functional analysis of LuxS in the probiotic strain Lactobacillus rhamnosus GG reveals a central metabolic role important for growth and biofilm formation. Journal of bacteriology, 2007, 189(3): 860-871. DOI:10.1128/JB.01394-06 |
| [34] | Tannock GW, Ghazally S, Walter J, Loach D, Brooks H, Cook G, Surette M, Simmers C, Bremer P, Bello FD, Hertel C. Ecological behavior of Lactobacillus reuteri 100-23 is affected by mutation of the luxS gene. Applied and Environmental Microbiology, 2005, 71(12): 8419-8425. DOI:10.1128/AEM.71.12.8419-8425.2005 |
| [35] | Xue T, Ni JT, Shang F, Chen XL, Zhang M. Autoinducer-2 increases biofilm formation via an ica- and bhp-dependent manner in Staphylococcus epidermidis RP62A. Microbes and Infection, 2015, 17(5): 345-352. DOI:10.1016/j.micinf.2015.01.003 |
| [36] | Han XG, Lei L, Fan GB, Zhang YX, Xu D, Zuo JK, Wang SH, Wang XL, Tian MX, Ding C, YU SQ. Riemerella anatipestifer lacks luxS, but can uptake exogenous autoinducer-2 to regulate biofilm formation. Research in Microbiology, 2015, 166(6): 486-493. DOI:10.1016/j.resmic.2015.06.004 |
| [37] | Lu RF, Osei-Adjei G, Huang XX, Zhang YQ. Role and regulation of the orphan AphA protein of quorum sensing in pathogenic Vibrios. Future Microbiology, 2018, 13(3): 383-391. DOI:10.2217/fmb-2017-0165 |
| [38] | Ma RH, Qiu SW, Jiang Q, Sun HP, Xue T, Cai G, Sun BL. AI-2 quorum sensing negatively regulates rbf expression and biofilm formation in Staphylococcus aureus. International Journal of Medical Microbiology, 2017, 307(4/5): 257-267. |
| [39] | Parai D, Banerjee M, Dey P, Chakraborty A, Islam E, Mukherjee SK. Effect of reserpine on Pseudomonas aeruginosa quorum sensing mediated virulence factors and biofilm formation. Biofouling, 2018, 34(3): 320-334. DOI:10.1080/08927014.2018.1437910 |
| [40] | Jia WX. Progress in microbial biofilm research. Progress in Microbiology and Immunology, 2012, 40(5): 1-9. (in Chinese) 贾文祥. 微生物生物膜研究的新进展. 微生物学免疫学进展, 2012, 40(5): 1-9. DOI:10.3969/j.issn.1005-5673.2012.05.001 |
