董旭日1, 柴旭锋1, 檀玲1, 齐家伟1, 刘海泉1, 潘迎捷1,2,3, 赵勇1,2,3


1.上海海洋大学食品学院, 上海 201306;
2.农业部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306;
3.上海水产品加工及贮藏工程技术研究中心, 上海 201306
收稿日期:2017-12-28;修回日期:2018-03-22;网络出版日期:2018-05-28
基金项目:国家自然科学基金(31571917, 31671779);上海市科技兴农重点攻关项目[沪农科攻字2015第4-8号, 2016第1-1号, 沪农科推字(2017)第4-4号]; 上海市“曙光计划”(15SG48);上海市教育委员会科研创新计划资助(2017-01-07-00-10-E00056)
*通信作者:赵勇, Tel:+86-21-61900503, E-mail:yzhao@shou.edu.cn
摘要:[目的]研究副溶血性弧菌(Vibrio parahaemolyticus,VP)和霍乱弧菌(Vibrio cholera,VC)混合生物被膜的形成过程。[方法]在4、8、12、24、36、48、60、72 h测定单独条件下VP、VC及其混合后生物被膜的形成情况,通过结晶紫染色法、平板菌落计数法、测定胞外多糖、胞外蛋白,通过荧光原位杂交(FISH)观察混合生物被膜形成。[结果]虽然形成的混合生物被膜量介于VC和VP之间,但混合生物被膜在形成过程中,成熟期后生物被膜量的变化较小,对环境的抗性增强。混合生物被膜中拥有更多的活菌,混合生物被膜形成过程中胞外蛋白和胞外多糖的变化体现出其可能在对抵御不适应环境中起重要作用,通过FISH可观察到不同时期生物被膜的变化过程。[结论]VC与VP共同形成生物被膜的过程中,混合生物被膜总量虽然减少,但混合生物被膜中拥有更多的活菌,这可能引起更大的危害。研究混合生物被膜形成过程中被膜的变化,可为有害生物被膜的控制提供基础。
关键词: 副溶血性弧菌 霍乱弧菌 混合生物被膜 荧光原位杂交
Dynamic biofilm forming process of Vibrio parahaemolyticus and Vibrio cholera
Xuri Dong1, Xufeng Chai1, Ling Tan1, Jiawei Qi1, Haiquan Liu1, Yingjie Pan1,2,3, Yong Zhao1,2,3


1.College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;
2.Safety Risk Assessment Laboratory of Aquatic-Product Processing & Preservation, Ministry of Agriculture, Shanghai 201306, China;
3.Engineering Research Center of Food Thermal-Processing Technology, Shanghai Ocean University, Shanghai 201306, China
Received 28 December 2017; Revised 22 March 2018; Published online 28 May 2018
*Corresponding author: Yong Zhao, Tel: +86-21-61900503; E-mail: yzhao@shou.edu.cn
Supported by the National Natural Science Foundation of China (31571917, 31671779), by the Key Project of Shanghai, Agriculture Prosperity through Science and Technology [G20150408, G20160101, T20170404], by the "Dawn" Program of Shanghai Education Commission (15SG48) and by the Innovation Program of Shanghai Municipal Education Commission (2017-01-07-00-10-E00056)
Abstract: [Objective]We studied the formation of a mixed biofilm formed by Vibrio parahaemolyticus and Vibrio cholerae.[Methods]Biofilm formation was quantified using crystal violet staining, abundance of extracellular polysaccharide and extracellular protein, fluorescence in situ hybridization and colony plate count. Biofilms formed by individual and mixed strains were determined from the start and the following intervals at 4, 8, 12, 24, 36, 48, 60 and 72 h.[Results]The amount of biofilm produced by the mixed strains was less than the total amount of biofilm produced by the individual strains, indicating there was no synergism between the strains. However, in the mixed biofilm the time of maturation was increased, the stability of the biofilm to external perturbation was enhanced and the cell density was higher.[Conclusion]The biofilm formed by a mixed population of V. parahaemolyticus and V. cholera is therefore more persistent and can potentially pose a greater risk for recontamination and subsequent development of disease.
Keywords: Vibrio parahaemolyticus Vibrio cholera mixed biofilm fluorescence in situ hybridization
细菌生物被膜(bacterial biofilm)是许多细菌粘附在生物或非生物表面后,分泌胞外多糖(EPS)、蛋白质、脂质和DNA等复合物,并将细菌包裹其中而形成的膜状物,是细菌为了适应自然环境、利于自身生存的一种存在形态[1-2]。普遍认为生物被膜的形成一共经历了3个阶段:粘附期、发展期和成熟期。这3个阶段中,生物被膜经历了从浮游态到结构化,从低密度到高密度的过程[3]。自然界中90%以上的细菌都能形成生物被膜[4],人类细菌性感染约有65%是由生物被膜引起的[5]。
副溶血性弧菌(Vibrio parahaemolyticus,VP)是一种常见的食源性致病菌,由于人们食用未烧熟煮透的食物或者烹调后的食品重新受到污染[6-7]。尤其在夏秋季节,因误食被致病性VP污染的海产品而引发的急性肠胃炎、原发性败血症等疾病时有发生,对食品安全构成了巨大威胁。霍乱弧菌(Vibrio cholera,VC)是引起霍乱的病原菌,可引起严重的腹泻,从而引起身体严重脱水甚至死亡[8]。在世界上曾引起多次暴发流行,给人们的生命财产造成巨大的损失。副溶血性弧菌和霍乱弧菌常常在海产品中共存,并能在海产品表面形成混合生物被膜,容易引起食品交叉污染,导致食品腐败或疾病传播的隐患,给食品安全带来极大威胁。
实际生产中,混合被膜污染严重影响着食品生产与安全。混合生物被膜同单菌种形成的生物被膜相比,由于其菌种组成的多样性,对环境具有更好的适应力[9]。生物被膜中的微生物,其代谢速率较低且一些细胞处于休眠状态,这使得生物被膜难以被清除,并且当其中生物被膜脱离时,可能产生交叉污染。对食品安全带来了巨大的危害[10]。现在大部分有关生物被膜的研究主要集中在单一物种生物被膜,然而从自然界中生物被膜的微观结构发现,许多生物被膜不只是单一物种形成的,而包含有多物种之间相互作用形成的更复杂的生物被膜,进而影响这些群体的繁殖、结构和功能[11]。因此,近年来,人们的研究热点逐渐从单一细菌生物被膜转变为混合生物被膜的复杂性和细菌之间的交流[12-13]。本文通过研究副溶血性弧菌和霍乱弧菌形成的混合生物被膜形成过程,从而为食品加工环境对有害微生物被膜的有效控制鉴定了基础。
1 材料和方法 1.1 材料
1.1.1 实验菌种: 本实验中采用菌株:副溶血性弧菌标准菌株ATCC 17802;霍乱弧菌GIM1.449。
1.1.2 培养基: 硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(TCBS)、胰酶大豆肉汤培养基(TSB)、NaCl等,北京陆桥技术有限责任公司;弧菌显色培养基,上海欣中生物工程有限公司。
1.1.3 试剂及仪器: 结晶紫,美国Sigma公司;磷酸缓冲液(PBS),上海诺伦生物医药技术有限公司;SYBR Green Ⅰ染料,北京索莱宝科技有限公司;25%戊二醛溶液,上海展云化工有限公司;24和96孔板,美国康宁公司;BioTek酶标仪,美国伯腾仪器有限公司;MIR154高精度低温培养箱、MLS-3750型高压灭菌锅,日本三洋电机生物医药株式会社;OptiMair?垂直流超净工作台、Airstream?A2型二级生物安全柜,Esco China公司;LSM710型激光扫描共聚焦显微镜,德国卡尔蔡司公司。DNA细菌原位杂交通用试剂盒[含Solution A、Solution B、细菌杂交液、细菌杂交Washing Buffer(10×)],广州市外显子生物技术有限公司;VC探针、VP探针购自广州市外显子生物技术有限公司。
1.2 菌种活化 将副溶血性弧菌和霍乱弧菌分别接种于TCBS琼脂,37℃过夜培养,挑单菌落至含1% NaCl的5 mL的TSB液体培养基,在37℃、180 r/min的摇床过夜培养,连续活化2次至OD600=0.6,作为接种液备用。
1.3 生物被膜的制备 将上述所得种子液用TSB按1:100的比例进行稀释,另取副溶血性弧菌和霍乱弧菌种菌液按1:1比例混合,并用TSB按1:100的比例进行稀释。将上述菌液分别取1 mL稀释后的菌液置于24孔板中25℃培养。分别培养4、8、12、24、36、48、60、72 h。
1.4 结晶紫染色 参照文献[14],将上述24孔板中培养液移除,加入1 mL磷酸缓冲液每孔清洗3次,去除浮游菌体。室温干燥10 min。加入1 mL 0.1% (W/V)的结晶紫染液。室温下染色30 min。用1 mL磷酸缓冲液每孔清洗3次,置于60℃烘箱,干燥30 min。然后加入1 mL 95%乙醇,检测其在600 nm条件下的吸光值(OD600),以新鲜TSB培养基为阴性对照,每个实验重复3次。
1.5 平板菌落计数 在无菌操作台中,将1.3中24孔板中的上清液移除,参考文献[15],加入1 mL磷酸缓冲液清洗,每孔清洗3次,去除浮游菌体。加入1 mL 0.85%的NaCl,用枪头将附着在24孔板底部的生物被膜刮起,并反复吹打混匀,取0.5 mL混匀的菌液加入4.5 mL已灭菌的0.85%的NaCl溶液中,用振荡器振荡混匀。制成10-1的被膜菌液。在从10-1的被膜混合菌液中取0.5 mL加入4.5 mL已灭菌的0.85% NaCl。制成10-2的稀释被膜菌液。并以此依次制成10-3、10-4、10-5、10-6的稀释菌液。再分别从10-4、10-5、10-6的稀释菌液中取100 μL涂布TCBS固体培养基,每个稀释浓度涂布3个平板作为试验平行。在37℃倒置培养24 h后进行菌落计数。
1.6 生物被膜中胞外多糖和胞外蛋白的测定 将1.2.2培养后的24孔板中的菌液吸出至96孔板,参照文献[16]用酶标仪测定其OD595,加入1 mL磷酸缓冲液清洗,每孔清洗3次,去除浮游菌体。然后向24孔板中加入1 mL 0.01 mol/L的氯化钾溶液。用枪头将附着在24孔板底部的生物被膜刮起,并反复吹打混匀。超声处理(每次5 s,间隙5 s,循环5次)。4℃下4000×g离心20 min。0.22 μm滤膜过滤。加200 μL浓硫酸至滤液,静置30 min后加25 μL苯酚溶液(6%)。90℃静置5 min,测定OD490,样品多糖相对含量为OD490/OD595。吸取40 μL滤液于1.5 mL无菌离心管内,加入200 μL lowry reagent溶液室温静置10 min。然后加入20 μL福林-酚溶液,室温静置30 min。最后测定750 nm处的光吸收值,比值OD750/OD595即为样品胞外蛋白的相对含量。
1.7 荧光原位杂交(FISH)法观察VP和VC混合生物被膜 根据霍乱弧菌和副溶血性弧菌16S rRNA基因序列分别设计VC探针和VP探针。探针信息如表 1。
表 1. 荧光原位杂交探针序列 Table 1. Fluorescence in situ hybridization (FISH) probe sequence
| Probe names | Probe sequences (5′→3′) | Labeling group | Marker color |
| VP probe | ACTTTGTGAGATTCGCTCCACCTCG | FITC | Green |
| VC probe | TGCAATTCCGAGGTTGAGCCCCG | CY3 | Red |
表选项
将1.3中培养后的被膜中的上清液吸出,参考文献[17],加入1 mL磷酸缓冲液清洗,每孔清洗3次,去除浮游菌体。在4%的多聚甲醛溶液中固定3 h,然后用PBS溶液洗2-3次。用预冷的PBS清洗被膜2-3次除去剩余的多聚甲醛。将Solution A滴加在标本上,室温静置20 min;吸去Solution A,滴加Solution B,室温静置15 min;吸去Solution B,在PBS溶液中浸泡10 min;在标本上滴加约200 μL Hybridization Buffer,置于湿盒中,于恒温箱55℃预杂交2 h,预杂交快结束时,将探针与Hybridization Buffer (25%杂交液)按以下比例稀释:VC探针3 μL:VP探针3 μL:Hybridization Buffer (25%杂交液) 150 μL。混合均匀后,88℃变性3 min,37℃平衡5 min;预杂交结束后,吸去Hybridization Buffer,滴加15-30 μL平衡后的探针,盖上盖玻片,用Rubber Cement封片,37-42℃杂交16-72 h;避光条件下洗涤,将细菌杂交Washing Buffer (10×)与蒸馏水按1:9混合均匀,配成工作液,揭去Rubber Cement,将玻片放入Washing Buffer Ⅰ工作液,3-5 min后,盖玻片会自动脱落,再将玻片移至新的Washing Buffer Ⅰ工作液(预热至60℃),洗涤2 min,再移到室温的细菌杂交Washing Buffer Ⅱ (10×)工作液,洗涤15 min;依次浸入70%、85%、100%乙醇中各脱水2 min,室温干燥;滴加20 μL DAPI Anti-fade solution,盖上盖玻片后,暗处静置15 min后,荧光显微镜下观察。
1.8 数据处理 采用Origin 8.0软件处理,并对相关数据进行统计分析。
2 结果和分析 2.1 通过结晶紫染色法观察副溶血性弧菌和霍乱弧菌混合生物被膜形成过程 利用结晶紫染色法观察副溶血性弧菌和霍乱弧菌生物被膜形成的变化过程,测量600 nm条件下的吸光度,以吸光度值的高低反映生物被膜形成量的变化。结果如图 1所示,在4-12 h黏附期,无论单独培养的VP、VC还是VP、VC的混合菌,测量所得的OD600值都在迅速增长,这一阶段的细菌处于细菌生长曲线的指数期。指数期的微生物在生长曲线上活菌数直线上升,细菌以稳定的几何级数极快增长。细菌形成生物被膜的量随着细菌生长而增加。在12-48 h成熟发展期,随着细菌的生长繁殖,营养物质的消耗和有害代谢废物的积累使细菌形成生物被膜的增速减缓,并于24 h时达到峰值。在24-48 h,随着24孔板中营养物质的消耗和有害代谢废物的积累,使得环境不利于生物被膜的形成,从而使生物被膜的形成量减少。48-72 h播散期,营养物质的减少和有害代谢废物的积累,使得环境条件变得不利于微生物生存,生物被膜持续减少。
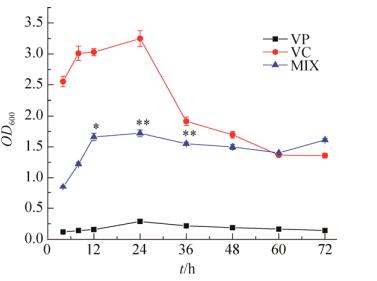 |
| 图 1 副溶血性弧菌(VP)和霍乱弧菌(VC)结晶紫染色下生物被膜的形成过程 Figure 1 Biofilm formation of Vibrio parahaemolyticus (VP) and Vibrio cholerae (VC) under the crystal violet stain. |
| 图选项 |
如图 1所示,同单独培养条件下相比,VC和VP的混合菌形成的生物被膜介于形成生物被膜能力极强的VC和形成生物被膜能力较弱的VP之间。在单培养时,霍乱弧菌在24-36 h生物被膜的量急剧减少,表明其受环境变换的影响较大。混合生物被膜同单培养的VC生物被膜相比在24-36 h时生物被膜的量具有显著性差异(P < 0.01)。表明在VC与VP共同形成生物被膜的条件下,VC、VP形成的混合生物被膜对不利环境的抗性增强。
2.2 混合菌与单一菌生物被膜活菌数的变化 使用弧菌显色培养基测量VP和VC混合生物被膜中的活菌数时,VP形成的菌落为紫红色;VC形成的菌落为蓝绿色。根据菌落颜色的不同,可以将混合生物被膜中的VP和VC分别计数,结果如图 2所示。同单培养的VC相比,在24 h前混合生物被膜中VC的活菌数比单培养的VC被膜中的活菌数要少(P < 0.05);在24 h后混合生物被膜中VC的活菌数比单培养条件下VC生物被膜中的活菌数多(P < 0.05)。这表明当VC与VP混合培养形成的生物被膜同单培养VC形成的生物被膜相比,混合生物被膜中的VC活菌在成熟期有着更多的活菌,从而有更大的危害性。而混合被膜中的VP活菌数一直比单培养被膜中的VP活菌数多(P < 0.05),这表明VC可能促进VP的生长。在成熟发展期后。培养条件逐渐不适于微生物的生存。此时被膜中的微生物活菌数开始减少。但是混合生物被膜中的活菌数都比单培养的被膜中的活菌数多。这表明混合生物被膜中的VP和VC比单培养条件下有了更强的抗逆性,从而使其危害性可能增高。
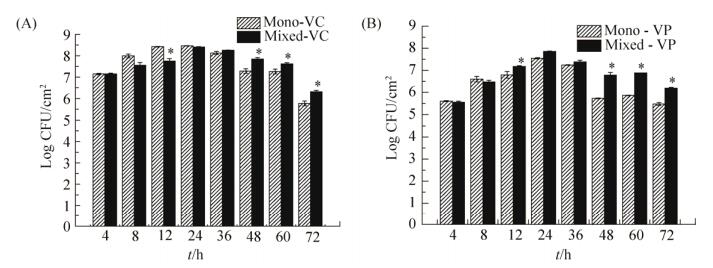 |
| 图 2 混合生物被膜中活菌数的变化 Figure 2 Changes in the number of living bacteria in the mix biofilm. A: the change of viable cells in biofilms of VC strains under single and mixed culture conditions. B: the change of viable cells in biofilms of VP strains under single and mixed culture conditions. |
| 图选项 |
虽然我们用结晶紫测得混合生物被膜中被膜的总量介于VC和VP单培养生物被膜之间,但是同分别培养VP和VC相比,混合生物被膜中拥有更多的活菌。表明了VP和VC形成的混合被膜同2种细菌单培养条件下的生物被膜相比能对人类健康产生更大的安全威胁。
2.3 生物被膜形成过程中胞外多糖和胞外蛋白的变化 胞外物质不仅能增强微生物细胞对外界环境因素的抵抗能力,而且在细胞初始粘附及维持生物被膜稳定中起着关键作用。胞外多糖和胞外蛋白相对含量的变化如图 3所示。在4-24 h时,无论单独培养的VP、VC还是VP、VC的混合菌,测量所得的都在增长,因为细菌生物被膜主要物质是胞外多糖和胞外蛋白等,在生物被膜形成过程中对生物被膜的形成有重要作用。36 h细菌胞外多糖和胞外蛋白仍会继续增加并达到最大值(P < 0.01),可能是由于细菌在此时期,营养物质的消耗和有害代谢废物的积累使生物被膜中的活菌分泌更多胞外多糖胞外蛋白等物质来抵御逐渐不适合其生存的环境。36-72 h生物被膜中胞外多糖和胞外蛋白的量逐渐减少,由于环境条件变得不利于微生物生存,生物被膜量减少,引起胞外蛋白和胞外多糖量的减少。
 |
| 图 3 副溶血性弧菌(VP)和霍乱弧菌(VC)胞外多糖和胞外蛋白相对含量的变化 Figure 3 Changes of relative content of extracellular polysaccharide in Vibrio parahaemolyticus (VP) and Vibrio cholerae (VC). A: the relative content of extracellular polysaccharides in the biofilms of VC, VP and their mixed bacteria. B: the relative content of extracellular proteins in the biofilms of VC, VP and their mixed bacteria. |
| 图选项 |
2.4 FISH法观察副溶血性弧菌和霍乱弧菌混合生物被膜 VC、VP混合生物被膜的荧光原位杂交结果如图 4所示。在4 h时红色荧光的VP较少、聚集较少,绿色荧光的VC较多且开始聚集;在8 h呈红色的荧光VP较多且开始聚集成片;在12 h红色荧光的VP生物被膜将生物被膜表面完全覆盖,绿色荧光的VC生物被膜也在逐渐增加。在24-36 h,绿色荧光的VC与红色荧光的VP共同形成紧密结合的生物被膜。36 h后混合生物被膜表面混合生物被膜逐渐减少。荧光原位杂交表明,VC、VP混合生物被膜形成过程中,24 h前主要由形成生物被膜能力较弱的VP包裹VC形成生物被膜;24 h后,随着环境条件逐渐不适应微生物生存,生物被膜的量逐渐开始减少,生物被膜逐渐解体。
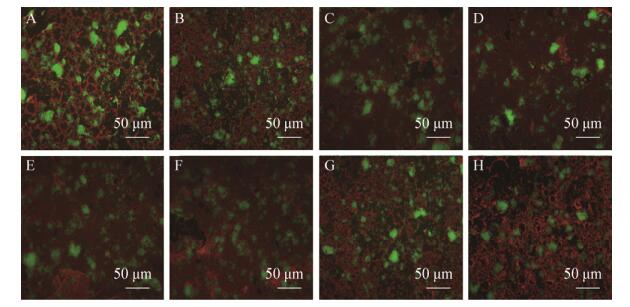 |
| 图 4 荧光原位杂交观察混合生物被膜的形成过程 Figure 4 Formation of mixed biofilms was observed by using fluorescence in situ hybridization (FISH). VP: red; VC: green; a-h respectively mixed strain 4 h, 8 h, 12 h, 24 h, 36 h, 48 h, 60 h and 72 h. |
| 图选项 |
3 讨论 同浮游态的微生物相比,生物被膜中的微生物生长相对较慢[18]。这可能是因为在生物被膜中的微生物获得营养物质和氧气受限[19]。种间的相互作用在混合生物膜的形成和发展中发挥关键作用[20]。陈东等的研究表明,大肠杆菌O157:H7和沙门氏菌形成的混合被膜也是介于两种细菌单培养被膜量之间[21]。Granillo对曲霉、金黄色葡萄球菌形成混合生物被膜也有类似的结果[22]。Shahryar等的研究结果表明不动杆菌在同放线杆菌、布兰汉氏球菌、芽孢杆菌、微球菌形成混合生物被膜时,虽然形成的生物被膜量有所减少,但是黏附能力和耐药性有所增加[23]。在本研究中,VC、VP形成的混合生物被膜同单培养VC形成的生物被膜形成量有类似的变化,单其黏附力与抗药性的变化后续可进一步研究。Katherine等的研究表明妥布霉素处理的铜绿假单胞菌对星座链球菌生物被膜的形成有促进作用[24]。Ren的研究表明在混合生物被膜中的寡养单胞菌、黄单胞菌、氧化微杆菌、解淀粉类芽孢杆菌同单培养的生物被膜中的菌相比,混合生物被膜中活菌的含量更多[25]。生物被膜在形成过程中胞外多糖和胞外蛋白随时间的变化表明,在生物被膜形成过程中胞外多糖和胞外蛋白起重要作用。
本文研究VP和VC形成单培养和混合生物被膜的过程,结果表明VP和VC形成的单培养和混合生物被膜是一个动态的变化的过程,在24 h时混合生物被膜的形成能力最强。研究发现混合生物被膜虽然总的被膜量相对于VC单培养的细胞有所减少,但是却含有更多的活细菌;同单培养的生物被膜相比,混合生物被膜可能会引起更大的危害。测定胞外多糖和胞外蛋白的结果表明,生物被膜形成过程中胞外蛋白和胞外多糖变化同单培养VC生物被膜变化趋势类似。在36 h生物被膜中胞外多糖和胞外蛋白达到最大值。表明胞外蛋白和胞外多糖在生物被膜抵抗不利环境中可能起重要作用。荧光原位杂交(FISH)观察混合生物被膜的形成的结果可以观察混合生物被膜形成过程中两种菌的变化过程。通过了解混合生物被膜的变化过程,我们可以为有效控制VP和VC混合生物被膜引起的食品污染奠定基础。另外,可以通过进一步研究VP和VC混合生物被膜形成过程中的基因表达调控,从而更加深入理解微生物在生物被膜中通过何种分子机制互作。
References
| [1] | Costerton JW. Introduction to biofilm. International Journal of Antimicrobial Agents, 1999, 11(3/4): 217-221. |
| [2] | Stoodley P, Sauer K, Davies DG, Costerton JW. Biofilms as complex differentiated communities. Annual Reviews in Microbiology, 2002, 56: 187-209. DOI:10.1146/annurev.micro.56.012302.160705 |
| [3] | 周文渊. 牛奶介质中混合菌生物被膜形成特性及其抑制的研究. 广东工业大学硕士学位论文, 2014. http://journals.im.ac.cn/html/actamicrocn/2018/10/%20//cdmd.%20cnki.%20com.%20cn/Article/CDMD-11911-1014294804.%20htm |
| [4] | Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms:a common cause of persistent infections. Science, 1999, 284(5418): 1318-1322. DOI:10.1126/science.284.5418.1318 |
| [5] | Potera C. Forging a link between biofilms and disease. Science, 1999, 283(5409): 1837-1839. DOI:10.1126/science.283.5409.1837 |
| [6] | Tian MS, Zheng LJ, Peng SJ, Li J, Zhang L, Qi LB, Zhao YX. Analysis and measures on collective food poisoning caused by vibrio parahaemolyticus in shanghai munidpality during 2000-2007. Chinese Journal of Food Hygiene, 2008, 20(6): 514-517. (in Chinese) 田明胜, 郑雷军, 彭少杰, 李洁, 张磊, 戚柳彬, 赵宇翔. 2000-2007年上海市副溶血性弧菌致集体性食物中毒分析及对策. 中国食品卫生杂志, 2008, 20(6): 514-517. DOI:10.3969/j.issn.1004-8456.2008.06.014 |
| [7] | Daniels NA, MacKinnon L, Bishop R, Altekruse S, Ray B, Hammond RM, Slutsker L, Thompson S, Wilson S, Bean N H, Griffin PM, Slutsker L. Vibrio parahaemolyticus infections in the United States, 1973-1998. The Journal of Infectious Diseases, 2000, 181(5): 1661-1666. DOI:10.1086/jid.2000.181.issue-5 |
| [8] | Kierek K, Watnick PI. Environmental determinants of Vibrio cholerae biofilm development. Applied and Environmental Microbiology, 2003, 69(9): 5079-5088. DOI:10.1128/AEM.69.9.5079-5088.2003 |
| [9] | Joo HS, Otto M. Molecular basis of in vivo biofilm formation by bacterial pathogens. Chemistry & Biology, 2012, 19(12): 1503-1513. |
| [10] | Rode TM, Langsrud S, Holck A, M?retr? T. Different patterns of biofilm formation in Staphylococcus aureus under food-related stress conditions. International Journal of Food Microbiology, 2007, 116(3): 372-383. DOI:10.1016/j.ijfoodmicro.2007.02.017 |
| [11] | Jass J, Roberts SK, Lappin-Scott HM. Microbes and enzymes in biofilms//Burns RG, Dick RD. Enzymes in the Environment. Activity, Ecology and Applications. New York, USA: Marcel Dekker Inc., 2002: 307-326. http://journals.im.ac.cn/html/actamicrocn/2018/10/%20//docview1.%20tlvnimg.%20com/tailieu/2011/20111217/chimungdauhoi/enzymes_in_the_environment_12__5922.%20pdf |
| [12] | Momeni B, Brileya KA, Fields MW, Shou W. Correction:Strong inter-population cooperation leads to partner intermixing in microbial communities. Elife, 2014, 3: e029645. |
| [13] | Zengler K, Palsson BO. A road map for the development of community systems (CoSy) biology. Nature Reviews Microbiology, 2012, 10(5): 366-372. DOI:10.1038/nrmicro2763 |
| [14] | Chopra L, Singh G, Jena KK, Sahoo DK. Sonorensin:a new bacteriocin with potential of an anti-biofilm agent and a food biopreservative. Scientific Reports, 2015, 5: 13412. DOI:10.1038/srep13412 |
| [15] | Harwood VJ, Gandhi JP, Wright AC. Methods for isolation and confirmation of Vibrio vulnificus from oysters and environmental sources:a review. Journal of Microbiological Methods, 2004, 59(3): 301-316. DOI:10.1016/j.mimet.2004.08.001 |
| [16] | Nguyen D. Studying regulation of a virulence factor in Vibrio cholerae using genetic reporter assays and hybridization chain reaction: fluorescent in situ hybridization (HCR-FISH) to label bacterial MRNA in drosophila. Amherst College Doctoral Dissertation, 2017. |
| [17] | Kim HS, Park HD. Ginger extract inhibits biofilm formation by Pseudomonas aeruginosa PA14. PLoS One, 2013, 8(9): e76106. DOI:10.1371/journal.pone.0076106 |
| [18] | Donlan RM. Role of biofilms in antimicrobial resistance. ASAIO Journal, 2000, 46(6): S47-S52. DOI:10.1097/00002480-200011000-00037 |
| [19] | Donlan RM. Biofilm formation:a clinically relevant microbiological process. Clinical Infectious Diseases, 2001, 33(8): 1387-1392. DOI:10.1086/cid.2001.33.issue-8 |
| [20] | O'Toole G, Kaplan HB, Kolter R. Biofilm formation as microbial development. Annual Reviews of Microbiology, 2000, 54(1): 49-79. DOI:10.1146/annurev.micro.54.1.49 |
| [21] | Chen D, Zhao T, Doyle MP. Single-and mixed-species biofilm formation by Escherichia coli O157:H7 and Salmonella, and their sensitivity to levulinic acid plus sodium dodecyl sulfate. Food Control, 2015, 57: 48-53. DOI:10.1016/j.foodcont.2015.04.006 |
| [22] | Granillo AR, Canales MGM, Espíndola MES, Rivera MAM, De Lucio VMB, Tovar AVR. Antibiosis interaction of Staphylococccus aureus on Aspergillus fumigatus assessed in vitro by mixed biofilm formation. BMC Microbiology, 2015, 15(1): 33. DOI:10.1186/s12866-015-0363-2 |
| [23] | Shakeri S, Kermanshahi RK, Moghaddam MM, Emtiazi G. Assessment of biofilm cell removal and killing and biocide efficacy using the microtiter plate test. Biofouling, 2007, 23(1/2): 79-86. |
| [24] | Price KE, Naimie AA, Griffin EF, Bay C, O'Toole GA, DiRita VJ. Tobramycin-treated Pseudomonas aeruginosa PA14 enhances Streptococcus constellatus 7155 biofilm formation in a cystic fibrosis model system. Journal of Bacteriology, 2016, 198(2): 237-247. DOI:10.1128/JB.00705-15 |
| [25] | Ren DW, Madsen JS, S?rensen SJ, Burm?lle M. High prevalence of biofilm synergy among bacterial soil isolates in cocultures indicates bacterial interspecific cooperation. The ISME Journal, 2015, 9(1): 81-89. DOI:10.1038/ismej.2014.96 |
