赵龙飞1

 , 徐亚军1, 常佳丽2, 李全芬1, 杨静雅1, 欧启凡1, 杨梦冉1
, 徐亚军1, 常佳丽2, 李全芬1, 杨静雅1, 欧启凡1, 杨梦冉1 1.河南省高校植物与微生物互作重点实验室, 商丘师范学院生命科学学院, 河南 商丘 476000;
2.清华大学环境学院, 水环境保护研究所, 北京 100084
收稿日期:2016-10-12;修回日期:2016-12-01;网络出版日期:2017-01-19
基金项目:国家自然科学基金(U1204301);河南省高等学校重点科研项目(17A180011);国家级大学生创新性实验计划项目(201610483021)
*通信作者:Tel:+86-370-3057892;Fax:+86-370-2595979;E-mail:hnzhaolongfei@163.com
摘要: [目的]采用优良抗病性内生菌资源来控制棉花枯萎病是一种有效的措施。本研究从大豆根瘤中筛选棉花枯萎病拮抗性内生细菌,探索其对棉花枯萎病菌丝的抑制作用和代表菌株特性,为发掘和应用防病、抗逆优良菌株提供理论基础。[方法]采用对峙法和代谢液培养法对大豆根瘤内生细菌进行棉花枯萎病菌抑菌性筛选,显微观察法研究筛选菌株引起病原菌菌丝变化,通过菌株培养特征、理化特性和16S rDNA序列同源性分析确定菌株系统发育地位,比色法测定DD174耐盐碱性,盆栽试验验证防病效果。[结果]经复筛和代谢液试验有5株拮抗性较强菌株,被作用病原菌菌丝畸形、细胞壁消失、自溶,菌丝基部加粗、分支增多,呈树根状;菌丝被菌苔包埋而溶解、断裂,菌丝末端球形膨大。对棉花枯萎病菌的抑制作用主要通过菌体产生胞外代谢物发挥作用。菌株DD174、DD176和DD179最相似菌株分别为Bacillus oceanisediminis H2T(GQ292772)和B. thuringiensis ATCC 10792T(AF290545),菌株DD165和DD166最相似菌株均为Stenotrophomonas maltophilia LMG 958T(X95923)。DD174能耐受6%盐浓度,pH 10生长良好,具有一定耐盐碱能力。DD174处理组防治效果达76.32%,其他防效均在62%以上,可作为棉花枯萎病的生防菌株资源。[结论]大豆根瘤内存在棉花枯萎病内生拮抗细菌,其中有些菌株具有一定耐盐碱能力,对棉花枯萎病病原菌及病害有一定抑菌和防病作用。s
关键词: 棉花枯萎病菌 根瘤内生菌 拮抗性 16S rDNA 系统发育分析
Screening endophytic bacteria from soybean root nodules to inhibit Fusarium oxysporum f. sp. Vasinfectum
Longfei Zhao1

 , Yajun Xu1, Jiali Chang2, Quanfen Li1, Jingya Yang1, Qifan Ou1, Mengran Yang1
, Yajun Xu1, Jiali Chang2, Quanfen Li1, Jingya Yang1, Qifan Ou1, Mengran Yang1 1.Key Laboratory of Plant-Microbe Interactions of Henan, College of Life Sciences, Shangqiu Normal University, Shangqiu 476000, Henan Province, China;
2.Division of Water Environment, College of Environment, Tsinghua University, Beijing 100084, China
Received 12 October 2016; Revised 01 December 2016; Published online 19 January 2017
*Corresponding author: Tel: +86-370-3057892; Fax: +86-370-2595979; E-mail: hnzhaolongfei@163.com
Supported by the National Natural Science Foundation of China (U1204301), by the University Key Scientific Research Project of Henan Province (17A180011) and by the National Innovation Experiment Program for University Students (201610483021)
Abstract: [Objective]Using desirable strain resources to control Fusarium wilt of cotton is an effective way. This study aimed to acquire antagonistic endophytic bacteria from soybean nodules, explore their inhibition mechanism and strain characteristics.[Methods]Confrontation and metabolic liquid culture methods were adopted to screen endophytic bacteria from soybean nodules against Fusarium oxysporum f. sp. vasinfectum. The effect of screened strains on pathogen hyphae changes were analyzed with microscopic observation method. Combined with cultural, physical and chemical characteristics, 16S rDNA sequencing results and homology analysis of screened strains, phylogenetic status were determined. Disease-control effects were demonstrated by greenhouse inoculation test.[Results]Five strains of endophytes have inhibitory effect by the second screening and metabolic liquid test. Pathogen hyphae treated with endophytes became deformity, its cell wall disappeared, autolysis, bold at the base of the mycelium, branches increased and root shape appeared. Hyphae were embeded, dissolved and fractured by lawn formed by endophytic bacteria, and presented spherical expansion of its terminal. The inhibition of endophytic bacteria against Fusarium oxysporum f. sp. vasinfectum was mainly caused by extracellular metabolites. DD174, DD176 and DD179 were similar to Bacillus oceanisediminis H2T(GQ292772) and B. thuringiensis ATCC 10792T(AF290545), respectively. DD165 and DD166 were similar to Stenotrophomonas maltophilia LMG 958T (X95923). DD174 tolerated 6% salt concentration and grew well at pH 10. Control effect of treatment group with DD174 was 76.32%, those of others were above 62%, so these strains can be used as biocontrol resources against Fusarium oxysporum f. sp. vasinfectum.[Conclusion]Endophytic antagonistic bacteria inhabited soybean root nodules against Fusarium oxysporum f. sp. vasinfectum.
Key words: Fusarium oxysporum f. sp. vasinfectum soybean nodule endophytes antagonistic effect 16S rDNA phylogenetic analysis
棉花枯萎病是尖孢镰刀菌萎蔫专化型 (Fusarium oxysporum f. sp. vasinfectum) 引起的维管束病害,是一种世界性棉花土传病害,这种病害严重威胁着棉花产量和纤维品质,发病严重时可造成绝产,也是当前危害棉花生产的最严重病害之一[1]。但目前对棉花枯萎病的控制主要采取大量喷施化学农药、选择适宜品种和与其他作物轮作等措施。这些措施不仅控制效果不佳给环境带来污染,还会增强病原菌抗药性[2]。寻求环保、有效的控制措施成为研究者关注的焦点。前人研究[3-4]已证实可利用内生细菌抑制棉花枯萎病的发生和蔓延,这为利用植物内生细菌资源拓展绿色环保生物防治措施提供了新思路。
植物内生菌 (Endophyte) 是指在其生活史一定阶段或全部阶段生活于健康植物各种组织和器官内部不引起明显症状的微生物类群,是植物微生态系统重要组成部分。内生菌与宿主植物经长期协同进化形成互惠互利的关系[5]。内生菌具有防病、固氮、溶磷、产植物激素 (如IAA)、产ACC脱氨酶、产铁载体、产挥发性有机物质 (VOCs)、抑制病原菌、诱导系统抗性、促进植物生长和增强宿主抗逆性等生物学功能[6],内生菌资源也是植物病害生物防治的天然微生物资源库,具有潜在的应用和开发价值。自Stierle等[7]从短叶紫杉 (Taxus breoifolia) 中发现产紫杉醇的内生真菌后,有关植物内生菌的研究逐渐引起研究者的兴趣,已成为近十年来微生物学、植物学、植物保护学、生态学等研究领域一大热点。豆科根瘤内蕴藏丰富的内生细菌资源[8-9],研究发现大豆根瘤内生细菌能产生抗菌类物质、水解酶类、抗生素等代谢产物[10]以及在培养基表面迅速形成生物膜,溶解病原真菌细胞壁,抑制其生长。所以大豆根瘤这一特殊微环境中丰富的内生细菌资源是研究生物防治剂的优良材料。但目前,利用大豆根瘤内生细菌资源来防治棉花枯萎病的相关研究确实未见报道。在前期工作中,课题组分离和保藏了采集自河南省部分地区的大豆根瘤内生细菌样品,已分析其溶磷性[11]、ACC脱氨酶活性[12]、烟草赤星病菌拮抗性[13]等特性,鉴于此,本试验拟通过对大豆根瘤内生细菌进行棉花枯萎病菌拮抗性筛选、鉴定和特性分析及盆栽防效试验,初步探讨其抑菌机理,为棉花枯萎病的生物防治提供菌种资源和科学依据。
1 材料和方法 1.1 供试材料和培养基 植物病原菌:棉花枯萎病菌FO101(Fusarium oxysporum f. sp. vasinfectum) 由西北农林科技大学生命科学学院提供,以菌核形式保藏在PDA试管斜面培养基[13]。
根瘤内生细菌:2012年7-8月采集自河南部分地区的大豆根瘤并分离获得。对采集的大豆根瘤,经平板划线法对内生细菌进行分离、纯化、镜检,将其在固体斜面4 ℃短期保藏或甘油管于-80 ℃冰箱长期保藏、备用。
棉花种子:“百朵大桃懒汉王”采购于河南省商丘市棉办农业技术服务部。
1.2 棉花枯萎病菌拮抗性内生细菌初筛 采用对峙平板培养法[14]。在无菌条件下,将活化棉花枯萎病菌饼置于PDA平板中央,置于培养箱中30 ℃恒温培养2 d。把5株不同内生细菌均匀接种菌饼周围在距平板边缘2.5 cm处,放入30 ℃恒温培养箱倒置培养3 d,以不接种内生细菌的病原菌菌落为对照 (CK),观察并测量培养基中受抑制棉花枯萎病菌落直径和对照菌落直径。每隔24 h测量1次,连续测量3次,依据抑菌率 (%)=(对照菌落直径-处理菌落直径)×100%/(对照菌落直径)[17],计算抑制率。
1.3 棉花枯萎病菌拮抗性内生细菌复筛 挑选初筛中抑菌率较高菌株进行复筛。与初筛方法基本类似,在无菌条件下,用打孔器取下棉花枯萎病菌菌饼,置于PDA培养基中央,待病原菌培养2 d后,把初筛内生细菌制作成菌悬液 (OD600≈1),用移液器吸取30 μL菌悬液点接在距离平板边缘2.5 cm处,每个平板点接同一菌株3次。以接种等量无菌水的病原菌菌落为对照,每处理3个重复。30 ℃恒温倒置培养,每隔24 h观察并记录棉花枯萎病菌落和对照菌落直径变化。
1.4 拮抗菌株代谢液抑菌活性测定 抑菌活性较高菌株接种到YM液体培养基[13]中,28 ℃、130 r/min恒温振荡培养7 d后,10000 r/min离心10 min收集上清,再用0.22 μm细菌微孔滤膜过滤上清,滤液用于代谢产物活性测定。取10 mL滤液与150 mL灭菌冷却至60 ℃的PDA培养基混合均匀制成平板,以添加等量无菌水代替滤液的平板为对照,将直径为0.5 cm生长旺盛的棉花枯萎病菌饼接种在平板中央。每个处理3次重复,置于30 ℃恒温培养5 d,测量处理和对照菌落直径,计算抑菌率。
1.5 受抑制病原菌菌丝的显微观察 复筛中把受抑制作用较明显病原菌菌落培养48 h后,置于荧光倒置显微镜下观察病原菌菌丝和对照菌丝间的形态变化,拍照并记录结果。
1.6 筛选菌株培养特征及生理生化测试 对筛选菌株进行菌落和细胞特性测定,方法参见文献[15]。
1.7 16S rDNA序列测定及系统发育分析 采用CTAB法提取内生细菌基因组DNA,以此为模板进行16S rDNA扩增[2],正向引物P1:5′-CGGGATCCAGAGTTTGATCCTGGCTCAGAACGAACGCT-3′,反向引物P2:5′-CGGGATCCTAC GGCTACCTTGTTACGACTTCACCCC-3′,分别对应大肠杆菌 (Escherichia coli) 16S rRNA基因序列上8-37 bp和1479-1506 bp位置,目的片段大小约1500 bp,获得序列提交GenBank。使用ClustalX 1.81软件进行序列比对,Bioedit 4.8.4进行手工纠正,使用TRENCONW软件以Neighbor-Joining方法构建系统发育树,用Bootstrap重复1000次进行可信度评估,用DNAMAN 6.0软件进行序列相似性分析。
1.8 拮抗性内生细菌耐盐碱性分析 筛选抑菌率较高菌株,采用比浊法测定大豆根瘤内生细菌在盐碱环境下生长规律以反应其盐碱抗性。将待测菌株接种至灭菌YM培养基中,置于恒温振荡培养箱中130 r/min、30 ℃培养3 d后,将培养基在10000 r/min离心10 min弃上清,收集沉淀,加入无菌蒸馏水调节OD600值至0.8-1.0的菌悬液,置于4 ℃冰箱保存备用。配制YM培养基分装至250 mL三角瓶中,加入NaCl,配制成0、3%、4%、5%和6% (单位:g/mL) 5个盐浓度梯度,灭菌后备用,以不加NaCl为对照。用1 mol/L NaOH调节终pH为7、8、9、10和11的培养基,以pH 7培养基为对照。每瓶接入定量菌悬液,置于130 r/min、30 ℃条件下振荡培养,每2 h观察并测OD600。以测得OD600值作纵坐标,培养时间 (h) 作横坐标,绘制该菌生长曲线。
1.9 接种菌株对棉花枯萎病的防治效果试验 试验分为空白对照CK (不接菌组) 和处理组 (接种内生细菌+病原真菌)。每个处理6盆,每盆5株,设3次重复。选择籽粒饱满“懒汉王”棉花种子,表面消毒后按每盆5粒播种于灭菌蛭石中,置于人工气候箱中保持一定温湿度。待棉花苗长至2-3叶时 (约7-8 cm),活化内生细菌并制成菌悬液 (浓度6×108 CFU/mL),每株1 mL浇灌幼苗根部。每株菌重复3次,每重复处理5株幼苗,置于22-32 ℃保湿培养。接种内生细菌2 d后,采用切根灌注接种法[16]接种处理组,病原菌悬液孢子浓度为1×106个/mL,置于24-30 ℃保湿培养。第1次接种3周后每7 d统计植株的发病率、发病严重度和病情指数。严重程度分级标准:0级,无病症,不致病,叶色油绿;1级,1-2片子叶边缘发病,病斑微泛黄;2级,子叶及1片真叶局部发黄;3级,2片真叶发病或脱落仅剩心叶,叶色泛黄色枯萎症状明显;4级,植株生长点或全株枯萎,出现落叶。发病率 (%)=∑病株数/调查总株数×100;病情指数=∑(该级植株数×病害等级)/(调查植株数×最严重等级)×100;防治效果 (%)=[(对照病情指数-处理病情指数)/对照病情指数]×100。
利用SPSS 17.0软件对数据进行统计分析。采用双因素随机方差分析 (two-way ANOVA) 和最小显著差数法 (LSD) 分析菌落直径和对照菌落直径对抑菌率的影响,显著性水平设定为α=0.05。
2 结果和分析 2.1 拮抗性大豆根瘤内生细菌初筛 把276株大豆根瘤内生细菌采用对峙培养法进行病原真菌拮抗性试验,初步筛选出对棉花枯萎病有拮抗作用的内生细菌共61株,其中抑菌率在20%以上的有27株 (表 1),占分离菌株的9.78%。抑菌率最大者为菌株DD165 (50.92%),其次为菌株DD176,抑菌率为49.69%;抑菌率最小菌株为DD292 (21.79%)。因此,不同内生细菌菌株对棉花枯萎病菌的抑菌率不同。
表 1. 棉花枯萎病菌拮抗性大豆根瘤内生细菌的初筛 Table 1. The first screening results of antagonistic endophytic bacteria isolated from soybean nodules against F. oxysporum f. sp. vasinfectum FO101 (72 h, mean±SD)
| Endophytic bacteria | Colony diameter of pathogen/cm | Inhibition rate of endophytic bacteria/% | Endophytic bacteria | Colony diameter of pathogen/cm | Inhibition rate of endophytic bacteria/% |
| CK | 4.91±0.01 | - | DD170 | 2.62±0.01 | 46.64±0.03i |
| DD165 | 2.41±0.01 | 50.92±0.01a | DD243 | 2.63±0.02 | 46.44±0.01j |
| DD176 | 2.47±0.01 | 49.69±0.02b | DD254 | 2.64±0.01 | 46.23±0.02k |
| DD174 | 2.51±0.01 | 48.88±0.01c | DD299 | 2.66±0.01 | 45.82±0.01l |
| DD044 | 2.53±0.02 | 48.47±0.02d | DD065 | 2.70±0.02 | 45.01±0.03m |
| DD006 | 2.54±0.01 | 48.27±0.01e | DD134 | 2.71±0.01 | 44.81±0.03n |
| DD190 | 2.55±0.01 | 48.07±0.02f | DD281 | 2.73±0.01 | 44.40±0.03o |
| DD179 | 2.56±0.02 | 47.86±0.03g | DD199 | 2.83±0.01 | 42.36±0.02p |
| DD166 | 2.56±0.01 | 47.86±0.03g | DD252 | 3.85±0.02 | 41.96±0.03q |
| DD210 | 2.56±0.01 | 47.86±0.03g | DD280 | 3.87±0.01 | 41.55±0.01r |
| DD060 | 2.56±0.01 | 47.86±0.03g | DD222 | 3.32±0.02 | 32.38±0.01s |
| DD161 | 2.61±0.02 | 46.84±0.02h | DD189 | 3.41±0.01 | 30.55±0.03t |
| DD201 | 2.61±0.01 | 46.84±0.02h | DD312 | 3.81±0.01 | 22.40±0.01u |
| DD303 | 2.62±0.01 | 46.64±0.03i | DD292 | 3.84±0.01 | 21.79±0.01v |
| CK: control. Different lowercase letters in the same column showed significant difference at 0.05 levels. The same as below. | |||||
表选项
2.2 拮抗性大豆根瘤内生细菌复筛 对初筛选出27株菌进行复筛,结果表明对棉花枯萎病菌抑菌率在40%以上有9株 (表 2)。
表 2. 大豆根瘤内生细菌对棉花枯萎病菌抑制作用的复筛结果 Table 2. The second screening results of antagonistic endophytic bacteria from soybean nodules against F. oxysporum f. sp. vasinfectum
| Endophytic bacteria | 1Colony diameter of pathogen/cm | 1Inhibition ratio of endophytic bacteria/% | 2Colony diameter of pathogen/cm | 2Inhibition ratio of endophytic bacteria/% | 3Colony diameter of pathogen/cm | 3Inhibition ratio of endophytic bacteria/% |
| CK | 3.67±0.02 | - | 5.01±0.03 | - | 6.53±0.01 | - |
| DD174 | 2.42±0.01 | 34.06±0.01a | 2.53±0.01 | 49.50±0.01a | 2.45±0.02 | 62.48±0.01a |
| DD166 | 2.55±0.02 | 30.52±0.03b | 2.55±0.01 | 49.10±0.02b | 2.48±0.01 | 62.02±0.01b |
| DD176 | 2.55±0.02 | 30.52±0.03b | 2.65±0.02 | 47.11±0.03c | 2.51±0.03 | 61.56±0.08c |
| DD179 | 2.61±0.01 | 28.88±0.05c | 2.61±0.01 | 47.90±0.02d | 2.53±0.01 | 61.26±0.02d |
| DD165 | 2.41±0.01 | 34.33±0.02d | 2.61±0.01 | 47.90±0.01d | 2.56±0.01 | 60.80±0.01e |
| DD170 | 2.87±0.01 | 21.80±0.04e | 2.81±0.01 | 43.91±0.02e | 2.86±0.02 | 56.20±0.01f |
| DD044 | 2.43±0.02 | 33.79±0.01f | 2.82±0.03 | 43.71±0.02f | 2.87±0.01 | 56.05±0.03g |
| DD281 | 2.81±0.01 | 23.43±0.03g | 2.85±0.01 | 43.11±0.01g | 2.98±0.02 | 54.36±0.01h |
| DD006 | 2.43±0.03 | 33.79±0.03f | 2.67±0.01 | 46.71±0.02h | 3.26±0.01 | 50.08±0.02i |
| 1:inoculation for 24 hours; 2: inoculation for 48 hours; 3: inoculation for 72 hours; CK: contrast without inoculation. Data were presented as mean±SD, different lowercase letters in the same column showed significant difference at 0.05 levels. | ||||||
表选项
由表 2可知,大豆根瘤内生细菌对棉花枯萎病菌抑菌率 (72 h) 均达到50.08%以上,其中对病原菌抑制作用最明显菌株为DD174,抑菌率为62.48%。对棉花枯萎病菌抑制作用较不明显菌株为DD006,其抑菌率仅为50.08%。由此可见,进一步印证不同大豆根瘤内生细菌对棉花枯萎病菌抑制作用存在差异,并且培养72 h抑菌效果最佳。
在复筛过程中,菌株DD174、DD166对病原菌抑制现象如图 1所示。随时间延长对照组病菌菌落 (图 1-A) 逐渐变大,但处理组病菌菌落变化却不明显。
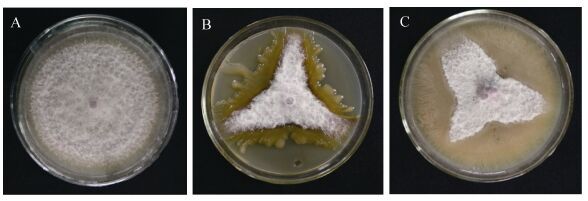 |
| 图 1. 菌株DD174与DD166对棉花枯萎病菌的抑制作用 Figure 1. Inhibition effect of endophytic bacteria against F. oxysporum f. sp. Vasinfectum (72 h). A: CK; B: DD174; C: DD166. |
| 图选项 |
2.3 拮抗菌株代谢液活性 根据平板复筛结果,对复筛菌株抑菌率在60%以上的5株菌进行代谢液抑制病原菌活性试验 (表 3)。结果表明,代谢液处理病原菌生长24 h最大抑制率为34.15%,其他菌株抑菌率均在26.56%以上;培养48 h时最大抑菌率为56.84%,其他菌株在37.30%以上;培养72 h最大抑菌率为64.06%,其他菌株在60.98%以上。不同菌株间代谢液对病原菌抑菌率呈极显著差异 (P < 0.01)。由此可见,内生细菌代谢液对病原菌是逐步发挥抑菌作用,在培养72 h时抑制效果较好。与复筛抑制效果基本一致,进一步印证大豆根瘤内生细菌对棉花枯萎病菌的抑制作用主要是通过菌体产生胞外代谢物在发挥作用。
表 3. 复筛菌株代谢液对棉花枯萎病菌的拮抗作用 Table 3. The inhibitory effect of metabolic liquid from second screened endophytic bacteria against F. oxysporum f. sp. vasinfectum
| Endophytic bacteria | 1Colony diameter of pathogen/cm | 1Inhibition ratio of endophytic bacteria/% | 2Colony diameter of pathogen/cm | 2Inhibition ratio of endophytic bacteria/% | 3Colony diameter of pathogen/cm | 3Inhibition ratio of endophytic bacteria/% |
| CK | 3.69±0.03 | - | 5.12±0.01 | - | 6.51±0.02 | - |
| DD174 | 2.43±0.01 | 34.15±0.01A | 2.21±0.01 | 56.84±0.01A | 2.34±0.01 | 64.06±0.01A |
| DD166 | 2.54±0.01 | 31.17±0.01B | 2.34±0.01 | 54.30±0.02B | 2.38±0.01 | 63.44±0.01B |
| DD176 | 2.48±0.01 | 32.79±0.02C | 3.12±0.02 | 39.06±0.01C | 2.43±0.01 | 62.67±0.03C |
| DD179 | 2.62±0.01 | 29.00±0.01D | 3.17±0.01 | 38.09±0.01D | 2.51±0.01 | 61.44±0.01D |
| DD165 | 2.71±0.01 | 26.56±0.02E | 3.21±0.01 | 37.30±0.01E | 2.54±0.01 | 60.98±0.01E |
| CK: control without metabolic liquid; 1: cultured for 24 h; 2: cultured for 48 h; 3: cultured for 72 h.Different capital letters in the same column showed significant difference at P < 0.01 levels. | ||||||
表选项
2.4 受抑制病原菌菌丝的显微观察 荧光显微镜显微观察结果 (图 2) 表明,棉花枯萎病菌对照组菌丝 (图 2-A) 挺直、粗细均匀、颜色一致;而处理组受内生细菌DD174作用的菌丝畸形、粗细不一,细胞壁消失,出现自溶现象、局部发生断裂 (图 2-B-a);受DD179作用菌丝也呈现畸形,菌丝旋转扭结 (图 2-C-b),菌丝末端细胞壁溶解、菌丝变得透明、粗细不均一 (图 2-C-c);DD176作用菌丝基部加粗,分支增多,呈现树根状 (图 2-D-d);DD166作用菌丝被内生菌形成的生物膜包埋并使菌丝溶解、断裂 (图 2-E-e);DD165沿菌丝形成菌苔,固定菌丝于培养基表面,菌丝末端出现膨大呈球形 (图 2-F-f),且菌丝逐渐被溶解、断裂 (图 2-F-g)。
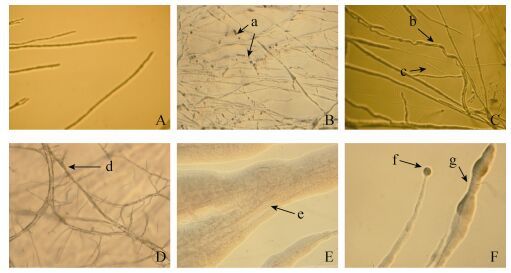 |
| 图 2. 大豆根瘤内生细菌对棉花枯萎病菌抑制作用时菌丝变化 Figure 2. Microscopic photography of inhibited hyphae ofF. oxysporum f. sp. vasinfectum (72 h, ×200). A: control; B: DD174; C: DD179; D: DD176; E: DD166; F: DD165. |
| 图选项 |
2.5 筛选菌株的培养特征及生理生化特性 筛选菌株经过72 h培养,菌落及菌体特征见图 3、表 4。菌落多数呈现乳白色、不透明、正反面颜色一致。其中DD176、DD165菌落较湿润。理化试验结果表明,5株菌对接触酶、V-P试验、D-葡萄糖产酸、肉汤、酪素分解反应都呈阳性;对L-阿拉伯糖产酸、苯丙氨酸脱氢酶反应均为阴性;D-甘露醇反应除DD174外其余菌株反应均为阳性;木糖反应除DD174、DD179外其他菌株反应为阳性;淀粉酶、卵黄磷脂酶、柠檬酸盐利用反应除DD176外其余菌株为阳性;硝酸还原酶、酪氨酸水解反应除DD176、DD165外其余菌株反应为阳性。菌体均为杆状,大小为 (0.25-1.00) μm×(2.0-4.0) μm。经革兰氏染色DD165为阴性,其他为阳性;除DD166、DD165外,其余菌株都有芽孢。结合菌体培养特征和生理生化反应特征,DD174、DD176、DD179符合芽孢杆菌属 (Bacillus) 特征,DD165、DD166符合寡养单胞菌属 (Stenotrophomonas) 特征。
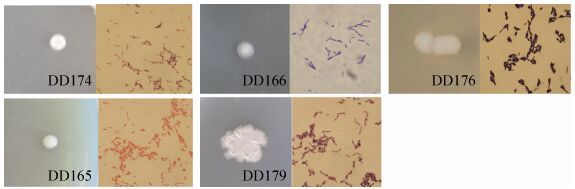 |
| 图 3. 筛选菌株菌落形态及菌体显微照片 Figure 3. Colony morphology and microscopic photography of screened strains. |
| 图选项 |
表 4. 筛选菌株的理化特性 Table 4. Physiological and biochemical characteristics of screened strains
| Physiological and biochemical characteristics | DD174 | DD166 | DD176 | DD179 | DD165 |
| Catalase test | + | + | + | + | + |
| V-P test | + | + | + | + | + |
| D-glucose acid yield | + | + | + | + | - |
| L-Arab sugar acid yield | - | - | - | - | - |
| D-mannitol | - | + | + | + | + |
| Xylose | - | + | + | - | + |
| Broth (pH 5.0) | + | + | + | + | + |
| Amylase | + | + | - | + | + |
| Phenylalanine deaminase | - | - | - | - | - |
| Lecithinase | + | + | - | + | + |
| Nitrate reductase | + | + | - | + | - |
| Casein decomposition | + | + | + | + | + |
| Citrate utilization | + | + | - | + | + |
| Tyrosine hydrolysate | + | + | - | + | + |
| Morphology | Rod | Rod | Rod | Rod | Rod |
| Strain size/μm | 1.0×(3.0-4.0) | 1.0×(2.0-4.0) | 1.0×(2.0-3.0) | 1.0×(2.0-3.0) | 0.25×(1.0-2.0) |
| Gram stain | G+ | G+ | G+ | G+ | G- |
| Spore forming | + | - | + | + | - |
| +: positive; -: negative. | |||||
表选项
2.6 筛选菌株16S rDNA序列测定及系统发育分析 对5株菌的基因组DNA进行PCR扩增,16S rDNA序列片段大小均为1.5 kb,将所得序列提交GenBank,获序列号为:KR822264、KF843715、KT216617、KT216618、KT216620。菌株间同源性分析 (表 5) 可知,这5株棉花枯萎病菌拮抗性较强内生细菌16S rDNA序列与GenBank中已报道相关菌株16S rDNA序列相似性均在99.7%以上。整个系统发育树 (图 4) 分为2个分支,菌株DD174、DD176和DD179位于分支Ⅰ (芽孢杆菌属Bacillus),其中DD174与模式株海洋沉淀芽孢杆菌Bacillus oceanisediminis H2T(GQ292772) 具有最大相似率 (99.8%);DD176、DD179与模式株苏云金芽孢杆菌Bacillus thuringiensis ATCC 10792T(AF290545) 均有最大相似率 (100%)。DD165与DD166在系统发育树上属于分支Ⅱ (寡养单胞菌属Stenotrophomonas),且与Stenotrophomonas maltophilia LMG 958T(X95923) 均具有最高相似率 (99.7%)。结合菌体培养特征、生理生化反应特征及系统发育分析,菌株DD174最相似于B. oceanisediminis,DD176、DD179最相似于B. thuringiensis,DD165、DD166最相似于S. maltophilia。因此,棉花枯萎病大豆根瘤内生拮抗细菌具有一定种属多样性。
表 5. 测序菌株的同源性分析 Table 5. Homology analysis of the sequenced strains
| Strain | Genus affiliation | Accession No. of 16S rDNA sequence | The most closet match | Similarity/% |
| DD165 | Stenotrophomonas | KR822264 | S. maltophilia LMG 958T(X95923) | 99.7 |
| DD166 | Stenotrophomonas | KT216620 | S. maltophilia LMG 958T(X95923) | 99.7 |
| DD174 | Bacillus | KT216617 | B. oceanisediminis H2T(GQ292772) | 99.8 |
| DD176 | Bacillus | KF843715 | B. thuringiensis ATCC 10792T(AF290545) | 100 |
| DD179 | Bacillus | KT216618 | B. thuringiensis ATCC 10792T(AF290545) | 100 |
表选项
 |
| 图 4. 筛选菌株16S rDNA序列系统发育树 Figure 4. Phylogenetic tree generated by the neighbor-joining method based on 16S rDNA sequences of selected strains. Bootstrap values (1000 replicates) above 50% are indicated above the branches. Strains tested are labeled in bold. Scale bar indicates 0.1% substitution of nucleotide. |
| 图选项 |
2.7 大豆根瘤内生细菌对盐碱抗性测定 结合复筛和代谢液抑菌效果,选取DD174进行盐碱抗性试验。从DD174抗盐生长曲线 (图 5) 可知,随着盐浓度升高,菌株生长潜伏期不断增长,在盐浓度为0%时延迟期最短 (8 h),盐浓度为6%时延迟期最长 (30 h);到达平稳期OD值随盐浓度升高逐渐减小,所有盐浓度在培养至58 h开始进入衰亡期。可见,此菌株在6%盐浓度下也能生长,具有一定抗性。
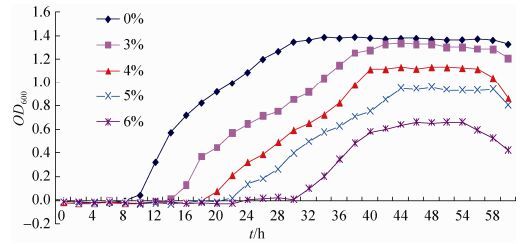 |
| 图 5. 内生细菌DD174的抗盐生长曲线 Figure 5. The salt resistantgrowth curve of endophytic strain DD174 from soybean root nodule. |
| 图选项 |
抗碱生长规律曲线 (图 6) 表明,pH 9时菌株延滞期最短 (10 h),pH 7、8时菌株延滞期为12 h;pH 10时菌株延滞期为16 h,对数期 (15 h) 之后进入平稳期,OD值在0.8-1.0之间,生长良好;在pH值达到11时菌株不再生长。可见,在一定碱性环境中内生菌可能产生某些物质调节生长环境的pH值,使其自身适合生长。因此,菌株DD174具有一定耐碱性。
 |
| 图 6. 大豆根瘤内生细菌DD174的抗碱生长曲线 Figure 6. Alkali resistant growth curve of endophytic strain DD174 from soybean root nodule. |
| 图选项 |
2.8 接种拮抗性内生细菌对棉花枯萎病的防病效果 盆栽试验表明,接种4周时对照组出现明显病状,叶色大面积发灰绿,叶片边缘出现不规则干枯,沿叶脉向叶片内部延伸,严重者叶片脱落,发病率为86.28%。而内生细菌处理组,只有部分叶片的接种点变黄,整片也仍然为绿色,发病程度相对CK较轻。由表 6可知,菌株DD174和DD166处理植株整体上发病率和病情指数均降低,植株发病率均小于33%,防治效果均在74%以上。另外,DD174处理植株叶片绿色,逐步正常,病斑面积不再扩大,生长趋正常;DD165处理植株部分叶片局部感病处发黄,病斑处出现枯死。而对照组叶片边缘大面积变灰绿、泛黄,枯萎面积扩大,植株生长受到严重影响。整体上,拮抗性内生细菌处理组病情指数和防治效果与对照相比达极显著 (P < 0.01),因此,可作为棉花枯萎病的生防菌株资源。
表 6. 拮抗性内生细菌在苗期对棉花枯萎病防治效果 Table 6. The control efficiency of antagonistic endophyic bacteria against F. oxysporum f. sp. vasinfectum
| Strains | Incidence/% | Disease index | Control efficacy/% |
| CK | 86.28±0.01A | 64.51±0.01A | / |
| DD174 | 27.66±0.01B | 16.19±0.01B | 76.32±0.01A |
| DD166 | 32.82±0.01C | 18.66±0.01C | 74.74±0.01B |
| DD176 | 37.22±0.01D | 19.52±0.01D | 67.58±0.01C |
| DD179 | 39.34±0.01E | 22.15±0.01E | 64.96±0.01D |
| DD165 | 39.78±0.01F | 23.43±0.01F | 62.46±0.01E |
| The data are mean±SD. Different uppercase letters in the same column show significant difference at P < 0.01 level. | |||
表选项
3 讨论 利用植物内生细菌来抑制植物病原微生物进行生物防治国内外已开展许多研究[2, 6, 17-20],但从豆科植物特殊组织——根瘤中筛选病原菌拮抗性菌株的研究较为少见[13],这些研究为棉花枯萎病生物防治提供了新思路和借鉴。本研究从大豆根瘤中分离276株内生细菌,经复筛和代谢液试验,有5株对棉花枯萎病菌具较强拮抗作用,其中DD174最大抑制率 (72 h) 为64.06%,但DD165抑制率为60.98%,进一步说明不同根瘤内生细菌对病原菌抑制作用不同,也证明内生细菌产生代谢液中包含代谢物质能有效抑制病原菌菌丝的生长和发育。本研究结果与易龙[14]、Fernando[17]试验结果类似,内生细菌Itb62无菌滤液对烟草赤星病菌丝生长有很强抑制作用;镜检发现菌丝形态受到明显影响,菌丝膨大呈结节状,成畸形菌丝,并且破裂、消解。盆栽防病试验表明防治效果为52.3%-75.8%[13]。而本研究盆栽防治效果最佳菌株DD174达76.32%,其余4株防治效果均在62%以上,和易龙等研究基本一致。但菌体代谢物中发挥抑制作用的具体成分我们正进一步研究。
芽孢杆菌 (Bacillus) 对环境具有较强适应性,是最普遍被报道的植物生长促生根际细菌,能产生多种次生代谢产物,如多肽类物质、多种胞外水解酶和抗菌物质 (Mycosubtilin、iturins、fengymycin、subsporin、bacilysin、fungistatin) 等,是枯草芽孢杆菌和解淀粉芽孢杆菌广泛抑制病原真菌的主要成分,对棉花枯萎病菌有较强拮抗作用[21]。本试验中筛选抑菌性较强菌株DD174、DD176和DD179最相似菌株均为芽孢杆菌属 (Bacillus)。产生的抗菌类物质分解消融病原菌细胞壁[22],导致原生质在菌丝末端外溢形成原生质球、破裂,对病原菌菌丝发挥较强抑菌作用[23]。本结果与林玲等[4]报道相一致,分离自棉花根部的枯萎病拮抗性内生菌中,芽孢杆菌属菌株属于优势种群。在逆境中能产生特殊休眠结构——芽孢,有助于该类细菌在高温、盐碱和干旱等不良环境中长期存在。在不利环境中芽孢杆菌能形成聚羟基烷酸酯,在缺少元素情况下能够争夺周围更多的元素供应给植物体。这些特性有力支持了本试验盐碱抗性试验结果,DD174可耐受6%盐浓度和pH 10碱,具有一定耐盐碱性。此外,DD174盆栽防治效果为76.32%,这与易龙[24]、Leite[25]等结论相一致,盆栽试验使用芽孢杆菌属内生菌处理烟草植株,对烟草赤星病防治效果为75.18%;短小芽孢杆菌AR03的无菌滤液能有效地抑制烟草赤星病菌菌丝生长,菌丝隔间变短、肿胀且集结成团,内含物聚集,菌丝顶端生长膨大畸形,减少孢子萌发或产生畸形芽管。前期试验结果[14]表明,大豆根瘤内生细菌DD174作用于植物病原菌烟草赤星,菌丝变成结节状,菌丝末端逐渐变细且有斑点、相互缠绕;分离自野生艾蒿的芽孢杆菌属菌株S11对棉花枯萎病菌有抑制作用,导致菌丝发生畸形扭曲。因此,DD174具有一定耐盐碱性和较强生物防治活性,是潜在的作物病害生防资源。
寡养单胞菌属 (Stenotrophomonas) 对真菌性植物病菌都有潜在的生物控制作用,大多数菌株具有抗真菌活性和超常水解活性,因其可产生新的抗真菌化合物maltophilin、xanthobaccin[26]、挥发性有机化合物 (VOCs)[27]、多样化蛋白酶、几丁质酶、葡聚糖酶、酯酶和漆酶等[28]。这些酶类水解病原真菌细胞壁,菌丝因缺乏机械强度弯曲、畸形,末端膨大变形,原生质浓缩,最终导致其死亡;此外,可激发宿主防御机制[29]。本试验与DD165、DD166最相似菌株为嗜麦芽寡养单胞菌 (S. maltophilia),对棉花枯萎病菌的抑制率在60%以上,盆栽防治效果在62%以上。前期试验已表明[11],大豆根瘤内生细菌DD299 (S. maltophilia) 接种水稻苗整体上发病率和病情指数均明显降低,防治效果在66%以上,均证实大豆根瘤内生细菌中嗜麦芽寡养单胞菌具有防治病原真菌的潜能。本研究与Jha等[30]报道相一致,水稻根部的嗜麦芽寡养单胞菌不仅对稻瘟病菌抑制效果明显,且能促进水稻生长。复筛结果表明,随培养时间延长对照组病菌菌落逐渐变大,但处理组病原菌菌落变化却不明显,这可能是由于内生菌DD165、DD166生长速度快,在培养基表面迅速形成生物薄膜 (biofilm),能更好地适应周围生存环境,占据营养空间,具更强抗逆性[31]和降解能力,导致病原真菌因缺乏营养而生长受抑制[32];另外,对棉花枯萎病菌菌丝进行包埋、物理粘附或机械阻碍,并产生次生代谢产物,对病原菌菌丝可能产生抑制作用,是潜在的植物病原菌生防资源。目前,未见关于大豆根瘤内生细菌抑制棉花枯萎病菌的相关报道,但其大田应用还有待进一步试验研究。
4 结论 本研究有5株内生细菌对棉花枯萎病菌具较强拮抗作用。内生细菌作用棉花枯萎病菌,引起菌丝发生畸形、细胞壁消失、自溶,菌丝基部加粗、分支增多,呈树根状;菌丝被菌苔包埋而溶解、断裂,菌丝末端球形膨大。对病原菌抑制作用主要通过菌体产生的胞外代谢物发挥作用。筛选5株内生菌属于2个属,即Bacillus、Stenotrophomonas。DD174具较强耐盐碱能力,对棉花枯萎病防治效果达76.32%,其余4株防治效果均在62%以上,可作为棉花枯萎病的生防菌株资源。筛选大豆根瘤内棉花枯萎病菌拮抗性菌株,为发掘和应用抗逆、防病优良菌株提供理论基础。
参考文献
| [1] | Shapulatov UM, Buriev ZT, Ulloa M, Saha S, Devor EJ, Ayubov MS, Norov TM, Shermatov SE, Abdukarimov A, Jenkins JN, Abdurakhmonov IY. Characterization of small RNAs and their targets from Fusarium oxysporum infected and noninfected cotton root tissues.Plant Molecular Biology Reporter, 2016, 34(3): 698–706DOI:10.1007/s11105-015-0945-z. |
| [2] | Pereg L, McMillan M. Scoping the potential uses of beneficial microorganisms for increasing productivity in cotton cropping systems.Soil Biology and Biochemistry, 2015, 80: 349–358DOI:10.1016/j.soilbio.2014.10.020. |
| [3] | Li CH, Deng YY, Zhao MW, Tang CM, Li SP, Lv HW. Population dynamics and antagonism toward Fusarium oxysporium f. sp. vasinfectum and Verticillium dahliae Kleb of endophytic bacteria from cotton.Acta Microbiologica Sinica, 2009, 49(9): 1196–1202(in Chinese). 李春宏, 邓渊钰, 赵明文, 唐灿明, 李顺鹏, 吕海伟. 棉花内生细菌数量动态及其对棉花黄、枯萎病菌的拮抗作用.微生物学报, 2009, 49(9): 1196–1202. |
| [4] | Lin L, Wang MJ, Zhou YJ. Diversity analysis of culturable endophytic bacteria with antagonistic activity against Fusarium oxysporum f. sp. vasinfectum or Verticillium dahliae from the roots of Gossypium hirsutum.Cotton Science, 2015, 27(2): 166–175(in Chinese). 林玲, 王明江, 周益军. 棉花根部拮抗枯萎病菌或黄萎病菌的可培养内生细菌多样性分析.棉花学报, 2015, 27(2): 166–175.DOI:10.11963/issn.1002-7807.201502010 |
| [5] | Rajendran G, Sing F, Desai AJ, Archana G. Enhanced growth and nodulation of pigeon pea by co-inoculation of Bacillus strains with Rhizobium spp..Bioresource Technology, 2008, 99(11): 4544–4550DOI:10.1016/j.biortech.2007.06.057. |
| [6] | Rosenblueth M, Martínez-Romero E. Bacterial endophytes and their interactions with hosts.Molecular Plant-Microbe Interactions, 2006, 19(8): 827–837DOI:10.1094/MPMI-19-0827. |
| [7] | Stierle A, Strobel G, Stierle D. Taxol and taxane production by taxomyces andreanae, an endophytic fungus of Pacific yew.Science, 1993, 260(5105): 214–216DOI:10.1126/science.8097061. |
| [8] | Kuklinsky-Sobral J, Araújo WL, Mendes R, Geraldi IO, Pizzirani-Kleiner AA, Azevedo JL. Isolation and characterization of soybean-associated bacteria and their potential for plant growth promotion.Environmental Microbiology, 2004, 6(12): 1244–1251DOI:10.1111/emi.2004.6.issue-12. |
| [9] | De Meyer SE, De Beuf K, Vekeman B, Willems A. A large diversity of non-rhizobial endophytes found in legume root nodules in Flanders (Belgium).Soil Biology and Biochemistry, 2015, 83: 1–11DOI:10.1016/j.soilbio.2015.01.002. |
| [10] | Compant S, Duffy B, Nowak J, Clément C, Barka EA. Use of plant growth-promoting bacteria for biocontrol of plant diseases:principles, mechanisms of action, and future prospects.Applied and Environmental Microbiology, 2005, 71(9): 4951–4959DOI:10.1128/AEM.71.9.4951-4959.2005. |
| [11] | Zhao LF, Xu YJ, Cao DJ, Li Y, Li JJ, Lü JM, Zhu ZY, Qin SS, He XL. Screening, resistance, phylogeny and growth promoting of phosphorus solubilizing bacteria isolated from soybean root nodules.Acta Ecologica Sinica, 2015, 35(13): 4425–4435(in Chinese). 赵龙飞, 徐亚军, 曹冬建, 李源, 厉静杰, 吕佳萌, 朱自亿, 秦珊珊, 贺学礼. 溶磷性大豆根瘤内生菌的筛选、抗性及系统发育和促生.生态学报, 2015, 35(13): 4425–4435. |
| [12] | Zhao LF, Xu YJ, Chang JL, Li M, Zhang YL, Dang YJ, Wang MS, Cheng YW, Zhang BY. Screening, resistance and growth-promoting effect of endophytic bacteria with ACC deaminase activity isolated from soybean nodules.Acta Microbiologica Sinica, 2016, 56(5): 1009–1021(in Chinese). 赵龙飞, 徐亚军, 常佳丽, 李敏, 张艳玲, 党永杰, 王梦思, 程亚稳, 张斌月. 具ACC脱氨酶活性大豆根瘤内生菌的筛选、抗性及促生作用.微生物学报, 2016, 56(5): 1009–1021. |
| [13] | Zhao LF, Xu YJ, Hou YT, Zou YH, Li YN, Yang ZH, Li XY, Zhang MY. Screening and inhibition of antagonistic endophytic bacteria isolated from soybean (Glycine max) nodules against Alternaria longipes.Chinese Journal of Applied Ecology, 2016, 27(5): 1560–1568(in Chinese). 赵龙飞, 徐亚军, 侯怡婷, 邹艳慧, 李亚楠, 杨志华, 李小雨, 张梦瑶. 烟草赤星病菌拮抗性大豆根瘤内生菌的筛选及抑制作用.应用生态学报, 2016, 27(5): 1560–1568. |
| [14] | Yi L, Xiao CG, Ma GH, Wang WN, Long LK. Inhibition and screening of beneficial endophytic bacteria to control tobacco brown spot.Acta Microbiologica Sinica, 2004, 44(1): 19–22(in Chinese). 易龙, 肖崇刚, 马冠华, 王万能, 龙良鲲. 防治烟草赤星病有益内生细菌的筛选及抑菌作用.微生物学报, 2004, 44(1): 19–22. |
| [15] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册.北京: 科学出版社, 2001. |
| [16] | 方中达. 植病研究方法.第3版.北京: 中国农业出版社, 1998. |
| [17] | Fernando WGD, Ramarathnam R, Krishnamoorthy AS, Savchuk SC. Identification and use of potential bacterial organic antifungal volatiles in biocontrol.Soil Biology and Biochemistry, 2005, 37(5): 955–964DOI:10.1016/j.soilbio.2004.10.021. |
| [18] | Maldonado-González MM, Prieto P, Ramos C. From the root to the stem:interaction between the biocontrol root endophyte Pseudomonas fluorescens PICF7 and the pathogen Pseudomonas savastanoi NCPPB 3335 in olive knots.Microbial Biotechnology, 2013, 6(3): 275–287DOI:10.1111/1751-7915.12036. |
| [19] | Gond SK, Bergen MS, Torres MS, White JF Jr. Endophytic Bacillus spp. produce antifungal lipopeptides and induce host defence gene expression in maize.Microbiological Research, 2015, 172: 79–87DOI:10.1016/j.micres.2014.11.004. |
| [20] | Santoyo G, Moreno-Hagelsieb G, Orozco-Mosqueda MDC, Glick BR. Plant growth-promoting bacterial endophytes.Microbiological Research, 2016, 183: 92–99DOI:10.1016/j.micres.2015.11.008. |
| [21] | Cawoy H, Debois D, Franzil L, De Pauw E, Thonart P, Ongena M. Lipopeptides as main ingredients for inhibition of fungal phytopathogens by Bacillus subtilis/amyloliquefaciens.Microbial Biotechnology, 2015, 8(2): 281–295DOI:10.1111/mbt2.2015.8.issue-2. |
| [22] | Guo QG, Dong WX, Li SZ, Lu XY, Wang PP, Zhang XY, Wang Y, Ma P. Fengycin produced by Bacillus subtilis NCD-2 plays a major role in biocontrol of cotton seedling damping-off disease.Microbiological Research, 2014, 169(7/8): 533–540. |
| [23] | Yánez-Mendizábal V, Zeriouh H, Vi?as I, Torres R, Usall J, de Vicente A, Pérez-García A, Teixidó N. Biological control of peach brown rot (Monilinia spp.) by Bacillus subtilis CPA-8 is based on production of fengycin-like lipopeptides.European Journal of Plant Pathology, 2012, 132(4): 609–619DOI:10.1007/s10658-011-9905-0. |
| [24] | Yi L, Ma GH, Yang SY, Xiao CG. Identification of the antagonistic Bacterium Ata 28 and its inhibition of tobacco brown spot.Journal of Southwest University (Natural Science Edition), 2007, 29(3): 100–103(in Chinese). 易龙, 马冠华, 杨水英, 肖崇刚. 拮抗菌Ata 28对烟草赤星病菌的抑制及种类鉴定.西南大学学报 (自然科学版), 2007, 29(3): 100–103. |
| [25] | Leite HAC, Silva AB, Gomes FP, Gramacho KP, Faria JC, de Souza JT, Loguercio LL. acillus subtilis and Enterobacter cloacae endophytes from healthy Theobroma cacao L. trees can systemically colonize seedlings and promote growth.Applied Microbiology and Biotechnology, 2013, 97(6): 2639–2651DOI:10.1007/s00253-012-4574-2. |
| [26] | Nakayama T, Homma Y, Hashidoko Y, Mizutani J, Tahara S. Possible role of xanthobaccins produced by Stenotrophomonas sp. strain SB-K88 in suppression of sugar beet damping-off disease.Applied and Environmental Microbiology, 1999, 65(10): 4334–4339. |
| [27] | Wheatley RE. The consequences of volatile organic compound mediated bacterial and fungal interactions.Antonie van Leeuwenhoek, 2002, 81(1): 357–364DOI:10.1023/A:1020592802234. |
| [28] | Galai S, Limam F, Marzouki MN. A new Stenotrophomonas maltophilia strain producing laccase. Use in decolorization of synthetics dyes.Applied Biochemistry and Biotechnology, 2009, 158(2): 416–431DOI:10.1007/s12010-008-8369-y. |
| [29] | Ryan RP, Monchy S, Cardinale M, Taghavi S, Crossman L, Avison MB, Berg G, van der Lelie D, Dow JM. The versatility and adaptation of bacteria from the genus Stenotrophomonas.Nature Reviews Microbiology, 2009, 7(7): 514–525DOI:10.1038/nrmicro2163. |
| [30] | Jha Y, Subramanian RB. Root associated bacteria from the rice antagonizes the growth of Magnaporthe grisea.Journal Plant Pathology & Microbiology, 2013, 4(2): 1000164. |
| [31] | Scher K, Romling U, Yaron S. Effect of heat, acidification, and chlorination on Salmonella enterica serovar typhimurium cells in a biofilm formed at the air-liquid interface.Applied and Environmental Microbiology, 2005, 71(3): 1163–1168DOI:10.1128/AEM.71.3.1163-1168.2005. |
| [32] | Vitullo D, Di Pietro A, Romano A, Lanzotti V, Lima G. Role of new bacterial surfactins in the antifungal interaction between Bacillus amyloliquefaciens and Fusarium oxysporum.Plant Pathology, 2012, 61(4): 689–699DOI:10.1111/ppa.2012.61.issue-4. |
