张娟1, 石超2, 王丽娜1, 柯文灿1, 陈明1, 郭旭生1

 , 丁武蓉1
, 丁武蓉1

1.兰州大学生命科学学院, 草地农业生态系统国家重点实验室, 甘肃 兰州 730020;
2.兰州生物制品研究所, 甘肃 兰州 730046
收稿日期:2016-10-27;修回日期:2016-12-18;网络出版日期:2016-12-29
基金项目:国家自然科学基金(31272486)
*通信作者:郭旭生, guoxsh07@lzu.edu.cn
丁武蓉, E-mail:dingwurong@lzu.edu.cn
摘要:[目的]本研究通过构建大鼠高脂结构模型来探究一株植物乳杆菌Lp3的益生作用。[方法]]植物乳杆菌Lp3筛选自青藏高原地区传统发酵的牦牛酸奶,初步认定Lp3是一株具有良好耐受力的降胆固醇菌株,且体外益生特性突出,本研究通过建立高脂SD大鼠模型,在饲喂试验动物高脂饲料的同时灌胃植物乳杆菌Lp3,来确定该菌株对试验动物血脂的影响效果,并同时研究其对大鼠肠道菌群、粪便水分、粪便中胆固醇和胆汁酸含量的影响,以及对肝脏组织中的胆固醇(TC)和甘油三酯(TG)的影响。[结果]结果表明,植物乳杆菌Lp3对大鼠没有任何明显的毒副作用,对高脂模型大鼠具有良好的降血脂效果。饲喂高脂饲料并灌喂乳酸菌Lp3组大鼠(HL)的血清总胆固醇、甘油三酯和低密度脂蛋白胆固醇含量较饲喂高脂饲料组(HC)显著减少(P < 0.05),但是高密度脂蛋白胆固醇的含量变化并不明显。HC组大鼠与HL组及饲喂普通日粮组(对照组)大鼠相比较,HC组大鼠粪便中大肠杆菌数量明显增加,双歧杆菌、乳杆菌数量明显减少。但是灌胃乳酸菌的HL组大鼠的粪便中乳杆菌数略高于对照组,大肠杆菌和双歧杆菌数量和对照组大鼠的基本一致。表明植物乳杆菌Lp3具有维持肠道菌群平衡的作用。此外灌胃乳酸菌后HL组大鼠粪便含水量比HC组要高6.44%。HC组大鼠肝脏组织中胆固醇和甘油三酯要显著高于HL组(P < 0.05),说明Lp3可以减少脂类物质在肝脏组织中的沉积。从肝脏组织切片来看,也可以得出上述结论。[结论]结果表明本研究所筛选的植物乳杆菌Lp3对高脂大鼠具有值得深入研究的益生作用。
关键词: 乳酸菌 大鼠 降胆固醇 益生作用
Probiotic role of Lactobacillus plantarum Lp3 on hyperlipidemia rats
Zhang Juan1, Shi Chao2, Wang Lina1, Ke Wencan1, Chen Ming1, Guo Xusheng1

 , Ding Wurong1
, Ding Wurong1

1.State Key Laboratory of Grassland Argo-ecosystems, School of Life Sciences, Lanzhou University, Lanzhou 730020, Gansu Province, China;
2.Lanzhou Institute of Biological Products, Lanzhou 730046, Gansu Province, China
Received 27 October 2016; Revised 18 December 2016; Published online 29 December 2016
*Corresponding author: Guo Xusheng, guoxsh07@lzu.edu.cn
Ding Wurong, E-mail:dingwurong@lzu.edu.cn
Supported by the National Natural Science Foundation of China (31272486)
Abstract: [Objective]In this study, we explored the probiotic effect of Lactobacillus plantarum Lp3 on fatty rats.[Methods]In vitro Lp3 with high hypocholesterolemic effects was isolated from Yak yogurt in Qinghai Tibet Plateau. We established a Sprague Dawley rat model of hyperlipidemia to determine the effect of the strain on blood lipids in experimental animals, and to study the effects on the intestinal flora, fecal moisture, cholesterol levels and bile acids of fecal, and the changes of cholesterol and triglycerides levels in the liver of SD rats. Thirty rats were assigned to three groups and fed either a normal or a high-cholesterol diet. The LAB treated group received the high-cholesterol diet supplemented with Lactobacillus plantarum Lp3.[Results]Lactobacillus plantarum Lp3 had no obvious side effects in rats and had a good cholesterol-lowering effect in high fat model rats. Lactobacillus plantarum Lp3 could significantly reduce serum total cholesterol, triglycerides and LDL-cholesterol levels in rats fed a high fat diet compared with the control group (P < 0.05), but no difference was observed in high-density lipoprotein cholesterol. Compared with other two groups of rats, number of E. coli in feces of high fat fed rats group (HC) had obvious increase, the number of Bifidobacterium and Lactobacillus decreased significantly. But in high fat and LAB fed rats group (HL), the number of Lactobacillus in the feces was slightly higher than that in control group. The number of E. coli and Bifidobacteria were almost same as that in the control group. The results indicated that Lp3 could maintain the balance of intestinal flora and increase the moisture content in feces about 6.44% compared with HC group. Cholesterol and triglyceride in the liver tissue of the high fat fed rats group (HC) were significantly higher than high fat and LAB fed rats HL group (P < 0.05). Lp3 could reduce lipid deposition in liver tissue. From histology of liver steatosis, we could also draw out the above conclusion. Cholesterol and bile acid contents in feces of HL group were higher than the HC group.[Conclusion]Lactobacillus plantarum Lp3 has probiotic potentials.
Key words: lactic acid bacteria rats cholesterol-lowing the probiotic effect
近年来心脑血管疾病的患病率和死亡率一直呈上升的趋势,严重威胁人类健康。降脂药物虽然可以有效降低人体血脂水平,但是长期服用对人体有明显的毒副作用。流行病学调查和临床观察也证实了,血清总胆固醇和心血管疾病的发病率之间始终存在着一定关系[1]。因此,找到一种对人类安全有效的降胆固醇方法已成为研究热点。
20世纪初,俄国著名的生物学家梅契尼柯夫发表了著名的《长寿学说》,最先从科学角度揭示了乳酸菌的保健和医疗价值[2],1974年Mann和Spoerry发现非洲Masai部落的人平时大量饮用乳酸菌发酵的乳制品,这些牧民的血清胆固醇相对较低[3]。随后不断有研究表明乳酸菌及其发酵的酸奶具有降低血清胆固醇的能力。1983年Bazzare提出摄入益生的乳酸菌对人类来说也许是最为安全的降低血清胆固醇的方法[4]。迄今为止,已有大量研究表明,乳酸菌可以有效降低老鼠[5-6]、猪[7-9]和人[10]的血清胆固醇。
青藏高原牧民的饮食结构非常简单,主要食物为牛羊肉、糟粑、酥油茶以及奶和奶制品等[11],几乎每年至少有8个月甚至全年没有蔬菜和水果,并且主食的牦牛奶与普通的牛奶相比含有更高的脂肪[12],然而牧民们并没有心脑血管疾病高发的现象,很有可能在牦牛奶中存在有具有强降胆固醇能力的菌株。潘道东等从新疆酸马奶中筛选的发酵乳杆菌SM-7在体内外试验中均有良好的降胆固醇能力[13]。本研究首先建立高脂SD大鼠模型,在饲喂试验动物高脂饲料的同时灌胃植物乳杆菌Lp3,以此来确定该菌株对试验动物血脂的影响效果,并同时研究其对大鼠肠道菌群和粪便水分的影响等。植物乳杆菌Lp3筛选至青藏高原地区传统发酵的牦牛酸奶,通过乳酸菌降解胆固醇能力的测定,以及耐受模拟胃肠道、胆盐和疏水能力试验,最终确定Lp3是一株具有良好耐受力的降胆固醇菌株,且体外益生特性突出,可用于动物试验。其中,该菌株的胆固醇降解率达到了(73.26±2.47)%;在人工胃液消化3 h后的存活率为92.48%,在人工肠液中消化3 h存活率为91.02%,6 h后的存活率为87.91%,24 h后的存活率为61.24%,表现出对人工胃肠液较强的耐受性;对0.3%胆盐不敏感,迟滞期为0.71 h,且该菌株的细胞表面输水率为(58.41±9.44)%,表明有较强的粘附性。以上试验对降胆固醇药物研究,开发利用极地微生物,建立我国乳酸菌种质资源库具有重要的意义。
1 材料和方法 1.1 试验动物 5周龄雄性SD(Sprague Dawley)大鼠30只,体重范围在120–130 g之间,购于甘肃中医药大学实验动物中心。喂养于单独隔离的鼠笼,室温维持在(23±2)℃,相对湿度为(55±5)%,定时12 h光照和12 h黑暗,并定期更换饮水和锯末。
1.2 饲料成分 普通饲料(北京科澳协力饲料有限公司):粗蛋白229.9 g/kg,粗脂肪48.4 g/kg,粗纤维36.0 g/kg,水分91.6 g/kg,钙11.3 g/kg,总磷7.2 g/kg,粗灰分63.7 g/kg。
高脂饲料(江苏美迪森生物科技有限公司),成分如表 1所示。
表 1. 高脂饲料成分 Table 1. Composition of high fat diet
| Parameters | Ratios/% |
| Casein | 22.18 |
| Corn starch | 23.70 |
| Maltodextrin | 7.87 |
| Sucrose | 12.53 |
| Cellulose | 5.54 |
| Soya-bean oil | 2.77 |
| Cocoa butter | 17.19 |
| L-Cystine | 0.33 |
| Composite minerals | 4.99 |
| Multi-vitamins | 1.11 |
| Choline bitartrate | 0.22 |
| Cholesterol | 1.25 |
| Sodium cholate hydrate | 0.30 |
表选项
1.3 试验动物分组及饲喂方式 第1周适应期由大鼠自由饮水取食,基础饲料购自北京科澳协力饲料有限公司。适应1周后,称量大鼠体重,将大鼠随机分为3组,每组10只,分组情况如表 2所示。
表 2. 试验动物分组情况 Table 2. The groups of experimental animals
| Groups | Numbers of rats | Assigned diets |
| Control group | 10 | Normal diet |
| Model Group (HC) | 10 | High-cholesterol diet |
| Model Group (HL) | 10 | High-cholesterol diet + Lp3 |
表选项
各组均饲养7周,在试验期间,每天称重喂食量和剩余饲料量,计算大鼠每天的采食量。每周固定时间称量大鼠体重并记录,按照公式(1) 计算食物利用率。
 | 公式(1) |
1.5 血液采集与检测 从大鼠适应期开始,每隔7 d将大鼠禁食12 h,断尾取血1 mL。冰上静置2 h,4 ℃冰箱静置过夜,待血清自然析出后,4 ℃、3000 r/min离心1 min,分离血清,弃去不溶物质,将血清转移至干净离心管,于-20 ℃贮存待测。
根据购买的血清胆固醇各指标试剂盒的说明书对总胆固醇、甘油三酯、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇含量进行测定。
1.6 粪便采集及测定
1.6.1 粪便中各菌数的测定: 每周同一时间采集大鼠新鲜粪便至灭菌离心管中称重,按1:9加入灭菌生理盐水,适当稀释,选取适宜的稀释液涂布于EMB、LBS、BSM三种培养基进行活菌计数。EMB (伊红美蓝琼脂)用于粪便中大肠杆菌活菌计数,于37 ℃有氧培养48 h。LBS用于乳杆菌计数,于37 ℃厌氧培养48 h。BSM培养基用于双歧杆菌计数,于37 ℃厌氧培养48 h。每个试验组设3个平行。
1.6.2 粪便水分测定: 将铝盒洗干净放入干燥箱,烘干至恒重,记录下铝盒重量W0。将每周采集的新鲜粪便收集于铝盒,记录下总重量W1。然后把铝盒放入电热鼓风干燥箱,105 ℃干燥48 h至恒重后,取出后放入干燥箱,记录下总重量W2。粪便水分含量按照公式(2) 计算。
 | 公式(2) |
1.6.3 粪便中胆固醇和胆汁酸测定: 将最后1周收集的粪便放入无菌试管中,准确称取1 g粪便重量,按照重量(g):体积(mL)=1:9的比例,加入9倍体积的匀浆介质,冰浴条件下机械匀浆,2500 r/min离心10 min,取上清液测定胆固醇和总胆汁酸含量。
根据购买的胆汁酸试剂盒和胆固醇试剂盒的说明书分别对粪便中总胆汁酸和胆固醇含量进行测定。
1.7 动物处死 动物处死前禁食12 h,乙醚麻醉,心脏采血2 mL。立即取出肝脏、脾脏、肾脏后用预冷的无菌生理盐水冲去血液,滤纸擦干,称重并记录。从大鼠肝脏最大肝叶中(同一部位)切取1 cm × 1 cm大小的组织块,放入10%甲醛溶液中固定24 h,送至甘肃中医药大学进行HE组织染色。其余肝脏组织放入-20 ℃冰箱,并尽快进行后续试验。
1.8 肝脏组织处理
1.8.1 肝脏组织中TG和TC含量测定: 将肝脏组织从冰箱中取出,称取1 g组织块,于干净离心管中,用高速匀浆器匀浆(冰浴),以1:9的体积比加入Folch溶液(氯仿:甲醛=2:1),充分混匀。5000 r/min离心2 min,吸取上清液。按照试剂盒说明书上的步骤测定肝脏组织中总胆固醇和甘油三酯含量。
1.8.2 肝脏组织切片与HE染色: 将固定好的组织块送至甘肃中医药大学实验中心,经过包埋、切片、脱蜡、HE染色等步骤完成组织切片的制作。
1.9 数据处理 基础数据利用Excel 2010软件处理,SPSS软件的一般线性模型进行单因素方差分析与Duncan多重比较。用origin 8.6绘图软件进行绘图。
2 结果和讨论 2.1 各组大鼠体重增加量、采食量和饲料利用率 在试验期间,大鼠的体重增加量、总采食量及饲料利用率结果如表 3所示。在体重增加方面,可以看出HC组大鼠的体重增加量要显著高于其他两组(P < 0.05)。HL组的大鼠体重增加量要低于HC组的大鼠体重增加量,这可能是由于灌胃的乳酸菌影响大鼠的脂质代谢,在一定程度上减少了大鼠的体重增加量。在采食量上,对照组的大鼠要显著高于饲喂高脂饲料的大鼠(P < 0.05),这可能与饲料中添加的胆固醇和油脂导致大鼠食欲下降的结果。HC组和HL组大鼠的食物利用率要显著高于对照组的大鼠。
表 3. 各组大鼠体重增加量、采食量和饲料利用率 Table 3. The increased weight, feed intake and feed utilization rate of rats in each group
| Groups | Increased weight/g | Feed intake/g | Feed utilization/% |
| Control group | 177.86±16.40b | 957.53±38.86a | 18.55±1.27b |
| HC | 204.09±22.77a | 763.89±57.79b | 26.73±2.18a |
| HL | 181.71±24.32b | 721.02±60.81b | 25.27±2.92a |
| The data of different letters within the same column mean significant difference (P < 0.05). The same letters represent no significant difference (P > 0.05). C, HC and HL stand for the ordinary diet treatment group, high fat diet treatment group and high fat diet + Lactobacillus treatment group, respectively, the same below. (x±SD, n=10). | |||
表选项
2.2 大鼠脏器指数 在试验期间各组大鼠食欲正常,毛色光洁,没有出现死亡和异常行为。从表 4中可以看出,HC组和HL组大鼠的肝脏指数显著高于对照组大鼠,表明大鼠在摄入高脂饲料的时候,由于过多地摄入了胆固醇,这些胆固醇不能被完全代谢掉,就会在肝脏组织内沉积下来,导致肝脏的重量升高。而HL组大鼠的肝脏指数略低于HC组大鼠(差异不显著),这说明灌胃的乳酸菌可以减少脂类在大鼠肝脏内的沉积。而肾脏指数和脾脏指数在三组之间没有显著变化,这说明了灌胃的植物乳杆菌Lp3对于SD大鼠没有明显的毒副作用。
表 4. 各组大鼠脏器指数 Table 4. The organ index of rats in each group
| Groups | Liver weight/% | Kidney weight/% | Spleen weight/% |
| Control group | 3.46±0.17b | 0.68±0.05 | 0.17±0.03 |
| HC | 5.32±0.41a | 0.64±0.04 | 0.20±0.04 |
| HL | 4.90±0.34a | 0.62±0.02 | 0.16±0.05 |
| The data of different letters within the same column mean significant difference (P < 0.05). The same letters represent no significant difference (P > 0.05). (x±SD, n=10). | |||
表选项
2.3 血脂各指标检测结果
2.3.1 SD大鼠血清总胆固醇含量变化: 从图 1-A中可以看出,对照组和HC、HL组的大鼠在第1周时的血清总胆固醇含量没有显著差异。第2周时HC组和HL组大鼠的血清总胆固醇含量较对照组明显升高,且差异显著(P < 0.05),这表明给大鼠饲喂高脂饲料后,在第2周时高血脂动物模型已经基本形成。对照组大鼠的血清总胆固醇含量在饲喂期间基本恒定。从第3周开始,HL组大鼠血清TC含量与HC组比较,均有所下降,且与HC组之间差异显著(P < 0.05)。这说明植物乳杆菌Lp3可显著降低大鼠血清总胆固醇的含量。
 |
| 图 1 SD大鼠血清总胆固醇(A)、甘油三酯(B)、低密度脂蛋白胆固醇(C)、高密度脂蛋白胆固醇(D)含量变化 Figure 1 Changes of serum total cholesterol content (A), triglyceride content (B), low (C) and high-density lipoprotein cholesterol levels (D) in SD rats. Each time point of the top of histograms with different letters indicate a significant difference (P < 0.05). The same below. Error bars represent standard error (n=3). |
| 图选项 |
2.3.2 SD大鼠血清中甘油三酯(TG)含量变化: 三组大鼠血清中甘油三酯(TG)含量变化如图 1-B所示。从第2周开始饲喂高脂饲料的两组大鼠的TG含量显著高于对照组(P < 0.05)。从第3周到第5周,HC组大鼠血清中TG含量显著高于对照组大鼠(P < 0.05),HC组和HL组之间没有显著差异,但是HL组大鼠血清中TG含量要低于HC组。从第6周开始,HC组大鼠血清中TG含量要显著高于HL组和对照组大鼠(P < 0.05)。这说明灌胃植物乳杆菌Lp3具有降低高脂大鼠血清中甘油三酯含量的作用。
自第2周起,饲喂高脂饲料的大鼠的血清胆固醇和甘油三酯的含量就明显高于对照组大鼠,说明了本试验中高脂模型已基本形成。这一结果表明,在饲料中添加胆固醇和油脂类物质是可以诱导试验动物脂类物质代谢紊乱,从而引起血清胆固醇和甘油三酯的升高。这种通过增加饮食中胆固醇和脂肪含量来建立高血脂动物模型的方法在很多研究中都采用过。
2.3.3 SD大鼠血清低密度脂蛋白胆固醇含量变化: SD大鼠血清中低密度脂蛋白胆固醇含量变化如图 1-C所示。从第2周开始HC组大鼠的低密度脂蛋白胆固醇(LDL-C)含量显著高于HL组大鼠,而HL组大鼠的低密度脂蛋白胆固醇含量显著高于对照组(P < 0.05),这表明灌胃乳酸菌对大鼠血清中低密度脂蛋白胆固醇具有一定的降低作用,但是仍不能达到正常水平。
2.3.4 SD大鼠血清中高密度脂蛋白胆固醇含量变化: 如图 1-D所示血清中高密度脂蛋白胆固醇在三组之间没有显著差异,但是总体来看,HL组大鼠的HDL-C含量略高于其他两组,这说明灌胃乳酸菌Lp3对于高密度脂蛋白的含量有一定影响,但是效果不明显。
从以上结果可以看出,灌胃植物乳杆菌Lp3可以有效降低高脂大鼠的血清中总胆固醇、甘油三酯和低密度脂蛋白胆固醇含量,但是对高密度脂蛋白胆固醇浓度的影响不大。
2.4 粪便各指标测定结果
2.4.1 粪便水分测定结果: 从图 2-A中可以看出来,对照组大鼠的粪便水分含量最高,保持在70%左右。HC大鼠和HL组大鼠的粪便水分含量较低,而HL组大鼠粪便水分比HC组大鼠平均高了6.44%,这与这两组大鼠所喂食的饲料成分有很大的关系。
 |
| 图 2 SD大鼠粪便中水分含量(A)、大肠杆菌数量(B)、乳杆菌数量(C)、双歧杆菌数量(D)变化 Figure 2 The changes of water content (A), the number of E. coli (B), Lactobacillu (C) and Bifidobacteria (D) in the feces of SD rats. Error bars represent standard error (n=3). |
| 图选项 |
2.4.2 粪便中各菌数变化: 我们通过测定大鼠粪便中大肠杆菌、乳酸杆菌和双歧杆菌的活菌数来研究大鼠肠道内这三类菌群的组成情况。从图 2-B、C和D中可以看出,HC组大鼠粪便中大肠杆菌数量要明显高于其他两组,乳杆菌和双歧杆菌的数量要低于其他两组,这说明只饲喂高脂饲料以后,大鼠粪便中的微生物菌群有了明显变化。
2.4.3 粪便中胆固醇和胆汁酸含量: 在粪便中胆固醇和胆汁酸的测定结果如图 3所示,HC、HL组大鼠粪便TC含量明显高于对照组,这说明通过饮食摄入的过多胆固醇中,部分不能被代谢而排出体外。HL组大鼠粪便TC含量要显著高于HC组(P < 0.05),这表明植物乳杆菌Lp3可以促进体内胆固醇的排泄。图 3-B是大鼠粪便中胆汁酸(TBA)含量对比,从图中可以看出HC、HL组大鼠粪便中胆汁酸含量明显高于对照组(P < 0.05),而HC、HL两组间粪便TBA含量差异不大,但是HL组大鼠粪便TBA含量略高于HC组。总的来讲,HL组大鼠粪便中的TC、TBA含量要高于HC组大鼠,这可能是因为植物乳杆菌Lp3可以在肠道内水解共轭胆盐,然后共轭胆盐与胆固醇形成不溶的复合物,共同沉淀下来,这就使HL组大鼠粪便中TC和TBA的含量增加。同时胆酸的重吸收减少,会促使胆固醇转化为胆酸参与肝胆循环,从而降低体内胆固醇的含量。
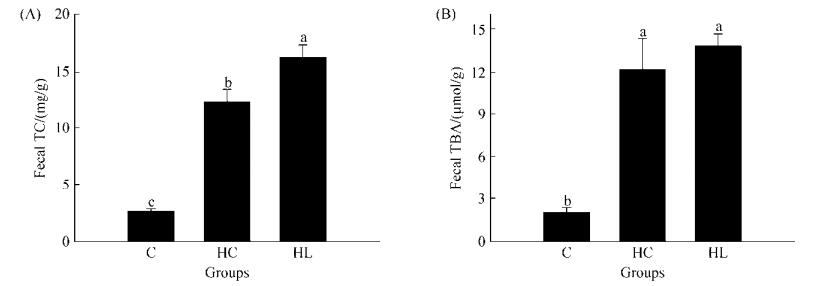 |
| 图 3 SD大鼠粪便中胆固醇(A)和胆汁酸(B)比较 Figure 3 Comparison of cholesterol levels (A) and bile acids (B) in SD rats. Each time point of the top of histograms with different letters indicate a significant difference (P < 0.05). Error bars represent standard error (n=3). |
| 图选项 |
2.5 肝脏组织中TG、TC含量测定 大鼠肝脏中TG、TC的测定结果如图 4所示,饲喂高脂饲料的两组大鼠肝脏中TC和TG含量远高于对照组,说明这两组大鼠从食物中摄入了过多胆固醇和脂类物质,而这些物质会在肝脏中大量积存。但是HL组大鼠肝脏中TC、TG的含量要显著低于HC组(P < 0.05),这表明灌胃乳酸菌Lp3可以显著减少胆固醇和甘油三酯在肝脏中的积存。这可能是因为一部分共轭胆盐水解后和胆固醇共同沉淀下来,肝脏中的胆固醇会形成新的胆酸进入肝胆循环,从而降低肝脏中胆固醇的含量。
 |
| 图 4 SD大鼠肝脏中胆固醇(A)和甘油三酯(B)含量 Figure 4 Cholesterol (A) and triglycerides (B) levels in the liver of SD rats. Each time point of the top of histograms with different letters indicate a significant difference (P < 0.05). Error bars represent standard error (n=3). |
| 图选项 |
2.6 肝脏组织HE染色结果 正常的肝脏细胞呈索状排列,胞浆为红色,细胞核位于细胞中央,如图 5-A箭头所示。
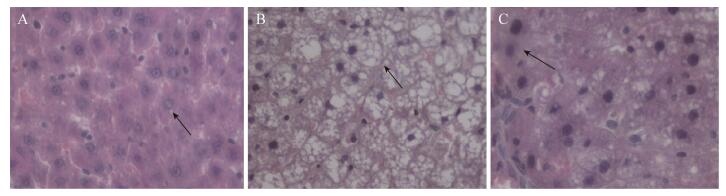 |
| 图 5 大鼠肝脏组织HE染色 Figure 5 HE staining of liver tissue. A: ordinary diet treatment group; B: high fat diet treatment group; C: high fat diet + Lactobacillus treatment group. |
| 图选项 |
从图 5-B中可以明显看出,HC组大鼠的肝脏有严重的脂肪肝病变。该组大鼠肝脏细胞呈圆形,细胞内部充满了脂肪空泡,红色胞浆较少,细胞核被脂肪泡挤至细胞边缘。
而HL组大鼠肝脏组织(图 5-C)虽然也有不同程度的脂肪浸润,但是总的看来,细胞内部的脂肪泡数量较HC组要少,胞浆呈现红色,并且还有正常形态的肝脏细胞存在(图中箭头所指细胞)。
由此可以得知,植物乳杆菌Lp3可以减少脂肪在肝脏细胞中的浸润,保护肝脏细胞。
3 讨论 建立高脂动物模型后,每天将一定数量的植物乳杆菌Lp3灌胃给HL组大鼠,以研究Lp3对高脂大鼠的益生作用。在试验期间HL组大鼠的血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇的水平要显著低于HC组大鼠(P < 0.05),但是高密度脂蛋白胆固醇没有显著差异(P > 0.05)。这表明该菌株可以有效降低高脂大鼠血清中总胆固醇、甘油三酯和低密度脂蛋白胆固醇含量,但是对高密度脂蛋白胆固醇的影响不是很大。Jaspers等在1984年就提出,不同的乳酸菌菌株对于血清胆固醇浓度的影响是不一样的[14]。李梅用两株双歧杆菌以不同剂量饲喂给高脂血症模型大鼠,发现给药45 d后,这两株双歧杆菌均能显著降低大鼠的血清TG和TC含量,但是对HDL-C没有显著影响[15],这与本试验中所得出的结论相符。但是Wang的研究中所用的乳杆菌不但可以显著降低高脂大鼠血清TG、TC和LDL-C的水平,还能显著增加HDL-C的浓度[16]。Hashimoto等也发现干酪乳杆菌可以增加HDL-C的浓度[17]。
由于摄入高脂饲料,导致HC组大鼠的粪便含水量下降,肠道内菌群失调。HC组大鼠粪便中大肠杆菌数量要明显高于其他两组,乳杆菌和双歧杆菌的数量要低于其他两组。HL组大鼠虽然也饲喂的高脂饲料,但是由于每天灌胃一定数量的乳酸菌,该组大鼠粪便中乳杆菌数略高于对照组,大肠杆菌和双歧杆菌数量和对照组大鼠的基本一致。由此可以看出,植物乳杆菌Lp3对胃肠液有很好的耐受力,可以黏附在肠道内壁并定殖,Usman和Hosono在他们的研究中也提出这个结论[18]。Chiu[19]、Liong[6]、Jones[20]等都提出乳酸菌对大肠杆菌有一定抑制作用,并且在一定程度上可以促进双歧杆菌的生长。在本研究中,HL组大鼠粪便中大肠杆菌数要低于HC组,双歧杆菌数高于HC组,而和对照组基本相同,这就表明了植物乳杆菌Lp3可以抑制大肠杆菌生长、促进双歧杆菌生长,对维持大鼠肠道微生物菌群平衡具有一定作用。王芳在2005年的研究表明,高脂饮食引起的高脂血症会引起模型大鼠肠道内菌群失调,具体表现在肠杆菌数量明显增加,双歧杆菌、乳酸杆菌数量明显减少,而这种菌群失调又会加重机体脂类代谢紊乱,从而形成恶性循环[21]。这与本试验中高脂模型组(HC)大鼠粪便中菌群变化相一致。
而灌胃乳酸菌的HL组大鼠虽然也长期摄入高脂饲料,但是其粪便中的含水量比HC组大鼠高了6.44%,Wang在2009年的研究中,给高脂大鼠灌胃植物乳杆菌MA2五周后发现,灌胃乳酸菌的大鼠组粪便水分比高脂组大鼠平均高了7%[22]。这与本试验结果相似,且表明了植物乳杆菌Lp3可以在一定程度上增加粪便的含水量,具有一定的润肠通便的作用,但是效果并不明显,且乳酸菌所产生的代谢产物或是菌体本身都对维持肠道内菌群的平衡具有一定作用。
HL组大鼠粪便中胆固醇和胆汁酸的含量比HC组大鼠的要高,这可能是因为植物乳杆菌Lp3在肠道内解共轭胆盐,然后与胆固醇形成不溶的复合物,共同沉淀下来的结果。与此同时胆酸的重吸收减少,会促使胆固醇转化为胆酸参与肝胆循环,从而降低体内胆固醇的含量。Usman[23]等用冻干的加氏乳杆菌饲喂给高脂的Wister大鼠,发现试验组小鼠的血清TC、TBA含量显著降低,但是粪便中的TC、TBA含量升高,他认为这是因为结合胆盐在乳酸菌的作用下转化为游离态,然后和胆固醇形成复合物共同沉淀下来,并且试验组大鼠的血清胆固醇的下降与体内胆酸的重吸收减少有关,这与本试验结果相同。此外,Huang[24]、胡梦坤[25]、潘道东[26]等在各自的研究中也得出了相同的结论。由此可知,植物乳杆菌Lp3降胆固醇的机理可能以共沉淀作用为主。
通过测定大鼠肝脏组织中胆固醇和甘油三酯含量,可知HL组大鼠肝脏组织中胆固醇和甘油三酯含量均显著低于HC组大鼠(P < 0.05)。从肝脏组织切片中可以看出,HL组大鼠肝脏细胞中的脂肪泡要明显比HC组大鼠的少,这都可以表明Lp3可以减少脂类物质在肝脏中的沉积,Xie等的研究中也得出了相同的结论[27]。
4 结论 植物乳杆菌Lp3对消化液具有良好的耐受力,可以定殖到肠道内壁,并能促进双歧杆菌的繁殖,抑制大肠杆菌的生长,因此对肠道内的菌群平衡具有一定作用。并且Lp3有效降低高脂大鼠的血清总胆固醇、甘油三酯和低密度脂蛋白胆固醇含量,有效减少胆固醇和甘油三酯在肝脏组织中的沉积,促进胆固醇排泄。此外,该菌还可以增加粪便的含水量,并可以调节肠道内菌群的平衡,所以本研究所筛选的植物乳杆菌Lp3对高脂大鼠具有值得深入研究的益生作用。且该菌株的来源安全,无明显毒副作用,为开发功能性食品或是降胆固醇药物提供理论依据,但是该菌株的安全性、耐药性和降胆固醇的机理等还需进一步研究。
References
| [1] | Kannel WB. Range of serum cholesterol values in the population developing coronary artery disease. The American Journal of Cardiology, 1995, 76(9 S1): 69C-77C. |
| [2] | Zhang G. Lactic Acid Bacteria-Basied, Technology and Application. Beijing: Chemical Industry Press, 2007: 2-13. (in Chinese) 张刚. 乳酸细菌——基础、技术和应用. 北京: 化学化工出版社, 2007: 2-13. |
| [3] | Mann GV, Spoerry A. Studies of a surfactant and cholesteremia in the Maasai. The American Journal of Clinical Nutrition, 1974, 27(5): 464-469. |
| [4] | Bazarre TL, Wu SM, Yuhas JA. Total and HDL-cholesterol concentrations following yogurt and calcium supplementation. Nutrition Reports International, 1983, 28(6): 1225-1232. |
| [5] | Portugal LR, Gon alves JL, Fernandes LR, Silva HPS, Arantes RME, Nicoli JR, Vieira LQ, Alvarez-Leite JI. Effect of Lactobacillus delbrueckii on cholesterol metabolism in germ-free mice and on atherogenesis in apolipoprotein E knock-out mice. Brazilian Journal of Medical and Biological Research, 2006, 39(5): 629-635. DOI:10.1590/S0100-879X2006000500010 |
| [6] | Liong MT, Shah NP. Effects of a Lactobacillus casei synbiotic on serum lipoprotein, intestinal Microflora, and organic acids in rats. Journal of Dairy Science, 2006, 89(5): 1390-1399. DOI:10.3168/jds.S0022-0302(06)72207-X |
| [7] | Rodas BZD, Gilliland SE, Maxwell CV. Hypocholesterolemic action of Lactobacillus acidophilus ATCC 43121 and calcium in swine with hypercholesterolemia induced by diet. Journal of Dairy Science, 1996, 79(12): 2121-2128. DOI:10.3168/jds.S0022-0302(96)76586-4 |
| [8] | Gilliland SE, Nelson CR, Maxwell C. Assimilation of cholesterol by Lactobacillus acidophilus. Applied and Environmental Microbiology, 1985, 49(2): 377-381. |
| [9] | du Toit M, Franz CMAP, Dicks LMT, Schillinger U, Haberer P, Warlies B, Ahrens F, Holzapfel WH. Characterisation and selection of probiotic lactobacilli for a preliminary minipig feeding trial and their effect on serum cholesterol levels, faeces PH and faeces moisture content. International Journal of Food Microbiology, 1998, 40(1/2): 93-104. |
| [10] | Agerbaek M, Gerdes LU, Richelsen B. Hypocholesterolaemic effect of a new fermented milk product in healthy middle-aged men. European Journal of Clinical Nutrition, 1995, 49(5): 346-352. |
| [11] | Goldstein MC, Beall CM. Anthropological fieldwork in Tibet studying nomadic pastoralists on the Changtang. Himalaya, the Journal of the Association for Nepal and Himalayan Studies, 1987, 7(1): 4. |
| [12] | Beall CM, Henry J, Worthman C, Goldstein MC. Basal metabolic rate and dietary seasonality among Tibetan nomads. American Journal of Human Biology, 1996, 8(3): 361-370. DOI:10.1002/(ISSN)1520-6300 |
| [13] | Pan DD, Zeng XQ, Yan YT. Characterisation of Lactobacillus fermentum SM-7 isolated from koumiss, a potential probiotic bacterium with cholesterol-lowering effects. Journal of the Science of Food and Agriculture, 2011, 91(3): 512-518. DOI:10.1002/jsfa.v91.3 |
| [14] | Jaspers DA, Massey LK, Luedecke LO. Effect of consuming yogurts prepared with three culture strains on human serum lipoproteins. Journal of Food Science, 1984, 49(4): 1178-1181. DOI:10.1111/jfds.1984.49.issue-4 |
| [15] | Li M, Tong CH, Liu XJ. Blood lipid regulation of lactic acid bacteria in rat models of hyperlipidemia. Journal of Dairy Science and Technology, 2013, 36(2): 1-3. (in Chinese) 李梅, 仝春晖, 刘小杰. 大鼠模型研究乳酸菌调节血脂作用. 乳业科学与技术, 2013, 36(2): 1-3. |
| [16] | Wang J, Zhang H, Chen X, Chen Y, Menghebilige, Bao Q. Selection of potential probiotic lactobacilli for cholesterol-lowering properties and their effect on cholesterol metabolism in rats fed a high-lipid diet. Journal of Dairy Science, 2012, 95(4): 1645-1654. DOI:10.3168/jds.2011-4768 |
| [17] | Hashimoto H, Yamazaki K, He F, Kawase M, Hosoda M, Hosono A. Hypocholesterolemic effects of Lactobacillus casei subsp. casei TMC0409 strain observed in rats fed cholesterol contained diets. Nihon Chikusan Gakkaiho, 1999, 70(2): 90-97. DOI:10.2508/chikusan.70.90 |
| [18] | Usman, Hosono A. Effect of administration of Lactobacillus gasseri on serum lipids and fecal steroids in hypercholesterolemic rats. Journal of Dairy Science, 2000, 83(8): 1705-1711. DOI:10.3168/jds.S0022-0302(00)75039-9 |
| [19] | Chiu CH, Lu TY, Tseng YY, Pan TM. The effects of Lactobacillus-fermented milk on lipid metabolism in hamsters fed on high-cholesterol diet. Applied Microbiology and Biotechnology, 2006, 71(2): 238-245. DOI:10.1007/s00253-005-0145-0 |
| [20] | Jones ML1, Tomaro-Duchesneau C, Martoni CJ, Prakash S. Cholesterol lowering with bile salt hydrolase-active probiotic bacteria, mechanism of action, clinical evidence, and future direction for heart health applications. Expert Opinion on Biological Therapy, 2013, 13(5): 631-642. DOI:10.1517/14712598.2013.758706 |
| [21] | Wang F, Fang JW, Wang ZY, Dou Z. Intestinal floras of hyperlippermia rats. Heilongjiang Medicine and Pharmacy, 2005, 28(4): 52-53. (in Chinese) 王芳, 房建伟, 王泽宇, 斗章. 高脂血症大鼠肠道菌群变化的实验研究. 黑龙江医药科学, 2005, 28(4): 52-53. |
| [22] | Wang YP, Xu N, Xi AD, Ahmed Z, Zhang B, Bai XJ. Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-cholesterol diet. Applied Microbiology and Biotechnology, 2009, 84(2): 341-347. DOI:10.1007/s00253-009-2012-x |
| [23] | Usman, Hosono A. Hypocholesterolemic effect of Lactobacillus gasseri SBT0270 in rats fed a cholesterol-enriched diet. Journal of Dairy Research, 2001, 68(4): 617-624. |
| [24] | Huang Y, Wang XJ, Wang JF, Wu F, Sui YJ, Yang LF, Wang ZG. Lactobacillus plantarum strains as potential probiotic cultures with cholesterol-lowering activity. Journal of Dairy Science, 2013, 96(5): 2746-2753. DOI:10.3168/jds.2012-6123 |
| [25] | Hu MK, Yue XQ. Screening and cholesterol-degrading mechanism of Lactobacillus plantarum LP1103. Food Science, 2008, 29(6): 226-229. (in Chinese) 胡梦坤, 岳喜庆. 植物乳杆菌LP1103的筛选及其降胆固醇作用机理的研究. 食品科学, 2008, 29(6): 226-229. |
| [26] | Pan DD, Zhang DZ. Screening of cholesterol-reducing Lactic acid bacteria and it's activity in cholesterol-reducing. Food Science, 2005, 26(6): 233-237. (in Chinese) 潘道东, 张德珍. 降胆固醇乳酸菌的筛选及其降胆固醇活性研究. 食品科学, 2005, 26(6): 233-237. |
| [27] | Xie N, Cui Y, Yin YN, Zhao X, Yang JW, Wang ZG, Fu N, Tang Y, Wang XH, Liu XW, Wang CL, Lu FG. Effects of two Lactobacillus strains on lipid metabolism and intestinal microflora in rats fed a high-cholesterol diet. BMC Complementary and Alternative Medicine, 2011, 11: 53. DOI:10.1186/1472-6882-11-53 |
