李众1, 2, 张伟1, 李盛英1


1 中国科学院青岛生物能源与过程研究所,山东省合成生物学省级重点实验室,中国科学院生物燃料重 点实验室,山东 青岛 266101
2 中国科学院大学,北京 100049
收稿日期:2015-09-11; 修回日期: 2015-12-11; 网络出版日期: 2015-12-21
基金项目:国家自然科学基金(31422002,31300075);山东省自然科学基金(JQ201407)
通信作者:Tel: +86-532-80662676;E-mail: lishengying@qibebt.ac.cn
摘要:细胞色素P450酶广泛存在于动植物和微生物体内,具有底物结构多样性和催化反应类型多样性,在天然产物生物合成中扮演重要作用。P450酶可在温和条件下高选择性地催化结构复杂有机化合物中惰性C-H键的氧化反应,具备化学催化剂难以比拟的优势,因此在微生物制药领域具有广阔的应用空间。本文综述了参与天然产物生物合成的P450酶近年来的研究进展;P450酶的酶工程改造、生物转化实践及其在微生物药物创制方面的应用现状;探讨了P450酶的工业应用瓶颈及其解决途径;并对P450酶未来的应用前景进行了展望。
关键词: 细胞色素P450酶微生物制药酶工程生物转化
Cytochrome P450 enzymes and microbial drug development - A review
Zhong Li1, 2, Wei Zhang1, Shengying Li1


1 Shandong Provincial Key Laboratory of Synthetic Biology, CAS Key Laboratory of Biofuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong Province, China;
2 University of Chinese Academy of Sciences, Beijing 100049, China
Received: 11 September 2015; Revised: 11 December 2015; Published online: 21 December 2015
Fountion Item: Supported by the National Natural Science Foundation of China (31422002, 31300075) and by the Natural Science Foundation of Shandong Province (JQ201407)
Corresponding author.Tel: +86-532-80662676; E-mail: lishengying@qibebt.ac.cn
Abstract:Cytochrome P450 enzymes broadly exist in animals, plants and microorganisms. This superfamily of monooxygenases holds the greatest diversity of substrate structures and catalytic reaction types among all enzymes. P450 enzymes play important roles in natural product biosynthesis. In particular, P450 enzymes are capable of catalyzing the regio- and stereospecific oxidation of non-activated C-H bonds in complex organic compounds under mild conditions, which overrides many chemical catalysts. This advantage thus warrants their great potential in microbial drug development. In this review, we introduce a variety of P450 enzymes involved in natural product biosynthesis; provide a brief overview on protein engineering, biotransformation and practical application of P450 enzymes; and discuss the limits, challenges and prospects of industrial application of P450 enzymes.
Key words: cytochrome P450 enzymesmicrobial drug developmentprotein engineeringbiotransformation
细胞色素P450酶(cytochrome P450 enzymes,CYP450)为一类亚铁血红素—硫醇盐(heme-thiolate)蛋白超家族,因其还原态与一氧化碳结合后在450 nm处的特征吸收峰而得名[1]。亚铁血红素作为P450酶的辅基,由铁原子与卟啉环络合而成,并与P450酶中绝对保守的半胱氨酸相连。自P450酶从小鼠肝脏中被发现并定义以来[2],关于P450酶的研究已有50多年的历史。因其广泛参与哺乳动物尤其是人体内的异源物质降解、解毒作用、药物代谢以及甾体类激素和维生素的合成,P450酶一直是药理学家和生化学家关注的重点。由于P450酶可在温和条件下高选择性地催化结构复杂有机化合物中惰性C-H键的氧化反应(例如羟基化与环氧化),近年来也开始吸引有机化学家的关注。
在微生物学领域,随着海量微生物基因组测序数据的积累,以及许多微生物次级代谢产物生物合成基因簇的分离和鉴定,越来越多的P450酶被发现参与了多种天然产物的生物合成,尤其是后修饰过程,使得P450酶在微生物新药发掘领域脱颖而出。迄今为止,GenBank已发布的 P450 基因序列超过8万条,其中人类基因组含有57个P450基因[3, 4],天蓝色链霉菌(Streptomyces coelicolor A3(2))有18个P450基因[5],构巢曲霉(Aspergillus nidulans)拥有111个P450基因[6]。这些基础研究信息对P450酶在药物先导化合物开发、药物代谢研究以及上市药物的生物催化合成等领域的应用均具有十分重要的意义。
1 细胞色素P450酶概述 1.1 结构和功能特点细胞色素P450酶如“多才多艺的舞者”,兼具底物结构多样性和催化反应类型多样性,且其催化反应具有高度的区位和立体选择性。P450酶可识别的底物结构类型包括脂肪酸类、甾醇族、萜类、生物碱、多肽类、大环内酯类及芳香族化合物等,催化的反应类型更是多达20余种,常见的如sp3杂化C-H键的羟基化、C=C双键的环氧化、N-Me或O-Me基团的去烷基化等,不常见的如色氨酸的硝基化、分子内C-H键的氨化作用、脂肪酸脱羧反应等[7]。
首次获得的P450酶晶体结构来自恶臭假单孢菌(Pseudomonas putida)的P450cam,由Poulos等于1985年解析完成,分辨率达2.6 Å[8]。随着结构生物学的发展,越来越多P450酶的晶体结构得到解析,使得P450酶的“结构—功能—机制”研究工作得以更加深入。通过对不同来源P450酶的三维结构进行比较,发现P450酶的核心结构是由4个螺旋(α-helix)结构D、E、I和L共同形成的三菱柱结构[9](图 1)。底物进入P450活性位点与结构灵活的BC-环(loop)和FG-环相关,F-螺旋和G-螺旋的摆动使得底物(产物)可以顺利进入(泵出)酶的活性位点[10]。尽管不同P450酶的氨基酸序列同源性可能低至20%,但其三维结构却是高度保守的,尤其是靠近亚铁血红素的I和L螺旋[11]。I螺旋上的氨基酸残基主要参与催化过程中氧分子的激活,而位于L-螺旋N端的一个半胱氨酸残基则绝对保守,通过硫醇键与亚铁血红素中铁原子相连[12]。相比之下,P450酶的底物识别位点(substrate recognition sites,SRSs)则缺乏保守性,不同P450酶具有迥异的SRS残基组成,构成了P450酶底物多样性的结构基础。
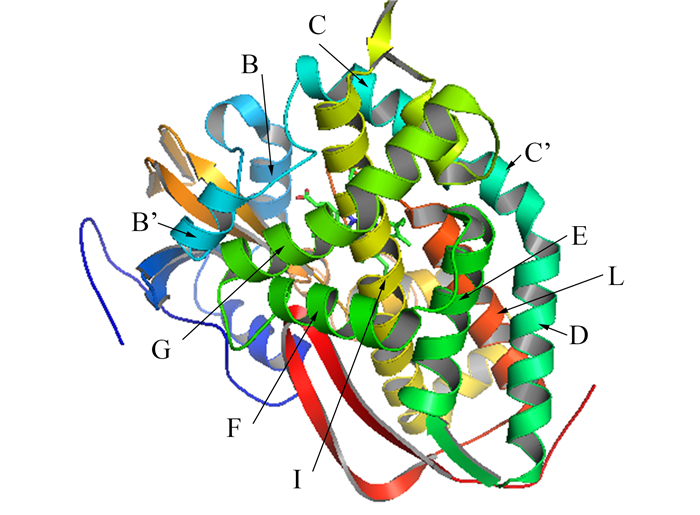 |
| 图 1. P450cam的晶体结构(PDB ID:2CPP) Figure 1. The crystal structure of P450cam (PDB ID: 2CPP). |
| 图选项 |
1.2 催化机制几乎所有细胞色素P450酶的催化过程都需要还原伴侣蛋白(redox partner proteins)的参与,来源于NAD(P)H的2个电子经还原伴侣蛋白顺序传递到亚铁血红素反应中心实现O2分子的激活[13],其中一个氧原子加入底物形成羟基、环氧基等基团(故而P450酶经常被称为单加氧酶),另一个氧原子则参与形成一个水分子。此处以P450酶催化羟基化反应为例,简要介绍其催化机制(图 2):底物进入P450酶的活性位点;血红素的Fe3+从还原伴侣蛋白获得一个电子后被还原为Fe2+,再与O2结合形成Fe2+-O2复合物;该复合物从还原伴侣蛋白获得第二个电子,得到一个质子形成被称为Compound 0的Fe3+-OOH复合物;Compound 0再次获得一个质子后,O-O键断裂生成一分子H2O,并得到Fe4+=O复合物(Compound I),高价铁Fe4+与卟啉环形成π键体系和高反应性碳正离子自由基;Compound I作为真正的催化剂将底物C-H键上的H原子脱去,并经分子重排生成羟基化产物;最后,产物从P450酶活性位点离去,被新的底物取代进入新一轮催化循环。P450酶催化总反应为:R-H+O2+2H++2e– → R-OH+H2O。值得一提的是,H2O2等过氧化物可以代替O2,使得P450酶催化步骤缩短(图 2中虚线所示)。
 |
| 图 2. 细胞色素P450酶的催化循环 Figure 2. The catalytic cycle of cytochrome P450 enzymes. |
| 图选项 |
1.3 基本分类对于细胞色素P450酶的分类有不同标准:按照宿主来源可分为植物P450酶,动物P450酶,真菌P450酶,细菌P450酶等;依据催化反应类型可分为环氧酶,羟化酶,异构酶等[13];根据序列同源性,Nebert等在1987年建立了细胞色素P450酶的命名法则[14],同源性大于40%可归为族(family: 1,2,3......),大于55%归为亚族(subfamily: A,B,C......),以及对亚族中的单个P450酶进行顺序编号(1,2,3......),如CYP3A1,CYP105A3等。
此外还有一种重要的分类方法是按照P450酶在催化反应过程中所需的还原伴侣蛋白进行分类。第一类P450酶的还原伴侣系统(Class I,图 3)包含一个含有铁硫簇(Fe2S2)的铁氧还蛋白(ferredoxin,Fdx)与一个含有FAD的铁氧还蛋白还原酶(ferredoxin reductase,FdR),常见于细菌和真核生物线粒体中的P450酶;第二类P450酶的还原伴侣蛋白(ClassⅡ,图 3)为含有FAD/FMN的细胞色素P450酶还原酶(cytochrome P450 reductase,CPR),常见于真核生物,许多情况下以膜蛋白形式存在;第三类P450酶与它的还原酶(CPR)天然融合(Class Ⅲ,图 3),如来自巨大枯草芽孢杆菌(Bacillus megaterium)的P450 BM3[15];第四类P450酶则与含有FMN/Fe2S2的还原伴侣蛋白天然融合(Class Ⅳ,图 3),如源于Rhodococcus sp. NCIMB 9784的P450RhF[16–17];第五类为不需要还原伴侣蛋白、可直接利用NAD(P)H的细胞色素P450酶(Class Ⅴ,图 3),但在自然界极其少见,如来自Fusarium oxysporum的 P450nor[18]。除了第一类细胞色素P450酶为三组分系统,第二类为双组分系统;其余3类均是单组分系统,属于该系统的P450酶称为“催化自主型”P450酶,不需要额外还原伴侣完成电子传递。
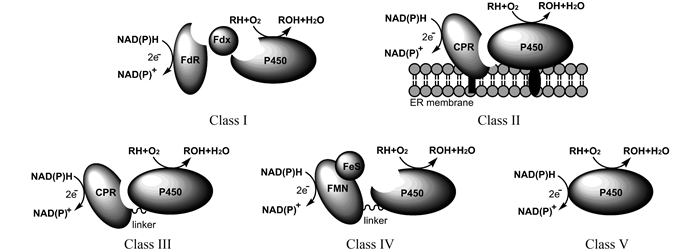 |
| 图 3. 依据还原伴侣蛋白的细胞色素P450酶分类 Figure 3. Classification of cytochrome P450 enzymes based on redox partners. |
| 图选项 |
2 细胞色素P450酶与天然产物生物合成细胞色素P450酶在动物体内主要参与类固醇激素的生物合成,如人的CYP11B1,牛的CYP11A1,果蝇的CYP314A1等。现今已有一些甾醇激素的全细胞催化工艺成功应用于工业生产[19],即将哺乳动物参与甾醇激素合成相关的P450酶及还原伴侣在重组细胞中共表达并生物催化甾醇激素的合成。一般来说,种类丰富多样、施行化学防御的微生物和植物,其在代谢过程中产生的天然有机化合物,无论从化学结构还是生物活性上,其多样性均远远高于动物。因此,一些拥有新颖底物结构类型和催化反应类型的细胞色素P450酶常见于微生物和植物天然产物生物合成途径中,构成了未来细胞色素P450酶研发的重点领域。
2.1 参与微生物次级代谢产物生物合成的细胞色素P450酶1928年,Fleming从Penicillium notatum发现青霉素(penicillin)以来,微生物次级代谢产物开始走入人们的视野。微生物次级代谢产物具有化学结构类型多样性和生物活性多样性特点,一直是新药创制的重要来源,为人类对抗疾病作出了巨大贡献,如以青霉素为代表的β-内酰胺类、以红霉素为代表的大环内酯类、以庆大霉素为代表的氨基糖苷类,以氯霉素为代表的酰胺醇类,以万古霉素为代表的糖肽类等[20]。目前研究比较广泛和深入的微生物次级代谢产物生物合成途径主要包括非核糖体肽类(NRPS)途径、聚酮类(PKS)途径以及NRPS-PKS杂合途径等。NRPS和PKS途径合成的次级代谢产物母核结构经常通过细胞色素P450酶的后修饰作用,如羟基化、环氧化等,使得最终产物展现出丰富多样的生物活性。基于微生物次级代谢产物生物合成途径中细胞色素P450酶的结构基础、催化机制和酶学等方面的基础研究工作,通过酶工程和组合生物合成方式理性设计高效低毒的“非天然”活性物质,对于微生物药物创新具有重要意义。
从催化功能来看,大多数微生物P450酶仅能催化一种类型反应,为单功能P450酶,例如来自红色糖多孢菌(Saccharopolyspora erythraea)的EryF和EryK在红霉素(erythromycin)生物合成过程中分别催化十四元环聚酮母核erythronolide的6位羟基化和大环内酯中间产物红霉素D的12位羟基化[21, 22](图 4-A)。来自委内瑞拉链霉菌(Streptomyces venezuelae)的PikC以十二元环大环内酯YC-17为底物,分别在C10和C12位羟基化得到酒霉素(methymycin)和新酒霉素(neomethmycin),还可以在C10/C12位双羟基化得到novamethymycin(图 4-B);PikC以冥菌素(narbomycin)为底物分别在C12位和C14羟基化得到苦霉素(pikromycin)和新苦霉素(neopikromycin),在C12/C14位双羟基化得到novapikromycin (图 4-C)[23, 24]。来自抗生链霉菌(Streptomyces antibioticus)的OleP由竹桃霉素(oleandomycin)生物合成基因簇中的P450基因编码,负责催化C8位内酯环的环氧化反应[25](图 4-D)。来自纤维堆囊菌(Sorangium cellulosum)的EpoK催化埃博霉素C(epothilone C)和D中C12/C13位碳碳双键的环氧化分别得到埃博霉素A和B[26](图 4-E)。来自Penicillium aethiopicum的GsfF在灰黄霉素(griseofulvin)的生物合成途径中催化螺环的形成(图 4-F);同样来自该菌的P450酶VrtE和VrtK则分别参与杂萜viridicatumtoxin生物合成中的C5位羟基化和萜烯环化,其中催化萜烯环化反应的活性为首次在P450酶中发现[27, 28](图 4-G)。
 |
| 图 4. 微生物天然产物生物合成中的单功能细胞色素P450酶 Figure 4. Examples of mono-functional P450 enzymes involved in microbial natural product biosynthesis. |
| 图选项 |
相比单功能细胞色素P450酶,多功能细胞色素P450酶可以对一种或多种底物催化几种不同类型的反应,例如来自稀有放线菌淡灰红小单孢菌(Micromonospora griseorubida)的MycG可以催化十六元环大环内酯抗生素麦新米星IV(mycinamicin IV)的C14位羟基化形成麦新米星V,以及C12/C13位的环氧化形成麦新米星I;麦新米星V还能进一步被MycG环氧化形成麦新米星II[29](图 5-A)。海洋链霉菌Streptomyces sp. 307-9中替达霉素(tirandamycin)生物合成P450酶TamI 能够催化替达霉素C的C10位羟基化得到替达霉素E,黄素单加氧酶(flavin monooxygenase) TamL氧化替达霉素E得到替达霉素D,TamI再以替达霉素D作为底物依此进行C11/C12位环氧化和C18位羟基化,分别得到替达霉素A和B[30–31](图 5-B)。有趣的是,真菌来源的细胞色素P450酶更多地展现出多功能性,例如来自土曲霉(Aspergillus terreus)参与萜类化合物terretonin生物合成的P450酶Trt6通过连续3次氧化 后的不稳定中间体重排得到terretonin H[32](图 5-C);土曲霉中参与洛伐他汀(lovastatin)生物合成过程的P450酶LovA,能够催化dihydromonacolin L的C4a/C5位脱氢形成双键得到monacolin L,并进一步催化C8位羟基化得到monacolin J[33](图 5-D)。
 |
| 图 5. 微生物天然产物生物合成中的多功能细胞色素P450酶 Figure 5. Examples of multi-functional P450 enzymes involved in microbial natural product biosynthesis. |
| 图选项 |
2.2 植物天然产物生物合成中的细胞色素P450酶相对于微生物而言,人类对植物天然产物的利用历史更为悠久,勤劳聪明的中国人民开创的中药也可称为人类对植物天然产物利用的高峰。随着现代色谱分离技术和波谱解析技术的发展,很多疗效显著的药物单体从植物提取物中分离获得,吸引了生物化学家们对其生物合成途径的研究,例如从黄花蒿(Artemisia annua)中提炼出来的抗疟药物青蒿素,从唇形科植物丹参(Salvia miltiorrhiza bunge)根中提取的心脑血管疾病治疗药物丹参酮,从曼陀罗(Datura stramonium linn)提取的用于治疗青光眼的莨菪碱等,而在这些植物天然产物的生物合成途径中均有不同的细胞色素P450酶发挥着重要功能。
将植物的次级代谢产物生物合成基因簇在微生物体中异源表达合成药物,是现代合成生物学研究的新热点,同时也正在成为微生物制药的一个重要方向。植物细胞色素P450酶在微生物制药领域迄今最成功的应用是青蒿素(artemisinin)前体青蒿酸(artemisinic acid)的合成:来自黄花蒿(Artemisia annua)的P450酶CYP71AV1,通过对紫穗槐二烯(amorphadiene)C12位的连续三步氧化得 到青蒿酸[34](图 6-A)。在植物激素赤霉素(gibberellin)的生物合成途径过程中,由2个P450酶亚族CYP701A和CYP88A参与,如来自拟南芥(Arabidopsis thaliana)的CYP701A3催化ent-贝壳杉烯(ent-kaurene)经过三步氧化得到ent-贝壳杉酸(ent-kaurenoic acid),CYP88A3或CYP88A4催化ent-贝壳杉酸合成赤霉素GA12[35](图 6-B)。在吗啡(morphine)的生物合成中,来自罂粟(Papaver somniferum)的CYP82Y2可以催化(S)-reticuline得到1,2-dehydroreticuline,与其天然融合的氧化还原酶催化1,2-dehydroreticuline得到(R)-reticuline,接着CYP719B1催化(R)-reticuline的芳环偶联合成沙罗泰里啶(salutaridine)[36, 37](图 6-C)。
 |
| 图 6. 植物天然产物生物合成中的细胞色素P450酶 Figure 6. Examples of cytochrome P450 enzymes involved in plant natural product biosynthesis. |
| 图选项 |
3 天然细胞色素P450酶的改造细胞色素P450酶的不断发现和功能鉴定为微生物药物创制提供了宝贵的新资源和新思路,然而许多天然来源的P450酶存在催化效率低、底物谱窄、稳定性差等缺点,需要我们利用各种手段进行合理改造以适应产业化要求,目前这些手段主要包括P450酶的定向进化和理性设计。定向进化一般从P450酶的编码基因出发,通过基因突变和重组使基因发生变异,然后结合快速灵敏的高通量筛选方法获得具备目标特性的突变酶。理性设计则立足于酶分子的三维结构信息和催化作用机制,通过模拟计算、设计突变等方式对关键氨基酸残基进行改造从而得到符合需求的突变酶。
3.1 定向进化在大量细胞色素P450酶结构信息缺乏的情况下,定向进化由于不需要酶分子的“结构—功能”关系数据,理论上可适用于任何P450酶的改造,因而可大大拓宽细胞色素P450酶的研究和应用范围。巨大芽孢杆菌(Bacillus megaterium)的P450 BM3是一种催化自主型P450酶,在目前已知的细胞色素P450酶中催化效率最高,其天然底物羟基化反应的kcat值可达17000 min–1,因此是一个很好的定向进化亲本酶[38]。在过去几十年间,P450 BM3通过定向进化筛选得到的突变体成功实现了对甾族化合物、萜类化合物、生物碱等多种结构类型非天然底物的羟基化和环氧化反应。近年来,一些P450酶突变体也在药物以及药物代谢物的合成中展露头角。Arnold等利用易错PCR构建P450 BM3突变体库,筛选得到的突变体可以从过氧化氢直接获得活性氧高效地催化抗心绞痛药普萘洛尔(propranolol)得到具有同样活性的4-羟基普萘洛尔和5-羟基普萘洛尔[39]。Sawayama等以P450 BM3和来自Bacillus subtilis的CYP102A2和CYP102A3编码基因作为模板,利用DNA洗牌技术(DNA shuffling)定向进化得到的突变体产生出一些野生型不具备的反应活性,如催化动脉扩张药维拉帕米(verapamil)和阿司咪唑(astemizole)等药物的选择性氧化[40]。综上,定向进化是建立功能多样化P450酶库的重要手段。然而,在大多数情况下定向进化获得的突变体库存在阳性率低,筛选成本高、耗时费力等缺点,而且从突变酶库中筛选得到的具备新反应活性的P450酶突变体往往不具备很好的稳定性。
3.2 理性设计相对于定向进化而言,基于细胞色素P450酶三维结构信息的蛋白理性设计,获得的突变体库容量较小,往往更容易获得目的突变体。 Commandeur等利用点突变的方式获得的P450 BM3突变体(R47L/F87V/L188Q)产生了野生型不具备的反应活性,如催化睾酮(testosterone),右美沙芬(dextromethorphan),对乙酰氨基酚(acetaminophen)等药物分子的代谢反应[41]。Kim等在前人研究基础上,利用点突变的手段构建了17个 P450 BM3 突变体,发现个别突变体催化抗肿瘤药反式白藜芦醇(trans-resveratrol)合成白皮杉醇(piceatannol)的速率与野生型相比提高了18倍[42]。
Sherman等根据PikC分别与底物narbomycin和YC-17共结晶获得的三维结构数据,推测D50、E85和E94对于PikC的催化活性至关重要。通过定点突变方式将这3个酸性氨基酸变为非极性的丙氨酸或不带负电荷的天冬酰胺(N)或谷氨酰胺(Q)。其中,无论底物是narbomycin或YC-17,D50N突变体的催化活性均明显高于野生型;在YC-17的羟基化反应中,D50N导致产物neomethymycin产量高于methymycin,E85Q使得主要产物为methymycin,而野生型PikC则产生等量的两种羟基化产物[43]。由此可见,活性位点关键氨基酸的改变可直接影响P450酶的催化活性和选择性。
上述研究表明,细胞色素P450酶的理性设计是一种拓宽酶分子底物谱及调整酶分子催化选择性的重要策略。值得一提的是,在P450酶的稳定性、催化活性和选择性提高过程中,将理性设计和定向进化有机结合起来是未来的一个趋势。
4 细胞色素P450酶与药物及药物中间体的生产在微生物制药领域,细胞色素P450酶具有“施展拳脚”的广阔空间:(1) 构建药物筛选和药代分析模型[44]。由于人体内药物代谢过程主要由细胞色素P450酶完成,因此可以构建P450酶库,用于体外药物筛选和人体药物代谢过程模拟,与动物实验相比更为经济快捷。(2) 合成药物及药物中间体。此为细胞色素P450酶产业化的一个重要方向,并且已有如青蒿酸,普伐他汀等药物中间体及药物通过P450酶催化合成的工业化成功案例[45](图 7)。除此之外,一些基础研究工作也为未来更多P450酶的工业化奠定了良好的基础,例如我们最近通过全细胞催化手段成功利用重组大肠杆菌表达来自Sebekia benihana的CYP-sb21催化环孢菌素A (cyclosporine A)结构中4 位亮氨酸的羟基化,从而成功得到低免疫抑制活性、高促生发活性的羟基环孢菌素A,该技术有望未来应用于新型生发剂的工业化生产[46]。
 |
| 图 7. 已工业化的细胞色素P450酶参与合成的药物以及药物中间体 Figure 7. The pharmaceuticals with cytochrome P450 enzymes involved in their industrial production. |
| 图选项 |
相对于青蒿素的全合成以及植物提取等方式,微生物异源生产其前体青蒿酸无疑更加绿色环保、成本低廉。Sanofi公司已成功将酵母工程菌生产青蒿酸的工艺路线应用到工业生产中。首先对酵母焦磷酸法尼酯(FPP)生物合成途径中的相关基因进行改造以达到FPP的高水平积累,然后在酵母中表达紫穗槐二烯(amorphadiene)合成酶ADS将FPP转化为紫穗槐二烯(amorphadiene),紫穗槐二烯(amorphadiene)在细胞色素P450酶CYP71AV1的作用下,通过对紫穗槐二烯(amorp-hadiene)C12位的连续三步氧化得到青蒿酸。Keasling等利用这种策略获得的青蒿酸产量达100 mg/L[34]。Paddon等通过使用弱启动子表达还原伴侣CPR使得其与CYP71AV1更好地偶联,同时在重组酵母菌中表达来自黄花蒿(Artemisia annua)的细胞色素b5基因,使得青蒿酸的产量达到25 g/L[47]。
普伐他汀通过可逆性抑制HMG-COA还原酶,降低胆固醇的生物合成,是一种药效显著的降血脂药物,于1989年首先在日本上市,但是通过化学催化美伐他汀羟基化合成普伐他汀存在产率低的缺点。普伐他汀的生物转化最早由日本Sankyo公司应用于工业生产,主要分为两步:从橘青霉(Penicillium citrinum)的发酵液中获得美伐他汀[48];利用来自玫瑰红链霉菌(Streptomyces carbophilus)的P450sca-2(CYP105A3)对美伐他汀进行6β羟基化得到普伐他汀[49]。但是美伐他汀对玫瑰红链霉菌(Streptomyces carbophilus)的生长存在抑制作用,高浓度条件下甚至会导致菌体裂解,对工业生产极为不利。随后通过对生产工艺路线的一系列改进,如选择对美伐他汀耐受性高的表达宿主[50],定向进化或理性设计获得更高催化效率的P450sca-2[51]等。
另一个细胞色素P450酶应用于工业生产的典型案例是维生素D3到1α,25-二羟基维生素D3的转化。1α,25-二羟基维生素D3作为维生素D3的活性形式,与人体内的钙磷代谢紧密相关,可用于治疗甲状腺机能减退、骨质疏松症等疾病。由于从胆固醇开始从头至尾合成1α,25-二羟基维生素D3一共需要经过20多步化学反应,总得率仅为1%,成本高昂,人们开始寻求微生物转化方法。Sasaki发现Pseudonocardia autotrophica的发酵液可以催化维生素D3转化为1α,25-二羟基维生素D3,并从中分离得到了参与该过程的细胞色素P450 VD25 (CYP105A2)的基因,重组表达该基因的变铅青链霉菌(Streptomyces lividans)成功完成了1α,25-二羟基维生素D3的生物转化[52, 53]。随后,Sawada等发现灰色链霉菌(Streptomyces griseolus)的CYP105A1也可以完成维生素D3的1α/25位羟基化[54]。Hayashi等结合CYP105A1的晶体结构数据分别对R73和R84进行理性定点突变,相比野生型,R73A/R84V双突变体对维生素D3的1α位和25位羟基化的kcat/Km值分别提高了435倍和110倍,表达这一P450双突变体的变铅青链霉(Streptomyces lividans)生产1α,25-二羟基维生素D3的产量达到了2 mg/L[55, 56]。
细胞色素P450酶在甾族类激素生物转化领域也成绩斐然,一些工业菌株已成功运用于氢化可的松(hydrocortisol)的生产。例如Bayer公司利用表达P450酶的新月弯孢菌(Curvularia lunata)的菌丝体,催化11-脱氧可的松(11-deoxycortisol)的11位β羟基化得到氢化可的松[57]。由于肾上腺催化类固醇激素合成皮质醇的过程只存在于哺乳动物体内,涉及CYP17A1、CYP11A1、CYP21A2(或CYP21B2)和CYP11B1羟基化反应,因此甾醇类激素的生物转化主要利用更适合表达真核来源P450酶的重组酵母菌完成,如裂殖酵母和酿酒酵母。Sakaki等构建含有CYP17A1、CYP21B1及其还原伴侣基因的重组酿酒酵母,可以催化孕酮(progesterone)连续的17α羟基化和21位羟基化得到11-脱氧可的松(11-deoxycortisol)[58]。Szczebara等更是富有创造力地将13个工程化改造的基因在1株经过遗传改造的酿酒酵母(Saccharomyces cerevisiae)工程菌中表达,顺利将麦角甾醇(ergosterol)转化为氢化可的松:首先,酿酒酵母利用内源麦角甾醇积累egrosta-5-eneol和ergosta-5,22-dieneol,随后被CYP11A1转化为孕烯醇酮(pregnenolone),再经过3β-类固醇脱氢酶,CYP17A1、CYP21A1及CYP11B1的氧化依次合成孕酮,17-羟基孕酮(17-hydroxy-progesterone),11-脱氧可的松及终产物氢化可的松,实现了在1株酿酒酵母中成功完成多步P450酶催化反应,并可以得到孕烯醇酮,可的松和氢化可的松等一系列类固醇激素[59]。Upjohn公司利用Rhizopus arrhizus发酵液催化孕酮羟基化得到11α-羟基孕酮(11α-hydroxyprogesterone),使得可的松(cortisol)的全合成缩短了10余步,大大降低了生产成本[60]。后续研究表明,孕酮的11α-羟基化反应是由来自Rhizopus arrhizus的CYP509C12完成的[61]。此外,来自巨大枯草芽孢杆菌(Bacillus megaterium)的CYP106A2也可以催化孕酮(progesterone)的11α-羟基化反应[62]。
上述这些工业上成功应用的细胞色素P450酶案例将为其他工业候选P450酶的酶工程改造及产业化瓶颈的突破提供了良好的理论数据和经验支撑。
5 细胞色素P450酶的工业应用挑战及其解决途径尽管细胞色素P450酶的底物结构多样性和催化反应类型多样性使其在结构复杂有机化合物合成领域颇具潜力,但其工业应用仍面临许多瓶颈:P450酶的低稳定性及低催化效率;催化反应需要价格昂贵的还原伴侣和NAD(P)H的参与;电子传递过程与产物产生不耦合;以及P450酶结构信息不足阻碍其理性设计和改造等[45]。目前,大多数P450酶的定向进化和理性设计以及全细胞催化技术的发展仍局限于实验室阶段,工业应用还有很长一段路要走。针对细胞色素P450酶的工业应用瓶颈通常有以下一些解决途径。
5.1 细胞色素P450酶的优化在多数情况下P450酶的催化效率低、稳定性较差,除了来自巨大芽孢杆菌(Bacillus megaterium)的P450 BM3和来自恶臭假单胞菌(Pseudomonas putida)P450cam的转换数kcat达到1000–17000 min–1,大部分细胞色素P450酶的kcat在1–300 min–1[19]。因此,对于候选P450酶常需通过定向进化和理性设计等酶工程手段,并结合高通量筛选技术来获得高稳定性、高催化效率的突变体。例如,Guengerich等对P450 BM3底物识别位点(SRSs)的25个氨基酸残基通过饱和突变的方式得到突变体库,一些突变体相比野生型,对非那西汀(phenacetin)的催化效率提高了3–4倍[63];Schwaneberg等通过定向进化手段获得的P450 BM3突变体在二甲基亚砜和四氢呋喃等有机溶剂中的稳定性得以提高[64]。
很多参与植物和微生物次级代谢过程的细胞色素P450酶往往具有较高的底物专一性,只能利用单一或少数同类底物。为了拓宽这些P450酶的底物谱,Keasling等创造性地利用改造后的P450 BM3合成青蒿素的前体:结合计算机模拟分析结果,在P450 BM3的活性位点通过点突变的方式来获得P450 BM3突变体库,成功地获得一种突变体以非天然底物紫穗槐二烯(amorphadiene)作为底物催化artemisinic-11S,12-epoxide的合成[65]。
除了酶工程,底物工程(substrate engineering)也被成功应用于P450酶底物谱的拓宽。2009年,李盛英等独辟蹊径,根据P450 PikC在催化反应过程中对特异碱性脱氧六碳糖(desosamine)依赖的特性,从底物结构入手,利用该六碳糖协助不同结构的工程化非天然底物进入PikC活性位点,实现了具有高度位点及空间选择性的碳氢键氧化[66]。Sherman等进一步根据PikC催化过程中该六碳糖上的碱性氮与Glu和Asp形成盐桥的特点,设计了一系列带有二甲氨基锚定基团的薄荷醇(menthol)衍生物,实现了PikC对非天然底物薄荷醇的羟基化[67]。上述研究成果提示可以根据P450酶特异性识别某些小分子基团的特性,通过化学合成将该小分子基团可逆地连接至目标化合物来引导P450酶完成对目标化合物特定位点的选择性氧化反应。
5.2 还原伴侣选择和相互作用方式优化大部分细胞色素P450酶在催化过程中都需要还原伴侣蛋白的参与,并且在催化非天然底物氧化反应过程中往往存在电子传递与产物生成的解偶联问题,说明还原伴侣的选择及其与P450酶的相互作用关系至关重要,然而这种重要性在过去的研究中一直被低估。由于生物基因组中的P450基因与还原伴侣蛋白基因一般距离较远,因此很多P450酶的自体还原伴侣处于未知状态,因而需要替代还原伴侣的协助以实现体内或体外的活性重建,常用的替代还原伴侣如来源于菠菜(Spinach oleracea)的铁氧还蛋白(ferredoxin,Fdx)和铁氧还蛋白还原酶 (ferredoxin reducatase,FdR)、来源于牛(bovine)的肾上腺皮质铁氧还蛋白(adrenodoxin,Adx)和肾上腺皮质铁氧还蛋白还原酶(adrenodoxin reductase,AdR)、来源于大肠杆菌(Escherichia coli)的黄素氧化还原蛋白(flavodoxin,Fld)和黄素氧化还原蛋白还原酶(flavodoxin reductase,FlR)、以及来源于恶臭假单胞菌(Pseudomonas putida)的假单孢铁氧还蛋白(putidaredoxin,Pdx)和假单孢铁氧还蛋白还原酶(putidaredoxin reductase,PdR)等。
一些细胞色素P450酶借助异源还原伴侣无法有效地重建反应活性,但利用自体还原伴侣蛋白进行电子传递的催化速率一定最佳吗?Khatri等用Adx/AdR体外重建来自S. cellulosum So ce56的CYP109D1的反应活性,其对月桂酸(lauric acid)的催化效率与自体还原伴侣FdR_B/Fdx2和FdR_B/Fdx8相比提高了3–5倍[68]。Hakki等将Adx/AdR和CYP11B1在裂殖酵母(Saccharomyces pombe)中共表达,与CYP11B1依靠裂殖酵母自体还原伴侣支撑的活性相比,对氢化可的松的转化速率提高了3.4倍[69];Neunzig等利用不同来源的还原伴侣与人线粒体细胞色素P450酶相互组合,共构建了28株重组裂殖酵母,催化布洛芬(ibuprofen)、类固醇激素(steroids)等底物转化时发现,选择不同来源的还原伴侣,不但P450酶的催化速率受到影响,甚至产物的构型也出现变化[70]。以上研究结果表明,选择不同来源的还原伴侣,P450酶的催化速率受到较大影响,但通过逐个尝试来寻找P450酶最佳还原伴侣的方式效率很低,实用性不强。
除了还原伴侣的来源,P450酶与还原伴侣之间的相互作用方式对催化速率也有很大影响,因此可通过P450酶与还原伴侣相互作用界面的工程化改造达到优化电子传递链,提高催化效率的目的。清华大学林章凛教授研究组对P450sca-2的半理性工程化改造使之与替代还原伴侣Pdx/PdR 间形成更有效的电子传递链,成功将普伐他汀的生产效率提高了近10 倍[51];Uhlman等利用N端截短的Adx作为CYP11A1的还原伴侣,与野生型Adx相比,催化11-脱氧可的松的11位β羟基化得到氢化可的松的速率提高了近20倍[71]。
细胞色素P450酶和还原伴侣蛋白的融合表达相对于分开表达,电子传递更为高效,因而催化速率也更快。例如与还原伴侣天然融合的催化自主型P450 BM3的转换数在已发现P450酶中是最高的,这给人工构建“P450酶—还原伴侣”融合蛋白提供了启示。迄今为止,与P450 BM3天然融合的还原伴侣蛋白CPR已成功地与多种细菌来源的P450酶组成杂交融合体,形成人工催化自主型P450酶。李盛英等将来自红球菌Rhodococcus sp. NCIMB 9784的催化自主型P450RhF的还原伴侣功能域RhFRED与PikC融合表达,成功构建催化自主型PikC-RhfRED[16],随后陆续有科学家将RhFRED与其他细菌P450酶或植物P450酶融合表达并顺利完成体外活性重建。与此同时,一些研究表明P450酶与还原伴侣融合表达还可增加P450酶的稳定性,Maurer等发现将还原伴侣与P450 BM3融合表达在25 oC条件下的半衰期为29 d,而单独表达的P450功能域半衰期仅为2 d[72]。Weis等建立细菌和真菌细胞色素P450酶库进行药物代谢物合成过程中,发现一种来自烟曲霉(Asperigillus fumigatus)的、与还原伴侣蛋白天然融合的细胞色素P450酶CYP505X在催化过程即便存在有机溶剂也十分稳定[73]。
值得一提的是,在细胞色素P450酶研究领域存在一个简单“公设”,即还原伴侣的选择及其与P450酶的作用方式不会改变P450酶的催化反应类型。但我们近期的研究发现,来自Micromonospora griseorubida P450酶MycG与RhFRED融合表达时,能够在体外成功催化麦新米星IV的C14羟基化以及C12/C13碳碳双键的环氧化;而当以2个独立组分蛋白形式存在时,除了可以催化上述氧化反应外,还可以催化麦新米星结构中脱氧糖desosamine的去甲基化反应[16],这一实验结果直接对上述传统“公设”发起了挑战,同时也深化了我们对于细胞色素P450酶与还原伴侣相互作用机制的认识。通过选择不同的还原伴侣或调整P450酶和还原伴侣的相互作用方式,我们有可能获得全新的催化反应以及更多具有新颖结构的产物。
5.3 辅酶再生细胞色素P450酶催化过程需要从NAD(P)H获得电子,NAD(P)H价格昂贵,无疑给工业生产增加了巨大的生产成本。尽管大部分P450酶可以利用过氧化氢等过氧化物完成对底物的氧化过程,但是这种“走捷径”的方式由于催化速率低以及过氧化氢对酶稳定性的负面作用极大地限制了其工业应用,因此NAD(P)H再生系统的建立变得尤为重要。Sweers等利用葡萄糖脱氢酶实现了NAD(P)H的再生[74];Zhao等利用工程化改造的亚磷酸盐脱氢酶高效地实现了NADPH的再生[75];Ritva等利用葡萄糖-6-磷酸脱氢酶顺利地在酿酒酵母中完成了NADPH的再生[76];Karsten等利用甲酸脱氢酶完成了NADPH的再生[77];Sumio等利用甘油-3-磷酸脱氢酶成功地实现了NADH的再生[78]。Kuba等也顺利将乙醇脱氢酶的应用于NADPH的再生,其中乙醇不仅可以作为乙醇脱氢酶的底物合成NADPH,还可以作为助溶剂促溶疏水底物[79]。
光合作用中的光反应阶段可以积累NAD(P)H,于是一些科学家创造性地尝试将光合作用中电子传递链直接偶联至细胞色素P450酶为其提供电子以替代NAD(P)H的再生系统。如Jensen等成功在体外利用分离于大麦(Hordeum vulgare)的光系统I(PSI)为CYP79A催化反应提供还原力[80]。Coni等也利用鱼腥藻(Anabaena)的光合系统稳定地为CYP106A2提供还原力[81]。但是,这种技术在工业应用上能否适用仍有待进一步研究。
通过添加荧光染料的方法也可以为细胞色素P450酶持续地提供电子来源。如Park等不提供还原伴侣蛋白和辅酶因子,而在光照条件下利用曙红Y (eosin Y)为P450 BM3和CYP 1A1等P450酶催化洛伐他汀和类固醇激素等底物的氧化反应提供电子[82]。
有趣的是,一些物理化学学家也尝试使用电化学方法来给细胞色素P450酶催化反应提供电子[83]。由于P450酶血红素辅基需要从阴极获取电子,但过于靠近电极表面会变得极不稳定,因此至少目前来看利用电化学法还原P450酶在生物转化中的实际应用仍然很遥远。
5.4 全细胞催化需解决的问题全细胞生物催化是指利用完整的生物有机体(全细胞、组织甚至个体)作为催化剂进行化学转化的过程,即生物转化(biotransformation),是介于发酵法和提取酶催化法之间的一种生物催化技术。细胞色素P450酶催化反应需要多组分参与,包括P450酶和还原伴侣的表达系统,NAD(P)H再生系统等,相比纯酶催化,重组细胞体内丰富的组分、稳定的内环境可以保障酶反应得以高效、持续稳定地运转,因此成为P450酶工业应用的首选。但是P450酶底物和产物对细胞的毒性以及细胞对底物摄取和产物泵出的效率仍需要不断优化和改进。
工业化应用的细胞色素P450酶多为水溶性,但底物或产物往往是疏水性有机化合物,因此极大地限制了P450酶的催化效率。对此一般有两种解决途径:(1)使用两相体系,通过加入如环糊精等助溶剂使得疏水底物更易被重组细胞摄取;(2)选用有机溶剂耐受的菌株构建重组体细胞,如P. putida S12[84]和B. subtilis 3C5N[85]等。
优化重组体细胞对底物摄取和产物泵出的效率在全细胞催化中极为关键,例如近期我们在利用重组大肠杆菌表达CYP-sb21催化环孢菌素A的4位亮氨酸羟基化的过程中,添加十六烷基三甲基溴化铵(CTAB)来改善细胞膜通透性,从而显著提高P450全细胞催化剂对环孢菌素A的转化效率[46]。又如Cornelissen等在大肠杆菌重组体中表达来自P. putida GPo1外膜蛋白AlkL,使得CYP153A6对柠檬烯(S-limonene)的羟基化速率提高了2–5倍[86]。鉴于不同表达宿主的生理构造区别,对底物摄取和产物泵出的效率不尽相同,我们也可以通过尝试不同的宿主微生物来提高转化效率。
底物和产物对重组体的毒性目前主要通过更换宿主来规避,如利用酿酒酵母表达CYP71D51V2生产诺卡酮(nootkatone),当累积量超过了100 mg/L时对宿主菌产生毒性抑制[87],而利用大肠杆菌重组表达CYP109B1生产诺卡酮(nootkatone),累积量则可超过120 mg/L,且对大肠杆菌重组体无明显抑制[88]。
除此以外,立足于整个细胞色素P450酶的反应体系,一些物理化学的方法和策略也可提高催化效率。例如在不影响酶活性的前提下,使用超声波技术加快分子间的相互作用,可以提高细胞 色素P450酶的反应速率;利用磷脂纳米盘(nanodisc)体系可以提高与膜结合的P450酶的稳定性和催化效率;提高反应体系O2压力或选择溶氧量较高的试剂,优化重组体细胞的发酵条件等均对提高P450酶生物转化效果具有一定作用[89]。
6 结语和展望细胞色素P450酶具有自然界最好的催化多能性,可在温和条件下催化化学合成难以实现的复杂有机化合物的选择性氧化反应,但是由于P450酶的低稳定性、低活力以及对还原伴侣蛋白和辅因子的依赖等因素限制了这一单加氧酶家族的工业化应用。本文对上述优势和劣势均进行了较为系统的阐述。现今,科学家们已经针对P450酶工业化的这些问题作出了许多努力并积累了大量经验教训,并且不断有P450酶成功应用于微生物制药领域的案例出现。细胞色素P450酶的催化机制和工程化改造一直是国际研究热点,但关于P450酶与还原伴侣的相互作用研究还比较欠缺,尤其是一些P450酶还苦于不能寻获其最佳还原伴侣而无法进行详细研究和开发,因此通用性高的还原伴侣选择及电子传递链优化策略的建立迫在眉睫。在微生物药物创制领域,我们需要不断加强对参与植物和微生物药用活性天然产物生物合成中各种P450酶的基因资源挖掘、功能鉴定和酶工程研究,按照合成生物学思路建立和充实P450催化元件库及还原伴侣蛋白库。在此基础上,针对具有工业需求的目标化学反应开发最佳的细胞色素P450酶及其还原伴侣,以优化的工程菌株作为载体,开发新的工业P450酶和生物转化方案。随着基因工程、酶工程、代谢工程及合成生物学的不断发展,我们有理由相信,细胞色素P450酶将在不久的将来更加广泛地应用于不同行业领域,尤其是微生物药物创制领域。
参考文献
| [1] | Denisov IG, Makris TM, Sligar SG, Schlichting I. Structure and chemistry of cytochrome P450. Chemical Reviews, 2005, 105(6): 2253-2278. |
| [2] | Klingenberg M. Pigments of rat liver microsomes. Archives of Biochemistry and Biophysics, 1958, 75(2): 376-386. |
| [3] | Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, Devon K, Dewar K, Doyle M, FitzHugh W. Initial sequencing and analysis of the human genome. Nature, 2001, 409(6822): 860-921. |
| [4] | Venter JC, Adams MD, Myers EW, Li PW, Mural RJ, Sutton GG, Smith HO, Yandell M, Evans CA, Holt RA. The sequence of the human genome. Science, 2001, 291(5507): 1304-1351. |
| [5] | Lamb DC, Skaug T, Song HL, Jackson CJ, Podust LM, Waterman MR, Kell DB, Kelly DE, Kelly SL. The cytochrome P450 complement (CYPome) of Streptomyces coelicolor A3 (2). Journal of Biological Chemistry, 2002, 277(27): 24000-24005. |
| [6] | Kelly DE, Kraševec N, Mullins J, Nelson DR. The CYPome (cytochrome P450 complement) of Aspergillus nidulans. Fungal Genetics and Biology, 2009, 46(1): S53-S61. |
| [7] | Guengerich FP, Munro AW. Unusual cytochrome P450 enzymes and reactions. Journal of Biological Chemistry, 2013, 288(24): 17065-17073. |
| [8] | Poulos TL, Finzel B, Gunsalus I, Wagner GC, Kraut J. The 2.6-A crystal structure of Pseudomonas putida cytochrome P450. Journal of Biological Chemistry, 1985, 260(30): 16122-16130. |
| [9] | Poulos TL. Cytochrome P450. Current Opinion in Structural Biology, 1995, 5(6): 767-774. |
| [10] | Halpert JR, Domanski TL, Adali O, Biagini CP, Cosme J, Dierks EA, Johnson EF, Jones JP, de Montellano PO, Philpot RM. Structure-function of cytochromes P450 and flavin-containing monooxygenases implications for drug metabolism. Drug Metabolism and Disposition, 1998, 26(12): 1223-1231. |
| [11] | Bernhardt R. Optimized chimeragenesis: creating diverse P450 functions. Chemistry & Biology, 2004, 11(3): 287-288. |
| [12] | Ortiz de Montellano PR. Cytochrome P450: structure, mechanism, and biochemistry. 3rd Ed. New York: Montellano, P. R. Ed. Kluwer Academic / Plenum Publishers, 2005.87-114. |
| [13] | Guengerich FP. Common and uncommon cytochrome P450 reactions related to metabolism and chemical toxicity. Chemical Research in Toxicology, 2001, 14(6): 611-650. |
| [14] | Nebert DW, Adesnik M, Coon MJ, Estabrook RW, Gonzalez FJ, Guengerich FP, Gunsalus IC, Johnson EF, Kemper B, Levin W. The P450 gene superfamily: recommended nomenclature. DNA, 1987, 6(1): 1-11. |
| [15] | Ruettinger RT, Fulco A. Epoxidation of unsaturated fatty acids by a soluble cytochrome P450-dependent system from Bacillus megaterium. Journal of Biological Chemistry, 1981, 256(11): 5728-5734. |
| [16] | Li S, Podust LM, Sherman DH. Engineering and analysis of a self-sufficient biosynthetic cytochrome P450 PikC fused to the RhFRED reductase domain. Journal of the American Chemical Society, 2007, 129(43): 12940-12941. |
| [17] | Roberts GA, Grogan G, Greter A, Flitsch SL, Turner NJ. Identification of a new class of cytochrome P450 from a Rhodococcus sp.. Journal of Bacteriology, 2002, 184(14): 3898-3908. |
| [18] | Daiber A, Shoun H, Ullrich V. Nitric oxide reductase (P450 nor) from Fusarium oxysporum. Journal of Inorganic Biochemistry, 2005, 99(1): 185-193. |
| [19] | Bernhardt R, Urlacher VB. Cytochromes P450 as promising catalysts for biotechnological application: chances and limitations. Applied Microbiology and Biotechnology, 2014, 98(14): 6185-6203. |
| [20] | Huang W, Wang JB, Tang GL. Synthetic biology toward medicinal natural products. Chinese Bulletin of Life Sciences, 2011, 23(9): 891-899. (In Chinese) |
| 黄伟, 王健博, 唐功利. 天然产物类药物的合成生物学研究. 生命科学, 2011, 23(9): 891–899. | |
| [21] | Stassi D, Donadio S, Staver MJ, Katz L. Identification of a Saccharopolyspora erythraea gene required for the final hydroxylation step in erythromycin biosynthesis. Journal of Bacteriology, 1993, 175(1): 182-189. |
| [22] | Weber J, Leung J, Swanson S, Idler K, McAlpine J. An erythromycin derivative produced by targeted gene disruption in Saccharopolyspora erythraea. Science, 1991, 252(5002): 114-117. |
| [23] | Lee SK, Park JW, Kim JW, Jung WS, Park SR, Choi CY, Kim ES, Kim BS, Ahn JS, Sherman DH. Neopikromycin and novapikromycin from the pikromycin biosynthetic pathway of Streptomyces venezuelae. Journal of Natural Products, 2006, 69(5): 847-849. |
| [24] | Xue Y, Wilson D, Zhao L, Liu HW, Sherman DH. Hydroxylation of macrolactones YC-17 and narbomycin is mediated by the pikC-encoded cytochrome P450 in Streptomyces venezuelae. Chemistry & Biology, 1998, 5(11): 661-667. |
| [25] | Rodriguez AM, Olano C, Méndez C, Hutchinson CR, Salas J. A cytochrome P450-like gene possibly involved in oleandomycin biosynthesis by Streptomyces antibioticus. FEMS Microbiology Letters, 1995, 127(1-2): 117-120. |
| [26] | Ogura H, Nishida CR, Hoch UR, Perera R, Dawson JH, Ortiz de Montellano PR. EpoK, a cytochrome P450 involved in biosynthesis of the anticancer agents epothilones A and B. Substrate-mediated rescue of a P450 enzyme. Biochemistry, 2004, 43(46): 14712-14721. |
| [27] | Cacho RA, Chooi YH, Zhou H, Tang Y. Complexity generation in fungal polyketide biosynthesis: a spirocycle-forming P450 in the concise pathway to the antifungal drug griseofulvin. ACS Chemical Biology, 2013, 8(10): 2322-2330. |
| [28] | Chooi YH, Hong YJ, Cacho RA, Tantillo DJ, Tang Y. A cytochrome P450 serves as an unexpected terpene cyclase during fungal meroterpenoid biosynthesis. Journal of the American Chemical Society, 2013, 135(45): 16805-16808. |
| [29] | Anzai Y, Li S, Chaulagain MR, Kinoshita K, Kato F, Montgomery J, Sherman DH. Functional analysis of MycCI and MycG, cytochrome P450 enzymes involved in biosynthesis of mycinamicin macrolide antibiotics. Chemistry & Biology, 2008, 15(9): 950-959. |
| [30] | Carlson JC, Fortman J, Anzai Y, Li S, Burr DA, Sherman DH. Identification of the tirandamycin biosynthetic gene cluster from Streptomyces sp. 307-9. Chembiochem : a European Journal of Chemical Biology, 2010, 11(4): 564-572. |
| [31] | Carlson JC, Li S, Burr DA, Sherman DH. Isolation and characterization of tirandamycins from a marine-derived Streptomyces sp. Journal of Natural Products, 2009, 72(11): 2076-2079. |
| [32] | Matsuda Y, Iwabuchi T, Wakimoto T, Awakawa T, Abe I. Uncovering the unusual D-ring construction in terretonin biosynthesis by collaboration of a multifunctional cytochrome P450 and a unique isomerase. Journal of the American Chemical Society, 2015, 137(9): 3393-3401. |
| [33] | Barriuso J, Nguyen DT, Li JWH, Roberts JN, MacNevin G, Chaytor JL, Marcus SL, Vederas JC, Ro DK. Double oxidation of the cyclic nonaketide dihydromonacolin L to monacolin J by a single cytochrome P450 monooxygenase, LovA. Journal of the American Chemical Society, 2011, 133(21): 8078-8081. |
| [34] | Ro DK, Paradise EM, Ouellet M, Fisher KJ, Newman KL, Ndungu JM, Ho KA, Eachus RA, Ham TS, Kirby J. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440(7086): 940-943. |
| [35] | Davidson SE, Reid JB, Helliwell CA. Cytochromes P450 in gibberellin biosynthesis. Phytochemistry Reviews, 2006, 5(2-3): 405-419. |
| [36] | Gesell A, Rolf M, Ziegler J, Chávez MLD, Huang FC, Kutchan TM. CYP719B1 is salutaridine synthase, the CC phenol-coupling enzyme of morphine biosynthesis in opium poppy. Journal of Biological Chemistry, 2009, 284(36): 24432-24442. |
| [37] | Winzer T, Kern M, King AJ, Larson TR, Teodor RI, Donninger SL, Li Y, Dowle AA, Cartwright J, Bates R. Morphinan biosynthesis in opium poppy requires a P450-oxidoreductase fusion protein. Science, 2015, 349(6245): 309-312. |
| [38] | Warman A, Roitel O, Neeli R, Girvan H, Seward H, Murray S, McLean K, Joyce M, Toogood H, Holt R. Flavocytochrome P450 BM3: an update on structure and mechanism of a biotechnologically important enzyme. Biochemical Society Transactions, 2005, 33(4): 747-753. |
| [39] | Otey CR, Bandara G, Lalonde J, Takahashi K, Arnold FH. Preparation of human metabolites of propranolol using laboratory-evolved bacterial cytochromes P450. Biotechnology and Bioengineering, 2006, 93(3): 494-499. |
| [40] | Sawayama AM, Chen MM, Kulanthaivel P, Kuo MS, Hemmerle H, Arnold FH. A panel of cytochrome P450 BM3 variants to produce drug metabolites and diversify lead compounds. Chemistry-A European Journal, 2009, 15(43): 11723-11729. |
| [41] | van Vugt-Lussenburg BM, Damsten MC, Maasdijk DM, Vermeulen NP, Commandeur JN. Heterotropic and homotropic cooperativity by a drug-metabolising mutant of cytochrome P450 BM3. Biochemical and Biophysical Research Communications, 2006, 346(3): 810-818. |
| [42] | Kim DH, Ahn T, Jung HC, Pan JG, Yun CH. Generation of the human metabolite piceatannol from the anticancer-preventive agent resveratrol by bacterial cytochrome P450 BM3. Drug Metabolism and Disposition, 2009, 37(5): 932-936. |
| [43] | Sherman DH, Li S, Yermalitskaya LV, Kim Y, Smith JA, Waterman MR, Podust LM. The structural basis for substrate anchoring, active site selectivity and product formation by P450 PikC from Streptomyces venezuelae. Journal of Biological Chemistry, 2006, 281(36): 26289-26297. |
| [44] | Lamb DC, Waterman MR, Zhao B. Streptomyces cytochromes P450: applications in drug metabolism. Expert Opinion on Drug Metabolism & Toxicology, 2013, 9(10): 1279-1294. |
| [45] | Sakaki T. Practical application of cytochrome P450. Biological and Pharmaceutical Bulletin, 2012, 35(6): 844-849. |
| [46] | Ma L, Du L, Chen H, Sun Y, Huang S, Zheng X, Kim E-S, Li S. Reconstitution of the in vitro activity of the cyclosporine-specific P450 hydroxylase from Sebekia benihana and development of a heterologous whole-cell biotransformation system. Applied and Environmental Microbiology, 2015, 81(18): 6268-6275. |
| [47] | Paddon CJ, Westfall P, Pitera D, Benjamin K, Fisher K, McPhee D, Leavell M, Tai A, Main A, Eng D. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528-532. |
| [48] | Hosobuchi M, Kurosawa K, Yoshikawa H. Application of computer to monitoring and control of fermentation process: microbial conversion of ML-236B Na to pravastatin. Biotechnology and Bioengineering, 1993, 42(7): 815-820. |
| [49] | Serizawa N, Matsuoka T. A two component-type cytochrome P450 monooxygenase system in a prokaryote that catalyzes hydroxylation of ML-236B to pravastatin, a tissue-selective inhibitor of 3-hydroxy-3-methylglutaryl coenzyme A reductase. Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism, 1991, 1084(1): 35-40. |
| [50] | Chen CH, Hu HY, Cho YC, Hsu WH. Screening of compactin-resistant microorganisms capable of converting compactin to pravastatin. Current microbiology, 2006, 53(2): 108-112. |
| [51] | Ba L, Li P, Zhang H, Duan Y, Lin Z. Semi-rational engineering of cytochrome P450sca-2 in a hybrid system for enhanced catalytic activity: Insights into the important role of electron transfer. Biotechnology and Bioengineering, 2013, 110(11): 2815-2825. |
| [52] | Kawauchi H, Sasaki J, Adachi T, Hanada K, Beppu T, Horinouchi S. Cloning and nucleotide sequence of a bacterial cytochrome P-450 VD25 gene encoding vitamin D-3,25-hydroxylase. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 1994, 1219(1): 179-183. |
| [53] | Sasaki J, Miyazaki A, Saito M, Adachi T, Mizoue K, Hanada K, Omura S. Transformation of vitamin D3 to 1α, 25-dihydroxyvitamin D3 via 25-hydroxyvitamin D3 using Amycolata sp. strains. Applied Microbiology and Biotechnology, 1992, 38(2): 152-157. |
| [54] | Sawada N, Sakaki T, Yoneda S, Kusudo T, Shinkyo R, Ohta M, Inouye K. Conversion of vitamin D 3 to 1α, 25-dihydroxyvitamin D 3 by Streptomyces griseolus cytochrome P450SU-1. Biochemical and Biophysical Research Communications, 2004, 320(1): 156-164. |
| [55] | Hayashi K, Sugimoto H, Shinkyo R, Yamada M, Ikeda S, Ikushiro S, Kamakura M, Shiro Y, Sakaki T. Structure-based design of a highly active vitamin D hydroxylase from Streptomyces griseolus CYP105A1. Biochemistry, 2008, 47(46): 11964-11972. |
| [56] | Hayashi K, Yasuda K, Sugimoto H, Ikushiro S, Kamakura M, Kittaka A, Horst RL, Chen TC, Ohta M, Shiro Y. Three-step hydroxylation of vitamin D3 by a genetically engineered CYP105A1. FEBS Journal, 2010, 277(19): 3999-4009. |
| [57] | Petzoldt K, Annen K, Laurent H, Wiechert R. Process for the preparation of 11 β-hydroxy steroids. U.S. Patent 4,353,985[P]. 1982-10-12. |
| [58] | Sakaki T, Akiyoshi-Shibata M, Yabusaki Y, Manabe K, Murakami H, Ohkawa H. Progesterone metabolism in recombinant yeast simultaneously expressing bovine cytochromes P450cl7 (CYP17A1) and P450c21 (CYP21B1) and yeast NADPH-P450 oxidoreductase. Pharmacogenetics and Genomics, 1991, 1(2): 86-93. |
| [59] | Szczebara FM, Chandelier C, Villeret C, Masurel A, Bourot S, Duport C, Blanchard S, Groisillier A, Testet E, Costaglioli P. Total biosynthesis of hydrocortisone from a simple carbon source in yeast. Nature Biotechnology, 2003, 21(2): 143-149. |
| [60] | Hogg JA. Steroids, the steroid community and upjohn in perspective: a profile of innovation. Steroids, 1992, 57(12): 593-616. |
| [61] | Petrič Š, Hakki T, Bernhardt R, Žigon D, Črešnar B. Discovery of a steroid 11α-hydroxylase from Rhizopus oryzae and its biotechnological application. Journal of Biotechnology, 2010, 150(3): 428-437. |
| [62] | Nguyen KT, Virus C, Günnewich N, Hannemann F, Bernhardt R. Changing the regioselectivity of a P450 from C15 to C11 hydroxylation of progesterone. Chembiochem : a European Journal of Chemical Biology, 2012, 13(8): 1161-1166. |
| [63] | Parikh A, Josephy PD, Guengerich FP. Selection and characterization of human cytochrome P450 1A2 mutants with altered catalytic properties. Biochemistry, 1999, 38(17): 5283-5289. |
| [64] | Wong TS, Arnold FH, Schwaneberg U. Laboratory evolution of cytochrome P450 BM-3 monooxygenase for organic cosolvents. Biotechnology and Bioengineering, 2004, 85(3): 351-358. |
| [65] | Dietrich JA, Yoshikuni Y, Fisher KJ, Woolard FX, Ockey D, McPhee DJ, Renninger NS, Chang MC, Baker D, Keasling JD. A novel semi-biosynthetic route for artemisinin production using engineered substrate-promiscuous P450BM3. ACS Chemical Biology, 2009, 4(4): 261-267. |
| [66] | Li S, Chaulagain MR, Knauff AR, Podust LM, Montgomery J, Sherman DH. Selective oxidation of carbolide C–H bonds by an engineered macrolide P450 mono-oxygenase. Proceedings of the National Academy of Sciences, 2009, 106(44): 18463-18468. |
| [67] | Narayan AR, Jiménez Osés G, Liu P, Negretti S, Zhao W, Gilbert MM, Ramabhadran RO, Yang YF, Furan LR, Li Z. Enzymatic hydroxylation of an unactivated methylene C–H bond guided by molecular dynamics simulations. Nature Chemistry, 2015, 7(8): 653-660. |
| [68] | Khatri Y, Hannemann F, Ewen KM, Pistorius D, Perlova O, Kagawa N, Brachmann AO, Müller R, Bernhardt R. The CYPome of Sorangium cellulosum So ce56 and identification of CYP109D1 as a new fatty acid hydroxylase. Chemistry & biology, 2010, 17(12): 1295-1305. |
| [69] | Hakki T, Zearo S, Drăgan CA, Bureik M, Bernhardt R. Coexpression of redox partners increases the hydrocortisone (cortisol) production efficiency in CYP11B1 expressing fission yeast Schizosaccharomyces pombe. Journal of Biotechnology, 2008, 133(3): 351-359. |
| [70] | Neunzig I, Widjaja M, Peters FT, Maurer HH, Hehn A, Bourgaud F, Bureik M. Coexpression of CPR from various origins enhances biotransformation activity of human CYPs in S. pombe. Applied Biochemistry and Biotechnology, 2013, 170(7): 1751-1766. |
| [71] | Uhlmann H, Kraft R, Bernhardt R. C-terminal region of adrenodoxin affects its structural integrity and determines differences in its electron transfer function to cytochrome P450. Journal of Biological Chemistry, 1994, 269(36): 22557-22564. |
| [72] | Shoji O, Fujishiro T, Nagano S, Tanaka S, Hirose T, Shiro Y, Watanabe Y. Understanding substrate misrecognition of hydrogen peroxide dependent cytochrome P450 from Bacillus subtilis. JBIC Journal of Biological Inorganic Chemistry, 2010, 15(8): 1331-1339. |
| [73] | Weis R, Winkler M, Schittmayer M, Kambourakis S, Vink M, Rozzell JD, Glieder A. A diversified library of bacterial and fungal bifunctional cytochrome P450 enzymes for drug metabolite synthesis. Advanced Synthesis & Catalysis, 2009, 351(13): 2140-2146. |
| [74] | Wong C, Drueckhammer DG, Sweers HM. Enzymatic vs. fermentative synthesis: thermostable glucose dehydrogenase catalyzed regeneration of NAD (P) H for use in enzymatic synthesis. Journal of the American Chemical Society, 1985, 107(13): 4028-4031. |
| [75] | Johannes TW, Woodyer RD, Zhao H. Efficient regeneration of NADPH using an engineered phosphite dehydrogenase. Biotechnology and Bioengineering, 2007, 96(1): 18-26. |
| [76] | Verho R, Londesborough J, Penttilä M, Richard P. Engineering redox cofactor regeneration for improved pentose fermentation in Saccharomyces cerevisiae. Applied and Environmental Microbiology, 2003, 69(10): 5892-5897. |
| [77] | Seelbach K, Riebel B, Hummel W, Kula MR, Tishkov VI, Egorov AM, Wandrey C, Kragl U. A novel efficient regenerating method of NADPH using a new formate dehydrogenase. Tetrahedron Letters, 1996, 37(9): 1377-1380. |
| [78] | Michnick S, Roustan JL, Remize F, Barre P, Dequin S. Modulation of glycerol and ethanol yields during alcoholic fermentation in Saccharomyces cerevisiae strains overexpressed or disrupted for GPD1 encoding glycerol 3-phosphate dehydrogenase. Yeast, 1997, 13(9): 783-793. |
| [79] | Kubo T, Peters MW, Meinhold P, Arnold FH. Enantioselective epoxidation of terminal alkenes to (R)- and (S)-epoxides by engineered cytochromes P450 BM-3. Chemistry-a European Journal, 2006, 12(4): 1216-1220. |
| [80] | Jensen K, Jensen PE, Møller BL. Light-driven cytochrome P450 hydroxylations. ACS Chemical Biology, 2011, 6(6): 533-539. |
| [81] | Goñi G, Zöllner A, Lisurek M, Velázquez-Campoy A, Pinto S, Gómez-Moreno C, Hannemann F, Bernhardt R, Medina M. Cyanobacterial electron carrier proteins as electron donors to CYP106A2 from Bacillus megaterium ATCC 13368. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2009, 1794(11): 1635-1642. |
| [82] | Park JH, Lee SH, Cha GS, Choi DS, Nam DH, Lee JH, Lee JK, Yun CH, Jeong KJ, Park CB. Cofactor-free light-driven whole-cell cytochrome P450 catalysis. Angewandte Chemie, 2015, 127(3): 983-987. |
| [83] | Schneider E, Clark DS. Cytochrome P450 (CYP) enzymes and the development of CYP biosensors. Biosensors and Bioelectronics, 2013, 39(1): 1-13. |
| [84] | Kieboom J, Dennis JJ, de Bont JA, Zylstra GJ. Identification and molecular characterization of an efflux pump involved in Pseudomonas putida S12 solvent tolerance. Journal of Biological Chemistry, 1998, 273(1): 85-91. |
| [85] | Siriphongphaew A, Pisnupong P, Wongkongkatep J, Inprakhon P, Vangnai AS, Honda K, Ohtake H, Kato J, Ogawa J, Shimizu S. Development of a whole-cell biocatalyst co-expressing P450 monooxygenase and glucose dehydrogenase for synthesis of epoxyhexane. Applied Microbiology and Biotechnology, 2012, 95(2): 357-367. |
| [86] | Cornelissen S, Julsing MK, Volmer J, Riechert O, Schmid A, Bühler B. Whole-cell-based CYP153A6-catalyzed (S)-limonene hydroxylation efficiency depends on host background and profits from monoterpene uptake via AlkL. Biotechnology and Bioengineering, 2013, 110(5): 1282-1292. |
| [87] | Gavira C, Höfer R, Lesot A, Lambert F, Zucca J, Werck-Reichhart D. Challenges and pitfalls of P450-dependent (+)-valencene bioconversion by Saccharomyces cerevisiae. Metabolic Engineering, 2013, 18: 25-35. |
| [88] | Girhard M, Machida K, Itoh M, Schmid RD, Arisawa A, Urlacher VB. Regioselective biooxidation of (+)-valencene by recombinant E. coli expressing CYP109B1 from Bacillus subtilis in a two-liquid-phase system. Microbial Cell Factories, 2009, 8(36): 10.1186. |
| [89] | Caswell JM, O’Neill M, Taylor SJ, Moody TS. Engineering and application of P450 monooxygenases in pharmaceutical and metabolite synthesis. Current Opinion in Chemical Biology, 2013, 17(2): 271-275. |
