张盼盼, 秦盛, 袁博, 陈永强, 曹小迎, 蒋继宏


江苏师范大学, 江苏省药用植物生物技术重点实验室, 江苏 徐州 221116
收稿日期: 2015-05-20; 修回日期: 2015-08-21; 网络出版日期: 2015-09-11
基金项目: 国家自然科学基金(31170605,31370646)
通信作者: 蒋继宏, Tel/Fax: +86-516-83403515;E-mail: jhjiang@jsnu.edu.cn
摘要: [目的] 研究药用植物南方红豆杉内生及根际土壤放线菌的多样性及其抑菌、抗肿瘤等重要生物活性并获得一些具有强抑制植物病原真菌以及抗肿瘤等重要生物活性的菌株。[方法] 选择7种培养基从南方红豆杉及其根际土壤中分离放线菌,对链霉菌进行形态学分类,去重复后对其进行抑制植物病原真菌以及抗肿瘤活性的筛选并对高活性菌株进行初步鉴定。对部分菌株进行16S rRNA基因测序分析研究其多样性。[结果] 研究共分离得到277株放线菌,经去重复后剩余111株放线菌,可归类到6个亚目、7个科、8个属。其中链霉菌可分为10个类群。生物活性研究结果显示:30.9%的菌株具有抑制植物病原真菌活性,其中6株放线菌对多种植物病原真菌显示了强的抑菌活性。分别有44.1%和33.3%的菌株对胃癌肿瘤细胞株SGC-7901和肺癌肿瘤细胞株NCI-H460的抑制率在40%以上。[结论] 药用植物南方红豆杉及其根际土壤蕴含种类丰富的放线菌资源,具有良好的生物学活性。菌株KLBMP 2170具有显著的抑菌以及抗肿瘤活性,值得我们去进一步研究。
关键词: 放线菌南方红豆杉根际土壤多样性生物活性
Diversity and bioactivity of actinomycetes isolated from medicinal plant Taxus chinensis and rhizospheric soil
Panpan Zhang, Sheng Qin, Bo Yuan, Yongqiang Chen, Xiaoying Cao, Jihong Jiang


Key Laboratory for Biotechnology on Medicinal Plants of Jiangsu Province, Jiangsu Normal University, Xuzhou 221116, Jiangsu Province, China
Received: 20 May 2015; Revised: 21 August 2015; Published online: 11 September 2015
Foundation Item: Supported by the National Natural Science Foundation of China (31170605, 31370646)
Corresponding author: Jihong Jiang, Tel/Fax: +86-516-83403515;E-mail: jhjiang@jsnu.edu.cn
Abstract:[Objective] In order to provide strains with high activity of anti-phytopathogenic fungi and antitumor activity, we studied the diversity and bioactivity of actinomycetes isolated from medicinal plant Taxus chinensis and rhizospheric soil. [Methods] Seven selective media were used to isolate actinomycetes. Experiments of anti-phytopathogenic fungi, cytotoxicity activity, and the 16S rRNA gene sequencing of them were carried out to evaluate the diversity and bioactivity. Strains with high activity were identified. [Results] A total of 277 actinomycetes were isolated, of which 111 strains were selected and assigned to 6 suborders, 7 families and 8 genera, in which Taxus chinensis can be divided into 10 groups. The bioactivity testing results indicated that: 30.9% isolates showed activity against at least one of the 12 phytopathogenic fungi; 44.1% strains and 33.3% strains showed cytotoxicity activity with inhibition rate above 40% against stomach cancer cell line SGC-7901 and lung cancer cell line NCI-H460 respectively. [Conclusion] Actinomycetes isolated from Taxus chinensis and rhizospheric soil is of high diversity and a good source for the selection of bioactive compounds. Taxus chinensis KLBMP 2170 is an excellent resource with antifungal and cytotoxicity activity for further studies.
Key words: actinomycetesTaxus chinensisrhizospheric soildiversitybioactivity
放线菌是一类高G+C含量的革兰氏阳性细菌,广泛分布于地球上的各种生态环境中,是多种生物活性物质的重要来源,如抗生素、免疫抑制剂、植物病原真菌抑制剂、抗肿瘤药物,细胞分裂以及消炎药等[1, 2]。然而迄今为止,仅有大约1%的放线菌被分离鉴定,大量的放线菌资源及其产生的生物活性物质有待我们去分离纯化。土壤是放线菌及其生物活性物质的一个重要来源,植物根际土壤放线菌能够帮助保护植物的根部不被病原菌感染,并且其中一些根际放线菌还具有促进植物生长的能力[3]。如分离自土壤的StreptomycetesYCED9能够合成3种类型抗真菌的抗生素以及2个水解酶,显示了很强的生物防治潜力[4]。然而随着研究的深入,从这一传统的环境中分离新的放线菌资源以及新的生物活性物质变得越来越难。因而科学家们开始尝试开发一些新的分离方法[5]并把目光投向一些新的环境,如海洋、热泉、盐湖,药用植物或生长于特殊生境下的植物[6, 7],以期获得一些新的放线菌资源以及新的生物活性物质。植物内生放线菌是指一类能够定殖于植物体内并且不引起宿主植物显著伤害的放线菌[8]。在与宿主植物的长期进化过程中,与次级代谢产物生物合成有关基因可通过水平基因转移[9]使得内生放线菌产生一些由植物合成的生物活性物质。迄今为止,有关植物[10]内生放线菌的研究揭示了其高度的生物多样性,并且其中一些菌株具有良好的生物活性。如Streptomyces sp. NRRL 30562能够产生具有广谱抑菌活性的新型多肽类抗生素munumbicins[11];Streptomyces sp. Hedaya48产生的抗菌剂saadamycin[12];以及Micromonospora lupini产生的蒽醌类抗肿瘤化合物lupinacidins A和B[13] 等。因而植物内生放线菌及根际土壤放线菌是生物活性物质的重要来源。
紫杉醇是一种分离自药用植物红豆杉(Taxus sp.)体内的具有显著抗肿瘤活性的化合物,被广泛应用于卵巢癌、乳腺癌、肺癌、胃癌等癌症的临床治疗。除了植物这一来源,研究发现一些红豆杉内生真菌[14]以及内生放线菌[15]也能够合成紫杉醇。然而,由于尚未有紫杉醇生物合成的基因被鉴定以及基因组测序也未找到相关基因[16],这些内生菌能否独自合成紫杉醇仍存有疑问。有关红豆杉内生菌的研究主要集中于内生真菌,而内生及根际土壤放线菌及其生物活性物质的研究则不够充分,除了紫杉醇以外,这些微生物能否产生一些其它的具有良好生物活性的物质呢?本研究将综合研究红豆杉内生及根际土壤放线菌的多样性,及其抑制植物病原真菌及抗肿瘤活性等生物活性,以评估这一微生物类群的开发潜力。
1 材料和方法 1.1 材料1.1.1 样品采集:本实验所用的样品采集自黄山以及重庆两个城市。健康的南方红豆杉植物样本采集后置于塑料袋中并存放于4 ℃环境下直至使用。南方红豆杉根际土壤采集后室温风干7 d后用于放线菌的分离。
1.1.2 指示植物病原真菌:多主小穴壳(Dothiorella ribis)、葡萄座腔菌(Botryosphaeria dothidea)、可可球二孢菌(Lasiodiplodia theobromae,Lasiodiplodia rubropurpurea,Lasiodiplodia crassispora)、新月弯孢菌(Curvularia lunata)、喙壳孢菌(Ceratocystis adipose)、金黄壳囊孢菌(Cytospora chrysosperma)、荔枝炭疽病菌(Colletotrichum gloeosporioides)、二球壳孢菌(Chaetomium globosum),小麦赤霉菌(Fusarium graminearum)以及苹果轮纹病菌(Botryospuaeria berengeriana)。以上植物病原真菌由江苏农林职业技术学院和江苏师范大学药用植物生物技术重点实验室提供。
1.1.3 肿瘤细胞株:胃癌肿瘤细胞株SGC-7901以及肺癌肿瘤细胞株NCI-H460由江苏师范大学药用植物生物技术重点实验室提供。
1.1.4 培养基:(1)放线菌分离培养基[17]:TWYE、M8、M9、M10、ISP5、HV以及SS (琥珀酸钠0.9 g/L,KNO3 0.5 g/L,MgSO4 0.1 g/L,FeSO4 10 mg/L,琼脂15 g/L,H2O 1 L,pH 7.2)。上述培养基中分别加入50 mg/L的K2Cr2O7,50 mg/L的制霉菌素以及15 mg/L的利福平以抑制革兰氏阴性细菌及真菌的生长。(2)放线菌纯化及保藏培养基:TWYE以及ISP2。(3)放线菌发酵培养基:酵母膏-蛋白胨培养基 (可溶性淀粉7.5 g/L,葡萄糖10.0 g/L,蛋白胨5.0 g/L,酵母提取物 5.0 g/L,NaCl 4.0 g/L,K2HPO4 0.5 g/L,MgSO4·7H2O 0.5 g/L,CaCO3 2 g/L,pH 7.2)。(4)抑菌活性筛选培养基:PDA。(5)肿瘤细胞培养基:RPMI 1640。
1.2 放线菌分离流程植物样本的处理参照Qin[17]的方法并做了一些调整。健康的植物样本首先室温风干48 h,随后将植物样本切成2 cm×2 cm的小块,160 W超声清洗5 min使得植物表面的土壤以及有机物残渣得以去除。吸水纸吸干样本表面的水分,并按下述流程进行表面消毒:首先将植物样本浸泡在5%次氯酸钠中3 min,接着用2.5%的硫代硫酸钠清洗10 min以中和残留的次氯酸钠;随后用75%的乙醇浸泡3 min,接着用无菌水清洗3次以除去乙醇残留;最后将植物样本置于10%浓度的碳酸氢钠溶液中浸泡10 min。表面消毒后的植物样品在无菌环境下干燥后置于80 ℃条件下处理15 min,最后用无菌粉碎机粉碎植物样品,将粉碎的植物样品涂抹到分离培养基表面,28 ℃培养4–8周,分离植物内生放线菌。为了验证表面消毒效果,取200 μL最后一次用于清洗表面消毒样品的无菌水涂布到ISP 2培养基上,28 ℃培养以验证表面消毒效果。根际土壤放线菌的分离采用下述方法进行:分别称取1 g采集的南方红豆杉根际土壤样品,80 ℃烘箱处理1 h。随后向土壤样品中加入9 mL的无菌水,120 r/min振荡1 h,接着160 W超声40 s促进放线菌孢子的释放。随后梯度稀释,取10-3浓度梯度的稀释液100 μL涂布到分离培养基上,28 ℃培养4–8周,分离土壤放线菌。待放线菌长出后,挑取单克隆至TWYE培养基上纯化培养,最后将获得的单克隆转接至ISP2斜面上培养并短期保藏。
1.3 放线菌分离流程(1)形态、培养特征:根据放线菌在ISP 2培养基上的形态学特征以及培养特征进行分类及去重复,并按照国际链霉菌计划推荐的方法对其中的链霉菌进行培养、观察和分类。(2) 16S rRNA基因的PCR扩增与系统发育分析:对其中的一些代表性菌株进行基因组提取以及16S rRNA基因序列测定,基因组提取参照Janso等[9]的方法进行。随后用16S rRNA通用引物27F:5′-AGAGTTTGATC-CTGGCTCAG-3′以及1542R:5′-AAGGAGGTGA-TCCAGCCGCA-3′PCR扩增16S rRNA。PCR扩增条件为:94 ℃ 3 min;随后为30个循环的94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min;最后为72 ℃ 10 min。PCR产物经胶回收后送至上海生工生物工程技术服务有限公司进行测序。测序获得的16S rRNA基因序列利用EzBioCloud (http://www. ezbiocloud.net/)中的EzTaxon在线比对服务进行相关标准菌株的相似性搜索,确定菌株的分类学地位,并调出相关放线菌的16S rRNA基因序列,随后用Clustal X进行序列比对,最终用MEGA 5软件构建系统发育树。
1.4 放线菌的发酵培养及产物提取将4 ℃保藏的放线菌菌株在ISP2培养基上活化后,转接至含有100 mL发酵培养基的500 mL锥形瓶中,28 ℃、180 r/min培养7 d。随后用等体积的乙酸乙酯超声萃取2次,合并有机相,减压蒸馏并用甲醇复溶,室温干燥后用于抗肿瘤活性的研究。
1.5 放线菌抗植物病原真菌活性的研究采用曹艳茹等所述方法[18]研究放线菌抗植物病原真菌活性,统计抑菌活性在4 mm以上的各个放线菌的抑菌结果。
1.6 抗肿瘤活性评估放线菌发酵液初提物的抗肿瘤活性研究采用Alamar blue法[19]并做了一些调整。细胞培养及体外抗肿瘤活性实验参照陈永强等[20]所述方法进行,每个样品重复3次。
1.7 菌株KLBMP 2170的形态特征及生理生化特征根据国际链霉菌计划(ISP)中有关放线菌的培养特征的标准,观察并记录菌株KLBMP 2170在不同培养基上的生长情况。菌株在28 ℃条件下采用埋片法在ISP2培养基上生长14 d后,用扫描电子显微镜(Hitachi S-3400N)观察菌丝特征、孢子形态以及着生方式。生理生化特征按照吴文龙等[21]的方法进行。
2 结果和分析 2.1 植物表面消毒结果评估涂布有200 μL最后一次用于清洗植物表面消毒样品无菌水的ISP 2平板在28 ℃培养2周的平板上没有微生物生长,因而我们可以认为分离得到的为植物内生放线菌,而非外界环境污染的放线菌。
2.2 放线菌的分离鉴定及系统发育分析据估算,迄今为止大约有90%-99%的微生物尚未能够在实验室条件下得以分离鉴定[22],因而选择适当的培养基是分离得到尽可能多的放线菌以及一些未培养的放线菌的关键所在。本研究选择了两种类型的培养基用于放线菌的分离,一类是TWYE、M9、M8,HV以及SS等用于模拟根际土壤以及植物内部营养贫瘠环境的寡营养培养基,以分离那些适合在营养贫瘠条件下生长的放线菌;一类是诸如ISP5以及M10等营养丰富的培养基,能够分离得到一些对营养要求比较高的放线菌。通过选用寡营养以及营养丰富型培养基我们可以尽可能地满足不同放线菌的生长要求,从而分离得到尽可能多的放线菌,为后续的多样性以及生物活性的研究积累大量的菌种资源,有利于我们较为全面地评估他们的多样性以及生物活性。
利用上述7种分离培养基,我们共得到277株放线菌(内生放线菌:KLBMP 2001-2120;根际土壤放线菌:KLBMP 2121-2277),从表1可以看出寡营养培养基M8的分离效率最高,营养丰富型培养基ISP5以及M10也具有较高的分离效率,各种培养基的分离效果为M8>ISP5>HV>M10>TWYE>M9>SS。
表 1. 不同培养基分离效果统计Table 1. Isolation efficiency by different culture media
| Medium | Number of isolates |
| TWYE | 26 |
| M10 | 32 |
| M8 | 88 |
| M9 | 23 |
| ISP5 | 61 |
| HV | 32 |
| SS | 15 |
| Total | 277 |
表选项
在分离得到的放线菌中链霉菌为主要类群,占分离得到放线菌总数的76% (210株),其中109株为内生放线菌,101株为根际土壤放线菌。根据气生菌丝的颜色共可分为10个类群(表2):白孢类群(Albosporus),灰褐类群(Griseofuscus),烬灰类群(Cinereus),黄色类群(Flavus),粉红孢类群(Roseosporus),灰红紫类群(Griseorubroviolaceus),金色类群(Aureus),青色类群(Glaucus),淡紫灰类群(Lavendulae)以及蓝色类群(Cyaneus)。内生链霉菌可分为8个类群,其中灰褐类群、白孢类群和烬灰类群为主要类群;根际土壤链霉菌可分为10个类群,多样性较内生链霉菌要高,白孢类群和烬灰类群是主要的类群。
表 2. 链霉菌的类群统计Table 2. Statistics of the color groups of Streptomyces isolates
| Group | No. of endophytes | No. from rhizospheric soil | Total |
| Albosporus | 28 | 44 | 72 |
| Flavus | 4 | 10 | 14 |
| Roseosporus | 1 | 12 | 13 |
| Lavendulae | 0 | 1 | 1 |
| Glaucus | 1 | 1 | 2 |
| Cinereus | 27 | 17 | 44 |
| Cyaneus | 0 | 1 | 1 |
| Griseorubroviolaceus | 3 | 2 | 5 |
| Griseofuscus | 42 | 12 | 56 |
| Aureus | 3 | 1 | 4 |
| Total | 109 | 101 | 210 |
表选项
通过形态学特征以及分类学特征去重复后,111株放线菌被用于抑制植物病原真菌以及抗肿瘤活性研究。对15株代表性的放线菌进行16S rRNA PCR扩增并测序,测序结果提交至GenBank数据库中(GenBank登录号:JF521442-JF521452、JF521454、JF803742,JF803742以及JN119363)。测序结果显示这些菌株分属于棒杆菌亚目(Corynebacterineae)、链孢囊菌亚目(Streptospor-angineae)、假诺卡氏亚目(Pseudonocardineae)、丙酸杆菌亚目(Propionibacteriales)、微球菌亚目(Micrococcineae)以及链霉菌亚目(Streptomycineae)共计6个亚目;链霉菌科(Streptomycetaceae)、诺卡氏菌科(Nocardiaceae)、链孢囊菌科(Streptospor-angiaceae)、类诺卡氏科(Nocardioidaceae)、丙酸杆菌科(Propionibacteriaceae),假诺卡氏菌科(Pseudonocardiaceae),微杆菌科(Microbacteriaceae)共计7个科;链霉菌属(Streptomyces)、诺卡氏菌属(Nocardia)、野野村氏菌属(Nonomuraea)、韩国生工菌属(Kribbella)、红球菌属(Rhodococcus)、小月菌属(Microlunatus)、 微杆菌属(Microbacterium)以及假诺卡氏菌属(Pseudonocardia) 8个属。其中从红豆杉体内分离得到链霉菌属和诺卡氏菌属2个属的放线菌,从根际土壤中分离得到除了诺卡氏菌属以外的7个属的放线菌。对这些菌株进行16S rRNA基因序列系统发育分析结果(图1)显示,7株放线菌为链霉菌,与GenBank数据库中的标准菌株的相似性在97.8%-100%。来自于植物体内的稀有放线菌KLBMP 2114以及根际土壤稀有放线菌KLBMP 2137、KLBMP2140、KLBMP2143、KLBMP2145、KLBMP2147、KLBMP2151与GenBank数据库中标准菌株Nocardia aobensis (AB126876)、Nonomuraea endophytica (GU367158)、 Microbacterium yannicii (FN547412)、Kribbella hippodromi (EF472955)、Rhodococcus tukisamuensis (AB067734)、Pseudonocardia cypriaca (HQ157191)、Microlunatus parietis (FN556016)相似性最高,分别为99.71%、100%、98.17%、97.58%、99.05%、99.57%、98.86%。
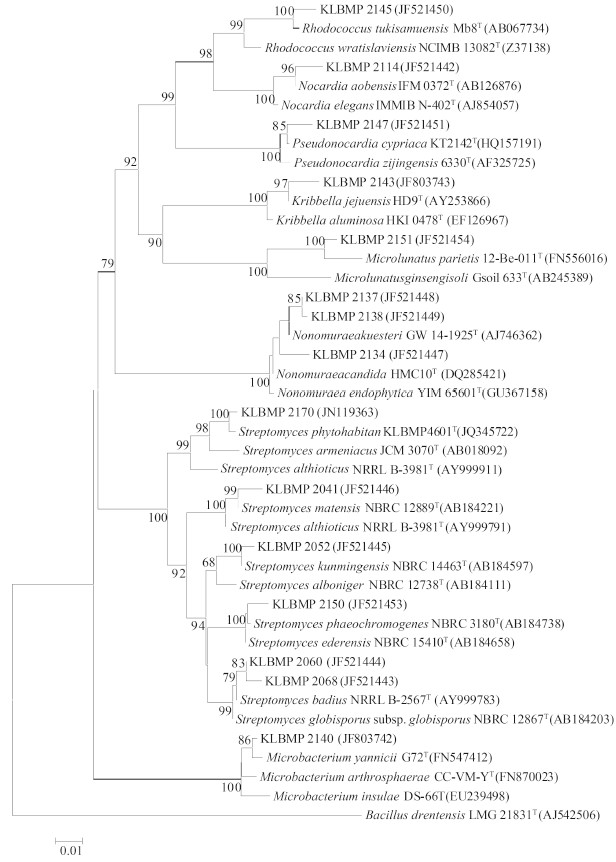 |
| 图 1. 基于16S rRNA基因序列的系统发育树 Figure 1. Phylogenetic Neighbour-Joining tree of the actinomycetes based on the 16S rRNA gene sequences. Numbers on branch nodes are bootstrap values (1000 resamplings). Bar: 1% sequence divergence. |
| 图选项 |
2.3 放线菌抑制植物病原真菌活性的研究对上述111株放线菌对植物病原真菌的抑菌活性进行测定。结果显示(表3),分别有14.4%、13.5%、13.5%、10.8%、9.9%、9.9%、9.9%、9.3%、8.1%、7.2%、5.4%、0.9%的菌株对L. theobromae、B. dothidea、C. chrysosperma、B. berengeriana、D. ribis、C.lunata、C. adipose、C. gloeosporioides、L. crassispora、F. graminearum、C. globosum以及C. adipose具有抑菌活性。内生放线菌KLBMP 2009、KLBMP 2051、KLBMP 2088以及根际土壤放线菌KLBMP 2170、KLBMP 2174、KLBMP 2176 具有较强的抑菌活性,至少对1种病原真菌的抑菌圈半径在15 mm以上。内生放线菌KLBMP 2009、KLBMP 2047、KLBMP 2051以及根际土壤放线菌KLBMP 2170具有广谱的抑菌活性,至少对4种植物病原真菌具有中等的抑菌活性。这些具有高效及广谱抑菌活性的放线菌可作为植物病原真菌潜在的生物防治菌株,这些菌株发挥抑菌活性的生物活性物质及其作用机理有待于进一步地研究。
表 3. 放线菌抑制植物病原真菌结果统计Table 3. The anti-phytopathogenic fungal activity profile of the 35 positive actinomycetes
| Test strains | Inhibition degree against indicator strains a | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 b | |
| KLBMP 2009 | + | +++ | + | - | - | - | + | ++ | ++ | - | ++ | +++ |
| KLBMP 2047 | - | ++ | ++ | - | - | - | ++ | ++ | - | - | + | - |
| KLBMP 2051 | - | ++ | ++ | - | - | - | + | - | - | - | ++ | +++ |
| KLBMP 2062 | - | - | - | - | - | - | - | - | - | - | ++ | + |
| KLBMP 2067 | - | ++ | - | - | - | - | + | + | - | - | - | - |
| KLBMP 2068 | - | + | - | - | - | - | - | + | - | - | - | ++ |
| KLBMP 2079 | - | - | - | + | ++ | - | + | - | ++ | - | - | - |
| KLBMP 2088 | - | + | - | - | - | - | - | + | +++ | - | - | +++ |
| KLBMP 2112 | + | + | + | + | + | - | - | + | ++ | - | - | - |
| KLBMP 2113 | + | + | + | + | + | - | - | + | ++ | + | - | - |
| KLBMP 2124 | + | + | - | - | - | - | - | + | - | + | - | + |
| KLBMP 2133 | - | - | - | - | - | - | + | - | - | - | - | - |
| KLBMP 2143 | - | - | - | - | - | - | - | - | - | - | - | + |
| KLBMP 2147 | - | - | + | - | - | - | - | - | - | - | - | - |
| KLBMP 2153 | + | ++ | - | - | + | - | - | + | - | - | + | ++ |
| KLBMP 2155 | - | - | + | - | - | - | - | - | - | + | - | - |
| KLBMP 2157 | - | + | - | - | - | - | - | - | - | - | - | + |
| KLBMP 2164 | - | - | - | - | + | - | - | - | - | - | - | - |
| KLBMP 2165 | ++ | + | + | ++ | + | - | - | - | - | - | - | - |
| KLBMP 2167 | - | - | - | - | - | - | - | - | + | - | - | - |
| KLBMP 2168 | - | - | - | - | - | - | - | - | + | - | - | - |
| KLBMP 2170 | +++ | - | +++ | ++ | + | + | +++ | +++ | + | - | + | - |
| KLBMP 2172 | ++ | - | + | + | - | - | + | + | - | - | - | - |
| KLBMP 2174 | - | - | +++ | ++ | + | - | - | - | - | - | - | - |
| KLBMP 2175 | + | + | - | + | + | - | - | + | - | + | + | + |
| KLBMP 2176 | - | - | +++ | +++ | + | - | - | - | - | - | - | - |
| KLBMP 2177 | + | - | - | - | - | - | - | - | - | + | - | - |
| KLBMP 2178 | + | ++ | + | + | - | - | - | + | - | + | + | + |
| KLBMP 2181 | - | + | + | - | - | - | - | + | + | - | - | + |
| KLBMP 2186 | - | - | - | + | - | - | + | - | - | - | - | - |
| KLBMP 2189 | - | - | + | - | - | - | - | - | + | - | - | - |
| KLBMP 2190 | - | - | - | - | + | - | - | - | - | - | - | - |
| KLBMP 2194 | - | - | - | - | - | - | - | + | - | - | - | - |
| Total % | 9.9% | 13.5% | 14.4% | 9.9% | 9.9% | 0.9% | 8.1% | 13.5% | 9.0% | 5.4% | 7.2% | 10.8% |
| a: Symbols of inhibition degree against indicator strains: (+) zone of inhibition ranged between 4 and 7 mm, (++) zone of inhibition 8 to 15 mm, (+++) zone of inhibition greater than 15 mm, (-) no inhibition. b: Antifungal activities were tested against D. ribis (1), B. dothidea (2), L. theobromae (3), L. rubropurpurea (4), C.lunata (5), C. adipose (6), L. crassispora (7), C. chrysosperma (8), C. gloeosporioides (9), C. globosum (10), F. graminearum (11), B. berengeriana (12). | ||||||||||||
表选项
2.4 抗肿瘤活性研究111株放线菌按上述发酵及产物提取方法进行发酵及萃取后,在终浓度为50 μg/mL条件下采用Alamar blue法对两株肿瘤细胞株SGC-7901和NCI-H460进行抗肿瘤活性研究。对其中肿瘤增殖抑制率大于40%的菌株进行了统计(表4),结果显示分别有44.1% (49)以及33.3% (37)的菌株对肿瘤细胞株SGC-7901以及NCI-H460的抑制率在40%以上,其中内生放线菌占抗肿瘤活性菌株总数的44.4%,根际土壤放线菌占总数的55.6%。分别有18株以及22株放线菌对肿瘤细胞株SGC-7901和NCI-H460的抑制率在80%以上。其中KLBMP2137为野野村氏菌属菌株,KLBMP 2145为红球菌属菌株,其余的为链霉菌属的菌株。值得注意的是,与紫杉醇相比,分离自根际土壤的菌株KLBMP 2170显示了更强的抗肿瘤活性。紫杉醇及KLBMP 2170发酵液初提物对SGC7901的IC50分别为1.2 ng/mL和0.79 μg/mL;对NCI-H460的IC50分别为16.3 ng/mL以及4.1 ng/mL。这说明菌株KLBMP 2170可能合成一些具有良好抗肿瘤活性的化合物,具有进一步的开发价值。这些结果显示南方红豆杉内生及根际土壤放线菌是一个很好的抗肿瘤活性化合物筛选对象。与此同时,我们发现一些菌株对不同的细胞株具有不同的抗肿瘤活性,如菌株KLBMP 2093对SGC-7901的抑制率为80.79%,而对NCI-H460的抑制率仅为40.12%;菌株KLBMP 2133和KLBMP 2152 对NCI-H460的抑制率分别为87.81%和85.85%,而对SGC-7901的抑制率则为 65.00%和59.8%,这可能是不同的抗肿瘤机制所导致,因而我们推测这些菌株可能合成多种化合物通过不同的作用机制发挥抗肿瘤活性。
表 4. 发酵液粗提物对肿瘤细胞株SGC-7901以及NCI-H460的抗肿瘤活性统计Table 4. Antitumor activity of crude extracts of the isolated actinomycetes against cell lines SGC-7901 and NCI-H460
| IE a (50 μg/mL) | No. b | SGC-7901 | No. b | NCI-H460 |
| Strains (KLBMP) | Strains (KLBMP) | |||
| *** | 18 | 2030, 2044, 2062, 2068, 2080, 2087 c , 2093, 2101, 2112, 2113, 2137, 2145,2164, 2170, 2185, 2188, 2189, 2195 | 22 | 2030, 2044, 2062, 2068, 2080, 2087, 2101, 2112, 2113, 2128, 2133, 2137,2145, 2152, 2158, 2164, 2167, 2170,2185, 2188, 2189, 2195 |
| ** | 9 | 2002, 2034, 2036, 2097, 2128, 2158,2165, 2167, 2172 | 5 | 2043, 2053, 2159, 2172, 2187 |
| * | 22 | 2006, 2011, 2014, 2053, 2084, 2096,2133, 2134, 2135, 2139, 2144, 2152,2153, 2159, 2162, 2166, 2174, 2177,2178, 2184, 2187, 2193 | 10 | 2002, 2006, 2041, 2055, 2072, 2093,2124, 2153, 2165, 2178 |
| Total (%) | 49 (44.1%) | 37 (33.3%) | ||
| a: IE (Inhibitory efficiency): The cytotoxic activity is expressed by the inhibition rate, inhibition rate small than 40% are not shown in this paper: * 40% < inhibition rate < 60%; ** 60% < inhibition rate < 80%; *** 80% < inhibition rate < 100%. b: The total number of strains. c: Bold font represents the endophytic actinomycetes. | ||||
表选项
2.5 菌株KLBMP 2170的形态特征、培养特征及生理生化特征菌株KLBMP 2170在ISP 2、ISP 3以及NA培养基上生长良好,在PDA、查氏、ISP 4以及ISP 5培养基上中等生长,在ISP 4培养基上能够产生粉红色可溶性色素。气生菌丝呈白色至粉红色,基内菌丝灰黄色至粉红色(表5)。显微形态特征显示(图2)气生菌丝呈弧状或螺旋状,成串株状孢子链;孢子表面光滑无刺,基内菌丝多分支、不断裂,为典型的链霉菌属放线菌。
表 5. 菌株KLBMP 2170的培养特征Table 5. Cultural characteristics of strain KLBMP 2170
| Agar mediums | Growth | Colour of mycelium | Soluble pigment | |
| Aerial | Substrate | |||
| ISP 2 | Good | Yellowish white | Light orange | - |
| ISP 3 | Good | Vivid pink | Grayish greenish yellow | - |
| ISP 4 | Moderate | Grayish yellow | Light yellowish pink | Pink |
| ISP 5 | Moderate | White | Vivid pink | - |
| NA | Good | White | Pale orange yellow | - |
| PDA | Moderate | White | Yellowish gray | - |
| Czapek’s | Moderate | Pale yellowish green | Yellow white | - |
表选项
 |
| 图 2. KLBMP 2170在ISP 2培养基上培养2周后的扫描电镜图片 Figure 2. Scanning electron micrograph of strain KLBMP 2170 grown on ISP 2 medium for 14 days at 28 °C. Bar, 10 μm. |
| 图选项 |
表 6. 菌株KLBMP 2170的生理生化特征Table 6. Physiological and biochemical properties of strain KLBMP 2170
| Reaction item | Results | Reaction item | Results |
| D-Arabinose | + | Mannitol | + |
| D-Raffinose | + | Cysteine | - |
| L-rhamnose | + | Lactamine | - |
| Dextrin | - | Hypoxanthine | + |
| D-sorbitol | + | Glycine | - |
| Trehalose | - | Valine | - |
| Xylose | + | Arginine | + |
| D-Cellobiose | + | β-N-acetyl-glucosaminidase | + |
| Xylitol | - | β-glucosidase | + |
| Sucrose | + | α-galactosidase | + |
| Glucose | + | β-galactosidase | + |
| Maltose | + | β-glucosidase | + |
| Urea | + | Esculoside | + |
| Gelatin | + | Starch | + |
表选项
菌株KLBMP 2170能够液化明胶、水解淀粉;能够利用尿素、精氨酸、七叶苷等氮源,能够利用葡萄糖、蔗糖、麦芽糖、木糖等碳源,具有β-N-乙酰氨基葡萄糖苷酶、α-半乳糖苷酶、β葡糖苷酶等酶活,但不能够利用糊精、海藻糖、木糖醇、半胱氨酸、丙氨酸、甘氨酸、缬氨酸生长。
3 讨论放线菌是生物活性物质的一个重要来源,据统计约40%的具有生物活性微生物天然产物以及约70%的临床用抗生素如多烯大环内酯类抗生素、蒽环类抗生素、聚醚类抗生素、氨基糖苷类抗生素等是由放线菌产生的[23, 24]。药用植物内生放线菌及其根际土壤放线菌是生物活性物质的重要来源,迄今为止已从其中分离得到多种具有抑菌抗肿瘤活性的放线菌。红豆杉是一类非常重要的药用植物资源,而对药用植物南方红豆杉内生及根际土壤放线菌的多样性及生物活性的系统研究还相对较少,因而对其开展研究显得尤为重要。
为了尽可能地满足不同放线菌的生长要求,本研究选用了寡营养型以及营养丰富型共计8种分离培养基,从南方红豆杉体内及根际土壤中分离得到了277株放线菌,经去重复后剩余111株。为后续的多样性以及生物活性的研究积累大量的菌种资源,有利于我们较为全面地评估他们的多样性以及生物活性。
根据气生菌丝的颜色对内生及根际土壤链霉菌进行分类统计,其中内生链霉菌可分为8个类群,根际土壤链霉菌可分为10个类群。对15株代表性菌株的16S rRNA基因测序研究结果显示他们分属于6个亚目、7个科、8个属,显示了南方红豆杉内生及其根际土壤放线菌的高度生物多样性。
本研究所涉及的111株放线菌中,有29.7% (33)的菌株至少对1种病原真菌具有抑菌活性。其中30%的为内生放线菌,70%的为根际土壤放线菌。在具有抑菌活性的放线菌中,仅有两株稀有放线菌KLBMP 2143 (Kribbella)、KLBMP 2147 (Pseudonocardia)对部分植物病原真菌呈现微弱的抑菌活性,这与Tanaka等[25]报道的大部分生物防治菌株为链霉菌相一致。对抑菌结果进一步分析发现,对C. globosum以及C. adipose有抑菌活性的菌株仅为5.4%和0.9%,筛选到的阳性菌株的抑菌活性也较弱。而据报道,药用植物内生放线菌以及根际土壤放线菌具有显著的抑菌活性,这其中主要原因可能为本研究所用的发酵培养基并不能够提供足够的营养及合适的环境使得所有的放线菌发酵产生有生物活性的产物[9],导致一些具有生物活性的化合物的生物合成途径沉默。因而虽然70.3%的放线菌在本研究中没有抑菌活性,它们可能仍存在着一些抑菌的潜力有待于我们进一步去挖掘。
抗肿瘤活性筛选方面,48.6% (54)的菌株至少对一种肿瘤细胞株的抑制率在40%以上。其中值得关注的是,野野村氏菌属菌株KLBMP 2137和红球菌属菌株KLBMP 2145为稀有放线菌。据报道,Miyanaga等[26]从Nonomuraea pusilla TP-A0861中分离得到具有抗肿瘤活性的Myxochelin A,Natsuhara等[27]从Rhodococcus terrae 70012 (Rt. GM-2)中分离得到具有抗肿瘤活性的mycoloyl glycolipid (Rt. GM-2) 。在大量链霉菌属放线菌被研究以及大量生物活性物质被重复发现的当下,尚未被深入研究的蕴藏着新的生物活性物质的稀有放线菌尤为值得我们去注意。能同时产生具有广谱高效抑菌活性以及高效抗肿瘤活性化合物的菌株KLBMP 2170与菌株 Streptomyces phytohabitan (JQ345722)具有高度的相似性(99.43%)。可能蕴藏着一些新的具有生物活性潜力的化合物,是研究抑制植物病原真菌以及抗肿瘤活性很好的资源,具有开发成抑菌剂以及抗肿瘤药物的潜力。
综上所述,我们可以看出南方红豆体内及根际土壤中蕴藏着种类丰富的放线菌资源,对多种植物病原真菌以及肺癌、胃癌细胞株具有良好的生物活性,是生物活性物质的重要来源。与南方红豆杉内生放线菌相比,根际土壤放线菌的多样性更为丰富,生物活性菌株的比例要高。菌株KLBMP 2170的生物活性物质值得我们去分离鉴定,其发挥生物活性功能的机理也将是我们今后要解决的一个问题。
致谢感谢江苏农林职业技术学院赵桂华教授为本实验提供植物病原真菌。
参考文献
| [1] | Tian XP, Zhang S, Li WJ. Advance in marine actinobacterial research-a review. Acta Microbiologica Sinica, 2011, 51(2): 161-169. (in Chinese)田新朋, 张偲, 李文均. 海洋放线菌研究进展. 微生物学报, 2011, 51(2): 161-169. |
| [2] | Hong K. Actinomycetes from mangrove and their secondary metabolites. Acta Microbiologica Sinica, 2013, 53(11): 1131-1141. (in Chinese)洪葵. 红树林放线菌及其天然产物研究进展. 微生物学报, 2013, 53(11): 1131-1141. |
| [3] | Khamna S, Yokota A, Lumyong S. Actinomycetes isolated from medicinal plant rhizosphere soils: diversity and screening of antifungal compounds, indole-3-acetic acid and siderophore production. World Journal of Microbiology and Biotechnology, 2009, 25(4): 649-655. |
| [4] | Trejo-Estrada SR, Rivas Sepulveda I, Crawford DL. In vitro and in vivo antagonism of Taxus chinensis violaceusniger YCED9 against fungal pathogens of turfgrass. World Journal of Microbiology and Biotechnology, 1998, 14(6): 865-872. |
| [5] | Xiao W, Li MG, Cui XL, Li YQ, Wen ML, Liu H W, Chen Y G, Peng Q. Some approaches for the selective isolation of rare actinomycetes. Microbiology, 2006, 33(1): 133-137. (in Chinese)肖炜, 李铭刚, 崔晓龙, 李一青, 文孟良, 刘宏伟, 陈义光, 彭谦. 几种选择性分离稀有放线菌的方法. 微生物学通报, 2006, 33(1): 133-137. |
| [6] | Cragg GM, Newman DJ. Natural product drug discovery in the next millennium. Pharmaceutical Biology, 2001, 39(S1): 8-17. |
| [7] | Qin S, Xing K, Jiang JH, Xu LH, Li WJ. Biodiversity, bioactive natural products and biotechnological potential of plant-associated endophytic actinobacteria. Applied Microbiology and Biotechnology, 2011, 89(3): 457-473. |
| [8] | Hallmann J, Quadt-Hallmann A, Mahaffee WF, Kloepper, JW. Bacterial endophytes in agricultural crops. Canadian Journal of Microbiology, 1997, 43(10): 895-914. |
| [9] | Janso JE, Carter GT. Biosynthetic potential of phylogenetically unique endophytic actinomycetes from tropical plants. Applied and Environmental Microbiology, 2010, 76(13): 4377-4386. |
| [10] | Passari AK, Mishra VK, Saikia R, Gupta VK, Singh BP. Isolation, abundance and phylogenetic affiliation of endophytic actinomycetes associated with medicinal plants and screening for their in vitro antimicrobial biosynthetic potential. Frontiers in Microbiology, 2015, 6: 273, doi: 10.3389/fmicb.2015.00273. |
| [11] | Castillo UF, Strobel GA, Ford EJ, Hess WM, Porter H, Jensen JB, Albert H, Robison R, Condron MAM, Teplow DB, Stevens D, Yaver D. Munumbicins, wide-spectrum antibiotics produced by Taxus chinensis NRRL 30562, endophytic on Kennedia nigriscans. Microbiology, 2002, 148(9): 2675-2685. |
| [12] | El-Gendy MMA, EL-Bondkly AMA. Production and genetic improvement of a novel antimycotic agent, Saadamycin, against Dermatophytes and other clinical fungi from Endophytic Taxus chinensis sp. Hedaya48. Journal of Industrial Microbiology & Biotechnology, 2010, 37(8): 831-841. |
| [13] | Igarashi Y, Trujillo ME, Martínez-Molina E, Yanase S, Miyanaga S, Obata T, Sakurai H, Saiki I, Fujita T, Furumai T. Antitumor anthraquinones from an endophytic actinomycete Micromonospora lupini sp. nov.. Bioorganic & Medicinal Chemistry Letters, 2007, 17(13): 3702-3705. |
| [14] | Zhou XW, Zhu HF, Liu L, Lin J, Tang KX. A review: recent advances and future prospects of taxol-producing endophytic fungi. Applied Microbiology and Biotechnology, 2010, 86(6): 1707-1717. |
| [15] | Caruso M, Colombo AL, Crespi-Perellino N, Fedeli L, Malyszko J, Pavesi A, Quaroni S, Saracchi M, Ventrella G. Studies on a strain of Kitasatospora sp. paclitaxel producer. Annals of Microbiology, 2000, 50(2): 89-102. |
| [16] | Heinig U, Scholz S, Jennewein S. Getting to the bottom of taxol biosynthesis by fungi. Fungal Diversity, 2013, 60(1): 161-170. |
| [17] | Qin S, Li J, Chen HH, Zhao GZ, Zhu WY, Jiang CL, Xu LH, Li WJ. Isolation, diversity, and antimicrobial activity of rare actinobacteria from medicinal plants of tropical rain forests in Xishuangbanna, China. Applied and Environmental Microbiology, 2009, 75(19): 6176-6186. |
| [18] | Cao YR, Jiang Y, Chen YG, Tang SK, Qin S, Zhao GZ, Xu LH. Diversity of actinomycetes in Wuling Mountain. Acta Microbiologica Sinica, 2008, 48(7): 952-958. (in Chinese)曹艳茹, 姜怡, 陈义光, 唐蜀昆, 秦盛, 赵国振, 徐丽华. 武陵山放线菌多样性. 微生物学报, 2008, 48(7): 952-958. |
| [19] | Hamid R, Rotshteyn Y, Rabadi L, Parikh R, Bullock P. Comparison of Alamar blue and MTT assays for high through-put screening. Toxicology in Vitro, 2004, 18(5): 703-710. |
| [20] | Chen YQ, Chen XH, Sun Y, Miao Q, Wang L, Jiang JH. Comparisons on antioxidant and anti-tumor activity of ethanol extracts from 20 polypores fungi in vitro. Food Science, 2011, 32(5): 27-31. (in Chinese)陈永强, 陈先晖, 孙勇, 缪倩, 王力, 蒋继宏. 20种多孔类真菌乙醇提取物体外抗氧化和抗肿瘤活性的比较研究. 食品科学, 2011, 32(5): 27-31. |
| [21] | Wu WL, Duan SR, Li WJ, Duan RL, Xu LH. Isolation and identification of three actinomycete strains with strong insecticidal activity for armyworm. Acta Microbiologica Sinica, 2004, 44(5): 567-570.吴文龙, 段淑蓉, 李文均, 段若玲, 徐丽华, 姜成林. 三株杀粘虫放线菌的分类鉴定. 微生物学报, 2004, 44(5): 567-570. |
| [22] | Amann RI, Ludwig W, Schleifer KH. Phylogenetic identification and in situ detection of individual microbial cells without cultivation. Microbiological Reviews, 1995, 59(1): 143-169. |
| [23] | Bérdy J. Bioactive microbial metabolites. The Journal of Antibiotics, 2005, 58(1): 1-26. |
| [24] | Bérdy J. Thoughts and facts about antibiotics: where we are now and where we are heading. The Journal of Antibiotics, 2012, 65(8): 385-395. |
| [25] | Tanaka Y, Omura S. Agroactive compounds of microbial origin. Annual Reviews in Microbiology, 1993, 47(1): 57-87. |
| [26] | Miyanaga S, Obata T, Onaka H, Fujita T, Saito N, Sakurai H, Saiki I, Furumai T, Igarashi Y. Absolute configuration and antitumor activity of myxochelin A produced by Nonomuraea pusilla TP-A0861. The Journal of Antibiotics, 2006, 59(11): 698-703. |
| [27] | Natsuhara Y, Yoshinaga J, Shogaki T, Sumi-Nishikawa Y, Kurano S, Kato Y, Kaneda K, Oka S, Yano I. Granuloma-forming activity and antitumor activity of newly isolated mycoloyl glycolipid from Rhodococcus terrae 70012 (Rt. GM-2). Microbiology and Immunology, 1990, 34(1): 45-53. |
