赵秀英, 县怡涵, 李晨博, 王超, 虞德夫, 朱伟云, 杭苏琴


南京农业大学消化道微生物研究室, 江苏 南京 210095
收稿日期:2015-11-07;修回日期:2016-02-28;网络出版日期:2016-03-11
基金项目:农业部公益性行业专项(201403047);饲用微生物国家重点实验室开放课题
*通信作者:杭苏琴, Tel: +86-25-84395037; E-mail: suqinhang69@njau.edu.cn
摘要: [目的]研究断奶前给仔猪饲喂植物乳杆菌和干酪乳杆菌对断奶前、后肠道菌群组成、数量和短链脂肪酸(SCFA)浓度的影响,分析仔猪生长性能与肠道形态、微生物菌群及SCFAs的相关性,探讨测试菌株缓解仔猪断奶应激的可能机制。[方法]选取15窝7 d龄杜长大仔猪,随机分为3组,分别灌喂2 mL去离子水(对照组)、0.5×109 CFU/mL植物乳杆菌(LP组)或干酪乳杆菌(LC组)的菌液,每组以窝为单位5个重复,于21 d (断奶)、24 d和35 d屠宰,采集回肠和结肠食糜,分析菌群组成和数量的变化,测定SCFAs浓度。[结果]测试菌株均能显著提高断奶2周后回肠、结肠菌群多样性(P < 0.05),促进乳酸杆菌和双歧杆菌增殖;显著促进断奶前回肠和结肠中乙酸、丙酸、丁酸和总SCFA生成,促进断奶后乙酸和总SCFA产生;相关分析显示,测试菌株组仔猪腹泻率下降与SCFAs浓度上升、回肠绒毛高度增加和总菌数量上升显著相关,日增重提高与结肠乙酸和TSCFA浓度增加显著相关。[结论]测试菌株促进乳酸杆菌、双歧杆菌等有益菌增殖,增加肠道菌群多样性,促进肠道SCFAs生成。
关键词: 植物乳杆菌 干酪乳杆菌 断奶仔猪 肠道微生物 短链脂肪酸 乳酸杆菌
Feeding Lactobacillus plantarum and Lactobacillus casei increased microbial diversity and short chain fatty acids production in the gut-intestinal tract of weaning piglets
Xiuying Zhao, Yihan Xian, Chenbo Li, Chao Wang, Defu Yu, Weiyun Zhu, Suqin Hang


Laboratory of Gastrointestinal Microbiology, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China
Received 07 November 2015; Revised 28 February 2016; Published online 11 March 2016
*Corresponding author: Suqin Hang, Tel: +86-25-84395037; E-mail: suqinhang69@njau.edu.cn
Supported by the Special Fund for Agro-Scientific Research in the Public Interest (201403047) and by the Open Project of State Key Laboratory of Direct-Fed Microbial Engineering
Abstract: [Objective]The objective of the study was to study the effects of Lactobacillus plantarum and Lactobacillus casei on the changes in composition and quantity of microbial populations and the concentrations of short chain fatty acids in the gut digesta of piglets before and after weaning, to explore the mechanisms of the tested two strains to relieve weaning stress.[Methods]Fifteen litters of piglets (Duroc×Yorkshire×Landrace) at the age of 7 days were randomly allocated to 3 groups (5 each), including the control group with an oral administration of saline, LP group with L. plantarum and and LC group, with L. casei. On day 21, 24 and 35, the piglets were slaughtered, and the ileum and colon digesta were analyzed for microbial populations and short chain fatty acids.[Results]In the ileum and colon, the test strains significantly increased the microbial diversity (P < 0.05), promoted the growth of Lactobacilli spp. and Bifidobacteria spp. after 2 weeks of post-weaning. The two test strains increased the concentration of acetate, propionate, butyrate and total short chain fatty acids both in ileum and colon before weaning, and the concentration of acetate, total short chain fatty acids after weaning. Correlation analysis showed that the decreased diarrhea rate before weaning in the LP and LC groups was significant associated with the increased short chain fatty acids concentration and total bacteria of ileum and colon, the increased height of the ileum villi. The improved average daily gain presented a correlation with the increased concentration of acetate and total short chain fatty acids of colon.[Conclusion]The findings imply that the tested strains are contribute to increase the microbial diversity, the quantities of beneficial bacteria and the production of short chain fatty acids in the gut intestinal tract of weaning piglets.
Key words: Lactobacillus plantarum Lactobacillus casei weaning piglets, intestinal microbiota short chain fatty acid Lactobacillus spp.
断奶时仔猪因为离母、转群和饲料转换常出现生长缓慢,体重下降、腹泻,严重时致死等应激症状[1],抗生素在预防和缓解断奶应激、促进仔猪生长等方面发挥了巨大作用[2],但由于药残、耐药性等问题而不得不寻找其替代品[3]。乳酸杆菌(Lactobacillus spp.)和双歧杆菌(Bifidobacteria spp.)等产乳酸菌[4-5]等益生菌因能促进肠道有益菌增殖,促进乳酸和短链脂肪酸(Short chain fatty acids, SCFAs)生成,改善肠道微生态环境,增进宿主健康等被广泛用作缓解仔猪断奶应激的抗生素替代品[6]。Suo等报道,断奶仔猪饲喂植物乳杆菌(Lactobacillus plantarum)60 d后,日增重、小肠绒毛高度显著增加,料重比和腹泻率显著下降[6];Guerra-Ordaz等报道,断奶仔猪饲喂植物乳杆菌10 d后,回肠、结肠乳酸杆菌数量显著增加,腹泻率显著下降[7];刘虎传等给断奶仔猪饲喂乳酸杆菌后,肠道绒毛高度增加、隐窝深度降低,SCFAs生成增多,腹泻率降低,仔猪断奶应激得到缓解[8]。综上所述,乳酸杆菌制剂对缓解仔猪断奶应激发挥了一定作用,但其机制和效果不尽相同。Nagpal等指出,益生菌存在属、种及菌株差异性,不同菌株特性不同,分泌产物也不同,因而对每个潜在益生菌株都有必要进行深入研究[9]。为此,本研究通过给断奶前仔猪灌喂植物乳杆菌和干酪乳杆菌,研究其对断奶前、后仔猪回肠和结肠菌群组成和数量及微生物代谢产物SCFAs的影响,结合笔者前期研究结果[10]分析仔猪生长性能与肠道形态、微生物菌群及SCFAs的相关性,揭示测试菌株对肠道微生物菌群和环境的可能调控作用及机制,分析其作为益生菌的潜力,为测试菌株的开发和应用提供依据。
1 材料和方法 1.1 试验动物、试验日粮与试验设计 从江苏省某猪场选择出生日期相近、同一品种(杜×大×长)的15窝7日龄仔猪,随机分为生理盐水组(对照组),植物乳杆菌(Lactobacillus plantarum)组(LP组)和干酪乳杆菌(Lactobacillus casei)组(LC组),以窝为单位每组5个重复,仔猪基础日粮组成及营养水平见表 1。灌喂时将测试菌株的冻干粉用去离子水配成0.5×109 CFU/mL的菌液,分别于7、9、11、13、19、21和24 d龄清晨每头仔猪灌喂2 mL,对照组同时灌喂2 mL生理盐水,每天1次,试验从仔猪7日龄开始至35日龄结束,21日龄断奶。试验期间仔猪自由采食,每天饲喂2次,自动饮水器供水,仔猪免疫及消毒程序等饲养管理按猪场常规进行。测试菌株(植物乳杆菌和干酪乳杆菌)均分离自自然发酵的马奶样品,除对菌株进行常规生理、生化鉴定外,还对其产酸、耐酸、耐胆盐、抑菌、肠上皮细胞粘附、人工胃液存活率和耐受性及耐高温等特性进行了测试(北京大北农科技集团股份有限公司)。
表 1. 基础日粮组成和营养水平(饲喂基础,%) Table 1. Composition and nutrient level of the basal diet (as-fed basis, %)
| Ingredients | Content | Nutrient level△ | Content | ||
| Corn | 61.80 | Digestible energy (MJ/kg) | 13.82 | ||
| Soybean meal | 16.00 | Crude protein | 19.96 | ||
| Fermented soybean meal | 6.30 | Calcium | 0.78 | ||
| Whey powder | 5.00 | Phosphorus | 0.58 | ||
| Soybean oil | 3.00 | L-lysine | 1.36 | ||
| Fish meal | 4.00 | DL-methionine | 0.43 | ||
| Zeolite powder | 0.90 | L-threonine | 0.90 | ||
| Ca(HCO3) 2 | 1.20 | ||||
| CaCO3 | 0.60 | ||||
| Premix # | 1.20 | ||||
| #: the premix provided as the total ration per kilo: VD3 386 IU, VA 3086 IU, VE 15.4 IU, VK3 2.3 mg, VB2 3.9 mg, D-calcium pantothenate 15.4 mg, nicotinic acid 23 mg, choline 500 mg, VB12 0.016 mg; Cu (Gly-Cu, 21%) 17 mg, Fe (Gly-Fe 14%) 133 mg, Zn (Met-Zn 17.5%) 133 mg, Mn (Gly-Mn 22%) 33.3 mg, I (Ca(IO3)2) 0.83 mg, choline chloride (50%) 1000 mg, anti-mildew agent 500 mg, antioxidant 200 mg, sweetener 400 mg, flavor 600 mg, salt 1.3 g, propanoic acid 2 g, lysine·HCl 2.7 g, methionine 660 mg, threonine 440 mg. △: nutrient level was calculated values. | |||||
表选项
1.2 样品采集 于仔猪的21、24、35 d,每组每个重复随机选择1头仔猪屠宰,剖开腹腔后,取出整个消化道,分离、结扎肠道各部位,迅速取出回肠和结肠全部食糜,分别置于样品袋中,均匀混合后,每头仔猪取部分回、结肠食糜样品于-20℃保存,用于DNA提取。
1.3 食糜中总细菌DNA的提取和16S rRNA基因片段的扩增 珠磨法提取肠道内容物总DNA[11]。称取0.3 g解冻后的食糜样品,加入2 mL 0.1 mol/L磷酸盐缓冲液(每升中含8.0 g NaCl,0.1998 g KCl,0.2 g KH2PO4和2.9 g Na2HPO4,最终pH为7.4)涡旋混匀、离心(12000×g、5 min)清洗样品2-3次,沉淀中加入1 mL CTAB液,混匀后转移至含0.3 g灭菌的锆珠管中,珠磨仪(Biospec,美国)机械破碎细胞,酚-氯仿抽提法提取食糜中细菌总DNA。以提取的DNA为模版,用引物U968-GC和L1401对细菌16S rRNA基因序列的V6-V8区进行PCR扩增,引物序列、反应体系和程序参照Nübel等[12]进行,扩增产物用1.2%(W/V)的琼脂糖凝胶电泳检测。
1.4 变性梯度凝胶电泳及图谱分析 用8%聚丙烯酰胺凝胶(其中丙烯酰胺与二丙烯酰胺比例为37.5:1.0),尿素浓度梯度为35%-50%进行PCR产物的变性梯度凝胶电泳(Denature gradient gel electrophoresis,DGGE)(Dcode DGGE系统,Bio-Rad),先于200 V电压下电泳10 min,再于85 V电泳12-16 h,结束后取出凝胶进行硝酸银染色,GS-800灰度扫描仪对显色定影后的凝胶扫描。分子分析软件包(Molecular analyst,Bio-Rad)分析DGGE图谱的多样性,计算公式为:Pi=ni/H,其中Pi:某一种菌(DGGE图谱中一条带)在整个样品中的优势概率,ni:密度曲线上某一谱带的峰高,H:所有峰高的和[13-14]。
1.5 短链脂肪酸(Short chain fatty acids)的测定 取食糜0.5 g于0.5 mL生理盐水中,混匀后取0.4 mL上清,按5:1的比例与25%(W/V)偏磷酸巴豆酸混合(巴豆酸作为内标),-20℃保存过夜。解冻后12000×g离心5 min,取1 L上清于GC-14B型气相色谱仪(日本,岛津)测定[15]。
1.6 微生物菌群数量的分析 采用荧光实时定量PCR技术对回肠和结肠食糜中总细菌(Total bacteria)、乳酸杆菌(Lactobacillus spp.)、双歧杆菌(Bifidobacteria spp.)和大肠杆菌(E.coli)数量进行分析。总细菌和乳酸杆菌菌群的扩增引物、反应条件和程序参照Su等[16]进行,双歧杆菌菌群的扩增引物、反应条件和程序根据Walker等[17]进行,大肠杆菌菌群的扩增引物、反应条件和程序参照Khafipour等[18]进行。
1.7 仔猪生长性能与肠道形态、肠道SCFAs生成与微生物菌群相关分析 于试验开始当天(7 d)、21、35 d分别对仔猪称重,计算仔猪断奶前(7-21 d)、后(21-35 d)平均日增重(Average daily gain,ADG)、腹泻率;于21 d和35 d屠宰时采集空、回肠组织,经固定、石蜡包埋、常规HE染色后测定肠绒毛高度、隐窝深度[10];GaphPad Prism 5分析仔猪日增重、腹泻率与肠绒毛高度、肠道SCFAs浓度与微生物菌群的相关性。
1.8 统计分析 菌群定量分析和SCFAs浓度数据用Excel初步处理后,用SPSS 16.0软件中的单因素方差(One-way ANOVA)模型分析,Tukey test比较差异显著性,P < 0.05为差异显著。
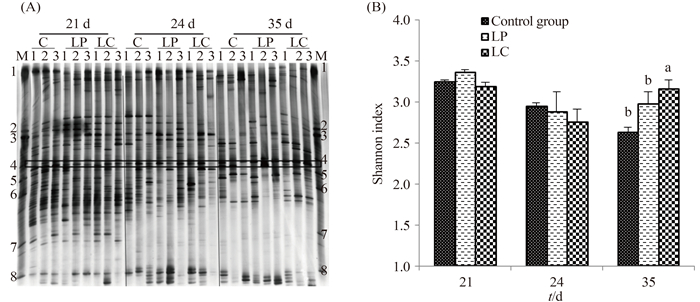
2 结果和分析 2.1 仔猪回肠食糜菌群DGGE图谱及菌群分析 由图 1-A可见,断奶前条带分布在图谱中上部,断奶后条带多集中于中部,说明断奶前、后仔猪回肠食糜菌群发生了较大变化;不同组的仔猪有共同泳带(图中方框所示),但多数泳带位置及图谱总带数有明显差异,说明仔猪回肠食糜既存在共有菌群,也存在特异菌群。图 1-B为图谱菌群多样性分析结果,发现仔猪断奶前(21 d)LP组菌群多样性显著高于对照组和LC组(P < 0.05),LC组与对照组无明显差异,说明LP可提高回肠菌群多样性,饲喂LC效果不明显;断奶后3 d(24 d)与断奶前比较,3组菌群多样性都有所下降,说明断奶影响菌群多样性,但此时LP组菌群多样性仍高于对照组和LC组(P < 0.05),LC组与对照组无差异,说明LP能缓解断奶对菌群的影响,LC作用不明显;断奶后2周(35 d)3组菌群多样性都比断奶后3 d有所升高,LP组菌群多样性显著高于对照组和LC组(P < 0.05),LC组与对照组差异不显著,说明断奶后2周内肠道菌群能自行恢复,LP组菌群恢复能力强于对照组和LC组。
 |
| 图 1. 仔猪断奶前、后回肠食糜总细菌菌群DGGE图谱(A)及多样性分析(B) Figure 1. DGGE profiles (A) and diversity index (B) of bacterial community from the ileum contents of piglets before and after weaning. C: control group; LP: Lactobacillus plantarum treatment; LC: Lactobacillus casei treatment; 1, 2, 3: 3 replicates; M: Marker, known bacteria. |
| 图选项 |
2.2 仔猪结肠食糜菌群DGGE图谱及菌群分析 与回肠相比,结肠食糜DGGE带谱更为复杂(图 2-A),虽然所有仔猪存在共同泳带(图中方框所示),但是3个日龄的结肠食糜DGGE图谱存在明显不同,与断奶前相比,断奶后许多优势条带消失,如Marker 2和7所对应条带在24 d和35 d几乎所有样品中均不存在,Marker 1和3所对应条带在35 d的样品中消失,Marker 4上部和下部许多其它条带也在断奶后消失。整体来看,断奶前样品条带数明显多于断奶后,断奶后2周样品条带数又少于断奶3 d,说明断奶显著影响结肠食糜微生物菌群数量,断奶后结肠菌群复杂性低于断奶前。处理组之间比较发现,断奶前所有仔猪图谱非常相似,断奶后3 d对照组和LP组图谱较为复杂,断奶后两周LP组与LC组图谱比对照组复杂。多样性结果显示(图 2-B),断奶后结肠食糜菌群多样性比断奶前下降,断奶影响结肠菌群复杂性;3组之间比较,断奶前3组菌群多样性无明显差别,断奶后3 d LC组菌群多样性低于对照组和LP组(P > 0.05),断奶两周后LP和LC组菌群多样性显著高于对照组(P < 0.05),说明测试菌株有助于菌群恢复。
 |
| 图 2. 仔猪断奶前、后结肠食糜总细菌菌群DGGE图谱(A)及多样性分析(B) Figure 2. DGGE profiles(A) and diversity index(B) of bacterial community from the colon contents of piglets before and after weaning. C: control group; LP: Lactobacillus plantarum treatment; LC: Lactobacillus casei treatment; 1, 2, 3: 3 replicates; M: known bacteria. |
| 图选项 |
2.3 乳酸杆菌对仔猪回、结肠SCFAs浓度的影响 由表 2,饲喂LP和LC后,回肠食糜中丙酸、丁酸和总SCFAs浓度(TSCFAs)均显著高于对照组(P < 0.05),LC组乙酸和总SCFAs显著高于LP组(P < 0.05);在结肠食糜中,2个试验组乙酸、丙酸、丁酸和总SCFAs浓度也显著高于对照组(P < 0.05),说明哺乳期仔猪饲喂乳酸杆菌对肠道各SCFAs的产生有促进作用。断奶后3 d LP和LC组回肠食糜中乙酸和总SCFAs浓度明显高于对照组(P < 0.05),丙酸和丁酸浓度3组间差异不显著;在结肠食糜中,LP和LC组乙酸浓度显著高于对照组(P < 0.05),丙酸、丁酸和总SCFAs浓度3组间差异不显著,说明LP和LC主要通过促进乙酸生成提高总SCFAs浓度;断奶后两周回肠食糜中各SCFA与总SCFAs浓度3组间差异均不显著(P > 0.05),LP和LC组结肠食糜乙酸和总SCFAs浓度显著高于对照组(P < 0.05),丙酸和丁酸浓度3组间差异不显著(P > 0.05),说明随着时间的推移和测试菌株的停止饲喂,其对回肠SCFA产生能力的影响在逐渐减小,但对结肠乙酸产生和提高总SCFAs浓度仍有促进作用。
表 2. 植物乳杆菌和干酪乳杆菌对肠道食糜SCFAs浓度的影响(mmol/L) Table 2. Effects of Lactobacillus plantarum and Lactobacillus casei on SCFAs concentration in the gut digesta (mmol/L)
| Age/d | Groups | Ileum | Colon | |||||||
| Acetate | Propionate | Butyrate | Total SCFAs | Acetate | Propionate | Butyrate | Total SCFAs | |||
| 21 | Control group | 2.30 b | 0.41 b | 0.17 b | 2.98 c | 9.03 b | 2.81 c | 2.52 b | 15.87 c | |
| LP treatment | 2.79 b | 1.04 a | 0.40 a | 3.95 b | 12.54 ab | 3.97 b | 4.37 a | 21.18 b | ||
| LC treatment | 3.88 a | 1.04 a | 0.50 a | 5.51 a | 16.62 a | 5.41 a | 4.08 a | 26.56 a | ||
| SEM | 0.56 | 0.11 | 0.05 | 0.38 | 2.22 | 1.09 | 1.31 | 3.68 | ||
| 24 | Control group | 2.54 b | 0.43 | 0.18 | 3.99 b | 13.97 b | 5.51 | 3.02 | 22.41 | |
| LP treatment | 3.26 ab | 0.42 | 0.35 | 5.17 ab | 16.56 ab | 5.67 | 4.21 | 24.14 | ||
| LC treatment | 4.03 a | 0.75 | 0.36 | 6.09 a | 17.22 a | 5.77 | 3.85 | 26.48 | ||
| SEM | 0.26 | 0.13 | 0.11 | 0.13 | 0.62 | 1.24 | 1.31 | 3.14 | ||
| 35 | Control group | 4.65 | 1.34 | 0.37 | 6.89 | 23.23 b | 8.31 | 5.93 | 33.70 b | |
| LP treatment | 5.29 | 1.36 | 0.69 | 6.44 | 30.45 a | 9.33 | 6.81 | 43.58 a | ||
| LC treatment | 5.51 | 1.52 | 0.58 | 6.71 | 31.90 a | 8.33 | 6.34 | 43.15 a | ||
| SEM | 0.24 | 0.11 | 0.06 | 0.37 | 1.48 | 0.46 | 1.20 | 3.65 | ||
| a, b means within different treatments having a different superscript letter differ significantly (P < 0.05). | ||||||||||
表选项
2.4 LP和LC对肠道菌群数量的影响 由表 3,断奶前连续饲喂LP和LC不影响断奶前、后回肠和结肠总菌数量(P > 0.05),但显著提高了断奶前肠道乳酸杆菌和双歧杆菌数,LC显著降低了回肠大肠杆菌数;断奶后3 d,LP和LC组回肠和结肠乳酸杆菌数均显著高于对照组(P < 0.05),LC组结肠双歧杆菌数显著高于对照组和LP组,3组之间回肠和结肠大肠杆菌数无明显差异;而断奶后3 d总细菌、乳酸杆菌和双歧杆菌等数量比断奶前都有所下降,大肠杆菌数上升,说明断奶影响了肠道菌群数量,造成有益菌下降,病原菌上升,这可能是造成断奶应激的原因。断奶2周后3组总细菌、乳酸杆菌和双歧杆菌数上升,基本恢复至断奶前水平,大肠杆菌数有所下降,LP和LC组回、结肠乳酸杆菌数均显著高于对照组(P < 0.05),LC组双歧杆菌数显著高于对照组和LP组,3组之间回、结肠大肠杆菌数均无明显差异,说明饲喂LP和LC可促进乳酸杆菌和双歧杆菌的生长。
表 3. 植物乳杆菌和干酪乳杆菌对肠道食糜菌群数量的影响[Lg (copies/g湿重)] Table 3. Effects of Lactobacillus plantarum and Lactobacillus casei on quantity of microbial populations in the gut digesta [Lg (copies/g wet weight)]
| Age/d groups | Ileum | Colon | ||||||||
| Total bacteria | Lactobacillus spp. | Bifidobacteria spp. | E. coli | Total bacteria | Lactobacillus spp | Bifidobacteria spp. | E. coli | |||
| 21 | Control group | 9.13 | 5.12 b | 4.8 b | 6.98 a | 10.03 | 5.36 b | 5.03 b | 6.45 | |
| LP treatment | 9.32 | 6.34 a | 5.4 ab | 6.01 b | 10.45 | 6.78 a | 5.68 ab | 6.34 | ||
| LC treatment | 9.01 | 6.02 a | 5.6 a | 6.13 b | 10.21 | 6.94 a | 6.23 a | 6.22 | ||
| SEM | 0.11 | 0.21 | 0.23 | 0.29 | 0.30 | 0.21 | 0.41 | 0.12 | ||
| 24 | Control group | 9.03 | 4.99 b | 4.78 | 7.23 | 9.85 | 5.19 b | 4.79 b | 7.35 | |
| LP treatment | 9.11 | 5.78 ab | 5.26 | 7.31 | 10.14 | 6.32 a | 5.02 b | 7.22 | ||
| LC treatment | 8.78 | 5.96 a | 5.11 | 7.45 | 10.02 | 6.48 a | 5.89 a | 7.11 | ||
| SEM | 0.15 | 0.36 | 0.62 | 0.45 | 0.11 | 0.46 | 0.85 | 0.51 | ||
| 35 | Control group | 9.10 | 5.21 b | 4.98 | 6.22 | 10.12 | 5.33 b | 5.13 b | 6.24 | |
| LP treatment | 9.16 | 6.28 a | 5.54 | 6.34 | 10.38 | 6.81 a | 5.79 ab | 6.55 | ||
| LC treatment | 9.03 | 6.13 a | 5.56 | 6.88 | 10.22 | 7.01 a | 6.17 a | 6.34 | ||
| SEM | 0.23 | 0.36 | 0.65 | 0.51 | 0.24 | 0.42 | 0.76 | 0.46 | ||
| a, b: means within different treatments having a different superscript letter differ significantly (P < 0.05). | ||||||||||
表选项
2.5 仔猪生长性能与肠道SCFAs、微生物菌群的相关性 研究发现,LP和LC对断奶前仔猪日增重无明显影响,但显著降低腹泻率(P < 0.05),提高断奶后日增重和回肠绒毛高度(P < 0.05)[10]。对仔猪生产性能与肠道绒毛高度、SCFAs浓度与微生物菌群多样性和数量进行相关分析发现(图 3),断奶前(图 3-A),LP和LC组仔猪腹泻率下降与空、回肠绒毛高度升高,回肠乙酸、丁酸浓度、乳酸杆菌上升呈负相关(P < 0.05),与大肠杆菌下降呈正相关(P < 0.05),与结肠丙酸、丁酸浓度呈显著负相关(P < 0.05);断奶后(图 3-B),LP和LC组仔猪日增重增加与空肠绒毛高度提高、结肠乙酸及TSCFA浓度上升呈显著正相关(P < 0.05),腹泻率下降主要与回肠TSCFA浓度和总菌数量上升有关;综上,LP和LC组仔猪断奶前、后生长性能的改善与空、回肠绒毛高度增加、肠道SCFA浓度上升和乳酸杆菌、双歧杆菌数量上升存在显著相关。
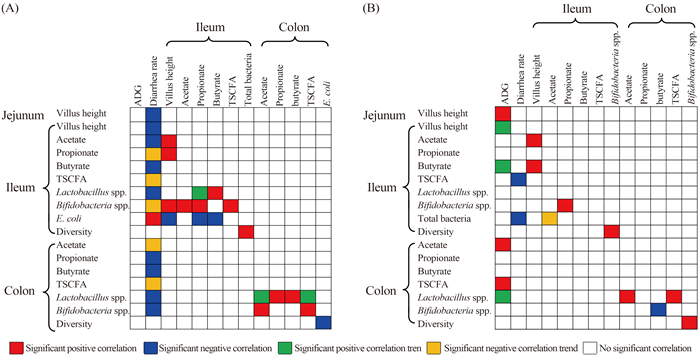 |
| 图 3. 仔猪断奶前(A)、后(B)生长性能与肠绒毛高度、SCFAs浓度及微生物菌群的相关性 Figure 3. Correlation of the growth performance and villus height, SCFA concentrations and microbial populations in piglets gut before (A) and after (B) weaning. |
| 图选项 |
3 讨论 3.1 植物乳杆菌和干酪乳杆菌对肠道微生物菌群的影响 笔者前期研究发现,断奶显著影响仔猪生长、降低饲料利用率,增加腹泻率,断奶前连续灌喂LP和LC显著降低断奶前仔猪腹泻率,提高断奶后仔猪日增重[10]。本研究发现,断奶显著影响仔猪回肠和结肠菌群组成与数量,说明仔猪断奶时的种种表现可能与肠道菌群破坏有关。结果还显示,断奶前连续灌喂植物乳杆菌对仔猪回肠菌群复杂性和断奶后菌群恢复的作用更强、更快一些,在结肠干酪乳杆菌组仔猪菌群在断奶后两周恢复更快,说明测试菌株对断奶后仔猪菌群恢复均有一定效果,但作用部位有差别,这可能与菌株各自特性差异有关[19]。McCann等指出,菌群多样性增加说明肠道抗干扰能力增强,有利于缓解断奶应激[20]。Su等报道,断奶显著影响仔猪大肠菌群组成,降低菌群多样性和乳酸杆菌数,断奶前饲喂益生菌Lactobacillus sobrius显著促进大肠乳酸杆菌增殖,缓解断奶对菌群的影响[16]。Siggers等发现,新生仔猪较早饲喂植物乳杆菌等乳酸菌显著影响肠道菌群组成,提高抵抗坏死性肠炎的能力[21]。Pieper等报道,仔猪断奶前或断奶时饲喂超过1010 CFU的植物乳杆菌能显著提高断奶后仔猪小肠和大肠菌群多样性,植物乳杆菌促进了肠道有益菌Lactobacillus sobrius、产SCFAs菌如Clostridium coccoides-Eubacterium rectale cluster XIVa的增殖[22],说明植物乳杆菌通过促进有益菌以及产酸菌增殖来改善肠道生态环境,保护肠道抵御病原菌的侵扰[23-25]。Liu等报道,仔猪口服植物乳杆菌显著降低肠道梭菌属病原菌的数量,促进肠道发育和健康[26]。本研究发现,测试菌株对小肠和大肠乳酸杆菌的增殖具有明显促进作用,LC对结肠双歧杆菌的增殖作用较明显,虽然大肠杆菌数未明显下降,但仍说明乳酸杆菌类的益生菌能改变肠道菌群组成,促进有益菌增殖。为进一步研究微生物菌群多样性增加和有益菌增殖是否与LP和LC改善仔猪生长性能有关,我们对其相关关系进行了分析,结果显示断奶前回肠乳酸杆菌增殖、大肠杆菌下降与腹泻率下降直接相关,而日增重的提高与菌群多样性和数量增加无明显相关。
3.2 植物乳杆菌和干酪乳杆菌对SCFAs产生能力的影响 乙酸、丙酸和丁酸等SCFAs主要由大肠微生物发酵碳水化合物产生,可为肠上皮细胞提供能量,尤其丁酸是肠上皮细胞的主要能量来源[25]。本研究发现,测试菌株均能促进断奶时肠道各SCFAs和总SCFAs的产生,促进断奶后乙酸和总SCFAs的产生,说明测试菌株影响了肠道微生态环境。Le等报道,肠道乳酸杆菌菌群的数量与SCFAs浓度呈正相关,乳酸杆菌越多SCFAs浓度也越高[27],这与Holzapfel等的报道一致,即乳酸杆菌降解碳水化合物代谢物的能力非常强,可促进SCFAs的产生[28],但由于乳酸杆菌不是SCFAs的主要产生菌,说明肠道内乳酸杆菌与产SCFAs的菌之间存在交互饲喂[27]。Lebeer等报道,肠道中的拟杆菌通常情况下以肠粘膜糖苷为能量来源,当乳酸杆菌增多时,便与拟杆菌建立碳水化合物利用方面的合作,拟杆菌把日粮或食糜多糖降解为寡糖,产乳酸菌包括乳酸杆菌利用寡糖产生乳酸,乳酸再被乳酸利用菌分解为SCFAs[29],本研究食糜中SCFAs的浓度升高可能与测试菌株促进乳酸杆菌、双歧杆菌等产乳酸菌增殖,增强了菌群之间的互作有关。而Fuller和Rossi等早有报道,乳酸杆菌能发酵非消化性碳水化合物产生大量SCFAs和乳酸等有机酸抑制大肠杆菌的生长[30-31]。为研究LP和LC组肠道SCFAs浓度上升是否与乳酸杆菌、双歧杆菌增殖有关,仔猪生长性能改善是否也与肠道SCFAs生成有关,我们进行了相关分析,发现肠道SCFAs浓度上升与乳酸杆菌和双歧杆菌增殖显著相关,双歧杆菌增殖与菌群多样性增加直接有关,断奶前回肠绒毛高度提高、腹泻率下降与肠道SCFAs大量生成分别呈显著正相关和负相关,断奶后日增重、回肠绒毛高度增加和腹泻率下降也与SCFAs生成显著相关,说明测试菌株通过促进乳酸杆菌、双歧杆菌等有益菌增殖,增加菌群多样性,促进SCFAs大量生成,改善肠道环境,从而提高肠绒毛高度,促进肠道形态发育,改善仔猪生长性能,缓解仔猪断奶应激,从机制上解释了我们前期研究仔猪生长性能和腹泻率等表观症状得以改善的原因。
4 结论 仔猪断奶前饲喂测试菌株植物乳杆菌和干酪乳杆菌能显著影响断奶前、后仔猪小肠、大肠微生物菌群组成,促进有益菌增殖,提高菌群多样性,促进SCFAs生成,改善肠道生态环境。
参考文献
| [1] | Pluske JR, Le Dividich J, Verstegen MWA. Weaning the pig: concepts and consequences.Wageningen: Wageningen Academic Publishers, 2003. |
| [2] | Bosi P, Casini L, Finamore A, Cremokolini C, Merialdi G, Trevisi P, Nobili F, Mengheri E. Spray-dried plasma improves growth performance and reduces inflammatory status of weaned pigs challenged with enterotoxigenic Escherichia coli K88.Journal of Animal Science, 2004, 82(6): 1764–1772. |
| [3] | Thacker PA. Alternatives to antibiotics as growth promoters for use in swine production: a review.Journal of Animal Science and Biotechnology, 2013, 4(1): 35. |
| [4] | Land MH, Rouster-Stevens K, Woods CR, Cannon ML, Conta J, Shetty AK. Lactobacillus sepsis associated with probiotic therapy.Pediatrics, 2005, 115(1): 178–181. |
| [5] | Desjardins ML, Roy D, Goulet J. Growth of bifidobacteria and their enzyme profiles.Journal of Dairy Science, 1990, 73(2): 299–307. |
| [6] | Suo C, Yin YS, Wang XN, Lou XY, Song DF, Wang X, Gu Q. Effects of Lactobacillus plantarum ZJ316 on pig growth and pork quality.BMC Veterinary Research, 2012, 8: 89. |
| [7] | Guerra-Ordaz AA, González-Ortiz G, Ragione RML, Woodward MJ, Collins JW, Pérez JF, Martín-Orúe SM. Lactulose and Lactobacillus plantarum, a potential complementary synbiotic to control postweaning colibacillosis in piglets.Applied and Environmental Microbiology, 2014, 80(16): 4879–4886. |
| [8] | Liu HC, Zhang MH, Li SX, Feng JH, Jiang HL, Yang JJ, Yin RJ. Effects of probiotic preparation on intestinal pH, mucosal morphology and volatile fatty acid content in early weaner piglets.Chinese Journal of Animal Nutrition, 2012, 24(7): 1329–1335(in Chinese).刘虎传, 张敏红, 李素霞, 冯京海, 姜海龙, 杨家军, 殷瑞娟. 益生菌制剂对早期断奶仔猪肠道pH、黏膜形态结构和挥发性脂肪酸含量的影响.动物营养学报, 2012, 24(7): 1329–1335. |
| [9] | Nagpal R, Kumar A, Kumar M, Behare PV, Jain S, Yadav H. Probiotics, their health benefits and applications for developing healthier foods: a review.FEMS Microbiology Letters, 2012, 334(1): 1–15. |
| [10] | Xian YH, Zhao XY, Li CB, Ding LR, Zhu WY, Hang SQ. Effects of Lactobacillus plantarum and Lactobacillus casei on growth performance, organ index and intestinal morphology of piglets.Chinese Journal of Animal Nutrition, 2015, 27(12): 3805–3811(in Chinese).县怡涵, 赵秀英, 李晨博, 丁立人, 朱伟云, 杭苏琴. 植物乳杆菌和干酪乳杆菌对仔猪生长性能、器官指数及小肠形态的影响.动物营养学报, 2015, 27(12): 3805–3811. |
| [11] | Zoetendal EG, Akkermans ADL, De Vos WM. Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria.Applied and Environmental Microbiology, 1998, 64(10): 3854–3859. |
| [12] | Nübel U, Engelen B, Felske A, Snaidr J, Wieshuber A, Amann RI, Ludwig W, Backhaus H. Sequence heterogeneities of genes encoding 16S rRNAs in Paenibacillus polymyxa detected by temperature gradient gel electrophoresis.Journal of Bacteriology, 1996, 178(19): 5636–5643. |
| [13] | Muyzer G, De Waal EC, Uitterlinden AG. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA.Applied and Environmental Microbiology, 1993, 59(3): 695–700. |
| [14] | Sanguinetti CJ, Dias Neto E, Simpson AJ. Rapid silver staining and recovery of PCR products separated on polyacrylamide gels.Biotechniques, 1994, 17(5): 914–921. |
| [15] | Qin WL. Determnaton of rumen volatile fatty acids by means of gas chromatography.Journal of Nanjing Agricultural University, 1982, 5(4): 110–116(in Chinese).秦为琳. 应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进.南京农学院学报, 1982, 5(4): 110–116. |
| [16] | Su Y, Yao W, Perez-Gutierrez ON, Smidt H, Zhu WY. 16S ribosomal RNA-based methods to monitor changes in the hindgut bacterial community of piglets after oral administration of Lactobacillus sobrius S1.Anaerobe, 2008, 14(2): 78–86. |
| [17] | Walker AW, Ince J, Duncan SH, Webster LM, Holtrop G, Ze XL, Brown D, Stares MD, Scott P, Bergerat A, Louis P, McIntosh F, Johnstone AM, Lobley GE, Parkhill J, Flint HJ. Dominant and diet-responsive groups of bacteria within the human colonic microbiota.The ISME Journal, 2011, 5(2): 220–230. |
| [18] | Khafipour E, Li SC, Plaizier JC, Krause DO. Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis.Applied and Environmental Microbiology, 2009, 75(22): 7115–7124. |
| [19] | Hou CL, Zeng XF, Yang FJ, Liu H, Qiao SY. Study and use of the probiotic Lactobacillus reuteri in pigs: a review.Journal of Animal Science and Biotechnology, 2015, 6(1): 14. |
| [20] | McCann KS. The diversity-stability debate.Nature, 2000, 405(6783): 228–233. |
| [21] | Siggers RH, Siggers J, Boye M, Thymann T, M lbak L, Leser T, Jensen BB, Sangild PT. Early administration of probiotics alters bacterial colonization and limits diet-induced gut dysfunction and severity of necrotizing enterocolitis in preterm pigs.Journal of Nutrition, 2008, 138(8): 1437–1444. |
| [22] | Pieper R, Janczyk P, Urubschurov V, Korn U, Pieper B, Souffrant WB. Effect of a single oral administration of Lactobacillus plantarum DSMZ 8862/8866 before and at the time point of weaning on intestinal microbial communities in piglets.International Journal of Food Microbiology, 2009, 130(3): 227–232. |
| [23] | Konstantinov SR, Awati A, Smidt H, Williams BA, Akkermans AD, De Vos WM. Specific response of a novel and abundant Lactobacillus amylovorus-like phylotype to dietary prebiotics in the guts of weaning piglets.Applied and Environmental Microbiology, 2004, 70(7): 3821–3830. |
| [24] | Barcenilla A, Pryde SE, Martin JC, Duncan SH, Stewart CS, Henderson C, Flint HJ. Phylogenetic relationships of butyrate-producing bacteria from the human gut.Applied and Environmental Microbiology, 2000, 66(4): 1654–1661. |
| [25] | Pryde SE, Duncan SH, Hold GL, Stewart CS, Flint HJ. The microbiology of butyrate formation in the human colon.FEMS Microbiology Letters, 2002, 217(2): 133–139. |
| [26] | Liu H, Zhang J, Zhang SH, Yang FJ, Thacker PA, Zhang GL, Qiao SY, Ma X. Oral administration of Lactobacillus fermentum I5007 favors intestinal development and alters the intestinal microbiota in formula-fed piglets.Journal of Agricultural and Food Chemistry, 2014, 62(4): 860–866. |
| [27] | Le Roy CI, ?t?epetova J, Sepp E, Songisepp E, Claus SP, Mikelsaar M. New insights into the impact of Lactobacillus population on host-bacteria metabolic interplay.Oncotarget, 2015, 6(31): 30545–30556. |
| [28] | Holzapfel WH. Appropriate starter culture technologies for small-scale fermentation in developing countries.International Journal of Food Microbiology, 2002, 75(3): 197–212. |
| [29] | Lebeer S, Vanderleyden J, De Keersmaecker SCJ. Genes and molecules of lactobacilli supporting probiotic action.Microbiology and Molecular Biology Reviews, 2008, 72(4): 728–764. |
| [30] | Fuller R. Probiotics in man and animals.Journal of Applied Bacteriology, 1989, 66(5): 365–378. |
| [31] | Rossi M, Corradini C, Amaretti A, Nicolini M, Pompei A, Zanoni S, Matteuzzi D. Fermentation of fructooligosaccharides and inulin by bifidobacteria: a comparative study of pure and fecal cultures.Applied and Environmental Microbiology, 2005, 71(10): 6150–6158. |
