贺新丽, 赵丽丽, 张柏林, 赵宏飞


北京林业大学生物科学与技术学院, 北京 100083
收稿日期: 2015-07-16; 修回日期: 2015-09-10; 网络出版日期: 2015-10-19
基金项目: 国家自然科学基金(31471710)
通信作者: 赵宏飞, Tel:+86-10-62336154;E-mail: zhaohf518@163.com
摘要: [目的] 研究了模拟淀粉条件下嗜酸乳杆菌(Lactobacillus acidophilus) NCFM、植物乳杆菌(Lactobacillus plantarum) 121以及戊糖乳酸菌(Lactobacillus pentosus) ML32吸附苯并芘的能力,为利用乳杆菌去除苯并芘提供一定的理论指导。[方法] 基于苯并芘的HPLC检测方法,考察了淀粉含量及类型、培养时间和pH等因素对乳杆菌吸附苯并芘能力的影响,研究了淀粉水解产物及菌体活性影响乳杆菌吸附苯并芘的效果。[结果] 淀粉含量在2%-10%的范围内,乳杆菌吸附苯并芘的能力与淀粉含量的增加呈正相关性,且与淀粉种类关系不大,但经糊化处理的淀粉可以促进菌体吸附苯并芘。在模拟淀粉体系中,培养前4 h时乳杆菌吸附苯并芘的效率增长快,此后其吸附率增加缓慢。淀粉经酸性(pH为3-4)和碱性(pH为8-9)处理,乳杆菌吸附苯并芘的能力提升。淀粉的水解产物麦芽糖和葡萄糖都能显著改善乳杆菌吸附苯并芘的能力。与活细胞相比,经灭活处理后乳杆菌细胞吸附苯并芘的能力降低。[结论] 在淀粉体系中,乳杆菌依然表现出良好的苯并芘吸附能力,且一定范围内淀粉含量增多、糊化作用以及麦芽糖和葡萄糖的存在可促进其吸附苯并芘的能力。因此,本研究中的乳杆菌或许可以用作生物脱除剂来减少淀粉食物中的苯并芘。
关键词: 苯并芘乳酸菌淀粉体系吸附
Removal of benzo(a)pyrene by Lactobacillus strains under simulated starch conditions
Xinli He, Lili Zhao, Bolin Zhang, Hongfei Zhao


School of Biological Science & Biotechnology, Beijing Forestry University, Beijing 100083, China
Received: 16 July 2015; Revised: 10 September 2015; Published online: 19 October 2015
Foundation Item: Supported by the National Natural Science Foundation of China (31471710)
Corresponding author. Tel: +86-10-62336154, E-mail: zhaohf518@163.com
Abstract: [Objective] The performances of Lactobacillus acidophilus NCFM, Lactobacillus plantarum121 and Lactobacillus pentosus ML32 in removing benzo(a)pyrene [B(a)P] in simulated starch conditions were studied. To provide a novel way to reduce the potential risk of B(a)P to human, several factors which affect the binding of the 3 Lactobacillus strains to the chemical toxin were investigated in starch system. [Methods] The percentage of B(a)P bound by Lactobacillus strains was determined with HPLC after incubation at 37℃ for 4 h. The B(a)P-removing capabilities of Lactobacillus strains in various simulated starch systems were evaluated, including the concentrations, types and gelatinization of starch, incubation time, pH and starch-hydrolyzed products. [Results] The B(a)P-binding percentages of the Lactobacillus strains increased as starch concentrations were elevated from 2% to 10%. Starch types, either from corn, potato or sweet potato, had little effects on the ability of these bacterial cells to bind B(a)P. The gelatinization of starch favored Lactobacillus strains to bind more B(a)P. The percentage of these bacterial cells to bind B(a)P grew fast at 37℃ for the first 4 h-incubation time, and then slowly increased. The three Lactobacillus strains bound more B(a)P when starches were acidified to pH of 3 to 4 or alkalified to pH of 8 to 9. The viable cells of three Lactobacillus strains removed more B(a)P via their binding than their dead cells did. Moreover, both glucose and maltose, the end products after starch is hydrolyzed, improved significantly the performance of the 3 bacterial strains to remove B(a)P. [Conclusion] All of the three Lactobacillus strains perform good ability to bind B(a)P in the presences of starch. Their B(a)P-removing ability would be improved with an increased starch concentration, and the gelatinization of starch as well as the supplements of glucose and maltose. Thus, the selected Lactobacillus strains in our current work should be promising as a biological agent to reduce the occurrence of B(a)P in starch-based food products.
Key words: benzo(a)pyreneLactobacillus strainsstarch systembinding
苯并(a)芘[Benzo(a)pyrene,B(a)P]是含碳有机物不完全燃烧所产生的1种苯与芘稠合而成的多环芳烃化合物,广泛存在于空气、水和土壤等环境中。食物中苯并芘的来源主要包含两个方面,一方面是在工业生产和生活过程中,煤炭、天然气和石油等燃料不完全燃烧产生的物质,如汽车尾气、橡胶生产以及吸烟产生的烟气等,之后通过污染水、大气和土壤,从而进入粮食、蔬菜、水果、水产和肉制品等食物中[1, 2];另一方面是在食物加工过程中采用的熏制、烘烤和煎炸等方法,使食物中的碳水化合物、脂肪、胆固醇和蛋白质等在高温条件下会发生热裂解反应,再经过环化和聚合反应生成包含苯并芘在内的多环芳烃类物质。与普通食物相比,在烟熏和烘烤加工过程中苯并芘的产生量将会增加10-20倍[3]。
苯并芘对人体健康存在巨大的危害,不仅有致癌性,而且有致畸和致突变性。实验研究表明,B(a)P经过代谢能够在胎儿、儿童或成人组织中形成B(a)P-DNA加合物,除了引起染色体错配导致多种癌症,还会改变配子(精子和卵子)的DNA组成而引起畸变[4, 5]。成人长时间暴露在苯并芘环境中会引起精子形态改变、精子数量减少和卵子数量减少等[6]。另外,急性暴露在高水平苯并芘环境中,会抑制免疫系统,损坏红细胞和引起贫血。
近年来乳酸菌的抗癌与抗突变特性逐渐受到人们的关注。目前,关于乳酸菌的吸附特性研究主要集中在黄曲霉毒素、赭曲霉素A、伏马毒素和玉米烯酮等真菌毒素方面[7]。部分报道指出,乳酸菌对于杂环胺有吸附作用[8]。此外,研究还发现乳酸菌也能够吸附重金属,例如镉和铅等[9]。乳酸菌作为人体肠道内重要的益生菌,具有促进消化吸收、调整肠道内菌群、降低胆固醇、增强免疫力、抗肿瘤等生理作用。我们以前的研究证实,戊糖乳酸菌(Lactobacillus pentosus) ML32和植物乳杆菌(Lactobacillus plantarum) 121对苯并芘有较好的吸附效果[10]。然而,复杂多样的食物成分是否会影响乳酸菌吸附苯并芘的能力则未见相关报道,淀粉是重要的食物组分之一,且富含淀粉的食物在烟熏和烘烤等热加工过程中容易产生大量的苯并芘,因此研究淀粉条件下乳酸菌吸附苯并芘的能力意义重要。
本研究以植物乳杆菌(Lactobacillus plantarum) 121、戊糖乳杆菌(Lactobacillus pentosus) ML32和商业上广泛应用的嗜酸乳杆菌株(Lactobacillus acidophilus) NCFM为实验菌株,考查了在模拟淀粉条件下其对苯并芘的吸附能力,并分析了相关影响因素,旨在为食物体系中运用乳酸菌清除苯并芘提供理论依据。
1 材料和方法 1.1 材料 1.1.1实验菌株:植物乳杆菌(L. plantarum) 121和戊糖乳杆菌(L. pentosus) ML32由北京林业大学食品系(现保存于中国工业微生物菌种保藏中心,CICC)提供,商业化嗜酸乳杆菌(L. acidophilus) NCFM由丹尼斯克(Danisco)公司(上海)提供。
1.1.2菌体培养:将所选用3株斜面保藏乳杆菌连续活化两代,按4%的接种量接种于MRS(Man,Rogosa,and Sharpe)培养基中,37 ℃培养18-22 h。
1.1.3主要试剂和仪器:苯并芘(≥99%,Sigma);淀粉(可溶性淀粉、玉米淀粉、马铃薯淀粉、红薯淀粉);葡萄糖;麦芽糖;甲醇(色谱纯)。高效液相色谱仪SPD-M20A,购自日本岛津公司;无菌超净工作台,购自北京东联哈尔仪器制造有限公司;高压蒸汽灭菌锅,购自上海博讯实业有限公司医疗设备厂;冷冻离心机,购自上海菲恰尔分析仪器有限公司;生化恒温培养箱,购自上海一恒科学仪器有限公司等;超纯水机,购自上海Canrex仪器分析公司。
1.2 乳酸菌对苯并芘的吸附 苯并芘溶液的配置:将苯并芘固体溶于DMSO中配制为10 mg/mL的苯并芘贮备液,然后用水稀释为苯并芘浓度为100 μg/mL的工作液。
取37 ℃培养18-22 h的菌体培养液,离心5min (6000 r/min,4 ℃)收集菌体,无菌水洗涤2次,调整菌体浓度为109 CFU/mL。取1 mL菌悬液离心后去掉上清,将菌体重悬于苯并芘浓度为10 μg/mL的溶液中,37 ℃培养4 h离心(6000 r/min,5 min)收集上清[10]。将上清加入500 μL氯仿萃取,取有机相于-20 ℃保存。用HPLC法检测苯并芘含量。实验以不含乳杆菌的苯并芘溶液作为对照,进行37 ℃培养4 h离心(6000 r/min,5 min)做相同处理。每个样品取3个平行,重复实验3次。
色谱检测条件:色谱柱:Diamonsil C18 (5μm,4.6 mm×250 mm);流动相:100%甲醇;进样量:20 μL;流速:1 mL/min;检测器:二极管阵列检测器;苯并芘保留时间:5.93 min。
乳杆菌对苯并芘的吸附率按下式计算:
吸附率(%)=[(空白样中苯并芘的含量−上清液中苯并芘的含量)/空白样中苯并芘的含量]×100%。
1.3 淀粉含量对乳杆菌吸附苯并芘的影响 按方法1.2将1 mL菌悬液离心去上清,菌体重悬于900 μL 0%、2%、4%、6%、8%和10%的淀粉水溶液中,加入100 μL苯并芘工作液(100 μg/mL)得到苯并芘含量为10 μg/mL菌悬液,37 ℃培养4h。按方法1.2通过HPLC测定上清液中残留苯并芘含量,以不含乳杆菌的淀粉苯并芘溶液作为对照。
1.4 淀粉类型对乳杆菌吸附苯并芘的影响 选取马铃薯淀粉、红薯淀粉和玉米淀粉配制浓度为2%的淀粉溶液,按方法1.2将1 mL菌悬液离心去上清,菌体重悬于900 μL淀粉溶液中,加入100 μL苯并芘工作液(100 μg/mL)得到苯并芘含量为10 μg/mL的菌悬液。将混合液于37 ℃培养4h。按方法1.2通过HPLC测定上清液中残留苯并芘含量,以不含淀粉的水溶液为对照。
1.5 糊化淀粉对乳杆菌吸附苯并芘的影响 将含量为2%的马铃薯淀粉、红薯淀粉和玉米淀粉加热糊化(100 ℃,5 min),按方法1.2将1mL菌悬液离心去上清,菌体重悬于900 μL淀粉含量为2%糊化溶液中,加入100 μL苯并芘工作液(100 μg/mL)得到苯并芘含量为10 μg/mL的菌悬液,37 ℃培养4 h。按方法1.2测定上清液中残留苯并芘含量,以马铃薯淀粉、红薯淀粉和玉米淀粉未经糊化处理为对照。
1.6 培养时间对乳杆菌吸附苯并芘的影响 按方法1.2将1 mL菌悬液离心去上清,菌体重悬于900 μL淀粉含量为2%溶液中,加入100 μL B(a)P工作液(100 μg/mL)混匀为1 mL菌体共培液,37 ℃分别培养10 min、30 min、1 h、2 h、4h、10 h、24 h和48 h。按方法1.2通过HPLC测定上清液中残留苯并芘含量,以不含乳杆菌的淀粉苯并芘溶液作为对照。
1.7 pH 对乳杆菌吸附苯并芘的影响 按方法1.2将1 mL菌悬液离心去上清,菌体重悬于900 μL淀粉含量为2%溶液中,加入100 μL苯并芘工作液(100 μg/mL)得到苯并芘含量为10μg/mL的菌悬液。调整培养液的pH分别为4、5、6、7、8、9和10,37 ℃培养4 h。按方法1.2测定上清液中残留苯并芘含量,以不含乳杆菌的淀粉苯并芘溶液作为对照。
1.8 葡萄糖和麦芽糖对乳杆菌吸附苯并芘的影响 按方法1.2将1 mL菌悬液离心去上清,加入900 μL葡萄糖溶液(含量分别为0%、0.5%、1%、2%、4%、6%、8%、10%),加入100 μL苯并芘工作液(100 μg/mL)得到苯并芘含量为10 μg/mL的菌悬液。将混合液于37 ℃培养4 h。按方法1.2测定上清液中残留苯并芘含量,并以不含乳杆菌的葡萄糖苯并芘溶液作为对照。麦芽糖对于乳杆菌吸附的影响测定同葡萄糖。
1.9 细胞活性对乳杆菌吸附苯并芘的影响 将3株乳杆菌经过121 ℃、30 min灭活后,按照方法1.2将1 mL菌悬液离心去上清,加入900 μL 2%淀粉溶液、0.5%葡萄糖溶液、0.5%麦芽糖溶液和水溶液,再加入100 μL苯并芘工作液(100 μg/mL)得到苯并芘含量为10 μg/mL的菌悬液。将混合液于37 ℃培养4 h。按方法1.2通过HPLC测定上清液中残留苯并芘含量。实验以活性乳杆菌作为对照。
1.10 数据分析 采用Origin 9.1和SPSS 20.0统计软件对实验数据进行统计分析,所有实验均重复3次,实验数据采用平均值±标准差表示。
2 结果和分析 2.1 淀粉含量对乳杆菌吸附苯并芘的影响 以嗜酸乳杆菌NCFM、植物乳杆菌121和戊糖乳杆菌ML32为实验菌株,探究在模拟淀粉条件下乳杆菌吸附苯并芘的能力。在不同淀粉浓度条件下,3株乳杆菌均能吸附苯并芘,且吸附率大于60%(图 1)。在淀粉含量为2%-10%的范围内,随着淀粉含量的增加,乳杆菌对苯并芘的吸附能力增加(图 1)。3株乳杆菌吸附苯并芘的能力存在菌株之间的差异性,其中戊糖乳杆菌ML32对苯并芘的吸附能力最强,嗜酸乳杆菌NCFM次之,植物乳杆菌121的吸附能力最弱。在对照组中,不同淀粉含量的条件下体系中苯并芘含量没有明显降低,说明实验组中苯并芘含量的减少是由于乳杆菌吸附苯并芘所致(图 1)。
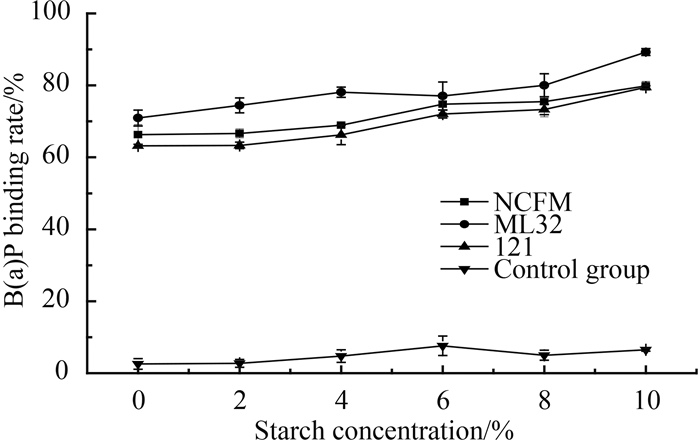 |
| 图 1. 淀粉含量对乳杆菌吸附B(a)P能力的影响 Figure 1. Effect of starch concentrations on the ability of Lactobacillus strains to bind B(a)P. |
| 图选项 |
2.2 淀粉种类对乳杆菌吸附苯并芘的影响 与不含淀粉的对照组对比,3株乳杆菌在不同类型淀粉溶液中吸附率都显著增加(P<0.01)(图 2)。不同种类的淀粉体系之间,乳杆菌对苯并芘的吸附率不同,但差异不显著(P>0.05)(图 2-A、和C)。不同乳杆菌之间吸附苯并芘的能力存在差异(图 2-A、B和C)。
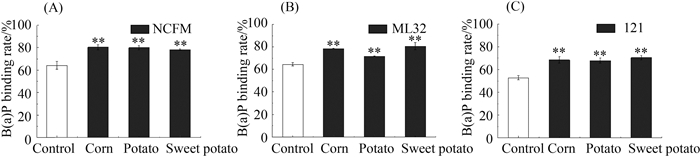 |
| 图 2. 淀粉种类对乳杆菌吸附B(a)P的影响 Figure 2. Effect of starch types on the ability of Lactobacillus strains to bind B(a)P. A: Lactobacillus strain of NCFM; B: Lactobacillus strain of 121; C: Lactobacillus strain of ML32; **: P<0.01 compared with control group. |
| 图选项 |
2.3 糊化淀粉对乳杆菌吸附苯并芘的影响 为了研究淀粉经糊化后对乳杆菌吸附苯并芘的影响,本研究选取了玉米淀粉、马铃薯淀粉和红薯淀粉,对3种不同结构的淀粉溶液采用100℃ 煮沸5 min糊化处理,再检测乳杆菌吸附苯并芘的效果(图 3)。与对照相比,红薯淀粉经糊化后,乳杆菌菌株NCFM、ML32和121吸附苯并芘的效率显著增强(P<0.01)(图 3-A)。马铃薯淀粉经糊化后,3株乳杆菌菌株吸附苯并芘的能力增加,其中菌株NCFM表现出最强的吸附效果(P<0.05) (图 3-B)。玉米淀粉经糊化后,3株乳杆菌对苯并芘的吸附率表现出显著性的增强(P<0.01)(图 3-C)。综上,淀粉经糊化处理可以提高乳杆菌吸附苯并芘的能力。
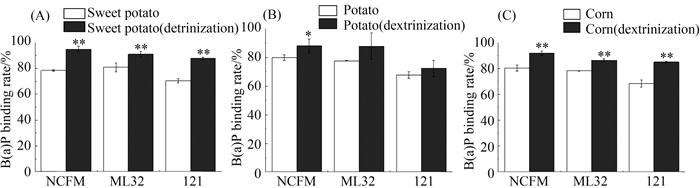 |
| 图 3. 淀粉糊化对乳杆菌吸附B(a)P的影响 Figure 3. Effect of starch dextrinization on the ability of Lactobacillus strains to bind B(a)P. A: Starch of sweet potato; B: Starch of potato; C: Starch of corn; *: P<0.05; **: P<0.01 compared with starch without heating treatments. |
| 图选项 |
2.4 培养时间对乳杆菌吸附苯并芘的影响 将乳杆菌与淀粉溶液中的苯并芘共同温育,分别在10 min、30 min、1 h、2 h、4 h、6 h、8h、10 h、12 h、24 h和48 h后取样测试菌株的吸附率。结果如图 4所示,在共同培养的0-4 h内,乳杆菌对苯并芘的吸附速率增长快,吸附率与培养时间呈正相关;在共同培养10 min时,菌株ML32对苯并芘的吸附率为79.67%、菌株NCFM的吸附率为71.57%、菌株121的吸附率为54.08%;在共同4 h后吸附率增长缓慢;24 h后吸附率基本趋于不变;培养48 h时,菌株ML32、NCFM和121对苯并芘的吸附率分别达到99.03%、98.49%和99.11%。
 |
| 图 4. 培养时间对乳杆菌吸附B(a)P能力的影响 Figure 4. Effect of incubation time on the ability of Lactobacillus strains to bind B(a)P. |
| 图选项 |
2.5 pH 对乳杆菌吸附苯并芘能力的影响 当淀粉溶液处于不同pH时,菌株NCFM、121和ML32吸附苯并芘的变化趋势基本相同。在pH为4-5的酸性环境中,3株乳杆菌吸附苯并芘的效率最高;在pH为6-7时吸附率较低;相对于中性体系中,pH为9-10的碱性环境3株乳杆菌也表现出较高苯并芘吸附能力。其次,菌株间在吸附苯并芘上存在差异性,其中菌株ML32的吸附率最高,菌株NCFM的吸附率次之,菌株121的吸附率最低(图 5)。淀粉溶液的pH影响3株乳杆菌吸附苯并芘的效果。
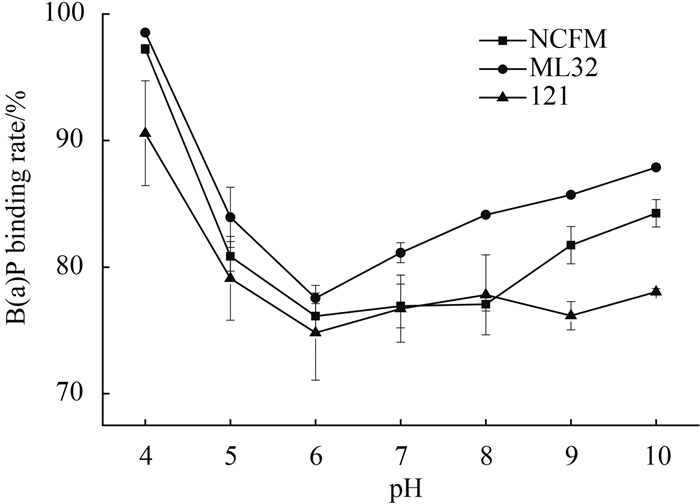 |
| 图 5. pH对乳杆菌吸附B(a)P的影响 Figure 5. Effect of pHs from starch system on the ability of Lactobacillus strains to bind B(a)P. |
| 图选项 |
2.6 麦芽糖与葡糖糖对乳杆菌吸附苯并芘的影响 麦芽糖和葡萄糖为淀粉水解产物。本实验研究了淀粉的水解产物麦芽糖对乳杆菌吸附苯并芘能力的影响,结果显示,当不添加麦芽糖时,3株乳杆菌的苯并芘吸附率分别是73.34%、67.91%和78.19%;当溶液中的麦芽糖含量为0.5%,3株乳杆菌吸附苯并芘的效果均有显著的增加,且菌株NCFM、121和ML32的吸附率分别较之前提升到97.01%、95.07%和99.83%(图 6-A、B和C)。然而,随着麦芽糖浓度的继续增加(0.5%-10%),乳杆菌的苯并芘吸附能力没有显著的变化(图 6-A、B和C)。
 |
| 图 6. 麦芽糖对乳杆菌吸附B(a)P的影响 Figure 6. Effect of maltose on the ability of Lactobacillus strains to bind B(a)P. A: Lactobacillus strain of NCFM; B: Lactobacillus strain of 121; C: Lactobacillus strain of ML32; D: Control group. |
| 图选项 |
与麦芽糖的结果相似,在葡萄糖含量为0%,菌株NCFM、121和ML32的苯并芘吸附率分别是73.34%、67.91%和78.19%;当葡萄糖含量为0.5%时,3株乳杆菌的苯并芘吸附率显著增加,分别上升到99.98%、99.21%和99.25%(图 7-A,B和C)。但随葡萄糖浓度继续增大(0.5%- 10%),3株乳杆菌的苯并芘吸附能力没有显著的变化(图 7-A,B和C)。
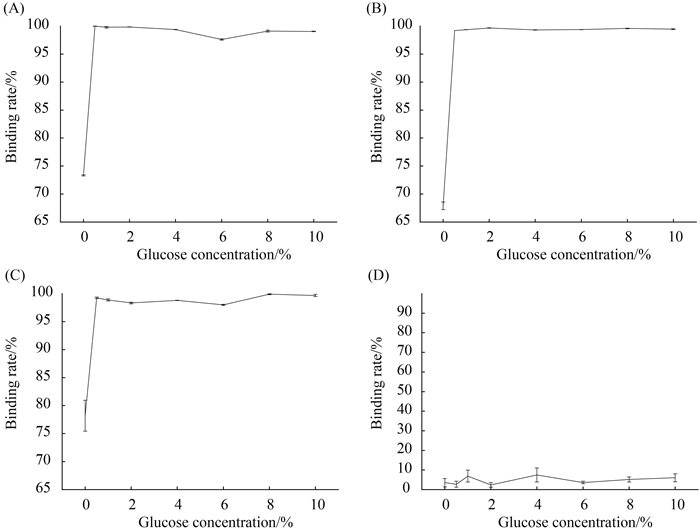 |
| 图 7. 葡萄糖对乳杆菌吸附B(a)P的影响 Figure 7. Effect of glucose on the ability of Lactobacillus strains to bind B(a)P. A: Lactobacillus strain of NCFM; B: Lactobacillus strain of ML32; C: Lactobacillus strain of 121; D: Control group. |
| 图选项 |
2.7 菌体活性对乳杆菌吸附苯并芘的影响 在苯并芘含量为(10 μg/mL)的水溶液中,将嗜酸乳杆菌NCFM、植物乳杆菌121和戊糖乳杆菌ML32经过121 ℃、30 min灭活后,3株乳杆菌吸附苯并芘的能力下降。将灭活的3株菌分别置于含苯并芘(10 μg/mL)的2%淀粉溶液、0.5%的葡萄糖溶液或0.5%的麦芽糖溶液中,其苯并芘吸附能力均显著降低(P<0.01)。其次,无论是在水溶液、2%淀粉溶液、0.5%葡萄糖溶液和0.5%麦芽糖溶液中,热灭活后的菌体在吸附苯并芘方面并没有表现出明显的菌株差异性(图 8)。然而,在同样条件下,3株乳杆菌活细胞均能比灭活细胞吸附更多的苯并芘。显然,在淀粉条件下,乳杆菌吸附苯并芘的能力与其细胞活性有关。
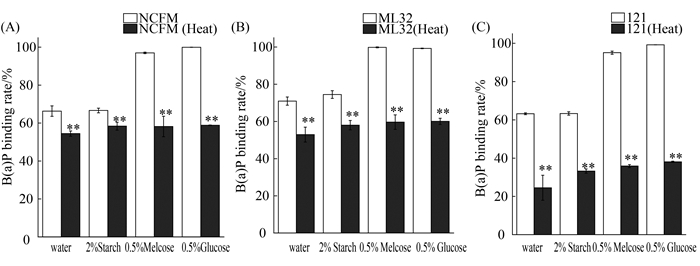 |
| 图 8. 菌体活性对乳杆菌吸附B(a)P的影响 Figure 8. Effect of Lactobacillus strains viability on their ability to bind B(a)P. A: Lactobacillus strain of NCFM; B: Lactobacillus strain of ML32; C: Lactobacillus strain of 121; **: P<0.01 compared with strains without heating treatments. |
| 图选项 |
3 讨论 目前,关于苯并芘污染控制的研究主要集中在生物降解、高级氧化和吸附等方面。其中生物降解法需要多个菌株共同作用,且机制不明朗不易控制;氧化法容易导致二次污染,且成本较高。吸附法简单低耗应用比较普遍,其中活性炭、硅藻土、水滑石类化合物常被用于吸附苯并芘污染,但这些材料均非人体可食用。乳酸菌是公认的益生菌,大量研究表明乳杆菌可以吸附致突变因子,但是关于乳杆菌吸附苯并芘的报道并不多见,本课题组先前研究表明植物乳杆菌121和戊糖乳杆菌ML32可以从环境中吸附苯并芘,其吸附的能力与乳杆菌细胞壁结构及组分有关[10],但是在食品体系中乳酸菌对于苯并芘的清除效果仍有许多因素影响,本文主要研究模拟淀粉条件下乳杆菌吸附苯并芘能力的影响。
淀粉含量和糊化处理对乳杆菌吸附苯并芘的能力有影响。在淀粉条件下3株乳杆菌能够吸附苯并芘,且随着淀粉含量的增加吸附率也增加,淀粉自身不会与苯并芘作用而降低体系中苯并芘的含量(图 1)。实验选用马铃薯、红薯和玉米3种不同类型的常见淀粉,其中马铃薯淀粉的颗粒大小为5-100 μm,平均粒度为40 μm,形状多为圆形或椭圆形;红薯淀粉颗粒大小为5-40 μm,平均粒度为17 μm;玉米淀粉颗粒大小为5-30 μm,平均粒度为15 μm,形状多为三角形[11]。实验结果显示乳杆菌在玉米淀粉、马铃薯淀粉和红薯淀粉3种不同结构淀粉溶液中对苯并芘的吸附没有显著差异(图 2)。但将3种淀粉糊化后,乳杆菌对于苯并芘的吸附效果增强。目前,在此方面的研究尚未有报道。
在淀粉体系中,培养时间和pH不同程度的影响乳杆菌吸附苯并芘的效果。EL-Nezami等报道,鼠李糖乳杆菌能够在24 h内结合培养基中80%的黄曲霉毒素,同时在8 h内与黄曲霉毒素的结合率可以达到78%以上[12]。根据****Sreekumar等报道5株格式乳杆菌(L. gasseri)在10min之内就可以吸附80%以上的Trp-P-1(色氨酸的热解产物),并认为此过程被是一个菌体细胞壁结构参与的一个物理吸附过程[13]。Nybom等研究活性乳酸菌对于微囊藻毒素-LR的吸附过程中,在培养24 h之内吸附率与时间呈正相关,是一个随时间缓慢增加的过程,并提出乳酸菌对于微囊藻毒素的去除机制可能有降解或者代谢参与[14]。在调查乳杆菌与苯并芘作用的过程中,本研究发现3株乳杆菌在10 min就表现出一定程度的苯并芘吸附效应,前4 h是苯并芘吸附率快速增加的过程,4 h之后依然有一个缓慢的增长过程。漆叶琼等研究乳杆菌吸附苯并芘的特性发现,在酸性条件下(pH为3-5)乳杆菌吸附苯并芘的效率高,在中性环境下则吸附率显著下降[10]。本研究与漆叶琼[10]等的研究结果基本一致,即在pH为4-5的酸性环境中乳杆菌吸附苯并芘的效率最高。一个值得注意的结果是,在淀粉体系中,乳杆菌在碱性条件下(pH为9-10时)也有较高的苯并芘吸附率。
葡萄糖和麦芽糖是淀粉水解后的产物。我们的研究表明,添加0.5%的葡萄糖或麦芽糖都能显著促进乳杆菌吸附苯并芘的能力。Nybom等的研究表明,菌株清除毒素能力的特异性上受葡萄糖及细胞活性的影响。通常情况下,加入葡萄糖能够提高菌株吸附微囊藻毒素-LR的能力。对L. plantarumIS-20506菌株而言,在75% PBS中添加1%-2%葡萄糖后可以清除95%以上的微囊藻毒素[15]。王松等的研究也证实,添加外源物质葡萄糖能显著提高实验菌株清除藻毒素的效率[16]。Nybom等认为,添加葡萄糖或许为菌体提供了能量物质,故毒素的去除能力也增强[14]。
经菌体灭活后的3株乳杆菌与苯并芘共同培养结果显示,灭活的乳杆菌细胞吸附苯并芘的能力降低(图 8),说明乳杆菌吸附苯并芘的能力受到细胞活性的影响。此结论与Nybom等利用乳酸菌清除藻毒素的研究中结果一致[17]。Fusch等研究表明,在培养基中热灭活的乳酸菌对赭曲霉素A的吸附率低于11%,但是具有代谢能力的活细胞则能够清除96%以上的此毒素[18]。王松等对于乳酸菌清除微囊藻毒素也得出相似的结果,推断这种吸附过程与细胞活性有关[16]。另一方面,部分研究指出乳酸菌在吸附黄曲霉素B1中,灭活菌体较活菌有更强的吸附能力[12],其原因是非蛋白类毒素的吸附机制与蛋白质类和氨基酸类毒素吸附机制不同所致[19]。在本研究中,3株乳杆菌在2.0%淀粉溶液、0.5%葡萄糖溶液或0.5%麦芽糖溶液中其吸附苯并芘的能力增强;然而热灭活后的菌体吸附苯并芘的能力在同样条件下没有表现出显著差异,即淀粉、葡萄糖和麦芽糖对热灭活的菌体吸附苯并芘的能力没有显著的促进作用。我们的结果表明,乳杆菌吸附苯并芘的能力明显受到细胞活性的影响,Nybom等乳酸菌吸附微囊藻毒素的研究结果也证实了我们的结论[14]。
4 结论 (1)模拟淀粉条件下,在一定浓度范围内随着淀粉含量的增加,促进乳酸菌吸附苯并芘的效果,且淀粉本身不能与苯并芘发生相互作用而降低苯并芘含量。淀粉的种类对乳杆菌吸附没有显著影响,而淀粉糊化处理可以增强吸附能力。
(2)在酸性和碱性条件下,乳杆菌的吸附能力都较强,pH为4-5时吸附能力最强。在共同温育4h吸附率趋于不变。
(3)淀粉水解产物葡萄糖和麦芽糖能够显著促进乳杆菌对于苯并芘的吸附效果,吸附率可达99%以上。菌体灭活后吸附能力降低。
本研究证实,应用乳杆菌清除淀粉食物体系中的苯并芘具有可行性,为降低食物中苯并芘对人体的危害提供了新思路。
参考文献
| [1] | Liu Y, Liu LB, Lin JM, Tang N, Hayakawa K. Distribution and characterization of polycyclic aromatic hydrocarbon compounds in airborne particulates of east Asia. China Particuology, 2006, 4(6):283-292. |
| [2] | Kira S, Katsuse T, Nogami Y, Ito T. Measurement of benzo(a)pyrene in sea water and inmussels in the Seto Inland Sea, Japan. Bulletin of Environmental Contamination and Toxicology, 2000, 65(5):631-637. |
| [3] | Wu D. The harm and prevention measures of benzopyrene pollution in food. Science and Technology of Food Industry, 2008, 29(5):309-311. (in Chinese)吴丹. 食物中苯并芘污染的危害性及其预防措施. 食品工业科技, 2008, 29(5):309-311. |
| [4] | Arnould JP, Verhoest P, Bach V, Libert JP, Belegaud J. Detection of benzo. Human & Experimental Toxicology, 1997, 16(12):716-721. |
| [5] | Perera F, Tang DL, Whyatt R, Lederan SA, Jedrychowsko W. DNA damage from polycyclic aromatic hydrocarbons measured by benzo. Cancer Epidemiology Biomarkers & Prevention, 2005, 14(3):709-714. |
| [6] | Zenzes MT, Bielecki R, Reed TE. Detection of benzo(a)pyrene diol epoxide-DNA adducts in sperm of men exposed to cigarette smoke. Fertility and Sterility, 1999, 72(2):330-335. |
| [7] | Piotrowska M. The adsorption of ochratoxin A by Lactobacillus species. Toxins, 2014, 6(9):2826-2839. |
| [8] | Pithva SP, Dave JM, Vyas BRM. Binding of acridine orange by probiotic Lactobacillus rhamnosus strains of human origin. Annals of Microbiology, 2015, 65(3):1373-1379. |
| [9] | Halttunen T, Salminen S, Tahvonen R. Rapid removal of lead and cadmium from water by specific lactic acid bacteria. International Journal of Food Microbiology, 2007, 114(1):30-35. |
| [10] | Qi YQ, Zhang JT, Pan XH, Pei JH, Zhang BL. Binding of benzo(a)pyrene by Lactobacilli strains. Acta Microbiologica Sinica, 2011, 51(7):956-964. (in Chinese)漆叶琼, 张佳涛, 潘向辉, 裴家伟, 张柏林. 乳杆菌吸附苯并芘的特性. 微生物学报, 2011, 51(7):956-964. |
| [11] | 阚建全. 食品化学. 第2版. 北京:中国农业大学出版社, 2008, 130-133. |
| [12] | El——Nezami H, Mykkänen H, Kankaanpää P, Salminen S, Aholas J. Ability of Lactobacillus and Propionibacterium strains to remove aflatoxin B1 from the chicken duodenum. Journal of Food Protection, 2000, 63(4):549-552. |
| [13] | Sreekumar O, Hosono A. The heterocyclic amine binding receptors of Lactobacillus gasseri cells. Mutation Research, 1998, 421(1):65-72. |
| [14] | Nybom SMK, Salminen SJ, Meriluoto JAO. Removal of microcystin-LR by strains of metabolically active probiotic bacteria. FEMS Microbiology Letters, 2007, 270(1):27-33. |
| [15] | Nybom SMK, Collado MC, Surono IS, Salminen SJ, Meriluoto JAO. Effect of glucose in removal of microcystin-LR by viable commercial probiotic strains and strains isolated from Dadih fermented milk. Journal of Agricultural and Food Chemistry, 2008, 56(10):3714-3720. |
| [16] | Wang S, Zhang J, Wang M, Du GC, Chen J. Removal of microcystin-LR by lactic acid bacteria. Acta Microbiologica Sinica, 2010, 50(6):729-735. (in Chinese)王松, 张娟, 王淼, 堵国成, 陈坚. 乳酸菌对微囊藻毒素的清除. 微生物学报, 2010, 50(6):729-735. |
| [17] | Nybom SMK, Salminen SJ, Meriluoto JAO. Specific strains of probiotic bacteria are efficient in removal of several different cyanobacterial toxins from solution. Toxicon, 2008, 52(2):214-220. |
| [18] | Fuchs S, Sontag G, Stidl R, Ehrlich V, Kundi M, Knasmüller S. Detoxification of patulin and ochratoxin A, two abundant mycotoxins, by lactic acid bacteria. Food and Chemical Toxicology, 2008, 46(4):1398-1407. |
| [19] | Heikkilä JE, Nybom SMK, Salminen SJ, Meriluoto JAO. Removal of cholera toxin from aqueous solution by probiotic bacteria. Pharmaceuticals, 2012, 5(6):665-673. |
