吴彬彬, 王文昭, 颜晓庆, 陈宏运, 刘春花, 潘永龙, 梁岩


中国科学院深圳先进技术研究院食品安全及环境技术研究室, 广东 深圳 518055
收稿日期:2015-10-26;修回日期:2016-02-15;网络出版日期:2016-06-25
资助课题:深圳市科技计划项目(CXZZ20150422152108120,JCYJ20140417113430641,JCYJ20140509174140691)
通信作者:Tel:+86-755-86585247;Fax:+86-755-86585222;E-mail:yan.liang@siat.ac.cn
摘要: [目的] 探讨植物发酵液提取物(plant fermentation extract,PFE)对铜绿假单胞菌生物膜的抑制作用,为临床上铜绿假单胞菌感染相关疾病的治疗提供参考。[方法] 通过划线法分离临床标本中的铜绿假单胞菌并进行鉴定,通过报告菌株测定铜绿假单胞菌的毒力因子,采用试管法和激光共聚焦扫描显微镜测定生物膜的形成。[结果] 在分离出的16 株铜绿假单胞菌中,PFE对PA007菌株的作用效果最好,1%PFE显著降低PA007菌株生物膜、绿脓菌素和N-(3-oxododecanoyl)-HSL(3-oxo-C12-HSL)的产量(P<0.05)。同时,也显著降低LasA蛋白酶的活性以及持留菌存活率(P<0.05)。荧光定量PCR实验结果表明PFE能显著抑制lasI和pqsA基因的表达(P<0.05)。[结论] PFE具有抗铜绿假单胞菌感染能力,在临床上铜绿假单胞菌感染疾病的治疗中具有巨大的潜在价值。
关键词: 植物发酵液 铜绿假单胞菌 生物膜 群体感应 持留菌
Effects of plant fermentation extract (PFE) on biofilms of Pseudomonas aeruginosa
Binbin Wu, Wenzhao Wang, Xiaoqing Yan, Hongyun Chen, Chunhua Liu, Yonglong Pan, Yan Liang


Laboratory for Food Safety and Environmental Technology, Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, Guangdong Province, China
Abstract: [Objective] We studied the effects of a plant fermentation extract on destroying biofilms of P. aeruginosa, to provide basic information for treatment of P. aeruginosa related infection diseases. [Methods] Strains of P. aeruginosa in clinical specimens were isolated by streaking plate method and identified by PCR and sequencing. Virulence factors were examined using reporter strains, and biofilms were measured by test tube method and a confocal laser scanning microscopy. [Results] A total of 16 strains of P. aeruginosa were isolated from clinical specimens from a local hospital, among them PA007 strain showed a maximum response when treated with plant fermentation extract. It shows that 1% plant fermentation extract significantly reduced the production of biofilm, pyocyanine and 3-oxo-C12-HSL (P<0.05). Besides, 1% plant fermentation extract also deceased the bioactivity of LasA protease and survival rate of persisters (P<0.05). The qRT-PCR result indicated that the expressions of lasI and pqsA genes were also markedly inhibited at the presence of 1% plant fermentation extract (P<0.05). [Conclusion] The studied plant fermentation extract has anti-infection effect against some P. aeruginosa strains, suggesting a great potential to work as natural antibiotics.
Key words: plant fermentation extract (PFE) Pseudomonas aeruginosa biofilm quorum-sensing (QS) persister cell
生物膜是一种基质膜包被的微生物聚合体,它普遍存在于自然界和慢性疾病感染中。在生物膜内,细菌高度分化,组织性强,菌间“交流”密切[1]。研究发现细菌之间的“交流方式”-群体感应(quorum-sensing,QS)在生物膜形成过程中发挥重要作用。同时,在一些致病菌中QS还能调控毒力因子的合成,危害人体健康[2]。生物膜内高密度细菌还有利于菌间基因水平转移、代谢副产物的共享以及信号转导。此外,菌群中还含有一个特殊亚群-持留菌(persister cell)[3],它们具有明显的耐药性,生物膜能够保护持留菌免受免疫反应、抗生素等的伤害,提供给持留菌一个安全的生存环境[3-4]。所以,QS、生物膜以及持留菌通过一个复杂的调节网络使杂乱的细菌具有较高的组织性和协调性,提高细菌在极端条件(如抗生素、氧化剂、干燥剂和宿主免疫反应等)下的生存能力[5-7]。
铜绿假单胞菌(Pseudomonas aeruginosa)是目前研究QS、生物膜及持留菌的主要模式菌之一。作为条件致病菌,铜绿假单胞菌能够引起心内膜炎、肺炎及导管相关感染疾病,这在囊包性纤维症和重度烧伤住院患者中尤为突出[8]。QS系统、生物膜的形成以及持留菌的存在使得铜绿假单胞菌在一定程度上能够抵抗抗生素以及人体免疫反应,威胁公众健康[1, 4, 9-10]。更重要的是,越来越多的研究表明抗生素的使用增加细菌的耐药性并诱导生物膜的形成[11],这促使人们制定针对QS、生物膜及持留菌的治疗新策略。近年来,有****已经研发出一些针对QS和生物膜的天然或合成抑制剂[12],这些化合物在控制细菌感染方面具有巨大的潜能。此外,目前关于降低菌群中持留菌方法的报道也越来越多[13-14]。但迄今为止,能够同时抑制QS、生物膜和持留菌的物质还鲜有报道。
发酵饮品是通过益生菌将水果、蔬菜等进行发酵后的产品,在抗氧化和美白等方面具有积极作用[15-16]。PFE是由几十种水果和蔬菜等发酵而来的液体,主要成分为多糖、寡糖、多酚、黄酮、有机酸和生物碱等,且富含维生素、矿物质和氨基酸,在中国、韩国和日本等国家和台湾地区深受人们的喜爱[17-18]。特别在台湾地区,人民通常通过饮用PFE来提高免疫力,甚至在感冒期间同时服用抗生素和PFE,以达到快速治愈疾病的效果。目前,科学研究已经发现PFE含有抗菌物质,具有良好的抑菌作用[19]。但不同厂家的PFE的作用效果具有一定差异,因此,本文基于已有研究基础,使用深圳市中科台富科技有限公司的产品,基于铜绿假单胞菌研究PFE的抗QS、抗生物膜以及抗持留菌作用。
1 材料和方法 1.1 材料
1.1.1 菌株: Chromobacteriumviolaceum CV026、C. violaceum VIR07、Staphylococcus aureus subsp. aureus ATCC29213 (S. aureus)、大肠杆菌(ATCC35150)、金黄色葡萄球菌(ATCC29213)和沙门氏菌(ATCC14028)菌株均为本实验室保存,菌株PA001-PA018为本课题从临床标本中分离出的细菌(无PA005H和PA013)。临床标本中,尿液标本(尿路感染患者来源) 2份,粪便标本(胃肠道感染患者来源) 2份,痰标本(呼吸道感染患者来源) 1份,耳拭子标本(耳部感染患者来源) 1份,伤口拭子标本1份,脓肿拭子标本1份和烧伤拭子标本1份,共9份。
1.1.2 主要试剂与仪器: 植物发酵液(“古元真”酵素,深圳市中科台富科技有限公司);Spectra Max M5分光光度计(Molecular Devices);FilmTracer LIVE/DEAD生物膜检测试剂盒(Invitrogen);Leica TCS SP5 激光共聚焦扫描显微镜 (Leica,Wetzlar,Germany);PCR试剂盒(TaKaRa);其余试剂均为国产分析纯试剂。
1.2 细菌的分离、筛选与鉴定 收集临床样本后,采用划线法在LB肉汤培养皿中划线,挑选并纯化克隆,然后使用通用引物27F和1492R进行PCR实验扩增16S rRNA,扩增完成后进行测序,将测序结果与NCBI数据库进行比对。
1.3 PFE对细菌增殖作用研究 划线法培养细菌,挑选单菌落接种于4 mL新鲜培养基37 ℃过夜培养后,调整Optical Density600 (OD600)至0.01,继续培养1 h,离心去上清,用含不同浓度PFE的培养基调节OD600至0.1,培养一定时间后,测定细菌数目。
1.4 生物膜测定实验
1.4.1 生物膜含量测定: 参照Pratt等的实验方法[20]并稍作修改。菌株在LB培养基37 ℃培养15 h,离心收集细菌,用新鲜LB培养基重悬后,调节OD600至0.02。在试管中37 ℃培养72 h后,收集菌液并离心,上清液保存于-20 ℃,用于高丝氨酸内酯(Acyl-homoserine lactone,AHL)提取和毒力因子测定。试管使用无菌水洗涤2遍,加入0.1%结晶紫溶液,室温孵育15 min,再洗涤2遍,加入5 mL 95%的乙醇,待结晶紫溶解后,测定溶液在595 nm处OD值。
1.4.2 激光共聚焦扫描显微镜分析: 细菌37 ℃过夜培养后,用新鲜培养基稀释至OD600约0.02,取5 mL菌液到50 mL离心管中,同时在离心管中加入无菌玻璃盖玻片,37 ℃培养4 d。待生物膜形成后,使用FilmTracer LIVE/DEAD Biofilm Viability kit进行染色,通过Leica TCS SP5激光共聚焦扫描显微镜进行扫描观察,使用LAS AF软件进行图像处理。
1.5 毒力因子测定实验
1.5.1 绿脓毒素测定: 准确吸取3 mL菌液上清,加入3 mL氯仿,剧烈混匀后离心,吸取有机相,加入0.2 mol/L HCl 600 μL,测定520 nm处OD值,计算绿脓毒素浓度。
1.5.2 LasA蛋白酶活性测定: 参照Kong等的实验方法[21],通过测定菌株裂解S. aureus的能力检测LasA蛋白酶活性。首先,培养S. aureus并煮沸,10000 r/min离心10 min后,弃上清,加入10 mmol/L Na2HPO4 (pH 4.5),调节OD600至0.8,取900 μL与100 μL铜绿假单胞菌上清液混合,测定培养一定时间后OD600值,以1h内OD600数值的平均变化值计算LasA蛋白酶活性。(3) 鼠李糖脂测定鼠李糖脂的测定参照Pearson等[22]的实验方法。吸取333 μL的PA007菌液上清,加入乙醚提取3次后,吹干,加入0.5 mL的ddH2O,取100 μL加入900 μL的地衣酚溶液,80 ℃孵育30 min,测定421 nm处OD值,计算鼠李糖脂浓度。
1.6 AHL的提取与活性测定 收集过夜培养细菌,调节OD600至0.02,37 ℃静置培养72 h后离心,收集上清,取5 mL加入酸化乙酸乙酯提取AHL,重复2次后进行浓缩,再次加入2 mL酸化乙酸乙酯,取300 μL加入50 μL ddH2O,用于AHL活性分析实验。N-butyryl-HSL (C4-HSL)和3-oxo-C12-HSL信号分子的检测使用Chromobacterium violaceum CV026 或C. violaceum VIR07报告菌株,各信号分子分别通过报告平板法测定。
1.7 持留菌活力测定 持留菌的活力通过测定抗生素处理后的细菌数进行评价[23]。细菌过夜培养后,用含有葡萄糖(阴性对照组)[13]或PFE (处理组)的新鲜LB肉汤培养基调节OD600至0.005,培养24 h,加入庆大霉素(1-5 μg/mL)继续培养3 h,离心弃上清,用新鲜LB肉汤培养基重悬细菌,进行持留菌计数。
1.8 统计分析 采用SPSS 13.0统计软件进行统计分析,采用t检验,α=0.05为检验水准,P<0.05为有统计学意义。
2 结果和分析 2.1 临床铜绿假单胞菌的分离、筛选及鉴定 本研究共从临床样本中分离纯化出18株细菌,16S rRNA测序和序列比对分析发现,其中16株属于铜绿假单胞菌,其进化关系见图 1。经AHL含量测定、生物膜分析及绿脓菌素活性实验,8株细菌具有明显的AHL合成活性,6株具有较高的绿脓菌素合成能力,15株能够形成良好的生物膜(数据未列出)。由于PA007菌株不仅能够合成C4-HSL和3-oxo-C12-HSL,还能够形成稳定的生物膜、产生绿脓菌素,经综合分析后,我们选择PA007菌株作为后续实验菌株。
 |
| 图 1. 临床分离铜绿假单胞菌16S rRNA的进化关系图 Figure 1. Neighbor-Joining tree of the 16S rRNA sequences obtained from P. aeruginosa strains. For phylogenetic analysis, 9 type strains of P. aeruginosa and 16 isolated were used. The numbers in tree stand for evolutionary distance and in brackets stand for NCBI ID number, respectively. |
| 图选项 |
2.2 PFE 对细菌增殖作用研究 不同浓度PFE (1%,2%,5%,10%) 对PA007菌株的生长有不同的影响。在低浓度(1%)时,PFE具有促进PA007菌株增殖的趋势。但当PFE达到10%时,PA007菌株基本停止生长(图 2)。为了进一步研究PFE在高浓度下是否对细菌具有广谱性作用,我们又研究了50%PFE对大肠杆菌、金黄色葡萄球菌和沙门氏菌的作用,结果发现在培养30 min后,PFE的抑菌效果达到99%以上,培养2 h后,PFE的抑菌效果达到100% (表 1)。
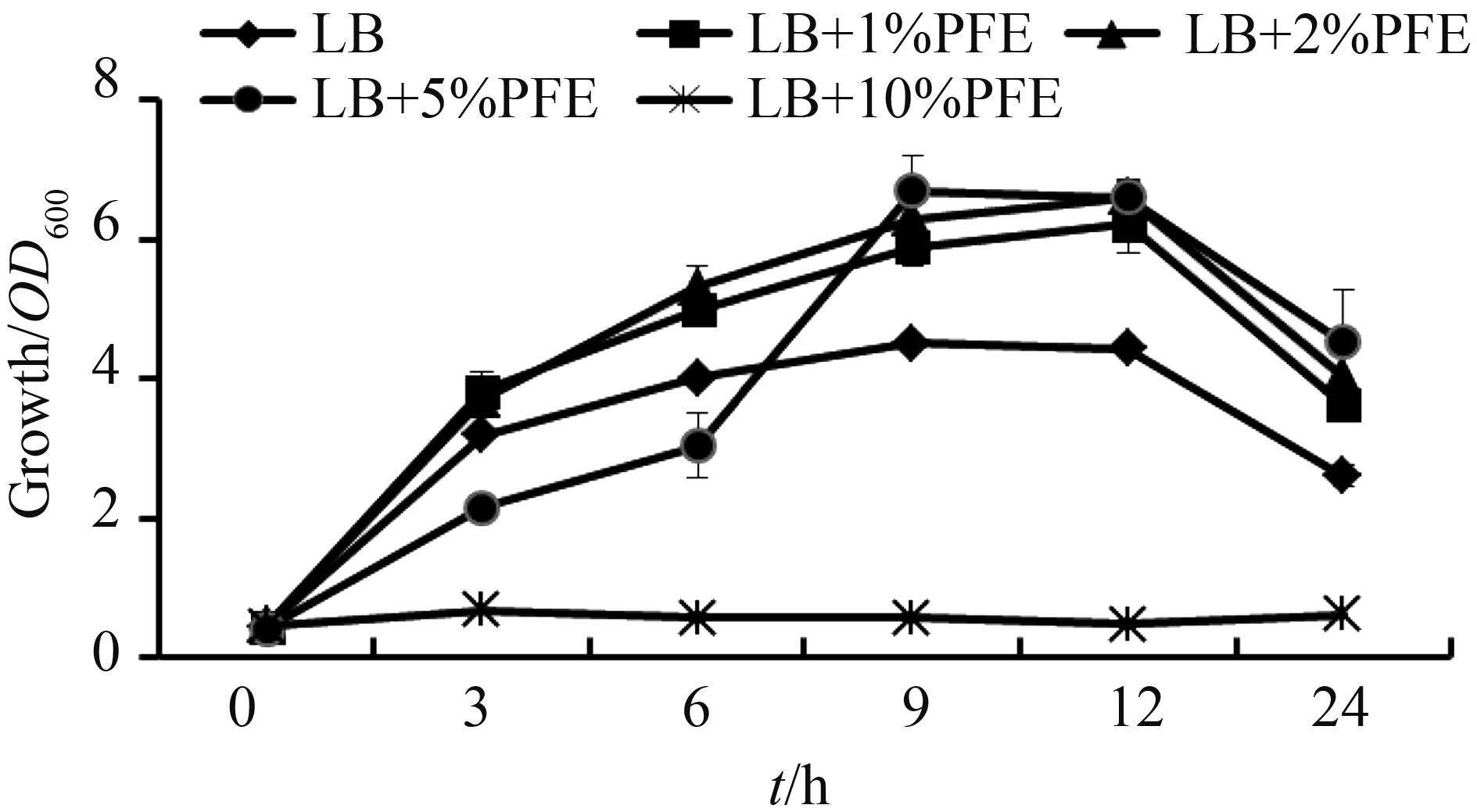 |
| 图 2. PFE对PA007菌株的增殖抑制作用 Figure 2. PFE inhibits the growth of PA007 strain. |
| 图选项 |
表 1. PFE对细菌的增殖抑制作用 Table 1. The inhibitory effects of PFE on bacteria
| Strains | Bacteria number/(CFU/mL) | t/min | Inhibition rate/% |
| P. aeruginosa (isolated) | 8.1 × 108 | 30 | 99.999 |
| E. coli (ATCC35150) | 6.3 × 108 | 30 | 99.999 |
| Staphylococcus aureus (ATCC29213) | 7.2 × 108 | 30 | 99.999 |
| Salmonella (ATCC14028) | 5.5 × 108 | 30 | 99.999 |
| P. aeruginosa (isolated) | 7.5 × 108 | 120 | 100.000 |
| E. coli (ATCC35150) | 6.9 × 108 | 120 | 100.000 |
| Staphylococcus aureus (ATCC29213) | 6.3 × 108 | 120 | 100.000 |
| Salmonella (ATCC14028) | 4.5 × 108 | 120 | 100.000 |
表选项
2.3 PFE 抑制生物膜的形成 试管培养法实验表明在1%的PFE浓度下培养48 h后,PA007菌株形成的生物膜与对照组相比降低了44.2%。96 h后,PA007形成的生物膜进一步降低,达到62.7% (图 3)。此外,在培养48 h和96 h的试管中,可以明显观察到生物膜的脱落。这表明PFE不仅能够抑制生物膜的形成,还在促进生物膜游离方面具有重要作用。同时,为了检测PFE是否具有广谱性,我们还研究了PFE对其他15株铜绿假单胞菌生物膜的影响,结果发现PFE能明显抑制其中13株菌的生物膜形成(图 4),提示PFE对临床分离的铜绿假单胞菌生物膜的形成具有广泛抑制作用。
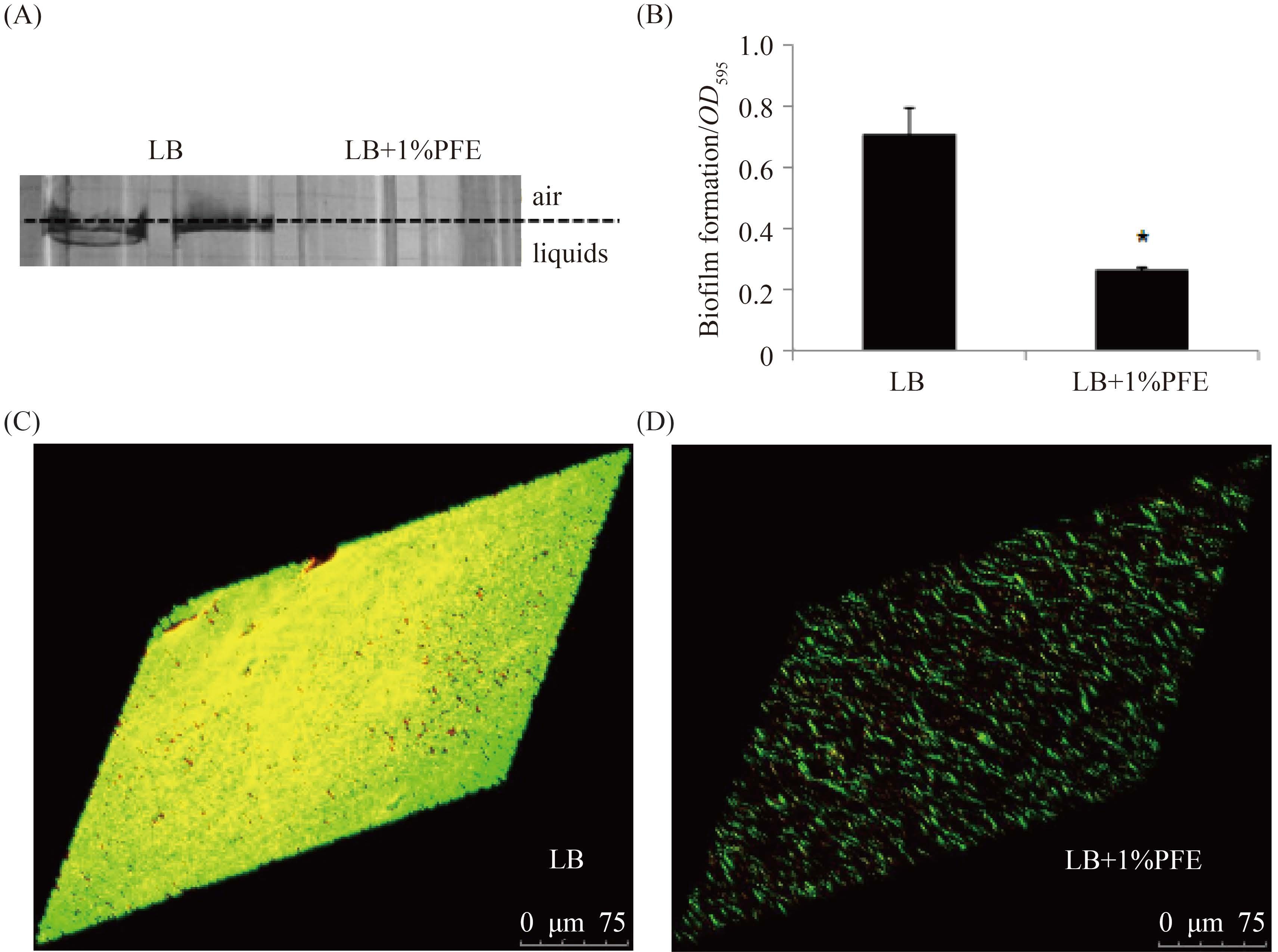 |
| 图 3. PFE抑制PA007菌株生物膜的形成 Figure 3. PFE suppress the biofilm formation of PA007 strain. A: image for biofilm formed on the glass tubes; B: quantified biofilm attachment; C: biofilm formed without PFE; D: biofilm formed in LB with 1% PFE. *: P<0.05. |
| 图选项 |
 |
| 图 4. PFE抑制临床分离的铜绿假单胞菌的生物膜形成 Figure 4. PFE suppress the biofilm formation of clinical isolated P. aeruginosa. The biofilm formations of 13 strains clinical isolated P. aeruginosa (except PA002, PA006 and PA010) were significantly suppressed by PFE. |
| 图选项 |
我们进一步使用CLSM研究了PFE作用后PA007菌株的生物膜三维结构,发现随着PFE浓度的增加,生物膜厚度和结构特征发生明显变化。在1% PFE浓度下,PA007菌株呈现生物膜减少且多数细胞稀释分散现象,而在无PFE时,PA007菌株生物膜呈现成熟的多细胞层密集堆积状态 (图 3),说明PFE影响PA007生物膜的强度和结构。
2.4 PFE 对毒力因子产生的影响 在生物膜形成实验中,PFE明显降低PA007菌株反应的蓝绿色程度,这提示PA007菌株中绿脓菌素的合成可能被PFE所抑制。为了进一步确定PFE抑制绿脓菌素合成作用,我们测定了培养96 h后的PA007菌液中绿脓菌素含量,结果发现,与对照组相比,1% PFE的PA007菌株中绿脓菌素的含量减少了68.7%。同时,在相同PFE浓度作用下,LasA蛋白酶的活性降低了45.5%,然而鼠李糖脂的含量无显著变化(图 5)。
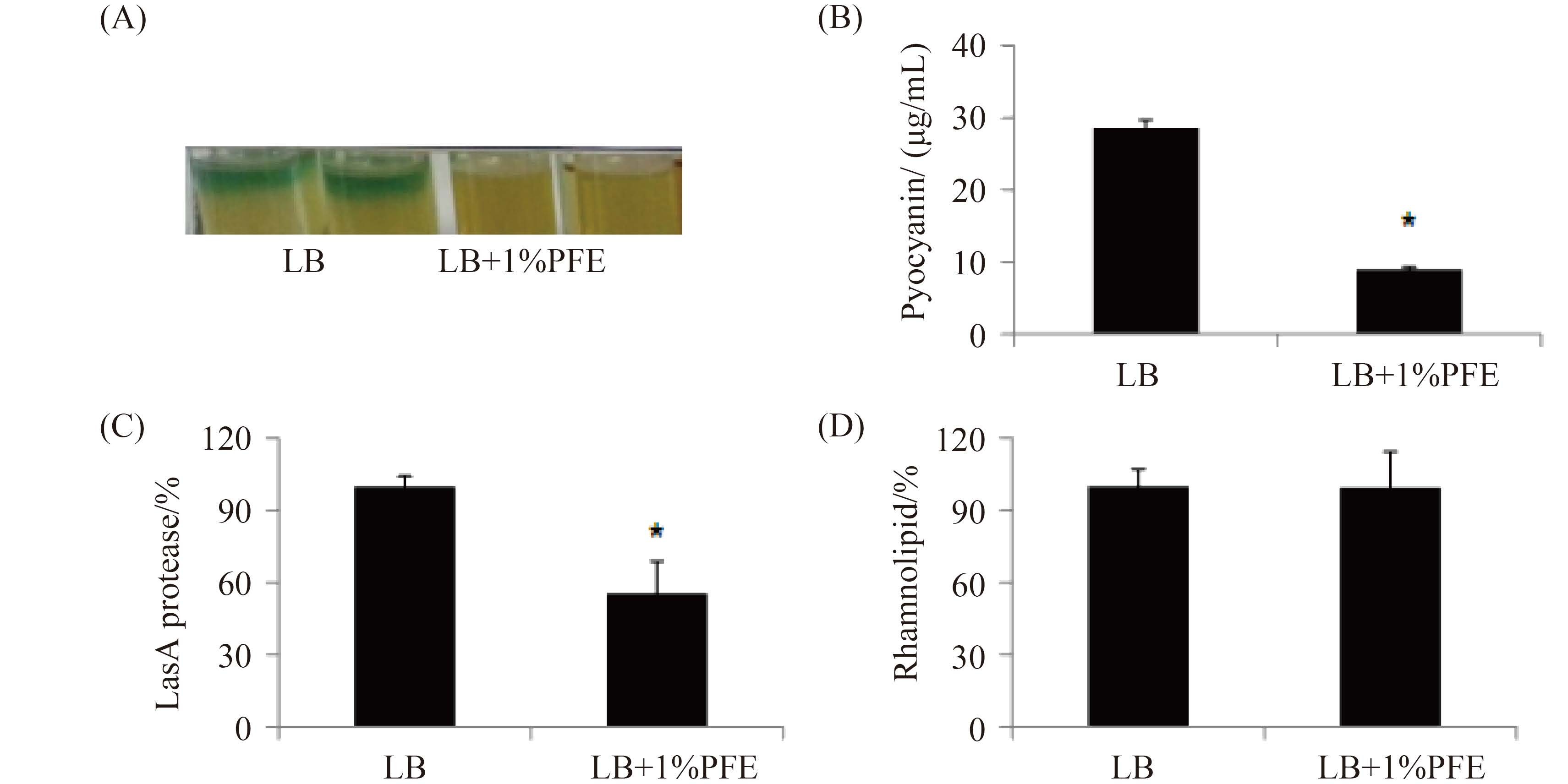 |
| 图 5. PFE对PA007菌株毒力因子合成的影响 Figure 5. Inhibit effects of PFE on virulence factors production in PA007 strain. A: pyocyanin produced in the culture medium; B: qualified pyocyanin production; C: LasA protease activity; D: rhamnolipid content. *: P<0.05. |
| 图选项 |
2.5 PFE 对 QS 系统的影响 生物膜的形成通常是由QS系统调控,为了深入了解PFE对PA007菌株生物膜形成的作用,我们研究了PFE对QS系统的影响。QS系统代表性类型有3种:Las、Rhl和AHQ。C4-HSL和3-oxo-C12-HSL分别是Rhl和Las系统的信号分子,而PQS则是AHQ系统的代表性信号分子。我们通过报告菌株C. violaceum CV026 和VIR07测定了1% PFE浓度下PA007菌株合成的C4-HSL和3-oxo-C12-HSL含量,结果发现与对照组相比PA007菌株的3-oxo-C12-HSL产量降低了55%,而C4-HSL含量无显著变化(图 6),这可能是由于PA007菌株中3-oxo-C12-HSL合成相关基因的表达受PFE抑制导致的,为此,我们使用qRT-PCR检测了lasI、rhlI和pqsA基因的表达,发现PFE能够显著抑制lasI和pqsA基因的表达,分别达3.7和4.5 倍 (P<0.05,表 2)。
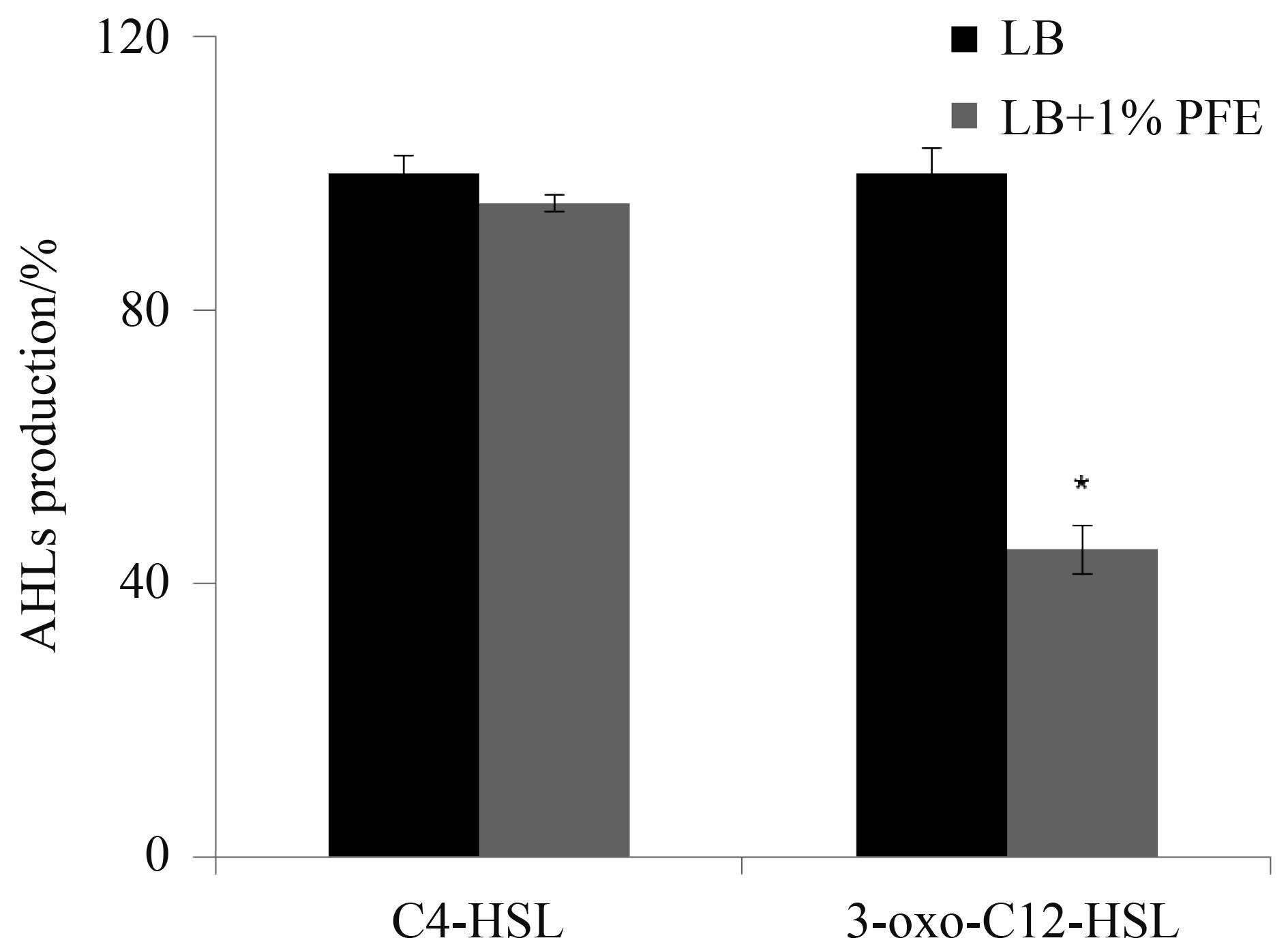 |
| 图 6. PFE对PA007菌株AHLs合成的影响 Figure 6. Inhibit effects of PFE on AHLs production in PA007 strain. *: P<0.05. |
| 图选项 |
表 2. PFE对PA007菌株QS相关基因表达的影响 Table 2. PFE affect QS related gene expression of PA007 strain
| Gene name | Primer | Fold change |
| rhll | F: 5′-GCTCTCTGAATCGCTGGA-3′ | –0.8 ± 0.5 |
| R: 5′-TCACACCGCCATCGACAG-3′ | ||
| lasl | F: 5′-TCGGCGCGAAGAGTTCGA-3′ | –3.7 ± 0.3 * |
| R: 5′-TCATGAAACCGCCAGTCG-3′ | ||
| pqsA | F: 5′-CTCTCAGCCGGCTGCAAT-3′ | –4.5 ± 0.5 * |
| R: 5′-GCACCAACAGCACGCCTT-3′ |
表选项
2.6 PFE 增强抗生素对持留菌作用 持留菌是指细菌受到不利条件(如抗生素等)刺激后形成的准休眠表型变异的细菌,它们在生物膜中含量高,被认为是抗生素治疗后感染复发的基础[3, 24]。我们研究发现PFE能够抑制抗生素预处理的持留菌的生长。与对照组相比,葡萄糖和PFE均能降低持留菌的存活率,但PFE效果更明显,降低存活率约1000倍(图 7)。
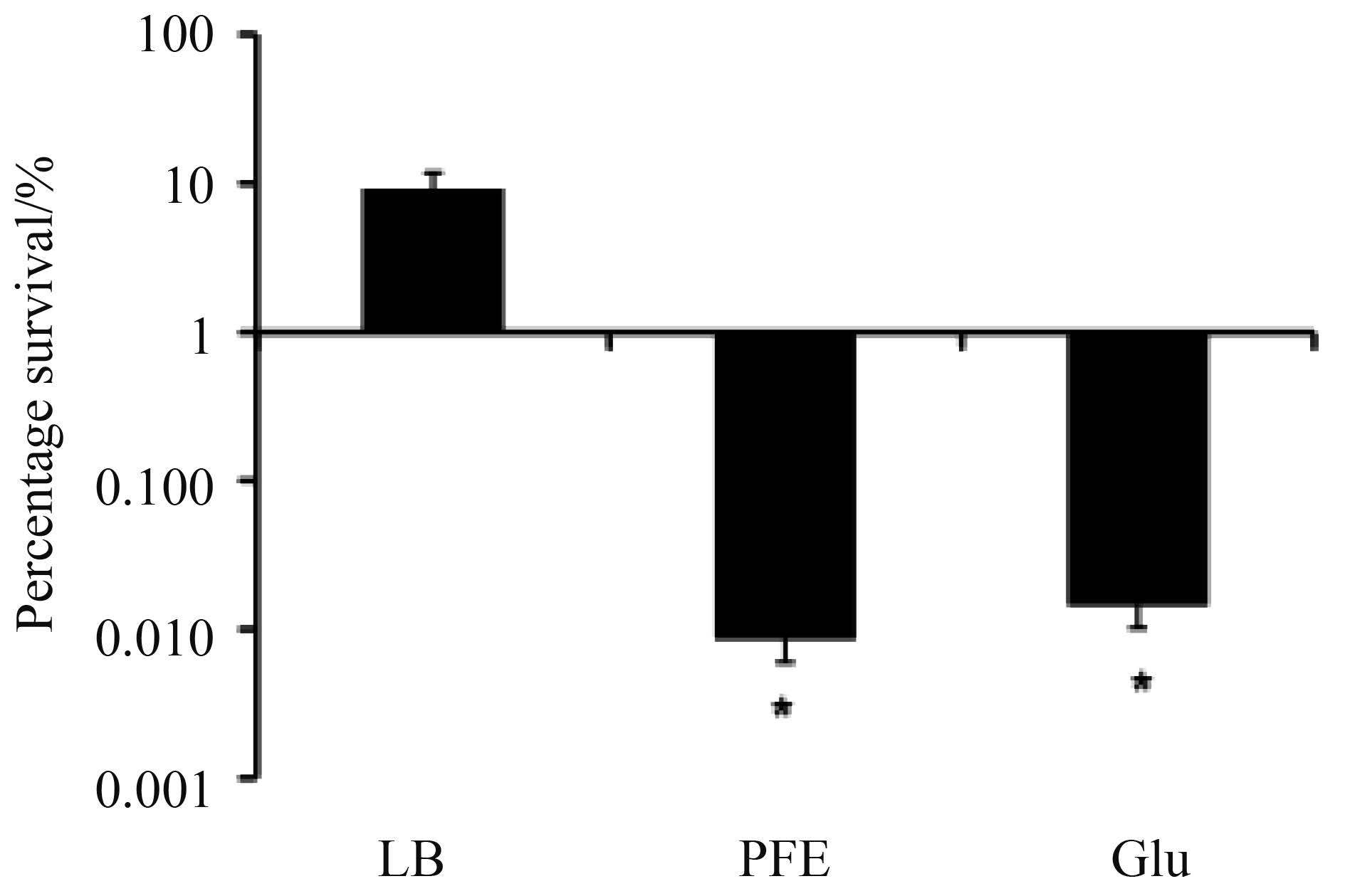 |
| 图 7. PFE增强庆大霉素对PA007菌株持留菌的抑制作用 Figure 7. PFE enhance antibacterial effect of gentamicin on persister cells in PA007 strain. Glu: glucose. *: P<0.05. |
| 图选项 |
3 讨论 细菌在生长、增殖过程中经常遭遇到极端环境,如氧化应激、抗生素或辐射等。为了适应这些环境,细菌形成了一系列的应对策略。形成生物膜、QS系统和顽固化是常见的3 种方式,它们能够调节细菌自身,甚至改变内环境以便更好的生存[2, 10, 20]。当不利条件出现后,细菌间能够通过QS系统传递信息,建立壁垒(生物膜)并进行顽固化来适应不利条件,达到生存下去的目的。目前,已经有一些QS抑制剂或抗生物膜化合物被开发出来,但能够像PFE一样同时具有抗生物膜、抗QS系统和抗持留菌的物质仍鲜有报道。
本研究结果表明PFE在抗生物膜方面具有重要作用,1% PFE处理48 h后,PA007的生物膜降低了40%以上,而96 h后进一步增加到60%以上。在抗QS系统方面,PFE能够显著降低3-oxo-C12-HSL的含量,说明PFE能抑制PA007菌间的“交流”。此外,PFE与对照组相比,能够强力清除持留菌(达1000倍),提示PFE与庆大霉素具有良好的协同效应,具有潜在的临床应用价值。
PFE是一种复杂的混合物,因此其对铜绿假单胞菌的作用机制也较为复杂。已有研究表明Las系统对于生物膜的成熟和分化至关重要,而PQS则参与生物膜基质形成[2],我们通过定量PCR实验发现PFE作用后PA007菌株的lasI和pqsA基因表达明显受到抑制,提示PFE可能通过调控QS系统关键基因的表达发挥作用。此外,PFE还可能含有能清除持留菌的活性物质,如发酵寡糖、单糖等。目前已有关于PFE分离的糖类能够选择性的被益生菌利用,而不能被非益生菌利用的报道[25]。
总之,PFE在抗生物膜、抗QS以及抗持留菌方面具有积极作用,在治疗铜绿假单胞菌相关感染疾病中具有巨大潜力,但其机制尚不十分清楚,仍需进一步的研究。
参考文献
| [1] | Davies DG, Parsek MR, Pearson JP, Iglewski BH, Costerton JW, Greenberg EP. The involvement of cell-to-cell signals in the development of a bacterial biofilm.Science,1998, 280(5361): 295–298. |
| [2] | De Kievit TR. Quorum sensing in Pseudomonas aeruginosa biofilms.Environmental Microbiology,2009, 11(2): 279–288. |
| [3] | Lewis K. Persister cells.Annual Review of Microbiology,2010, 64: 357–372. |
| [4] | Spoering AL, Lewis K. Biofilms and planktonic cells of Pseudomonas aeruginosa have similar resistance to killing by antimicrobials.Journal of Bacteriology,2001, 183(23): 6746–6751. |
| [5] | Hall-Stoodley L, Hu FZ, Gieseke A, Nistico L, Nguyen D, Hayes J, Forbes M, Greenberg DP, Dice B, Burrows A, Wackym PA, Stoodley P, Post JC, Ehrlich GD, Kerschner JE. Direct detection of bacterial biofilms on the middle-ear mucosa of children with chronic otitis media.The Journal of the American Medical Association,2006, 296(2): 202–211. |
| [6] | Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections.Science,1999, 284(5418): 1318–1322. |
| [7] | Penterman J, Nguyen D, Anderson E, Staudinger BJ, Greenberg EP, Lam JS, Singh PK. Rapid evolution of culture-impaired bacteria during adaptation to biofilm growth.Cell Reports,2014, 6(2): 293–300. |
| [8] | Dubin PJ, Kolls JK. Pseudomonas aeruginosa and the host pulmonary immune response.Expert Review of Respiratory Medicine,2007, 1(1): 121–137. |
| [9] | Que YA, Hazan R, Strobe B, Maura D, He JX, Kesarwani M, Panopoulos P, Tsurumi A, Giddey M, Wilhelmy J, Mindrinos MN, Rahme LG. A quorum sensing small volatile molecule promotes antibiotic tolerance in bacteria.PLoS One,2013, 8(12): e80140. |
| [10] | Balaban NQ. Persistence: mechanisms for triggering and enhancing phenotypic variability.Current Opinion in Genetics & Development,2011, 21(6): 768–775. |
| [11] | Hoffman LR, D'Argenio DA, MacCoss MJ, Zhang ZY, Jones RA, Miller SI. Aminoglycoside antibiotics induce bacterial biofilm formation.Nature,2005, 436(7054): 1171–1175. |
| [12] | Kalia VC. Quorum sensing inhibitors: an overview.Biotechnology Advances,2012, 31(2): 224–245. |
| [13] | Allison KR, Brynildsen MP, Collins JJ. Metabolite-enabled eradication of bacterial persisters by aminoglycosides.Nature,2011, 473(7346): 216–220. |
| [14] | Cohen NR, Lobritz MA, Collins JJ. Microbial persistence and the road to drug resistance.Cell Host & Microbe,2013, 13(6): 632–642. |
| [15] | Shao DZ, Hwang HJ, Lin YL. To assess the moisturizing and whitening effectiveness of the skin by the fruits and vegetable fermented drinks.The Journal of International Esthetic Science,2013, 10(1): 7–15(in Chinese).邵东子, 黄汉章, 林樱莲. 蔬果发酵饮品对于皮肤保湿美白之有效性评估.美容科技学刊,2013, 10(1): 7–15. |
| [16] | Chen HY, Cui HY, Wu BB, Liu CH, Luo Q, Xu FF, Pan YL, Yang LL, Liang Y. Antioxidant activity of fermented plant extracts (FPE) in a mouse model of D-galactose-induced aging.Modern Food Science and Technology,2015, 31(8): 7–12(in Chinese).陈宏运, 崔红燕, 吴彬彬, 刘春花, 罗茜, 徐芳芳, 潘永龙, 杨莉丽, 梁岩. 植物发酵液对D-半乳糖致衰老模型小鼠的抗氧化活性研究.现代食品科技,2015, 31(8): 7–12. |
| [17] | Prado FC, Parada JL, Pandey A, Soccol CR. Trends in non-dairy probiotic beverages.Food Research International,2008, 41(2): 111–123. |
| [18] | Blandino A, Al-Aseeri ME, Pandiella SS, Cantero D, Webb C. Cereal-based fermented foods and beverages.Food Research International,2003, 36(6): 527–543. |
| [19] | Hou T, Zhao Z, Jiang HD. Study on the antibacterial characteristic by Lactobacillus helveticus TUST-005.Food Research and Development,2006, 27(8): 31–34(in Chinese).侯婷, 赵征, 江浩东. 瑞士乳杆菌TUST-005发酵乳抗菌特性研究.食品研究与开发,2006, 27(8): 31–34. |
| [20] | Pratt LA, Kolter R. Genetic analysis of Escherichia coli biofilm formation: roles of flagella, motility, chemotaxis and type I pili.Molecular Microbiology,1998, 30(2): 285–293. |
| [21] | Kong KF, Jayawardena SR, Indulkar SD, del Puerto A, Koh CL, H?iby N, Mathee K. Pseudomonas aeruginosa AmpR is a global transcriptional factor that regulates expression of AmpC and PoxB β-lactamases, proteases, quorum sensing, and other virulence factors.Antimicrobial Agents & Chemotherapy,2005, 49(11): 4567–4575. |
| [22] | Pearson JP, Pesci EC, Iglewski BH. Roles of Pseudomonas aeruginosa las and rhl quorum-sensing systems in control of elastase and rhamnolipid biosynthesis genes.Journal of Bacteriology,1997, 179(18): 5756–5767. |
| [23] | Donegan K, Matyac C, Seidler R, Porteous A. Evaluation of methods for sampling, recovery, and enumeration of bacteria applied to the phylloplane.Applied & Environmental Microbiology,1991, 57(1): 51–56. |
| [24] | Lewis K. Multidrug tolerance of biofilms and persister cells.Current Topics in Microbiology & Immunology,2008, 322: 107–131. |
| [25] | Okada H, Fukushi E, Yamamori A, Kawazoe N, Onodera S, Kawabata J, Shiomi N. Isolation and structural confirmation of the oligosaccharides containing α-D-fructofuranoside linkages isolated from fermented beverage of plant extracts.Carbohydrate Research,2011, 346(16): 2633–2637. |
