殷俊磊, 李求春, 焦新安


扬州大学江苏省人兽共患病学重点实验室, 江苏省动物重要疫病与人兽共患病防控协同创新中心, 江苏扬州 225009
收稿日期:2015-06-11;修回日期:2015-08-21;网络出版日期:2015-09-22
资助课题: 国家自然科学基金(31230070,31201905);国家公益性行业(农业)科研专项(201403054);江苏省普通高校研究生科研创新计划项目(CXZZ13_0917);江苏省优势学科项目
通讯作者: 焦新安,Tel:+86-514-87971136;Fax:+86-514-87311374;E-mail:jiao@yzu.edu.cn
摘要: 沙门菌(Salmonella)是革兰氏阴性的兼性胞内菌,可引起其广泛宿主的一系列疾病,严重时可导致全身性感染,威胁生命安全。沙门菌致病岛2(SPI2)是与沙门菌全身性感染密切相关的重要毒力基因簇,其编码的Ⅲ型分泌系统2(T3SS2)在沙门菌侵入宿主细胞后开始组装合成,经该装置分泌的多种效应蛋白对沙门菌在宿主细胞内的生存和增殖起着重要作用。近些年来,与沙门菌T3SS2相关的研究一直都是病原微生物领域关注的焦点之一。本文简要综述了SPI2的基因特征、SPI2基因表达的调控、T3SS2的结构和组成、T3SS2的效应蛋白及与T3SS2相关的疫苗研究等方面的主要研究进展。
关键词: 沙门菌沙门菌致病岛2Ⅲ型分泌系统
Advances in Salmonella pathogenicity island 2 type Ⅲ secretion system-A review
Junlei Yin, Qiuchun Li, Xin'an Jiao


Jiangsu Key Laboratory of Zoonosis, Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou University, Yangzhou 225009, Jiangsu Province, China
Abstract:Salmonella is a Gram-negative facultative intracellular pathogen that can infect vast array of hosts and cause a series of diseases, sometimes even life-threatening systemic diseases. As an indispensable virulence determinant associated with the systemic infections, Salmonella pathogenicity island 2 (SPI2) encodes type Ⅲ secretion system 2 (T3SS2) which is induced after invasion, and the T3SS2 secreted effectors are essential for Salmonella to survive and replicate inside various cell types. In recent years, this issue remains the focus of pathogenic research. This review focuses on the aspects of gene characterization of SPI2, regulation of SPI2 gene expression, the structure and assembly of T3SS2, the T3SS2 effectors and some vaccine candidates associated with T3SS2 to present the current understanding of Salmonella T3SS2.
Key words: SalmonellaSalmonella pathogenicity island 2type Ⅲ secretion system
沙门菌(Salmonella)是属肠杆菌科、呈革兰氏阴性的重要致病菌,宿主广泛,绝大多数沙门菌对人和动物有致病性,能引起人和动物多种不同临床表现的沙门菌病,并且是引起人类食物中毒的主要病原之一,严重时可导致死亡[1, 2]。沙门菌属分为肠道沙门菌(S. enterica)和邦戈尔沙门菌(S. bongori)两个种,肠道沙门菌又可分为6个亚种:肠道亚种(S. enterica subsp. enterica或Ⅰ)、萨拉姆亚种(S. enterica subsp. salamae或Ⅱ)、亚利桑那亚种(S. enterica subsp. arizonae或Ⅲa)、双相亚利桑那沙门菌(S. enterica subsp. diarizonae或Ⅲb)、豪顿沙门菌(S. enterica subsp. houtenae或Ⅳ)和因迪卡沙门菌(S. enterica subsp. indica或Ⅵ);目前,肠道沙门菌已有超过2600种血清型,其中绝大多数属于肠道亚种;而邦戈尔沙门菌的血清型却较为罕见[1, 2, 3]。根据对宿主嗜性的不同,沙门菌可以分为3个群:(1) 泛嗜性沙门菌,它们宿主广泛,能引起人和各种动物的沙门菌病,具有重要的公共卫生意义,并且这群血清型占沙门菌属的大多数,比如鼠伤寒沙门菌和肠炎沙门菌;(2) 一定程度适应于特定动物的偏嗜性沙门菌,仅个别血清型属于此群,比如猪霍乱沙门菌和都柏林沙门菌,它们分别是猪和牛羊的强适应性菌型,多在各自宿主中致病,但也能感染其它动物;(3) 专嗜性沙门菌,只对人或某种动物产生特定的疾病,比如伤寒与甲、乙、丙三型副伤寒沙门菌是高度适应于人类的沙门菌,对动物不引起自然感染,鸡白痢沙门菌和鸡伤寒沙门菌仅能使鸡和火鸡发病,猪伤寒沙门菌仅侵害猪[2]。
致病岛(PI)是指在染色体或质粒上成簇分布的编码毒力相关基因的特定区域。目前,在沙门菌中已有23个致病岛(SPI1-23)已被鉴定出来,但一些致病岛的分布和组成在不同血清型沙门菌之间存在一定的差异[4, 5]。沙门菌有两套Ⅲ型分泌系统(T3SS),分别为由SPI1编码的T3SS1和由SPI2编码的T3SS2,其中,T3SS1与侵袭力相关,T3SS2与全身性感染相关;SPI1在肠道沙门菌和邦戈尔沙门菌中均存在,而SPI2仅存在于肠道沙门菌中[6]。T3SS1和T3SS2分别参与沙门菌致病过程的不同阶段,并且与其相关的研究报道已有很多。本文主要对SPI2的基因特征、SPI2基因表达的调控、T3SS2的结构和组成、T3SS2的效应蛋白以及与其相关的疫苗研究等方面的主要研究成果进行概述。
1 SPI2的基因特征全长约40 kb的SPI2含有40多个基因,为毗邻valV tRNA基因插入的一段序列,该序列可分为两部分[7, 8]。一部分编码T3SS,序列全长约25 kb,G+C含量约为43%,确切地说,在邦戈尔沙门菌中缺失的是SPI2中的此部分,该区域根据其编码蛋白功能的不同可以分为4类基因:编码T3SS结构成分的基因(ssa)、编码分泌系统调节因子的基因(ssr)、编码分泌系统效应蛋白的基因(sse)和编码效应蛋白的特异性伴侣蛋白的基因(ssc)。另一部分在肠道沙门菌和邦戈尔沙门菌中是均存在的,序列全长约15 kb,G+C含量约为54%,该区域并不是沙门菌全身性感染所必需的,主要包含5个与编码连四硫酸盐还原酶(Ttr)相关的基因,其中ttrR和ttrS是编码Ttr的调节基因,ttrA、ttrB和ttrC共同编码Ttr,Ttr与沙门菌的厌氧呼吸相关;另外,在该区域已陆续有一些其它基因被鉴定出来,但关于其功能的研究报道却较少见到。同SPI1一样,SPI2也是独立从外界水平获得的,并且不是从单一水平获得,研究显示,SPI2基因与编码肠致病性大肠杆菌和耶尔森菌T3SS的基因具有一定的相似性,SPI2中非全身性感染所必需的约15 kb的区域要比编码T3SS2的约25 kb的区域系统发育的早[7, 9, 10]。
2 SPI2基因表达的调控SPI2基因的表达只有在特定的微环境条件下才会出现,现有研究显示,共有3套双组分系统SsrA (又称SpiR)/SsrB、EnvZ/OmpR和PhoP/ PhoQ参与SPI2基因表达的调控,其中,由SPI2编码的SsrA/SsrB起着最关键的作用,EnvZ/OmpR和PhoP/PhoQ为沙门菌固有,同时也参与SPI1基因表达的调控;此外,还有一些其它蛋白也参与SPI2基因表达的调控,比如拟核相关蛋白(NAPs) IHF、Fis、H-NS、Hha和YdgT,调节蛋白SlyA,DNA结合蛋白HilA和HilD,铁摄取相关蛋白Fur和氮代谢相关蛋白EIIANtr等,其中,H-NS、Hha、YdgT、EIIANtr和Fur主要负调控SPI2基因的表达[6, 11, 12]。
SsrA为与膜组成相关的传感器,SlyA可与ssrA的启动子结合来调控SPI2的表达;SsrB通过置换结合在SPI2启动子区域的蛋白H-NS来直接激活T3SS2底物蛋白基因的反转录,并进一步促进T3SS2组分的表达,它还可激活和调控它自身及其上游基因ssrA的反转录。近有研究发现,由rpoE编码的σE因子在感染的早期可上调ssrB的表达,在感染的后期可下调hns的表达,这都会引起SPI2基因表达的上调[13]。EIIANtr可直接与SsrB作用,负调控SsrB对其自身反转录的激活,进而避免SPI2基因不必要的过表达[14]。而Fur在酸性环境中和巨噬细胞内则可通过与ssrB启动子的结合来抑制ssrB的表达,进而调控SPI2基因的表达[15]。
EnvZ/OmpR和PhoP/PhoQ主要是通过调控SsrA/SsrB来影响SPI2基因的表达。沙门菌无论在特定培养条件下,还是在受感染宿主细胞内,EnvZ/OmpR在SPI2基因表达的过程中均发挥着重要作用[16, 17]。EnvZ可通过感应胞浆的渗透压来激活其下游的靶蛋白OmpR,反应调节因子OmpR可通过与ssrA和ssrB启动子的结合来促进SsrA/SsrB 的表达,进而间接调控SPI2基因的表达。作为调控SPI1基因表达的主要调节因子,HilD可通过与OmpR作用来介导由SPI1转录到SPI2转录的转变,另外,HilD还可与ssrA/ssrB的启动子区域结合,抵消H-NS引起的抑制作用,促进OmpR的结合,同时诱导SPI2基因的表达[18, 19]。PhoP/PhoQ与沙门菌毒力相关。有研究显示,PhoP通过直接与ssrB启动子结合来调控SPI2基因的转录;与OmpR 不同的是,PhoP通过干扰ssrA转录后mRNA的5′端来调控SsrA的水平[20]。在Mg2+缺乏或低pH的条件下,PhoP/PhoQ可以被激活。另外,在众多调控SPI2基因表达的相关因子中,有许多也参与着SPI1基因表达的调控,比如IHF、Fis、H-NS、Hha、YdgT、HilA和HilD等。
SPI2基因表达的调控是在复杂的微环境中进行的,受多种因素的影响。要完全了解这些调控因子是怎样在复杂的微环境中调控SPI2基因的时空表达的,仍需要更多的相关研究。
3 T3SS2的结构和组成为逃避宿主细胞的清除,沙门菌侵入宿主细胞后会在其形成的沙门菌液泡(SCV)内存活和增殖,并在其中利用T3SS2注射装置分泌多种效应蛋白进入宿主细胞,为全身性感染提供条件[21]。该装置与SPI1编码的T3SS装置及其它多种病原菌的T3SS装置结构相似,通常被称为针状复合物(needle complex,NC)或T3SS注射装置(injectisome),如图 1。它是一个大分子复合物结构,由跨越细菌内外膜的基体和从细菌外膜开始延伸的针状结构复合物组成,包含多种不同的蛋白。沙门菌通过T3SS2分泌的多种效应蛋白与沙门菌在宿主细胞内的复制增殖及引发的全身性感染相关。虽然沙门菌T3SS2注射装置的结构与T3SS1相似,但它们的功能和组成是不同的。目前,关于T3SS1注射装置结构组成的研究报道已有很多,而关于T3SS2注射装置结构组成的数据仍较少[6, 22]。
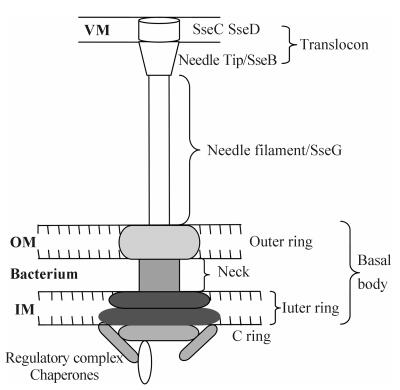 |
| 图 1 T3SS2注射装置示意图 Figure. 1 Schematic representation of T3SS2 injectisome. |
| 图选项 |
T3SS2注射装置基体部(basal body)包括横跨细菌内膜(IM)和外膜(OM)的内环(inner ring)和外环(out ring)及位于内外膜之间的颈部(neck)。针状结构(needle filament)起始于细菌外膜并向外延伸,是注射装置的核心,在T3SS1注射装置中,PrgJ可调控该针状结构的长度[23],而在T3SS2注射装置中,与此相关的研究报道尚未见到。易位子(translocon)是由T3SS2注射装置分泌的蛋白质,该装置针状结构的针尖部位(needle tip)与易位子接触,T3SS2分泌的效应蛋白通过易位运动到达沙门菌液泡膜(VM)上,并形成孔隙,进而使效应蛋白进入宿主细胞内来发挥功能。另外,在分泌效应蛋白的过程中,T3SS2装置除了需要分子伴侣(chaperone)的帮助,还需要一些其它部件的辅助,如位于胞浆一侧、与基体部相邻的C环(C ring)和具有调控功能的调控复合物(regulatory complex)。T3SS2的分子伴侣主要包括SrcA、SscA、SscB、SsaE、SseA等蛋白,SrcA参与效应蛋白SseL和PipB分泌[24],SscA是易位子SseC的分子伴侣蛋白[25],SseF的分泌和功能的发挥需要它的分子伴侣SscB[26],SseA是易位子SseB和SseD的分子伴侣蛋白[27]。蛋白SpiC (又称SsaB)、SsaL和SsaM可形成调控复合物SpiC/SsaL/SsaM可调控多种蛋白的转运[28]。C环的组成包括SsaQ,SsaK和SsaN等,SsaN可与多种分子伴侣(如SsaE、SseA、SscA和SscB等)作用,为一些易位子和效应蛋白的转运提供条件,SsaN还能够水解ATP,为T3SS2注射装置提供能量并促进相关蛋白的分泌[29]。基体部内环的组成包括SsaV,也有推测认为,SsaJ、SsaR、SsaS、SsaT和SsaU等也是其组成蛋白;颈部和外环组成包括SsaC、SsaJ和SsaG等;SsaG也是构成针状结构的组成蛋白;SseB、SseC 和SseD是易位子的主要组成蛋白;另外,还有一些相关蛋白(如SsaH、SsaI、SsaO和SsaP等)的功能尚不完全清楚[6, 22, 29]。
目前,与T3SS1注射装置相比,对T3SS2装置的结构、组成及装配等相关的了解还远远不够,仍需更多深入的研究。
4 T3SS2的效应蛋白现已有32个沙门菌T3SS2效应蛋白被鉴定,分别为CigR、GogB、GtgA、PipB、SifA、SifB、SopD2、SpiC、SpvB、SrfJ、SrgE、SseF、SseG、SseI (又称SrfH或GtgB)、SseJ、SseK1、SseK2、SseK3、SseL、SspH2、SteB、SteC、SteD、GtgE、PipB2、SlrP、SopD、SpvC、SpvD、SspH1、SteA和SteE,它们在沙门菌的致病过程中发挥着重要的作用,编码这些蛋白的基因并非位于沙门菌基因组的同一位置,仅spiC、sseF和sseG位于SPI2上,其余的分别分布在基因组的其它位置,有些位于质粒上,有些由噬菌体编码[22, 30, 31]。同时,GtgE、PipB2、SlrP、SopD、SpvC、SpvD、SspH1、SteA和SteE又是沙门菌T3SS1的效应蛋白。有趣的是,编码这些效应蛋白的基因并非均存在于所有的沙门菌中,有时即使沙门菌含有某个T3SS2效应蛋白基因,它也可能是以假基因的形式存在[30, 32]。SrgE是Habyarimana 等在鼠伤寒沙门菌中鉴定出来的,进一步的系统进化分析显示,SrgE仅存在于肠道亚种的沙门菌中[31]。沙门菌在侵入宿主细胞后形成的SCV为沙门菌的存活和增殖提供了必需的环境,研究表明,有些T3SS1效应蛋白参与早期SCV的形成,而T3SS2效应蛋白主要参与中期和后期SCV的形成及维持SCV的稳定[21]。
SCV的形成大致可以分为3个阶段:感染后10–60 min为形成早期;1–4 h为形成中期;4 h以后为形成后期。在SCV形成的中期,除了需要T3SS1效应蛋白SipA和SopB的参与外,还需要T3SS2效应蛋白SifA、SseF和SseG的参与;参与SCV后期形成的T3SS2效应蛋白包括PipB2、SifA、SifB、SopD2、SseF、SseG、SseJ和SpvB。PipB2、SifA、SopD2和SseJ参与SCV膜的形成,SseF和SseG参与维持SCV稳定性的作用,SpvB具有负调控沙门菌诱导丝(SIFs)形成的作用。SifA可以通过抑制甘露醇-6-磷酸受体的回运来阻止溶酶体对沙门菌的清除,sifA基因的缺失引起沙门菌毒力的显著降低[33, 34, 35]。SpiC是第一个被鉴定的T3SS2效应蛋白,它可以抑制SCV与溶酶体的融合,spiC缺失会导致沙门菌毒力明显减弱[36, 37]。
有些T3SS2效应蛋白还参与介导宿主的免疫应答,比如SspH1、SseL和SpvC,SspH1可以抑制NF-kappaB依赖性的基因转录,负调控炎性反应的产生;SseL能够延迟巨噬细胞的毒性作用,下调NF-kappaB依赖性的细胞因子的产生,改变被感染细胞的脂质代谢,缺失sseL基因后会导致沙门菌毒力下降;SpvC具有使丝裂原活化蛋白激酶(MAPK)去磷酸化的作用,缺失该基因后沙门菌毒力下降。SteC、SspH2、SseI和SpvB等效应蛋白在沙门菌的感染过程中与宿主细胞骨架的重排相关。SopD能促进炎性反应及受感染的肠道内液体的分泌,该基因的缺失引起沙门菌毒力降低。sseK1和sseK2的双缺失或sseK1、sseK2和sseK3的三重缺失对沙门菌的毒力影响均较小。GogB具有抗炎作用,限制组织受损伤的程度。SrfJ是受SsrB正调控的1个T3SS2效应蛋白。Kidwai等[38]以小鼠为感染模型通过对鼠伤寒沙门菌除了SrfJ、SrgE和SteE以外的29个T3SS2效应蛋白的研究发现:除了SteB、PipB、PipB2、SopD2、SseK2和SseK3外,其余的效应蛋白均对沙门菌在小鼠体内的持续感染相关;除了cigR、pipB、pipB2、sopD2、sseK2和sseK3外,其它效应蛋白基因的缺失均引起沙门菌毒力的下降,其中,sspH1、steA、gogB、gtgA、sifA、spiC、spvB、sseG或sseJ的缺失使该沙门菌毒力至少降低了10倍;cigR是唯一一个缺失后引起沙门菌毒力上升的基因,他们推测CigR是炎性抑制因子。有研究发现,slrP基因缺失的沙门菌株对牛犊的毒力没有变化,但对小鼠的毒力却出现了下降,这说明在不同的动物感染模型中,有些效应蛋白发挥的作用可能存在差别[39]。此外,对一些效应蛋白的研究处于刚开始甚至未开始的阶段,比如SrgE、SrfJ、CigR、GtgA、GtgE、SteD和SteE等。
总之,虽然目前已有较多与T3SS2效应蛋白相关的研究报道,但仍有很多的未知需要探索,尤其有很多效应蛋白的功能并不单一。同时,新T3SS2效应蛋白的发掘也是一个不能忽视的方向。
5 与T3SS2相关的疫苗研究随着对沙门菌T3SS2及其效应蛋白的研究不断深入,与T3SS2相关的疫苗研究也在逐渐增多。目前,基于T3SS2及其效应蛋白的疫苗研究主要集中在三方面:(1) 沙门菌减毒株疫苗;(2) 重组疫苗;(3) 亚单位疫苗。同时,这三方面之间又有紧密联系。
由于沙门菌SPI2及部分T3SS2效应蛋白与其毒力密切相关,这就为相应的疫苗研究提供了可能。整个SPI2缺失的肠炎沙门菌对雏鸡具有很好的保护效力,同时它又有作为运送外源抗原载体的潜力[40]。编码T3SS2结构蛋白SsaV的基因ssaV突变会引起伤寒沙门菌和鼠伤寒沙门菌毒力的明显下降,并且具有作为人类伤寒疫苗的潜力,同时也可考虑作为携带外源抗原的疫苗载体[41]。Yin等[42]研究结果显示,整个SPI2缺失的鸡白痢沙门菌具有用作疫苗的潜力,并且对鸡伤寒沙门菌的感染也能提供有效的交叉保护。spiC基因缺失的鸡白痢沙门菌也能够对雏鸡提供良好的保护效力,同样具有用作疫苗的潜力[37]。
目前,与沙门菌T3SS2相关的重组疫苗在预防肿瘤和糖尿病等方面的研究已有报道。Xiong 等[43]将能融合表达肿瘤相关抗原(TAA)和T3SS2效应蛋白SseF的减毒鼠伤寒沙门菌免疫小鼠发现,该菌株能诱导良好的免疫反应,同时为研究新型的肿瘤疫苗提供了新的思路。Xu等[44]构建的能融合表达SifB::SseJ与TAA的减毒沙门菌,经口服免疫后也取得了较好的效果。将能融合表达SseF与糖尿病自身的抗原-前胰岛素原的减毒沙门菌经口服免疫后,前胰岛素原能在宿主细胞内表达,并能运送到细胞质,这为糖尿病的预防提供了新的策略[45]。另外,SspH2也能够在免疫的小鼠体内有效的携带外源抗原完成抗原递呈,并且能够同时诱导抗原特异性的CD4和CD8 T细胞的产生[46]。有研究发现,是否合适的选择了运送外源抗原的T3SS2效应蛋白是衡量相关沙门菌重组疫苗免疫效果是否理想的一个重要指标[47]。
近些年来,在与T3SS2及其效应蛋白相关的亚单位疫苗研究方面也取得了新的进展。Wisner 等[48]通过研究发现,部分T3SS2注射装置的结构蛋白及其效应蛋白均具有作为亚单位疫苗的潜力。Reynolds等[49]的研究结果显示,SseB含有CD4 T细胞的优势免疫表位,为沙门菌亚单位疫苗的研究提供了参考。
但是,现在关于这些疫苗的研究大多仅处于初步开发阶段,要真正进入临床应用,还有大量的研究有待开展。
6 小结和展望沙门菌T3SS2是在细胞内被激活的,其分泌的效应蛋白能够与宿主细胞相互作用,对沙门菌在细胞内的存活和增殖起重要作用,也是引起沙门菌的全身性感染所必需。当前,与沙门菌T3SS2相关的研究仍是国内外众多****关注的热点。相信随着对与沙门菌T3SS2相关研究的不断深入,对沙门菌的致病机制及宿主的防御机制会有更多的了解,同时也为更加深入研究沙门菌带来新的契机,并为该病的防控提供新的思路和策略,比如新型疫苗和抗菌药物的研发。另外,如何更好地将沙门菌T3SS2及其效应蛋白作为有效的工具来利用也应该是一个重要的研究方向。
参考文献
| [1] | Yan SS, Pendrak ML, Punderson JW, Fedorko DP, Foley SL. An overview of Salmonella typing:public health perspectives. Clinical and Applied Immunology Reviews, 2004, 4(3):189-204. |
| [2] | Lu CP. Veterinary microbiology. 3rd ed. Beijing:China Agricultural Press, 2001:223-231. (in Chinese)陆承平. 兽医微生物学. 第3版. 北京:中国农业出版社, 2001:223-231. |
| [3] | Zhang JL, Wei LJ, Kelly P, Freeman M, Jaegerson K, Gong JS, Xu B, Pan ZM, Xu CL, Wang CM. Detection of Salmonella spp. using a generic and differential FRET-PCR. PLoS One, 2013, 8(10):e76053. |
| [4] | Fookes M, Schroeder GN, Langridge GC, Blondel CJ, Mammina C, Connor TR, Seth-Smith H, Vernikos GS, Robinson KS, Sanders M, Petty NK, Kingsley RA, Bäumler AJ, Nuccio S, Contreras Ⅰ, Santiviago CA, Maskell D, Barrow P, Humphrey T, Nastasi A, Roberts M, Frankel G, Parkhill J, Dougan C, Thomson NR. Salmonella bongori provides insights into the evolution of the Salmonellae. PLoS Pathogens, 2011, 7(8):e1002191. |
| [5] | Hayward MR, Jansen VAA, Woodward MJ. Comparative genomics of Salmonella enterica serovars Derby and Mbandaka, two prevalent serovars associated with different livestock species in the UK. BMC Genomics, 2013, 14:356. |
| [6] | Moest TP, Méresse S. Salmonella T3SSs:successful mission of the secret(ion) agents. Current Opinion in Microbiology, 2013, 16(1):38-44. |
| [7] | Hensel M, Hinsley AP, Nikolaus T, Sawers G, Berks BC. The genetic basis of tetrathionate respiration in Salmonella typhimurium. Molecular Microbiology, 1999, 32(2):275-288. |
| [8] | Hensel M, Nikolaus T, Egelseer C. Molecular and functional analysis indicates a mosaic structure of Salmonella pathogenicity island 2. Molecular Microbiology, 1999, 31(2):489-498. |
| [9] | Wood MW, Jones MA, Watson PR, Hedges S, Wallis TS, Galyov EE. Identification of a pathogenicity island required for Salmonella enteropathogenicity. Molecular Microbiology, 1998, 29(3):883-891. |
| [10] | Hueck CJ. Type Ⅲ protein secretion systems in bacterial pathogens of animals and plants. Microbiology and Molecular Biology Reviews, 1998, 62(2):379-433. |
| [11] | Fass E, Groisman EA. Control of Salmonella pathogenicity island-2 gene expression. Current Opinion in Microbiology, 2009, 12(2):199-204. |
| [12] | Hansen-Wester Ⅰ, Hensel M. Salmonella pathogenicity islands encoding type Ⅲ secretion systems. Microbes and Infection, 2001, 3(7):549-559. |
| [13] | Li J, Overall CC, Nakayasu ES, Kidwai AS, Jones MB, Johnson RC, Nguyen NT, McDermott JE, Ansong C, Heffron F, Cambronne ED, Adkins JN. Analysis of the Salmonella regulatory network suggests involvement of SsrB and H-NS in σE-regulated SPI-2 gene expression. Frontiers in Microbiology, 2015, 6:27. |
| [14] | Choi J, Shin D, Yoon H, Kim J, Lee CR, Kim M, Seok YJ, Ryu S. Salmonella pathogenicity island 2 expression negatively controlled by EIIANtr-SsrB interaction is required for Salmonella virulence. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(47):20506-20511. |
| [15] | Choi E, Kim H, Lee H, Nam D, Choi J, Shin D. The iron-sensing fur regulator controls expression timing and levels of Salmonella pathogenicity island 2 genes in the course of environmental acidification. Infection and Immunity, 2014, 82(6):2203-2210. |
| [16] | Wang LC, Morgan LK, Godakumbura P, Kenney LJ, Anand GS. The inner membrane histidine kinase EnvZ senses osmolality via helix-coil transitions in the cytoplasm. The EMBO Journal, 2012, 31(11):2648-2659. |
| [17] | Chakraborty S, Mizusaki H, Kenney LJ. A FRET-based DNA biosensor tracks OmpR-dependent acidification of Salmonella during macrophage infection. PLoS Biology, 2015, 13(4):e1002116. |
| [18] | Bustamante VH, Martinez LC, Santana FJ, Knodler LA, Steele-Mortimer O, Puente JL. HilD-mediated transcriptional cross-talk between SPI-1 and SPI-2. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(38):14591-14596. |
| [19] | Martínez LC, Banda MM, Fernández-Mora M, Santana FJ, Bustamante VH. HilD induces expression of Salmonella pathogenicity island 2 genes by displacing the global negative regulator H-NS from ssrAB. Journal of Bacteriology, 2014, 196(21):3746-3755. |
| [20] | Bijlsma JJE, Groisman EA. The PhoP/PhoQ system controls the intramacrophage type three secretion system of Salmonella enterica. Molecular Microbiology, 2005, 57(1):85-96. |
| [21] | Steele-Mortimer O. The Salmonella-containing vacuole:moving with the times. Current Opinion in Microbiology, 2008, 11(1):38-45. |
| [22] | Ramos-Morales F. Impact of Salmonella enterica type Ⅲ secretion system effectors on the eukaryotic host cell. ISRN Cell Biology, 2012, 2012:Article ID 787934. |
| [23] | Lefebre MD, Galán JE. The inner rod protein controls substrate switching and needle length in a Salmonella type Ⅲ secretion system. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(2):817-82 |
| [24] | Cooper CA, Zhang K, Andres SN, Fang Y, Kaniuk NA, Hannemann M, Brumell JH, Foster LJ, Junop MS, Coombes BK. Structural and biochemical characterization of SrcA, a multi-cargo type Ⅲ secretion chaperone in Salmonella required for pathogenic association with a host. PLoS Pathogens, 2010, 6(2):e1000751. |
| [25] | Cooper CA, Mulder DT, Allison SE, Pilar AV, Coombes BK. The SseC translocon component in Salmonella enterica serovar Typhimurium is chaperoned by SscA. BMC Microbiology, 2013, 13:221. |
| [26] | Dai SP, Zhou DG. Secretion and function of Salmonella SPI-2 effector SseF require its chaperone, SscB. Journal of Bacteriology, 2004, 186(15):5078-5086. |
| [27] | Ruiz-Albert J, Mundy R, Yu XJ, Beuzón CR, Holden DW. SseA is a chaperone for the SseB and SseD translocon components of the Salmonella pathogenicity-island-2-encoded type Ⅲ secretion system. Microbiology, 2003, 149(Pt5):1103-1111. |
| [28] | Yu XJ, McGourty K, Liu M, Unsworth KE, Holden DW. pH sensing by intracellular Salmonella induces effector translocation. Science, 2010, 328(5981):1040-1043. |
| [29] | Yoshida Y, Miki T, Ono S, Haneda T, Ito M, Okada N. Functional characterization of the type Ⅲ secretion ATPase SsaN encoded by Salmonella pathogenicity island 2. PLoS One, 2014, 9(4):e94347. |
| [30] | Figueira R, Holden DW. Functions of the Salmonella pathogenicity island 2(SPI-2) type Ⅲ secretion system effectors. Microbiology, 2012, 158(Pt5):1147-1161. |
| [31] | Habyarimana F, Sabag-Daigle A, Ahmer BMM. The SdiA-regulated gene srgE encodes a type Ⅲ secreted effector. Journal of Bacteriology, 2014, 196(12):2301-2312. |
| [32] | Langridge GC, Fookes M, Connor TR, Feltwell T, Feasey N, Parsons BN, Seth-Smith HMB, Barquist L, Stedman A, Humphrey T, Wigley P, Peters SE, Maskell DJ, Corander J, Chabalgoity JA, Barrow P, Parkhill J, Dougan G, Thomson NR. Patterns of genome evolution that have accompanied host adaptation in Salmonella. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(3):863-868. |
| [33] | McGourty K, Thurston TL, Matthews SA, Pinaud L, Mota LJ, Holden DW. Salmonella inhibits retrograde trafficking of mannose-6-phosphate receptors and lysosome function. Science, 2012, 338(6109):963-967. |
| [34] | Zhang XM, Jiao XA, Tang LH, Pan ZM, Yin YL. Construction and characterization of Salmonella typhimurium SL7207 SifA- mutant strain. Acta Microbiologica Sinica, 2005, 45(3):349-354. (in Chinese)张晓明, 焦新安, 唐丽华, 潘志明, 殷月兰. 鼠伤寒沙门氏菌SL7207 SifA-突变株的构建和鉴定. 微生物学报, 2005, 45(3):349-354. |
| [35] | Yin JL, Xu LJ, Wang ZP, Lin ZJ, Li QC, Geng SZ, Jiao XA. Construction of a Salmonella pullorum S06004ΔsifA strain and study on its biological characteristics. Chinese Veterinary Science, 2015, 45(4):345-351. (in Chinese)殷俊磊, 徐黎娟, 王志鹏, 蔺志杰, 李求春, 耿士忠, 焦新安. 鸡白痢沙门菌sifA基因缺失株的构建及其生物学特性的研究. 中国兽医科学, 2015, 45(4):345-351. |
| [36] | Uchiya KI, Barbieri MA, Funato K, Shah AH, Stahl PD, Groisman EA. A Salmonella virulence protein that inhibits cellular trafficking. The EMBO Journal, 1999, 18(14):3924-3933. |
| [37] | Geng SZ, Jiao X, Barrow P, Pan ZM, Chen X. Virulence determinants of Salmonella gallinarum biovar pullorum identified by PCR signature-tagged mutagenesis and the spiC mutant as a candidate live attenuated vaccine. Veterniary Microbiology, 2014, 168(2/4):388-394. |
| [38] | Kidwai AS, Mushamiri Ⅰ, Niemann GS, Brown RN, Adkins JN, Heffron F. Diverse secreted effectors are required for Salmonella persistence in a mouse infection model. PLoS One, 2013, 8(8):e70753. |
| [39] | Tsolis RM, Adams LG, Ficht TA, Bäumler AJ. Contribution of Salmonella typhimurium virulence factors to diarrheal disease in calves. Infection and Immunity, 1999, 67(9):4879-4885. |
| [40] | Matulova M, Havlickova H, Sisak F, Rychlik I. Vaccination of chickens with Salmonella pathogenicity island (SPI) 1 and SPI2 defective mutants of Salmonella enterica serovar Enteritidis. Vaccine, 2012, 30(12):2090-2097. |
| [41] | Khan SA, Stratford R, Wu T, McKelvie N, Bellaby T, Hindle Z, Sinha KA, Eltze S, Mastroeni P, Pickard D, Dougan G, Chatfield SN, Brennan FR. Salmonella typhi and S. typhimurium derivatives harbouring deletions in aromatic biosynthesis and Salmonella pathogenicity island-2(SPI-2) genes as vaccines and vectors. Vaccine, 2003, 21(5/6):538-548. |
| [42] | Yin JL, Cheng Z, Wang XC, Xu LJ, Li QC, Geng SZ, Jiao X. Evaluation of Salmonella enterica serovar pullorum pathogenicity island 2 mutant as a candidate live attenuated oral vaccine. Clinical and Vaccine Immunology, 2015, 22(7):706-710. |
| [43] | Xiong GS, Husseiny MI, Song LP, Erdreich-Epstein A, Shackleford GM, Seeger RC, Jäckel D, Hensel M, Metelitsa LS. Novel cancer vaccine based on genes of Salmonella pathogenicity island 2. International Journal of Cancer, 2010, 126(11):2622-2634. |
| [44] | Xu X, Hegazy WAH, Guo LJ, Gao XH, Courtney AN, Kurbanov S, Liu DF, Tian GW, Manuel ER, Diamond DJ, Hensel M, Metelitsa LS. Effective cancer vaccine platform based on attenuated Salmonella and a type Ⅲ secretion system. Cancer Research, 2014, 74(21):6260-6270. |
| [45] | Husseiny MI, Rawson J, Kaye A, Nair Ⅰ, Todorov Ⅰ, Hensel M, Kandeel F, Ferreri K. An oral vaccine for type 1 diabetes based on live attenuated Salmonella. Vaccine, 2014, 32(20):2300-2307. |
| [46] | Panthel K, Meinel KM, Domènech VES, Retzbach H, Igwe EI, Hardt WD, Rüssmann H. Salmonella pathogenicity island 2-mediated overexpression of chimeric SspH2 proteins for simultaneous induction of antigen-specific CD4 and CD8 T cells. Infection and Immunity, 2005, 73(1):334-341. |
| [47] | Hegazy WAH, Xu X, Metelitsa L, Hensel M. Evaluation of Salmonella enterica type Ⅲ secretion system effector proteins as carriers for heterologous vaccine antigens. Infection and Immunity, 2012, 80(3):1193-1202. |
| [48] | Wisner AL, Desin TS, Lam PK, Berberov E, Mickael CS, Townsend HG, Potter AA, Köster W. Immunization of chickens with Salmonella enterica subspecies enterica serovar enteritidis pathogenicity island-2 proteins. Veterniary Microbiology, 2011, 153(3/4):274-284. |
| [49] | Reynolds CJ, Jones C, Blohmke CJ, Darton TC, Goudet A, Sergeant R, Maillere B, Pollard AJ, Altmann DM, Boyton RJ. The serodominant secreted effector protein of Salmonella, SseB, is a strong CD4 antigen containing an immunodominant epitope presented by diverse HLA class Ⅱ alleles. Immunology, 2014, 143(3):438-446. |
