彭思露1, 杨慧林1, 2, 朱笃1, 2

 , 张志斌1, 颜日明1, 汪涯2
, 张志斌1, 颜日明1, 汪涯21. 江西师范大学生命科学学院, 江西省亚热带植物资源保护与利用重点实验室, 江西 南昌 330022;
2. 江西科技师范大学生命科学学院, 江西省生物加工过程重点实验室, 江西 南昌 330013
收稿日期: 2015-08-05; 修回日期: 2015-10-11; 网络出版日期: 2015-11-05
基金项目: 国家自然科学基金(31460021);国家"十二五"重大科技支撑项目(2011BAC13B04);江西省自然科学基金(20142BAB214008,20151BAB204003,20151BA204002)
通信作者: E-mail: zhudu12@163.com
摘要: [目的] 阿尔茨海默症治疗药物石杉碱甲(Huperzine A, HupA)的生物合成途径起始于赖氨酸脱羧酶(Lysine decarboxylase, LDC)。本研究克隆及表达了来源于产HupA的植物内生真菌的LDC基因,并研究了其功能。[方法] 采用RT-PCR扩增法,从一株产HupA的蛇足石杉内生真菌Shiraia sp. Slf14获得LDC基因,构建表达质粒pET-22b-LDC与pET-32a-LDC,转化感受态细胞E. coli BL21,加入IPTG至终浓度为1×10-3 mol/L,于24℃、200 r/min培养8 h,诱导表达LDC蛋白质;通过Ni2+金属亲和层析纯化重组LDC并建立酶促反应体系,利用TLC检测了LDC催化活性。利用生物信息学软件分析了LDC的理化性质及蛋白质的空间结构。[结果] 成功克隆并异源表达出重组蛋白LDC与Trx-LDC,经SDS-PAGE电泳鉴定分子量分别为24.4 kDa和42.7 kDa,与预计大小相符。TLC结果表明LDC与Trx-LDC均具有赖氨酸脱羧酶活性。[结论] 本研究从产HupA的蛇足石杉内生真菌Shiraia sp. Slf14中成功克隆到LDC基因并进行了异源表达,检测到了其催化活性,为丰富LDC分子信息及阐明内生真菌中HupA生物合成机制提供参考数据。
关键词: 赖氨酸脱羧酶蛇足石杉内生真菌石杉碱甲克隆及表达酶活性
Molecular cloning, expression and characterization of lysine decarboxylase gene of endophytic fungus Shiraia sp. Slf14 from Huperzia serrata
Silu Peng1, Huilin Yang1, 2, Du Zhu1, 2

 , Zhibin Zhang1, Riming Yan1, Ya Wang2
, Zhibin Zhang1, Riming Yan1, Ya Wang21. Key Laboratory of Protection and Utilization of Subtropic Plant Resources, Jiangxi Normal University, Nanchang 330022, Jiangxi Province, China;
2. Jiangxi Key Laboratory of Bioprocess, Jiangxi Science Technology Normal University, Nanchang 330013, Jiangxi Province, China
Received: 5 August 2015; Revised: 11 October 2015; Pulished online: 5 November 2015
Supported by the National Natural Science Foundation of China (31460021), by the Key Projects in the National Science andTechnology Pillar Program during the Twelfth Five-year Plan Period (2011BAC13B04) and by the Natural Science Foundation ofJiangxi Province (20142BAB214008, 20151BAB204003, 20151BAB204002)
Corresponding author. E-mail: zhudu12@163.com
Abstract:[Objective] Huperzine A (HupA) was approved as a drug for the treatment of Alzheimer's disease. The HupA biosynthetic pathway was started from lysine decarboxylase (LDC), which catalyzes lysine to cadaverine. In this study, we cloned and expressed an LDC gene from a HupA-producing endophytic fungus, and tested LDC activities. [Methods] An endophytic fungus Shiraia sp. Slf14 from Huperzia serrata was used. LDC gene was obtained by RT-PCR, and cloned into pET-22b(+) and pET-32a(+) vectors to construct recombinant plasmids pET-22b-LDC and pET-32a-LDC. These two recombinant plasmids were transformed into E. coli BL21, cultured for 8 h at 24℃, 200 r/min with 1×10-3 mol/L IPTG into medium to express the LDC proteins, respectively. LDC proteins were purified by Ni2+ affinity chromatography. Catalytic activities were measured by Thin Layer Chromatography. At last, the physicochemical properties and structures of these two LDCs were obtained by bioinformatics software. [Results] LDC and Trx-LDC were expressed in E. coli BL21 successfully. SDS-PAGE analysis shows that the molecular weight of LDC and Trx-LDC were 24.4 kDa and 42.7 kDa respectively, which are consistent with bioinformatics analysis. In addition, TLC analysis reveals that both LDC and Trx-LDC had catalytic abilities. [Conclusion] This work can provide fundamental data for enriching LDC molecular information and reveal the HupA biosynthetic pathway in endophytic fungi.
Key words: lysine decarboxylaseendophytic fungus from Huperzia serratahuperzine Acloning and expressionenzyme activity
蛇足石杉[Huperzia serrata (Thunb. ex Murray) Trev.]又名千层塔,为蕨类植物,属石杉科、石杉属。作为中国传统的中草药,蛇足石杉普遍用于治疗跌打损伤、瘀血肿痛、精神分裂等疾病[1]。 蛇足石杉中的石杉碱甲(Huperzine A,Hup A)是1种低毒、高效抑制乙酰胆碱酯酶(AChE)的药物,对治疗“阿尔茨海默症”(Alzaheimer disease,AD)有很好的疗效[2, 3]。此外,石杉碱甲在脑血管性痴呆、神经退行性疾病、认知障碍和抗炎、阵痛等方面的疗效也有报道[4, 5]。
目前Hup A主要来源于蛇足石杉的提取,由于石杉碱甲市场需求日益增大,蛇足石杉被大量采摘,供不应求,且植物来源的石杉碱甲提取工艺复杂且成本高。因此,为了大量获得石杉碱甲以及保护植物资源,探究石杉碱甲的体外合成成为必要。据文献报道,在体外合成石杉碱甲的方法中,化学合成法占很大比例,但缺点是化学合成的石杉碱甲的活性远低于天然石杉碱甲,且得到高光学活性的石杉碱甲成本较高[6, 7, 8]。生物合成石杉碱甲能避免活性降低这一缺陷。石杉碱甲生物合成途径的起始两步反应机制已经阐明(图 1),其中赖氨酸脱羧酶(Lysine decarboxylase,LDC)介导赖氨酸转化为尸胺作为第一步反应,随后铜胺氧化酶(Copper amine oxidase)催化尸胺氧化脱氨生成5-氨基戊醛(5-Aminopentanal),进一步脱水形成△1-Piperideine,再经过一系列反应生成石杉碱甲[9, 10]。目前有少量文献报道成功克隆、表达赖氨酸脱羧酶及相关分析[11, 12, 13, 14],但是未见报道植物内生真菌中的赖氨酸脱羧酶基因功能表征。一些研究者们已经从蛇足石杉中分离得到了产石杉碱甲的内生真菌,并尝试通过添加诱导剂以提高石杉碱甲的产量[15, 16, 17]。本文使用本实验室从蛇足石杉中分离得到的一株产石杉碱甲的内生真菌Shiraia sp. Slf14为研究对象[18, 19, 20],经过全基因组[21] 和转录组测序结果分析后,发现一个赖氨酸脱羧酶基因,随后采用RT-PCR的方法克隆出赖氨酸脱羧酶基因,进行异源表达、酶活性分析以及生物信息学分析,为阐明内生真菌石杉碱甲生物合成机制提供参考数据。
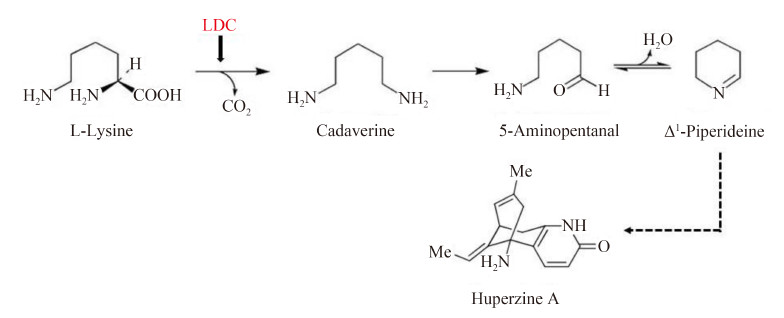 |
| 图 1. 石杉碱甲生物合成起始反应[10] Figure 1. Proposed biosynthetic pathway of Hup A from Lysine to △1-Piperideine[10]. |
| 图选项 |
1 材料和方法 1.1 材料 1.1.1 菌株与质粒: 内生真菌Shiraia sp. Slf14为本实验室前期从江西省庐山自然保护区采取的蛇 足石杉中分离得到,接种于PDA斜面培养基,27 ℃培养4-7 d后,4 ℃保存;E. coli DH5α、E. coli BL21(DE3)购自北京天根生化科技有限公司;质粒pET-32a(+)、pET-22b(+)由本实验室保藏,质粒pET-22b(+)中含有T7启动子可在T7噬菌体聚合酶的作用下启动蛋白表达,及C端His标签序列可用于后续的目的蛋白质纯化;pET-32a(+)除上述T7启动子和His标签外,还含有109个氨基酸Trx标签序列,能够获得融合表达蛋白质,同时融合蛋白包含有His标签,可以用于蛋白表达检测和纯 化过程;质粒pMD?19-T (simple) 购自TaKaRa 公司。
1.1.2 酶和试剂: Ex Taq DNA聚合酶,T4 DNA 连接酶,Nco Ι、Xho I、Nde I限制性内切酶,DL2000 DNA marker,Protein molecular weight marker (Low),RNAiso Plus,反转录试剂盒PrimeScriptTM reagent Kit with gDNA Eraser均购自TaKaRa公司;E.Z.N.A cycle-pure kit、Plasmid Mini Kit I、Gel Extraction Kit购自美国OMEGA公司;IPTG购自上海生工生物工程有限公司;亲和层析柱HisTrapTM FF购自GE Healthcare公司;赖氨酸、尸胺、磷酸吡哆醛、丹磺酰氯购自Sigma 公司。
1.2 Shiraia sp. Slf14总RNA的提取及cDNA的合成 液氮研磨液体发酵培养后得到的菌体,向研钵中加入适量RNAiso Plus,充分匀浆。按照RNAiso Plus说明书提取Shiraia sp. Slf14的总RNA并除去可能存在的DNA,采用1%的琼脂糖凝胶电泳检测RNA质量,总RNA保存于-20 ℃冰箱中。以提取的总RNA为模板,利用PrimeScript 反转录试剂盒,按其说明书操作流程,反转录合成cDNA。
1.3 赖氨酸脱羧酶基因(LDC)的克隆与测序 根据Shiraia sp. Slf14全基因组测序结果(GenBank No. AXZNrh20160413),预测出该真菌的LDC基因(GenBank No. KT362170)。采用Primer 5软件设计2对包含LDC基因的扩增引物F1、R1和 F2、R2(表 1)。以cDNA为模板,分别用F1、R1和F2、R2两对引物PCR扩增LDC基因,所得基因片段分别以LDCa、LDCb表示,反应体系如下:TaKaRa Ex Taq (5 U/μL) 0.25 μL,10×Ex Taq Buffer (Mg2+ Plus) 5.0 μL,dNTPs Mixture (各2.5×10-3 mol/L) 4 μL,模板 cDNA 1 μL,引物F1/F2 (1×10-5 mol/L) 和引物R1/R2 (1×10-5 mol/L) 各2 μL,补加灭菌蒸馏水至终体积50 μL;PCR反应程序:95 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min,琼脂糖凝胶电泳检测扩增结果。
表 1. 所用引物序列 Table 1. Primers used in this study
| Vectors | Primers | Primer sequence (5′→3′) | Restriction enzyme |
| Underlined bold nucleotides: restriction enzyme recognition sites | |||
| pET22b(+) | F1 | GGAATTCCATATGTCGACCAACAACGAAGTTACCG | Nde I |
| R1 | CCGCTCGAGCTGCTGATCCCAGGTCAAGTCGAAG | Xho I | |
| pET32a(+) | F2 | CATGCCATGGCGACCAACAACGAAGTTACCG | Nco I |
| R2 | CCGCTCGAGCTGCTGATCCCAGGTCAAGTCGAAG | Xho I | |
表选项
在紫外灯下切下带有目的条带胶块,利用Gel Extraction Kit回收PCR产物,琼脂糖凝胶电泳检测纯化结果。按照pMD?19-T 说明书连接T载体与纯化后的DNA片段,即T-LDC a、T-LDC b,并分别转化E. coli DH5α,通过氨苄青霉素筛选挑取阳性克隆进行PCR检测,从检测合格的重组菌株中提取质粒,送至华大基因测序。
1.4 赖氨酸脱羧酶基因的原核表达及产物纯化 本研究利用质粒pET-32a(+)、pET-22b(+)构建了2个重组表达载体,即pET-22b-LDC与pET-32a-LDC(图 2)。用限制性内切酶Nde I、Xho I双酶 切1.3中的重组质粒T-LDC a和表达载体pET-22b(+),用Nco I、Xho I双酶切T-LDC b和pET-32a(+)。琼脂糖凝胶电泳检测酶切结果,分别切胶回收2对表达载体与目的基因,使用Gel Extraction Kit进行纯化后,利用T4 DNA连接酶于4 ℃分别过夜连接2对纯化产物,将连接产物转化E. coli BL21(DE3),37 ℃过夜培养,在氨苄抗性平板上筛选转化子。挑取阳性克隆子进行PCR检测,并分别进行Nde I、Xho I和Nco I、Xho I双酶切及测序鉴定。
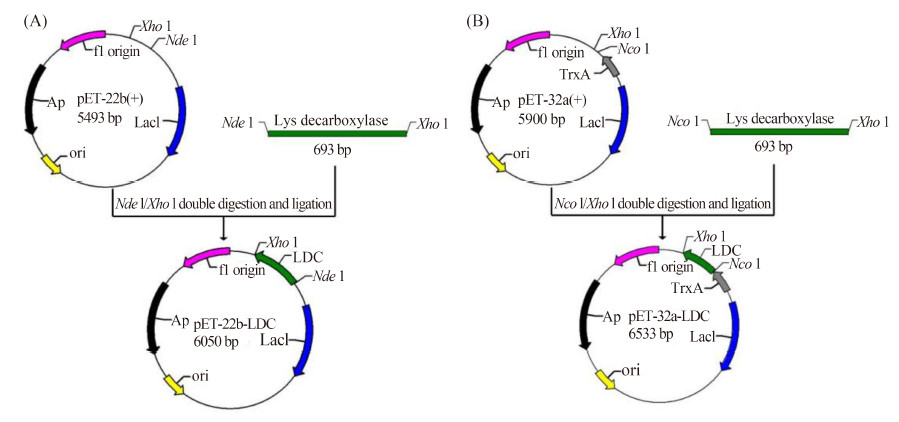 |
| 图 2. 重组质粒pET-22b-LDC与pET-32a-LDC的构建 Figure 2. Construction of recombinant plasmids pET-22b-LDC and pET-32a-LDC. A: Construction of pET-22b-LDC; B: Construction of pET-32a-LDC. |
| 图选项 |
将鉴定正确的阳性克隆子接种至LB液体培养基,于37 ℃、200 r/min培养至OD600约0.7;加入IPTG至终浓度为1×10-3 mol/L,于24 ℃、200 r/min培养8 h;同时分别以含空载体的E. coli BL21/pET-22b (+)、E. coli BL21/pET-32a(+)作对照。诱导结束后,将发酵液于4 ℃、5000 r/min离心5 min,收集菌体,用TE 缓冲液洗涤。菌体重悬于裂解缓冲液后,用超声破碎仪破碎细胞,12000 r/min离心15 min,上清液经过HisTrapTM FF亲和层析柱纯化,SDS-PAGE电泳检测结果。
1.5 重组赖氨酸脱羧酶的活性检测 参照杜次等[14]方法,配制酶反应体系,以沸水浴5 min后失活的蛋白质为对照组,于37 ℃ 水浴锅中反应至出现浑浊后,加入1滴浓HCl终止反应,加入500 μL 氯仿剧烈振荡,5000 r/min 离心10 min弃去不溶物。40 ℃干燥后用1 mol/L 的HCl溶解两相残留物,将溶解后的上清同时与赖氨酸和尸胺标准品用丹磺酰氯进行衍生[22],随后进行薄层层析(TLC) 检测,展开剂为氯仿、乙醚、三乙胺(10∶1∶2)。
1.6 重组赖氨酸脱羧酶的生物信息学分析 采用在线工具Protparam预测蛋白质的理化性质;采用Bioinformatics Group软件(http://bioinf.cs.ucl.ac.uk/psipred/)和SWISS-MODEL(http://swissmodel.expasy.org/)分析蛋白质高级结构。
本文总共选择了19个不同种属的植物及真菌的LDC氨基酸序列与Shiraia sp. Slf14进行比对,采用软件ClustalX比较氨基酸序列,比对结果采用软件MEGA 5.0和Neighbor-Joining方法构建系统进化树,bootstrap test 设置为1000个重复以检测内部分支的可靠性和进化树的有效性。
2 结果和分析 2.1 赖氨酸脱羧酶基因的克隆及表达 以Shiraia sp. Slf14的RNA反转录得到的cDNA为模板,PCR扩增得到690 bp左右的片段 (图 3),符合预测片段长度。将纯化的目的片段克隆到pMD19-T中,挑取阳性克隆提取质粒,双酶切后分别连接于pET-22b(+)、pET-32a(+),获得了pET-22b-LDC与pET-32a-LDC重组质粒。
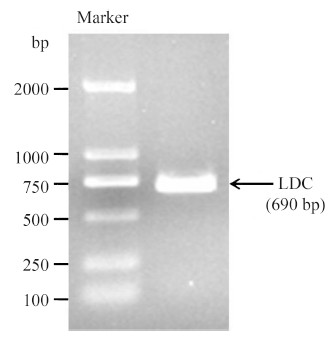 |
| 图 3. LDC基因RT-PCR产物电泳图 Figure 3. Agarose gel electrophoresis for RT-PCR products of LDC gene. |
| 图选项 |
重组质粒pET-22b-LDC与pET-32a-LDC转化到E. coli BL21,经IPTG诱导表达相应的蛋白质,分别产生了24 kDa和43 kDa左右的蛋白质,与预测大小相符(图 4)。SDS-PAGE分析表明超声波破碎后菌液的上清蛋白含量比沉淀要少,该蛋白的可溶性不佳,即使添加促融标签Trx后可溶性也没有得到改善。利用HisTrapTM FF柱层析纯化重组蛋白得到LDC和Trx-LDC,用于后续的赖氨酸脱羧酶催化活性检测。
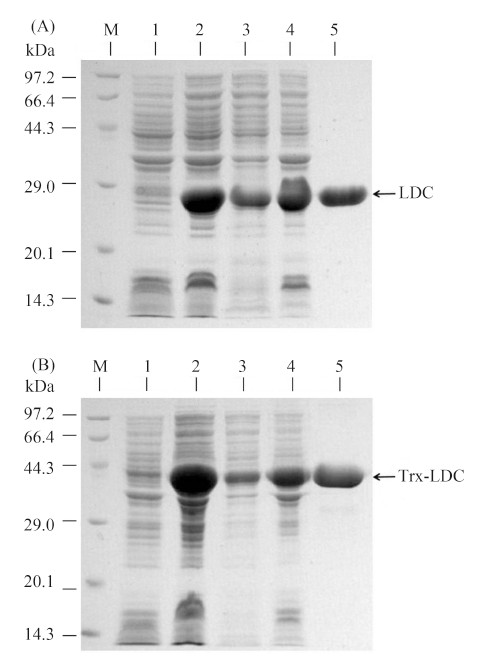 |
| 图 4. 重组蛋白质的SDS-PAGE电泳图 Figure 4. SDS-PAGE analysis of recombinant proteins. A: pET22b-LDC; B: pET32a-LDC; M: marker; lane 1: control; lane 2: total protein; lane 3: supernatant; lane 4: precipitation; lane 5: purification. |
| 图选项 |
2.2 重组赖氨酸脱羧酶的活性鉴定 根据1.5的方法,将衍生后的尸胺、赖氨酸标准品和反应体系利用薄层色谱法(TLC)分析,分别以相应的失活蛋白质做对照,在相同的反应条件下,LDC和Trx-LDC均有尸胺生成,而对照组无尸胺生成,表明两者都有催化活性。同时,我们发现还有赖氨酸底物并没有完全转化成尸胺,表明赖氨酸脱羧酶催化活性不是很高。此外,LDC和Trx-LDC催化生成尸胺量相差不大,说明两者酶催化活性相似(图 5)。
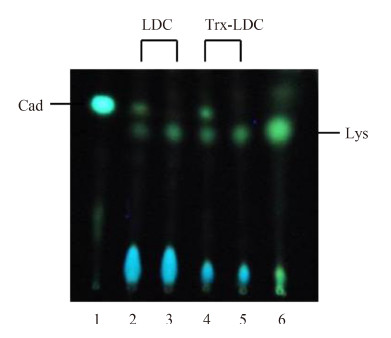 |
| 图 5. 表达产物LDC和Trx-LDC活性的TLC检测 Figure 5. TLC detection of expressed protein LDC and Trx-LDC activities. Lane 1: cadaverine (Cad); lane 2, 4: production of Lys decarboxy reaction catalyzed by LDC/Trx-LDC respectively; lane 3, 5: production of Lys decarboxy reaction catalyzed by boiled LDC/Trx-LDC respectively; lane 6: L-Lysine. |
| 图选项 |
2.3 重组赖氨酸脱羧酶的理化性质分析 该赖氨酸脱羧酶基因编码228个氨基酸,其中带正电荷的氨基酸残基(Arg+Lys)总数为15,带负电荷的残基(Asp+Glu)总数为24;理论等电点pI为5.2预测该蛋白质的分子式为C1071H1679N295 O334S11,分子量为24.4 kDa;该蛋白质的半衰期在大肠杆菌体内大于10 h;由不稳定指数为32.65可知此蛋白质为稳定性蛋白;由亲疏水性分析可知,该蛋白为亲水性蛋白质(图 6)。
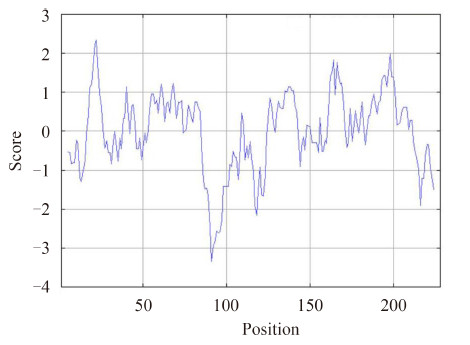 |
| 图 6. 克隆基因的表达产物的亲/疏水性分析 Figure 6. Hydrophilicity/hydrophobicity analysis of cloned gene expression. website: http://www.expasy.org/cgi-bin/protscale.pl. |
| 图选项 |
2.4 重组赖氨酸脱羧酶的二级结构 通过在线软件预测的表达产物的二级和三级结构(图 7,图 8)表明,表达产物中存在较丰富的α螺旋与β折叠结构,且呈相互间隔分布状态;其中具体比例为:α螺旋37.3%,β 折叠11.4%,无规则卷曲51.3%。三级结构表明表达产物为二聚体结构,且N端肽链暴露在蛋白表面,主要通过C端肽链相互作用形成二聚体。此外,根据系统进化树分析,在所选择的参考序列中,Shiraia sp. Slf14的LDC与来源于Aspergillus clavatus NRRL 1的相应蛋白的氨基酸序列相似度最高,而和来源于Cryptococcus neoformans var. grubii H99、Oryza sativa Japonica Group和Chlamydomonas reinhardtii等 的LDC氨基酸序列有较大的区别(图 9)。另一方面,来源于Shiraia sp. Slf14的LDC氨基酸序列和来自宿主植物Huperzia serrata的2个序列有很大的差异。
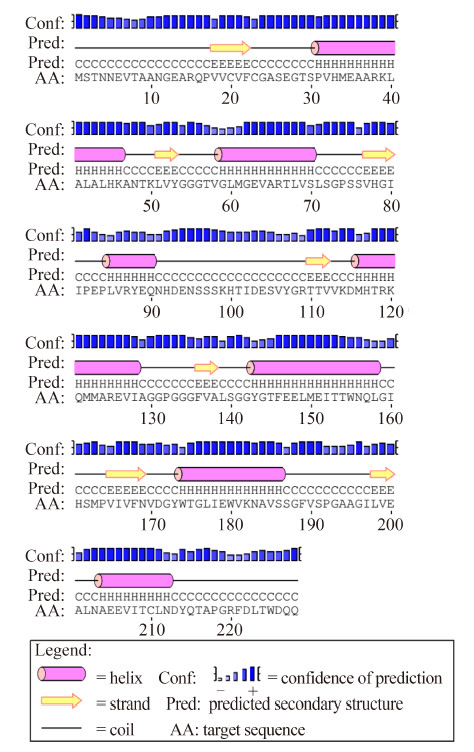 |
| 图 7. 预测的赖氨酸脱羧酶二级结构 Figure 7. Predicted secondary structure of cloned gene expression. website: http://bioinf.cs.ucl.ac.uk/psipred/. |
| 图选项 |
 |
| 图 8. 克隆基因的表达产物三级结构预测 Figure 8. Predicted tertiary structure of cloned gene expression. |
| 图选项 |
 |
| 图 9. 基于氨基酸序列的植物和真菌赖氨酸脱羧酶系统进化树分析 Figure 9. Phylogenetic tree based on neighbor-joining analysis of amino acid sequence of fungi and plants LDC. LDC of Shiraia sp. Slf14 is highlighted by an arrow. Bootstrap values (%) out of 1000 resamplings are at each node. The tree is drawn to scale, with branch lengths in the same units as those of the evolutionary distances used to infer the phylogenetic tree. The evolutionary distances are in the units of number of amino acid substitutions per site. The indicated scale represents 0.2 amino acid substitutions per site. Each accession number of LDC amino acid sequences of fungi and plants is in each bracket. |
| 图选项 |
3 讨论 尽管天然石杉碱甲有巨大的药用前景,但是蛇足石杉内的石杉碱甲含量甚少,且提取工艺繁琐成本较高[1]。虽然化学合成石杉碱甲已有研究成果,但是其活性不高,因此探明石杉碱甲生物合成途径亟待解决[6, 7]。在石杉碱甲生物合成途径中介导第一、二步反应的赖氨酸脱羧酶(LDC)及铜胺氧化酶(CAO),目前只有少量文献报道成功从蛇足石杉内克隆及异源表达LDC[14]与CAO[10],未见报道克隆及表达内生真菌中的LDC。本文首次从产石杉碱甲的蛇足石杉内生真菌Shiraia sp. Slf14中克隆并体外表达出LDC。
为了研究融合蛋白标签TrxA是否会显著提高LDC蛋白的可溶性及影响LDC的催化活性,本文将LDC基因分别连接到2个表达载体即pET-22b(+)与pET-32a(+)中进行异源表达。结果表明:有无TrxA蛋白标签对表达的LDC蛋白的可溶性及催化活性方面没有明显差别。杜次等[14]从蛇足石杉中克隆出2个LDC基因即LDC1、LDC2,与之相比较,在理化性质方面本文克隆出的LDC与LDC2有较大差异,与LDC1较为相似;在二级结构方面,三者的α螺旋与β折叠结构所占比例趋势一致,但是具体比例数值相差较大;在酶活性方面,3个酶催化赖氨酸生成尸胺的活性均较低。Bunsupa等[9]通过定点突变发现在豆科植物的LDC中Phe-344氨基酸残基不仅在接受L-Lys为底物中发挥重要作用;而且该位点的氨基酸残基突变可能会影响整个LDC蛋白结构从而改变酶学性质。然而,少有文献报道真菌LDC的空间结构和保守序列,因此精确的真菌LDC催化赖氨酸合成尸胺反应机制有待进一步阐明。
此外,根据系统进化树分析,在所选择的参考序列中,Shiraia sp. Slf14的LDC与来源于Aspergillus clavatus NRRL 1的相应蛋白的氨基酸序列相似度最高,而和来源于Cryptococcus neoformans var. grubii H99、Oryza sativa japonica group和Chlamydomonas reinhardtii等的LDC氨基酸序列有较大的区别。另一方面,来源于Shiraia sp. Slf14的LDC氨基酸序列和来自宿主植物Huperzia serrata的2个序列有很大的差异。
参考文献
| [1] | Ma XQ, Tan CH, Zhu DY, Gang DR, Xiao PG. Huperzine A from Huperzia species-an ethnopharmacolgical review. Journal of Ethnopharmacology, 2007, 113(1):15-34. |
| [2] | Huang XT, Qian ZM, He X, Gong Q, Wu KC, Jiang LR, Lu LN, Zhu ZJ, Zhang HY, Yung WH, Ke Y. Reducing iron in the brain:a novel pharmacologic mechanism of huperzine A in the treatment of Alzheimer's disease. Neurobiology of Aging, 2014, 35(5):1045-1054. |
| [3] | Wang R, Yan H, Tang XC. Progress in studies of huperzine A, a natural cholinesterase inhibitor from Chinese herbal medicine. Acta Pharmacologica Sinica, 2006, 27(1):1-26. |
| [4] | Yang Y, Yang J, Jiang Q. The protective effect of huperzine A against hepatic ischemia reperfusion injury in mice. Transplantation Proceedings, 2014, 46(5):1573-1577. |
| [5] | Sui X, Gao C. Huperzine A ameliorates damage induced by acute myocardial infarction in rats through antioxidant, anti-apoptotic and anti-inflammatory mechanisms. International Journal of Molecular Medicine, 2014, 33(1):227-233. |
| [6] | Sohel SMA, Opatz T. Synthetic approaches towards huperzine A and B. Arkivoc, 2014, (i):92-108. |
| [7] | Zheng SY, Yu CH, Shen ZW. Progresses in the total synthesis of huperzine A. Chinese Journal of Organic Chemistry, 2013, 33(11):2261-2270. (in Chinese) 郑书岩, 郁春辉, 沈征武. 石杉碱甲的合成研究进展. 有机化学, 2013, 33(11):2261-2270. |
| [8] | Tudhope SR, Bellamy JA, Ball A, Rajasekar D, Azadi-Ardakani M, Meera HS, Gnanadeepam JM, Saiganesh R, Gibson F, He LL, Behrens CH, Underiner G, Marfurt J, Favre N. Development of a large-scale synthetic route to manufacture (-)-huperzine A. Organic Process Research & Development, 2012, 16(4):635-642. |
| [9] | Bunsupa S, Katayama K, Ikeura E, Oikawa A, Toyooka K, Saito K, Yamazaki M. Lysine decarboxylase catalyzes the first step of quinolizidine alkaloid biosynthesis and coevolved with alkaloid production in Leguminosae. The Plant Cell, 2012, 24(3):1202-1216. |
| [10] | Sun JY, Morita H, Chen GS, Noguchi H, Abe I. Molecular cloning and characterization of copper amine oxidase from Huperzia serrata. Bioorganic & Medicinal Chemistry Letters, 2012, 22(18):5784-5790. |
| [11] | Tang X, Cai CB, Luo XX, Zhou JR, Wu YJ. Cloning and sequence analysis of Bacillus subtilis BJ3-2 lysine decarboxylase gene yaaO. China Brewing, 2014, 33(12):116-120. (in Chinese) 唐雪, 蔡传斌, 罗信旭, 周景瑞, 吴拥军. 枯草芽孢杆菌BJ3-2赖氨酸脱羧酶基因yaaO的克隆与序列分析. 中国酿造, 2014, 33(12):116-120. |
| [12] | Jian X, Miao YM, Sui YH, Bian ZW, Chen CK, Huang CJ, Li ZX. Cloning and expression vector construction of cucumber LDC and transformation to tabacco. Guihaia, 2015, 35(2):255-260. (in Chinese) 简兴, 苗永美, 隋益虎, 边卓吾, 陈存款, 黄春景, 李振兴. 黄瓜LDC克隆、表达载体的构建及烟草转化研究. 广西植物, 2015, 35(2):255-260. |
| [13] | Li NQ, Chou H, Yu LJ, Xu Y. Cadaverine production by heterologous expression of Klebsiella oxytoca lysine decarboxylase. Biotechnology and Bioprocess Engineering, 2014, 19(6):965-972. |
| [14] | Du C, Li J, Tang YT, Peng QZ. Cloning, prokaryotic expression and characterization of lysine decarboxylase gene from Huperzia serrata. Chinese Journal of Biotechnology, 2014, 30(8):1299-1307. (in Chinese) 杜次, 李菁, 唐云涛, 彭清忠. 蛇足石杉赖氨酸脱羧酶基因的克隆、原核表达及其功能分析. 生物工程学报, 2014, 30(8):1299-1307. |
| [15] | Shu SH, Zhao XM, Wang WJ, Zhang GW, Cosoveanu A, Ahn Y, Wang M. Identification of a novel endophytic fungus from Huperzia serrata which produces huperzine A. World Journal of Microbiology and Biotechnology, 2014, 30(12):3101-3109. |
| [16] | Su JQ, Huang B, Qiu H, Yan LM, Zhang JC, Yang MH. Alkaloid and huperzine A-producing endophytic fungi isolated from Huperzia serrata. Chinese Pharmaceutical Journal, 2011, 46(19):1477-1481. (in Chinese) 苏经迁, 黄彬, 邱慧, 颜玲妹, 张君诚, 杨民和. 产生物碱和石杉碱甲蛇足石杉内生真菌的初步研究. 中国药学杂志, 2011, 46(19):1477-1481. |
| [17] | Yan RM, Zhang ZB, Wang Y, Yang YL, Zeng QG, Zhu D. Efficient strategy for maintaining and enhancing the huperzine A production of Shiraia sp. Slf14 through inducer elicitation. Journal of Industrial Microbiology & Biotechnology, 2014, 41(7):1175-1179. |
| [18] | Zhu D, Wang J, Zeng Q, Zhang ZB, Yan R. A novel endophytic huperzine A-producing fungus, Shiraia sp. Slf14, isolated from Huperzia serrata. Journal of Applied Microbiology, 2010, 109(4):1469-1478. |
| [19] | Wang Y, Zeng QG, Zhang ZB, Yan RM, Wang LY, Zhu D. Isolation and characterization of endophytic huperzine A-producing fungi from Huperzia serrata. Journal of Industrial Microbiology & Biotechnology, 2011, 38(9):1267-1278. |
| [20] | Wang Y, Yan RM, Zeng QG, Zhang ZB, Wang D, Zhu D. Producing huperzine A by an endophytic fungus from Huperzia serrata. Mycosystema, 2011, 30(2):255-262. (in Chinese) 汪涯, 颜日明, 曾庆桂, 张志斌, 汪娣, 朱笃. 一株产石杉碱甲的蛇足石杉内生真菌的分离和鉴定. 菌物学报, 2011, 30(2):255-262. |
| [21] | Yang HL, Wang Y, Zhang ZB, Yan RM, Zhu D. Whole-genome shotgun assembly and analysis of the genome of Shiraia sp. strain Slf14, a novel endophytic fungus producing huperzine A and hypocrellin A. Genome Announcements, 2014, 2(1), doi:10.1128/genomeA.00011-14. |
| [22] | Wang FQ, Liu F, Meng Y, Wang DY, Zhu YZ, Xu WM. Biogenic amines in salted duck analyzed by TLC combined with HPLC. Food Science, 2011, 32(14):273-276. (in Chinese) 王凤芹, 刘芳, 孟勇, 王道营, 诸永志, 徐为民. TLC和HPLC法相结合分析盐水鸭中的生物胺. 食品科学, 2011, 32(14):273-276. |
| [23] | Liang ZQ. The diversity of fungal secondary metabolites and their potential applications value. Chinese Biodiversity, 1999, 7(2):145-150. (in Chinese) 梁宗琦. 真菌次生代谢产物多样性及其潜在应用价值. 生物多样性, 1999, 7(2):145-150. |
| [24] | Sun RF, Ran XQ, Wang JF. Isolation and identification of a taxol-producing endophytic fungus from podocrapus. Acta Microbiologica Sinica, 2008, 48(5):589-595. (in Chinese) 孙端方, 冉雪琴, 王嘉福. 一株产紫杉醇罗汉松内生真菌的分离和鉴定. 微生物学报, 2008, 48(5):589-595. |
