盛志, 陈凯

 , 李旭
, 李旭沈阳化工研究院有限公司,辽宁 沈阳 110021
收稿日期:2015-09-27; 修回日期:2015-11-30; 网络出版日期:2016-01-07
通讯作者:陈凯,Tel:+86-24-85869279;E-mail:chenkai05@sinochem.com
摘要: 多杀菌素是在刺糖多胞菌发酵液中提取的一种大环内酯类生物杀虫剂,它对靶标昆虫具有独特的快速触杀和摄食毒性,兼具化学农药的速效性和生物农药的安全性,具有低残留、快速降解等优点。本文介绍了多杀菌素的生物合成途径和体外合成方法,对随机诱变、代谢工程定向改造等刺糖多孢菌工业菌株育种方法进行了介绍,对多杀菌素在异源宿主中的合成进行了讨论。
关键词: 多杀菌素刺糖多孢菌生物农药生物合成
Advances in the biosynthesis of spinosad-A review
Zhi Sheng, Kai Chen

 , Xu Li
, Xu LiShenyang Research Institute of Chemical Industry Co., Ltd, Shenyang 110021, Liaoning Province, China
Abstract:Spinosad, extracted from Saccharopolyspora spinosa, one of the most successful commercial bioinsecticides, is derived from a family of macrocyclic lactones. It shows excellent potent insecticidal activities, low residue, and low environmental effect. Here, we reviewed the biosynthetic pathway of spinosad, the chemoenzymatic method of spinosad synthesis, and the strain improvement method and the heterologous expression of spinosad.
Key words: spinosadSaccharopolyspora spinosabiopesticidebiosynthesis
刺糖多胞菌(Saccharopolyspora spinosa)是最初由礼来公司的化学家从一个废弃的酿酒场分离出的一种土壤放线菌,多杀菌素是在刺糖多胞菌发酵液中提取的一种大环内酯类生物杀虫剂[1]。多杀菌素(Spinosad)包含多种结构类似的组分,其主要活性成分是组分A (Spinosyn A)和组分D (Spinosyn D)[2],组分A约占85%,组分D约占15%。多杀菌素组分A和组分D的结构如图 1所示[3],组分A与组分D的差异在于C6上的取代基R,组分A上连接的是甲基,组分D上连接的是氢。
 |
| 图 1. 多杀菌素A和D的结构 Figure 1. Structure of spinosyn A and D. |
| 图选项 |
多杀菌素对靶标昆虫具有独特的快速触杀和摄食毒性,可以有效防治小菜蛾、甜菜夜蛾等多种鳞翅目害虫,而对哺乳类、鸟类等几乎没有毒性[4]。相比于其他杀虫农药,多杀菌素兼具化学农药的速效性和生物农药的安全性,具有低残留、快速降解等优点。多杀菌素继1999年获得美国“总统绿色化学品挑战奖”后,2008年其衍生物乙基多杀菌素再一次获得该奖[5]。多杀菌素类杀虫农药的市场份额在2012年就已经高达4亿多美元(包括多杀菌素2.6亿美元以及乙基多杀菌素1.65亿美元)[6]。
目前,多杀菌素仍由刺糖多孢菌通过有氧发酵进行生产。但由于刺糖多孢菌发酵单位产量低、副产物多、提取步骤复杂、产品收率低等因素导致其生产成本较高,制约了多杀菌素的推广应用。市场上销售的多杀菌素产品及原料药基本都是美国陶氏益农公司的产品,国内多杀菌素原料药的生产还无法与之竞争。本文主要对多杀菌素的合成途径、育种方法等进行了介绍。
1 多杀菌素的合成 1.1 多杀菌素的生物合成途径 合成多杀菌素的基因簇共有23个基因,长约80 kb (图 2)[7, 8]。其中spnA、spnB、spnC、spnD、spnE基因是聚酮合酶(Polyketide Synthase,PKS)的基因,负责合成大环内酯骨架。spnJ、spnM、spnF、spnL基因负责修饰大环内酯糖苷配基。spnG、spnH、spnI、spnK基因负责鼠李糖基团的连接和甲基化。spnO、spnN、spnQ、spnR、spnS、spnP基因负责合成和连接福乐糖胺基团。多杀菌素基因簇上除了上述基因外还有其他几个开放阅读框(Open Reading Frame,ORF),包括ORF-L15、ORF-L16、ORF-R1、ORF-R2等,这些开放阅读框与多杀菌素的合成无关。而与鼠李糖合成相关的gtt、gdh、kre、epi基因不在基因簇上,存在于刺糖多孢菌基因组上的其他位置。
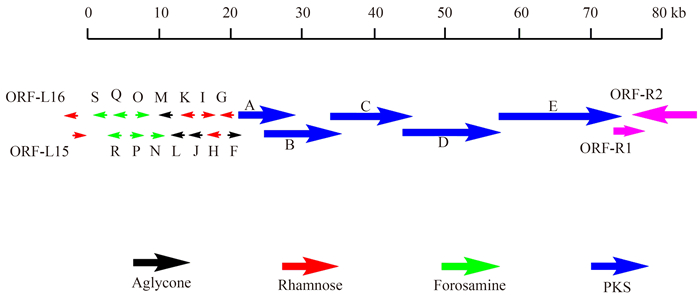 |
| 图 2. 多杀菌素的生物合成基因簇 Figure 2. Spinosyn biosynthetic gene cluster. |
| 图选项 |
虽然多杀菌素的生物合成途径早已阐述清楚,然而多杀菌素生物合成中的一些修饰步骤的详细机理是最近才弄清,如不同的酶在多杀菌素合成中的作用,催化反应的顺序等,且发现许多基因的功能与它们最初被注释的功能不同[9]。多杀菌素的生物合成包括大环内脂的合成和修饰,鼠李糖及福乐糖胺的合成与连接等环节。首先是聚酮链的生物合成,合成途径如图 3所示[10]。开始是在起始单元丙酸上逐步缩合和修饰酰基前体,按照A-A-P-A-A-A-A-A- A-A(A-乙酰,P-丙酰)的顺序添加10个酰基,形成线性的聚酮链,然后再环化。PKS包含1个装载模块(Loading Module)和10个延伸模块(Elongation Module),这些模块的基因按顺序头尾相连,分属5个同一转录方向的基因spnA、spnB、spnC、spnD、spnE,全长约56 kb。PKS的第1个基因spnA编码装载模块和第1个延伸模块,这个延伸模块编码的功能域有:酮酰合成酶(Ketoacylsynthase,KS)、酰基转移酶(Acyltransferase,AT)、酮还原酶(Ketoreductase,KR)和酰基载体蛋白(Acyl Carrier Protein,ACP);第2个基因spnB编码第2个延伸模块,具有全套功能域KS、AT、脱水酶(Dehydratase,DH)、烯醇还原酶(Enoylreductase,ER)、KR和ACP;第3个基因spnC编码模块3和模块4,这2个模块具有KS、AT、KR和ACP功能域;第4个基因spnD编码延伸模块5、模块6和模块7,模块5包括KS、AT、DH、KR和ACP,模块6包括KS、AT、KR和ACP,模块7包括KS、AT、KR和ACP;第5个基因spnE编码延伸模块8、模块9和模块10,这3个模块均具有KS、AT、DH、KR和ACP。spnE还编码硫酯酶结构域(Thioesterase,TE)。刺糖多孢菌的大多数酰基转移酶(AT结构域)都只掺入乙酰基团,但起始装载模块和延伸模块3的AT序列中具有掺入丙酰基团的结构域,模块8的AT结构域也类似于丙酰基团的掺入结构域,但仍以掺入乙酰基团为主,掺入丙酰基团的比例不足20%。当模块8掺入丙酰基团时则产生Spinosyn D,当模块8掺入乙酰基团时则产生Spinosyn A。
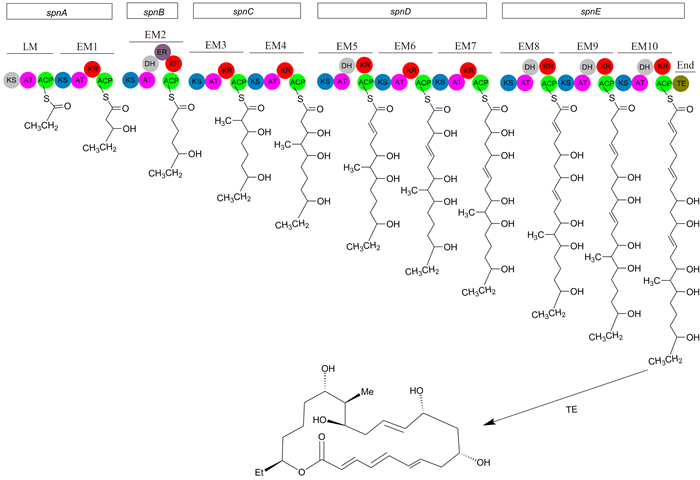 |
| 图 3. 聚酮环的生物合成途径 Figure 3. Biosynthetic pathway of polyketide. LM: Loading Module; EM: Elongation Module. |
| 图选项 |
NDP-鼠李糖和NDP-二甲基福乐糖胺的合成如图 4所示[11]。负责合成鼠李糖基团的酶有4种:TDP葡萄糖合成酶(Gtt)、葡萄糖脱氢酶(Gdh)、3-5异构酶(Epi)和酮还原酶(Kre)。这4个酶将葡萄糖-1-磷酸(2)转换为TDP-L-鼠李糖(6)。编码这4个酶的基因并不在多杀菌素生物合成基因簇上,这4个基因同时还负责细胞壁中鼠李糖的合成。从NDP-4-酮-6-脱氧葡萄糖(4)生成NDP-二甲基福乐糖胺(11)是由2,3-脱氢酶(SpnO)、3-酮还原酶(SpnN)、3,4-脱氢酶(SpnQ)、转氨酶(SpnR)和二甲基转移酶(SpnS)催化,相关基因均包含在多杀菌素生物合成基因簇中[12, 13]。
 |
| 图 4. NDP-鼠李糖和NDP-二甲基福乐糖胺的生物合成途径 Figure 4. Biosynthetic pathway of NDP-L-rhamnose and NDP-D-forosamine. |
| 图选项 |
最后,合成完整的多杀菌素的途径如图 5所示[11]。大环内酯1从PKS的酰基转移蛋白上脱落下来后就开始了糖基化修饰。单环中间体1首先在SpnJ的催化下在C15位置发生脱氢反应(1→12)[14],这个反应促发了下一步SpnM催化的1,4-脱氢反应(12→13),中间体13可以在SpnF的催化下发生跨环[4+2]-环化加成反应(13→14)。因为SpnF是目前唯一一个被认为是催化Diels-Alder反应的酶,因此这个反应受到了广泛关注[15, 16]。C3和C14之间形成第2个闭合五元环的Rauhut-Currier环化反应(15→16)是SpnL催化的,这个反应发生在SpnG催化的TDP-鼠李糖6与中间体14的连接之后(14→15)[17]。SpnH,SpnI和SpnK是依赖S-腺苷-L-甲硫氨酸(S-Adenosyl-L-Methionine,SAM)的甲基转移酶。连有鼠李糖基的中间体16在SpnI的催化下在鼠李糖的2-OH基上连接一个甲基,在SpnK的催化下在鼠李糖的3-OH基上连接一个甲基,在SpnH的催化下在鼠李糖的4-OH基上连接一个甲基,从而得到拟糖苷(Pseudoaglycone) 17[18, 19]。
 |
| 图 5. 多杀菌素合成途径 Figure 5. Biosynthetic pathway of spinosyn A. |
| 图选项 |
1.2 多杀菌素的体外合成 多杀菌素高度复杂且独特的结构使其很难进行化学合成。Evans等[20]用Diels-Alder反应第一次对多杀菌素类化合物进行了化学全合成,但由于没有建立严格的立体化学方法,得到的是多杀菌素的对映异构体形式(+)-A83543A。后来,Paquette等[20, 21, 22, 23]成功开发出了合成天然的左旋Spinosyn A的方法。与生物合成相比,化学合成已经开发出了一系列成熟的方法和工具,应用化学合成方法可以很快地开发新的化合物衍生物或类似物,而且在合成对细胞有毒性的物质上比生物合成更有优势。然而在其他方面,生物合成的优势更明显,生物合成的中间体往往不用进行纯化就可以进行下一步反应,可以实现一锅反应(One-Pot Reaction);生物合成往往可以避免化学合成中复杂的“保护”和“去保护”操作;生物酶促反应的产物多数是具有生物活性的单一消旋体,不用考虑异构体等问题。综合考虑化学合成和生物合成的优缺点,Kim等[10]应用化学-生物酶耦合的方法成功地在体外合成了多杀菌素。他们首先用化学法合成了多杀菌素的聚酮骨架大环内酯11,然后用一系列的酶将大环内酯11合成为拟糖苷17,最后用BF3·OEt2处理拟糖苷17和D-福乐糖胺,得到多杀菌素18。虽然,目前这种化学-生物酶耦合的合成方法还远远不能取代依靠刺糖多孢菌发酵来生产多杀菌素的生物合成方法,但相关技术在未来有很好的发展前景。而且体外构建合成途径的研究也有助于了解多杀菌素合成途径中相关酶的催化反应的静态反应速率,为系统代谢工程的基因改造提供指导[24]。
2 刺糖多孢菌高产育种 2.1 诱变育种诱变是一种经典的育种方法,在提高抗生素等次级代谢物的产量上起到重要作用。刺糖多孢菌菌种选育中常用的诱变方法有:紫外(UV)诱变,氯化锂(LiCl)诱变,硫酸二乙酯(DES)诱变,亚硝基胍(NTG)诱变,60Co及137Cs诱变、离子束诱变、常压室温等离子体(ARTP)诱变等等,在实际生产中常交叉使用多种诱变方式,复合处理进行微生物诱变选育,筛选高产菌株[25, 26, 27, 28, 29, 30, 31, 32, 33]。虽然传统的诱变方法具有偶然性高、筛选工作繁杂、工作量大、育种周期长等缺点,但仍然是提高发酵产量、改善菌种性状的有效手段。例如,代鹏等对多杀菌素产生菌的孢子采用紫外线、氮离子注入、60Co-γ射线等方法进行逐步诱变,筛选得到的高产菌株的发酵效价达到460 mg/L,是出发菌株效价的171%[34]。梁艳等通过紫外诱变筛选出了耐受鼠李糖前体的突变菌株,在优化发酵条件后多杀菌素产量相比原始菌株高了286%[35]。
2.2 代谢工程定向育种与传统的诱变育种方法相比,进行基因改造的代谢工程方法在提高抗生素合成能力方面具有更强的目的性和针对性。通过使用强启动子和增加调节合成途径的限速步骤的基因拷贝数,提高限速步骤中关键基因的表达量,解除限制步骤对合成速度的影响,可以显著地提高抗生素的合成能力。Madduri等[36]发现gtt、gdh、epi和kre基因不仅负责合成多杀菌素中的鼠李糖基团,还负责合成刺糖多孢菌细胞壁中的鼠李糖,而且gtt、gdh还要参与福乐糖胺前体的生物合成,由于在发酵前期拟糖苷(Pseudoaglycone)会积累,他们分析认为福乐糖胺基团的合成可能是多杀菌素合成途径的一个限速步骤,于是他们将克隆有gtt、gdh和kre 基因的质粒通过接合转移的方式整合到刺糖多孢菌基因组中,增加了基因的拷贝数,实验获得的重组子发酵后多杀菌素的产量比出发菌株提高了2倍。Pan等[37]利用强启动子PermE*表达鼠李糖合成基因,使得多杀菌素产量比原始菌株提高了4倍。Tang等[38]通过表达多杀菌素基因簇中除了spnA,spnB,spnC,spnD,spnE,ORF-L15和ORF-L16 的所有基因后,使得多杀菌素的合成能力提高了3.9倍。薛超友等[39]分析认为spnP、spnO、spnN、spnQ、spnR和spnS这6个基因的表达是不足的,而且spnK表达不足造成了无用的中间产物积累,他们用ermE*强启动子过表达spnK、spnP、spnO、spnN、spnQ、spnR、spnS基因,使多杀菌素发酵产量提高到214 mg/L,比野生菌提高了2.6倍;他们又用ermE*强启动子过表达gtt、gdh、kre、spnK、spnP、spnO、spnN、spnQ、spnR、spnS基因,使多杀菌素发酵产量提高到405 mg/L,是野生菌的5倍。由于刺糖多孢菌通过好氧发酵生产多杀菌素,溶氧不足会导致产量下降,罗玉双等[40]将透明颤菌血红基因(vgb)导入刺糖多孢菌,改善了刺糖多孢菌发酵培养过程中供氧不足的问题,增加了多杀菌素的产量。蔡妹等[41]增加了刺糖多孢菌中的对次级代谢产物的合成有调控作用的bldD基因的拷贝数,通过过量表达该基因,使重组菌株的多杀菌素产量相比对照菌株提高了1.35倍。
2.3 异源宿主表达刺糖多孢菌无论在实验室还是在工业生产中都存在难以操作的问题,包括菌株难以培养、生长缓慢、产孢时间较晚、发酵周期长等,且刺糖多孢菌自身的遗传背景也不够清楚,对其进行遗传操作较为困难,目前在刺糖多孢菌中还难以实现对多杀菌素合成基因表达的精确调控。解决上述问题的方法之一就是建立一个好的外源宿主表达系统,对多杀菌素进行异源表达,通过对异源宿主进行代谢工程和遗传操作以实现多杀菌素的高产。利用异源宿主表达聚酮类化合物是近年来的一个研究热点[42]。目前尽管一些复杂的聚酮化合物可以通过异源表达合成,但其产量往往比原始菌株还要低很多。造成这种现象的关键限制性因素是胞内前体供应的不足或生物合成酶的不足[43]。Zhang等[44]利用线性质粒SCP1分别对81 kb的阿维菌素基因簇和76 kb的多杀菌素基因簇进行克隆,并导入到模式菌株Streptomyces coelicolor A3上进行异源表达,然而发酵优化后只有阿维菌素的表达产物可以检测到。郭航等[45]提出了异源表达多杀菌素的方法,即筛选基因组文库中的多杀菌素基因簇的阳性克隆,并采用RED/ET重组技术对位于不同科斯质粒的部分基因簇进行拼接,或者使用细菌人工染色体(BAC)载体克隆多杀菌素基因簇,最后分别将表达糖合成基因(gtt、gdh、kre、epi)的载体和多杀菌素完整的基因簇一起转到异源宿主。目前,多杀菌素的完全异源表达还比较困难。
3 展 望国外公司和学术界对多杀菌素的研究已经超过了30年,这段时间他们克服困难开发出了很多新的技术和手段来提高多杀菌素的产量,而我国在这方面的研究与他们还有显著的差距,至今还没有开发出一个具有显著竞争力的工业菌株和配套的生产工艺。合成生物学近年来发展迅速,为我们利用代谢工程或异源表达高产多杀菌素提供基础。随着合成生物学的发展,以及我们对多杀菌素生物合成途径及其调控基因越来越多的了解,我们将来可能直接设计并创建用于多杀菌素高效合成的人工途径,实现多杀菌素的高效异源表达,降低多杀菌素的生产成本,开发新型的农用抗生素,提高我国生物农药的国际竞争力,促进绿色农药在我国的推广应用。
参考文献
| [1] | Mertz FP, Yao RC. http://journals.im.ac.cn/html/actamicrocn/2016/3/Saccharopolyspora%20spinosa%20sp.%20nov.%20isolated%20from%20soil%20collected%20in%20a%20sugar%20mill%20rum%20still. International Journal of Systematic Bacteriology, 1990, 40(1): 34-39. |
| [2] | Huang KX, Xia LQ, Zhang YM, Ding XZ, Zahn JA. Recent advances in the biochemistry of spinosyns. Applied Microbiology and Biotechnology, 2009, 82(1): 13-23. |
| [3] | Su JY, Sheng JL. The biosynthesis of spinosad. China Biotechnolgy, 2003, 23(5): 55-59, 73. (in Chinese) 苏建亚, 沈晋良. 多杀菌素的生物合成. 中国生物工程杂志, 2003, 23(5): 55-59, 73. |
| [4] | Wang XY, Zhang CB, Wang ML, Lu WY. Genome-scale metabolic network reconstruction of Saccharopolyspora spinosa for spinosad production improvement. Microbial Cell Factories, 2014, 13(1): 41-47. |
| [5] | Kirst HA. The spinosyn family of insecticides: realizing the potential of natural products research. The Journal of Antibiotics, 2010, 63(3): 101-111. |
| [6] | Zhang YB, Qian H. The global marketing and development of six classes of insecticides and new insecticides. Fine Chemical intermediates, 2015, 45(1): 1-8. (in Chinese) 张一宾,钱虹. 世界六大类杀虫剂的发展和新研发的杀虫剂品种. 精细化工中间体, 2015, 45(1): 1-8. |
| [7] | Madduri K, Waldron C, Matsushima P, Broughton MC, Crawford K, Merlo DJ, Baltz RH. Genes for the biosynthesis of spinosyns: applications for yield improvement in Saccharopolyspora spinosa. Journal of Industrial Microbiology and Biotechnology, 2001, 27(6): 399-402. |
| [8] | Waldron C, Matsushima P, Rosteck Jr PR, Broughton MC, Turner J, Madduri K, Crawford KP, Merlo DJ, Baltz RH. Cloning and analysis of the spinosad biosynthetic gene cluster of Saccharopolyspora spinosa. Chemistry & Biology, 2001, 8(5): 487-499. |
| [9] | Friedrich S, Hahn F. Opportunities for enzyme catalysis in natural product chemistry. Tetrahedron, 2015, 71(10): 1473-1508. |
| [10] | Luo YS, Xia LQ, Huang P, Wang HL, Ding XZ. Molecular mechanism of spinosyns biosyntheses and its orientational genetic manipulation strategy. Life Science Research, 2008, 12(3): 200-206. (in Chinese) 罗玉双, 夏立秋, 黄璠, 王海龙, 丁学知. 多杀菌素生物合成的分子机理与定向遗传改造策略. 生命科学研究, 2008, 12(3): 200-206. |
| [11] | Kim HJ, Choi SH, Jeon BS, Kim N, Pongdee R, Wu QQ, Liu HW. Chemoenzymatic synthesis of spinosyn A. Angewandte Chemie International Edition, 2014, 53(49): 13553-13557. |
| [12] | Hong L, Zhao ZB, Liu HW. Characterization of SpnQ from the spinosyn biosynthetic pathway of Saccharopolyspora spinosa: mechanistic and evolutionary implications for C-3 deoxygenation in deoxysugar biosynthesis. Journal of the American Chemical Society, 2006, 128(44): 14262-14263. |
| [13] | Zhao ZB, Hong L, Liu HW. Characterization of protein encoded by spnR from the spinosyn gene cluster of Saccharopolyspora spinosa: mechanistic implications for forosamine biosynthesis. Journal of the American Chemical Society, 2005, 127(21): 7692-7693. |
| [14] | Kim HJ, Pongdee R, Wu QQ, Hong L, Liu HW. The biosynthesis of spinosyn in Saccharopolyspora spinosa: synthesis of the cross-bridging precursor and identification of the function of SpnJ. Journal of the American Chemical Society, 2007, 129(47): 14582-14584. |
| [15] | Gordeev EG, Ananikov VP. Computational study of a model system of enzyme-mediated [4+2] cycloaddition reaction. PLoS One, 2015, 10(4): e0119984. |
| [16] | Kim HJ, Ruszczycky MW, Choi SH, Liu YN, Liu HW. Enzyme-catalysed [4+2] cycloaddition is a key step in the biosynthesis of spinosyn A. Nature, 2011, 473(7345): 109-112. |
| [17] | Isiorho EA, Liu HW, Keatinge-Clay AT. Structural studies of the spinosyn rhamnosyltransferase, SpnG. Biochemistry, 2012, 51(6): 1213-1222. |
| [18] | Huang KX, Zahn J, Han L. SpnH from Saccharopolyspora spinosa encodes a rhamnosyl 4′-O-methyltransferase for biosynthesis of the insecticidal macrolide, spinosyn A. Journal of Industrial Microbiology & Biotechnology, 2008, 35(12): 1669-1676. |
| [19] | Kim HJ, White-Phillip JA, Ogasawara Y, Shin N, Isiorho EA, Liu HW. Biosynthesis of spinosyn in Saccharopolyspora spinosa: synthesis of permethylated rhamnose and characterization of the functions of SpnH, SpnI, and SpnK. Journal of the American Chemical Society, 2010, 132(9): 2901-2903. |
| [20] | Evans DA, Black WC. Total synthesis of (+)-A83543A [(+)-lepicidin A]. Journal of the American Chemical Society, 1993, 115(11): 4497-4513. |
| [21] | Mergott DJ, Frank SA, Roush WR. Total synthesis of (-)-spinosyn A. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(33): 11955-11959. |
| [22] | Paquette LA, Collado I, Purdie M. Total synthesis of spinosyn A. 2. Degradation studies involving the pure factor and its complete reconstitution. Journal of the American Chemical Society, 1998, 120(11): 2553-2562. |
| [23] | Paquette LA, Gao ZL, Ni ZJ, Smith GF. Total synthesis of spinosyn A. 1. Enantioselective construction of a key tricyclic intermediate by a multiple configurational inversion scheme. Journal of the American Chemical Society, 1998, 120(11): 2543-2552. |
| [24] | Zhu FY, Zhong XF, Hu MZ, Lu L, Deng ZX, Liu TG. In vitro reconstitution of mevalonate pathway and targeted engineering of farnesene overproduction in Escherichia coli. Biotechnology and Bioengineering, 2014, 111(7): 1396-1405. |
| [25] | Wang H, Xue W, He YM, Peng RH, Yao QH. Improvement of the ability to produce spinosad in Saccharopolyspora spinosa through the acquisition of drug resistance and genome shuffling. Annals of Microbiology, 2015, 65(2): 771-777. |
| [26] | Chen Y, Xiong J, Guo WQ, Liu GL, Zou QL, Zhang XL. High throughput screening and breeding of high spinosad producing strains. Chinese Journal of Antibiotics, 2013, 38(5): 339-343, 347. (in Chinese) 陈园, 熊犍, 郭伟群, 刘国丽, 邹球龙, 张晓琳. 多杀菌素产生菌的高通量诱变选育. 中国抗生素杂志, 2013, 38(5): 339-343, 347. |
| [27] | Guo WQ, Zou QL, Chen Y, Li NW, Zhang XL. Screening and breeding of high spinosad producing strains and preliminary study on metabolism curve of mutation. Chinese Journal of Antibiotics, 2014, 39(4): 245-248. (in Chinese) 郭伟群, 邹球龙, 陈园, 李能威, 张晓琳. 多杀菌素高产菌株的诱变选育及代谢曲线初步研究. 中国抗生素杂志, 2014, 39(4): 245-248. |
| [28] | 胡旭晔. 多杀菌素产生菌的诱变育种与发酵工艺研究. 上海医药工业研究院硕士学位论文, 2006. |
| [29] | 梁艳. 多杀菌素高产菌株的选育和发酵条件的优化研究. 天津大学硕士学位论文, 2007. |
| [30] | Qiao GJ, Wang C, Zhang K, Zhang HL, Cai H. Mutation breeding of spinosad producing strain. Food and Fermentation Technology, 2012, 48(5): 30-34. (in Chinese) 乔广军, 汪晨, 张凯, 张恒丽, 蔡恒. 多杀菌素高产菌株的诱变选育. 食品与发酵科技, 2012, 48(5): 30-34. |
| [31] | Qiao CS, Zhao N, Shi MM, Zhu M, Li X. Mutation screening of production strains of spinosad based on ribosome engineering theory through ARTP. China Biotechnolgy, 2014, 34(1): 71-78. (in Chinese)乔长晟, 赵男, 石漫漫, 朱明, 李雪. 基于核糖体工程理论的常压室温等离子体诱变筛选多杀菌素高产菌. 中国生物工程杂志, 2014, 34(1): 71-78. |
| [32] | Song W, Xiong J, Guo WQ, Zhang XL, Song Y. Mutagenic effects of MNNG treatment on the spinosad producing strains. Chinese Journal of Biological Control, 2009, 25(2): 176-180. (in Chinese) 宋炜, 熊犍, 郭伟群, 张晓琳, 宋渊. MNNG对多杀菌素产生菌的诱变效应. 中国生物防治, 2009, 25(2): 176-180. |
| [33] | 王美玲. 多杀菌素高产菌株的选育及发酵工艺的优化. 天津大学硕士学位论文, 2013. |
| [34] | Dai P, Xu XL, He YP, Dai JY, Lin KC, Huang JS. Breeding of production strains of spinosads. Chinese Journal of Tropical Crops, 2005, 26(4): 67-70. (in Chinese) 代鹏, 徐雪莲, 贺玉平, 戴经元, 林开春, 黄俊生. 多杀菌素生产菌株的选育. 热带作物学报, 2005, 26(4): 67-70. |
| [35] | Liang Y, Lu WY, Wen JP. Improvement of Saccharopolyspora spinosa and the kinetic analysis for spinosad production. Applied Biochemistry and Biotechnology, 2009, 152(3): 440-448. |
| [36] | Madduri K, Waldron C, Merlo DJ. Rhamnose biosynthesis pathway supplies precursors for primary and secondary metabolism in Saccharopolyspora spinosa. Journal of Bacteriology, 2001, 183(19): 5632-5638. |
| [37] | Pan HX, Li JA, He NJ, Chen JY, Zhou YM, Shao L, Chen DJ. Improvement of spinosad production by overexpression of gtt and gdh controlled by promoter PermE* in Saccharopolyspora spinosa SIPI-A2090. Biotechnology Letters, 2011, 33(4): 733-739. |
| [38] | Tang Y, Xia LQ, Ding XZ, Luo YS, Huang F, Jiang YW. Duplication of partial spinosyn biosynthetic gene cluster in Saccharopolyspora spinosa enhances spinosyn production. FEMS Microbiology Letters, 2011, 325(1): 22-29. |
| [39] | Xue CY, Duan YJ, Zhao FL, Lu WY. Stepwise increase of spinosad production in Saccharopolyspora spinosa by metabolic engineering. Biochemical Engineering Journal, 2013, 72: 90-95. |
| [40] | Luo YS, Kou XX, Ding XZ, Hu SB, Tang Y, Li WP, Huang F, Yang Q, Chen HN, Xia LQ. Promotion of spinosad biosynthesis by chromosomal integration of the Vitreoscilla hemoglobin gene in Saccharopolyspora spinosa. Science China Life Sciences, 2012, 55(2): 172-180. |
| [41] | Cai M, Liu HX, Yang Q, Sun YJ, Hu SB, Yu ZQ, Huang WT, Ding XZ, Xia LQ. Impact on spinosad biosynthesis and spore formation by overexpression of bldD gene in Saccharopolyspora spinosa. Chinese Journal of Biological Control, 2015, 31(4): 553-560. (in Chinese) 蔡妹, 刘红雪, 杨琦, 孙运军, 胡胜标, 余子全, 黄伟涛, 丁学知, 夏立秋. 刺糖多孢菌bldD基因过表达对多杀菌素合成及其孢子形成的影响. 中国生物防治学报, 2015, 31(4): 553-560. |
| [42] | Luo YZ, Li BZ, Liu D, Zhang L, Chen Y, Jia B, Zeng BX, Zhao HM, Yuan YJ. Engineered biosynthesis of natural products in heterologous hosts. Chemical Society Reviews, 2015, 44(15): 5265-5290. |
| [43] | Duan YJ, Xue CY, Lu WY. Progress in improving the supply of precursors for heterologous expression of polyketides. China Biotechnolgy, 2012, 32(11): 107-114. (in Chinese) 段月娇, 薛超友, 卢文玉. 异源表达聚酮类化合物前体的研究进展. 中国生物工程杂志, 2012, 32(11): 107-114. |
| [44] | Zhang R, Xia HY, Xu QY, Dang FJ, Qin ZJ. Recombinational cloning of the antibiotic biosynthetic gene clusters in linear plasmid SCP1 of Streptomyces coelicolor A3(2). FEMS Microbiology Letters, 2013, 345(1): 39-48. |
| [45] | Guo H, Bai TL, Tao MF. Cloning and reconstitution of rhamose and forosamine biosynthetic gene of Saccharopolyspora spinosa NRRL18395. Journal of Huazhong Agricultural University, 2012, 31(3): 298-302. (in Chinese) 郭航, 白亭丽, 陶美凤. 刺糖多孢菌鼠李糖和福乐糖胺合成基因的克隆和组装. 华中农业大学学报, 2012, 31(3): 298-302. |
