莫天录1, 2, 薛林贵1

 , 张琪2
, 张琪2 

1. 兰州交通大学化学与生物工程学院, 甘肃 兰州 730070;
2. 复旦大学化学系, 上海 200433
收稿日期:2015-09-16; 修回日期:2015-11-25; 网络出版日期:2016-01-12
资助课题:国家自然科学基金(KRH1615548)
通讯作者:薛林贵,E-mail: xuelg@mail.lzjtu.cn;张琪, Tel/Fax:+86-21-65648172;E-mail:qizhang@sioc.ac.cn
摘要: 羊毛硫肽化合物(Lanthipeptides)是由核糖体合成并经过翻译后修饰得到的一大类肽类天然产物。这类化合物广泛的产生于不同种类的细菌,具有丰富的结构和生物活性多样性,为活性药物研究和开发提供重要的来源。本文综述了近几年来羊毛硫肽化合物生物合成进展,从其合成酶结构,进化机制,区域和立体选择性控制等方面进行了简要的讨论,展示了羊毛硫肽类化合物生物合成中特殊而迷人的酶学机制。
关键词: 羊毛硫肽核糖体肽天然产物底物控制抗菌活性立体选择性
Recent advances in lanthipeptide biosynthesis-A review
Tianlu Mo1, 2, Lingui Xue1

 , Qi Zhang2
, Qi Zhang2

1. School of Chemical and Biological Engineering, Lanzhou Jiaotong University, Lanzhou 730070, Gansu Province, China;
2. Department of Chemistry, Fudan University, Shanghai 200433, China
Supported by the National Natural Science Foundation of China (KRH1615548)
Corresponding author. Lingui Xue, E-mail: xuelg@mail.lzjtu.cn;Qi Zhang, Tel/Fax:+86-21-65648172;E-mail:qizhang@sioc.ac.cn
Abstract:Lanthipeptides are a growing class of ribosomally synthesized and posttranslationally modified peptide (RiPP) natural products. These compounds are widely distributed among taxonomically distant species, and their structures and biological activities are diverse, providing an important source for drug research and developement. In this review, we summarized the recent advances in the understanding of structure, classification, evolution and substrate-controlled biosynthetic mechanism of lanthipeptide, attempting to highlight the intriguing chemistry and enzymology in the biosynthesis of this growing family of natural products.
Key words: lanthipeptideRiPPsubstrate-controlledantibacterial activitystereoselectivity
随着基因测序及相应组学技术的迅猛发展,近十年越来越多的核糖体天然产物(Ribosomally synthesized and posttranslationally modified peptides,RiPPs)被发现[1]。RiPPs是由核糖体合成,经由翻译后修饰而得到的一大类天然产物(图 1),具有非常广泛的结构多样性和生物活性多样性[1]。与其它天然产物例如聚酮和非核糖体肽天然产物相比,RiPPs的生物合成基因簇通常较短(一般小于30 kb),可以比较方便的进行异源表达研究[2]。另外由于化合物的结构直接对应于基因序列,可以通过改变前体肽基因序列直接改变化合物的结构,因而RiPPs在结构上具有较高的可进化性(high evolvablity)。基因组学研究表明目前已知的核糖体肽类化合物仅仅占自然界的很小一部分,有大量未知的化合物有待发现和阐明,具有广阔的研究前景[1]。
 |
| 图1 核糖体肽类天然产物的生物合成途径 Figure 1. Biosynthesis of RiPPs. The length of leader and core peptides varies significantly in different systems, and they are not shown in proportion to their actual lengths. |
| 图选项 |
羊毛硫肽化合物(Lanthipeptide)是一大类含有硫醚键的环肽类化合物[3, 4]。这类化合物广泛的存在于自然界中,具有丰富的化学结构及生物活性多样性。1928年L. A. Rogers报道了从Lactococcus lactis中分离的“明星”化合物乳酸链球菌素(Nisin)(2)[5, 6],发现其对革兰氏阳性菌有很强的抗菌活性[7]。Nisin作为一种食品添加剂使用目前已经有长达60年的历史,在世界上80多个国家中都得到广泛的使用,然而目前并没有明显的Nisin抗性菌出现。Nisin良好的抗菌活性及独特的作用机制引起了微生物学家和药物学家对羊毛硫肽类化物的很多关注,使这类化合物成为抗感染药物研究的一个新的方向[8]。目前,来源于Microbispora coralline的羊毛硫肽分子microbisporicin和来源于Actinoplanes liguriae的羊毛硫肽化合物deoxyactagardine B的衍生物NVB302作为新一代的抗感染药物都已进入了临床试验[9, 10]。此外,mutacin1140能够预防龋齿[11];epidermin可以有效的治疗和预防痤疮[12];而duramycin在治疗囊肿性纤维化的效果尤为突出,并且该化合物能促使前列腺素释放参与炎症反应,进而抑制真核生物体内的磷脂酶A2来维持生物体正常的脂代谢[12, 13];labyrinthopeptin除了具有良好的抗疼痛活性以外[14],还具有明显的抗HIV活性[15]。
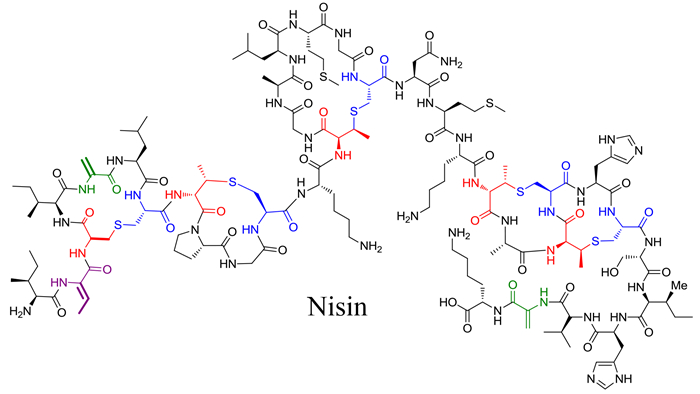 |
| 图2 Nisin的化学结构[5] Figure 2. The chemical structure of Nisin A[5]. The fragments of the (methyl) lanthionine residues that are derived from Cys are shown in blue and the fragments originating from Ser/Thr are shown in red. |
| 图选项 |
1 羊毛硫肽的结构多样性羊毛硫肽骨架仅来源于20个天然氨基酸(proteinogenic amino acids),且翻译后修饰方式多限于脱水和成环两种。然后由于脱水位点和成环方式的不同,羊毛硫肽具有丰富的结构多样性(图 3)。部分羊毛硫肽化合物如lactocinS,lacticin 3147 β 等具有典型的线性结构,而诸如lacticin 481,venezeulin等具有复杂交错的环结构。当然部分的羊毛硫肽可以被进一步的修饰,这些翻译后修饰包括色氨酸的氯化,脯氨酸和天冬氨酸的羟基化,氨基酸α-C构型的转变等等(图 3)。另外最近Donadio等发现了糖基化的羊毛硫肽NAI-112 (图 3)[16],进一步展示了羊毛硫肽化合物丰富的结构多样性。另外值得一提的是某些C-末端的半胱氨酸可以被氧化脱羧,生成一个硫烯醇,该硫烯醇进一步和双键进行加成,形成一个特殊AviCys (S-[(Z)-aminovinyl]-D-cysteine)结构[17]。该反应被一类黄素依赖的氧化酶LanD催化。AviCys结构不仅出现在I型和II型羊毛硫肽中,还出现在非羊毛硫肽如Cypemycin的结构中[18]。
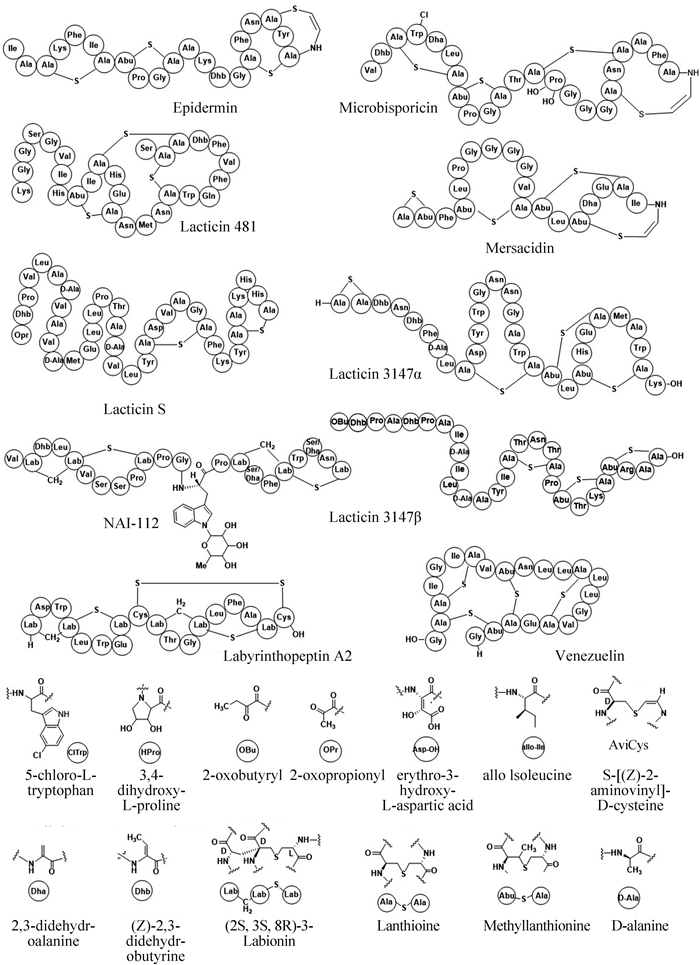 |
| 图3 某些代表性的羊毛硫肽类化合物结构,更多羊毛硫肽结构请参见综述[4, 19] Figure 3. The chemical structures of the representative lanthipeptides,demonstrating the vast diversity of ring topologies. For more lanthipeptide structures,please see reviews[4, 19]. |
| 图选项 |
2 羊毛硫肽的作用机制对Nisin作用机制的研究表明,该化合物可以与细胞壁合成前体lipid II结合(图 4),从而阻断细胞壁的合成造成细胞死亡[20]。Lipid II同时也是很多抗生素例如万古霉素的作用靶点,然而Nisin与万古霉素对lipid II有不同的结合位点,因为万古霉素敏感的肠球菌(Enterococci)对于Nisin不敏感[20]。与大多以蛋白质和核酸为靶点的抗生素相比,Nisin通过与细胞壁合成的前体分子lipid II结合实现抗菌的机制具有明显的优势,因为对于细菌而言,改变lipid II的结构显然比改变蛋白或核酸的结构困难得多。除了阻断细胞壁合成以外,Nisin还能与lipid形成多聚物在细胞膜上形成穿孔,从而造成细菌细胞内电解质的流失[3]。Nisin所具有的这两种截然不同的作用机制,使得细菌难以进化出同时抵御两种作用的防御机制,这可能是Nisin的长时间广泛使用并未导致Nisin抗性菌大量出现的原因。
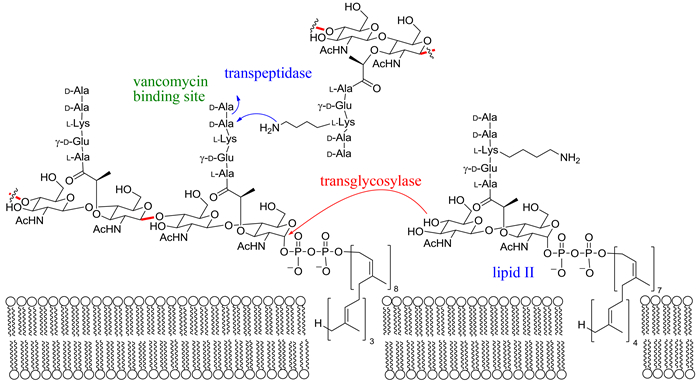 |
| 图4 Lipid II 参与细胞壁合成 Figure 4. Lipid II is a precursor for the biosynthesis of bacterial cell wall. Vancomycin binds lipid II via the L-Lys-DAla-D-Ala moiety. Figure is from review[3]. |
| 图选项 |
最近的研究发现,双组分羊毛硫肽化合物如haloduracin可以通过lipid II: haloduracinα:haloduracinβ=1:2:2的方式结合lipid II从而实现阻断细胞壁合成和细胞膜成孔两种作用机制[21]。羊毛硫肽这种特殊的作用模式,也预示着这类化合物在药物开发中的巨大潜力。需要注意的是并非所有羊毛硫肽类化合物都具有两种作用模式,例如mersacidin尽管与lipid II结合,但却不能在细胞膜上形成穿孔[22]。
3 羊毛硫肽的生物合成羊毛硫肽类化合物含有特征的羊毛硫氨酸(lanthionine),其来源于一个半胱氨酸残基和一个丝氨酸或苏氨酸残基,通过半胱氨酸的硫原子相连(图 2)。该特征硫醚键是由丝氨酸或苏氨酸脱水形成脱水氨基酸,然后半胱氨酸的巯基对新生成的脱水氨基酸进行Michael加成形成的[3, 4]。羊毛硫氨酸可具有不同的立体化学构型(图 5-A)[23, 24]。对于某些羊毛硫肽类化合物,其合成过程中可以涉及两步连续的Michael加成反应,形成一类特殊的含有C-C键连接的labionin结构(图 5-B)[25]。
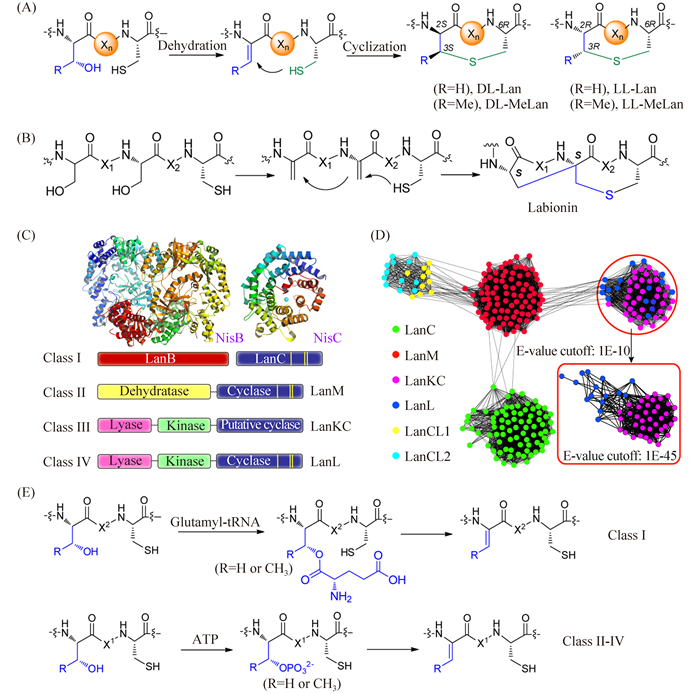 |
| 图5 羊毛硫氨酸的生物合成 Figure 5. Biosynthesis of lanthipeptides. A: (Methyl)lanthionine formation involves Ser/Thr dehydration and subsequent Michael addition of the Cys thiol to the nascent dehydroamino acids. B: Labionin biosynthesis involves a second Michael addition to yield the carbacycle. C: Four classes of lanthipeptide synthetases. The conserved zincbinding motifs are highlighted by the yellow lines in the cyclase domains. NisB[26] and NisC[27] represent the achetype of class I lanthipeptide synthetases (PDB entries: NisB 4WD9,NisC 2G0D). D: Protein similarity map of LanC-like enzymes. LanCL1(LanC-like)and LanCL2 are from eukaryotes,and their functions are unclear at present. E: The distinct dehydration mechanisms in the biosynthesis of different classes of lanthipeptides. X1 and X2 indicate the peptide linker regions[28]. |
| 图选项 |
目前功能较为清楚的有4类羊毛硫肽合成酶,其合成对应4类羊毛硫肽化合物(图 3C)[20, 21, 22, 23, 24, 25, 26, 27, 28, 29]。第一类合成酶含有一个独立的脱水酶(dehydratase) LanB和一个独立的环化酶(cyclase) LanC (图 5-C)。作为I类合成酶的代表Nisin合成酶NisB[26]和NisC[27]目前结构已经得到解析(图 5-C)。第二类合成酶(LanM)为一双功能酶,同时含有一个脱水酶结构域和一个环化酶结构域(图 5-C),目前作为II型酶的一个代表cyltolysin合成酶CylM结构也被解析[30]。III型(LanKC)和IV型(LanL)合成酶均含有裂解酶、激酶和环化酶3个结构功能域。目前关于这两类酶还没有相应的结构研究,其催化的详细过程也不清楚。对catenulipeptin的合成酶AciKC (III型)研究表明,裂解酶和激酶共同催化丝氨酸脱水,而环化酶则催化labionin的成环(图 5-B)[31]。I型,II型及IV型的环化酶均含有保守的锌离子结合位点,而III型合成酶不具有此保守位点(图 5-C)。III型合成酶中环化酶具体的成环机制目前还不清楚,目前发现的具有labionin结构的羊毛硫肽均为III型合成酶所产生。II,III,IV型合成酶均采用磷酸化的方式进行脱水,而I型合成酶则利用谷氨酰化的tRNA活化丝氨酸/苏氨酸的羟基进行脱水(图 5-E),表明了自然界在合成羊毛硫肽化合物过程中的趋同进化(convergent evolution)机制。
不同类型的环化酶具有一定的序列相似性。在序列相似性网络图中可以看到,不同类型的环化酶很明显的归属于某一特定的簇中(图 5-D),表明在进化中,不同类型的合成酶有较早的分化。最新研究表明,羊毛硫肽合成酶在酶结构和催化机制上具有高度的多样性,其类型远远大于以上所述的4类,反映了羊毛硫肽化合物在自然界中丰富的结构和生物合成多样性[32]。
4 羊毛硫肽的组合生物合成Li等通过基因组挖掘(genome mining),发现了蓝细菌Prochlorococcus具有产生大量羊毛硫肽化合物的能力[33]。Prochlorococcus的基因组编码了一个II型羊毛硫肽合成酶ProcM,然而却具有多达30个前体肽编码基因procA。这些前体肽基因具有非常保守的领导肽(leader peptide),然而其核心肽(core peptide)部分则高度可变,没有任何相似性可言(图 6)。体外反应和异源表达实验都证实ProcM可以非常特异的修饰多个ProcA底物生成成熟的化合物prochlorosin,证实了羊毛硫肽合成酶强大的组合生物合成能力。最近类似于Prochlorococcus的羊毛硫肽组合生物合成系统在Synechococcus,Nostoc,Cyanothece等多类蓝细菌中均广泛存在[34]。
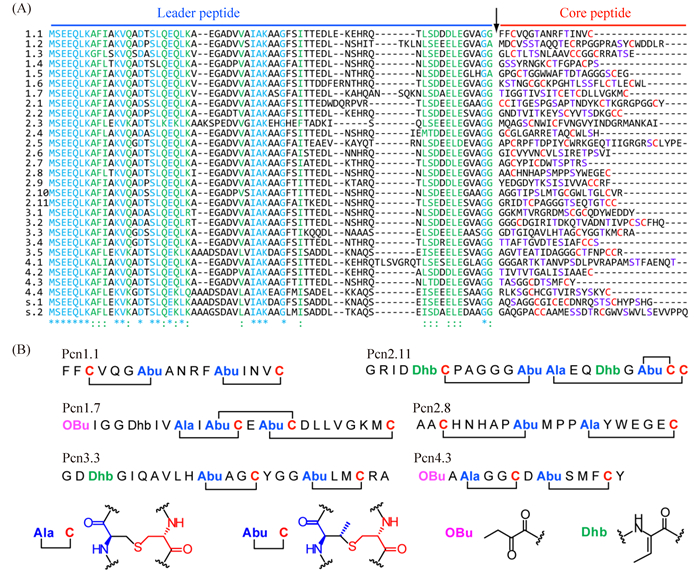 |
| 图6 羊毛硫肽类化合物prochlorosin的生物合成 Figure 6. Biosynthesis of prochlorosins in Prochlorococcus MIT 9313. A: Sequences of 29 the substrate peptides ProcAs. The protease cleavage site for leader peptide removal is shown by a black arrow[33]. B: Representative prochlorosin (Pcn) that have been structurally characterized. Part of the figure is from references[28]. |
| 图选项 |
Prochlorosin组合生物合成体系的发现提出了一个非常有意思的问题:同一个酶是如何作用于差异如此之大的底物并特异的生成产物的呢?可以得知,核心肽上通常有多个脱水氨基酸和多个半胱氨酸,理论上有多种成环的可能性,而酶却选择性的生成一种产物。van der Donk小组利用系统发育分析的方法,对多类来源各异产物各异的羊毛硫肽合成酶进行了详细的分析[29]。研究发现,进化上非常相似的酶可以催化结构截然不同的产物,而合成结构高度相似产物的酶,有时候在进化树上有较远的距离[29]。这些结果预示着羊毛硫肽中环的结构可能并非由酶来主导,而可能大部分由核心肽序列本身决定的。作者进而利用多个嵌合肽(Chimeric peptide)作为底物的异源表达实验证实了这一观点[29]。这些结果表明核心肽序列本身在羊毛硫肽的环结构形成中扮演了重要的作用,为羊毛硫肽类化合物的结构和合成途径改造提供了重要的理论基础。
5 底物控制Lanthipeptide立体选择性大部分羊毛硫氨酸长期以来都被认为仅具有(2S,3S)的构型(DL-Lan,图 5-A)。然而最近研究发现,Cyltolysin存在2种不同构型的羊毛硫氨酸:DL-Lan和(2R,3R)-lanthionine(LL-Lan,图 5-A),而LL-Lan存在于一个特殊的序列S/T-S/T-Xxx-Xxx-C(Xxx代表除Ser、Thr、Cys之外的氨基酸残基)[23, 24]。进一步的研究发现,含有S/T-S/T-Xxx-Xxx-C序列的羊毛硫氨酸结构均为LL构型。如果将S/T-S/T-Xxx-Xxx-C序列引入核心肽,则生成的羊毛硫氨酸的构型也为LL构型[23]。这些结果表明羊毛硫氨酸生成的立体选择性也是由底物自身序列所决定的[35]。这些研究大大深化了我们对酶催化反应的认识,对于酶的进化机制以及新型羊毛硫肽抗生素开发和研究具有重要的指导作用。
6 结论和展望伴随着目前耐药菌的泛滥,开发新型高效抗生素的需求日益紧迫。羊毛硫肽类化合物独特的作用机制(例如Nisin特殊的双重作用机制[3]),为新型抗生素的开发应用提供了很好的思路。最新的基因挖掘研究表明,目前自然界中发现的羊毛硫肽抗生素仅仅为实际存在的冰山一角,表明该类化合物的研究具有广阔的空间[32]。尽管对于这类化合物生物合成研究已经开展了20多年,目前对于其生物合成机制仍有诸多未知,而目前的研究也正在不断揭示其丰富的酶学机制。可以预见,在不久的将来,将会有更多新型的种类繁多的羊毛硫肽类化合物被报道,而对这些化合物的生物合成机制的研究同样令人期待[32]。
参考文献
| [1] | Arnison PG, Bibb MJ, Bierbaum G, Bowers AA, Bugni TS, Bulaj G, Camarero JA, Campopiano DJ, Challis GL, Clardy J, Cotter PD, Craik DJ, Dawson M, Dittmann E, Donadio S, Dorrestein PC, Entian KD, Fischbach MA, Garavelli JS, Göransson U, Gruber CW, Haft DH, Hemscheidt TK, Hertweck C, Hill C, Horswill AR, Jaspars M, Kelly WL, Klinman JP, Kuipers OP, Link AJ, Liu W, Marahiel MA, Mitchell DA, Moll GN, Moore BS, Müller R, Nair SK, Nes IF, Norris GE, Olivera BM, Onaka H, Patchett ML, Piel J, Reaney MJT, Rebuffat S, Ross RP, Sahl HG, Schmidt EW, Selsted ME, Severinov K, Shen B, Sivonen K, Smith L, Stein T, Süssmuth RD, Tagg JR, Tang GL, Truman AW, Vederas JC, Walsh CT, Walton JD, Wenzel SC, Willey JM, van der Donk WA. Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature. Natural Product Reports, 2013, 30(1): 108-160. |
| [2] | Velásquez JE, van der Donk WA. Genome mining for ribosomally synthesized natural products. Current Opinion in Chemical Biology, 2011, 15(1): 11-21. |
| [3] | Chatterjee C, Paul M, Xie LL, van der Donk WA. Biosynthesis and mode of action of lantibiotics. Chemical Reviews, 2005, 105(2): 633-684. |
| [4] | Knerr PJ, van der Donk WA. Discovery, biosynthesis, and engineering of lantipeptides. Annual Review of Biochemistry, 2012, 81(1): 479-505. |
| [5] | Gross E, Morell JL. Structure of nisin. Journal of the American Chemical Society, 1971, 93(18): 4634-4635. |
| [6] | Rogers LA. The inhibiting effect of Streptococcus lactis on Lactobacillus bulgaricus. Journal of Bacteriology, 1928, 16(5): 321-325. |
| [7] | Delves-Broughton J, Blackburn P, Evans RJ, Hugenholtz J. Applications of the bacteriocin, nisin. Antonie van Leeuwenhoek, 1996, 69(2): 193-202. |
| [8] | Piper C, Cotter PD, Ross RP, Hill C. Discovery of medically significant lantibiotics. Current Drug Discovery Technologies, 2009, 6(1): 1-18. |
| [9] | Castiglione F, Lazzarini A, Carrano L, Corti E, Ciciliato I, Gastaldo L, Candiani P, Losi D, Marinelli F, Selva E, Parenti F. Determining the structure and mode of action of microbisporicin, a potent lantibiotic active against multiresistant pathogens. Chemistry & Biology, 2008, 15(1): 22-31. |
| [10] | Crowther GS, Baines SD, Todhunter SL, Freeman J, Chilton CH, Wilcox MH. Evaluation of NVB302 versus vancomycin activity in an in vitro human gut model of Clostridium difficile infection. Journal of Antimicrobial Chemotherapy, 2013, 68(1): 168-176. |
| [11] | Hillman JD. Genetically modified Streptococcus mutans for the prevention of dental caries. Antonie van Leeuwenhoek, 2002, 82(1-4): 361-366. |
| [12] | Märki F, Hänni E, Fredenhagen A, van Oostrum J. Mode of action of the lanthionine-containing peptide antibiotics duramycin, duramycin B and C, and cinnamycin as indirect inhibitors of phospholipase A2. Biochemical Pharmacology, 1991, 42(10): 2027-2035. |
| [13] | Grasemann H. New developments in pharmaceutical treatments for cystic fibrosis. Current Pharmaceutical Design, 2012, 18(5): 613. |
| [14] | Krawczyk JM, Völler GH, Krawczyk B, Kretz J, Brönstrup M, Süssmuth RD. Heterologous expression and engineering studies of labyrinthopeptins, class III lantibiotics from Actinomadura namibiensis. Chemistry & Biology, 2013, 20(1): 111-122. |
| [15] | Férir G, Petrova MI, Andrei G, Huskens D, Hoorelbeke B, Snoeck R, Vanderleyden J, Balzarini J, Bartoschek S, Brönstrup M, Süssmuth RD, Schols D. The lantibiotic peptide labyrinthopeptin A1 demonstrates broad anti-HIV and anti-HSV activity with potential for microbicidal applications. PLoS One, 2013, 8(5): e64010. |
| [16] | Iorio M, Sasso O, Maffioli SI, Bertorelli R, Monciardini P, Sosio M, Bonezzi F, Summa M, Brunati C, Bordoni R, Corti G, Tarozzo G, Piomelli D, Reggiani A, Donadio S. A glycosylated, labionin-containing lanthipeptide with marked antinociceptive activity. ACS Chemical Biology, 2014, 9(2): 398-404. |
| [17] | Sit CS, Yoganathan S, Vederas JC. Biosynthesis of aminovinyl-cysteine-containing peptides and its application in the production of potential drug candidates. Accounts of Chemical Research, 2011, 44(4): 261-268. |
| [18] | Claesen J, Bibb M. Genome mining and genetic analysis of cypemycin biosynthesis reveal an unusual class of posttranslationally modified peptides. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(37): 16297-16302. |
| [19] | Willey JM, van der Donk WA. Lantibiotics: peptides of diverse structure and function. Annual Review of Microbiology, 2007, 61(1): 477-501. |
| [20] | Breukink E, Wiedemann I, van Kraaij C, Kuipers OP, Sahl HG, de Kruijff B. Use of the cell wall precursor lipid II by a pore-forming peptide antibiotic. Science, 1999, 286(5448): 2361-2364. |
| [21] | Oman TJ, Lupoli TJ, Wang TSA, Kahne D, Walker S, van der Donk WA. Haloduracin α binds the peptidoglycan precursor lipid II with 2: 1 stoichiometry. Journal of the American Chemical Society, 2011, 133(44): 17544-17547. |
| [22] | Brötz H, Bierbaum G, Markus A, Molitor E, Sahl HG. Mode of action of the lantibiotic mersacidin: inhibition of peptidoglycan biosynthesis via a novel mechanism? Antimicrobial Agents and Chemotherapy, 1995, 39(3): 714-719. |
| [23] | Tang WX, Jiménez-Osés G, Houk KN, van der Donk WA. Substrate control in stereoselective lanthionine biosynthesis. Nature Chemistry, 2015, 7(1): 57-64. |
| [24] | Tang WX, van der Donk WA. The sequence of the enterococcal cytolysin imparts unusual lanthionine stereochemistry. Nature Chemical Biology, 2013, 9(3): 157-159. |
| [25] | Müller WM, Schmiederer T, Ensle P, Süssmuth RD. In vitro biosynthesis of the prepeptide of type-III lantibiotic labyrinthopeptin A2 including formation of a C-C bond as a post-translational modification. Angewandte Chemie International Edition, 2010, 49(13): 2436-2440. |
| [26] | Ortega MA, Hao Y, Zhang Q, Walker MC, van der Donk WA, Nair SK. Structure and mechanism of the tRNA-dependent lantibiotic dehydratase NisB. Nature, 2015, 517(7535): 509-512. |
| [27] | Li B, Yu JPJ, Brunzelle JS, Moll GN, van der Donk WA, Nair SK. Structure and mechanism of the lantibiotic cyclase involved in nisin biosynthesis. Science, 2006, 311(5766): 1464-1467. |
| [28] | Yu Y, Zhang Q, van der Donk WA. Insights into the evolution of lanthipeptide biosynthesis. Protein Science, 2013, 22(11): 1478-1489. |
| [29] | Zhang Q, Yu Y, Vélasquez JE, van der Donk WA. Evolution of lanthipeptide synthetases. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(45): 18361-18366. |
| [30] | Dong SH, Tang WX, Lukk T, Yu Y, Nair SK, van der Donk WA. The enterococcal cytolysin synthetase has an unanticipated lipid kinase fold. eLife, 2015, 4: e07607. |
| [31] | Wang H, van der Donk WA. Biosynthesis of the class III lantipeptide catenulipeptin. ACS Chemical Biology, 2012, 7(9): 1529-1535. |
| [32] | Zhang Q, Doroghazi JR, Zhao XL, Walker MC, van der Donk WA. Expanded natural product diversity revealed by analysis of lanthipeptide-like gene clusters in Actinobacteria. Applied and Environmental Microbiology, 2015, 81(13): 4339-4350. |
| [33] | Li B, Sher D, Kelly L, Shi YX, Huang K, Knerr PJ, Joewono I, Rusch D, Chisholm SW, van der Donk WA. Catalytic promiscuity in the biosynthesis of cyclic peptide secondary metabolites in planktonic marine cyanobacteria. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(23): 10430-10435. |
| [34] | Zhang Q, Yang X, Wang H, van der Donk WA. High divergence of the precursor peptides in combinatorial lanthipeptide biosynthesis. ACS Chemical Biology, 2014, 9(11): 2686-2694. |
| [35] | Ding W, Li YZ, Zhang Q. Substrate-controlled stereochemistry in natural product biosynthesis. ACS Chemical Biology, 2015, 10(7): 1590-1598. |
