郭晓威1, 王秀然1, 解长睿1, 孙丹1, 陈欢1, 高红桃1, 张超2, 李明堂2, 李海燕1


1.吉林农业大学生命科学学院, 生物反应器与药物开发教育部工程研究中心, 吉林 长春 130118;
2.吉林农业大学资源与环境学院, 吉林 长春 130118
收稿日期:2016-12-12;修回日期:2017-02-15;网络出版日期:2017-03-02
基金项目:吉林省科技厅项目(20150204027NY);吉林省秸秆综合利用技术创新平台(2014·C-1);国家自然科学基金(31401403)
*通信作者:李海燕, Tel/Fax: +86-431-84532885; E-mail: hyli99@163.com
摘要:[目的]筛选高效降解木质素的菌株,并研究其以玉米秸秆为底物时木素降解酶活性。[方法]本研究以愈创木酚培养基和苯胺蓝培养基从吉林省不同经纬度的自然朽木及腐朽玉米秸秆土壤样品中分离、筛选得到高效降解木质素的菌株,并对其形态学鉴定,通过ITS序列分析构建系统发育树,分析菌株的分类地位。通过秸秆固体发酵过程产生的胞外木质素酶的活性分析,选出高效秸秆降解菌。[结果]筛选出1株高效降解秸秆的真菌,对其进行形态学特征和ITS序列分析,命名为白囊耙齿菌W2(Irpex lacteus W2)。该菌株在4-8 d内产生的锰过氧化物酶(Manganese peroxidase)呈上升趋势,并且在8 d达到峰值86.31 U/mL,与黄孢原毛平革菌(Phanerochaete chrysosporium)的最高酶活力45.86 U/mL相比,高出了88.20%(P < 0.01);该菌株的漆酶(Laccase)活力8 d时达到20.60 U/mL,比对照高40.76%(P < 0.05)。[结论]本研究分离到一株具有较强降解秸秆能力的真菌,初步鉴定为Irpex lacteus W2,具有较强的降解秸秆能力,其降解秸秆过程中产生较高的锰过氧化物酶与漆酶活力。
关键词: 玉米秸秆 木质素 筛选 锰过氧化物酶 漆酶
Isolation of lignin-degrading strain and its enzyme producing characteristics in corn stover degradation
Guo Xiaowei1, Wang Xiuran1, Xie Changrui1, Sun Dan1, Chen Huan1, Gao Hongtao1, Zhang Chao2, Li Mingtang2, Li Haiyan1


1.College of Life Sciences, Ministry of Education Engineering Research Center of Bioreactor and Pharmaceutical Development, Jilin Agricultural University, Changchun 130118, Jilin Province, China;
2.College of Resources and Environment, Jilin Agricultural University, Changchun 130118, Jilin Province, China
Received 12 December 2016; Revised 15 February 2017; Published online 2 March 2017
*Corresponding author: Haiyan Li, Tel/Fax: +86-431-84532885; E-mail: hyli99@163.com
Supported by the Project of Science and Technology of Jilin Province (20150204027NY), by the Innovation Platform of Straw Comprehensive Utilization Technology of Jilin Province (2014·C-1) and by the National Natural Science Foundation of China (31401403)
Abstract: [Objective]The objective of this study was to screen lignin-degrading fungi and study their lignin-degrading enzyme using corn stover as substrate.[Methods]Lignin-degrading fungi were isolated from decayed corn stover from different latitude and longitude of Jilin Province by using guaiacol and aniline blue culture medium. Strains were identified by morphological screening followed by the phylogenetic analysis of ITS sequences deciphering their taxonomic status. Through the analysis of the activity of extracellular ligninase produced during the solid-state fermentation of corn stover, the most efficient stover-degrading fungi were selected.[Results]A highly efficient corn stover degrading fungus was isolated and named as W2 (Irpex lacteus W2). Manganese peroxidase produced after 4 to 8 days showed an ascending trend, and reached the peak value of 86.31 U/mL at 8 d, which was 88.20% higher than that of Phanerochaete chrysosporium (P < 0.01). Laccase activity of this fungus was higher than that of Phanerochaete chrysosporium (45.86 U/mL) and reached 20.60 U/mL at 8 d, which was 40.76% higher than the control (P < 0.05).[Conclusion]An efficient corn stover degrading fungus was isolated and identified as Irpex lacteus W2, with high activity of peroxidase and laccase during the degradation process.
Key words: corn stover ligninase screening manganese peroxidase laccase
玉米是吉林省的主要粮食作物,因秸秆不能有效利用,每年秋冬季节大量秸秆被焚烧,不仅造成环境污染,而且使这一良好的生物质资源被浪费。将玉米秸秆中的木质纤维素转化为生物乙醇、纸制品、饲料等的相关技术研究,已成为生物质循环利用领域中的一个重要课题。秸秆中木质素的去除是秸秆生物质能源再利用的基础。秸秆作为天然木质纤维素由纤维素、半纤维素和木质素三大部分组成,其中木质素具有网状结构,作为支撑骨架包围并加固着纤维素和半纤维素[1]。由于木质素是以一种物理屏障包裹着纤维素,其降解必须先于纤维素分解,在对纤维素的生物降解过程中,首先破除木质素外壳是关键[2]。
在现阶段的研究中,木质素降解菌株的研究主要集中在白腐菌类,各国****早已积极地对白腐真菌及其木质素酶制品进行了研究,如Phanerochaete chrysosporium、Trametes versicolor、Aspergillus flavus等[3-6],针对降解玉米秸秆木质素的真菌菌株的筛选报道甚少,且存在秸秆预处理成本高[7]、木质素酶产量低的问题[8],难以实现大规模工业生产[9],基于此,本文从筛选秸秆降解真菌出发采集样品,筛选出一株对秸秆木质素降解有较高酶活性的真菌菌株,以降低秸秆结晶度,为秸秆再利用提供支持菌株。
本文以筛选秸秆高效降解真菌为目的采集样品,主要采集对象为多年玉米秸秆腐殖土、多年腐木等。采集地点为长春、吉林、四平、扶余、敦化、辽源、通化、延边、白城等地,共采集70余份土壤以及腐木样品进行菌株的筛选与分离,共得到约200余株真菌。对其生长特性以及木质素酶系活力进行综合测量分析;利用秸秆为主要碳源进行SSF法获取胞外提取液[10],系统地评价5株菌及黄孢原毛平革菌的胞外提取液对秸秆纤维素酶水解的影响,为构建高效的玉米秸秆复合酶解体系奠定基础。
1 材料和方法 1.1 材料
1.1.1 菌种: 菌株W2、F8-5、F4-6、Bai11、F5-1由本实验室分离得到。黄孢原毛平革菌(Phanerochaete chrysosporium AB361645.1)购自中国工业微生物菌种网,简称:P. chrysosporium,用于筛选产木质素酶真菌的对照菌。
1.1.2 主要试剂和仪器: 核酸Marker、dNTPs、真菌提取试剂盒和PCR产物纯化试剂盒,宝生物工程(大连)有限公司;dNTPs、FastPfu DNA聚合酶,北京全式金生物技术有限公司;ABTS,藜芦醇,上海源叶生物科技有限公司;其余试剂均为国产分析纯。
HDL洁净工作台,北京东联哈尔仪器制造有限公司;RXZ-300A型培养箱,宁波江南仪器厂;UVmini-1240,日本岛津公司;DK-8D型电热恒温水槽,上海森信实验仪器有限公司。HZQ-S200立式双层全温振荡器,哈尔滨市东联电子技术开发有限公司;BSA124S-CW,赛多利斯科学仪器(北京)有限公司。
1.2 培养基
1.2.1 马丁氏培养基(g/L): 参照文献[11]的方法,有改动。葡萄糖10.00,KH2PO4 1.00,MgSO4 0.50,蛋白胨5.00,孟加拉红0.33,ddH2O 1 L,搅拌均匀后加入琼脂粉18 g,120 ℃灭菌20 min。链霉素0.33 g溶于无菌水并入上述培养液后倒入平皿中。
1.2.2 Gu-PDA培养基/AB-PDA培养基: 先制作PDA培养基[12],灭菌20 min后加入0.4%的愈创木酚(Guaiacol)/苯胺蓝(Aniline blue)。
1.2.3 固体发酵培养基: 玉米秸秆:麸皮=7:3,过40目筛,取烘干混合秸秆粉3 g于柱型培养瓶中,(NH4)2SO4=1% (W/V),KH2PO4=0.2% (W/V)制成营养液,每瓶加入15 mL,121 ℃灭菌40 min以上。
1.3 菌株分离 将各地腐土采集样品取1 g加入约9 mL无菌水,置于28 ℃、120 r/min的恒温摇床上30 min。用无菌水梯度稀释3–5个稀释度。吸取菌样品稀释液200 μL涂布在马丁氏培养基平板中。
腐木样品取少量表皮刮片平放于马丁氏培养基,并用无菌的镊子轻轻按压,使其与培养基充分接触。最后将有真菌的培养基置于28 ℃培养箱中,每日观察真菌生长情况,将不同的真菌用接种环沾取接入马丁氏培养基中。
1.4 漆酶生产菌的筛选 将马丁氏培养基中的真菌编号,分别接入AB-PDA培养基和Gu-PDA培养基,2 d后开始观察培养基变色情况。用愈创木酚法识别漆酶的产生,真菌与愈创木酚作用产生的红褐色颜色越深、范围越大,表示漆酶产量越高。将有颜色变化的真菌挑出到PDA培养基28 ℃培养至菌丝体直径3–7 cm后4 ℃临时保藏。
1.5 形态学鉴定 取保藏的初筛菌株,接种于PDA平板上25 ℃培养4 d,观察其菌落形态,用搭片法观察菌株分生孢子区显微形态,查阅《真菌鉴定手册》初步鉴定。
1.6 菌株ITS序列分析 提取真菌基因组DNA:将筛选的真菌分别在PDA培养基上培养1周后,刮取表面菌丝50 mg,于研钵中加液氮研磨,参照全式金有限公司的植物基因组DNA提取方法提取各真菌ITS1-5.8S-ITS2区段。
取10 μL PCR扩增产物经1.0%琼脂糖凝胶电泳检测,有特异明亮条带的PCR产物交由生工生物工程(上海)股份有限公司测序。
系统发育树构建:将所测定的真菌ITS rDNA基因序列与GenBank数据库进行BLAST相似性比较分析,选取与实验菌株亲缘关系较近的菌株及对照菌株用Bio Edit软件进行序列比对,采用MEGA 5.1软件进行系统发育分析,构建系统发育树。
1.7 秸秆固体发酵 活化后的菌种接种到新的PDA中,28 ℃下培养3–5 d后再转接1次,培养5 d左右,用5 mm打孔器在真菌边缘取3个菌饼于固体发酵培养基中。在培养箱中28 ℃静置培养,分别在第2、4、6、8、10、12、14天取样,每种真菌设置3个平行。
1.8 胞外粗酶液制备 分别取真菌培养基15 g加入100 mL无菌水,120 r/min、28 ℃摇床3 h后,取上清液于离心管中7500 r/min离心3 min,然后用0.45 μm滤膜抽滤,所得滤液即其胞外粗酶提取液。每隔2 d测量木质素酶活性,每组设置3个平行。
1.9 酶组分分析 木质素过氧化物酶(Lip)比活力的测定:采用藜芦醇氧化法[13]分光光度法定量检测,以每分钟氧化1 μmol藜芦醇形成1 μmol藜芦醛所需的酶量为1个酶活力单位(IU)。
锰过氧化物酶(MnP)比活力的测定:采用锰离子氧化法[14]分光光度法定量检测,以每分钟氧化形成1 nmol Mn3+为1个酶活力单位(IU)。
漆酶(Lac)比活力的测定:采用ABTS氧化法[15]分光光度法定量检测,利用漆酶氧化底物ABTS,定义每氧化1 μmol ABTS所需的酶为1个酶活力单位(IU)。
分别在培养2–14 d取样测定LiP、MnP、Lac三种酶的比活力,每个数据表示为平均值±标准偏差(n=3),采用Student’s t检验分析。
2 结果和分析 2.1 菌株初选 以同一生长条件下,愈创木酚显色的棕色圈越大颜色越深,漆酶的产量越高为依据,利用Gu-PDA培养基,选取有明显显色圈的菌株在选择培养基上生长与变色圈的出现情形(图 1),初步挑选出5个漆酶生产菌株,测量其培养4 d后的菌落直径(d1)和褐色圈直径(d2),表 1可以看出所选菌株的d1/d2均小于1。结合图 1和表 1,初步判断菌株在4 d时漆酶产量依次为:W2 > Bai11 > F8-5 > F4-6 > F5-1 > P. chrysosporium,而且不同真菌受漆酶显色底物愈创木酚的影响,菌落生长速度不同,变色圈深浅皆有不同。
 |
| 图 1 部分菌株选择培养基上棕色变色圈 Figure 1 Part of the strains produce brown discoloration circles in selection medium. A: Phanerochaete chrysosporium; B: strain W2; C: strain F8-5; D: strain F4-6; E: strain Bai11; F: strain F5-1. |
| 图选项 |
表 1. 初筛菌培养4 d后菌丝圈直径(d1)、变色圈(d2)直径及比值 Table 1. Diameter and ratio of colony (d1) and color-zone formed (d2) by six fungal strains on the screening plates of 6 strains after 4 days of culture
| Strains | Collection location | Colony diameter (d1)/cm | Discoloration circle diameter (d2)/cm | Colony diameter/color circle diameter (d1/d2) |
| W2 | Dunhua, China (敦化) | 3.824±0.287 | 4.501±0.469 | 0.851±0.030 |
| F8-5 | Fuyu, China (扶余) | 1.903±0.082 | 3.110±0.212 | 0.613±0.021 |
| F4-6 | Siping, China (四平) | 2.633±0.319 | 3.015±0.567 | 0.883±0.087 |
| F5-1 | Fuyu, China (扶余) | 1.287±0.018 | 1.572±0.056 | 0.819±0.019 |
| Bai11 | Baicheng, China (白城) | 2.745±0.087 | 2.706±0.049 | 0.6980±0.0317 |
| P. chrysosporium | CICC | 1.327±0.115 | 3.623±1.172 | 0.367±0.445 |
表选项
利用AB-PDA培养基,根据真菌在苯胺蓝培养皿中的显色情况,对真菌MnP和LiP等过氧化物酶定性筛选,培养基的颜色越浅,说明产生的过氧化物酶活性越强。对初选的5株真菌进行苯胺蓝平板褪色试验,对真菌的显色情况记录如表 2,其菌株在AB-PDA培养基上培养8 d时,培养基颜色变化见表 2。结合图 2和表 2,初步判断菌株锰过氧化物酶8 d产量依次为W2 > Bai11 > P. chrysosporium > F8-5 > F5-1 > F4-6,与未接种培养基作对照,可以看出不同真菌使培养基褪色的时间不同,说明其锰过氧化物酶产生时间、浓度等均有差异。
表 2. 优势菌株在AB-PDA培养基平板显色反应 Table 2. Discoloration reaction of advantage strains in AB-PDA medium
| Strains | Days culture/d | |||
| 2 | 4 | 6 | 8 | |
| W2 | ± | + | + + + | + + + + |
| F8-5 | – | – | ± | + |
| F4-6 | – | – | ± | + |
| F5-1 | – | – | ± | + + |
| Bai11 | ± | + | + + + | + + + + |
| P. chrysosporium | – | + | + + | + + + |
| ±: shows that discoloration reaction just starts; +, ++, +++, ++++: show that discoloration reaction is continuously strengthening; –: shows that discoloration reaction does not happen. | ||||
表选项
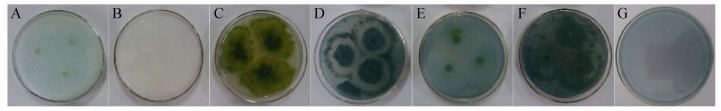 |
| 图 2 不同真菌使苯胺蓝-PDA培养基脱色情况 Figure 2 Different fungi discolored PDA medium with Aniline blue. A: Phanerochaete chrysosporium; B: strain W2; C: strain Bai11; D: strain F5-1; E: strain F8-5; F: strain F4-6; G: control. |
| 图选项 |
2.2 形态学鉴定 对W2、Bai11、F8-5、F4-6、F5-1进行菌种鉴定:结合真菌形态(图 3)及在40×倒置显微镜下其分生孢子区形态(图 4),根据《真菌鉴定手册》[16]得出如下结论。W2:菌落白色致密丝绒质,环形放射延伸,担子生孢子4个,初步鉴定为耙齿菌属;Bai11:菌落淡黄色且丝绒稀疏,顶毛分支少且屈曲,子囊壳壁先黄后黑,四周有毛,顶毛无隔膜,初步鉴定为毛壳菌属;F8-5:菌落白色致密,偶有疣状凸起,分生孢子梗较长,孢子较少,初步鉴定为半知菌;F4-6和F5-1:菌落由白圆形向四周扩展,后从菌落中央产生大量先白后深绿色孢子,孢囊梗垂直对称且纤细,初步鉴定两株菌均为木霉属。
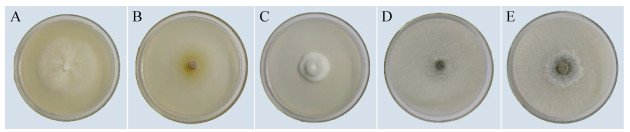 |
| 图 3 真菌形态 Figure 3 Fungi morphology. A: strain W2; B: strain Bai11; C: strain F8-5; D: strain F5-1; E: strain F4-6. |
| 图选项 |
 |
| 图 4 倒置显微镜下孢子形态(400×) Figure 4 Spore morphology under 400× inverted microscope. A: strain W2; B: strain Bai11; C: strain F8-5; D: strain F5-1; E: strain F4-6. |
| 图选项 |
2.3 ITS序列分析 提取其总DNA,选用真菌通用引物序列进行PCR手段克隆扩增菌株的ITS序列,再与GenBank中已有的菌株序列比对。选取与实验菌株亲缘关系较近的菌株及模式对照菌株进行序列比对,构建系统发育树(图 5)。菌株W2的rDNA-ITS序列与Irpex lacteus strain KUC8958 (JX311924.1)序列相似性均为99%,且位于系统发育树同一分支,结合形态学特征将其鉴定为白囊耙齿菌(Irpex lacteus)。菌株Bai11的rDNA-ITS序列与Chaetomium globosum isolate OTU470 (GU934507.1)、Chaetomium elatum strain P10-17a (KT354986.1)相似性均达99%,且与其在系统发育树同一分支,结合形态学特征将其鉴定为毛壳菌(Chaetomium globosum)。F8-5与Myrothecium verrucaria strain 11 (KT803061.1)和Albifimbra viridis (KU845899.1)相似性均为97%,且位于系统发育树不同分支,所以不能确定其种属,分析原因可能由于数据库序列不完全导致,在进化角度上有待于进一步加深菌株的鉴定精度。菌株F4-6和F5-1的rDNA-ITS序列与Trichoderma atroviride voucher NFCF408 (KT852831.1)及Trichoderma viride 1.1 (KT95855)相似性均达100%,且与其在系统发育树同一分支,结合形态学特征将其鉴定为木霉(Trichoderma spp.)。
 |
| 图 5 根据菌株的rDNA-ITS区序列同源性构建系统发育树 Figure 5 Phylogenetic tree of the strains based on rDNA-ITS sequences homology. The number in parentheses is accession number in GenBank, node number represents the confidence level of relatives, the length of branches represents the evolutionary distance and the coefficient is 0.05. |
| 图选项 |
2.4 秸秆固体发酵真菌产酶情况分析
2.4.1 胞外粗酶液组分分析: 为了更直观、更具体地测量木质素酶的变化,同时对菌株在秸秆培养基中的适应性进行了测定,以达到选择性降解秸秆中的木质素的目的,将菌株接入秸秆固体发酵培养基中,分别在培养第2、4、6、8、10、12、14天取样测定LiP、MnP、Lac三种木质素酶的活力。
从图 6、7、8可以得出,6株菌的MnP、Lac、LiP的产量随时间变化曲线在10 d以后趋于平稳,且在10 d内酶活各有1个峰值,即为每个菌株酶活力的最大值,如W2菌MnP活力在4 –8 d呈上升趋势,并且在8 d达到峰值86.31 U/mL;P. chrysosporium的Mnp活力最大值为第6天时45.86 U/mL。且6株菌的MnP酶活力相对高于Lac和LiP的产量(图 6),说明MnP在这几株菌降解秸秆中占主要作用。
 |
| 图 6 锰过氧化物酶的酶活力在降解秸秆过程中随时间的变化 Figure 6 Specific activity of manganese peroxidase with time in the process of fungi degrading corn stover. |
| 图选项 |
 |
| 图 7 漆酶的酶活力在降解秸秆过程中随时间的变化 Figure 7 Specific activity of laccase peroxidase with time in the process of fungi degrading corn stover. |
| 图选项 |
 |
| 图 8 木素过氧化物酶的酶活力在降解秸秆过程中随时间的变化 Figure 8 Specific activity of lignin peroxidase with time in the process of fungi degrading corn stover. |
| 图选项 |
2.4.2 木质素酶的产量及显著性分析: 在胞外粗酶液组分曲线基础上,取每种真菌培养14 d内最佳酶活点,P. chrysosporium作为对照菌进行差异显著性分析(图 9),以评价不同真菌处理的差异。
 |
| 图 9 发酵过程中不同真菌的酶活力分析 Figure 9 Analysis of enzyme activity of different fungi in fermentation process. A: Mnp activity; B: Lac activity; C: LiP activity. The data represent the average of three biological replicates±SD, asterisks indicate significant differences applying Student's t test. *P < 0.05, **P < 0.01. |
| 图选项 |
结合图 2,P. chrysosporium、W2、Bai11、F5-1、F8-5和F4-6这6株菌的MnP酶活力相对较高,说明MnP在这几株菌降解秸秆中占主要作用。其中,W2菌MnP活力的最大值为86.31 U/mL,与P. chrysosporium的W2菌Mnp活力的最大值45.86 U/mL相比,显著高于对照88.20% (P < 0.01,图 9-A)。F4-6及Bai11的MnP最高酶活力同样高于P. chrysosporium的MnP活力。其次,Lac的活力同样影响木质素的分解,P. chrysosporium的Lac活力为14.82 U/mL,而W2菌Lac活力的最大值达到20.60 U/mL,W2显著高于P. chrysosporium 40.76% (P < 0.05,图 9-B)。
3 讨论 本文以筛选秸秆高效降解真菌为目的采集样品,从70余份土壤以及腐木样品进行菌株的筛选与分离,共得到约200余株真菌样品。利用秸秆固态静止发酵获取胞外粗酶提取液的方法,系统地评价5株菌及P. chrysosporium菌的木质素酶系活力,以及对发酵玉米秸秆过程中的木质素酶系的综合测量分析来降低玉米秸秆纤维的结晶度,对增加饲料的适口性[17]、生产工业酒精[18]、增强造纸的柔韧等有重要工业价值。
本研究筛选出1株高效降解秸秆的真菌W2:菌落白色致密丝绒质,环形放射延伸,担子生孢子4个;与Irpex lacteus strain JX311924.1,Irpex lacteus strain JX290578.1及Irpex lacteus strain JX290573.1等多株白囊耙齿菌ITS序列相似度均达到99%以上,结合形态学观察的结果可认为所筛得菌株为白囊耙齿菌。
白囊耙齿菌属于白腐菌,有较强的选择性降解小麦秸秆木质素效果[19],这与本研究中白囊耙齿菌W2的较强木素酶产生能力结果是一致的。本研究分离得到的白囊耙齿菌W2在玉米秸秆为主要底物培养时,在8 d达到MnP峰值86.31 U/mL,与P. chrysosporium菌的6 d时达到最高酶活力45.86 U/mL相比,高出了88.20% (P < 0.01);本研究中白囊耙齿菌W2的Lac活力第8天达到20.60 U/mL,比对照高40.76% (P < 0.05)。与本研究相同酶活定义的前提下,吴柯军等[20]以白桦、红皮云杉木屑作为诱导物时白囊耙齿菌产生的Lac和MnP活性结果低于本研究,分析原因可能是木材中木质素比例高于秸秆,结构致密菌丝难以深入。戴永鑫等[21]用P. chrysosporium固体发酵秸秆,12 d得到最佳MnP酶活0.9 U/mL,Lac酶活1.4 U/mL,其结果MnP与Lac活力均低于本研究,可能与秸秆粉碎程度[22]较低有关。韦丽敏[23]报道Ganoderma降解秸秆过程中的MnP、Lac的酶活力分别在培养后的第4天和第10天达到最高值,分别为85.77 U/mL和1.87 U/mL,其MnP与Lac两种酶活力也低于本研究结果。本研究白囊耙齿菌W2的木质素酶活结果也优于郝杰杰等[24]报道的固体发酵研究Alternaria sp.、Penicillium sp.、Cephalosporium sp.、Tricherderma sp.、Pestalotiopsis sp.和Aspergillus fumigatus降解马尾松凋落叶片过程中产生的Lac及MnP的酶活,因此,本研究分离得到的白囊耙齿菌W2降解秸秆时具有较强的产木质素酶能力。
同时可见,在秸秆为底物的固态发酵中,MnP酶在木质素降解中起主要作用。Fackler等[25]用3种白腐菌木质素腐朽木材时,MnP起主要作用。李超[26]用白囊耙齿菌在固态培养中LiP活性较低,Lac和MnP相对较高,与本研究结果一致,与Pinto等[27]报道的Lac在固态发酵占优势的结果不同,分析原因可能是不同菌种代谢差异[28]导致。
真菌发酵的产酶能力在不同培养基的条件下不同,在玉米秸秆韧皮部为主要成分的培养条件下,白囊耙齿菌W2对其选择性更强。木质素酶产生能力远超过P. chrysosporium。因此,根据以上试验结果, 最终确定白囊耙齿菌W2为高效木质素降解的真菌菌株,为以玉米秸秆为底物的饲料生产以及复合菌降解生物制浆[29]提供备选,也为研究微生物降解秸秆的作用机理奠定了良好的基础。
References
| [1] | Kumar P, Barrett DM, Delwiche MJ, Stroeve P. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production. Industrial & Engineering Chemistry Research, 2009, 48(8): 3713-3729. |
| [2] | Phutela UG, Dar RA. Role of lignocellulolytic thermophilic fungus Thermoascus aurantiacus MTCC 375 in paddy straw digestibility and its implication in biogas production. African Journal of Microbiology Research, 2014, 8(17): 1798-1802. DOI:10.5897/AJMR |
| [3] | Yan H, Su J, Yu CL, Ai HY, Zhang XT. Isolation and screening of fungal strains with high ligninolytic enzyme activities. Journal of Zhejiang University (Agriculture & Life Sciences), 2011, 37(3): 259-262. (in Chinese) 燕红, 苏俊, 于彩莲, 艾恒雨, 张晓甜. 高效木质素降解菌株的分离筛选. 浙江大学学报(农业与生命科学版), 2011, 37(3): 259-262. |
| [4] | Wang M. Progress of Research on White rot fungi degradating lignin. Journal of Hengshui University, 2011, 13(1): 51-53. (in Chinese) 王敏. 白腐菌降解木质素研究进展. 衡水学院学报, 2011, 13(1): 51-53. |
| [5] | Liu B, Huang HY, Yu HB, Zhang XY. Effects of lignocellulose species on selective lignin-degrading ability of white rot fungus. Journal of Central South University of Forestry & Technology, 2012, 32(8): 108-111. (in Chinese) 刘波, 黄慧艳, 余洪波, 张晓昱. 木质纤维素种类对白腐菌降解选择性的影响. 中南林业科技大学学报, 2012, 32(8): 108-111. |
| [6] | Demiralp B, Büyük ?, Aras S, Cansaran-Duman D. Industrial and biotechnological applications of laccase enzyme. Türk Hijiyen ve Deneysel Biyoloji Dergisi, 2015, 72(4): 351-368. |
| [7] | Banerjee S, Mudliar S, Sen R, Giri B, Satpute D, Chakrabarti T, Pandey RA. Commercializing lignocellulosic bioethanol:Technology bottlenecks and possible remedies. Biofuels, Bioproducts and Biorefining, 2010, 4(1): 77-93. DOI:10.1002/bbb.v4:1 |
| [8] | Toyokawa C, Shobu M, Tsukamoto R, Okamura S, Honda Y, Kamitsuji H, Izumitsu K, Suzuki K, Irie T. Effects of overexpression of PKAc genes on expressions of lignin-modifying enzymes by Pleurotus ostreatus. Bioscience, Biotechnology, and Biochemistry, 2016, 80(9): 1759-1767. DOI:10.1080/09168451.2016.1158630 |
| [9] | Paris MJ, Cardoso MAT, Fonseca LP. Towards bioethanol:an overview of whole lignocellulose processing. Research and Reviews in Materials Science and Chemistry, 2014, 4(2): 55-118. |
| [10] | Jing DB, Li PJ, Tai PD, Liu W, Gong ZQ. Study on the optimization of solid fermentation for ligninase production from Coriolus versicolor. Microbiology, 2004, 31(5): 19-23. (in Chinese) 靖德兵, 李培军, 台培东, 刘宛, 巩宗强. 彩绒革盖菌固体发酵生产木质素酶工艺优化研究. 微生物学通报, 2004, 31(5): 19-23. |
| [11] | Dinis MJ, Bezerra RMF, Nunes F, Dias AA, Guedes CV, Ferreira LMM, Cone JW, Marques GSM, Barros ARN, Rodrigues MAM. Modification of wheat straw lignin by solid state fermentation with white-rot fungi. Bioresource Technology, 2009, 100(20): 4829-4835. DOI:10.1016/j.biortech.2009.04.036 |
| [12] | 张新亮. 猪苓液体发酵及其多糖活性的研究. 福建农林大学硕士学位论文, 2010. |
| [13] | Zhang M, Shukla P, Ayyachamy M, Permaul K, Singh S. Improved bioethanol production through simultaneous saccharification and fermentation of lignocellulosic agricultural wastes by Kluyveromyces marxianus 6556. World Journal of Microbiology and Biotechnology, 2010, 26(6): 1041-1046. DOI:10.1007/s11274-009-0267-0 |
| [14] | Cantarella G, d'Acunzo F, Galli C. Determination of laccase activity in mixed solvents:comparison between two chromogens in a spectrophotometric assay. Biotechnology and Bioengineering, 2003, 82(4): 395-398. DOI:10.1002/(ISSN)1097-0290 |
| [15] | Bie CY, Jiang T, Jiang XY, Zhang SY. Screening and comparison of growth characteristics of lignin-degradating advantage strains in soil of different regional sampling points. Chinese Journal of Animal Nutrition, 2013, 25(7): 1656-1662. (in Chinese) 别春雨, 姜涛, 蒋晓云, 章世元. 不同地区取样点土壤中木质素降解优势菌株的筛选及生长特性比较. 动物营养学报, 2013, 25(7): 1656-1662. |
| [16] | 魏景超. 真菌鉴定手册. 上海: 上海科学技术出版社, 1979. |
| [17] | Wang YY, Diao ZM, Chen KL. Application of white rot fungi and the straw feed. Qinghai Prataculture, 2014, 23(4): 36-40. (in Chinese) 王燕雲, 刁治民, 陈克龙. 白腐真菌资源及其在饲料方面的应用. 青海草业, 2014, 23(4): 36-40. |
| [18] | Suhara H, Kodama S, Kamei I, Maekawa N, Meguro S. Screening of selective lignin-degrading basidiomycetes and biological pretreatment for enzymatic hydrolysis of bamboo culms. International Biodeterioration & Biodegradation, 2012, 75(6): 176-180. |
| [19] | 别春雨. 白耙齿菌的筛选鉴定及其产酶与降解秸秆条件的优化. 扬州大学硕士学位论文, 2014. |
| [20] | Wu KJ, Yan SP, Lu H, Li HF, Wang QY. Difference in the activity of extracellular lignocellulolytic enzymes and the intracellular proteome of irpex lacteus induced by different wood substrates. Scientia Silvae Sinicae, 2016, 52(8): 157-166. (in Chinese) 吴柯军, 闫绍鹏, 卢宏, 李海峰, 王秋玉. 不同木质底物诱导下白囊耙齿菌胞外木质纤维素酶活性和胞内蛋白质组的差异. 林业科学, 2016, 52(8): 157-166. |
| [21] | Dai YX, Wang HK, Liu YH, Lu FP. Study on lignin biological degradation of straw with white-rot fungi. Journal of Tianjin University of Science & Technology, 2007, 22(4): 24-26, 51. (in Chinese) 戴永鑫, 王海宽, 刘逸寒, 路福平. 白腐菌对秸秆中木质素生物降解的研究. 天津科技大学学报, 2007, 22(4): 24-26, 51. |
| [22] | Jiang QH, Jiang Y, Zhang TJ, Hu QK. Fermentation optimization of fuel ethanol on maize straw fungal degradation liquid. Renewable Energy Resources, 2015, 33(12): 1872-1875. (in Chinese) 姜庆宏, 姜月, 张铁军, 胡庆凯. 玉米秸秆真菌降解液生产燃料乙醇的发酵条件优化. 可再生能源, 2015, 33(12): 1872-1875. |
| [23] | 韦丽敏. 降解秸秆的白腐真菌的筛选、优化及混菌发酵研究. 甘肃农业大学硕士学位论文, 2013. |
| [24] | Hao JJ, Song FQ, Tian XJ, Huang F, Zhang P, Zhang ZJ. Decomposition of Pinus massoniana needle driven by deuteromycetes-dynamics of lignocellulolytic enzymes. Scientia Silvae Sinicae, 2006, 42(11): 69-75. (in Chinese) 郝杰杰, 宋福强, 田兴军, 黄丰, 张鹏, 张智俊. 几株半知菌对马尾松落叶的分解-木质纤维素酶的活性动力学. 林业科学, 2006, 42(11): 69-75. DOI:10.3321/j.issn:1001-7488.2006.11.013 |
| [25] | Fackler K, Gradinger C, Hinterstoisser B, Messner K, Schwanninger M. Lignin degradation by white rot fungi on spruce wood shavings during short-time solid-state fermentations monitored by near infrared spectroscopy. Enzyme and Microbial Technology, 2006, 39(7): 1476-1483. DOI:10.1016/j.enzmictec.2006.03.043 |
| [26] | 李超. 白囊耙齿菌胞外漆酶的纯化及酶学性质的研究. 东北林业大学硕士学位论文, 2009. |
| [27] | Pinto PA, Dias AA, Fraga I, Marques G, Rodrigues MAM, Cola?o J, Sampaio A, Bezerra RMF. Influence of ligninolytic enzymes on straw saccharification during fungal pretreatment. Bioresource Technology, 2012, 111: 261-267. DOI:10.1016/j.biortech.2012.02.068 |
| [28] | Sharma RK, Arora DS. Bioprocessing of wheat and paddy straw for their nutritional up-gradation. Bioprocess and Biosystems Engineering, 2014, 37(7): 1437-1445. DOI:10.1007/s00449-013-1116-y |
| [29] | Wang YX, Liu Q, Yan L, Gao YM, Wang YJ, Wang WD. A novel lignin degradation bacterial consortium for efficient pulping. Bioresource Technology, 2013, 139: 113-119. DOI:10.1016/j.biortech.2013.04.033 |
