孙思1, 牛建军2,3,4, 王岱1


1.分子疫苗学和分子诊断学国家重点实验室, 厦门大学, 福建 厦门 361102;
2.厦门大学附属中山医院, 福建 厦门 361004;
3.厦门大学公共卫生学院, 福建 厦门 361102;
4.福建医科大学公共卫生学院, 福建 福州 350004
收稿日期:2016-11-21;修回日期:2017-01-03;网络出版日期:2017-01-19
基金项目:国家自然科学基金(31370166,81473251,81301474);福建省自然科学基金(2014J01139,2015J01345);厦门大学校长基金(20720160060)
*通信作者:王岱, Tel:+86-592-2880630;E-mail:daiwang@xmu.edu.cn
摘要:三型分泌系统(Type 3 secretion system,T3SS)作为存在于革兰氏阴性菌中的分泌系统之一,对革兰氏阴性菌的致病有重要作用。T3SS的致病作用体现在T3SS能直接将效应蛋白转运至宿主细胞,进而通过效应蛋白调控细胞的一系列通路,促进细菌定殖于细胞。而效应蛋白的转运受到两方面因素的调控,一方面是效应蛋白本身的信号序列,另一方面是T3SS相关蛋白的辅助。本文围绕近年来T3SS的构成、效应蛋白转运机制方面的最新进展进行概要综述。
关键词: 三型分泌系统 效应蛋白 转运 分泌信号
Advances in studies of translocation of effector by bacterial type 3 secretion system
Sun Si1, Niu Jianjun2,3,4, Wang Dai1


1.State Key Laboratory of Molecular Vaccinology and Molecular Diagnostics, Xiamen University, Xiamen 361102, Fujian Province, China;
2.Zhongshan Hospital Xiamen University, Xiamen 361004, Fujian Province, China;
3.Public Health School of Xiamen University, Xiamen 361102, Fujian Province, China;
4.Public Health School of Fujian Medical University, Fuzhou 350004, Fujian Province, China
Received 21 November 2016; Revised 3 January 2017; Published online 19 January 2017
*Corresponding author: Wang Dai, Tel:+86-592-2880630;E-mail:daiwang@xmu.edu.cn
Supported by the National Natural Science Foundation of China (31370166, 81473251, 81301474), by the Natural Science Foundation of Fujian Province (2014J01139, 2015J01345) and by the President of Xiamen University Foundation (20720160060)
Abstract: Type 3 secretion system, as one of the secretion systems for Gram-negative bacterial, plays an important role in the pathopoiesia of Gram-negative bacteria. Bacteria can use T3SS as a canal that directly translocates effectors to host cell. Effectors in host cell manipulate a subset of signaling pathways of host cell to promote bacterial colonization in cells. The translocation of effectors is regulated by two factors, one is the signal sequences of effector, and the other is the regulation of T3SS-associated proteins. In this article, we review recent advances in studies on the constitute of T3SS and the mechanism of effectors translocation.
Key words: type 3 secretion system effector translocation secretion signal
1994年,研究发现耶尔森氏菌(Yersinia pestis)能将效应蛋白直接转运到被感染细胞的细胞质中,并且在当时研究人员认为这一过程与已知的细菌分泌途径无关,所以称之为三型分泌(Type 3 secretion,T3S)[1]。同时,研究人员在发现了一组位于同一操纵子区域的基因所编码翻译的蛋白对效应蛋白跨细菌膜和哺乳动物细胞膜转运非常重要[2]之后,就将该组蛋白称之为三型分泌系统(Type 3 secretion system,T3SS)。近些年研究发现,T3SS是由二十多种膜结构装置蛋白和转运蛋白组成的跨细菌内外膜、细胞外空隙和宿主细胞膜的环状中空管道[3]。在致病菌感染宿主的早期,效应蛋白在细菌中合成,通过T3SS跨膜转运至宿主细胞后,将对宿主细胞产生重塑细胞骨架,调控免疫反应及细胞生存等作用,从而达到促进细菌定殖于宿主细胞的目的[4]。效应蛋白从细菌转运至宿主细胞的过程需要本身的信号序列[5]和(或)伴侣蛋白的辅助[6],同时受到T3SS的调控。本文围绕近年来T3SS的构成、效应蛋白转运和分泌机制方面的最新进展进行概要综述,将有助于阐明致病菌早期感染宿主的机制,有利于疾病的预防和治疗。
1 T3SS的构成 T3SS不仅存在于沙门氏菌(Salmonella enterica spp.)、伯克氏菌(Burkholderia spp.)、衣原体(Chlamidia spp.)、绿脓杆菌(Pseudomonas aeruginosa)、副溶血性弧菌(Vibrio parahaemolyticus)、志贺氏菌(Shigella spp.)、肠出血性大肠杆菌(Enterohemorrhagic E. coli,EHEC)、肠致病性大肠杆菌(Enteropathogenic E. coli,EPEC)这些动物致病菌中,同时也存在于丁香假单孢菌(Pseudomonas syringae)、青枯雷尔氏菌(Ralstonia solanacearum)、菊欧文菌(Erwinia chrysanthemi)这些植物致病菌中,已有研究表明T3SS对于致病菌的致病性非常重要[7]。并且T3SS也发现存在于共生菌中,如根瘤菌(Rhizobium)[8]。下面以EHEC为例,简要概述T3SS的构成。
1.1 LEE毒力岛 T3SS蛋白可以分成4类:细菌膜结构装置蛋白(Bacterial membrane apparatus proteins)、转运蛋白(Translocator)、效应蛋白(Effector protein)、T3SS伴侣蛋白(Type 3 chaperones)[9]。在EHEC中编码这些蛋白的基因主要位于肠上皮抹平基因簇(Locus of enterocyte effacement,LEE)毒力岛上,LEE的长度约为35 kb,包含5个不同的操纵子(LEE1、LEE2、LEE3、LEE4、LEE5) 共41个阅读框。T3SS的膜结构装置蛋白主要由其编码,同时该毒力岛也编码效应蛋白(Tir,Map,SepZ等)、伴侣蛋白(如CesT)、LEE编码调节因子(LEE-encoded regulator,Ler)以及紧密黏附素(Intimin)等[9]。
LEE受到Ler和环境因素的调控。Ler是T3SS关键的转录调节因子,能通过抑制全局调控因子类组蛋白核结构蛋白(histone-like nucleoid structuring protein,HNS),从而激活LEE2、LEE3、LEE4和LEE5的转录,ler本身的转录受到群体效应和SOS (一种DNA损伤修复机制)的激活调控[9]。LEE全局调控活化子GrlA (Global regulator of LEE activator,GrlA)是Ler的正反馈调节因子,而LEE全局调控抑制子(Global regulator of LEE repressor,GrlR)通过与GrlA结合抑制GrlA的作用,同时grlA和grlR两者的转录均能被Ler激活[10]。环境的调控有细菌与宿主的接触和群体效应,细菌与宿主的接触能诱导T3SS的启动,因为EspB和EspD (两者均是转运蛋白)是细菌感知宿主的关键因子,表明细菌在与宿主接触之前,T3SS的跨膜通道大部分都已组装[8],所以细菌与宿主的接触可能会调控效应蛋白的表达。群体效应的自诱导因子(Auto-inducers)能适当改变LEE毒力岛基因的转录[11]。
1.2 T3SS跨膜通道 T3SS跨膜通道由膜结构装置蛋白和转运蛋白构成,共分为7部分,从细菌延伸到宿主细胞分别为ATP酶复合体(ATPase complex)、C环、分泌装置(Export apparatus)、基体(Basal body)、针状复合体(Needle complex)、末端复合体(Tip complex)和转运孔(Translocator pore)(图 1)[3-4]。
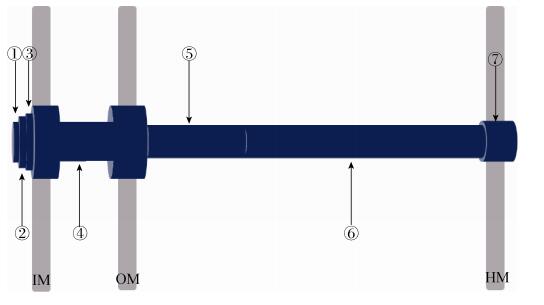 |
| 图 1 T3SS跨膜通道概括 Figure 1 General view of the transmembrane channel of T3SS. From left to right, ①: ATPase complex; ②: C ring; ③: Export apparatus; ④: Basal body; ⑤: Needle complex; ⑥: Tip complex; ⑦: Translocator pore. IM: bacterial inner membrane; OM: bacterial outer membrane; HM: host cell membrane. |
| 图选项 |
T3SS的基底主要由嵌入内外膜的环状结构所组成。外膜的环状结构是由12个单体EscC构成,EscC的氨基端突入到周质,形成长16 nm直径7 nm的管道。内膜的环状结构包括2层,内层由24个单体EscJ构成,外层是由24个单体EscD构成,EscJ在周质与EscC相连,EscD的氨基端位于胞质区,能与T3SS分泌装置相连[12]。除了内外膜的环状结构,基底还包括EscI和EscP,EscI与EscJ相连[12],并能形成1个环状中空管道与位于细菌外的针状复合体相连,EscP作为T3SS的“分子尺”能调节针状复合体的长度[13]。分泌装置由EscR、EscS、EscT、EscU、EscV构成,被基底内膜环状结构所包围。EscR、EscS、EscT三者形成跨膜区,9个单体EscV形成1个环状结构[14]。C环是由SepQ构成的30 nm的环状结构,附着于由EscD的氨基端形成的底座,C环本身也作为ATP酶复合体的承载体[15]。ATP酶复合体由EscN、EscL和EscO构成,其中EscN是ATP酶,在T3SS中起到能量转换的作用。ATP酶复合体的结构主要是由6个单体EscN所形成的环状结构,同时EscL与EscV和SepQ相连,EscO与EscV相连,起到稳固ATP酶复合体的作用[16]。针状复合体由EscF构成(长度在EHEC中为23 nm),末端复合体由EspA构成(长度在EHEC为600 nm),转运孔由EspB和EspD构成。
2 效应蛋白的转运 在EHEC中,效应蛋白进入宿主细胞后,将对宿主细胞产生重塑细胞骨架、调控免疫反应及细胞生存等作用,从而达到促进细菌定殖于宿主细胞的目的。但不同的效应蛋白对宿主细胞的调控作用存在拮抗,如SepZ会抑制细胞凋亡,而Map却会诱导宿主细胞凋亡,为了避免这类拮抗效应,完成细菌对宿主细胞的调控以利于其侵染定殖,需要效应蛋白有序地转运入宿主细胞[4]。
2.1 效应蛋白转运和分泌的关系 T3SS的生物学功能是将效应蛋白从细菌的胞质中直接转运入宿主细胞,但在适合的实验条件下,效应蛋白能从细菌分泌到细菌外基质中,而不是转运入宿主细胞。比如,耶尔森氏菌在去除钙离子的培养基中37培养能分泌效应蛋白[17],EHEC和EPEC能在DMEM或M9培养基中分泌效应蛋白[18]。效应蛋白的这种分泌性质,给我们提供了一种易于控制的条件来研究效应蛋白的转运机制。
2.2 研究方法 研究效应蛋白转运和分泌的方法主要是通过效应蛋白与标签蛋白的融合来检测。目前所使用的标签蛋白包括腺苷酸环化酶(Adenylate cyclase,CyaA)、β-内酰胺酶(β-lactamase,Bla)、四半胱氨酸荧光素标签(Tetracysteine motif tag labelled with the fluorescein-based biarsenical dye,Cys-FlAsH)、光氧电压(Light-oxygen-voltage,LOV)、分裂绿色荧光蛋白(Split green fluorescent protein,split-GFP),各方法的优缺点见表 1[19]。通过这些研究方法,研究者发现效应蛋白的转运需要位于其本身的效应蛋白氨基端分泌信号(N-terminal secretion signal,NSS)、效应蛋白的伴侣蛋白结合区(Chaperone bingding domain,CBD)和其他部位的信号序列。
表 1. 各标签的优缺点 Table 1. Advantage and disadvantage of these label
| Label | Advantage | Disadvantage |
| Bla | 1: High sensitivity 2: Broad applicability | 1: Modification of effectors 2: No real time secretion detection 3: Influence host cell |
| CyaA | 1: High sensitivity 2: Broad applicability | 1: No real time secretion detection 2: Influence host cell |
| Cys-Flash | 1: Potential broad applicability 2: Real time secretion detection 3: No influence to host cell | 1: Modification of effectors 2: Low sensitivity 3: Toxic to host cell |
| split-GFP | 1: High sensitivity 2: Real time secretion detection 3: Easy calibration | 1: Limited applicability 2: Influence host cell |
| LOV | 1: Small size 2: Oxygen-dependent fluorescence | 1: Less fluorescence 2: Limited applicability |
表选项
2.3 效应蛋白的信号序列
2.3.1 效应蛋白氨基端分泌信号(N-terminal secretion signal,NSS): 研究者发现单独效应蛋白NSS就能分泌,如Sory等发现耶尔森氏菌中的效应蛋白YopE和YopH分别只需氨基端的15个和17个氨基酸残基就足以分泌到细菌外基质中[20],同样,在EHEC和EPEC中,Charpentier等发现Tir、Map、EspF的分泌只需各自氨基端的20个氨基酸残基,对于Cif,它所需的氨基端的氨基酸残基数更少,只要16个就足以分泌到细胞外基质[21]。
不同于通过信号肽(Signal sequence,Sec)依赖型分泌系统所分泌的效应蛋白,T3SS效应蛋白的NSS没有一致的氨基端序列[22],并且也没有保守的三级结构,如同时对YopE和YopH的X射线晶体结构的研究发现,YopH的氨基端存在1个α螺旋,但YopE没有。所以Ghosh等猜测NSS序列不一致性可能使效应蛋白更易于被诱导形成一个特定结构从而被T3SS分泌装置识别[23]。但其他研究者发现效应蛋白氨基端的mRNA信号(mRNA signal)也能使效应蛋白转运入宿主细胞,这一信号发现存在于耶尔森氏菌中[24],同时Niemann等的研究表明,沙门氏菌效应蛋白基因gtgA、gigR、glgB、sseL、steD起始密码子前的25 bp的碱基能使标签蛋白CyaA进入宿主细胞[25]。基于此,有研究人员认为,效应蛋白的分泌可能依靠的不是氨基酸序列,而是mRNA信号,但这一点目前还没有共识。
虽然NSS没有一致的氨基酸序列,但研究人员发现NSS的亲水脂性有利于效应蛋白的分泌,Scott等对YopE氨基端2-8个氨基端残基分别用丝氨酸或异亮氨酸置换,分析了这128个片段的分泌情况后,发现具有亲水脂性的片段比疏水或亲水性的片段更易使YopE分泌[26]。
2.3.2 效应蛋白的伴侣蛋白结合区(Chaperone bingding domain,CBD): 效应蛋白的NSS不足以使得效应蛋白有效转运入宿主细胞,如在耶尔森氏菌中YopE至少需要氨基端的49个氨基端残基才能在宿主细胞中检测到与对照组有差异的cAMP水平[27],同样的情况也发生在YopH上,它需要氨基端的71个氨基酸残基才能进入宿主细胞[20]。在EHEC和EPEC中也有类似的情况,如Tir的氨基端的20个氨基酸残基虽然能被转运至宿主细胞,但转运效率与全长的Tir相比相差了1倍。而Boyd发现这段紧随NSS之后的氨基酸序列正是CBD,它是效应蛋白与相应伴侣蛋白结合的区域[17, 28]。
T3SS的伴侣蛋白通常比较小,以二聚体的形式存在于细胞质中,具有维持效应蛋白胞内稳定和协助效应蛋白胞内转运及之后分泌的功能[29]。伴侣蛋白有不同的种类,其中与效应蛋白相互作用的伴侣蛋白是Ⅰ类伴侣蛋白,根据它们结合效应蛋白数目的多少又分为Ⅰ A类和Ⅰ B类,前者指只与一种效应蛋白结合的伴侣蛋白,如EHEC和EPEC中的CesF,后者指可以与多种效应蛋白结合的伴侣蛋白,有志贺菌中的Spa15,EPEC的CesT等[29-33]。在氨基酸序列方面,ⅠB类伴侣蛋白表现出较弱的相似性,但它们的二级结构却表现出保守的α-β-β-β-α-β-β-α结构[34]。
效应蛋白的CBD与伴侣蛋白的结合参与到效应蛋白的转运,如在EHEC和EPEC中,Tir、Map在野生菌的转运效率是在敲除了它们伴侣蛋白cesT的缺陷型菌的2倍,这说明CesT参与到Tir和Map的转运[21]。同样在耶尔森氏菌中,YopE的分泌百分比在野生菌中是83%,但在敲除了sycE的缺陷型菌中是32%[17],同时其CBD的缺失会致使YopE无法转运入宿主细胞内[28],这说明SycE辅助了YopE的分泌和转运。并且Luo等发现Tir与CesT的结合不会影响Tir其他部位的折叠和酶活性,即伴侣蛋白与效应蛋白CBD的结合可能对效应蛋白其他部位没有影响[34]。
效应蛋白CBD和伴侣蛋白的结合也可能参与到效应蛋白的有序转运。如在EPEC中,伴侣蛋白CesT可以协助效应蛋白Tir、Map、EspH、NleA、EspG、NleG、NleH、NleH2以及SepZ的分泌,而在Tir不存在的情况下,效应蛋白的分泌量急剧减少,这可能是因为空余的CesT增多,从而阻遏了三型分泌系统[6]。这一情况也见于细菌性疮痂病的伴侣蛋白HpaB,它能协助效应蛋白HpaA和其他效应蛋白的分泌,在HpaA缺失的时候,HpaB的空余量增加,从而导致T3SS其余效应蛋白分泌的减少,由此可知效应蛋白的有序转运可能受到HpaB的影响[35]。
同时也有研究发现部分效应蛋白的转运不受CBD的影响,如EHEC和EPEC中的效应蛋白Cif和EspF,两者的转运在野生菌和敲除了cesT的缺陷型菌中没有差异[21]。
2.3.3 其他部位的信号序列: 效应蛋白的转运除了受到NSS和CBD的影响,也有研究发现效应蛋白的其他部位也对其转运有影响。在EHEC中,Tir的转运需要其Tir羧基端的519到524这6个氨基酸残基[36]。同样,在沙门氏菌中,效应蛋白SipB通过SPI-1 T3SS的分泌有赖于其羧基端的300至593这一亲水脂性区域[37]。
基于以上信息,我们概括了效应蛋白转运受自身部位影响的示意图(图 2)。
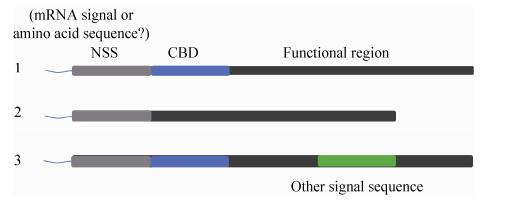 |
| 图 2 效应蛋白信号序列示意图 Figure 2 Model of effetor signal sequence. 1: Effector contained NSS and CBD. 2: Effector contained NSS alone; 3: Effector contained NSS, CBD and other signal sequence. |
| 图选项 |
2.4 效应蛋白在T3SS跨膜通道上的定位 效应蛋白能定位于T3SS的C环,如在沙门氏菌中IpaB、IpaC、IpgB1和VirA均能与Spa33相互作用[38],但目前不清楚效应蛋白哪个部位结合到C环。除了效应蛋白本身与C环结合,伴侣蛋白在效应蛋白定位于T3SS跨膜通道上也发挥重要作用。
伴侣蛋白与CBD的结合一方面可能使效应蛋白本身无法定位于膜上。如耶尔森氏菌效应蛋白YopO的CBD与伴侣蛋白SycO结合后,能阻止YopO定位于膜上,同时,YopO CBD的缺失不会影响YopO的分泌和转运,但会使YopO在宿主细胞中无法定位于膜上[39]。SycE和SycT也发现能掩盖它们相对应的效应蛋白YopE和YopT的膜定位区域[40]。
而另一方面,伴侣蛋白与CBD结合形成的复合体能与T3SS ATP酶复合体结合。如在EPEC中,CesT能与EscN结合从而定位于细菌内膜,但当CesT的142号氨基酸突变后,与EscN将无法结合,会导致Tir无法分泌[29],这一点在在沙门氏菌中也有实验验证,InvC能与SicP-SptP复合体结合[41]。除此之外,Kris等在衣原体中发现,伴侣蛋白-效应蛋白复合体Ct260-Cap1、Ct260-Ct618能与C环蛋白CdsQ结合,揭示了伴侣蛋白-效应蛋白复合体定位于T3SS跨膜通道上的另一种方式[42]。
2.5 “开关蛋白”对效应蛋白转运的调控 除了上述信号调控,效应蛋白的转运还受到“开关蛋白”的调控。在EHEC和EPEC中,SepL作为YopN和TyeA的同源蛋白,它与SepD一起作为“开关蛋白”,起到使转运蛋白优先分泌的作用,同时SepL或SepD的缺失会增加效应蛋白分泌,而减少转运蛋白分泌[18]。SepL的羧基端能与Tir作用,但不与其他效应蛋白作用,这种相互作用可能对SepL调控效应蛋白的分泌有影响,但对转运蛋白的分泌无影响[43]。目前为止,SepL与Tir相互作用和效应蛋白分泌调控之间联系的分子机制尚不清楚。然而,考虑到Tir是第一个通过T3SS分泌的效应蛋白,SepL与Tir的作用可能会阻遏其余效应蛋白与T3SS ATP酶复合体中EscN的有效接触。
3 问题和展望 近年来,有关T3SS的研究日益增多,但由于膜相关蛋白的结构研究困难,导致T3SS跨膜通道依然没有研究透彻。另一方面,效应蛋白转运机制的具体情况也不明朗,不同的效应蛋白受不同信号序列的影响不一致,特别是对于NSS,这一信号序列如何发挥作用依然存在争论。同时效应蛋白如何定位于跨膜通道上也没有定论,到底是效应蛋白本身直接定位于跨膜通道还是通过伴侣蛋白的辅助,亦或是这两种机制同时存在?再者,对于开关蛋白在效应蛋白转运方面的研究目前只知SepL与Tir有相互作用,但具体的机制也不清楚。不过,因为标签蛋白的增加和实时监测技术的进步[19],研究效应蛋白分泌和转运的方法将会容易实现,同时,结构生物学中超低温冷冻电镜的应用也将促进蛋白的结构研究[44],这些都将有利于效应蛋白转运机制的研究。而效应蛋白转运机制研究的发展,也将有利于阐明上述致病菌早期的致病过程,为预防和治疗上述致病菌所致疾病提供理论基础。
致谢: 感谢厦门大学公共卫生学院研究生张智、罗宇对文章撰写所提出的宝贵意见及建议。
References
| [1] | Rosqvist R, Magnusson KE, Wolf-Watz H. Target cell contact triggers expression and polarized transfer of Yersinia YopE cytotoxin into mammalian cells. The EMBO Journal, 1994, 13(4): 964-972. |
| [2] | Michiels T, Vanooteghem JC, de Rouvroit CL, China B, Gustin A, Boudry P, Cornelis GR. Analysis of virC, an operon involved in the secretion of Yop proteins by Yersinia enterocolitica. Journal of Bacteriology, 1991, 173(16): 4994-5009. DOI:10.1128/jb.173.16.4994-5009.1991 |
| [3] | Portaliou AG, Tsolis KC, Loos MS, Zorzini V, Economou A. Type Ⅲ secretion: building and operating a remarkable nanomachine. Trends in Biochemical Sciences, 2016, 41(2): 175-189. DOI:10.1016/j.tibs.2015.09.005 |
| [4] | Galán JE, Lara-Tejero M, Marlovits TC, Wagner S. Bacterial type Ⅲ secretion systems: specialized nanomachines for protein delivery into target cells. Annual Review of Microbiology, 2014, 68: 415-438. DOI:10.1146/annurev-micro-092412-155725 |
| [5] | Filloux A. Secretion signal and protein targeting in bacteria: a biological puzzle. Journal of Bacteriology, 2010, 192(15): 3847-3849. DOI:10.1128/JB.00565-10 |
| [6] | Thomas NA, Deng WY, Baker N, Puente J, Finlay BB. Hierarchical delivery of an essential host colonization factor in enteropathogenic Escherichia coli. The Journal of Biological Chemistry, 2007, 282(40): 29634-29645. DOI:10.1074/jbc.M706019200 |
| [7] | Tampakaki AP, Skandalis N, Gazi AD, Bastaki MN, Panagiotis FS, Charova SN, Kokkinidis M, Panopoulos NJ. Playing the " Harp" : evolution of our understanding of hrp/hrc genes. Annual Review of Phytopathology, 2010, 48(1): 347-370. DOI:10.1146/annurev-phyto-073009-114407 |
| [8] | Büttner D. Protein export according to schedule: architecture, assembly, and regulation of type Ⅲ secretion systems from plant-and animal-pathogenic bacteria. Microbiology and Molecular Biology Reviews, 2012, 76(2): 262-310. DOI:10.1128/MMBR.05017-11 |
| [9] | Levine JA, Hansen AM, Michalski JM, Hazen TH, Rasko DA, Kaper JB. H-NST induces LEE expression and the formation of attaching and effacing lesions in enterohemorrhagic Escherichia coli. PLoS One, 2014, 9(1): e86618. DOI:10.1371/journal.pone.0086618 |
| [10] | Russell RM, Sharp FC, Rasko DA, Sperandio V. QseA and GrlR/GrlA regulation of the locus of enterocyte effacement genes in enterohemorrhagic Escherichia coli. Journal of Bacteriology, 2007, 189(14): 5387-5392. DOI:10.1128/JB.00553-07 |
| [11] | Reading NC, Sperandio V. Quorum sensing: the many languages of bacteria. FEMS Microbiology Letters, 2006, 254(1): 1-11. DOI:10.1111/fml.2006.254.issue-1 |
| [12] | Gaytan MO, Martínez-Santos VI, Soto E, González-Pedrajo B. Type three secretion system in attaching and effacing pathogens. Frontiers in Cellular and Infection Microbiology, 2016, 6: 129. |
| [13] | Feria JM, García-Gómez E, Espinosa N, Minamino T, Namba K, González-Pedrajo B. Role of EscP (Orf16) in injectisome biogenesis and regulation of type Ⅲ protein secretion in enteropathogenic Escherichia coli. Journal of Bacteriology, 2012, 194(22): 6029-6045. DOI:10.1128/JB.01215-12 |
| [14] | Diepold A, Wagner S. Assembly of the bacterial type Ⅲ secretion machinery. FEMS Microbiology Reviews, 2014, 38(4): 802-822. DOI:10.1111/1574-6976.12061 |
| [15] | Hu B, Morado DR, Margolin W, Rohde JR, Arizmendi O, Picking WL, Picking WD, Liu J. Visualization of the type Ⅲ secretion sorting platform of Shigella flexneri. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(4): 1047-1052. DOI:10.1073/pnas.1411610112 |
| [16] | Romo-Castillo M, Andrade A, Espinosa N, Feria JM, Soto E, Díaz-Guerrero M, González-Pedrajo B. EscO, a functional and structural analog of the flagellar FliJ protein, is a positive regulator of EscN ATPase activity of the enteropathogenic Escherichia coli injectisome. Journal of Bacteriology, 2014, 196(12): 2227-2241. DOI:10.1128/JB.01551-14 |
| [17] | Cheng LW, Anderson DM, Schneewind O. Two independent type Ⅲ secretion mechanisms for YopE in Yersinia enterocolitica. Molecular Microbiology, 1997, 24(4): 757-765. DOI:10.1046/j.1365-2958.1997.3831750.x |
| [18] | Deng WY, Yu HB, Li YL, Finlay BB. SepD/SepL-dependent secretion signals of the type Ⅲ secretion system translocator proteins in enteropathogenic Escherichia coli. Journal of Bacteriology, 2015, 197(7): 1263-1275. DOI:10.1128/JB.02401-14 |
| [19] | Gawthorne JA, Audry L, McQuitty C, Dean P, Christie JM, Enninga J, Roe AJ. Visualizing the translocation and localization of bacterial type Ⅲ effector proteins by using a genetically encoded reporter system. Applied and Environmental Microbiology, 2016, 82(9): 2700-2708. DOI:10.1128/AEM.03418-15 |
| [20] | Sory MP, Boland A, Lambermont I, Cornelis GR. Identification of the YopE and YopH domains required for secretion and internalization into the cytosol of macrophages, using the cyaA gene fusion approach. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(26): 11998-12002. DOI:10.1073/pnas.92.26.11998 |
| [21] | Charpentier X, Oswald E. Identification of the secretion and translocation domain of the enteropathogenic and enterohemorrhagic Escherichia coli effector Cif, using TEM-1 β-lactamase as a new fluorescence-based reporter. Journal of Bacteriology, 2004, 186(16): 5486-5495. DOI:10.1128/JB.186.16.5486-5495.2004 |
| [22] | Arnold R, Brandmaier S, Kleine F, Tischler P, Heinz E, Behrens S, Niinikoski A, Mewes HW, Horn M, Rattei T. Sequence-based prediction of type Ⅲ secreted proteins. PLoS Pathogens, 2009, 5(4): e1000376. DOI:10.1371/journal.ppat.1000376 |
| [23] | Ghosh P. Process of protein transport by the type Ⅲ secretion system. Microbiology and Molecular Biology Reviews, 2004, 68(4): 771-795. DOI:10.1128/MMBR.68.4.771-795.2004 |
| [24] | Anderson DM, Schneewind O. A mRNA signal for the type Ⅲ secretion of Yop proteins by Yersinia enterocolitica. Science, 1997, 278(5340): 1140-1143. DOI:10.1126/science.278.5340.1140 |
| [25] | Niemann GS, Brown RN, Mushamiri IT, Nguyen NT, Taiwo R, Stufkens A, Smith RD, Adkins JN, McDermott JE, Heffron F. RNA type Ⅲ secretion signals that require Hfq. Journal of Bacteriology, 2013, 195(10): 2119-2125. DOI:10.1128/JB.00024-13 |
| [26] | Lloyd SA, Sj str m M, Andersson S, Wolf-Watz H. Molecular characterization of type Ⅲ secretion signals via analysis of synthetic N-terminal amino acid sequences. Molecular Microbiology, 2002, 43(1): 51-59. DOI:10.1046/j.1365-2958.2002.02738.x |
| [27] | Schesser K, Frithz-Lindsten E, Wolf-Watz H. Delineation and mutational analysis of the Yersinia pseudotuberculosis YopE domains which mediate translocation across bacterial and eukaryotic cellular membranes. Journal of Bacteriology, 1996, 178(24): 7227-7233. DOI:10.1128/jb.178.24.7227-7233.1996 |
| [28] | Boyd AP, Lambermont I, Cornelis GR. Competition between the Yops of Yersinia enterocolitica for delivery into eukaryotic cells: role of the SycE chaperone binding domain of YopE. Journal of Bacteriology, 2000, 182(17): 4811-4821. DOI:10.1128/JB.182.17.4811-4821.2000 |
| [29] | Thomas NA, Deng WY, Puente JL, Frey EA, Yip CK, Strynadka NCJ, Finlay BB. CesT is a multi-effector chaperone and recruitment factor required for the efficient type Ⅲ secretion of both LEE-and non-LEE-encoded effectors of enteropathogenic Escherichia coli. Molecular Microbiology, 2005, 57(6): 1762-1779. DOI:10.1111/j.1365-2958.2005.04802.x |
| [30] | Büttner D, Gürlebeck D, Noel LD, Bonas U. HpaB from Xanthomonas campestris pv. vesicatoria acts as an exit control protein in type Ⅲ-dependent protein secretion. Molecular Microbiology, 2004, 54(3): 755-768. DOI:10.1111/j.1365-2958.2004.04302.x |
| [31] | Ehrbar K, Friebel A, Miller SI, Hardt WD. Role of the Salmonella pathogenicity island 1 (SPI-1) protein InvB in type Ⅲ secretion of SopE and SopE2, two Salmonella effector proteins encoded outside of SPI-1. Journal of Bacteriology, 2003, 185(23): 6950-6967. DOI:10.1128/JB.185.23.6950-6967.2003 |
| [32] | Ehrbar K, Hapfelmeier S, Stecher B, Hardt WD. InvB is required for type Ⅲ-dependent secretion of SopA in Salmonella enterica serovar Typhimurium. Journal of Bacteriology, 2004, 186(4): 1215-1219. DOI:10.1128/JB.186.4.1215-1219.2004 |
| [33] | Page AL, Sansonetti P, Parsot C. Spa15 of Shigella flexneri, a third type of chaperone in the type Ⅲ secretion pathway. Molecular Microbiology, 2002, 43(6): 1533-1542. DOI:10.1046/j.1365-2958.2002.02835.x |
| [34] | Luo Y, Bertero MG, Frey EA, Pfuetzner RA, Wenk MR, Creagh L, Marcus SL, Lim D, Sicheri F, Kay C, Haynes C, Finlay BB, Strynadka NCJ. Structural and biochemical characterization of the type Ⅲ secretion chaperones CesT and SigE. Nature Structural Biology, 2001, 8(12): 1031-1036. DOI:10.1038/nsb717 |
| [35] | Lorenz C, Kirchner O, Egler M, Stuttmann J, Bonas U, Büttner D. HpaA from Xanthomonas is a regulator of type Ⅲ secretion. Molecular Microbiology, 2008, 69(2): 344-360. DOI:10.1111/mmi.2008.69.issue-2 |
| [36] | Allen-Vercoe E, Toh MCW, Waddell B, Ho H, deVinney R. A carboxy-terminal domain of Tir from enterohemorrhagic Escherichia coli O157:H7 (EHEC O157:H7) required for efficient type Ⅲ secretion. FEMS Microbiology Letters, 2005, 243(2): 355-364. DOI:10.1016/j.femsle.2004.12.027 |
| [37] | Kim BH, Kim HG, Kim JS, Jang JI, Park YK. Analysis of functional domains present in the N-terminus of the SipB protein. Microbiology, 2007, 153(9): 2998-3008. DOI:10.1099/mic.0.2007/007872-0 |
| [38] | Morita-Ishihara T, Ogawa M, Sagara H, Yoshida M, Katayama E, Sasakawa C. Shigella Spa33 is an essential C-ring component of type Ⅲ secretion machinery. The Journal of Biological Chemistry, 2006, 281(1): 599-607. DOI:10.1074/jbc.M509644200 |
| [39] | Letzelter M, Sorg I, Mota LJ, Meyer S, Stalder J, Feldman M, Kuhn M, Callebaut I, Cornelis GR. The discovery of SycO highlights a new function for type Ⅲ secretion effector chaperones. The EMBO Journal, 2006, 25(13): 3223-3233. DOI:10.1038/sj.emboj.7601202 |
| [40] | Krall R, Zhang Y, Barbieri JT. Intracellular membrane localization of Pseudomonas ExoS and Yersinia YopE in mammalian cells. The Journal of Biological Chemistry, 2004, 279(4): 2747-2753. DOI:10.1074/jbc.M301963200 |
| [41] | Akeda Y, Galán JE. Chaperone release and unfolding of substrates in type Ⅲ secretion. Nature, 2005, 437(7060): 911-915. DOI:10.1038/nature03992 |
| [42] | Spaeth KE, Chen YS, Valdivia RH. The Chlamydia type Ⅲ secretion system C-ring engages a chaperone-effector protein complex. PLoS Pathogens, 2009, 5(9): e1000579. DOI:10.1371/journal.ppat.1000579 |
| [43] | Wang D, Roe AJ, McAteer S, Shipston MJ, Gally DL. Hierarchal type Ⅲ secretion of translocators and effectors from Escherichia coli O157:H7 requires the carboxy terminus of SepL that binds to Tir. Molecular Microbiology, 2008, 69(6): 1499-1512. DOI:10.1111/mmi.2008.69.issue-6 |
| [44] | Metzger M, Konrad A, Skandary S, Ashraf I, Meixner AJ, Brecht M. Resolution enhancement for low-temperature scanning microscopy by cryo-immersion. Optics Express, 2016, 24(12): 13023-13032. DOI:10.1364/OE.24.013023 |
