杨粟, 刘梦葭, 王梁燕, 华跃进


农业部核农学重点实验室, 浙江大学原子核农业科学研究所, 浙江 杭州 310029
收稿日期:2016-08-31;修回日期:2016-09-25;网络出版日期:2016-10-09
基金项目:国家“973计划”(2015CB910600);国家自然科学基金(31370102,31570058)
*通信作者:华跃进, Tel/Fax:+86-571-86971703;E-mail:yjhua@zju.edu.cn
摘要: [目的]通过对极端环境耐受的耐辐射奇球菌Deinococcus radiodurans R1全基因组进行序列比对分析,获得具有铁储备蛋白Ferritin类似功能基序的未知功能蛋白DRA0258,采用分子生物学技术对该蛋白的功能和性质进行了验证和分析。[方法]首先对DRA0258进行克隆表达和纯化,并经络合物显色法测定蛋白上铁结合含量;通过三段连接敲除法构建dra0258突变株,检测突变株在双氧水协迫下的生存率、总抗氧化活性及过氧化氢酶活性;利用实时定量PCR检测突变株内抗氧化酶类及铁转运相关性调控蛋白的基因转录水平。[结果]经体内外蛋白铁含量检测证实DRA0258具有一定的铁结合能力;双氧水生存率实验表明dra0258的缺失导致细胞的抗氧化能力显著下降;过氧化氢酶活性、总抗氧化活性检测及抗氧化酶类的基因转录水平检测证实dra0258基因的缺失导致细胞内一些抗氧化基因转录水平下调,细胞的抗氧化应激系统受到损伤,并影响了一些铁调控网络蛋白的基因转录水平。[结论]本研究证实DRA0258是一种铁结合蛋白,该编码基因的缺失影响胞内铁转运系统并使细胞抗氧化能力下调。
关键词: 耐辐射奇球菌 铁储备蛋白 转录水平 过氧化氢酶活性 总抗氧化活性
Antioxidant function of the iron binding protein DRA0258 in Deinococcus radiodurans
Yang Su, Liu Mengjia, Wang Liangyan, Hua Yuejin


Key Laboratory of Nuclear-Agricultural Sciences, Ministry of Agriculture, Institute of Nuclear-Agricultural Science, Zhejiang University, Hangzhou 310029, Zhejiang Province, China
Received 31 August 2016; Revised 25 September 2016; Published online 09 October 2016
*Corresponding author: Yuejin Hua, Tel/Fax:+86-571-86971703;E-mail:yjhua@zju.edu.cn
Supported by the National Program on Key Basic Research Project (2015CB910600) and by the National Natural Science Foundation of China (31370102, 31570058)
Abstract: [Objective]The complete genome of the extreme environmental resistant bacterium Deiococcus radiodurans R1 was analyzed by sequence comparative method and putative ferritin-like protein DRA0258 was screened.Molecular techniques were applied to validate and analyze its function.[Methods]We applied sequence alignment to analyze amino acid sequence of the hypothetical protein DRA0258 and detected its iron binding activity after purification.We used triple-fraction-ligation method to construct dra0258 null mutant and detected its survival rate under H2O2 treatment, catalase activity and total antioxidant capacity, using QRT-PCR to examine the relative transcriptional level change of the antioxidant relative enzymes and iron transport relative proteins.[Results]We confirmed DRA0258 obtained a certain iron binding activity.The survival rate assay with H2O2 treatment suggested that deletion of dra0258 reduced the cellular antioxidant activity of D.radiodurans.The attenuation of catalase activity, total antioxidant capacity as well as the reduction of relative transcriptional levels of antioxidant related genes verified that both the oxidative stress response systems and the iron regulation network were damaged.[Conclusion]This study verified DRA0258 is an iron-binding protein.Deletion of this gene would affect cellular iron transport system and reduce cellular antioxidant capability.
Key words: Deinococcus radiodurans ferritin transcriptional level catalase activity total antioxidant capacity
耐辐射奇球菌(Deinococcus radiodurans,DR)是迄今发现的辐射抗性最强的物种之一,对电离辐射、紫外线、以及双氧水等强氧化剂具有极端的耐受性[1-3]。研究表明,耐辐射奇球菌高效的DNA修复系统和抗氧化能力是细胞极端抗性的主要原因[4],然而其具体的分子机制还有待深入研究。
研究证实细胞内锰铁含量及其比例是耐辐射奇球菌极端抗性的一个重要因素[5-6]。耐辐射奇球菌编码表达了多种锰铁离子调控蛋白,通道蛋白及一系列储备蛋白,他们参与并组成了复杂的离子代谢网络,用以维持细胞内铁锰离子的平衡[4, 6]。铁作为一种特殊的金属离子,由于其价态的多样性,因而对胞内氧化还原的平衡起着至关重要的作用。研究表明,耐辐射奇球菌铁结合蛋白DPS1(DR2263)和DPS2(DRB0092)对细胞的极端抗性有着至关重要的作用,该类基因的缺失导致细胞的氧化抗性急剧下降[7-8];铁转运调控蛋白Mur (DR0865)及DtxR (DR2539)的突变导致胞内铁锰离子转运代谢受到影响[9-10],并直接影响了细胞的氧化抗性和辐射抗性;另外通过对DR1709,DR1102、DR1236等膜内外铁转运通道蛋白的研究证实该类蛋白对细胞内的铁循环及细胞抗性有着重要作用[11],以上研究表明胞内铁离子循环参与构成了耐辐射奇球菌的极端抗性机制。
本研究中,我们通过搜索和比较耐辐射奇球菌中未知功能蛋白的结构域,发现基因dra0258编码的蛋白具有较为保守的铁结合功能基序,推测该蛋白有可能参与了细胞内铁离子平衡的代谢途径。经诱导、表达并纯化DRA0258,测定该蛋白的铁结合活性;构建dra0258突变株,并比较了突变株和野生型在双氧水处理后的存活率,胞内抗氧化酶类及铁离子转运相关性蛋白编码基因的转录表达水平,并对DRA0258在耐辐射奇球菌中的作用机制进行了讨论。
1 材料和方法 1.1 材料
1.1.1 菌种、质粒及生长条件 本文中所需用到的菌株、质粒见表 1。耐辐射奇球菌(Deinococcusradiodurans R1,美国菌株保藏中心ATCC13939)培养于TGY培养基(0.5%蛋白胨,0.3%酵母提取物,0.1%葡萄糖,固体培养基添加1.5%琼脂粉)中,培养温度为30 ℃,突变株通过抗生素进行筛选,卡那霉素(Kanamycin)用量为40 μg/mL。大肠杆菌(Escherichia coli)均培养于LB培养基(1%蛋白胨,0.5%酵母提取物,1%氯化钠,固体培养基再添加1.5%琼脂粉)中,一般培养温度为37 ℃,用于菌株筛选的卡那霉素(Kanamycin)浓度为50 μg/mL,氨苄青霉素(Ampicilin)浓度为100 μg/mL。 表 1. 实验所需用到的菌种与质粒 Table 1. Strains and plasmids used in this work
| Strains and Plasmids | Characteristics | Source |
| Strains | ||
| E. coli | ||
| ????DH5α | Host for cloning vectors | TaKaRa |
| ????BL21(DE3) | Host for expressing proteins | TaKaRa |
| ????DRA0258 BL21 | BL21 containing expression plasmid pET28a-dra0258 | This work |
| D. radiodurans | ||
| ????R1 | Wild type strains (ATCC 13939) | Store in this lab |
| ????Δdra0258 | D. radiodurans dra0258 gene knockout mutant | This work |
| Plasmids | ||
| ????pRADK | Resource of Km resistance cassette | Store in this lab |
| ????pET28a-dra0258 | Plasmid for DRA0258 purification | This work |
表选项
1.1.2 主要试剂 本实验中所需用到的各种限制性内切酶、LA Taq DNA聚合酶、dNTPs、T4 DNA连接酶均购自TaKaRa公司。DNA Ladder、质粒提取试剂盒、PCR纯化和胶回收试剂盒购自TIANGEN公司。引物合成及DNA测序工作由擎科新业生物公司完成。双氧水购自Sigma,其他生化试剂如硫酸亚铁铵、柠檬酸钠等试剂均购自上海生物工程有限公司。 1.2 DRA0258的生物信息学分析 本研究中涉及到的基因及蛋白质序列均来自于美国国家生物技术信息中心NCBI (http://www.ncbi.nlm.nih.gov)及日本基因网站KEGG (http://www.kegg.jp/kegg/kegg2.html)。根据已知大肠杆菌(E. coli)的铁结合蛋白Ferritin和耐辐射奇球菌中未知功能蛋白DRA0258的蛋白序列,采用Clustal X进行同源比对,比对结果采用DNAMAN进行编辑并分析蛋白序列同源性及保守氨基酸位点。
1.3 DRA0258表达菌株的构建 蛋白采用大肠杆菌BL21(DE3)的诱导表达系统。通过引物PA0258F 5′-GGAATTCCATATGGA GTGGTGTGGGGCG-3′(划线部分为NdeⅠ酶切位点)与PA0258R 5′-TTAGGATCCTTAGCGCTTGG GCGCG-3′(划线部分为BamHⅠ酶切位点)扩增得到目的基因片段,经NdeⅠ和BamHⅠ双酶切后与相同酶切处理后的pET28a表达载体连接,转化入大肠杆菌克隆菌株DH5α中,转化方法采用经典CaCl2转化法。转化菌株经含有50 μg/mL卡那霉素的LB平板筛选,并挑取单克隆菌株进行测序鉴定。鉴定正确的菌株经质粒重提并转化入大肠杆菌BL21(DE3)后,挑取单克隆进行后续的蛋白诱导纯化。
1.4 DRA0258蛋白的表达与纯化 将带有pET28a-dra0258重组载体的表达菌株培养于5 mL LB培养基中,至稳定生长期后扩大培养至500 mL LB液体培养基中,37 ℃、220 r/min培养至OD600≈0.6时,添加终浓度为200 μmol/L的诱导剂IPTG进行诱导,诱导条件为25 ℃、150 r/min,诱导16 h后收集菌体,并用1×PBS缓冲液清洗菌体2次,最后用40 mL蛋白上样缓冲液(500 mmol/L NaCl,20 mmol/L Tris-HCl,pH 7.5)重悬菌体。菌体经超高压细胞破碎仪破碎后,15000 r/min离心50 min,收集上清液用于后续纯化。蛋白纯化采用AKTA纯化仪进行。蛋白经Ni-NTA纯化柱得到粗纯化体,经脱盐柱除盐后再经离子交换柱进行进一步纯化,纯化所得的蛋白样品经SDS-PAGE分析蛋白纯度,并用milipore超滤浓缩管进行蛋白浓缩。蛋白浓度采用BCA蛋白浓度检测试剂盒测定。
1.5 DRA0258蛋白铁结合活性的检测 目的蛋白铁含量的检测采用络合物显色法测定[12]。铁在L-半胱氨酸作用下被还原为二价铁,并与菲咯嗪络合生成铁络合物,通过检测该底物在562 nm处的吸收峰,根据公式计算出样品中铁含量。体内环境下蛋白铁结合能力检测具体步骤如下:测定目的蛋白浓度并添加194 μL纯化得到的目的蛋白于1.5 mL Eppendorf离心管中,分别添加4 μL 100 mmol/L的L-半胱氨酸与2 μL 50 mmol/L的菲咯嗪,置于85 ℃水浴锅内加热20 min,室温冷却后,13000 r/min离心5 min,取上清液测定A564与A700,按公式(1)进行铁含量测定。并计算单位蛋白上铁结合量。
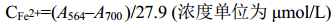 | (1) |
1.6 突变株的构建 本实验采用三段连接反向插入法构建耐辐射奇球菌dra0258基因突变株[13],突变程序如图 1所示,具体操作如下:以D. radiodurans R1基因组为模板,采用敲除引物PF1:5′-CGGTGCAGAACCTCTCCGAAGTC-3′与PR1:5′-TATAGGATCCCTTGAGATCATCGGTCATGGTGG-3′ (划线部分为BamHⅠ)扩增出dra0258基因的上游序列(region 1);以敲除引物PF2:5′-TTGAAGCTTCTCGCGCCTTACCTCAAGGTG-3′ (划线部分为HindⅢ)和PR2 5′-GTCTACACCGTGGTCGAGCAGCAGT-3′扩增出dra0258基因的下游序列(region 2),然后上下游片段分别经限制性内切酶BamHⅠ与Hind Ⅲ酶切。用于同源替换的抗性片段来自pRADK质粒,通过BamHⅠ与Hind Ⅲ双酶切得到带有groEL启动子的卡那霉素抗性片段,将上下游片段与卡那霉素片段连接并转化入耐辐射奇球菌细胞中,经上下游基因片段与目的基因上下游之间的同源性经重组得到基因突变株,采用含有40 μg/mL卡那霉素的TGY平板筛选得到突变菌株,并采用引物PF1、PR2经PCR及DNA测序鉴定。筛选所得突变株命名为Δdra0258。
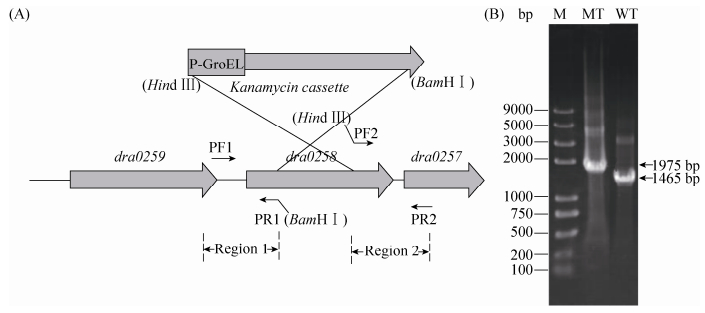 |
| 图 1. 突变株Δdra0258的构建和鉴定 Figure 1. Construction and identification of the mutant Δdra0258. A: the framework of the dra0258 construction. B: identification of Δdra0258 mutant by PCR analysis with primers PF1 and PR2. M: DNA ladder. MT, WT: represented the Δdra0258 and wild-type respectively. |
| 图选项 |
1.7 突变株H2O2抗性测定 细胞过氧化氢处理方法参照文献[14]。具体步骤如下:挑取野生型及突变株的单克隆,采用TGY培养基培养至对数生长期初期(OD600≈0.8),细胞采用10 mmol/L MgSO4稀释10倍后,添加终浓度为50 mmol/L的过氧化氢进行协迫处理,经不同时间段(0,5,10,20,40 min)处理,最后添加10 μL过量的过氧化氢酶(30 mg/mL)终止反应。处理后的样品倍比稀释并点样于TGY平板上或稀释至合适浓度后均匀涂布于TGY平板上。30 ℃条件下培养3 d。查数并计算存活率(以0 mmol/L H2O2处理的样品为对照进行计算)。处理实验独立进行3次并取平均值。
1.8 突变株的Fe2+敏感性检测 细胞Fe2+敏感性检测通过抑菌圈试验来测定。突变株与野生型在TGY培养基中培养至对数生长期(OD600≈0.8),收集细胞并用1×PBS缓冲液溶液重悬。吸取150 μL菌液均匀的涂布于TGY固体培养基上,于平板中心放置1个已灭菌的5 mm滤纸片,滤纸片上滴加5 μL或10 μL浓度为50 μmol/L的FeSO4进行处理。30 ℃恒温培养3 d后测量滤片周围抑菌圈大小。处理实验独立进行3次并取平均值。
1.9 过氧化氢酶活性检测与总抗氧化活性检测 过氧化氢酶活性采用过氧化氢酶检测试剂盒(碧云天)测定[15]。过氧化氢在过氧化氢酶催化下可以氧化试剂盒中的生色底物,产生红色产物N-(4-antipyryl)-3-chloro-5-sulfonate-p-benzoquinon emonoimine。通过检测该物质在520 nm处的吸收峰从而计算出细胞中过氧化氢酶在单位时间内的催化活性。具体步骤如下:待测菌株培养于100 mL的TGY液体培养基中,至对数生长期初期,将细胞分成2份,1份作为对照组,1份采用终浓度为40 mmol/L的H2O2处理30 min,收集菌体后,用1×PBS缓冲液清洗菌体3次,最后用2 mL 1×PBS缓冲液重悬菌体,经超声破碎细胞,12000 r/min离心20 min后收集上清,用于酶活检测。
总抗氧化活性采用总抗氧化检测试剂盒(Total Antioxidant Capacity Assay Kit,碧云天)检测[16]。由于ABTS在氧化剂作用下被氧化而生成绿色ABTS.+,试剂盒采用Trolox作为抗氧化剂,通过检测ABTS.+在734 nm或405 nm下的吸收峰,测定细胞内相对于Trolox的抗氧化活性能力。细胞处理过程同上。
1.10 细胞总铁离子含量及其他金属离子的测定 挑取突变株与野生型的单克隆,于5 mL TGY培养基中培养至稳定生长期后,按1:100的比例接种至100 mL TGY培养基中扩大培养,至OD600≈0.8时,收集菌体,经含有1 mmol/L EDTA的磷酸盐缓冲液清洗3次后,再用无EDTA的磷酸盐缓冲液清洗3次,经冷冻干燥制成菌粉,称重并采用电感耦合等离子体质谱分析法(ICP-MS)检测菌体内的各类金属离子含量。
1.11 耐辐射奇球菌总RNA的提取及实时荧光定量PCR 将耐辐射奇球菌野生型和突变株的单克隆菌株培养于TGY培养基中,至OD600≈0.5时,将样品平均分成2份,一份添加终浓度为30 mmol/L的H2O2处理30 min,另一份作为对照。处理后将菌液转移至1.5 mL Eppendorf中,用DEPC水清洗菌体2次,去除剩余的H2O2,后续操作采用Total RNA Extraction Kit试剂盒提取,提取的总RNA采用ND-1000 Spectrophtometer测定OD260/OD280及OD260/OD230的比值来判定RNA浓度和纯度。逆转录RNA (Reverse transcription PCR, RT-PCR)根据Tanaka的方法进行[17]。反应体系如下:1 μg RNA,3 μg随机六聚体引物,1 μL RNase抑制剂,0.5 mmol/L dNTPs,4 μL 5×FS缓冲液,2 μL Superscript逆转录酶和DEPC水。反应条件如下:65 ℃ 15 min,4 ℃ 2 min,42 ℃ 2 h,72 ℃ 10 min。产物cDNA置于-80 ℃保存备用。
实时荧光定量PCR (real-time quantitative PCR)采用Quant SYBR Green PCR试剂盒(TIANGEN)进行,程序设定于荧光定量PCR检测仪(Mx3000P with the real-time PCR detection system,Stratagene,USA)上,采用SYBR作为检测剂。具体反应体系如下:20 μL反应体系:10 μL 2×SYBR Mix,0.6 μL Forword primer,0.6 μL Reverse primer,适量cDNA及无核酸酶水。反应程序设置如下:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,40个循环;溶解曲线设置:94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s。基因相对表达量用相对定量方法2-ΔΔCt计算,结果取3次独立实验的平均值。所需用到的引物见表 2。
表 2. 实验中用到的引物 Table 2. Primers used in this work
| Primers | Primer sequences (5′→3′) |
| RT-1998-F | GGGCGTGGACAAGCGTATTC |
| RT-1998-R | GTAGACGGGGGCTTCCTGCT |
| RT-a0259-F | GGGCAAGGCTCACCTCGTCA |
| RT-a0259-R | CGCCCTGGTCAATGGTCTCC |
| RT-a0146-F | GGCGCCGAGTACCAGCTGC |
| RT-a0146-R | CGTGCCAGGGGTTGAACTCCAG |
| RT-1546-F | TGTCGCTTTCCGCCTGTGC |
| RT-1546-R | TCGGGTTCTCGTGGATGTGC |
| RT-a0202-F | GAGCCGCAACCACGATACGC |
| RT-a0202-R | GTCTTGTAGTCGTCGGGGTTGG |
| RT-1279-F | GGCAAGCTCGATGTCGTGTCC |
| RT-1279-R | GGCGGCGGTTCTGGTAGTTG |
| RT-1343-F | GCCTACACCGAAGACCCCAT |
| RT-1343-R | GAACTTGACGAGGTTGCCCAT |
| RT-0865-F | GGTCACCGAGGTACACGCCT |
| RT-0865-R | TCCGGACACTGCCCATAAAG |
| RT-2539-F | GGTAAGGTGAGCACCCAGGC |
| RT-2539-R | GAAACAGTTCGAGCAGACGGTG |
| RT-1219-F | GCCTTTATTCCGCTGATTCT |
| RT-1219-R | ACGGGTACGAGGTCTTTCTC |
| RT-2263-F | GAAACAGGAGCGCAGGGTG |
| RT-2263-R | TCGATGGAGGGGAAAATCT |
| RT-B0092-F | TTTCCAGCCTGCTCCTCGGT |
| RT-B0092-R | AGCTCGGTCAAGGTGTTTTGC |
| RT-1709-F | CACGGCAAGAACGTGGAAAAC |
| RT-1709-R | GCCCAGCAGAATGACGATGAAAG |
| RT-1102-F | TCACAACCACCCGCATGAGCAT |
| RT-1102-R | CGTAGGCGACTTCGAGGACCAG |
表选项
2 结果和分析 2.1 耐辐射奇球菌DRA0258结构与生物信息学分析 通过KEGG网站上对目的蛋白基序的注释,发现DRA0258具有类似于铁蛋白(Ferritin)的结构域。将DRA0258与大肠杆菌的铁蛋白Ferritin进行氨基酸序列的同源比对,发现DRA0258与E. coli Ferritin的同源度不高,只有16.3%同源性,但是具有几个保守的铁结合位点。如图 2所示,经NCBI蛋白库中对Ferritin蛋白结构的分析,发现E. coli Ferritin蛋白的氨基酸残基中,E17、S49-N50、Q53、Y94、E126、H129、D130为金属离子结合位点[18-19];在DRA0258氨基酸位点中,S114、E207与H129分别与E. coli Ferritin中的S49、E126和H129位点一致,说明这3个位点极有可能是潜在的铁结合位点。同时,虽然在一些位点上并没有体现出保守性,如DRA0258与E. coli Ferritin金属离子结合位点相对应的D48和E175,虽然不保守,但是这2个氨基酸残基属于常见的铁结合位点,具有潜在的铁结合活性。这些潜在的金属结合位点暗示了DRA0258在金属结合方面的活性。
 |
| 图 2. 耐辐射奇球菌DRA0258与大肠杆菌铁蛋白Ferritin的蛋白结构同源对比 Figure 2. Aligment of D. raiodurans DRA0258 and E. coli Ferritin. Cluatal X software was used to align the amino sequence of D. radiodurans DRA0258 and E. coli Ferritin. Black background: identical residues; Gray background: block of similar residues. Thick arrows pointed the positive iron binding residues. |
| 图选项 |
2.2 DRA0258蛋白具备铁结合活性 采用大肠杆菌BL21表达系统,通过将带有dra0258编码序列的片段与pET表达载体融合并在大肠杆菌细胞内表达目的蛋白,经亲和层析和离子交换树脂吸附,成功得到了目的蛋白DRA0258。经SDS-PAGE检测,蛋白纯度达到90%以上(图 3-A)。
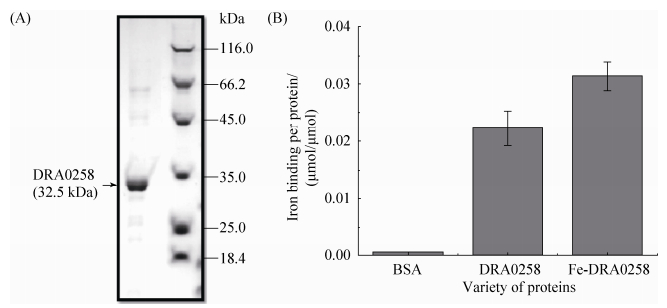 |
| 图 3. DRA0258蛋白铁结合能力检测 Figure 3. Detection of iron binding activity of DRA0258. A: the purification identified by SDS-PAGE; B: iron binding per protein. BSA was selected as control. DRA0258 represented the iron binding activity of the purified protein in vivo. Fe-DRA0258 represented the iron binding activity of the ferrous iron incubated protein in vitro. P < 0.05. |
| 图选项 |
得到目的蛋白后,为验证蛋白的铁结合活性,通过检测铁-菲咯嗪络合物在564 nm处的吸收峰,证实了DRA0258具有较强的铁结合活性(图 3-B)。
2.3 耐辐射奇球菌dra0258突变株的构建与鉴定 通过定点反向插入技术将含有groEL启动子的卡那霉素抗性基因片段(长度约为1092 bp)插入到dra0258基因的上下游之间,经同源重组将dra0258基因片段进行替换。以外侧引物PF1与PR2通过PCR反应确定插入片段的正确性。结果表明,以野生型R1的基因组为模板扩增得到的全长片段约为1465 bp,而经反向插入突变后,PCR片段产物大小约为1975 bp (图 1-B)。电泳结果符合预测,片段经测序进一步证实实验结果的正确性,表明dra0258基因被完全敲除。
2.4 H2O2处理对菌体存活率的影响 为考察dra0258缺失是否对细胞抗氧化能力造成影响,采用高浓度H2O2对R1野生型和Δdra0258突变株进行处理。结果显示,相较野生型,Δdra0258突变株对H2O2更加敏感(图 4-A)。在50 mmol/L H2O2处理浓度下,短时间处理后Δdra0258突变株显示出略低的生存率。随着处理时间逐步上升,Δdra0258突变株与野生型R1之间存活率差异越来越大(图 4-B)。当处理时间超过10 min时,Δdra0258突变株几乎不能存活,而R1仍有80%的存活率(图 4-B)。实验证实dra0258缺失导致了细胞对过氧化氢的抗性降低。
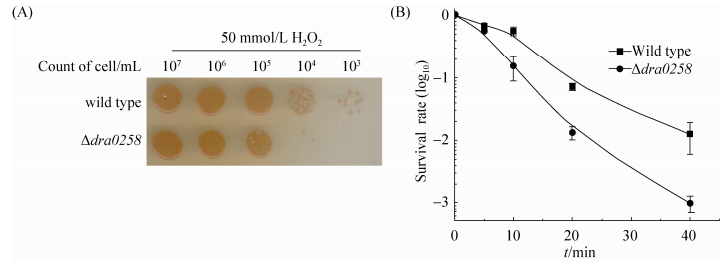 |
| 图 4. 耐辐射奇球菌R1与突变株Δdra0258在50 mmol/L H2O2处理下的存活比较 Figure 4. urvival profile of Δdra0258 mutant under 50 mmol/L H2O2 treatment. P < 0.05. |
| 图选项 |
2.5 突变株对Fe2+的敏感性增加 通过测定突变株与野生型在不同浓度Fe2+处理后的抑菌圈大小,结果证实野生型与突变株TGY平板上的抑菌圈具有较大的差异,突变株相较野生型细胞表现出更强的生存抑制性,表明突变株受到了Fe2+的强烈抑制(图 5)。这一结果进一步证实DRA0258与铁的代谢相关。
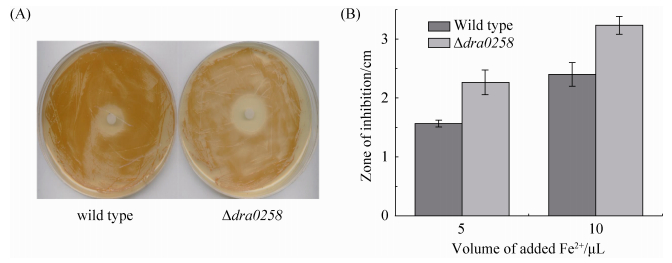 |
| 图 5. 野生型与突变株Δdra0258对Fe2+的敏感性差异 Figure 5. The Fe2+ sensitivity assay of wild type and Δdra0258 mutant. A: the comparison of inhibition zone between wild type strain and Δdra0258; B: the comparison of inhibition zone between wild type strain and Δdra0258 under different Fe2+ concentration. P < 0.05. |
| 图选项 |
2.6 突变株的过氧化氢酶活性与总抗氧化活性降低 为进一步从抗性机制上探究dra0258突变对细胞抗氧化活性的影响,我们检测了突变株与野生型细胞在H2O2处理前后过氧化氢酶的活性及细胞总抗氧化能力。结果表明,野生型与突变株在正常的生理状态下过氧化氢酶活性大致相同(图 6-A),而经40 mmol/L H2O2处理后,野生型细胞的过氧化氢酶活性有了一定的提升,而突变株中过氧化氢酶活性几乎没有变化,说明野生型通过细胞应激机制,在受H2O2胁迫时诱导表达了一定量的过氧化氢酶来消除过量的H2O2,而突变株在消耗自身过氧化氢酶消除H2O2的同时,不能产生足量的过氧化氢酶来抵御H2O2的氧化损伤,证实dra0258基因的缺失导致细胞应激机制受到了损伤。
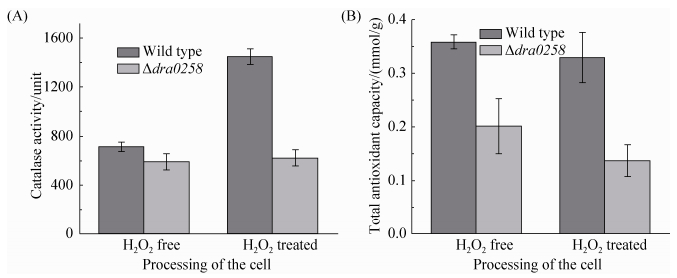 |
| 图 6. 野生型与突变株Δdra0258在H2O2处理前后过氧化氢酶活性及总抗氧化活性比较 Figure 6. The catalase activity and total antioxidant capacity of wild type and Δdra0258 mutant under normal condition and H2O2 treatment. A: catalase activity of wild type strain and Δdra0258 under normal condition and 30 mmol/L H2O2 treatment; B: total antioxidant capacity of wild type strain and Δdra0258 mutant under normal condition and 30 mmol/L H2O2 treatment. P < 0.05. |
| 图选项 |
通过检测野生型与突变株的总抗氧化活性(图 6-B),发现在H2O2处理前,突变株的总抗氧化能力只有野生型的57%,说明dra0258基因的突变导致了细胞本底抗氧化能力的减弱,而经40 mmol/L H2O2处理后,野生型细胞的总抗氧化能力还维持在较高的水平,而突变株的总抗氧化能力有所下降,只有野生型的40%,说明突变株在H2O2胁迫下抗氧化活性进一步下降。
2.7 突变株中抗氧化酶基因的转录水平下降 前面实验显示,经H2O2处理后,野生型R1存活率要显著高于Δdra0258突变株,同时Δdra0258突变株的过氧化氢酶活性要低于野生型,为探究这些表型产生的内在机制,我们采用荧光定量PCR对野生型R1与Δdra0258突变株中过氧化氢酶(KAT)和超氧化物歧化酶(SOD)的基因转录水平进行分析。耐辐射奇球菌中共有3个KAT编码基因(dr1998,dra0259及dra0146),和3个SOD编码基因(dr1546、dra0202和dr1279)。通过分析野生型R1与突变株在H2O2处理前后各抗氧化酶类编码基因的转录水平,结果显示如表 3所示。在H2O2处理前,与野生型相比,突变株中编码过氧化氢酶和超氧化物歧化酶的基因转录水平基本上无明显变化,只有dra0202(sodC)降低了近2倍,说明在细胞正常生理条件下,dra0258基因的缺失不会显著影响过氧化氢酶基因的表达。然而,经40 mmol/L H2O2处理30 min后,相较野生株,突变株的3个过氧化氢酶编码基因分别下调了2.32、2.98、和2.11倍,同时编码Mn-SOD酶的编码基因dr1279的转录水平也下调了3.47倍,说明过氧化氢在野生型细胞内引起了应激反应,而在dra0258突变株细胞中应激反应受到了一定程度的抑制。该结果从分子水平解释了突变株抗氧化能力减弱的内在机制。
表 3. 荧光定量PCR检测突变株Δdra0258与野生型在双氧水处理前后抗氧化酶类表达水平差异 Table 3. qRT PCR of anti-oxidation-related genes in the dra0258 mutant relative to wild type R1 with or without H2O2 treatment
| Locus | Annotationa | Fold change (±SD) | |
| H2O2 free Δa0258(-H)/R1(-H) | H2O2 treatment Δa0258(+H)/R1(+H) | ||
| DR1998 | Catalase (KatE) | -0.95 (±0.07) | -2.32 (±0.13) |
| DRA0259 | Catalase (KatE) | -1.09 (±0.09) | -2.98 (±0.56) |
| DRA0146 | Catalase (CatA) | -1.88 (±0.11) | -2.11 (±0.20) |
| DR1546 | Cu/Zn family superoxide dismutase (SodC) | -1.46 (±0.29) | -1.51 (±0.26) |
| DRA0202 | Cu/Zn family superoxide dismutase (SodC) | -2.15 (±0.57) | 0.76 (±0.11) |
| DR1279 | Mn family superoxide dismutase (SodA) | -1.58 (±0.17) | -3.47 (±0.15) |
| a: functional annotation is based on KEGG (http://www.genome.jp/kegg/). | |||
表选项
2.8 突变株内铁转运蛋白表达受影响 为研究Δdra0258突变对细胞内环境中金属离子转运系统的影响,利用实时荧光定量PCR (qRT-PCR)检测了包括铁调控家族蛋白Fur同源蛋白Mur (DR0865)[10]、DtxR (DR2539)[9]及铁结合蛋白家族DPS1 (DR2263)和DPS2 (DRB0095)[7]等编码基因的转录水平(表 4)。结果表明,mur转录水平下调了2.5倍,dps1及dr1709转录水平分别上调了2.3倍和2.0倍,证实dra0258基因的敲除使得胞内铁转运系统受到影响。Fur家族基因转录水平的下调以及胞内铁储蛋白编码基因dps1的上调,证实dra0258突变后胞内游离铁含量的上调,导致细胞内离子环境及氧化还原环境的改变,从而刺激细胞产生应激效应。
表 4. 荧光定量PCR检测突变株Δdra0258与野生型细胞中铁转运相关蛋白的表达水平差异 Table 4. qRT-PCR of iron-transport-related genes in the dra0258 mutant relative to wild type R1
| Locus | Annotationa | Fold change (±SD) |
| Δdra0258/R1 | ||
| DR0865 | Ferric uptake regulation protein Mur | -2.56 (±0.94) |
| DR2539 | DtxR family transcriptional regulator | -1.20 (±0.12) |
| DR1219 | Ferrous iron transport protein B | -1.28 (±0.11) |
| DR2263 | Dps family DNA-binding stress response protein | 2.38 (±0.18) |
| DRB0092 | Dps family DNA-binding stress response protein | 1.38 (±0.19) |
| DR1709 | Manganese transport protein MntH | 2.08 (±0.13) |
| DR1102 | Cation efflux system protein | 1.47 (±0.18) |
| a: functional annotation is based on KEGG (http://www.genome.jp/kegg/). | ||
表选项
2.9 利用ICP检测胞内铁离子含量的变化 利用ICP检测野生型与突变株细胞的总铁含量(表 5),结果表明突变株细胞中铁离子含量相比野生型只上调了20%左右,未有非常明显的变化,锰,铜,镁及锌等重要金属离子浓度也无明显变化。结合先前的研究,我们推测由于细胞内高效金属调控网络的存在,而且DRA0258的铁结合能力未达到DPS等经典铁储备蛋白的铁结合水平,因为并未出现明显的总铁含量的变化。
表 5. 突变株与野生型中的金属离子含量 Table 5. Ions concentration in mutant and wild type strains
| Ions concentration (nmol/mg) | Δdra0258 mutant | Wild type |
| Fe | 1.37 (±0.07) | 1.66 (±0.03) |
| Mn | 1.28 (±0.06) | 1.33 (±0.10) |
| Cu | 0.13 (±0.02) | 0.12 (±0.006) |
| Zn | 0.56 (±0.02) | 0.62 (±0.04) |
| Mg | 82.16 (±3.74) | 99.06 (±4.65) |
表选项
3 讨论 耐辐射奇球菌极端抗性机制与其特殊的DNA修复系统及高效的抗氧化防御机制密切相关。近年来对耐辐射奇球菌独特的抗性防御机制有了深入的研究,许多细胞抗性机制得到了解析,包括具有极强抗氧化性质的类胡萝卜素、高效的过氧化氢酶及超氧化物歧化酶和胞内高锰铁比的金属离子环境等等[6-20]。
金属内环境稳态作为构成耐辐射奇球菌极端抗性的一大因素越来越受到重视。研究表明耐辐射奇球菌细胞具有特殊的高锰铁比的金属离子内环境,该金属离子内环境对细胞的极端抗性有着非常重要的作用,当胞内锰离子浓度降低或者铁离子浓度升高时,细胞的氧化抗性将会明显下降[21]。铁作为一种过渡金属离子,由于化合价态的不稳定性会造成细胞内氧化还原环境的变化。当细胞内铁离子浓度升高,过量的铁离子能催化氧自由基的产生,导致细胞脂质体、蛋白质及核酸的氧化损伤,从而加速细胞的凋亡[22-23]。另外,金属辅基通常在蛋白酶中起重要的催化作用,有研究认为铁作为金属辅基,在胞内容易被氧化而失活,当被其他金属离子如锰离子或者锌离子代替后,蛋白的活性才得以恢复。
胞内多数铁离子都储备于铁储蛋白中[24]。原核生物中铁储蛋白分别是Dps和铁蛋白Ferritins, 该2类蛋白都属于Ferritin家族蛋白。在耐辐射奇球菌中存在2种Dps蛋白,分别是DR2263和DRB0092。同源比对发现耐辐射奇球菌编码的未知功能蛋白DRA0258与大肠杆菌的铁蛋白Ferritin具有一定的结构相似性。通过蛋白纯化得到该蛋白后,经体外铁结合活性检测,证实了该蛋白具有一定的铁结合能力,由此证实该蛋白为一种铁结合蛋白。
通过构建该基因的突变株Δdra0258,发现该突变株对双氧水极度敏感,我们推测是由于该基因缺失后胞内游离的铁离子增加,与双氧水反应引发羟自由基的产生,从而使细胞抗氧化能力下降。随后的过氧化物酶活性及细胞总抗氧化活性测定结果表明,突变株细胞的抗氧化能力受到了损伤,致使细胞在双氧水胁迫下无法通过正常的应激反应产生足量的过氧化物酶进行抗氧化抵御。
然而,通过检测野生型与突变株细胞中的总铁含量,发现突变株中总铁含量相较野生型没有非常显著的变化。综合该蛋白的铁结合能力及胞内各类铁转运相关蛋白的转录水平,推测该蛋白虽然具有一定的铁结合活性,但其铁结合能力比Dps等铁储蛋白微弱。我们推测由于细胞内存在复杂且高效的金属离子转运系统,使得突变株内的总铁含量始终维持在一定的水平,因此对该蛋白在胞内金属离子转运网络中的具体功能还有待进一步研究。另外,我们还检测了突变株在电离辐射、紫外辐照以及MMC处理后的生存率,结果显示dra0258突变后并不会影响细胞的抗辐射能力,说明该基因主要参与了细胞的抗氧化过程。
4 总结 本研究从细胞及分子水平上证实了未知功能蛋白DRA0258具有铁结合活性,并在耐辐射奇球菌的氧化抗性方面起着重要作用。该基因的缺失导致细胞的双氧水抗性、细胞总抗氧化活性及过氧化物酶应激活性降低,同时引起细胞内铁转运系统相关蛋白的基因转录水平发生变化。进一步的研究将集中于寻找并验证该蛋白保守的铁结合位点以及该蛋白在dps缺失背景基础上的功能研究。
参考文献
| [1] | White O, Eisen JA, Heidelberg JF, Hickey EK, Peterson JD, Dodson RJ, Haft DH, Gwinn ML, Nelson WC, Richardson DL, Moffat KS, Qin HY, Jiang LX, Pamphile W, Crosby M, Shen M, Vamathevan JJ, Lam P, McDonald L, Utterback T, Zalewski C, Makarova KS, Aravind L, Daly MJ, Minton KW, Fleischmann RD, Ketchum KA, Nelson KE, Salzberg S, Smith HO, Venter JC, Fraser CM. Genome sequence of the radioresistant bacterium Deinococcus radiodurans R1.Science, 1999, 286(5444): 1571–1577DOI:10.1126/science.286.5444.1571. |
| [2] | Makarova KS, Aravind L, Wolf YI, Tatusov RL, Minton KW, Koonin EV, Daly MJ. Genome of the extremely radiation-resistant bacterium Deinococcus radiodurans viewed from the perspective of comparative genomics.Microbiology and Molecular Biology Reviews, 2001, 65(1): 44–79DOI:10.1128/MMBR.65.1.44-79.2001. |
| [3] | Hua YJ, Gao GJ. Comparative genomics of genes contributed to DNA repair in the radiation-resistant Deinococcus radiodurans.Acta Microbiologica Sinica, 2003, 43(1): 120–126(in Chinese).华跃进, 高冠军. 耐辐射异常球菌DNA损伤与修复相关基因的比较基因组研究.微生物学报, 2003, 43(1): 120–126. |
| [4] | Liu YQ, Zhou JZ, Omelchenko MV, Beliaev AS, Venkateswaran A, Stair J, Wu LY, Thompson DK, Xu D, Rogozin IB, Gaidamakova EK, Zhai M, Makarova KS, Koonin EV, Daly MJ. Transcriptome dynamics of Deinococcus radiodurans recovering from ionizing radiation.Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(7): 4191–4196DOI:10.1073/pnas.0630387100. |
| [5] | Sun HX, Xu GZ, Zhan HD, Chen H, Sun ZT, Tian B, Hua YJ. Identification and evaluation of the role of the manganese efflux protein in Deinococcus radiodurans.BMC Microbiology, 2010, 10: 319DOI:10.1186/1471-2180-10-319. |
| [6] | Slade D, Radman M. Oxidative stress resistance in Deinococcus radiodurans.Microbiology And Molecular Biology Reviews, 2011, 75(1): 133–191DOI:10.1128/MMBR.00015-10. |
| [7] | Santos SP, Mitchell EP, Franquelim HG, Castanho MARB, Abreu IA, Rom?o CV. Dps from Deinococcus radiodurans: oligomeric forms of Dps1 with distinct cellular functions and Dps2 involved in metal storage.The FEBS Journal, 2015, 282(22): 4307–4327DOI:10.1111/febs.13420. |
| [8] | Yan ZY, Xu ZJ, Xu GZ, Tian B, Hua YJ. Construction of a dps mutant and its functional analysis in Deinococcus radiodurans.Acta Microbiologica Sinica, 2007, 47(4): 610–615(in Chinese).严卓彦, 许镇坚, 许光治, 天兵, 华跃进. 耐辐射奇球菌dps突变株的构建和蛋白功能初步研究.微生物学报, 2007, 47(4): 610–615. |
| [9] | Chen H, Wu RR, Xu GZ, Fang X, Qiu XL, Guo HY, Tian B, Hua YJ. DR2539 is a novel DtxR-like regulator of Mn/Fe ion homeostasis and antioxidant enzyme in Deinococcus radiodurans.Biochemical and Biophysical Research Communications, 2010, 396(2): 413–418DOI:10.1016/j.bbrc.2010.04.106. |
| [10] | Ul Hussain Shah AM, Zhao Y, Wang YF, Yan GQ, Zhang QK, Wang LY, Tian B, Chen H, Hua YJ. A Mur regulator protein in the extremophilic bacterium Deinococcus radiodurans.PLoS One, 2014, 9(9): e106341DOI:10.1371/journal.pone.0106341. |
| [11] | Chang SH, Shu HY, Li ZW, Wang YP, Chen LH, Hua YJ, Qin GY. Disruption of manganese ions[Mn (Ⅱ)] transporter genes DR1709 or DR2523 in extremely radio-resistant bacterium Deinococcus radiodurans.Acta Microbiologica Sinica, 2009, 49(4): 438–444. |
| [12] | Ding HG, Yang JJ, Coleman LC, Yeung S. Distinct iron binding property of two putative iron donors for the iron-sulfur cluster assembly:IscA and the bacterial frataxin ortholog CyaY under physiological and oxidative stress conditions.The Journal of Biological Chemistry, 2007, 282(11): 7997–8004DOI:10.1074/jbc.M609665200. |
| [13] | Markillie LM, Varnum SM, Hradecky P, Wong KK. Targeted mutagenesis by duplication insertion in the radioresistant bacterium Deinococcus radiodurans:radiation sensitivities of catalase (katA) and superoxide dismutase (sodA) mutants.Journal of Bacteriology, 1999, 181(2): 666–669. |
| [14] | Yang S, Xu H, Wang JL, Liu CZ, Lu HZ, Liu MJ, Zhao Y, Tian B, Wang LY, Hua YJ. Cyclic AMP receptor protein acts as a transcription regulator in response to stresses in Deinococcus radiodurans.PLoS One, 2016, 11(5): e0155010DOI:10.1371/journal.pone.0155010. |
| [15] | Liu CZ, Wang LY, Li TT, Lin L, Dai S, Tian B, Hua YJ. A PerR-like protein involved in response to oxidative stress in the extreme bacterium Deinococcus radiodurans.Biochemical and Biophysical Research Communications, 2014, 450(1): 575–580DOI:10.1016/j.bbrc.2014.06.015. |
| [16] | Cao LY, Dai C, Li ZJ, Fan Z, Song Y, Wu YL, Cao ZJ, Li WX. Antibacterial activity and mechanism of a scorpion venom peptide derivative in vitro and in vivo.PLoS One, 2012, 7(7): e40135DOI:10.1371/journal.pone.0040135. |
| [17] | Tanaka M, Earl AM, Howell HA, Park MJ, Eisen JA, Peterson SN, Battista JR. Analysis of Deinococcus radiodurans's transcriptional response to ionizing radiation and desiccation reveals novel proteins that contribute to extreme radioresistance.Genetics, 2004, 168(1): 21–33DOI:10.1534/genetics.104.029249. |
| [18] | Thiruselvam V, Sivaraman P, Kumarevel T, Ponnuswamy MN. Revelation of endogenously bound Fe2+ ions in the crystal structure of ferritin from Escherichia coli.Biochemical and Biophysical Research Communications, 2014, 453(3): 636–641DOI:10.1016/j.bbrc.2014.10.007. |
| [19] | Crichton RR. Ferritin. Structure and function.Die Medizinische Welt, 1981, 32(38): 1401–1404. |
| [20] | Ghosal D, Omelchenko MV, Gaidamakova EK, Matrosova VY, Vasilenko A, Venkateswaran A, Zhai M, Kostandarithes HM, Brim H, Makarova KS, Wackett LP, Fredrickson JK, Daly MJ. How radiation kills cells:survival of Deinococcus radiodurans and Shewanella oneidensis under oxidative stress.FEMS Microbiology Reviews, 2005, 29(2): 361–375. |
| [21] | Sharma A, Gaidamakova EK, Matrosova VY, Bennett B, Daly MJ, Hoffman BM. Responses of Mn2+ speciation in Deinococcus radiodurans and Escherichia coli to γ-radiation by advanced paramagnetic resonance methods.Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(15): 5945–5950DOI:10.1073/pnas.1303376110. |
| [22] | Aroun A, Zhong JL, Tyrrell RM, Pourzand C. Iron, oxidative stress and the example of solar ultraviolet A radiation.Photochemical & Photobiological Sciences, 2012, 11(1): 118–134. |
| [23] | Zhou ZZ, Ware JH, Kennedy AR. Carbon and iron ion radiation-induced cytotoxicity and transformation in vitro.Oncology Letters, 2011, 2(5): 915–918. |
| [24] | Clegg GA, Fitton JE, Harrison PM, Treffry A. Ferritin: molecular structure and iron-storage mechanisms.Progress In Biophysics and Molecular Biology, 1981, 36: 53–86DOI:10.1016/0079-6107(81)90004-3. |
