陈金松1, 2, 刘梅1, 2, 张立新1


1 中国科学院微生物研究所,中国科学院病原微生物与免疫学重点实验室,北京 100101;
2 中国科学院大学,北京 100049
收稿日期:2015-12-29; 修回日期: 2016-02-04; 网络出版日期: 2016-02-18
基金项目:国家“973计划”(2013CB734000,2012CB725203);国家自然科学基金(81573341,31500690,31170095);中国大洋矿产资源研究开发协会项目(DY125-15-T-07)
通信作者:Tel/Fax: +86-10-64807665; E-mail: lzhang03@gmail.com
摘要:纵观世界历史,大国崛起无不伴随着科技的兴起和机制体制的突破。来自大自然的天然产物对于人类的健康起到非常重要的作用,从抗肿瘤明星分子紫杉醇到挽救了无数人生命的抗感染药物青霉素,从治疗代谢疾病到营养保健,都离不开天然产物。此外,还有大量天然产物资源没有被开发过。而随着阿维菌素的发现者Satoshi ōmura教授和William C. Campbell博士,及青蒿素的发现者屠呦呦研究员因为这两种天然产物在治疗寄生虫感染病和疟疾上的应用而获得2015年诺贝尔生理与医学奖后,天然产物有望迎来其发展的第二个黄金时代。我国是世界工厂也是天然药物的资源大国,为了实现产业升级,弯道超车,实现大国崛起的中国梦,我国科学家在“十二五”期间围绕着天然产物的高产和创新两大主题开展了富有成效的合成生物学研究。阿维菌素是由阿维链霉菌产生的高效低毒生物杀虫剂,其原料产能占国际市场的100%。但我国原有生产菌株的单位发酵产量较低,高消耗、高污染、片面追求生产规模的粗放型发展模式已经成了阻碍低碳经济持续高速发展的瓶颈。如何从根本上解决问题,提高生产菌株的单位发酵产量和原料利用率,降低能耗和生产成本,减少环境污染,是促进我国从“发酵大国”向“发酵强国”转变的关键。本文以阿维菌素为例,综述其基础研究的技术发展,特别是中国科学院微生物研究所引入合成生物学技术,将阿维菌素的单位产量提高了1000倍,至9 g/L,在内蒙古新威远与阿维菌素产业联盟的公司应用,迫使默克公司全面退出阿维菌素历史舞台,从而引领产业迅速发展的过程,为我国其它天然产物生物制造品种的改良提供思路和方法。
关键词: 阿维菌素天然产物药物合成生物学
Avermectin, from winning the Nobel Prize to "innovation in China"
Jinsong Chen1, 2, Mei Liu1, 2, Lixin Zhang1


1 Chinese Academy of Sciences Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
2 Graduate University of Chinese Academy of Sciences, Beijing 100101, China
Received: 29 December 2015; Revised: 4 February 2016; Published online: 18 February 2016
Fountion Item: Supported in part by the National Program on Key Basic Research Project (973 program)(2013CB734000, 2012CB725203), by the National Natural Science Foundation of China (81573341, 31500690, 31170095), and China Ocean Mineral Resources R & D Association (DY125-15-T-07)
Corresponding author. Tel/Fax: +86-10-64807665; E-mail: lzhang03@gmail.com
Abstract:The uprise of the superpower nations is always accompanied by the breakthrough and advances of technologies and innovations in the history. Natural products play very important role in human health, such as anticancer molecular taxol, anti-infection drug artemisinin that save a lot of lives, metabolic disease treatment, nutrition and health care. However, more has never been explored. With the 2015 Nobel Prize in Physiology or Medicine awarded to William C. Campbell, Satoshi ōmura, and Youyou Tu for the discovery of avermectins and artemisinin respectively, the second "Golden age" in the development of natural product is dawning. China is a "world factory" and natural drugs-rich country, but how to upgrade and advance the industry and realize the China dream? Avermectins, produced by Streptomyces avermitilis, are pesticide with high efficiency and low levels of side effects. However, the low producer and expensive development pattern of high consumption, high contamination is not sustainable. Solving the problem, increasing the production and utilization of raw material, reducing the energy consumption and cost of production, decreasing environmental pollution are key to transform China into a power house. In this paper, we case-study avermectins to review the industry development driven by fundamental research. Institute of Microbiology, Chinese Academy of Sciences increased the production of avermectin 1000 folds to 9 g/L, which out licensed to new Veyong biochemical Ltd and avermectin Coalitions. As a result, Merck Sharp and Dohme ceased the manufacture of avermectins. The success also shed lights on the improvement of other natural product drugs in China.
Key words: avermectinnatural product drugsynthetic biology
纵观世界历史,随着和平和发展成为整个世界发展的主题,工业革命和信息时代带来的大国崛起无不伴随着科技的兴起和工业化的突破。其中具有核心竞争力的科技突破和机制体制创新已成为大国崛起的关键。合成生物学(Synthetic Biology)作为一门新兴的、有望引领生物技术和生命科学领域,乃至整个科学领域的颠覆性交叉学科登上了历史舞台。赵国屏教授在2015年12月21日的第552届香山科学会议上指出:合成生物学是一门在现代生物学以及系统科学与合成科学基础上发展起来的、融入工程学思想和策略的新兴交叉学科,是采用标准化表征的生物学部件,在理性设计指导下,重组乃至从头合成新的、具有特定功能的人造生命的系统知识和专有理论构架以及相关的使能技术与工程平台。合成生物学的核心是工程化的科学研究,也就是以“设计-合成-测试”为基本模式的工程“建造”,它高度依赖于使能技术的“发明”,并给科学“发现”提供了全新的思路和策略。合成生物学技术给生物技术带来了全新的理念与平台,使生物技术能够面对复杂系统,实现定量可控,并在人工设计的帮助指导下,可重复地建造新的、有效有益的生命体系,造福人类。中国是世界工厂,巨大的微生物天然产物发酵产能亟待创新的产品和技术的支持。合成生物学正是在这样的历史背景下走上历史舞台。
天然产物作为药物被用于治疗人类疾病已有几千年的历史,例如植物来源的天然产物中药。而20世纪40年代,微生物天然产物青霉素的应用提供了细菌感染的全新治疗方法,同时也促使了后面三四十年天然产物药物发展的黄金时代[1](图 1)。然而,由于天然产物研究的瓶颈限制,近20年获得的天然产物药物越来越少,制药公司的投入也越来越少。随着基因组测序技术、生物信息学、探索特境微生物技术等的发展,揭示了天然产物资源还有许多潜力尚未挖掘[2]。更为重要的是,随着阿维菌素的发现者Satoshi ōmura和William C. Campbell,青蒿素的发现者屠呦呦因为这两种天然产物在治疗寄生虫感染病和疟疾的应用,共同获得2015年诺贝尔生理与医学奖后,天然产物有望在未来的发展中出现第二个黄金时代[3, 4](图 1)。
 |
| 图 1. 微生物天然产物药物两个黄金时代历史沿革 Figure 1. Two "Golden age" of the discovery of microbial natural product drugs. |
| 图选项 |
化学生物学和合成生物学[5, 6]极大促进了天然产物领域的研究。化学生物学的研究主要是对化合物合成过程中的关键酶和化合物所产生的活性机制和靶标进行研究;而合成生物学在天然产物研究中的应用主要是对底盘细胞和生物合成途径进行设计改造[7],其中最具代表性的3个例子为:(1)利用酵母生产植物来源的抗疟疾药物青蒿素,使其生产能力提高到25 g/L[8]。(2)在大肠杆菌中进行植物来源的抗肿瘤药物紫杉醇中间产物紫衫烯的合成,使其产量提高了约15000倍,达到约1 g/L的水平[9]。(3)在酵母中完成植物来源的中枢性镇痛剂阿片类药物的生物合成[10]。随着化学生物学和合成生物学研究的快速发展,有望在未来的科学研究发展中打破过去“天然产物发现比较多,而高影响因子文章和产业应用较少”的“橄榄球”现象,在保持较多新发现天然产物的同时,使高影响因子文章和产业应用也能发展起来,成为顶天立地的“哑铃”形状(图 2)。本综述以阿维菌素这种新获诺贝尔奖的微生物天然产物为例介绍其发现和研究的历史沿革及在中国推动的产业发展历程,为我国其它天然产物产业化发展提供例证。
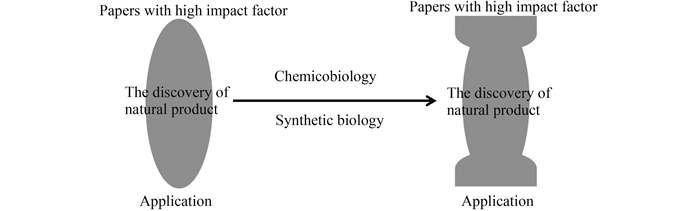 |
| 图 2. 化学生物学和合成生物学研究促进天然产物研究从“橄榄球”到“哑铃”形状演变 Figure 2. The development of natural products research from "football" to "dumbbell" by chemicobiology and synthetic biology. |
| 图选项 |
1 阿维菌素的发现阿维链霉菌是1974年由日本北里研究所从日本静冈地区一个土壤样品里分离得到的。后来经美国默克公司的分类鉴定结果,它是属于链霉菌属的一个新种,命名为阿维链霉菌,原始菌株为Streptomyces avermitilis MA-4680 (ATCC31267,NRRL8165,NCBIM 12804,JCM 5070)[11]。阿维链霉菌属于原核生物界,放线菌门,放线菌纲,链霉菌亚目,链霉菌科,链霉菌属的革兰氏阳性菌。
阿维菌素(avermectin)是1975年从阿维链霉菌中分离得到的十六元环大环内酯类聚酮化合物,因其高效、低毒的杀虫活性而被广泛应用在农业、畜牧业和医药行业上[12]。阿维菌素包含8个组分:有4个较多的组分(80%-90%) A1a、A2a、B1a和B2a,还有4个较少的组分(10%-20%) A1b、A2b、B1b和B2b (图 3)[13],其中B1a组分具有最有效的杀虫活性[14]。
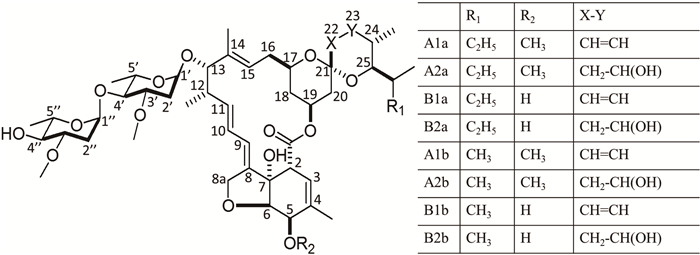 |
| 图 3. 阿维菌素的化学结构 Figure 3. Chemical structure of avermectin. |
| 图选项 |
2 阿维菌素的作用阿维菌素的作用机制过去被认为是神经毒剂,它对许多危害农作物的昆虫都具有杀虫活性,主要包括线虫类和节肢动物类。它能够结合线虫和节肢动物中特定的高亲和受体蛋白,但对脊椎动物无害。这种蛋白存在于神经纤维谷氨酸控制的氯离子通道中。阿维菌素和其结合会延长氯离子通道的开放,从而运输更多的氯离子,使神经膜电位超极化,阻断神经信号传递,导致处理对象麻痹或死亡[15]。但在脊椎动物里,神经细胞受阿维菌素刺激产生γ-氨基丁酸(GABA),这种分子只能存在脑里,它们受血脑屏障保护。因此,阿维菌素这种药物在哺乳动物中使用是相对安全的。
作为一种绿色生物农药,阿维菌素的杀螨虫、杀线虫效果很好,对许多危害农作物的昆虫都具有活性。由于它的作用机制与一般杀虫剂不同,因此对常用农药产生耐药和抗药性的害虫具有良好的功效。而相对于化学农药,它的使用量较少而且效用时间长,同时在植物和土壤的表面可在日光下迅速分解,因此对人、畜和生态环境有较高的安全性。
阿维菌素类化合物还可以作为抗寄生虫药用于畜牧业中。在19世纪80年代,阿维菌素类衍生物伊维菌素作为普通的兽药根除了马感染颈盘尾丝虫所产生的疾病,使科学家们开始把这种药物用于治疗同属的旋盘尾丝虫感染产生的河盲症疾病。河盲症这种疾病在非洲一些贫困国家普遍存在,严重地威胁了人类的健康。而经过长期的实验和研发,发现伊维菌素是一种对人体相对安全而又有效的治愈河盲症的药物[16]。现今,非洲西部的旋盘尾丝虫已经被根除。
作为传统杀虫剂的阿维菌素之前一直都被认为对所有的细菌和真菌没有活性。但近期研究发现,阿维菌素类化合物还能用于抗结核分枝杆菌,包括多重耐药和广泛耐药的菌株[17]。而且对同属的溃疡分枝杆菌也有活性[18, 19]。同时,通过高通量互动模型筛选[20]发现,阿维菌素B1a还可以和甲氧西林互动抗耐甲氧西林的金黄色葡萄球菌[21]。以上研究结果说明,阿维菌素的抗菌活性可能有新的靶标,预示着它作为药物用于抗感染的市场潜力。
3 阿维菌素产量提高的研究进展 3.1 通过培养基优化和传统诱变来提高阿维菌素产量早期在阿维链霉菌遗传背景不清楚的情况下,工业上一般应用发酵工艺的优化和传统的诱变筛选来提高阿维菌素的产量。阿维菌素的原始产量只有0.009 g/L,通过紫外线辐射、甲磺酸甲酯(MMS)和N-甲基-N-硝基-N-亚硝胍(NTG)诱变处理菌株和培养基改良提高到0.5 g/L[11, 22]。发酵工艺的优化通过碳氮源的优化[23, 24],添加丙酸盐[25]等前体,调节生理参数[26, 27, 28, 29]等促进菌体的生长从而使阿维菌素的产量得到提高。这种方法通过改良菌株的培养环境从而进行产量的提高,在工业上广泛应用并具有很好的效果。而随机诱变筛选的方法是传统的菌种优化方法,着重在改良菌株本身的生产效率。传统的诱变筛选方法是指菌株进行各种物理或化学诱变剂的处理,再定向筛选产量提高的菌株。不同的诱变剂对阿维链霉菌的诱变效果有一定差异[30, 31, 32, 33]。菌株经过诱变处理后,会产生许多不同性状的突变株,而如何从大量的突变株中筛选出产量提高的菌株是非常关键的。最初是根据气生菌丝,孢子和黑色素等形态、培养特征的不同来进行筛选的[34],但这种方法容易筛选得到一些不良突变株[33],并且筛选通量低。因此,后来又引入了一个采用96孔微量板(MTP)培养菌体并用UV检测阿维菌素的高效筛选方法[35]。
3.2 通过代谢工程方法提高阿维菌素产量随机诱变和筛选方法因其操作简易而被广泛应用。但是这种方法工作量大并且耗费时间,同时还可能引入不利突变。通过这种方法提高产量的分子机制不明确因而不能用于进一步的理性设计来获得更高产的菌株。随着阿维菌素生物合成基因簇的发现[36]和阿维链霉菌的全基因组测序[37]完成,理性改造的代谢工程被引入并且广泛应用在阿维菌素产量提高的研究中[38]。应用于阿维菌素产量提高的代谢工程研究主要包括以下几点:改变与阿维菌素生物合成前体相关的代谢流;阿维菌素生物合成的调控;阿维菌素的外排。
3.2.1 前体及其调控:生物合成前体的充足对次级代谢产物的产生是非常重要的。这些前体通常来自于脂肪酸代谢,氨基酸代谢和糖类代谢等初级代谢过程。淀粉是阿维菌素发酵过程中最重要的碳源[23]。淀粉的利用需要添加外源的淀粉酶从而形成麦芽糖和麦芽糖糊精。malEFG编码麦芽糖ATP结合转运蛋白,过表达malEFG能提高淀粉的利用率从而使阿维菌素的产量得到提高[39]。metK编码S-腺苷甲硫氨酸(SAM)合酶,过表达metK可以提高SAM的浓度,从而提高阿维菌素的产量[40]。其中机制还不是很清楚,有可能是因为SAM可以刺激抗生素生物合成正调控因子或是作为初级和次级代谢的甲基供体。
一些调控因子可能通过调节与阿维菌素前体合成代谢相关的基因从而影响阿维菌素的产量。其中一个TetR转录调控因子SAV7471对阿维菌素的产量起着负的影响作用。它直接抑制周边基因sav7472-sav7473的转录,而后者对阿维菌素的产量具有正影响[41]。sav7473编码黄素蛋白,可能参与泛酸酯和CoA代谢过程。另一个TetR转录调控因子SAV151也负影响阿维菌素的产量,对其进行敲除使阿维菌素的产量提高2倍[42]。SAV151直接调控它自身和周边基因sav152-sav153-sav154。sav152推测编码一种脱氢酶,sav154推测编码一种水解酶。这2个基因可能给阿维菌素的生物合成过程提供能量或前体[42]。
3.2.2 生物合成及其调控:阿维菌素的生物合成过程由以下3个阶段组成[43, 44]:(1)聚酮链的延伸。阿维菌素聚酮链的延伸是以2-甲基丁酰辅酶A和异丁酰辅酶A为起始单元,不同的起始单元分别形成阿维菌素的“a”组分和“b”组分,之后由4个多功能模块聚酮合酶(AVES1,2,3和4)添加了5个甲基丙二酰辅酶A和7个丙二酰辅酶A形成聚酮链。(2)糖苷配基的形成。聚酮链形成后由AVES4中的TE结构域催化形成环状,然后由AveC[45]催化22-23之间的脱水和C17-C25螺缩醛酮的形成,脱水这个过程是在另一个功能行使之前进行,这个脱水作用使C22-C23之间的单键变成双键。阿维菌素根据C22-C23之间单键或双键的不同分为“2”和“1”组分[45],因此AveC是决定“1”和“2”组分含量高低的一个关键酶。这2种酶的活性独立行使功能,竞争催化同一底物。脱水酶的活性可以通过突变aveC进行提高或降低,但并不影响另外一个酶的活性[46, 47]。AveC催化之后分别由AveE催化C-6和C-8a间呋喃环的形成和由AveF催化C5酮基的还原,最后由AveD催化C5 的O-甲基化,从而形成具有“A”和“B”组分的糖苷配基;(3)糖苷配基的糖基化修饰。2个葡萄糖-1-磷酸由AveBⅡ-Ⅷ催化形成脱氧胸苷二磷酸-齐墩果糖,然后再由aveBⅠ编码的糖基转移酶将脱氧胸苷二磷酸-齐墩果糖连接到阿维菌素糖苷配基的C-13和C-4’位上形成最后的阿维菌素。
阿维菌素的生物合成受到严密而精确的多层信号调控:(1)途径特异性调控因子。这些调控因子一般存在于次级代谢产物的生物合成基因簇中,调控一种或几种具有共同生物合成途径的次级代谢产物生物合成。位于阿维链霉菌生物合成基因簇最左侧的aveR是阿维菌素生物合成的途径特异性的唯一正调控基因[48, 49]。中国科学院微生物研究所通过比较阿维菌素高产菌株3-115和低产菌在基因组、转录组和蛋白组上的差异,最终获得与阿维菌素高产相关的的靶基因12个,其中包括阿维菌素生物合成相关的调控基因aveR。阿维菌素的生物合成由19个模块参与编码相应的酶来完成,其中aveR为阿维菌素生物合成途径特异性调控元件。实时定量RT-PCR进一步验证了在高产菌株中,aveR的表达量显著增加。通过对aveR上游启动子区域的序列测定发现有σhrdB识别和结合的保守序列,表明σhrdB具有全局转录调控作用。体外转录实验也证实了σhrdB (关键的调控元件)对aveR的调控作用,实现了对高产关键基因的精确定位。中国科学院微生物研究所通过体外定向进化的方法构建了hrdB基因突变库,进而将突变的hrdB基因导入阿维菌素高产菌株3-115中,构建了突变菌库。同时建立了基于96 孔深孔板进行阿维链霉菌固体发酵,应用紫外检测替代高效液相色谱检测阿维菌素产量的高通量培养、筛选体系。应用此高通量筛选方法对hrdB基因突变菌株库进行筛选,获得了阿维菌素产量进一步提高的突变菌株A56,该菌株比出发菌株3-115产率提高了41%。为进一步确认A56的阿维菌素高产性状与突变hrdB基因的相关性,将突变hrdB基因片段从A56中回收后,再次转入菌株3-115中,结果仍然能够使转化株的产量达到A56的水平。且在突变菌株A56中,aveR,aveAI,aveAIII基因的转录水平都较原出发菌株3-115有显著增加,对hrdBA56进行序列测定,结果表明突变位点主要集中在保守的1.1区和2.4区。高产重组菌株A56在180立方米发酵罐上阿维菌素B1a效价达到6.382 g/L,生长状态和阿维菌素生产水平保持稳定[50]。(2)多效调控:这种调控因子可调控多种次级代谢产物的生物合成,而且还会参与细胞形态分化过程。Avenolide是一类诱发阿维菌素产生的链霉菌自调控因子。与Avenolide合成相关的一个酶基因aco (编码酰基辅酶A氧化酶)旁边有3个γ-丁酸内酯自调控因子受体蛋白AvaR1、AvaR2和AvaR3[51]。敲除avaR3使阿维菌素的产量急剧降低,而菲律宾菌素的产量得到升高[52]。(3)全局性调控:这类调控因子对次级代谢和形态分化进行全局调控,如PhoR-PhoP双组分系统。PhoR-PhoP双组分系统中的PhoP对阿维菌素具有负影响,敲除phoP使阿维菌素的产量显著性提高。PhoP直接调控aveR的转录,还对氮代谢和形态分化的基因进行调控[53]。
3.2.3 阿维菌素的外排:药物外排泵对保护菌株本身不受天然产物毒性影响和减少反馈抑制从而提高产量具有重要作用[54]。阿维菌素生物合成基因簇上游的avtAB操纵子编码ABC转运蛋白AvtAB,它同时是阿维菌素的一个外排泵。敲除avtAB虽然对阿维菌素产量没有影响,但在野生型和工业菌上提高avtAB的mRNA水平可使阿维菌素的产量得到提高。这样处理后,菌体内和菌体外的阿维菌素比例从6:1降低到4.5:1.0,阿维菌素B1a的产量也从3.3 g/L提高到4.8 g/L,提高了50%左右[55]。
3.3 通过合成生物学方法提高阿维菌素产量合成生物学方法与代谢工程不同,代谢工程的重点是生物体自身的调控和代谢网络的理性改造,而合成生物学的重点是设计并且应用标准化可置换的元件建立新的有特定功能的生物系统[56]。随着分子生物学技术和系统生物学的发展[57, 58],合成生物学方法也成功地引入天然产物产量提高的研究中。首先应用天蓝色链霉菌[59]和优化后的阿维链霉菌[60, 61]作为阿维菌素提高产量的底盘。之前已经有报道证实阿维菌素生物合成基因簇在天蓝色链霉菌进行异源表达后,可以检测到阿维菌素[62]。而对启动子等调控元件在链霉菌中的探索与开发更能促进阿维菌素生物合成途径的设计和改造[63]。
合成生物学方法可以通过两方面来进行阿维菌素产量的提高。一方面可以通过构建合适的底盘细胞来提高阿维菌素的产量:例如优化前体供给配比、提高菌株自身耐药性等。另一方面可以通过优化阿维菌素的生物合成过程来提高阿维菌素的产量:例如通过不同的启动子来调节各个基因的转录水平,然后采用计算机模拟和实验操作测试对不同转录水平的各基因组合进行筛选从而获得最优的生物合成过程。
中国科学院微生物研究所针对合成生物学方法获得的高产突变株,利用响应面方法优化了阿维菌素的发酵培养基。建立了基于代谢参数OUR补糖生产阿维菌素的工艺,降低了生产成本,在发酵过程中有效延缓了菌体的衰老,使阿维菌素的效价提高了20%;此外采用全孢子接种工艺使阿维菌素效价增幅比挖块接种及菌丝接种更有优势;在阿维菌素结晶母液提取过程中,还建立一种简单的分离提取工艺,选用价廉、安全、环保的溶剂,使阿维菌素有效组分B1的回收率高达90%。除了在生产工艺上进行改进,本项目还创造了发酵废水的循环利用方法,并与补糖工艺相结合的方法有效地解决了阿维菌素发酵废水的回收利用问题,提高了水资源的利用,减少环境污染[23, 64, 65]。
4 阿维菌素产业在中国的发展1981年阿维菌素作为兽药投入市场,1985年阿维菌素作为农药投入工业生产。之后以阿维菌素为原料的新药相继被开发出来后并投入市场。后期经过不断地筛选和优化,使阿维菌素的产量比原始产量提高了5-6个数量级。美国默克公司阿维菌素垄断市场,获得了巨大的经济回报,而北里研究所获得的红利也非常可观,经济上支持了北里研究所、北里医院和北里大学的发展。
我国的阿维菌素研究始于1984年,上海市农药研究所从广东揭阳土壤中分离筛选得到7051菌株,后期经鉴定证明该菌株与S. avermitilis MA-4680相似,分离所得的化合物与阿维菌素的化学结构相同。沈寅初教授主持开发对阿维菌素的研究开发工作,证实其在农业和畜牧业上的应用效果。在1992年时这一技术成果转让于浙江海正企业,进行工业生产。但工业大规模的放大生产又是通过长期的科学研究才达到的。从1993年开始,北京农业大学李季伦教授开始立项研究并生产开发此药。一方面通过诱变育种、代谢工程等技术进行菌种选育从而提高阿维菌素产量;另一方面通过改进后提取技术,使阿维菌素的质量得到提高。随着科学研究的发展,国内阿维菌素的产业化生产也不断发展壮大。阿维菌素过去市场的主宰者美国默克公司终于停止阿维菌素的生产,转而向中国采购。在阿维菌素的产业化过程中,产生了4个上市公司,形成了我国阿维菌素产业链。而中国科学院微生物研究所以及其他科研院所在这些公司的支持下,采用合成生物学技术显著性地提高了阿维菌素B1a的产量1000倍,至9 g/L (图 4),市场价格由过去的每千克20000元降低到500元。
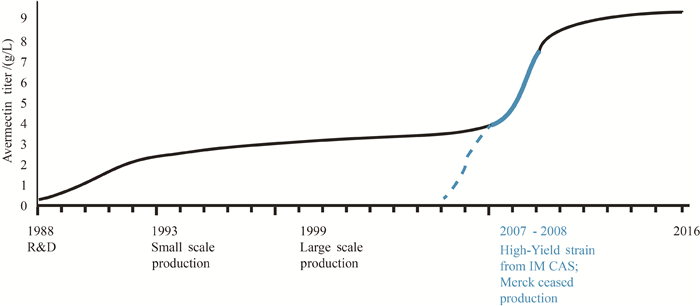 |
| 图 4. 中国阿维菌素效价的提升图 Figure 4. Avermectin production improvement in China. |
| 图选项 |
2010年4月,中国阿维菌素生产企业成立了阿维菌素协作组(又称阿维菌素产业联盟),包括阿维菌素主要生产企业13家(图 5)。产业联盟与新技术相结合,通过科技创新带动整个产业联盟的发展,形成产业联盟优势互补,从而带动整个行业的发展,为科技创新成果在该领域应用奠定了基础,增强了该产业在国际上的竞争力。威远生化作为全国阿维菌素协作组的组长单位与中国科学院微生物研究所建立了长期战略合作伙伴关系,2011年合作的阿维菌素项目获得内蒙古自治区科技进步一等奖。2013年1月1日,中国“973计划”项目“合成微生物体系的适配性研究”立项,聚焦大幅提高阿维菌素的单位生产效率。由于高效的生产菌株具有核心竞争力,从而推动了我国阿维菌素产业的迅猛发展,阿维菌素也成为中国农药领域中发展最快的品种。截止到2015年9月,中国已经成为阿维菌素的唯一生产国,相关的授权发明专利达到168个,完成了不断创新、后来居上、全部替代进口并世界领先的神话。
 |
| 图 5. 阿维菌素协作组成员 Figure 5. The avermectin industrial alliance member. From left to right in the first row, the sixth is Qing Zhang, the leader of the avermectin industrial alliance, the seventh is Professor Yinchu Shen, the ninth is Professor Lixin Zhang. Professor Yinchu Shen and Professor Lixin Zhang were invited as plenary speakers. |
| 图选项 |
阿维菌素是唯一一个年产值达到30亿元的生物农药,产生了巨大的社会和经济效益。根据企业报表结果统计,截止2014年3月底,国内阿维菌素原药共16家登记,与阿维菌素产品相关企业400多个,制剂证多达1300多个。2013年国内阿维菌素总产量为3543 t左右,总产能为5500 t左右。国内各生产厂家的产能和产量情况如表 1所示,竞争生产阿维菌素,促进了阿维菌素产业的良性发展。
表 1. 2013年各生产厂家的产能、产量数据Table 1. The gross product and the gross productivity of each companies in 2013
| Manufacturing enterprises | Gross productivity/t | Gross product/t |
| Qilu pharmaceutical Co., Ltd | 1200 | 1210.00 |
| Shijiazhuang xingbai bioengineering Co., Ltd | 650 | 669.00 |
| Shandong qilu king-phar pharmaceutical Co., Ltd | 500 | 516.00 |
| Hebei veyong bio-chemical Co., Ltd | 500 | 372.04 |
| Daqing jefene bio-chemical Co., Ltd | 250 | 282.40 |
| Zhejiang shenghua biok biology Co., Ltd | 280 | 142.13 |
| Ningxia dadifengzhiyuan biology Co., Ltd | 180 | 129.96 |
| North China pharmaceutical group aind Co., Ltd | 100 | 117.60 |
| Jiangsu fengyuan bioengineering Co., Ltd | 100 | 107.17 |
| Shandong shengli Co., Ltd | 140 | 9.00 |
| Zhejiang qianjiang biochemical Co., Ltd | 50 | 1.08 |
| Shandong zhicheng chemical engineering Co., Ltd | 500 | 0 |
| Shijiazhuang huashu pharmaceutical Co., Ltd | 600 | 0 |
| Zhejiang hisun | 40 | 0 |
| Other enterprises | 400 | Unknown |
表选项
根据对海关进出口数据的分类整理,2011年和2012年阿维菌素原药出口同比上一年增长率分别为120%和3.7%,2013年阿维菌素原药出口同比上一年增长率15%,达到526 t。2014年阿维菌素原药出口538 t,比上一年略有增长。2011年出口金额4770万美元,2012年出口金额4420万美元,2013年出口金额5416万美元,2014年出口金额5618万美元(表 2)。
表 2. 2011–2014年阿维菌素原料药出口规模Table 2. The export of avermectin from 2011 to 2014
| Year | Export quantity/t | Export volume/(million dollars) |
| 2011 | 434 | 4770 |
| 2012 | 450 | 4420 |
| 2013 | 526 | 5416 |
| 2014 | 538 | 5618 |
表选项
中国阿维菌素在国际市场的价格可谓经历了跌宕起伏的变化,2013年春节过后,国内外市场同时启动,需求量猛增,市场价已经由480元/千克涨到550元/千克左右,而此时部分企业的淡储阿维菌素供应合同仍未交完。不断上涨的价格一方面引发了制剂厂商的恐慌提前抢货,另一方面中间商捂货期待更高价格,阿维菌素供不应求情况不断加剧,至5月底市场价已经涨到660元/千克左右,部分中间商更是将价格炒到680元/千克以上。6月份以后,随着阿维菌素生产企业所欠的淡储订单陆续发完,以及国内需求由旺转淡,阿维供需关系出现拐点,由供不应求转为供大于求。价格也应声下跌,进入7月就跌破600元/千克,进入8月更是跌破550元/千克,9月价格回落530元/千克,受国际订单影响,10月价格返回580元/千克,年底逐步涨到600元/千克。2013年阿维菌素市场行情基本达到产销平衡,但前紧后松。由于预测不足,2012年冬季收淡储量过大,货源大量被中间商和厂家订购,造成2013年春节后淡储发货与新接订单之间货源冲突,货源一度紧张,中间商推波助澜,价格随之飞涨,这种情况一直持续到6月份,导致阿维菌素价格涨到3年以来的最高点。6月份逐步产销平衡,价格回落,下半年供需平衡,9月份价格达到下半年的最低水平。2014年阿维菌素价格相对平稳,全年价格在600-680元/千克之间,价格波动幅度较2013年之前大大缩小。2015年阿维菌素市场与2014年相比有较大区别:1、阿维菌素及甲维盐在水稻上的用药受到酰胺类产品的冲击,用量大幅减少;2、阿维菌素产能增加,供大于求;3、阿维菌素退税一直不明朗,使得出口数量受限。自6月份阿维菌素价格一直呈现下降趋势,供大于求是主要原因,市场需求下降加剧了供大于求的程度,加上国内阿维菌素用药淡季的来临,10月跌至下半年的最低水平;11月,厂家库存压力随着这几个月消化逐步减轻,出现了货源偏紧状况,价格缓慢回升(表 3)。
表 3. 2015年阿维菌素原料市场价格变化情况Table 3. The variation of market price of avermectin from 2011 to 2015
| (元/千克) | ||||||||||||
| (RMB/kg) | ||||||||||||
| Date | Jan | Feb | Mar | Apr | May | Jun | July | Aug | Sept | Oct | Nov | Dec |
| 2015 | 660 | 670 | 670 | 660 | 650 | 620 | 600 | 550 | 500 | 450 | 480 | 480 |
| 2014 | 600 | 640 | 660 | 680 | 660 | 640 | 620 | 620 | 620 | 620 | 630 | 640 |
| 2013 | 500 | 530 | 570 | 620 | 640 | 640 | 580 | 550 | 530 | 540 | 560 | 580 |
| 2012 | 420 | 420 | 410 | 410 | 420 | 520 | 550 | 480 | 480 | 480 | 490 | 500 |
| 2011 | 500 | 500 | 500 | 500 | 450 | 420 | 420 | 420 | 420 | 420 | 420 | 430 |
表选项
如表 4所示,我国的阿维菌素原料药已经远销世界各国。2013年以来国内外市场需求的特点主要表现在:(1)南美、印度甲维盐需求增长促进了阿维精品需求的增长。巴西因棉花虫情爆发,临时放宽了甲维盐颗粒剂的进口限制,加上巴拉圭等国进口量剧增(其中大部分是转销到巴西),甲维盐颗粒剂需求剧增。印度则是甲维盐原药需求量大增。导致甲维盐生产量大增,近一半的阿维精品都用来加工甲维盐。(2)东南亚阿维乳油销量萎缩:泰国政府已经限制阿维在水稻上的使用,越南因同类产品的竞争(如康宽)及滥用产品产生抗药性。以上原因导致阿维乳油销量已呈下降趋势。(3)国内阿维乳油销量萎缩。原因:同类产品的竞争日趋激烈,抗药性日趋增强。(4) 2013年总体来讲,在甲维盐需求增长带动下,阿维精品销量仍呈增长态势,而阿维油膏则逐渐萎缩,整体阿维需求呈稳中有增态势。
表 4. 2013年1–12月阿维菌素出口目的国构成Table 4. The avermectin export destination countries from January to December in 2013
| No. | Countries | Quantity/kg | Share/% | Amount/$ | Average price/($/g) |
| 1 | USA | 149400 | 28.42 | 17109007 | 114.52 |
| 2 | Denmark | 53505 | 10.18 | 5281960 | 98.72 |
| 3 | Germany | 48130 | 9.16 | 4974543 | 103.36 |
| 4 | India | 47536 | 9.04 | 4340961 | 91.32 |
| 5 | Brazil | 39843 | 7.58 | 3664910 | 91.98 |
| 6 | Netherlands | 29965 | 5.70 | 3565981 | 119.00 |
| 7 | Uruguay | 15200 | 2.89 | 1546018 | 101.71 |
| 8 | Dominica | 11975 | 2.28 | 1075575 | 89.82 |
| 9 | Spain | 11600 | 2.21 | 1084991 | 93.53 |
| 10 | Venezuela | 10000 | 1.90 | 939180 | 93.92 |
| 11 | Paraguay | 9250 | 1.76 | 824807 | 89.17 |
| 12 | Turkey | 8835 | 1.68 | 789276 | 89.34 |
| 13 | Taiwan, China | 7525 | 1.43 | 693965 | 92.22 |
| 14 | South Africa | 7400 | 1.41 | 696660 | 94.14 |
| 15 | France | 6540 | 1.24 | 814291 | 124.51 |
| 16 | Argentina | 6400 | 1.22 | 565276 | 88.32 |
| 17 | Singapore | 6151 | 1.17 | 732666 | 119.11 |
| 18 | Mexico | 6140 | 1.17 | 537983 | 87.62 |
| 19 | Vietnam | 5765 | 1.10 | 495807 | 86.00 |
| 20 | Iran | 4850 | 0.92 | 477354 | 98.42 |
| 21 | Pakistan | 4575 | 0.87 | 419216 | 91.63 |
| 22 | Macao, China | 3880 | 0.74 | 539715 | 139.10 |
| 23 | Jordan | 3675 | 0.70 | 319861 | 87.04 |
| 24 | Israel | 3505 | 0.67 | 333279 | 95.09 |
| 25 | Columbia | 3325 | 0.63 | 266995 | 80.30 |
| 26 | Australia | 2847 | 0.54 | 316194 | 111.06 |
| 27 | Switzerland | 2788 | 0.53 | 290390 | 104.16 |
| 28 | Thailand | 2095 | 0.40 | 197290 | 94.17 |
| 29 | New Zealand | 2012 | 0.38 | 255884 | 127.18 |
| 30 | Austria | 1700 | 0.32 | 169126 | 99.49 |
| 31 | Peru | 1400 | 0.27 | 131586 | 93.99 |
| 32 | Belgium | 1350 | 0.26 | 124139 | 91.95 |
| 33 | Saudi Arabia | 980 | 0.19 | 82727 | 84.42 |
| 34 | Britain | 950 | 0.18 | 79316 | 83.49 |
| 35 | Egypt | 601 | 0.11 | 56587 | 94.15 |
| 36 | Nigeria | 600 | 0.11 | 48300 | 80.50 |
| 37 | Sudan | 600 | 0.11 | 62306 | 103.84 |
| 38 | Chile | 475 | 0.09 | 38285 | 80.60 |
| 39 | Ukraine | 450 | 0.09 | 46812 | 104.03 |
| 40 | Ecuador | 270 | 0.05 | 26793 | 99.23 |
| 41 | Costa Rica | 250 | 0.05 | 21851 | 87.40 |
| 42 | Tanzania | 250 | 0.05 | 20500 | 82.00 |
| 43 | Malaysia | 240 | 0.05 | 21436 | 89.32 |
| 44 | Lebanon | 200 | 0.04 | 17533 | 87.67 |
| 45 | North Korea | 200 | 0.04 | 18503 | 92.52 |
| 46 | Poland | 150 | 0.03 | 15948 | 106.32 |
| 47 | Panama | 100 | 0.02 | 9850 | 98.50 |
| 48 | Ireland | 60 | 0.01 | 9300 | 155.00 |
| 49 | Ivory Coast | 50 | 0.01 | 4581 | 91.61 |
| 50 | Italy | 40 | 0.01 | 3588 | 89.70 |
| 51 | Canada | 25 | 0.00 | 3207 | 128.28 |
| 52 | Rumania | 10 | 0.00 | 850 | 85.00 |
| 53 | Hong Kong, China | 0 | 0.00 | 1 | 100.00 |
| Total | 525662 | 100.00 | 54163160 | 103.04 |
表选项
蒋华良研究员在2015年12月4日的上海市科学会堂解读2015年诺贝尔生理学或医学奖时重点评价了中国科学院微生物研究所在Nature上发表的青蒿素类过氧桥生物合成机制的文章[66]和在阿维菌素产业化上的贡献(http://dwz.cn/2u0RbE)。他指出中国在阿维菌素产品上的“三有”:(1)自主知识产权;(2)国际领先的创新技术;(3)国际市场的话语权。对比我国****屠呦呦因为发现青蒿素而共同获得2015年诺贝尔生理与医学奖,青蒿素在中国却出现了“三无”的情况,警示我国在以后的科技发展中更多思考产业的发展、自主创新技术的保护和高效的市场占有率等问题。
5 展望从阿维菌素的例子我们可以看出,随着阿维菌素基础研究的发展,阿维菌素的单位生产效率大幅提高,高效的生产菌株具有核心竞争力,从而推动了我国阿维菌素产业的迅猛发展,独享了全球原料药市场。而阿维菌素的发展,也为制备更优良的衍生物多拉菌素、伊维菌素[39, 67]等提供了坚实的基础,对影响阿维菌素起始单元专一性的酰基转移酶结构研究[68]也有利于制备其他结构新颖,活性多样和作用机制崭新的阿维菌素衍生物新药。开发高附加值医药品(抗真菌、抗结核、抗肿瘤等)升级换代产品,提高其性能和广谱性,充分利用合作优势,并购延伸产品线,增加融资渠道,扩大内需与扩大出口相结合,把阿维菌素产业做大做强。阿维菌素的成功例子也为我国其它天然产物生物制造品种的改良提供了很好的思路和方法,对我国实现从“发酵大国”向“发酵强国”的转变具有重要意义。
致谢
感谢苗靳、刘雪婷、姜玉国、王得明、张庆等对本文的贡献。
参考文献
| [1] | Singh SB, Barrett JF. Empirical antibacterial drug discovery—foundation in natural products. Biochemical Pharmacology, 2006, 71(7): 1006-1015. |
| [2] | Zhang L, An R, Wang J, Sun N, Zhang S, Hu J, Kuai J. Exploring novel bioactive compounds from marine microbes. Current Opinion in Microbiology, 2005, 8(3): 276-281. |
| [3] | Demain AL, Zhang L. Natural products: drug discovery and therapeutic medicine. Beijing: Humana Press, 2005. |
| [4] | Shen B. A New Golden Age of Natural Products Drug Discovery. Cell, 2015, 163(6): 1297-1300. |
| [5] | Bai CX, Zhuo Y, Zhang LX. Bioprospecting secondary metabolites of actinomycetes through synthetic biology. Microbiology China, 2013, 40(10): 1885-1895. (in Chinese) |
| [5] | 白超弦, 卓英, 张立新. 利用合成生物学技术深入挖掘放线菌中活性次级代谢产物. 微生物学通报, 2013, 40(10): 1885-1895. |
| [6] | Jia XP, Gao H, Zhuo Y, Zhang LX. The research of regulatory parts and Chassis compatibility. Biotechnology & Business, 2013, 4: 004. |
| [6] | 贾晓鹏, 高弘, 卓英, 张立新. 调控元件与底盘适配性的研发. 生物产业技术, 2013, 4: 004. |
| [7] | Zhuo Y, Zhang T, Wang Q, Cruz‐Morales P, Zhang B, Liu M, Barona‐Gómez F, Zhang L. Synthetic biology of avermectin for production improvement and structure diversification. Biotechnology Journal, 2014, 9(3): 316-325. |
| [8] | Paddon CJ, Westfall P, Pitera D, Benjamin K, Fisher K, McPhee D, Leavell M, Tai A, Main A, Eng D. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528-532. |
| [9] | Ajikumar PK, Xiao W-H, Tyo KE, Wang Y, Simeon F, Leonard E, Mucha O, Phon TH, Pfeifer B, Stephanopoulos G. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 70-74. |
| [10] | Galanie S, Thodey K, Trenchard IJ, Interrante MF, Smolke CD. Complete biosynthesis of opioids in yeast. Science, 2015, 349(6252): 1095-1100. |
| [11] | Burg RW, Miller BM, Baker EE, Birnbaum J, Currie SA, Hartman R, Kong Y-L, Monaghan RL, Olson G, Putter I. Avermectins, new family of potent anthelmintic agents: producing organism and fermentation. Antimicrobial Agents and Chemotherapy, 1979, 15(3): 361-367. |
| [12] | Miller TW, Chaiet L, Cole DJ, Cole LJ, Flor JE, Goegelman RT, Gullo VP, Joshua H, Kempf AJ, Krellwitz WR. Avermectins, new family of potent anthelmintic agents: isolation and chromatographic properties. Antimicrobial Agents and Chemotherapy, 1979, 15(3): 368-371. |
| [13] | Thuan NH, Pandey RP, Sohng JK. Recent advances in biochemistry and biotechnological synthesis of avermectins and their derivatives. Applied Microbiology and Biotechnology, 2014, 98(18): 7747-7759. |
| [14] | Egerton J, Ostlind D, Blair L, Eary C, Suhayda D, Cifelli S, Riek Ra, Campbell W. Avermectins, new family of potent anthelmintic agents: efficacy of the B1a component. Antimicrobial Agents and Chemotherapy, 1979, 15(3): 372-378. |
| [15] | Wolstenholme A, Rogers A. Glutamate-gated chloride channels and the mode of action of the avermectin/milbemycin anthelmintics. Parasitology, 2005, 131(S1): S85-S95. |
| [16] | Kearns T, Andrews R, Speare R, Cheng A, McCarthy J, Carapetis J, Holt D, Mulholland E, Currie B, Page W. Ivermectin mass drug administration program to treat endemic scabies and strongyloidiasis in a remote aboriginal community in northern Australia. Tropical Medicine and International Health, 2011: 198-199. |
| [17] | Lim LE, Vilchèze C, Ng C, Jacobs WR, Ramón-García S, Thompson CJ. Anthelmintic avermectins kill M. tuberculosis, including multidrug resistant clinical strains. Antimicrobial Agents and Chemotherapy, 2012: AAC. 01696-01612. |
| [18] | Omansen TF, Porter JL, Johnson PD, van der Werf TS, Stienstra Y, Stinear TP. In-vitro Activity of Avermectins against Mycobacterium ulcerans. PLoS Neglected Tropical Diseases, 2015, 9(3): e0003549-e0003549. |
| [19] | Scherr N, Pluschke G, Thompson CJ, Ramón-García S. Selamectin Is the Avermectin with the Best Potential for Buruli Ulcer Treatment. PLoS Neglected Tropical Diseases, 2015, 9(8): e0003996. |
| [20] | Zhang L, Yan K, Zhang Y, Huang R, Bian J, Zheng C, Sun H, Chen Z, Sun N, An R. High-throughput synergy screening identifies microbial metabolites as combination agents for the treatment of fungal infections. Proceedings of the National Academy of Sciences, 2007, 104(11): 4606-4611. |
| [21] | Guo H, Ren B, Dai H, Dai S, Zhang Y, Liu Y, Cao B, Zhang L. Reversal of meticillin resistance in Staphylococcus aureus by the anthelmintic avermectin. International Journal of Antimicrobial Agents, 2014, 44(3): 274. |
| [22] | Siddique S, Syed Q, Adnan A, Nadeem M, Irfan M, Ashraf Qureshi F. Production of Avermectin B1b From Streptomyces avermitilis 41445 by Batch Submerged Fermentation. Jundishapur Journal of Microbiology, 2013, 6(8). |
| [23] | Gao H, Liu M, Liu J, Dai H, Zhou X, Liu X, Zhuo Y, Zhang W, Zhang L. Medium optimization for the production of avermectin B1a by Streptomyces avermitilis 14-12A using response surface methodology. Bioresource Technology, 2009, 100(17): 4012-4016. |
| [24] | Zhinan X, Peilin C. Enhanced production of avermectin B1a by medium optimization and glucose feeding with Streptomyces avermilitis. Bioprocess Engineering, 1999, 20(1): 67-71. |
| [25] | Xu Z, Cen P. Stimulation of avermectin B1a biosynthesis in Streptomyces avermilitis by feeding glucose and propionate. Biotechnology Letters, 1999, 21(1): 91-95. |
| [26] | Chen J, Zhang S, Chu J, Zhuang Y, Luo J, Bai H. Ethanol evolution rate: a new parameter to determine the feeding rate for the production of avermectins by Streptomyces avermitilis. Biotechnology Letters, 2004, 26(2): 109-113. |
| [27] | Liang JG, Chu XH, Chu J, Wang YH, Zhuang YP, Zhang SL. Oxygen uptake rate (OUR) control strategy for improving avermectin B1a production during fed-batch fermentation on industrial scale (150 m3). African Journal of Biotechnology, 2010, 9(42): 7186-7191. |
| [28] | Liang JG, Chu XH, Xiong ZQ, Chu J, Wang YH, Zhuang YP, Zhang SL. Oxygen uptake rate regulation during cell growth phase for improving avermectin B1a batch fermentation on a pilot scale (2 m3). World Journal of Microbiology and Biotechnology, 2011, 27(11): 2639-2644. |
| [29] | Yin P, Wang YH, Zhang SL, Chu J, Zhuang YP, Chen N, Li XF, Wu YB. Effect of mycelial morphology on bioreactor performance and avermectin production of Streptomyces avermitilis in submerged cultivations. Journal of the Chinese Institute of Chemical Engineers, 2008, 39(6): 609-615. |
| [30] | Gao H, Liu M, Zhuo Y, Zhou X, Liu J, Chen D, Zhang W, Gou Z, Shang P, Zhang L. Assessing the potential of an induced-mutation strategy for avermectin overproducers. Applied and Environmental Microbiology, 2010, 76(13): 4583-4586. |
| [31] | Gao H, Liu Z, Zhang L. Secondary metabolism in simulated microgravity and space flight. Protein & Cell, 2011, 2(11): 858-861. |
| [32] | Liu M, Gao H, Shang P, Zhou X, Ashforth E, Zhuo Y, Chen D, Ren B, Liu Z, Zhang L. Magnetic field is the dominant factor to induce the response of Streptomyces avermitilis in altered gravity simulated by diamagnetic levitation. PLoS One, 2011, 6(10): e24697. |
| [33] | Wang LY, Huang ZL, Li G, Zhao HX, Xing XH, Sun WT, Li HP, Gou ZX, Bao CY. Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma. Journal of Applied Microbiology, 2010, 108(3): 851-858. |
| [34] | Aikawa M, Lopes-Shikida S, Lemos M, Pradella J, Padilla G. Screening of spontaneous and induced mutants in Streptomyces avermitilis enhances avermectin production. Applied Microbiology and Biotechnology, 1999, 52(4): 558-562. |
| [35] | Gao H, Liu M, Zhou X, Liu J, Zhuo Y, Gou Z, Xu B, Zhang W, Liu X, Luo A. Identification of avermectin-high-producing strains by high-throughput screening methods. Applied Microbiology and Biotechnology, 2010, 85(4): 1219-1225. |
| [36] | Ikeda H, Nonomiya T, Usami M, Ohta T, ōmura S. Organization of the biosynthetic gene cluster for the polyketide anthelmintic macrolide avermectin in Streptomyces avermitilis. Proceedings of the National Academy of Sciences, 1999, 96(17): 9509-9514. |
| [37] | Ikeda H, Ishikawa J, Hanamoto A, Shinose M, Kikuchi H, Shiba T, Sakaki Y, Hattori M, ōmura S. Complete genome sequence and comparative analysis of the industrial microorganism Streptomyces avermitilis. Nature Biotechnology, 2003, 21(5): 526-531. |
| [38] | Gao H, Zhou X, Gou Z, Zhuo Y, Fu C, Liu M, Song F, Ashforth E, Zhang L. Rational design for over-production of desirable microbial metabolites by precision engineering. Antonie van Leeuwenhoek, 2010, 98(2): 151-163. |
| [39] | Li M, Chen Z, Zhang X, Song Y, Wen Y, Li J. Enhancement of avermectin and ivermectin production by overexpression of the maltose ATP-binding cassette transporter in Streptomyces avermitilis. Bioresource Technology, 2010, 101(23): 9228-9235. |
| [40] | Zhao X, Wang Q, Guo W, Cai Y, Wang C, Wang S, Xiang S, Song Y. Overexpression of metK shows different effects on avermectin production in various Streptomyces avermitilis strains. World Journal of Microbiology and Biotechnology, 2013, 29(10): 1869-1875. |
| [41] | Liu Y, Yan T, Jiang L, Wen Y, Song Y, Chen Z, Li J. Characterization of SAV7471, a TetR-family transcriptional regulator involved in the regulation of coenzyme A metabolism in Streptomyces avermitilis. Journal of Bacteriology, 2013, 195(19): 4365-4372. |
| [42] | He F, Liu W, Sun D, Luo S, Chen Z, Wen Y, Li J. Engineering of the TetR family transcriptional regulator SAV151 and its target genes increases avermectin production in Streptomyces avermitilis. Applied Microbiology and Biotechnology, 2014, 98(1): 399-409. |
| [43] | Ikeda H, Omura S. Avermectin biosynthesis. Chemical Reviews, 1997, 97(7): 2591-2610. |
| [44] | Yoon Y, Kim ES, Hwang YS, Choi CY. Avermectin: biochemical and molecular basis of its biosynthesis and regulation. Applied Microbiology and Biotechnology, 2004, 63(6): 626-634. |
| [45] | Sun P, Zhao Q, Yu F, Zhang H, Wu Z, Wang Y, Wang Y, Zhang Q, Liu W. Spiroketal formation and modification in avermectin biosynthesis involves a dual activity of AveC. Journal of the American Chemical Society, 2013, 135(4): 1540-1548. |
| [46] | Stutzman-Engwall K, Conlon S, Fedechko R, McArthur H, Pekrun K, Chen Y, Jenne S, La C, Trinh N, Kim S. Semi-synthetic DNA shuffling of aveC leads to improved industrial scale production of doramectin by Streptomyces avermitilis. Metabolic Engineering, 2005, 7(1): 27-37. |
| [47] | Stutzman‐Engwall K, Conlon S, Fedechko R, Kaczmarek F, McArthur H, Krebber A, Chen Y, Minshull J, Raillard SA, Gustafsson C. Engineering the aveC gene to enhance the ratio of doramectin to its CHC‐B2 analogue produced in Streptomyces avermitilis. Biotechnology and Bioengineering, 2003, 82(3): 359-369. |
| [48] | Guo J, Zhao J, Li L, Chen Z, Wen Y, Li J. The pathway-specific regulator AveR from Streptomyces avermitilis positively regulates avermectin production while it negatively affects oligomycin biosynthesis. Molecular Genetics and Genomics, 2010, 283(2): 123-133. |
| [49] | Kitani S, Ikeda H, Sakamoto T, Noguchi S, Nihira T. Characterization of a regulatory gene, aveR, for the biosynthesis of avermectin in Streptomyces avermitilis. Applied Microbiology and Biotechnology, 2009, 82(6): 1089-1096. |
| [50] | Zhuo Y, Zhang W, Chen D, Gao H, Tao J, Liu M, Gou Z, Zhou X, Ye BC, Zhang Q. Reverse biological engineering of hrdB to enhance the production of avermectins in an industrial strain of Streptomyces avermitilis. Proceedings of the National Academy of Sciences, 2010, 107(25): 11250-11254. |
| [51] | Kitani S, Miyamoto KT, Takamatsu S, Herawati E, Iguchi H, Nishitomi K, Uchida M, Nagamitsu T, Omura S, Ikeda H. Avenolide, a Streptomyces hormone controlling antibiotic production in Streptomyces avermitilis. Proceedings of the National Academy of Sciences, 2011, 108(39): 16410-16415. |
| [52] | Miyamoto KT, Kitani S, Komatsu M, Ikeda H, Nihira T. The autoregulator receptor homologue AvaR3 plays a regulatory role in antibiotic production, mycelial aggregation and colony development of Streptomyces avermitilis. Microbiology, 2011, 157(8): 2266-2275. |
| [53] | Yang R, Liu X, Wen Y, Song Y, Chen Z, Li J. The PhoP transcription factor negatively regulates avermectin biosynthesis in Streptomyces avermitilis. Applied Microbiology and Biotechnology, 2015: 1-11. |
| [54] | Méndez C, Salas JA. The role of ABC transporters in antibiotic-producing organisms: drug secretion and resistance mechanisms. Research in Microbiology, 2001, 152(3): 341-350. |
| [55] | Qiu J, Zhuo Y, Zhu D, Zhou X, Zhang L, Bai L, Deng Z. Overexpression of the ABC transporter AvtAB increases avermectin production in Streptomyces avermitilis. Applied Microbiology and Biotechnology, 2011, 92(2): 337-345. |
| [56] | Endy D. Foundations for engineering biology. Nature, 2005, 438(7067): 449-453. |
| [57] | Li P, Li J, Guo Z, Tang W, Han J, Meng X, Hao T, Zhu Y, Zhang L, Chen Y. An efficient blue-white screening based gene inactivation system for Streptomyces. Applied Microbiology and Biotechnology, 2015, 99(4): 1923-1933. |
| [58] | Tang B, Wang Q, Yang M, Xie F, Zhu Y, Zhuo Y, Wang S, Gao H, Ding X, Zhang L. ContigScape: a Cytoscape plugin facilitating microbial genome gap closing. BMC Genomics, 2013, 14(1): 289. |
| [59] | Gomez‐Escribano JP, Bibb MJ. Engineering Streptomyces coelicolor for heterologous expression of secondary metabolite gene clusters. Microbial Biotechnology, 2011, 4(2): 207-215. |
| [60] | Komatsu M, Komatsu K, Koiwai H, Yamada Y, Kozone I, Izumikawa M, Hashimoto J, Takagi M, Omura S, Shin-ya K. Engineered Streptomyces avermitilis host for heterologous expression of biosynthetic gene cluster for secondary metabolites. ACS Synthetic Biology, 2013, 2(7): 384-396. |
| [61] | Komatsu M, Uchiyama T, ōmura S, Cane DE, Ikeda H. Genome-minimized Streptomyces host for the heterologous expression of secondary metabolism. Proceedings of the National Academy of Sciences, 2010, 107(6): 2646-2651. |
| [62] | Zhang R, Xia H, Xu Q, Dang F, Qin Z. Recombinational cloning of the antibiotic biosynthetic gene clusters in linear plasmid SCP1 of Streptomyces coelicolor A3 (2). FEMS Microbiology Letters, 2013, 345(1): 39-48. |
| [63] | Bai C, Zhang Y, Zhao X, Hu Y, Xiang S, Miao J, Lou C, Zhang L. Exploiting a precise design of universal synthetic modular regulatory elements to unlock the microbial natural products in Streptomyces. Proceedings of the National Academy of Sciences, 2015, 112(39): 12181-12186. |
| [64] | 张立新, 刘梅, 高弘, 周贤龙, 徐兵, 刘金涛, 卓英, 陈涤非. 一种制备阿维菌素的方法及其专用菌株. 中国: CN101407775. 2009. |
| [65] | 张立新, 卓英, 刘梅, 高弘, 周贤龙. 一种生产阿维菌素的基因工程方法及其专用菌株. 中国: CN102241750A. 2011. |
| [66] | Yan W, Song H, Song F, Guo Y, Wu CH, Her AS, Pu Y, Wang S, Naowarojna N, Weitz A. Endoperoxide formation by an α-ketoglutarate-dependent mononuclear non-haem iron enzyme. Nature, 2015, 527(7579): 539-543. |
| [67] | Zhang J, Yan YJ, An J, Huang SX, Wang XJ, Xiang WS. Designed biosynthesis of 25-methyl and 25-ethyl ivermectin with enhanced insecticidal activity by domain swap of avermectin polyketide synthase. Microbial Cell Factories, 2015, 14(1): 1. |
| [68] | Wang F, Wang Y, Ji J, Zhou Z, Yu J, Zhu H, Su Z, Zhang L, Zheng J. Structural and Functional Analysis of the Loading Acyltransferase from Avermectin Modular Polyketide Synthase. ACS Chemical Biology, 2015, 10(4): 1017-1025. |
