张映曈, 陈海琴

 , 宋元达, 张灏, 陈永泉, 陈卫
, 宋元达, 张灏, 陈永泉, 陈卫江南大学食品学院, 江南大学食品科学与技术国家重点实验室, 江苏 无锡 214122
收稿日期: 2015-08-03; 修回日期: 2015-09-29; 网络出版日期: 2015-12-03
基金项目: 国家自然科学基金(21276108,31271812)
通信作者: E-mail: haiqinchen@jiangnan.edu.cn
摘要: [目的] 探讨卷枝毛霉中苹果酸酶同工酶V的性质。[方法] 克隆卷枝毛霉中编码苹果酸酶同工酶V的me1基因并在大肠杆菌BL21(DE3)中表达,利用His标签纯化获得了高纯度的重组酶BLME1,并进行酶学性质分析。[结果] 该重组酶最适pH为8.0,最适温度为33 ℃,在此条件下酶活达到92.8 U/mg,对底物L-苹果酸和NADP+的米氏常数Km值为0.74960±0.06129 mmol/L和0.22070± 0.01810 mmol/L,最大反应速度Vmax分别为72.820±1.077 U/mg和86.110±1.665 U/mg。金属离子Mg2+、Mn2+、Co2+、Ni2+可以激活BLME1的活性,而Ca2+、Cu2+对BLME1活性则有抑制作用,中间代谢产物草酰乙酸和α-酮戊二酸也会抑制BLME1的活性,但琥珀酸却对BLME1有激活作用。[结论] 本实验调查了卷枝毛霉苹果酸酶同工酶V的最适反应温度和pH、动力学参数,以及各种金属离子和中间代谢产物对酶活力的影响,这为以后深入研究该苹果酸酶的功能提供了理论依据和参考。
关键词: 卷枝毛霉苹果酸酶酶学性质金属离子中间代谢产物
Characterization of a malic enzyme isoform V from Mucor circinelloides
Yingtong Zhang, Haiqin Chen

 , Yuanda Song, Hao Zhang, Yongquan Chen, Wei Chen
, Yuanda Song, Hao Zhang, Yongquan Chen, Wei ChenState Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Received: 3 August 2015; Revised: 29 September 2015; Published online: 3 December 2015
Supported by the National Natural Science Foundation of China (21276108, 31271812)
Corresponding author. E-mail: haiqinchen@jiangnan.edu.cn
Abstract:[Objective] We aimed at characterizing a malic enzyme isoform V from Mucor circinelloides. [Methods] me1 gene encoding malic enzyme isoform V was amplified and cloned into expression vector pET28a. High-purity recombinant protein BLME1 was obtained by affinity chromatography using Ni-NTA column and characterized subsequently. [Results] The optimum conditions were pH at 8.0 and temperature at 33 ℃. Under optimum conditions, BLME1 activity achieved 92.8 U/mg. The Km for L-malate and NADP+ were 0.74960±0.06120 mmol/L and 0.22070±0.01810 mmol/L, the Vmax for L-malate and NADP+ were 72.820±1.077 U/mg and 86.110±1.665 U/mg, respectively. In addition, ions played important roles in BLME1 activity; several ions such as Mn2+, Mg2+, Co2+, Ni2+ could activate BLME1, whereas Ca2+, Cu2+ could be used as inhibitors. Additionally, the metabolic intermediates such as oxaloacetic acid and α-ketoglutaric acid inhibited the activity of BLME1, whereas succinic acid activated it. [Conclusion] A malic enzyme isoform V from Mucor circinelloides was characterized, providing the references for further studies on this enzyme.
Key words: Mucor circinelloidesmalic enzymeenzymatic propertymetal ironmetabolic intermediate
苹果酸酶(Malic enzyme,ME; EC1.1.1.38-40)是一类氧化脱羧酶,催化苹果酸转变成丙酮酸,同时伴随着NAD(P)H的产生。它广泛分布于动物、植物和微生物中,参与能量代谢、光合作用、脂质合成等代谢途径[1, 2, 3],具有非常重要的生理功能。卷枝毛霉(Mucor circinelloides) CBS108.16是一株产脂真菌,总脂肪含量占细胞干重的25%[4],因富含γ-亚麻酸(GLA)而被用作月见草油的替代品[5]。由于其出色的积累油脂的能力,卷枝毛霉CBS108.16脂质合成的机理引起了广泛关注。原料乙酰辅酶A和还原力NADPH是脂质合成的两个必要元素,其中NADPH来源于细胞内提供还原力的酶。研究发现,在卷枝毛霉中,NADPH的提供者之一——苹果酸酶的酶活的消失与脂质积累停止是同步的,并且同源和异源表达卷枝毛霉苹果酸酶可以使脂质含量分别提高约2.5倍和2.1倍,抑制苹果酸酶活性则导致总脂肪含量从24%降至2%[6, 7, 8],这表明在卷枝毛霉中苹果酸酶在脂肪酸积累的过程中发挥着重要的作用,因此深入研究卷枝毛霉中的苹果酸酶的性质和功能对揭示其脂肪酸合成的机理以及提高脂肪酸产量都具有重要意义。然而,卷枝毛霉中存在有6种苹果酸酶同工酶[6, 9],它们启动子中出现的重复的TATA序列和CCAAT基元说明它们会在各自特殊的生理环境下表达,执行相应的功能[10]。同工酶III/IV已经被证实与脂肪酸合成相关[3, 10],其他的4种同工酶在脂质合成或者其他方面的功能尚不明确。其中,同工酶V在氧气充足和限制氧气的情况下都能表达,这与同工酶III (产脂相关)相同[6]。根据同工酶V在Native PAGE活性凝胶电泳胶图上的位置和生物信息学分析预测基因me1 (ID:186 772)编码了同工酶V[12]。为了进一步了解其性质,本实验克隆并且在大肠杆菌BL21(DE3)中表达了卷枝毛霉中编码苹果酸酶同工酶V的me1基因,经过纯化和浓缩获得了纯度较高的重组苹果酸酶BLME1,并且对其酶学性质、动力学参数和影响因素等方面进行了分析研究,为进一步研究该苹果酸酶的功能奠定了基础。
1 材料和方法 1.1 材料1.1.1菌株和质粒:卷枝毛霉(Mucor circinelloi-des) CBS108.16购于广东省微生物菌种保藏中心,现由本实验室保存。大肠杆菌(Escherichia coli) TOP10和BL21(DE3)由本实验室保存,pMD19T质粒购于TaKaRa公司,表达质粒pET-28a(+)购于Invitrogen公司,现由本实验室保存。
1.1.2培养基及培养条件:大肠杆菌用LB培养基培养,培养温度37 °C或20 °C,转速200 r/min,根据需要添加氨苄青霉素(100 μg/mL)、卡那霉素(50μg/mL)和IPTG (0.4 mmol/L)。Kendrick培养基[13]用于培养卷枝毛霉,培养温度30 °C,转速200 r/min。
1.1.3工具酶与试剂:DNA聚合酶Taq购自天根生化技术有限公司;高保真DNA聚合酶KOD plus 购自Toyobo公司;限制性内切酶、T4连接酶、DNA凝胶回收试剂盒购自Fermentas公司;产物纯化试剂盒、DNA A-Tailing试剂盒购自TaKaRa生物技术公司;ATP、CoA、乙酰CoA、丙二酰CoA、葡萄糖-6-磷酸、果糖-6-磷酸、酮戊二酸购自Sigma公司;其余试剂均为市售分析纯。实验中的引物合成和测序工作由上海生工生物有限公司完成。
1.1.4PCR引物:根据卷枝毛霉(M. circinelloides) CBS277.49全基因组序列(http://genome.jgi.doe.gov/ Mucci2/Mucci2.home.html)中me1 (ID:186772)基因的侧翼序列设计了一对引物Flanking me1-F和Flanking me1-R用于卷枝毛霉(M. circinelloides) CBS108.16 me1全长基因及其侧翼序列的扩增。根据测序结果得出的me1的核苷酸序列设计一对带有酶切位点的引物(me1-F/me1-R)用于me1的cDNA克隆。通用引物T7和T7 terminator用于pET28a构建的重组子的验证。本实验所用的引物见表 1。
表 1. 引物序列 Table 1. Primers used in this study
| Primers | Sequences (5′→3′) |
| Flanking me1-F | GATTAATAATGGTGAATGCCC |
| Flanking me1-R | AACAGCCTGCTAGCAGAAG |
| me1-F | CTAGCTAGCATGGCTCCATCATCCTACATT |
| me1-R | CCCAAGCTTCTAAATGGATGATGGCA |
| T7 | TAATACGACTCACTATAGGG |
| T7 terminator | TGCTAGTTATTGCTCAGCGG |
表选项
1.2 me1的克隆和重组质粒pET28a-me1构建以卷枝毛霉CBS108.16基因组为模板,用高保真KOD plus酶和引物Flanking me1-F/Flanking me1-R 扩增包括me1及其侧翼序列在内的DNA片段,连接至pMD19T载体,转化至大肠杆菌TOP10并送交测序公司测序,获得me1基因全长序列。取液氮中速冻的卷枝毛霉CBS108.16菌体提取总RNA,以其为模板用反转录酶催化合成cDNA第一链。以cDNA为模板,用高保真KOD plus酶和引物me1-F/me1-R PCR扩增me1基因。胶回收目的片段,和用Nhe I和Hind III双酶切的表达质粒pET28a连接,转化至大肠杆菌BL21(DE3)。
1.3 重组菌的筛选和鉴定挑取转化子用质粒上的通用引物T7和T7 terminator进行PCR验证,pET28a空质粒为阴性对照,同时以cDNA为模板扩增me1基因为阳性对照。条带大小正确的转化子送交公司进行测序验证。构建成功的重组质粒命名为pET28a-me1,转化成功的重组菌命名为BL21-pET28a-me1,重组酶命名为BLME1。
1.4 重组蛋白的诱导表达及SDS-PAGE将重组菌BL21-pET28a-me1于LB培养基(卡那霉素50μg/mL)中37 °C培养过夜,按1:100的比例转接到新鲜LB培养基中,待细菌生长至OD600≈0.6后,加入诱导剂IPTG至终浓度为0.4 mmol/L诱导表达,诱导温度为20 °C,诱导时间为12 h。诱导结束后,收集菌体后进行超声破碎,分别取全细胞,上清和沉淀进行SDS-PAGE分析。
1.5 重组蛋白的纯化诱导表达重组蛋白,收集菌体并超声破碎,Buffer A重悬,离心后取细胞上清过0.45 μm孔径的滤膜。制备亲和层析镍柱,加2-3个柱程的Binding buffer (20 mmol/L咪唑溶液)平衡柱床。将过滤后的细胞粗酶液缓慢加入镍柱,待上样完毕后用30 mL的80 mmol/L咪唑溶液洗脱杂蛋白,再用250 mmol/L的咪唑溶液洗脱目的蛋白,收集目标蛋白后在Buffer A中透析过夜。收集脱盐浓缩后的蛋白液加入甘油至终浓度50%后保存于-80 °C。
1.6 重组蛋白酶酶学性质分析苹果酸酶的酶活性测定参照Hsu & Lardy的方法[14],苹果酸酶催化苹果酸脱羧产生丙酮酸,辅酶NADP+为电子受体得氢被还原为NADPH,酶活的测定根据NADP+ 被还原为NADPH的速率来计算,NADPH的吸光值在340 nm处测定。
酶活单位(1U)定义为每分钟生成1 μmol的NADPH 所需要的酶量,酶活计算按照公式(1)进行:
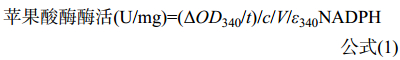
ΔOD340:吸光度的变化值;t:测定时间(min);c:蛋白质浓度(μg/μL);V:酶液体积(μL);ε340NADPH=6.22×103
1.6.1最适温度及热稳定性:缓冲液pH值为7.5 时,分别测定不同温度(15-50 °C)下BLME1的酶活,观察温度对酶活力的影响。将酶液置于上述不同温度下,2 h后测定剩余酶活,观察酶在不同温度下的稳定性。
1.6.2最适pH及pH稳定性:在上述实验得出的最适温度下,在不同pH值(4.5-10.0)的缓冲体系中测定BLME1的酶活,观察pH值对酶活力的影响。将酶液置于上述不同pH值的缓冲溶液中,最适温度下放置2 h后测定剩余酶活,观察酶在不同pH下的稳定性。
1.6.3动力学常数Km和最大反应速度Vmax的测定:在上述实验得出的最适pH值和温度下,加入不同浓度的NADP+和L-苹果酸分别与酶液反应,测定反应速率。采用Lineweaver-Burk双倒数法作图,确定BLME1的Km和Vmax。
1.6.4金属离子和螯合剂EDTA对酶活性的影响:在酶反应体系中分别加入不同浓度(0.02、0.04、0.06、0.08、1.00、2.00、4.00、6.00、8.00、10.00 mmol/L)的二价金属离子(Mg2+、Mn2+、Co2+、Ni2+、Cu2+和Ca2+)溶液,研究不同金属离子对酶活力的影响。
1.6.5中间代谢产物对酶活的影响:在酶反应体系中分别加入2 mmol/L的中间代谢产物(异柠檬酸、6-磷酸果糖、葡萄糖-6-磷酸、丙酮酸、草酰乙酸、α-酮戊二酸和琥珀酸),或者10 μmol/L的ADP、AMP、ATP、CoA、乙酰CoA和丙二单酰CoA,研究中间代谢产物对酶活的影响。以不添加任何中间代谢产物所测得的酶活作为对照,设定为100%。
2 结果和分析 2.1 me1的克隆和重组质粒pET28a-me1构建以卷枝毛霉CBS108.16基因组为模板,用引物Flanking me1-F/Flanking me1-R扩增包括me1基因及其侧翼序列在内的片段,连接至商业化的pMD-19T载体后送公司测序。根据获知的me1基因序列设计带有限制性酶切位点Nhe I和Hind III的引物me1-F/me1-R,以卷枝毛霉CBS108.16 cDNA 为模板PCR扩增me1基因,获得1.8 kb左右大小的片段,回收目的片段,Nhe I和Hind III双酶切后与表达载体pET28a连接过夜,连接产物转化至大肠杆菌BL21(DE3)。挑取转化子后,用质粒上的通用引物T7/T7 terminator进行PCR验证,并且送公司测序,测序结果显示me1 (GenBank Accession No.KT350389) cDNA全长为1764 bp,可编码587个氨基酸,其翻译的蛋白质的分子量大约为65 kDa。重组菌BL21-pET28a-me1构建成功。
2.2 重组蛋白的诱导表达及SDS-PAGE重组菌BL21-pET28a-me1在20 °C下过夜诱导,IPTG终浓度为0.4 mmol/L,收集菌体后用Buffer A 重悬并且用超声进行破碎,分别取全细胞、上清和细胞沉淀进行SDS-PAGE,BL21和BL21-pET28a为阴性对照菌株。如图 1所示,与对照菌株相比,含有目的基因的重组菌的全细胞、上清和沉淀中都有一条明显的条带,与目标蛋白质大小一致,这说明目的基因在大肠杆菌中得到了表达。通过观察还可以发现,上清中的目标蛋白远远多于沉淀中的目标蛋白,这说明重组蛋白表达产物主要以可溶性蛋白形式存在。
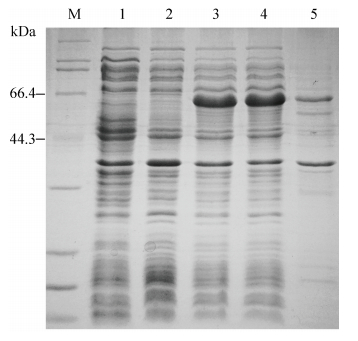 |
| 图 1. 重组菌BL21-pET28a-me1蛋白的SDS-PAGE分析 Figure 1. SDS-PAGE analysis of the protein from BL21-pET28a-me1. M: protein marker; lane 1: crude extract of BL21; lane 2: crude extract of BL21-28a; lane 3: crude extract of BL21-pET28a-me1; lane 4: supernatant of BL21-pET28a-me1; lane 5: precipitate of BL21-pET28a-me1. An apparent band of which the size is approximately 65 kDa was shown in lane 4 and 5 with respect to lane 1, 2, suggesting the existence of recombinant ME protein. The band represented the recombinant ME protein in lane 4 and 5 displayed remarkable discrepancy. It indicates that most of the recombinant ME protein exists as soluble protein. |
| 图选项 |
2.3 重组蛋白的纯化通过镍柱亲和层析分离纯化得到带有His标签的目的蛋白,再经过脱盐浓缩等步骤得到纯度约为95%的重组蛋白BLME1,蛋白的得率为53% (图 2)。
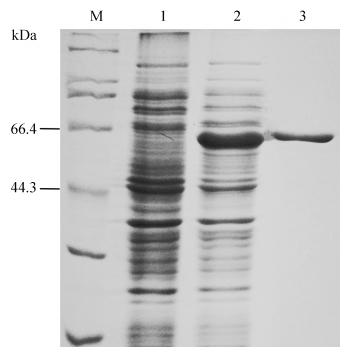 |
| 图 2. 重组蛋白BLME1的纯化 Figure 2. The purification of the recombinant protein BLME1. M: marker; lane 1: crude extracts of BL21-pET28a; lane 2: crude extracts of BL21-pET28a-me1; lane 3: purified recombinant protein BLME1. Hardly any bands were shown in lane 3 except the band corresponding to BLME1. It exhibited considerably high purity after purification with affinity chromatography using Ni-NTA column. |
| 图选项 |
2.4 重组蛋白酶酶学性质分析2.4.1最适温度和热稳定性:缓冲体系pH值为7.5 时,在不同的温度下进行酶促反应,重组酶的活性见图 3-A。随着温度升高,酶活力增强,当温度为33 °C时,重组酶的活力达到最大值,这与其他来源的苹果酸酶类似[15, 16]。之后酶活呈现下降趋势,当温度高于40 °C后急剧下降直到完全失活。另外,重组酶在不同温度下保持2 h后,酶活呈不同程度的下降,其中30、33、35、40 °C下存放的酶活力还保持在60%左右,45 °C和50 °C下的酶稳定性急剧下降。
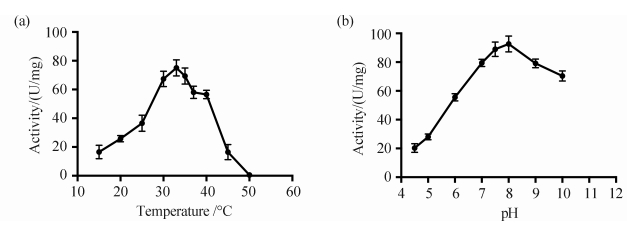 |
| 图 3. 不同温度(A)和pH值(B)对BLME1酶活的影响 Figure 3. Effects of different temperatures (A) or pH (B) on BLME1 activity. The temperature and pH impacted the activity of recombinant BLME1 significantly. It shown the highest activity at 33 °C and was completely inactivated above 50 °C. The optimal pH for the activity was 8 at which the BLME1 activity reached up to 92.8 U/mg, and the enzyme maintained the high activity at the pH range of 7 to 9. |
| 图选项 |
2.4.2最适pH和pH稳定性:在33 °C下测定不同pH (4.5-10.0)值反应体系中BLME1的活性,结果如图 3-B所示。当pH值为8时BLME1比酶活高达92.8 U/mg蛋白,并且pH值在7-9的范围内都能保持较高的活性,这与报道的其他来源的苹果酸酶的最适pH范围相符[15, 16]。另外,重组酶在pH 7-9的缓冲体系中保持2 h后测定酶活,酶活性仍保持在原来的80%左右,这说明苹果酸酶的活性在中性及弱碱性的环境中较稳定。
2.4.3Km值和Vmax的测定:在最适反应温度33°C 和最适pH值8的情况下,在反应体系中添加不同浓度的底物L-苹果酸和NADP+测定酶活,并且通过双倒数法分别求得重组酶对L-苹果酸和NADP+的Km和Vmax,如表 2所示。
表 2. 重组苹果酸酶BLME1的动力学参数 Table 2. Kinetics of the purified recombinant protein BLME1
| Substrates | Km/(mmol/L)a | Vmax/(U/mg)a |
| a: The values are means±standard errors of three independent experiments. | ||
| L-malate | 0.74960±0.06129 | 72.820±1.077 |
| NADP+ | 0.22070±0.01810 | 86.110±1.665 |
表选项
2.4.4不同金属离子对酶活力的影响:金属离子通常会作为辅因子参加酶促反应,而二价金属离子对于苹果酸酶发挥作用必不可少。高山被孢霉(Mortierella alpina)苹果酸酶在添加了3 mmol/L Mg2+的反应体系中酶活达到100 U/mg,当没有外源添加任何金属离子时,酶活降低至原来的10%,加入EDTA螯合反应体系中微量的金属离子后,无法检测到活性,说明苹果酸酶的活性依赖于金属离子的存在[17]。本实验在反应体系中分别添加了不同浓度的二价金属离子,研究了它们对苹果酸酶酶活力的影响,如图 4所示,不同的金属离子对酶活影响差异很大。Mn2+ (图 4-A)和Mg2+ (图 4-B)对酶活力均有较好的激活作用,随着浓度增加酶活提高,增加到一定浓度以后酶活趋于平缓。但是添加了Mn2+后BLME1酶活的最大值(120U/mg)明显高于添加Mg2+能达到的最大酶活(100U/mg),并且当Mn2+的浓度仅为0.8 mmol/L左右时,酶活已经接近最大值,相反,Mg2+浓度达到3 mmol/L时酶活才开始趋于稳定。图 4-C和图 4-D显示Co2+和Ni2+对BLME1也有激活作用,但是作用较弱,BLME1酶活最高只能达到60 U/mg和40U/mg。然而,Cu2+和Ca2+对BLME1却有抑制作用,如图 4-E和图 4-F所示,特别是Cu2+,4mmol/L的Cu2+几乎可以完全抑制BLME1的活力。这可能是因为Cu2+与BLME1结合后形成了四面体而非八面体,导致底物无法进入酶活性中心而使其丧失活力[18]。
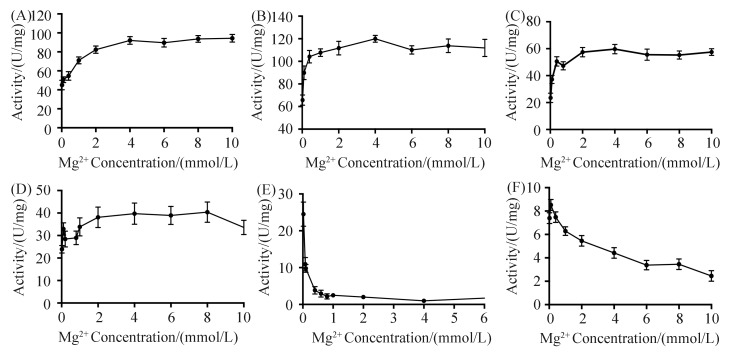 |
| 图 4. 金属离子对BLME1酶活的影响 Figure 4. Effects of various metal ions on BLME1 activity. The metal ions had different effects on the BLME1 activity. Mn2+ and Mg2+ activated the activity dramatically, whereas Mn2+ was capable to enhance the activity to 120 U/mg at a low concentration (0.8 mmol/L). Co2+ and Ni2+ were also able to stimulate the activity of BLME1, but had a weaker stimulation effect compared to Mn2+ and Mg2+. In the contrast, Cu2+ and Ca2+ were inhibitors of BLME1, they reduced the activity at different extent. |
| 图选项 |
2.4.5中间代谢产物对酶活力的影响:
为了了解苹果酸酶在代谢中的作用,实验测定了胞质中的一些中间代谢产物对苹果酸酶活性的影响。图 5-A中各中间代谢产物添加量为2 mmol/L,其中异柠檬酸、6-磷酸果糖、葡萄糖-6-磷酸和丙酮酸对BLME1的活性影响不显著,但是草酰乙酸和α-酮戊二酸却明显抑制了BLME1的活性。添加了草酰乙酸的反应体系中BLME1的酶活水平降低至对照组的20%以下,α-酮戊二酸的抑制作用相比较弱,酶活降低了20%左右,它们的抑制作用可能与二者的空间结构相关,因为这两个中间代谢产物都是L-苹果酸的结构类似物,它们可能会与L-苹果酸竞争酶活性中心[17]。此外,琥珀酸的添加使BLME1的活性提高了30%左右,这与人类线粒体中NADP+依赖型的苹果酸酶性质相似[19]。图 5-B中各中间代谢产物的添加量均为10 μmol/L,结果显示ADP、AMP和ATP对BMLE1的活力没有明显影响,CoA、乙酰CoA和丙二单酰CoA对BLME1有微弱的抑制作用。
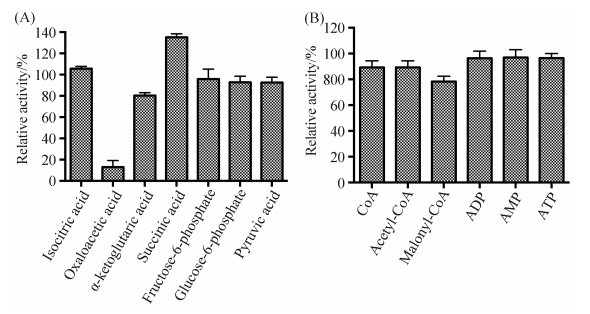 |
| 图 5. 不同中间代谢产物对BLME1活性的影响 Figure 5. Effects of various intermediates on BLME1 activity. Different intermediates had different effects on the BLME1 activity. It shown that oxaloacetic acid and α-ketoglutaric acid inhibited the activity of BLME1, especially oxaloacetic acid, the BLME1 activity dropped to less than 20% of the original activity in the presence of oxaloacetic acid. CoA, acetyl-CoA and malonyl-CoA were also inhibitors of BLME1 activity even though the effect was weak. In addition, 2 mmol/L isocitric acid, fructose-6-phosphate, glucose-6-phosphate, pyruvic acid and 10 μmol/L ADP, AMP, ATP had no effect on the activity of BLME1. Succinic acid was the unique activator among all the intermediates that we investigated. |
| 图选项 |
3 结论本实验成功地将卷枝毛霉CBS108.16中的me1基因在大肠杆菌BL21(DE3)中进行了表达,通过纯化获得了纯度较高的重组苹果酸酶并对重组苹果酸酶进行了酶学性质分析。获得了其最适pH值、最适反应温度和动力学参数,另还研究了不同金属离子和中间代谢产物对其活力的影响,这为后期深入研究该酶的功能奠定了良好的基础。
参考文献
| [1] | Wedding RT. Malic enzymes of higher plants: characteristics, regulation, and physiological function. Plant Physiology, 1989, 90(2): 367-371. |
| [2] | Gourdon P, Baucher MF, Lindley ND, Guyonvarch A. Cloning of the malic enzyme gene from Corynebacterium glutamicum and role of the enzyme in lactate metabolism. Applied and Environmental Microbiology, 2000, 66(7): 2981-2987. |
| [3] | Zhang Y, Adams IP, Ratledge C. Malic enzyme: the controlling activity for lipid production? Overexpression of malic enzyme in Mucor circinelloides leads to a 2.5-fold increase in lipid accumulation. Microbiology, 2007, 153(7): 2013-2025. |
| [4] | Ratledge C. Microbial Lipids: Commercial realities or academic curiosities//Kyle DJ, Ratledge C. Industrial Applications of Single Cell Oils. Champaign: American Oil Chemists' Society, 1992: 1-16. |
| [5] | Ratledge C. Fatty acid biosynthesis in microorganisms being used for single cell oil production. Biochimie, 2004, 86(11): 807-815. |
| [6] | Song YD, Wynn JP, Li YH, Grantham D, Ratledge C. A pre-genetic study of the isoforms of malic enzyme associated with lipid accumulation in Mucor circinelloides. Microbiology, 2001, 147(6): 1507-1515. |
| [7] | Wynn JP, Hamid A, Ratledge C. The role of malic enzyme in the regulation of lipid accumulation in filamentous fungi. Microbiology, 1999, 145(8): 1911-1917. |
| [8] | Wynn JP, Kendrick A, Ratledge C. Sesamol as an inhibitor of growth and lipid metabolism in Mucor circinelloides via its action on malic enzyme. Lipids, 1997, 32(6): 605-610. |
| [9] | Zhou B. Identification of malic isoforms in Mucor circinelloides. China Oils and Fats, 2009, 34(8): 43-48. (in Chinese)周兵. 微生物油脂卷枝毛霉中苹果酸酶异构体的解析. 中国油脂, 2009, 34(8): 43-48. |
| [10] | Li YH, Adams IP, Wynn JP, Ratledge C. Cloning and characterization of a gene encoding a malic enzyme involved in anaerobic growth in Mucor circinelloides. Mycological Research, 2005, 109(4): 461-468. |
| [11] | Li Z, Sun HX, Mo XM, Li XY, Xu B, Tian P. Overexpression of malic enzyme (ME) of Mucor circinelloides improved lipid accumulation in engineered Rhodotorula glutinis. Applied Microbiology and Biotechnology, 2013, 97(11): 4927-4936. |
| [12] | Vongsangnak W, Zhang YT, Chen W, Ratledge C, Song YD. Annotation and analysis of malic enzyme genes encoding for multiple isoforms in the fungus Mucor circinelloides CBS 277.49. Biotechnology Letters, 2012, 34(5): 941-947. |
| [13] | Kendrick A, Ratledge C. Lipids of selected molds grown for production of n-3 and n-6 polyunsaturated fatty acids. Lipids, 1992, 27(1): 15-20. |
| [14] | Hsu RY, Lardy HA. Malic enzyme. Methods in Enzymemology, 1969, 37: 230-235. |
| [15] | Holaday AS, Lowder GW. Effect of pH on the kinetic parameters of NADP-malic enzyme from a C4 Flaveria (Asteraceae) species. Plant Physiology, 1989, 90(2): 401-405. |
| [16] | Edwards GE, Andreo CS. NADP-malic enzyme from plants. Phytochemistry, 1992, 31(6): 1845-1857. |
| [17] | Yang JY, Hu XJ, Zhang HY, Chen HQ, Kargbo MR, Zhao JX, Song YD, Chen YQ, Zhang H, Chen W. Expression, purification, and characterization of NADP+-dependent malic enzyme from the oleaginous fungus Mortierella alpina. Applied Biochemistry and Biotechnology, 2014, 173(7): 1849-1857. |
| [18] | Chou WY, Chang HP, Huang CH, Kuo CC, Tong L, Chang GG. Characterization of the functional role of Asp141, Asp194, and Asp464 residues in the Mn2+-L-malate binding of pigeon liver malic enzyme. Protein Science, 2000, 9(2): 242-251. |
| [19] | Su KL, Chang KY, Hung HC. Effects of structural analogues of the substrate and allosteric regulator of the human mitochondrial NAD(P)+-dependent malic enzyme. Bioorganic & Medicinal Chemistry, 2009, 17(15): 5414-5419. |
