, 郝淼1, 李娟2, 李克斌3, 董雯1, 付冉1
, 郝淼1, 李娟2, 李克斌3, 董雯1, 付冉11. 西安理工大学, 西北旱区生态水利国家重点实验室, 西安 710048;
2. 陕西北控水务有限公司, 西安 710018;
3. 西北大学, 合成与天然功能分子教育部重点实验室, 西安 710069
收稿日期: 2021-03-10; 修回日期: 2021-04-30; 录用日期: 2021-04-30
基金项目: 国家自然科学基金(No.51979223);陕西省自然科学基金(No.2021JM-329)
作者简介: 魏红(1977-), 女, E-mail: weihong0921@163.com
通讯作者(责任作者): 魏红(1977-), 女, 教授, 博士, 主要从事有机污染治理及水资源保护方面的研究.目前已发表论文30余篇
摘要:采用超声(Ultrasound,US)催化过硫酸氢钾(Potassium peroxymonosulfate,PMS)对离子型碘代X射线造影剂-泛影酸钠(Sodium diatrizoate,DTZ)进行氧化降解,考察反应温度、初始pH的影响,分析US/PMS氧化DTZ过程中的主要活性物质和中间产物,并采用毒理基因组学评估DTZ氧化过程中的毒性变化.结果表明,US/PMS对DTZ具有显著的氧化效果,与单独US、PMS相比,反应60 min,降解效率分别提高了18.5和1.6倍.DTZ的降解率随温度(15~45℃)的升高而升高,降解过程遵循准一级反应动力学,反应活化能Ea=21.98 kJ·mol-1;pH=3.21和9.16~11.05时,DTZ的降解率较高.自由基抑制结果和EPR分析表明,O2-·和1O2是US/PMS氧化DTZ的主要活性物质.反应过程中IO3-和I2的生成量随DTZ降解率升高而增大.HPLC/MS/MS共检测出10种产物,其中3种为脱碘产物.基因毒理组学分析表明,DTZ毒性随反应的进行逐渐增强.
关键词:超声/过一硫酸盐泛影酸钠O2-·1O2毒性
The oxidation performance and intermidates toxicity of sodium diatrizoate in the ultrasound activated peroxymonosulfate system
WEI Hong1

 , HAO Miao1, LI Juan2, LI Kebin3, DONG Wen1, FU Ran1
, HAO Miao1, LI Juan2, LI Kebin3, DONG Wen1, FU Ran11. State Key Laboratory of Eco-Hydraulics in Northwest Arid Region, Xi'an University of Technology, Xi'an 710048;
2. Shaanxi Beikong Water Co. Ltd., Xi'an 710018;
3. Key Laboratory of Synthetic and Natural Functional Molecule of the Ministry of Education, Northwest University, Xi'an 710069
Received 10 March 2021; received in revised from 30 April 2021; accepted 30 April 2021
Abstract: Sodium diatrizoate (DTZ), one of the Ionic X-ray Contrast Medias, was oxidized in the ultrasound (US)-activated potassium peroxymonosulfate (PMS) system. The effect of temperature and initial pH on DTZ oxidation, the main reactive oxygen species and DTZ oxidation intermediates were identified and analyzed. In addition, the toxicity change of DTZ in the US/PMS system was assessed using the gene toxicological method. The results showed that DTZ was oxidized effectively in the US/PMS system, in 60 min, with the degradation efficiency 18.5 and 1.6 times higher than that in US and PMS individual system. DTZ degradation increased with temperature in the range of 15~45℃. The reaction followed the pseudo-first-order kinetics, and the activation energy (Ea) was calculated as 21.98 kJ·mol-1. The degradation achieved higher at pH 3.21 and pH 9.16~11.05. The radical inhibition experiments and EPR results indicated that O2-· and 1O2 were the predominant active species responsible for DTZ oxidation. Additionally, formation of IO3- and I2 was positively related to DTZ degradation. Ten intermediate products were detected by using HPLC/MS/MS method, three of them were deiodinated products. However, the genotoxicomic results showed that DTZ toxicity was gradually enhanced with the reaction.
Keywords: ultrasonic/peroxymonosulfatesodium diatrizoateO2-·1O2toxicity
1 引言(Introduction)碘代X-射线造影剂(Iodized X-ray contrast medias, ICM)是2, 4, 6-三碘苯基的衍生物(Ternes et al., 2000), 在医学上被广泛用于软组织成像(如器官、静脉、血管等)的CT和MRI(核磁共振)的增强检测(Duirk et al., 2011).据统计, 全球每年ICM的消耗量为3.5×106 kg(Sandra et al., 2007), 约4000万~8000万剂用于静脉和动脉注射(Martin et al., 2018), 摄入24 h后, 95%的ICM直接排出体外(Wang et al., 2012).
由于ICM的高水溶性和化学稳定性, 传统污水处理工艺很难将其去除(Mohle et al., 1999;Ternes et al., 2000).目前, ICM在污水受纳水体(Ternes et al., 2000)、甚至饮用水源中被经常检测到, 浓度高达100 μg·L-1, 占到水中检测药物的3%以上(Nowak et al., 2020), 其中, 离子型ICM具有更高的检测频率和检出浓度(Putschew et al., 2000).ICM本身没有毒性, 但其代谢产物能够增加水体中碘的浓度(Jeong et al., 2017).研究发现(Jeong et al., 2011;Dong et al., 2018), ICM是碘代三卤甲烷(Iodo-THMs)和碘酸类消毒副产物的主要前驱物.因此, 研究ICM的有效去除及分子中碘的转化具有重要意义.
近年来, 基于过一硫酸盐(Peroxymonosulfate, PMS)氧化的高级氧化技术(AOPs)在水污染控制方面日益受到关注.与其他氧化剂相比, PMS价格低廉、性质稳定, 可在紫外光、热、过渡金属(钟美娥等, 2015)、碱(Qi et al., 2016)、酮基化合物(张珂等, 2018)和超声催化中生成SO4-·、HO·、O2-·等自由基, 从而对有毒有机物质进行有效降解.已有报道多侧重于有机物的降解效率和矿化程度, 综合有机物毒性研究非催化剂存在的超声活化PMS降解有机物还鲜见报道.
因此, 本实验以离子型ICM—泛影酸钠(DTZ)为目标物, 研究US/PMS对DTZ的降解效果, 考察温度和初始pH的影响, 分析体系中的主要活性物质, 以及DTZ降解过程中分子中碘的转化, 并采用HPLC/MS/MS分析氧化产物;同时, 通过毒理基因组学对DTZ在降解过程中的毒性进行评估.旨在全面评估US/PMS技术对有机污染物的氧化效果, 为水体中ICM的有效控制提供一定的科学依据.
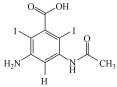
2 材料与方法(Materials and methods)2.1 实验材料过硫酸氢钾(纯度大于47%)购自美国Sigma-Aldrich公司;甲醇、叔丁醇、NaOH、磷酸二氢钾、葡萄糖、Na2S2O3均为分析纯, 购自福晨化学试剂有限公司;超纯水; M9低盐培养基(5x, 生物试剂)购自上海瑞楚生物科技有限公司;LB肉汤(生物试剂)购自北京奥博星生物技术有限责任公司;5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)、2, 2, 6, 6-四甲基-4-哌啶酮(TEMP)购自阿拉丁工业有限公司;DTZ(纯度大于98%)由江苏艾康生物医药研发有限公司提供, 分子式C11H9I3N2O4, 结构如图 1所示.
图 1(Fig. 1)
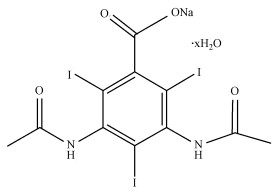 |
| 图 1 泛影酸钠的结构式 Fig. 1Chemical structural of Sodium diatrizoate |
2.2 实验仪器pH500数显酸度计(上海虹益仪器仪表有限公司)配E-201-C-9型pH复合电极(上海罗素科技);JY92-IIN超声波细胞粉碎机(配备直径8 mm的钛探头, 宁波新芝仪器有限公司);节能型智能恒温槽(DC-1006, 宁波新芝生物科技股份有限公司);Hach DR6000紫外可见分光光度计(美国哈希公司);ICS-1100离子色谱仪(Thermo scientific dionex);Aglient 1200高效液相色谱仪, 配备G1311A四元泵, 柱温箱30 ℃, G1314C XL可变波长紫外检测器.
2.3 实验方法2.3.1 DTZ的超声降解实验准确移取4.0 mL浓度为500 mg·L-1 DTZ储备液于200 mL容量瓶中, 定容、摇匀, 静置后转入250 mL烧杯中, 添加0.6147 g PMS搅拌使其溶解.然后采用超声波细胞粉碎机在标准大气压下处理, 反应过程中温度通过智能恒温槽控制, 用0.5 mol·L-1 HCl或NaOH调节pH值.每10 min取1 mL反应液, 放入预先装有0.05 mL、10 mmol·L-1 Na2S2O3溶液的进样瓶中, 摇匀终止PMS的作用, 过0.22 μm水系滤膜后立即进行HPLC分析, DTZ的降解率η按照式(1)计算.
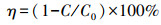 | (1) |
2.3.2 DTZ的HPLC分析DTZ浓度通过Agilent 1200液相色谱仪分析, 色谱柱为Eclipse Plus C18(4.6 mm×150 mm, 5 μm), 流动相为20%甲醇和80% pH=3.21的磷酸盐缓冲液, 进样量10.0 μL, 流速0.60 mL·min-1, 检测波长254 nm, 柱温30 ℃, 在此条件下, DTZ的保留时间tR=5.054 min.
2.3.3 I-、IO3-、I2分析I-、IO3-采用离子色谱仪分析, 色谱柱为IC(AS18 250 mm×4 mm), 柱温30 ℃, 流速为1.0 mL·min-1, 流动相为超纯水, 淋洗液为40 mmol·L-1 NaOH溶液, 进样量100 μL.IO3-的tR=3.024 min, I-的tR=32.05 min.I2通过紫外可见分光光度计分析, I2最大吸收波长为460 nm.
2.3.4 DTZ降解产物分析采用LC-MS (Agilent 1290UPLC/MS QTOF6550)对降解产物进行分析.色谱条件为: 配置Agilent Extend C18色谱柱(2.1 mm×50 mm, 1.7 μm);流动相A为0.1%甲酸水溶液, B为乙腈水溶液;流速0.3 mL·min-1, 采用梯度淋洗程序.质谱条件: 使用正离子模式进行全扫描(m/z=100~1000), 电喷雾ESI源, 电压4500 V, 气体温度15 ℃, 流速15 L·min-1.
2.3.5 毒理基因组学分析菌株为绿色荧光蛋白(GFP)转染的大肠杆菌阵列, -80 ℃保存, 加入120 μL LB培养基及20 μL解冻的大肠杆菌于96孔板中, 在37 ℃培养箱中培养16~22 h.培养后的大肠杆菌经M9培养基1∶4稀释, 并在培养箱中培养至对数期.随后加入10 μL不同反应时间DTZ溶液, 放入酶标仪中进行吸光度和荧光读数(GFP水平, λEX=485 nm, λEM=528 nm), 测定时长2 h, 时间间隔5 min.
2.3.6 电子顺磁共振光谱分析通过Burker 300E光谱仪(E500-9.5/12, 德国)进行自由基检测.TEMP为1O2的自由基捕获剂, DMPO为·OH、SO4-·和O2-·的自由基捕获剂.采用甲醇作为检测O2-·自由基的溶剂.
3 结果与讨论(Results and discussion)3.1 不同反应体系中DTZ的降解在DTZ初始浓度为0.015 mmol·L-1, PMS浓度为10.0 mmol·L-1, 初始pH=6.5±0.2, 超声功率为195 W, 温度25 ℃条件下, 超声(US)、PMS和US/PMS体系对DTZ的降解情况如图 2所示.
图 2(Fig. 2)
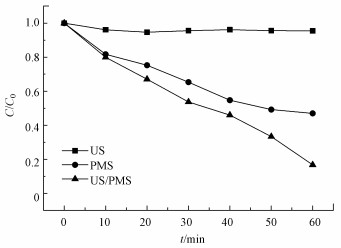 |
| 图 2 三种反应体系中DTZ的降解效果 Fig. 2Degradation of DTZ in three reaction systems |
由图 2可知, 单独超声时, 60 min后DTZ的降解率仅为4.5%.这是由于US裂解水分子产生的·OH非常有限;超声空化·OH氧化主要发生在气液界面, DTZ的疏水性较弱(logKow=1.37), 不易在气液界面富集.PMS氧化时, DTZ的降解率为53.01%.PMS的氧化还原电位E0=1.82 V(葛永建等., 2017), 对DTZ具有一定氧化作用.US/PMS对DTZ的降解显著增强, 相同时间DTZ的降解率达到83.24%, 大于DTZ在US和PMS的降解率之和(57.51%), 表明二者存在明显的协同效应.这是由于超声活化PMS产生·OH、SO4-·、O2-·和1O2等一系列自由基(式(2)~(10))(葛永建等, 2017), 促进了DTZ的分解.
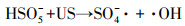 | (2) |
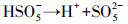 | (3) |
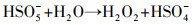 | (4) |
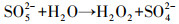 | (5) |
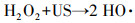 | (6) |
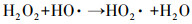 | (7) |
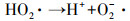 | (8) |
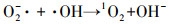 | (9) |
 | (10) |
图 3(Fig. 3)
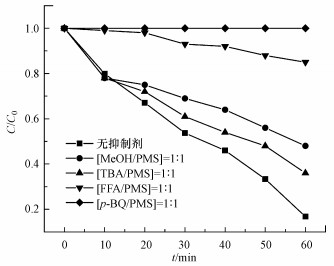 |
| 图 3 不同抑制剂对DTZ降解的影响 Fig. 3Effects of different inhibitors on DTZ degradation |
叔丁醇与SO4-·和·OH的反应速率常数k分别为(4.0~9.1)×105 L·mol-1·s-1和(3.8~7.6)×108 L·mol-1·s-1;甲醇与SO4-·和·OH的反应速率常数k分别为3.2×106 L·mol-1·s-1和9.8×108 L·mol-1·s-1 (Liang et al., 2009).10 mmol·L-1的MeOH和TBA可抑制DTZ降解, 抑制率分别为31.68%和19.24%, 且MeOH的抑制比TBA稍强, 表明体系中存在SO4-·和·OH, 但它们不是US/PMS氧化DTZ的主要活性物种.当体系中加入10 mmol·L-1的p-BQ(kp-BQ-O2-·=(0.9~1)×109 L·mol-1·s-1) (Qi et al., 2016), DTZ的降解几乎被完全抑制.加入10 mmol·L-1 FFA(kFFA-1O2=1.2×108 L·mol-1·s-1)(Jiang et al., 2017), DTZ的降解率从83.24%下降至14.87%.结果表明, O2-·和1O2是US/PMS降解DTZ的主要活性物种.
实验采用DMPO或TEMP作为自旋捕获剂进行电子顺磁共振(EPR)分析, 结果如图 4所示.DMPO与·OH和O2-·分别形成DMPO-·OH和DMPO-·O2自旋加合物, TEMP与1O2形成TEMP-1O2加合物.由图 4可见, EPR光谱中可以观察到4个峰, 归属于强度比为1∶2∶2∶1的DMPO-·OH加合物(ɑN=ɑH=14.2 G), 表明体系中有·OH产生.体系没有检测到SO4-·, 可能是由于SO4-·会快速转化为·OH (式(11)) (Shang et al., 2019).EPR检测到TEMP-1O2的特征三重峰(ɑN=16.1G)和DMPO-O2-·的六峰(ɑN=13.77 G, ɑNβ=8.29 G, ɑNγ=1.5 G), 表明反应体系中存在O2-·和1O2.EPR结果与自由基抑制结果一致.
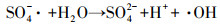 | (11) |
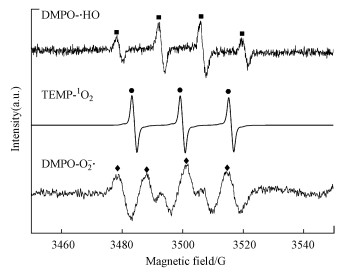 |
| 图 4 US/PMS体系中DMPO和TEMP作为捕获剂的EPR谱图 Fig. 4EPR spectra in US/PMS system with DMPO and EMP as trapping agents |
3.3 US/PMS降解DTZ的影响因素3.3.1 温度的影响在DTZ初始浓度为0.015 mmol·L-1, PMS浓度为10 mmol·L-1, 功率195 W, 初始pH=6.5±0.2, 温度为15~45 ℃的条件下, US/PMS降解DTZ的过程如图 5a所示.由图 5a可知, DTZ的降解率随温度升高而增加;15、25、35、45 ℃时, 60 min后DTZ的降解率分别为59.71%、83.24%、100%和100%.一方面, 温度升高能够有效活化PMS;另一方面, 升高温度促进了超声对PMS的活化效果, 增加了DTZ与自由基之间的碰撞频率.
图 5(Fig. 5)
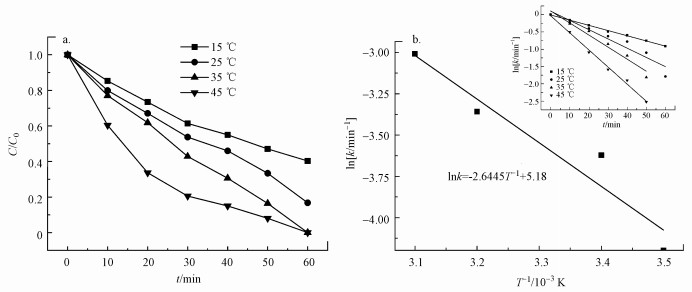 |
| 图 5 温度对DTZ降解率的影响(a)及lnk对1/TArrhenius拟合结果(b) Fig. 5Effect of temperature on DTZ degradation in US/PMS system (a) and the fitting result of lnk versus 1/T (b) |
不同温度下DTZ的降解过程符合准一级反应动力学(R2>0.95)(图 5b插图).15、25、35和45 ℃时, 相应的一级反应速率常数k分别为1.5×10-2、2.67×10-2、3.48×10-2和4.94 ×10-2 min-1.根据Arrhenius方程将1/T与lnk进行拟合, 结果见图 5b, 计算得到反应活化能Ea=21.98 kJ·mol-1, 远低于文献中报道的过渡金属活化PMS降解染料(王忠明等, 2016)和酚类有机污染物的活化能, 以及热活化过硫酸盐降解DTZ的Ea=105.57 kJ·mol-1(王晓晓等, 2019).相较而言, 超声活化PMS更容易实现DTZ的氧化.
3.3.2 初始pH的影响在DTZ初始浓度为0.015 mmol·L-1, PMS浓度为10 mmol·L-1, 温度为25 ℃, 功率为195 W, 初始pH为3.2~11.05的条件下, DTZ的降解情况如图 6所示.从图 6a可以看出, pH对DTZ降解具有显著影响.降解率在pH=3.20~5.10之间逐渐降低, 在pH=5.10~6.50范围内又有所增加, 继续增加pH至11.05, 降解率先降低后增加.pH=3.20时DTZ降解率较高可能是由于·OH的氧化能力更强, 且PMS通过质子催化容易生成SO4-·(Corbin et al., 2008).弱酸条件下, H+与HSO5-形成氢键, PMS不能有效活化.pH由9.16升高至11.05, 碱(HO-)活化PMS产生O2-·和1O2(葛永建等, 2017), 促进了DTZ的降解.
图 6(Fig. 6)
 |
| 图 6 pH值对DTZ降解的影响(a)及不同pH下的动力学拟合(b) Fig. 6Effect of pH on DTZ degradation (a) and DTZ degradation kinetics under different pH (b) |
此外, PMS和DTZ在不同pH下的存在形态不同.pH < 5.0时, DTZ主要以DTZ+和DTZ2+形式存在(图 6b插图), pH>6.0时以DTZ3+形式存在.PMS具有两个pKa, pKa1 < 0和pKa2=9.4(Guan et al., 2011).酸性和中性条件下PMS以HSO5-存在, 活化被抑制(Guan et al., 2011);pH>9.5时以SO52-存在, DTZ3+与SO52-之间的氧化更具有反应性.pH升高有助于DTZ3+与SO52-比例的增加, 有利于氧化过程进行.另外, 反应过程中溶液pH呈下降趋势, 这可能与PMS分解产生H+有关.不同初始pH下DTZ的降解过程符合准一级动力学, 拟合曲线如图 6b所示, R2>0.93.
4 US/PMS氧化DTZ的产物和毒性分析(Byproducts and toxicity change of DTZ under US/PMS system)4.1 IO3-和I2的生成ICM在氧化过程中会发生不同程度的脱碘反应, 形成无机和有机碘化合物, 无机碘主要包括I-、HOI和IO3-.实验条件同3.1节, DTZ降解过程中IO3-和I2的生成情况分别如图 7和表 1所示(未检测到I-).
图 7(Fig. 7)
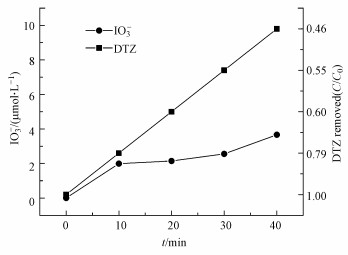 |
| 图 7 US/PMS氧化DTZ过程中碘酸根的生成 Fig. 7Formation of iodate root during the oxidation of DTZ using US/PMS system |
表 1(Table 1)
| 表 1 US/PMS降解DTZ过程中I2的生成(A460) Table 1 Changes of iodine absorbance (A460) in US/PMS system | ||||||||||
表 1 US/PMS降解DTZ过程中I2的生成(A460) Table 1 Changes of iodine absorbance (A460) in US/PMS system
| ||||||||||
图 7结果表明, IO3-的生成量随DTZ降解率的升高而增加, US/PMS体系能够有效脱除DTZ分子中的I并快速氧化为I2和IO3-(Yan et al., 2018).IO3-的生成量增加能有效减少碘代三卤甲烷的生成.因此, US/PMS是一种相对安全、有效降解DTZ的方法.表 1为I2(A460)的生成情况, A460随DTZ降解率的增加也有所增加, 进一步说明DTZ在US/PMS体系中发生了脱碘反应.
4.2 US/PMS氧化DTZ过程中的产物分析通过LC-ESI(+)-QTOF/MS分析DTZ在US/PMS体系中的降解产物, 共检测到10种产物(表 2).DTZ可能的降解路径如图 8所示.由图 8可知, 首先, O2-·攻击苯环侧链或发生亲电反应导致DTZ脱碘, 直接生成TP488;TP488脱碘羟基化和脱乙酰基生成TP335.DTZ在SO4-·和·OH作用下, 很容易脱碘发生分子内环化, 生成TP486;TP486脱乙酰基生成TP444.其次, ·OH进攻苯环, 取代I或发生脱酸反应分别生成TP476、TP350.脱羧也是US/PMS降解DTZ的主要过程, ·OH先进攻6C然后脱酸生成TP476.TP476去氢氧化生成醌类产物TP474, TP474进一步发生酰胺键断裂或氧化生成TP376.有报道指出(Meng et al., 2017), 与·OH相比, SO4-·更容易促进脱羧反应的进行.TP572、TP445主要是通过亲电反应引起乙酰胺键断裂然后氨基化.此外, DTZ乙酰氨基侧链的单羟基化中间产物在自由基作用下氧化, 进而水解形成TP643.综上, DTZ在US/PMS体系中发生了脱碘反应, 脱碘产物包括TP488、TP445和TP350.
表 2(Table 2)
| 表 2 DTZ在US/PMS作用下的降解产物 Table 2 Transformation products of DTZ in US/PMS system | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 DTZ在US/PMS作用下的降解产物 Table 2 Transformation products of DTZ in US/PMS system
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 8(Fig. 8)
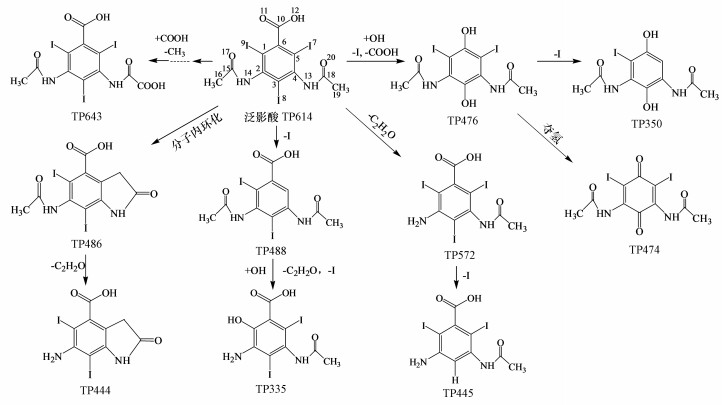 |
| 图 8 US/PMS氧化DTZ可能降解路径 Fig. 8Possible degradation pathway of DTZ under US/PMS oxidation |
4.3 US/PMS氧化DTZ毒性基因组学分析转录效应水平指数(Transcriptional Effect Level Index, TELI)是毒理基因组学数据的指标, 通过基因在每个时间点的基因表达变化I(也称诱导因子)进行计算(式(12)).给定时间段内及一系列基因中细胞暴露于有毒物质的总体转录基因水平反应的TELItotal通过式(13)计算.TELI=1.50表示基因表达正常, TELI≤1.50表示无毒性, TELI>1.50表示基因过度表达, 数值越大, 应激反应越强烈, 即毒性越大.
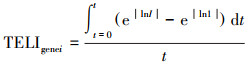 | (12) |
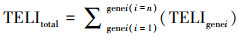 | (13) |
实验条件同3.1节, DTZ在US/PMS体系降解过程中0 min(DTZ溶液)、30 min、60 min时反应液的毒性变化如图 9所示.由图 9可知, 0 min时, DTZ溶液的TELItotal为1.65, 从基因表达角度分析, 具有一定毒性.DTZ溶液的DNA应激、氧化应激、蛋白质应激、膜应激和普通应激反应的TELI值分别为1.73、1.46、1.32、2.36、1.40, DTZ只产生DNA应激和膜应激.反应30 min后, DTZ降解率为46.31%, TELItotal为2.13, 5类应激反应的TELI值分别为1.85、2.94、1.37、2.59和1.91, 除蛋白质基因外, 其余4种的应激反应均加强, 毒性也随之增强.60 min时, DTZ降解率为83.24%, TELItotal为2.51, 对DNA应激、膜应激和普通应激更加强烈, TELI分别增加到2.94、3.16和3.14.蛋白质应激反应影响较小(TELI从1.37增加到1.41, 未表达), 氧化应激反应减弱(TELI降至1.91).结果说明, 从基因毒理角度分析, 溶液毒性随反应时间延长有所增强.
图 9(Fig. 9)
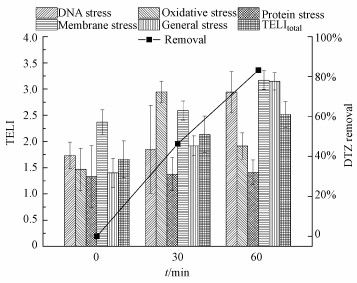 |
| 图 9 DTZ US/PMS体系降解过程中的毒性变化 Fig. 9Toxicity changes during DTZ degradation by US/PMS system |
综上, US/PMS体系能够有效增强DTZ的降解, 促进脱碘反应的进行, 但从基因毒理的角度分析, 溶液毒性随反应时间有所增加.溶液毒性与不同产物之间的相关性还有待于深入研究.
5 结论(Conclusions)1) 与单独US、PMS氧化相比, US/PMS能够显著增强DTZ的降解;O2-·和1O2是体系中的主要活性物质.
2) DTZ降解率在15~45 ℃范围内随温度升高而增加;反应过程符合准一级反应动力学, Ea=21.98 kJ·mol-1;pH对DTZ的降解影响显著, pH=3.21和9.16~11.05时降解率较高.
3) DTZ在US/PMS降解过程中IO3-和I2生成量随降解率升高而增加, HPLC/MS/MS共检出10种产物, 其中3种为脱碘产物.基因毒理组学分析表明, DTZ毒性随反应时间延长逐渐增强, 产物与毒性的相关性还有待进一步研究.
参考文献
| Corbin Ш J F. 2008. Mechanisms of base, mineral, and soil activation of persulfate for groundwater treatment[D]. Washington: Washington State University |
| Duirk S E, Lindell C, Comelison C C, et al. 2011. Formation of toxic lodinated disinfection by-products from compounds used in medical imaging[J]. Environmental Science & Technology, 45(16): 6845-6854. |
| Dong H, Qiang Z, Lian J, et al. 2018. Deiodination of iopamidol by zero valent iron (ZVI) enhances formation of iodinated disinfection by-products during chloramination[J]. Water Research, 129(1): 319-326. |
| Farag S A, Wells C E. 1997. Capillary electrophoresis determination of diatrizoic acid and its impurities in diatrizoate radiopaque solutions[J]. Microchimica Acta, 126(1): 141-145. |
| Guan Y H, Li X C, Ma J, et al. 2011. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/Peroxymonosulfate system[J]. Environmental Science & Technology, 45(21): 9308-9314. |
| 葛永建, 蔡显威, 林翰, 等. 2017. 碱活化过一硫酸盐降解水中环丙沙星[J]. 环境科学, 38(12): 5117-5123. |
| Jeong J, Jung J, Cooper W J, et al. 2010. Degradation mechanisms and kinetic studies for the treatment of X-ray contrast media compounds by advanced oxidation/reduction processes[J]. Water Research, 44(15): 4391-4398. DOI:10.1016/j.watres.2010.05.054 |
| Jeong C H, Machek E J, Shakeri M, et al. 2017. The impact of iodinated X-ray contrast agents on formation and toxicity of disinfection by-products in drinking water[J]. Journal of Environmental Sciences, 58: 173-182. DOI:10.1016/j.jes.2017.03.032 |
| Jiang M, Lu J, Ji Y, et al. 2017. Bicarbonate-activated persulfate oxidation of acetaminophen[J]. Water Research, 116: 324-331. DOI:10.1016/j.watres.2017.03.043 |
| Liang C, Su H W. 2009. Identification of sulfate and hydroxyl radicals in thermally activated persulfate[J]. Industrial & Engineering Chemistry Research, 48(11): 5558-5562. |
| Mohle E, Kempter C, Kern A, et al. 1999. Examination of the degradation of drugs in municipal sewage plants using liquid chromatography-electrospray mass spectrometry[J]. Acta Hydrochimica et Hydrobiologica, 27(6): 430-436. DOI:10.1002/(SICI)1521-401X(199912)27:6<430::AID-AHEH430>3.0.CO;2-I |
| Martin S, Audrey B, Emmanuelle V, et al. 2018. A rapid and easy method based on hydrophilic interaction chromatography coupled with tandem mass spectrometry (HILIC-MS/MS/MS) to quantify iodinated X-ray contrast in wastewaters[J]. Talanta, 190(1): 480-486. |
| Nowak A, Pacek G, Mrozik A. 2020. Transformation and ecotoxicological effects of iodinated X-ray contrast media[J]. Reviews Environmental Science Biotechnology, 19(2): 337-354. DOI:10.1007/s11157-020-09534-0 |
| Ning B, Graham N J D, Lickiss P D. 2009. A comparison of ultrasound-based advanced oxidation processes for the removal of X-ray contrast media[J]. Water Science & Technology, 60(9): 2383-2390. |
| Putschew A, Wischnack S, Jekel M. 2000. Occurrence of triiodinated X-ray contrast agents in the aquatic environment[J]. Science of the Total Environment, 255(1/3): 129-134. |
| Qi C, Liu X, Ma J, et al. 2016. Activation of peroxymonosulfate by base: Implications for the degradation of organic pollutants[J]. Chemosphere, 151: 280-288. DOI:10.1016/j.chemosphere.2016.02.089 |
| Rode U, Rudolf M. 1998. Transformation of the ionic x-ray contrast agente diatrizoate and related triiodinated benzoates by Trametes versicolor[J]. Applied & Environmental Microbiology, 64(8): 3114. |
| Radjenovic J, Petrovic M. 2016. Sulfate-mediated electrooxidation of X-ray contrast media on boron-doped diamond anode[J]. Water Research, 94: 128-135. DOI:10.1016/j.watres.2016.02.045 |
| Sandra P, Damià B. 2007. Fate and occurrence of X-ray contrast media in the environment[J]. Analytical & Bioanalytical Chemistry, 387(4): 1235-1246. |
| Shang W T, Dong Z J, Li M, et al. 2019. Degradation of diatrizoate in water by Fe(Ⅱ)-activated persulfate oxidation[J]. Chemical Engineering Journal, 361: 1333-1344. DOI:10.1016/j.cej.2018.12.139 |
| Ternes T A, Hirsch R. 2000. Occurrence and behavior of X-ray contrast media in sewage facilities and the aquatic environment[J]. Environmental Science & Technology, 34(13): 2741-2748. DOI:10.1021/es991118m |
| Velo-Gala I, López-Pealver J J, José Rivera-Utrilla M, et al. 2012. Ionic X-ray contrast media degradation in aqueous solution induced by gamma radiation[J]. Chemical Engineering Journal, 195-196: 369-376. DOI:10.1016/j.cej.2012.04.046 |
| Wang D, Bolton J R, Hofmann R. 2012. Medium pressure UV combined with chlorine advanced oxidation for trichloroethylene destruction in a model water[J]. Water Research, 46(15): 4677-4686. DOI:10.1016/j.watres.2012.06.007 |
| 王忠明, 陈家斌, 张黎明, 等. 2016. 活性炭负载Co3O4活化过一硫酸盐降解金橙G[J]. 环境科学, 37(7): 2591-2600. |
| 王晓晓, 王兆慧, 柳建设. 2019. 热活化过硫酸盐氧化降解水体中泛影酸钠的研究[J]. 环境科学学报, 39(5): 1519-1526. |
| Yan M, Chen Z, Li N, et al. 2018. Electrochemical reductive dehalogenation of iodine-containing contrast agent Pharmaceuticals: Examination of reactions of diatrizoate and iopamidol using the method of rotating ring-disc electrode (RRDE)[J]. Water Research, 136(1): 104-111. |
| 钟美娥, 李季, 龚道新, 等. 2015. 均相Co(Ⅱ)/PMS体系对二氯喹啉酸的降解特性研究[J]. 中国环境科学, 35(11): 3282-3287. DOI:10.3969/j.issn.1000-6923.2015.11.011 |
| 张珂, 许芬, 陈家斌, 等. 2018. 丙酮/氯离子活化过一硫酸盐降解酸性橙[J]. 中国环境科学, 38(11): 4159-4165. DOI:10.3969/j.issn.1000-6923.2018.11.022 |